Method Article
טכניקות אימונוהיסטוכימיה לניתוח התפשטות תאים ונוירוגנזה בחולדות באמצעות BrdU אנלוגי של תימידין
* These authors contributed equally
In This Article
Summary
מאמר זה מציג ארבע מהטכניקות הנפוצות ביותר להדמיית תאים חיוביים של BrdU למדידת נוירוגנזה בוגרת בחולדות. עבודה זו כוללת הוראות להכנת מגיבים, ניהול אנלוגי של תימידין, פרפוזיה של שריר הלב, הכנת רקמות, תגובה אימונוהיסטוכימית של פרוקסידאז, אימונופלואורסצנציה, הגברת אותות, צביעה נגדית, הדמיית מיקרוסקופיה וניתוח תאים.
Abstract
אחד הדברים החשובים ביותר בתחום של נוירוגנזה בהיפוקמפוס בוגר (AHN) הוא זיהוי התאים החדשים שנוצרו. זיהוי חיסוני של אנלוגים של תימידין (כגון 5-Bromo-2'-deoxyuridine (BrdU)) היא טכניקה סטנדרטית המשמשת להדמיה של תאים חדשים אלה שנוצרו. לכן, BrdU מוזרק בדרך כלל בבעלי חיים קטנים באופן תוך-צפקי, כך שהאנלוגיה של תימידין משולבת בחלוקת תאים במהלך סינתזת DNA. הגילוי מתבצע על ידי ניתוח אימונוהיסטוכימי של פרוסות המוח. כל קבוצת מחקר שהשתמשה בטכניקה זו יכולה להעריך שהיא דורשת תשומת לב מיוחדת לפרטים הקטנים כדי להשיג כתם מוצלח. לדוגמה, שלב חשוב הוא דנטורציה של דנטורציה של דנ"א עם HCl, המאפשרת לו להגיע לגרעין התא כדי להכתים אותו. עם זאת, הדו"חות המדעיים הקיימים מתארים מעט מאוד צעדים כאלה בפירוט. לכן, סטנדרטיזציה של הטכניקה היא מאתגרת עבור מעבדות חדשות מכיוון שזה יכול לקחת כמה חודשים כדי להניב תוצאות חיוביות ומוצלחות. מטרת עבודה זו היא לתאר ולפרט את השלבים להשגת תוצאות חיוביות ומוצלחות של טכניקת החיסון, בפירוט בעת עבודה עם התימידין האנלוגי BrdU. הפרוטוקול כולל הכנה והתקנה של ריאגנטים, מתן אנלוגי של תימידין במכרסם, פרפוזיה של שריר הלב, הכנת רקמות, תגובה אימונוהיסטוכימית של פרוקסידאז, שימוש בקומפלקס אבידין-ביוטין, אימונופלואורסנציה, צביעה נגדית, הדמיית מיקרוסקופיה ואנליזת תאים.
Introduction
הרעיון שתאי עצב חדשים נוצרים במוח האנושי הבוגר לאורך תוחלת החיים ריתק את הקהילה המדעית במשך עשרות שנים. הידיעה שהמוח מייצר תאי עצב חדשים לאורך תוחלת החיים שלו הושגה באמצעות זיהוי תאים תחת חלוקה 1,2. זיהוי של נוירונים חדשים שנוצרו במוח הבוגר זוהה לראשונה על ידי הזרקה תוך גולגולתית של תימידין טריטידין (תימידין-H3) בחולדות וזיהוי תאים במחזור התא על ידי אוטורדיוגרמות 1,2. דווח על חלוקת תאים של גליה ונוכחות של נוירובלסטים, שהיו הנתונים המבטיחים הראשונים על נוירוגנזה לאחר הלידה1. עם זאת, השימוש והזיהוי של thymidine-H3 רמז על השימוש ברדיואקטיביות, אשר יכול להזיק לאנשים המנהלים אותו. המאמץ הראשון שבחן את ההתאמה של אימונוהיסטוכימיה של BrdU בחקר ההתרבות, ההגירה והמקור של תאים במערכות העצבים הופיע בשנת 1988 על ידי מילר ונובאקובסקי3. בשנת 1998, מאמר שפורסם על ידי אריקסון ועמיתיו הראה כי נוירונים חדשים הודגמו לאחר המוות במוח הבוגר האנושי של מטופלים שהוזרקו להם 5-Bromo-2′-deoxyuridine (BrdU)4. חולים אלה קיבלו את זריקת BrdU (250 מ"ג תוך ורידי) כדי לסמן את הצמיחה של גידולים4. טכניקה זו אומצה למודלים של בעלי חיים. הכנסת שיטות אלה סימנה אבן דרך עבור התחום שכן זה איפשר גילוי של תאים חדשים שנוצרו ללא שימוש בתרכובות רדיואקטיביות. הליך זה הפך לסטנדרט הזהב למדידת התפשטות תאים בנישות מוח בוגרות כדי לקדם מחקר נוסף בתחום.
המגבלה של הטכניקה האנלוגית של תימידין היא שהיא אינה מאפשרת קביעת זהות תאית עבור התאים החדשים שנוצרו. עם זאת, אימונוהיסטוכימיה מאפשרת לנו לבצע טכניקת תיוג כפולה או משולשת של אותו תא, אשר מאמתת את גורלם התאי של התאים החדשים שנוצרו ואפילו את שלבי ההתבגרות שלהם, מה שמוביל לאבולוציה נוספת של השדה. שיטה זו אופיינה כדי להבדיל תאים חדשים שנוצרו לתוך גליה, נוירונים לא מובחנים, או תא גרגירי בוגר לחלוטין, ואפילו כדי לקבוע אם הם משתתפים באופן פעיל במעגלים. פריצת דרך נוספת בתחום הייתה השימוש במודלים מהונדסים לזיהוי תאים לא מובחנים בתחום ה-nestin. העכברים המהונדסים של nestin-GFP מבטאים חלבון פלואורסצנטי ירוק משופר (GFP), שנמצא תחת שליטתו של מקדם ה-nestin. נסטין הוא נימה ביניים המאופיינת בתאי אב5. העכברים המהונדסים של nestin-GFP אפשרו להם לקבוע שלבים התפתחותיים מוקדמים המעורבים בנוירוגנזה6. עם זאת, מגבלה משמעותית היא היכולת לשמור על מושבת עכברים מהונדסים מסוג nestin-GFP בתנאים מיוחדים במתקן מעבדה שהופך לחסכוני עבור קבוצות מדעיות מסוימות, במיוחד אלה ממדינות מתפתחות.
לטכניקות שהוזכרו לעיל יש יתרונות וחסרונות. עם זאת, זיהוי של תאים מתרבים על ידי אימונוהיסטוכימיה (IHC) והאפשרות לבצע טכניקת תיוג כפולה או משולשת על ידי אימונופלואורסצנציה כדי לזהות את שלב ההבשלה של התא או את גורל התא מייצג את הדרך האפשרית ביותר למדוד נוירוגנזה בוגרת, עד כה. תהליך הזיהוי באמצעות אימונוהיסטוכימיה מורכב מתיוג חלבונים, תחום חלבונים או נוקלאוטידים עם נוגדן ספציפי המאפשר את זיהוים המכונה נוגדן ראשוני. זה האחרון מוכר על ידי הנוגדן המשני, המסומן בכרומוגן (למשל, חזרת פרוקסידאז) או פלואורוכרום (למשל, FITC) יחד עם הנוגדן המשני. מיקרוסקופים יכולים לזהות גם כרומוגנים וגם אותות פלואורוכרומטים. באמצעות IHC, ניתן לזהות חלבוני ממברנה, חלבוני שלד או רכיבים גרעיניים כגון BrdU. מצד שני, BrdU ניתן למצוא בגרעין התא שכן הוא משולב בדנ"א במהלך S-phase על ידי תחרות. לכן, שלב מכריע הוא דנטורציה של דנ"א עם HCl, אשר פותחת קשרי דנ"א כדי לאפשר לנוגדן BrdU גישה ל-BrdU בתוך הדנ"א. זה חיוני כדי לדעת כי BrdU קיים בריכוז רווי בעכברים ובסרום חולדות במשך 15 ו 60 דקות בהתאמה, לאחר ניהול intraperitoneal, ולאחר מכן יורד במהירות לרמות בלתי ניתנות לגילוי ב 60 ו 120 דקות בהתאמה7.
כאן אנו מתארים ארבע טכניקות IHC שונות אך קשורות זו לזו: זיהוי עקיף כרומוגני באמצעות תגובת פרוקסידאז חזרת (HRP) עם DAB (3,3'-diaminobenzidine) הגברת אות sans (שלב 4.1), הגברה של קומפלקס אבידין-ביוטין (ABC) (שלב 4.1), זיהוי אימונופלואורסצנציה עקיפה ללא הגברת אות (שלב 4.4) והגברת סטרפטאווידין-ביוטין (LSAB) (שלב 4.3). לכל שיטה יש יתרונות וחסרונות והיא יכולה להיות שימושית עבור דרישות רקמות ספציפיות (ראה טבלה 1). החלטנו לעקוב אחר שיטות ICH עקיפות בשל מחירן הזול והפשטות שלהן כדי לבצע שינויים משיטות זיהוי כרומוגניות לפלואורסצנטיות בעת שימוש בנוגדנים ראשוניים לא מצומדים. גישת תוכנית המענה ההומניטרי היא שיטת IHC נפוצה בשל המחיר הזול שלה, היציבות הגבוהה, שיעור התחלופה הגבוה והזמינות המלאה של המצעים. עם זאת, אנו ממליצים להשתמש בבקרה חיובית כדי לוודא ששיטת ההכתמה פועלת במדויק ולהשתמש בבקרה שלילית כדי לבדוק את תפקוד הנוגדנים ביעילות. חיסונים מרובים או שיטות IHC מרובות (ראה שלב 6) הם כלים רבי עוצמה לרכישת כמויות גדולות של נתונים מקטע הרקמה בניסוי יחיד. טכניקה זו חשובה במיוחד כאשר הזמינות של דגימות מוגבלת. יתרון נוסף הוא האפשרות לזהות בו זמנית חלבונים ספציפיים המתבטאים יחד באותו חלל תאי תוך שמירה על שלמות הרקמות. מולטיפלקס מאפשר להכתים סמנים שונים המתבטאים בשלבי שגשוג ספציפיים (למשל, nestin, GFAP, DCX, Ki-67), ומאפשר לנו להגיע למחקר התפשטות ובידול מפורט יותר8. חשוב לבחור נוגדנים התואמים לטכניקת הקיבוע המשמשת למניעת תגובתיות צולבת. אנו ממליצים לבדוק כל נוגדן חדש (כולל BrdU) בנפרד כדי להתאים ולחדד את השיטה. לאחר מכן, הציגו את הכתם הרציף הכפול, ולבסוף, התחילו את תהליך החיסון בו זמנית כאשר השיטה הרציפה נשלטת לחלוטין. חשוב לבחור נוגדנים משניים מתאימים לשיטה זו.
| שיטת | שיטה ספציפית | יתרונות | חסרונות |
| שיטת איתור עקיף | תגובת פרוקסידאז עם DAB | 1. רגישות גבוהה יותר משיטת הגילוי הישיר והפלואורסצנציה העקיפה. 2. עמידות גבוהה יותר לפוטו-הלבנה מאשר פלואורוכרומים. 3. עלות נמוכה יותר משיטת זיהוי פלואורסצנציה | 1. קשה לריבוב עם פחות צבעים צבעוניים. 2. מסובך עבור מטרות ביטוי משותף באותו מרחב סלולרי. 3. טווח דינמי מופחת עבור מטרות נדירות ושופעות בו-זמנית על אותה רקמה. |
| פלואורסצנציה | 1. הטוב והקל ביותר לריבוב עם יותר צבעים צבעוניים. 2. הטוב ביותר עבור מטרות מבוטאות באותו מרחב סלולרי. 3. טווח דינמי טוב יותר עבור מטרות נדירות ושופעות בו זמנית על אותה רקמה. 4. אין צעדים נוספים. | 1. רגישות נמוכה יותר מתגובת הפרוקסידאז העקיפה בשיטת DAB. 2. התנגדות חלשה ל-Photobleaching לאורך זמן. 3. יקר יותר. | |
| שיטת הגברת אות | קומפלקס אבידין-ביוטין (ABC) | 1. רגישות גבוהה יותר משיטת האיתור הישירה והעקיפה. 2. צמצם את הרקע | 1. שלבים נוספים. 2. יקר יותר מאשר לא הגברה. |
| עם התווית סטרפטאווידין-ביוטין (LSAB) | 1. רגישות גבוהה יותר משיטת האיתור הישירה והעקיפה. 2. חדירת רקמות משמעותית יותר משיטת ABC. 3. צמצם את הרקע | 1. שלבים נוספים. 2. יקר יותר משיטת ABC. | |
| לא שיטת הגברה נוספת | 1. עלות נמוכה יותר. 2. אין צעדים נוספים. 3. אידיאלי למטרות שופעות גבוהות. | 1. רגישות נמוכה יותר: בעייתית ללא מטרות בשפע. |
טבלה 1: יתרונות/חסרונות של טכניקות IHC. טבלה זו מציגה את היתרונות/חסרונות של שיטות גילוי עקיפות: תגובת פרוקסידאז עם (3,3'-diaminobenzidine) DAB ופלואורסצנציה; ושיטות להגברת אותות: קומפלקס אבידין-ביוטין (ABC), שכותרתו סטרפטאווידין-ביוטין (LSAB), ולא שיטת הגברה נוספת.
תמונה ברזולוציה גבוהה היא בסיסית לביצוע ניתוח נכון ולהצגת התוצאות. ישנן שתי גישות לשיפור הרזולוציה: 1) שימוש בעיצוב מיקרוסקופ טוב יותר (למשל, קונפוקל, מולטיפוטון) או 2) היפוך מספרי של תהליך הטשטוש כדי לשפר תמונות באמצעות deconvolution9. למרבה הצער, מיקרוסקופיה קונפוקלית אינה משתלמת בשל העלויות הגבוהות של הציוד ושירות10 שלה. מיקרוסקופ אפיפלואורסצנטי רחב שדה והפירוק שלאחר מכן של תמונות z-stack מספקים חלופה מתאימה בעלות נמוכה למיקרוסקופיה קונפוקלית 8,9. כפי שצוין לעיל, מטרת הדה-קונבולוציה היא לשחזר את האות המקורי שהושפל על ידי מערכת הרכישה9, על ידי הפחתת טשטוש, אובך מחוץ למיקוד ועיוות המוצגים בתמונה המתקבלת על ידי מיקרוסקופ אפיפלואורסצנטי או קונפוקלי באמצעות אלגוריתמי הסרה מתמטיים10. ניתן למדל מתמטית את התמונה המטושטשת הנרכשת כתוצאה מסיבוב העצמים הנצפים באמצעות פונקציית התפשטות נקודה תלת-ממדית (PSF). PSF היא תבנית עקיפה תיאורטית של נקודות האור הנפלטות מדגימת הרקמה ונאספות על ידי המיקרוסקופ. קובץ PSF נוצר עם התנאים הספציפיים של כל תמונה, כגון מרווח תאי CCD של המצלמה, מקדם השבירה של המדיה שבה נעשה שימוש, הצמצם המספרי של העדשה האובייקטיבית, אורך גל הפליטה של הפלואורופור, גדלי התמונה, מספר התמונות בשיטת העיבוד z-stack והרווח ביניהן (ראה מפרט טכני בטבלה 2). במילים אחרות, קובץ PSF מסכם את ההשפעות של מערך ההדמיה על תצפיות המיקרוסקופ9. עם זאת, אנו משתמשים בתוסף התלת-ממד PSF עקיפה (https://imagej.net/Diffraction_PSF_3D) כדי ליצור קובץ PSF ספציפי משלנו עבור כל תמונת z-stack. תמונות Z-stack הן סדרה של מקטעים אופטיים שעברו דיגיטציה מעומקים מוגדרים (ציר z) באותו מיקום XY של השקופית. מחשב אוסף את המידע המתקבל ממישור המיקוד על-ידי הקצאה מחדש של אותות שמקורם בעצמים הממוקמים במישורי מוקד אחרים. כדי ליצור z-stack תמונות, יש צורך לצלם תמונות משכבות ממוקדות שונות של השקופיות (לדוגמה, עשר תמונות שונות של אותו אזור XY בכל עומק של 1 מיקרומטר). לאחר מכן, אנו משתמשים בתוכנת מיקרוסקופיה המסופקת על ידי היצרן או פיג'י כדי ליצור z-stack או תמונה תלת-ממדית. התוצאה תהיה קובץ תמונה בערימה אחת (לדוגמה, עשר תמונות עם מוקדים שונים). ישנם מספר כלים ופתרונות תוכנה ספציפיים ללקוח, כגון תוכנת קוד פתוח למיקרוסקופיה של פירוק. אנו נציג את הפלטים של תהליך הדה-קונבולוציה באמצעות DeconvolutionLab29 שהוא תוסף פיג'י11 (התפלגות של ImageJ12). פירוק פעולה יעזור לשפר את הרזולוציה של מיקרוגרפים סופיים (ראו איור 1B,C ). למידע נוסף והדרכה, אנו ממליצים בחום לקרוא את הפניה13.
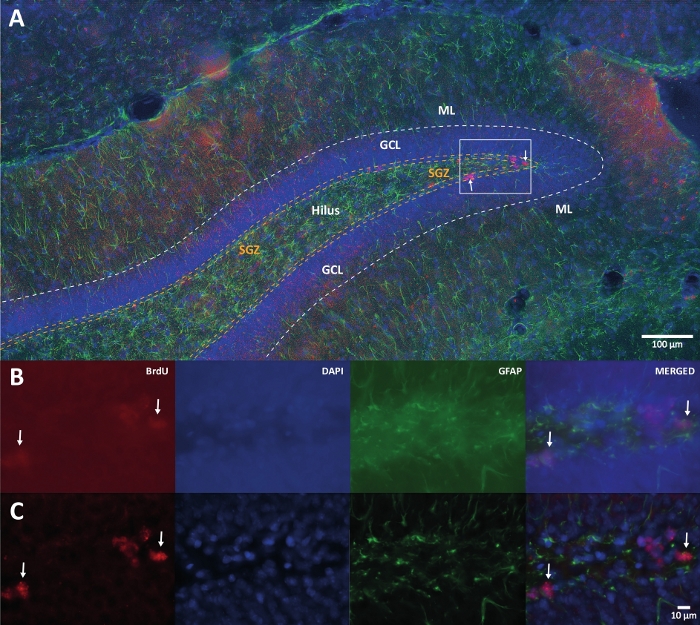
איור 1: תמונה מייצגת של דה-קונבולוציה תלת-ממדית עבור ערוצי צבע מרובים. (A) DG בהגדלה נמוכה. (B) תמונות z-stack המקוריות לכל אחד מהערוצים ולתמונה הממוזגת. (C) תמונות z-stack מפורקות בתלת-ממד עבור כל ערוץ והתמונה הממוזגת. המוח הזה היה מהחולדה שהייתה חלק מקבוצת הפעילות הגופנית. נעשה שימוש בשיטת ההגברה של סטרפטאווידין-ביוטין (LSAB). הוא הראה נוגדן מצומד של Cy3 סטרפטווידין לציון BrdU (אדום), DAPI ככתם נגדי (כחול), וחלבון חומצי פיברילרי גליאלי (GFAP) כסמן אסטרוגליאלי (ירוק). ML = שכבה מולקולרית; GCL = שכבת תא גרעינית; SGZ = אזור תת-גרנולרי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
מטרת עבודה זו היא לספק תיאור מפורט של השלבים להשגת תוצאות חיוביות ומוצלחות עם חיסון ולרשום צעדים נפוצים במחקרים מבוססי BrdU, ללא שימוש במיקרוסקופ קונפוקלי. צביעת BrdU היא טכניקה הדורשת מספר שלבים שיש לעקוב אחריהם בזהירות כדי להשיג כתם מוצלח. סטנדרטיזציה של טכניקות צביעה אלה אורכת בדרך כלל חודשים והיא דורשת זמן ומשאבים. ציפינו שמאמר זה יוכל לספק מידע לקבוצות המתחילות בתחום זה על ידי צמצום הזמן והשגיאות.
Protocol
כל הנהלים פועלים בהתאם למדריך המכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה (NIH Publications N°. 8023, תוקן בשנת 1978) והחוקים המקסיקניים המקומיים כדי למזער את מספר בעלי החיים שבהם נעשה שימוש ואת סבלם. ועדת האתיקה של אוניברסיטת איברואמריקנה אישרה את פרוטוקולי הניסוי לשימוש בבעלי חיים במחקר זה.
1. הכנה והתקנה של מגיב
הערה: ניתן להכין את רוב הפתרונות ימים לפני השימוש, אלא אם צוין אחרת.
- פתרון BrdU
- שלפו את תמיסת BrdU ממקפיא של -20 מעלות צלזיוס ואפשרו לה להתאזן בטמפרטורת החדר (RT).
- חשב את המסה של BrdU הדרושה למינון של 50 מ"ג/ק"ג בהתאם למשקל הגוף של החולדה. חישוב נפח של 0.9% תמיסת מלח (0.9 גרם NaCl ב-100 מ"ל של H2O סטרילי) הדרושה לתמיסת עבודה של 20 מ"ג/מ"ל. הכן עודף כדי לספק לפחות 0.5 מ"ל לכל חולדה לכל זריקה.
הערה: המינון הניתן לחיות ניסוי צריך להיות בטוח, עם תופעות לוואי מינימליות, ויעיל. דווח כי משך ההכתמה ב-BrdU של 100 מ"ג/ק"ג אינו עולה על הרעילות הגבוהה יותר בהשוואה למינון של 50 מ"ג/ק"ג7. לא נמצאו הבדלים משמעותיים במספר התאים המסומנים ב-BrdU/מ"מ3 עבור 50 ו-100 מ"ג/ק"ג i.p. בחולדות7. עדיף להזריק מנה קטנה כדי למזער את סבלם של בעלי החיים. - שקלו את תמיסת BrdU והוסיפו אותה לתמיסת המלח בצינור חרוטי ובמערבולת.
הערה: יש לחמם מראש את תמיסת המלח בטמפרטורה של 45\u201250°C באמבט מים בנפחים הגדולים מ-1 מ"ל. - מניחים את הצינור באמבט מים בטמפרטורה של 50 מעלות צלזיוס למשך 10\u201215 דקות ומערבלים כל 2\u20123 דקות עד להמסה מלאה. סנן את התמיסה עם מסנן מזרק להזרקה סטרילית. מכסים את הצינור בנייר כסף, מקררים אותו בטמפרטורת החדר ומשתמשים בו מיד.
התראה: תמיסת BrdU רעילה ועלולה להיות מסרטנת. הכינו אותו במכסה האדים. יש לטפל בתמיסת BrdU באמצעות ציוד מגן מתאים (PPE). מומלץ להכין את הפתרון מיד לפני השימוש. עם זאת, הפתרון יציב במשך 24 שעות תחת RT. אנא הגן עליו מפני אור.
- כדי להכין 1 ליטר של 0.1 M פוספט מלח מאגור (PBS) ב- pH 7.4, הוסף 240 מ"ג של אשלגן פוספט מונובאסיק (KH 2 PO 4), 1.44 גרם של נתרן פוספט דו-בסיסי (Na 2 HPO4), 200 מ"ג של אשלגן כלורי (KCl) ו-8 גרם של נתרן כלורי (NaCl) ל-800 מ"ל של מים מזוקקים כפולים (ddH2O) תחת ערבוב מתמיד. כוונן את ה-pH ל-7.4 והוסף H2O מזוקק כפול עד לנפח כולל של 1 ליטר. יש לאחסן בטמפרטורה של 4°C למשך עד שבוע.
- עבור 100 מ"ל של PBS+ , יש להוסיף 3% (3 מ"ל) של סרום סוסים רגיל ו-0.3% (300 μL) של Triton X-100 ל-0.1 M PBS (pH 7.4). יש לאחסן ב-20\u201250 מ"ל בטמפרטורה של -20°C למשך עד 3 חודשים.
הערה: לחלופין, ניתן להשתמש ב- TBS במקום ב- PBS. כל סרום אחר השונה מהנוגדנים של הפונדקאי ורקמת הניסוי מתאים. - עבור 100 מ"ל של PBS++, הוסף 10% (10 מ"ל) של סרום סוסים רגיל ו-0.3% (300 μL) של Triton X-100 עד 0.1 M PBS pH 7.4. יש לאחסן ב-20\u201250 מ"ל בטמפרטורה של -20°C למשך עד 3 חודשים.
- לקבלת ליטר אחד של תמיסה מגינה מפני הקפאה, יש לערבב 250 מ"ל של אתילן גליקול ו-250 מ"ל של גליצרול, תוך ערבוב מתמיד עד לערבוב. לאט לאט להביא 1 L עם PBS. סנן עם נייר סינון דרגה 4 (20\u201225 מיקרומטר). יש לאחסן בטמפרטורה של 4 °C או RT למשך עד שנה אחת.
- יש להכין 4% פרפורמלדהיד ב-0.1 M PBS (תמיסת PFA) באופן הבא. לקבלת ליטר אחד של תמיסה, יש להוסיף 40 גרם של אבקת פרפורמלדהיד באיטיות ל-800 מ"ל של 60\u201265 °C 0.1 M PBS תחת ערבוב קבוע. מערבבים עד שהפארפורמלדהיד מומס לחלוטין תוך שליטה בטמפרטורה (60\u201265 מעלות צלזיוס). במידת הצורך, להוסיף כמה טיפות של 1 M NaOH כדי להבהיר את הפתרון. כאשר התמיסה מגיעה לטמפרטורת החדר, יש לסנן עם נייר סינון בדרגה 4 (20-25 מיקרומטר).
אזהרה: Paraformaldehyde הוא רעיל והוא חשוד כמסרטן, יש להכין במכסה האדים. יש לאחסן בטמפרטורה של 4°C ורצוי להשתמש תוך יומיים. פתרון PFA מוכן לשימוש זמין מסחרית. - עבור ליטר אחד של חיץ נתרן ציטראט (SCB) ב-10 mM ב-pH 6, יש להוסיף 1.204 גרם נתרן ציטראט (דיהידראט), ו-1.134 גרם של חומצת לימון ל-800 מ"ל שלH2O מזוקק כפול תחת ערבוב קבוע. התאם את ה- pH ל- 6.0 והוסף ddH2O עד 1 ליטר. יש לאחסן בטמפרטורה של 4 °C למשך עד 6 חודשים.
- הכינו 50 מ"ל של 2 N HCl על ידי הוספה איטית של 8.25 מ"ל של 12 N HCl (תמיסת מלאי מרוכזת) ל-41.75 מ"ל של ddH2O תחת ערבוב קבוע.
אזהרה: יש להכין במכסה המנוע. הפתרון חייב להיות מוכן מיד לפני השימוש.
הערה: 2 N HCl ישמש לדנטורציה של DNA, שלב מכריע. מכיוון ש-BrdU משולב בדנ"א, HCl משמש לפתיחת קשרי הדנ"א ומאפשר לנוגדני BrdU גישה ל-BrdU בתוך הדנ"א. - הכן פתרון חסימת פרוקסידאז אנדוגני כדלקמן. הכן 100 מ"ל של 0.6% מי חמצן על ידי ערבוב 2 מ"ל של 30% מי חמצן עם 98 מ"ל של ddH2O תחת ערבוב קבוע.
הערה: יש להכין את התמיסה מיד לפני השימוש. שמור אותו בחושך מכיוון ש-H 2 O2 רגיש לאור. ניתן להשתמש ב-PBS או ב-TBS במקום במים. - הכינו את תמיסת קומפלקס אבידין-ביוטין (ABC) בהתאם להוראות היצרן. עבור 5 מ"ל של ABC ב-0.1 M PBS, הוסף 2 טיפות (≈100 μL) של מגיב A וערבב, ולאחר מכן הוסף 2 טיפות (≈100 μL) של מגיב B וערבוב.
הערה: יש להכין את הפתרון ולאפשר לו להתגלגל במשך 20\u201230 דקות לפני השימוש. - הכן את מצע DAB (Diaminobenzidine) פרוקסידאז (HRP) באמצעות הערכה על ידי ביצוע הוראות היצרן. ל-5 מ"ל של ddH 2 O, הוסיפו 2 טיפות (≈ 84 מיקרול) של מגיב 1 וערבבו, הוסיפו 4 טיפות (≈ 100 מיקרול) של מגיב 2 וערבבו, ואז הוסיפו2טיפות (≈ 80 מיקרול) של מגיב 3 וערבבו. לבסוף, אם תרצה, להוסיף 2 טיפות (≈ 80 μL) של מגיב 4 (ניקל) ולערבב.
הערה: יש להכין את הפתרון מיד לפני השימוש.
אזהרה: DAB רעיל ועלול להיות מסרטן. יש לטפל בו בזהירות ולהשליך אותו בהתאם לתקנות הפסולת המסוכנת בכל מוסד. כדי להשבית DAB, להוסיף כמה טיפות של אקונומיקה (hypochlorite נתרן); הפתרון יהפוך לשחור. - הכן 100 מ"ל של תמיסת קרסיל ויולט על ידי הוספת 100 מ"ג של אצטט סגול קרסיל ו 250 μL של חומצה אצטית ל 80 מ"ל של ddH2O ב 55\u201260 °C. כוונן את עוצמת הקול ל-100 מ"ל, סנן ואחסן ב-4 °C בכלי בצבע כהה.
הערה: מומלץ למשתמש לבדוק ריכוזים שונים של תמיסת הקרסיל ויולט לפני השימוש בה על דגימות רקמה יקרות ערך. התוצאה עשויה להיות כהה יותר עבור צביעה נגדית עם דגימות רקמה מסוימות, מה שעלול להפחית את היכולת לספור תאים חיוביים BrdU במדויק.
2. תימידין אנלוגי BrdU הממשל
- רסנו את החיה הניסיונית (למשל, חולדת Wistar זכרית בת 90 יום במשקל 350 גרם), על ידי שיתוק חלל הבטן התחתונה.
- יש לתת את תמיסת BrdU (50 מ"ג/ק"ג) תוך-צפקית (i.p.) באמצעות מחט של 23 גרם ומזרק של 1 מ"ל.
הערה: התאם את נפח ההזרקה בהתאם למשקל החיה. השתמש במחט G 23\u201227 ובמזרק 1\u20125 מ"ל לחולדות בוגרות. נפח ההזרקה התוך-צפקית המרבי נסבל בחולדה הבוגרת הוא 10 מ"ל. ניתן להשתמש במסלולים שונים כדי לנהל את פתרון BrdU14. לדוגמה, הזרקה תוך צפקית או מתן אוראלי באמצעות מי שתייה.
3. הכנת רקמות
הערה: חולדות בנות שלושה חודשים הורשו לגשת לפעילות גופנית (גלגל אינסופי) למשך שבעה ימים. ביום 6, חולדות הוזרקו עם BrdU (שלב 2) 3 פעמים במרווחים של 12 שעות. בצע שלבים בסעיף 3 לאחר 8 שעות מהזרקת BrdU האחרונה.
- להזריק פנטוברביטל (50 מ"ג/ק"ג i.p.) ולהמתין מספר דקות עד שהחיה מורדמת עמוק.
הערה: יש לוודא שבעל החיים מורדם לחלוטין לפני שתמשיך. בזהירות לצבוט את אחת הרגליים או את הזנב. אם החיה מגיבה לגירוי, המתן עוד כמה דקות. אם החיה אינה מגיבה לצביטה, עבור לשלב הבא. - חשוף את הלב על ידי חיתוך עור חלל הבטן מתחת לעצם החזה, פירוק הצלעות וחיתוך הסרעפת.
- קיבוע פרפוזיה של שריר הלב
- הכנס מחט לחדר השמאלי ובצע חתך קטן באטריום הימני. באמצעות משאבה או כוח משיכה, יש לפרום (קצב זרימה 5\u20127 מ"ל/דקה) 0.1 M PBS עד שכל הדם מתנקז החוצה, והתמיסה מתבהרת.
- באמצעות משאבה או כוח משיכה, בצע פרפוזיה קרה (קצב זרימה 5\u20127 מ"ל/דקה) עם תמיסת PFA כדי לתקן את הרקמה עד שהזנב הופך נוקשה.
הערה: בדרך כלל, חולדה במשקל 300 גרם דורשת כ- 100\u2012150 מ"ל של תמיסת PFA. קיבוע הרקמה הוא אופציונלי. לפיכך, ניתן לחלץ את המוח לשימוש בתהליכים שונים כדי למזער את השימוש בבעלי חיים בניסויים.
- דיסקציה ופוסט-קיבוע
- לערוף את החיה, בעדינות לחלץ את המוח מן הגולגולת. לטבול את המוח לתוך צינור חרוטי המכיל תמיסת PFA (~ 40 מ"ל עבור חולדה 250 מ"ג) במשך 1\u20122 ימים ב 4 מעלות צלזיוס.
הערה: אין להתקבע יתר על המידה (יותר מ-48 שעות), מכיוון שהדבר עלול לרוקן את כתם הרקמות עקב חוסר זמינות של אנטיגנים. - הכינו 100 מ"ל של תמיסת סוכרוז 30%, והוסיפו 30 גרם סוכרוז ל-70 מ"ל של תמיסת PBS של 0.1 M בערבוב קבוע. הוסף פתרון PBS של 0.1 M ל-100 מ"ל. לטבול את המוח לתוך צינור חרוטי עם תמיסה 30% סוכרוז (35 מ"ל) במשך כ 1\u20122 ימים ב 4 מעלות צלזיוס עד המוח שוקע לתחתית הצינור.
- לערוף את החיה, בעדינות לחלץ את המוח מן הגולגולת. לטבול את המוח לתוך צינור חרוטי המכיל תמיסת PFA (~ 40 מ"ל עבור חולדה 250 מ"ג) במשך 1\u20122 ימים ב 4 מעלות צלזיוס.
- חיתוך מקטעי מוח קורונלים
הערה: השימוש במיקרוטום קריוסטט דורש הדרכה והדרכה. לקבלת הוראות מפורטות, ראה הפניה15.- טבלו את כל המוח באיזו-פנטן בטמפרטורה של -80°C ושמרו אותו בטמפרטורה של -80°C למשך 10 דקות. הניחו את המוח במטריצת הטבעה על צלחת קריוסטט-מיקרוטום.
הערה: בתנאים מסוימים, הקפאה מהירה של המוח בטמפרטורה של -80 מעלות צלזיוס עלולה לגרום לשבר או לנזק לרקמה. המשתמש צריך להיות מודע לבעיה זו. אם זה המקרה, השתמש -20 °C iso-pentane כדי להקפיא את המוח. - באמצעות מיקרוטום קריוסטט (טמפרטורה ב -25 עד -20 מעלות צלזיוס) לחתוך חלקים קורונלים בעובי 40 מיקרומטר. העברה רציפה של מקטעים לתוך צלחת תרבית תאים בת 24 בארות עם תמיסת הגנה בקריה בהתאם למדריך באיור 2. יש לאחסן בטמפרטורה של -20°C עד לשימוש, למשך עד מספר חודשים.
הערה: לאחר מכן, יש לעבד את כל הרקמות במקטעים טוריים צפים חופשיים של 40 מיקרומטר בלוחות של 12 בארות עם תוספות רשת בתסיסה עדינה ורציפה (10 סל"ד). ניתן לאחסן מקטעי מוח במשך שנים בתנאים הנכונים.
- טבלו את כל המוח באיזו-פנטן בטמפרטורה של -80°C ושמרו אותו בטמפרטורה של -80°C למשך 10 דקות. הניחו את המוח במטריצת הטבעה על צלחת קריוסטט-מיקרוטום.
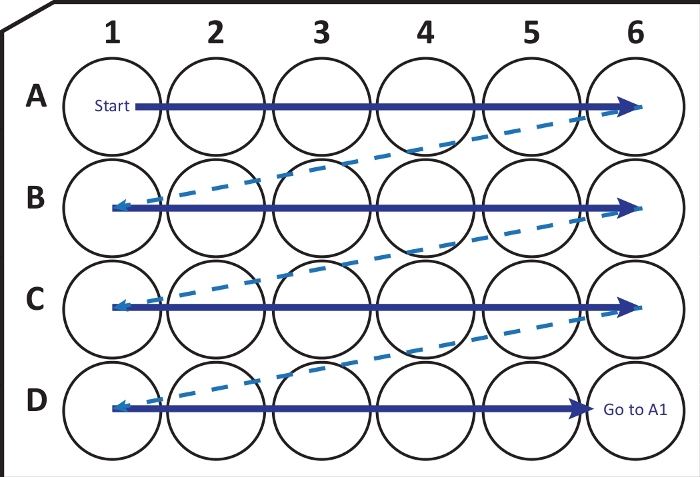
איור 2: המחשה סכמטית של העברה ברצף של מקטעים ממיקרוטום קריוסטאט לצלחת תרבית תאים בת 24 בארות עם תמיסת הגנה קריוגרפית. מתחילים ב-A1-well ומניחים את הפרוסות הבאות בשורה A; אחרי A6-ובכן לעבור לשורה הבאה B, וכן הלאה. כשתגיעו ל-D6, חזרו ל-A1 והמשיכו. סידור זה מאפשר כימות מקטע Nth (למשל, שישי עבור נוירוגנזה, שווה ערך לתוכן של עמודה אחת) של אזור מוח שלם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. אימונוסטינינג
הערה: ראה טבלה 1 לסיכום היתרונות והחסרונות של כל טכניקה.
- זיהוי BrdU באמצעות תגובת פרוקסידאז עם DAB
הערה: בצע את שלבים 4.1.1 עד 4.1.5 ביום הראשון.- מעבירים פרוסות מתמיסת ההקפאה ל-0.1 M PBS בטמפרטורת החדר. יש לשטוף שלוש פעמים במשך 10 דקות כל אחת, עם PBS של 0.1 M.
- דגירה פרוסות במשך 30 דקות בתמיסת חסימת פרוקסידאז אנדוגנית כדי להשבית פרוקסידאז אנדוגני. יש לשטוף 3 פעמים, 10 דקות כל אחת, עם 0.1 M PBS. לחלופין, בצע אחזור אנטיגן (ראה סעיף 5). דגירה פרוסות במשך 20 דקות עם 2 N HCl ב 37 מעלות צלזיוס. יש לשטוף במאגר בוראט באורך 0.1 M (8.5 pH) למשך 10 דקות. יש לשטוף 3 פעמים במשך 10 דקות כל אחת, עם PBS 0.1 M קר כקרח.
- דגירה של פרוסות למשך שעתיים בטמפרטורת החדר באמצעות PBS++ (תמיסת חסימה). דגירה עם נוגדן ראשוני נגד BrdU (מארח עכבר) בריכוז של 1:250 ב- PBS+ בלילה ב- 4 מעלות צלזיוס.
- ביום השני, שוטפים את הפרוסות 3 פעמים במשך 10 דקות כל אחת עם 0.1 M PBS.
- דגירה עם נוגדן משני מצומד 1:250 HRP (נגד עכבר) ב- PBS+ למשך 2\u20124 שעות בטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M.
- מעבירים פרוסות לתמיסת המצע DAB Peroxidase (HRP) ומדגרים למשך 2\u201210 דקות. כאשר פרוסות הופכות לאפורות כהות, דמיינו את הרקמה באמצעות זכוכית מגדלת או מיקרוסקופ. אם קיימים תאים חיוביים, יש לשטוף 3 פעמים (במשך 15 דקות כל אחד) במי ברז (כדי להפחית את הרקע). יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם 0.1 M PBS.
- הרכבו בזהירות פרוסות על מגלשות ג'לטיניות באמצעות מברשת רכה, ויבשו באוויר למשך הלילה בטמפרטורת החדר. כתם נגדי (ראה סעיף 7.1), הוסף מדיום הרכבה קבוע והנח כיסויים. יש לאחסן בטמפרטורה של 4°C למשך עד 6 חודשים.
- זיהוי BrdU באמצעות תגובת פרוקסידאז עם קומפלקס אבידין-ביוטין-פרוקסידאז
הערה: בצע את שלבים 4.2.1 עד 4.2.5 ביום הראשון.- העבירו פרוסות מתמיסת ההקפאה ל-0.1 M PBS כדי להגיע לטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M.
- דגירה במשך 30 דקות עם תמיסת חסימת פרוקסידאז אנדוגנית כדי להשבית פרוקסידאז אנדוגני. יש לשטוף 3 פעמים במשך 10 דקות כל אחת ב-PBS של 0.1 M. לחלופין, בצע אחזור אנטיגן (ראה סעיף 5).
- דגירה במשך 20 דקות עם 2 N HCl ב 37 מעלות צלזיוס. יש לשטוף פנימה חיץ בוראט באורך 0.1 מ' (pH 8.5) למשך 10 דקות. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS 0.1 M קר כקרח.
- דגירה במשך שעתיים בטמפרטורת החדר ב-PBS++ (תמיסת חסימה).
- דגירה עם נוגדן ראשוני נגד BrdU (עכבר מארח) 1:250 ב-PBS+ למשך הלילה בטמפרטורה של 4°C.
- ביום השני, יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם 0.1 M PBS.
- דגירה עם נוגדן משני 1:250 ביוטינילציה (אנטי-עכבר) ב-PBS+ למשך 2\u20124 שעות בטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M.
- דגירה בתמיסת ABC למשך שעה אחת בטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M.
- מעבירים פרוסות לתמיסת מצע DAB peroxidase (HRP) ומדגרים למשך 2\u201210 דקות. כאשר פרוסות הופכות לאפורות כהות, דמיינו את הרקמה באמצעות זכוכית מגדלת או מיקרוסקופ. אם קיימים תאים חיוביים, יש לשטוף 3 פעמים (15 דקות כל אחד) במי ברז (כדי להפחית את הרקע) ולאחר מכן 3 פעמים עם שטיפת PBS של 0.1 M למשך 10 דקות כל אחת.
הערה: יש להכין את הפתרון מיד לפני השימוש. יש להקפיד להימנע מפרוסות מוח שנדבקות זו לזו עקב כתמים כהים לא סדירים ברקמה. - הרכבו בזהירות פרוסות על מגלשות ג'לטיניות באמצעות מברשת רכה ולאחר מכן ייבשו באוויר למשך הלילה בטמפרטורת החדר.
- במידת הצורך יש צורך בכתם נגדי (ראו שלב 7.1), הוסיפו מדיום הרכבה קבוע והניחו את הכיסויים. יש לאחסן בטמפרטורה של 4°C למשך עד 6 חודשים.
- זיהוי BrdU על ידי אימונופלואורסצנציה באמצעות הגברת סטרפטאווידין-ביוטין (LSAB) המסומנת
הערה: בצע את שלבים 4.3.1 עד 4.3.4 ביום הראשון.- מעבירים פרוסות מתמיסת ההקפאה ל-0.1 M PBS בטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M. לחלופין, בצע אחזור אנטיגן (ראה סעיף 5).
- דגירה במשך 20 דקות ב 2 N HCl ב 37 מעלות צלזיוס. יש לשטוף במאגר בוראט באורך 0.1 M (8.5 pH) למשך 10 דקות. יש לשטוף 3 פעמים במשך 10 דקות כל אחת ב-PBS 0.1 M קר כקרח.
- דגירה במשך שעתיים בטמפרטורת החדר ב-PBS++ (תמיסת חסימה). דגירה עם נוגדן ראשוני 1:250 נגד BrdU (מארח עכבר) ב- PBS+ בלילה ב-4 מעלות צלזיוס.
- ביום השני, יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם 0.1 M PBS.
- דגירה עם נוגדן משני 1:250 ביוטינילציה (אנטי-עכבר) ב-PBS+ למשך 2\u20124 שעות בטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M. דגירה עם סטרפטווידין מצומד פלואורוכרום (Cy3) ב-PBS (אין להשתמש בסרום) למשך 1\u20122 שעות בטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M.
הערה: סרום יכול להכיל ביוטין ואין להוסיף אותו לדילולים. במקום זאת, השתמש ב- PBS המכיל 0.3% של Triton X-100. - הרכיבו בזהירות פרוסות על מגלשות ג'לטיניות באמצעות מברשת רכה, ייבשו באוויר למשך הלילה בטמפרטורת החדר, או הרכיבו מיד עם אמצעי הרכבה מתאים. מכתים נגדיים (ראה שלב 7.2), מוסיפים מדיום הרכבה קבוע ומניחים כיסויים. יש לאחסן בטמפרטורה של 4°C למשך עד 6 חודשים.
- זיהוי BrdU על ידי אימונופלואורסצנציה עקיפה
הערה: בצע את שלבים 4.4.1 עד 4.4.4 ביום הראשון.- מעבירים פרוסות מתמיסת ההקפאה ל-0.1 M PBS עד שהיא מגיעה לטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M. בצע אחזור אנטיגן במידת הצורך (אופציונלי, ראה סעיף 5).
- דגירה במשך 20 דקות ב 2 N HCl ב 37 מעלות צלזיוס. יש לשטוף במאגר בוראט באורך 0.1 M (8.5 pH) למשך 10 דקות. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS 0.1 M קר כקרח. דגירה במשך שעתיים בטמפרטורת החדר עם PBS++ (פתרון חוסם). דגירה עם נוגדן ראשוני 1:250 נגד BrdU (מארח עכבר) ב- PBS+ בלילה ב-4 מעלות צלזיוס.
- ביום השני, יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם 0.1 M PBS.
- דגירה עם נוגדן משני מצומד פלואורוכרום 1:250 (אנטי-עכבר) ב-PBS+ למשך 2\u20124 שעות בטמפרטורת החדר. יש לשטוף 3 פעמים במשך 10 דקות כל אחת עם PBS של 0.1 M.
- הרכיבו בזהירות פרוסות על מגלשות ג'לטיניות באמצעות מברשת רכה, ייבשו באוויר למשך הלילה בטמפרטורת החדר, או הרכיבו מיד עם אמצעי הרכבה מתאים. מכתים נגדיים (ראה שלב 7.2), מוסיפים מדיום הרכבה קבוע ומניחים כיסויים. יש לאחסן בטמפרטורה של 4°C למשך עד 6 חודשים.
5. שליפת אנטיגן (אופציונלי)
הערה: אחזור אנטיגן הוא צעד אופציונלי שנועד לתקן את אובדן האנטיגניות הנגרמת על ידי קיבוע המשנה את המבנה השלישוני והרבעוני של אנטיגנים רבים, מה שהופך אותם לבלתי ניתנים לגילוי על ידי נוגדנים. ניתן להוסיף שלב זה לפרוטוקול המקורי.
- במיקרוגל או באמבט מים, יש לחמם מראש תמיסת pH 6 של 10 mM עם חיץ נתרן ציטראט (SCB) ל-90\u201295 °C (בהתאם לגובה, התמיסה מתחילה לרתוח סביב טמפרטורה זו). מלא 80% מצינור חרוטי של 50 מ"ל (40 מ"ל) ב-SCB שחומם מראש. העבר פרוסות לתוספות רשת לתוך הצינור החרוטי עם SCB. כסו את הצינור בפקק הברגה עם חורים העשויים ממחט G 18\u201220.
- יש לשמור את הפרוסות למשך 30 דקות ב-SCB בטמפרטורה של 80\u201285 °C תוך התחלת מחזורי התחממות לסירוגין במיקרוגל ברמת ההספק המינימלית. במידת הצורך, למלא את הצינור החרוטי עם SCB. מעבירים את הפרוסות מיד לאחר מכן יחד עם תוספות הרשת ל-PBS 0.1 M קר כקרח ושוטפים 3 פעמים במשך 10 דקות כל אחת.
6. תופעות חיסון מרובות (אופציונלי)
הערה: עיין בסעיף המבוא לקבלת הרציונל מאחורי שלב זה.
- מחיסוני מרובים בו זמנית
- הכינו קוקטייל עם הנוגדנים העיקריים למטרה (למשל, נגד עכבר נגד BrdU ונגד ארנב נגד GFAP) ב-PBS+. השתמשו בפונדקאים שונים עבור כל נוגדן ראשוני שבו נעשה שימוש. לדגור לילה ב 4 °C (64 °F). המשך עם אותם השלבים הבאים עבור כל פרוטוקול.
- הכינו קוקטייל עם הנוגדנים המשניים המתאימים לכל נוגדן ראשוני שבו נעשה שימוש (למשל, FITC נגד עכברים עזים, עזים נגד ארנב TRITC) באותה תמיסה מדוללת לכל פרוטוקול. המשך עם אותם השלבים הבאים עבור כל פרוטוקול. באופן אידיאלי, השתמש בנוגדנים משניים שמגיעים מאותם מארחים כדי למנוע תגובה צולבת.
- תכשירי חיסון מרובים ברצף.
- עקוב אחר הפרוטוקול של יעד הנוגדנים הראשון (למשל, עכבר נגד BrdU) ועצור לפני הרכבת הפרוסות. דגירה במשך שעתיים בטמפרטורת החדר עם PBS++ (פתרון חוסם).
- לדגום את הנוגדן העיקרי השני (למשל, ארנב אנטי -GFAP) ב- PBS+ בלילה בטמפרטורה של 4 מעלות צלזיוס. בצע את השלבים הבאים עבור כל פרוטוקול, כולל הדגירה של הנוגדן המשני השני (למשל, עז נגד ארנב TRITC). המשך עם השלבים הבאים עבור כל פרוטוקול עד הסוף.
7. צביעה נגדית (אופציונלי)
- עבור פרוטוקולים באמצעות תגובת פרוקסידאז, מחממים מראש את התמיסה הסגולה של קרסיל ל 60 מעלות צלזיוס. לחות את המגלשות עם ddH2O למשך דקה אחת. דגרו את השקופיות בתמיסת הקרסיל הסגולה החמה למשך 5\u201220 דקות.
- שטפו את השקופיות עם ddH2O למשך דקה אחת. שטפו את השקופיות עם 70%, 80%, 90% ו-100% אלכוהול אתילי למשך 1\u20123 דקות כל אחת. שטפו את השקופיות עם קסילן למשך 1\u20123 דקות.
- הוסיפו מדיום הרכבה הידרופובי קבוע והניחו כיסויים.
הערה: יש לאחסן בטמפרטורה של 4°C למשך עד 6 חודשים. ניתן להשתמש במדיום הרכבה מתוצרת עצמית המכיל PVA (אלכוהול פוליוויניל)-DABCO.
- עבור פרוטוקולים המשתמשים באימונופלואורסצנציה, הוסף נפח קטן (25\u201250 μL) של מדיום הרכבה הידרופילי עם DAPI, פרופידיום יודיד או דומה. יש לאטום סביב המערכת עם לק או חומר איטום פלסטי. יש לאחסן בטמפרטורה של 4°C למשך עד 6 חודשים.
8. הדמיה וניתוח
הערה: ראה טבלה 2 למפרטי הגדרת מיקרוסקופים. בדרך כלל, ספירת התאים החדשים המוכתמים נעשית באמצעות פרוסות מוכתמות בתגובת פרוקסידאז (שיטה זולה יותר), אך ניתן לבצע אותה גם באמצעות אימונופלואורסצנציה.
- כדי לכמת תאים, ראשית, זהה כראוי את הפיתול המשונן באמצעות עדשת ההגדלה 4x (להוראות נוספות על פרטים אנטומיים של DG, ראו Amaral et al.16).
- חפש בשכבת התאים הגרעינית של הפיתול המשונן גרעינים המסומנים ב- BrdU (באמצעות עדשת ההגדלה של 40x). בצע חיפוש תאים באופן ממצה לאורך ציר z מכיוון שניתן להפיץ תאים חדשים בשכבות שונות (ראו וידאו 1).
- בחר מקטע מרווח לחיפוש תאים בכל רחבי הפיתול המשונן (לדוגמה, כל מקטע שישי של רקמה, שווה ערך לכל 240 מיקרומטר).
- ספירת כל התאים החיוביים של BrdU. המורפולוגיה של הגרעין המסומן יכולה להשתנות בהתאם לכמות BrdU שהתא שילב ( ראו איור 3 כמדריך). לנוע באיטיות על ציר z כדי לכמת את כל מספר הגרעינים המשלבים צביר (ראו וידאו 2).
- הכפל את המספר הכולל של תאים שנספרו עם מקטע המרווח שנבחר (לדוגמה, 6) כדי להעריך את המספר הכולל של תאים חדשים המסומנים ב- BrdU.
- באופן אידיאלי, בניסוי רגיל, יש לספור לפחות עשרה חלקים לכל חיה ולפחות חמישה בעלי חיים לקבוצה.
- פירוק תמונה (אופציונלי)
הערה: עיין בסעיף המבוא לקבלת מידע חשוב אודות שלב זה. הליך זה זקוק לתמונות מונוכרומטיות (גווני אפור). שינוי צורה של תמונות צבעוניות לגווני אפור. אם התמונות הן ללא הפרדות צבע RGB, פצלו תחילה את הערוצים ומיזגו אותם כתמונה אחת (לא ללא הפרדות צבע), ולאחר מכן שנו את צורתם לגווני אפור של 8 סיביות.- צור קובץ z-stack ממיקרוגרפים.
- צור קובץ פונקציית כפולת נקודות (PSF) הפותח את התוסף Diffraction PSF 3D (https://imagej.net/Diffraction_PSF_3D) מתפריט האפשרות תוספים . מלא את כל הנתונים הנדרשים (ראה טבלה 2). לחץ על OK ושמור את הקובץ.
- פתח את התוסף DeconvolutionLab29 מתפריט התוספים (http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/). גררו את תמונת z-stack וקובץ PDF התואמים לחריץ החלון המתאים.
- בחר את אלגוריתם הדה-קונבולוציה (לדוגמה, ריצ'רדסון-לוסי) ואת מספר האיטרציות (לדוגמה, 20). לחץ על RUN.
- שלבו את התמונות המפורקות לתמונה z-stack אחת, בחרו באפשרות 'אוספים' מתפריט 'תמונה ' בחלק העליון. לאחר מכן לחץ על Z Project. בחר עוצמה מרבית מהתפריט הנפתח סוג הקרנה , הקש OK ושמור את הקובץ.
- צור תמונת RGB באמצעות קובץ התמונה היחיד של z-stack שנוצר בשלב שלמעלה, כאשר הצבע המדומה הרצוי בוחר ' צבע' מתפריט 'תמונה ' בחלק העליון. לאחר מכן לחץ על מיזוג ערוצים. הגדר את התמונה המתאימה לערוץ צבע הרצון מהתפריט הנפתח. בטל את סימון התיבה צור ללא הפרדות צבע, לחץ על OK ושמור את הקובץ (ראה איור 4).
- אם יש יותר מתמונת ערוץ אחת, חזור על השלבים 8.2.1\u20128.2.5. צרו קובץ תמונת RGB לאחר שלב 8.2.6, תוך פתיחת שני קובצי תמונה לפחות ובחירת ערוצי צבע שונים לכל קובץ תמונה (ראו איור 4).
תוצאות
השיטות שתוארו לעיל יושמו כדי לכמת תאי יילוד בהיפוקמפוס של חולדות בוגרות לאחר פעילות גופנית רצונית, בניגוד לקבוצת ביקורת ללא כל פעילות גופנית נוספת. השתמשנו בהיפוקמפוס של חולדה לאחר הלידה כבקרה חיובית. חולדות זכרים בני 3 חודשים היו תחת פרוטוקול פעילות גופנית מרצון (גלגל אינסופי) במשך שבעה ימים. ביום השישי הוזרקו לחולדות BrdU (קטע 2), וכל 12 שעות לאחר מכן עד שלוש זריקות מלאות. כדי להשלים שלוש חלוקות מחזור תאים, בעלי החיים הושפעו באופן טרנסקרדי (סעיף 3) 8 שעות לאחר הזרקת BrdU האחרונה. אותו הליך שימש בחודות בנות שלושה חודשים שלא עברו פעילות גופנית כדי לשמש כבקרה השוואתית. כבקרה חיובית, גורי חולדות בני יום אחד (יום 1 לאחר הלידה) הוזרקו עם BrdU פעם אחת, כפי שתואר בסעיף 2 לעיל. יום לאחר ההזרקה (יום 2 לאחר הלידה), גורים הומתו, וראשיהם היו שקועים בתמיסת PFA, כפי שמתואר בשלב 3.4. חולדות בוגרות הרדימו עמוקות (שלב 3.1), עברו טרנסקרדיאליות, כפי שמתואר בשלב 3.2. המוחות נותחו ופוסט-מקובעים (שלב 3.4). המוחות נחתכו ל-40 מיקרומטר (שלב 3.5). המקטעים עובדו עבור אימונוהיסטוכימיה של BrdU, כמתואר בשלב 4.
השתמשנו בתגובת פרוקסידאז חזרת עם DAB IHC להכתמה (שלב 4.1) וספירת תאים חיוביים ל-BrdU ב-DG. איור 5 מראה מקטע DG עם תאים המסומנים ב-BrdU. איור 5C,D מראה חלק מייצג של מקטע DG בהגדלה גבוהה יותר. תאים מסומנים הראו כתמים כהים עזים, אשר סומנו בחצים. הכניסה מציגה את המספרים הממוצעים של תאים מסומנים בקבוצות הניסוי והביקורת (תאים חיוביים שנספרו כפול שישה כמתואר בשלב 8.1). מבחן t של סטודנט חשף הבדלי מובהקות בין מספר התאים החיוביים ל-BrdU (t(10) = 2.704, p = 0.0222). קבוצת הביקורת שלא עברה פעילות גופנית הראתה 2,040 ± 314 תאים (n = 6 חולדות). לשם השוואה, קבוצת הפעילות הגופנית הראתה בממוצע 3,606 ± 486 (n = 6 חולדות) תאים חיוביים ל-BrdU. כפי שנצפה, חשיפה לפעילות גופנית מגבירה תאים חיוביים ל-BrdU. לכן, תוצאות אלה עולות בקנה אחד עם תוצאות מדווחות אחרות המראות כי פעילות גופנית הגבירה את התפשטות התאים בפיתול המשונןהבוגר 17.
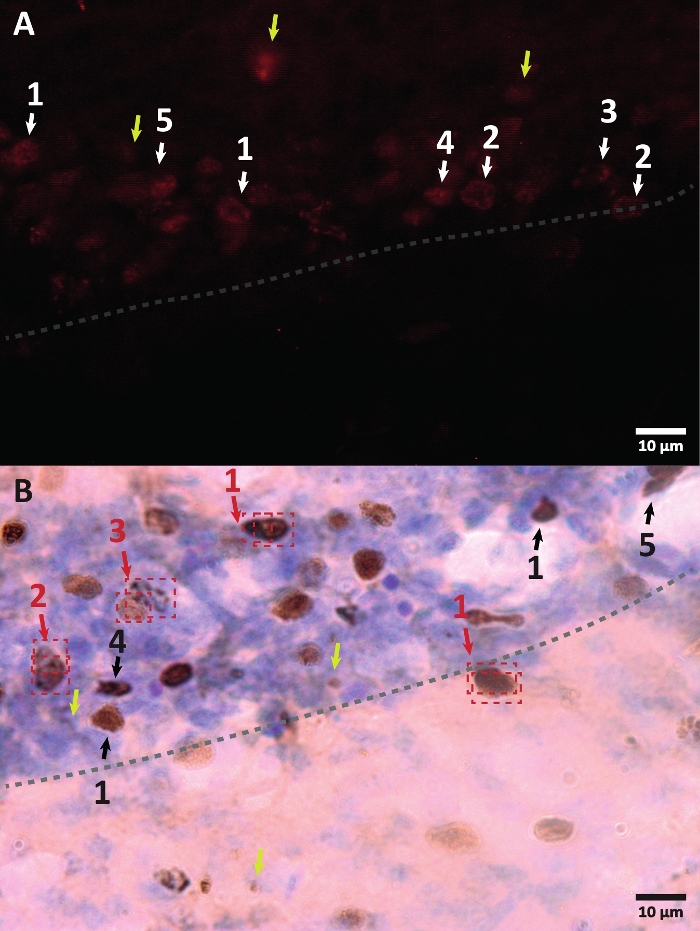
איור 3: דוגמאות למורפולוגיה שונה של גרעין תא המסומן ב-BrdU. BrdU הוא סמן סינתזת DNA המתייג את הגרעין. באזור ההיפוקמפוס, לגרעינים החיוביים ל-BrdU הייתה צורה סגלגלה למחצה הממוקמת באזור התת-גרגירי של הפיתול המשונן. מכיוון ש-BrdU משולב על ידי תחרות, לכמות המשולבת עבור כל תא תהיה וריאציה שתבוא לידי ביטוי מאוחר יותר באופן שבו הגרעין יודמי. (A) תמונת אימונופלואורסצנציה. (B) מוצגת תמונה המשתמשת בתגובת פרוקסידאז ללא שיטת הגברה נוספת. חצים צהובים מראים ממצאים ואותות לא ספציפיים. חצים שחורים או לבנים מציגים תאי BrdU+ . 1 – גרעין מתויק במלואו, גרעינים סגלגלים למחצה צבעוניים מאוד. 2 – גרעינים עם נקודות, גבול הגרעינים מסומן ויש לו בתוך כמה נקודות. 3 – גרעינים עם מעט נקודות, גבול הגרעינים מסומנים ויש בתוכם מספר קטן של נקודות. 4 – גרעין קטן הוא תאים אפשריים בשלב התמיינות שונה אך עדיין חלק מהגומחה. 5 – אשכולות הם תאים מקדימים בחלוקה, ולכן ניתן לראות מספר תאים יחד בקבוצות מעובות. בתוך קבוצות אלה, הספירה חייבת להיעשות בזהירות רבה במיוחד כדי למנוע תיוג שגוי של תאים חיוביים. חיצים אדומים מראים את הגרעין שמתחת לחלוקה שיכול להתבלבל כתא בודד. כל תא מוקף בתיבה וניתן להבחין בו במישור ציר Z בזמן אמת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
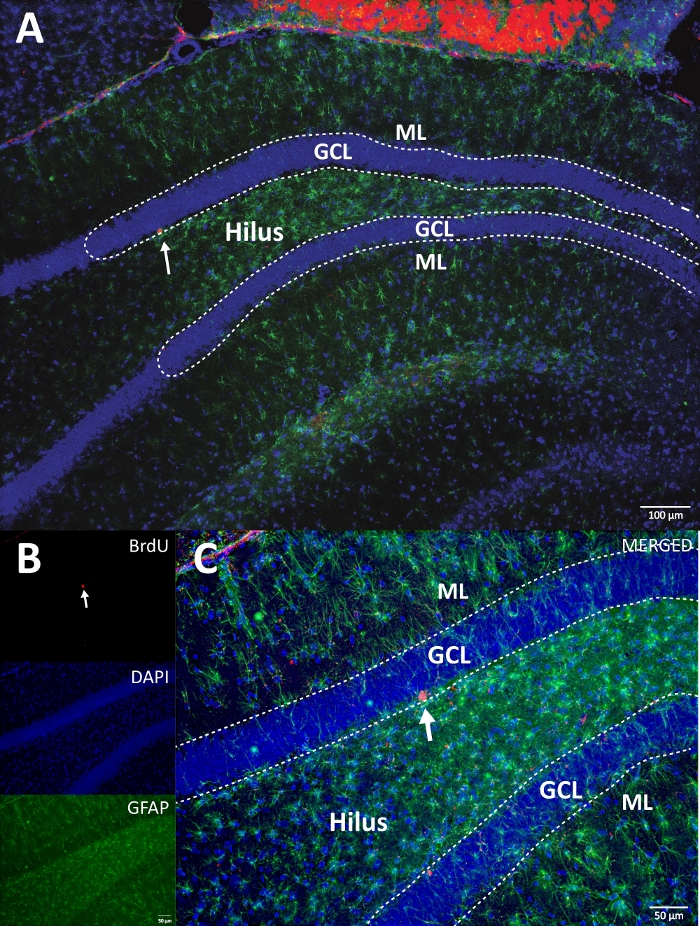
איור 4: תמונת RGB מייצגת לערוצים בודדים ולערוצים ממוזגים. התמונה העליונה מציגה את תמונת z-stack המקורית, והתמונה התחתונה מציגה את תמונת z-stack התלת-ממדית. (A) הגדלה נמוכה של DG. (B) תמונת RGB לכל ערוץ, ו- (C) תמונה ממוזגת RGB. זה היה מוח מקבוצת הביקורת. אימונופלואורסצנציה שימשה ללא שיטת הגברה נוספת. BrdU (אדום), DAPI ככתם נגדי (כחול), ו- GFAP (חלבון חומצי פיברילרי) כסמן אסטרוגליאלי (ירוק). ML = שכבה מולקולרית; GCL = שכבת תא גרעינית; SGZ = אזור תת-גרנולרי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
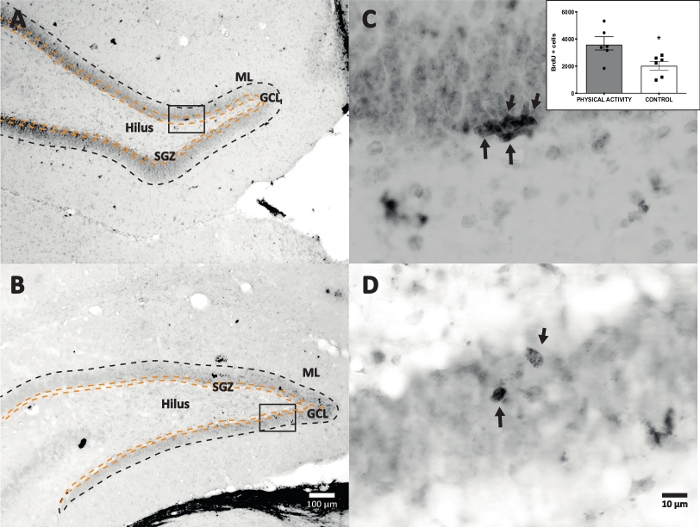
איור 5: מקטע DG מייצג עם תאים מסומנים BrdU (כהה עז) עבור כל קבוצת ניסוי. תגובת הפרוקסידאז שימשה בשיטת ההגברה המורכבת אבידין-ביוטין-פרוקסידאז. (א, ב) הצג הגדלה נמוכה של ה- DG, ו- (C, D) הצג את אזור התיבה בהגדלה גבוהה יותר. לוחות A ו- C הם רקמות מקבוצת הפעילות הגופנית, לוחות B ו- D הם מקבוצת הביקורת. הכניסה מציגה את המספרים הממוצעים של תאים מסומנים בקבוצות הפעילות הגופנית והביקורת (תאים חיוביים שנספרו כפול שישה כמתואר בשלב 8.1). ML = שכבה מולקולרית; GCL = שכבת תא גרעינית; SGZ = אזור תת-גרני; חצים מציינים תאי BrdU+ . אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
סרטון 1: סרטון המציג מיקוד שונה של תאים חיוביים לאורך ציר z המפוזר בשכבות שונות. אנא לחץ כאן כדי להוריד סרטון זה.
סרטון 2: סרטון המציג מוקד שונה של אשכולות תאים חיוביים לאורך ציר z המפוזרים בשכבות שונות. לנוע באיטיות על ציר z כדי לכמת את כל כמה גרעינים המשלבים צביר. אנא לחץ כאן כדי להוריד סרטון זה.
| סוג מיקרוסקופ: | מיקרוסקופ אפיפלואורסצנציה אולימפוס BX53 | ||||
| מקור אור: | מנורת קשת כספית בלחץ גבוה 130 W (U-HGLGPS) | ||||
| רכישת תוכנה: | סנסורים סלולריים סטנדרטיים | ||||
| ערכות מסננים: | מספר קטלוגי | טווח עירור | מראה דיכרומטית | טווח דיכוי | |
| U-FUW | 340 - 490 ננומטר | 410 נאנומטר | 420 נאנומטר | ||
| U-FBW | 460 - 495 ננומטר | 505 נאנומטר | 510 נאנומטר | ||
| U-FGW | 530 - 550 ננומטר | 570 נאנומטר | 575 נאנומטר | ||
| מצלמה: | מודל: | מצלמת CCD UC50 | |||
| טווח ספקטרלי: | 290 – 1000 ננומטר | ||||
| גודל שבב CCD: | 2/3 אינץ', 2588 (רוחב *7) X 1960 (גובה *8) פיקסלים | ||||
| גודל פיקסלים: | 3.4 X 3.4 מיקרומטר | ||||
| פלואורוכרום: | שם | עירור אורך גל (nm) | פליטה *3 אורך גל (ננומטר) | צבע פליטה | |
| 4, 6-דיאמידינו-2-פניל-אינדול הידרוכלוריד (DAPI) | 345 | 455 | כחול | ||
| טטרה-מתילרהודאמין-איזותיוציאנט (TRITC) | 541 | 572 | אדום | ||
| פלואורסצין-איזותיוציאנט (FITC) | 494 | 519 | ירוק | ||
| סי3 | 552 | 565 | אדום | ||
| הרכבה בינונית ושמן טבילה: | שם | מדד השבירה של התקשורת *1 | |||
| אוויר (שום דבר בין המגלשה לעדשה) | 1.00029 | ||||
| מדיום הרכבה נגד פעימה עם DAPI | 1.45 | ||||
| מדיום הרכבה פרמאונט | 1.519 | ||||
| שמן טבילה אוטופלואורסצנטי נמוך (MOIL-30 Type F) | 1.518 | ||||
| עדשת הגדלה (תוכנית פלואוריט) | הגדלה | צמצם מספרי (NA) *2 | רזולוציה (מיקרומטר) | מרווח בין פיקסלים בתמונה (nm) *5 | מרווח פרוסות ציר Z (ננומטר) *6 |
| פי 4 | 0.13 | 2.12 | 850 | 3000 | |
| פי 10 | 0.3 | 0.92 | 340 | 3000 | |
| פי 20 | 0.5 | 0.55 | 27 שניות | 2000 | |
| פי 40 | 0.75 | 0.37 | 85 | 1000 | |
| פי 100 | 1.3 | 0.21 | 34 | 1000 | |
טבלה 2: מפרטי הגדרת מיקרוסקופ ודרישות יצירת קבצים של פונקציית התפשטות נקודה (PSF). ישנם 11 חריצים בחלון תוסף PSF 3D עקיפה כדי ליצור את קובץ PSF. כל חריץ מתואר כך: *1 - אינדקס שבירה של המדיה: אינדקס שבירה עבור התווך שבין השקופית לעדשה (למשל, אוויר = 1.00029). *2 - מפתח צמצם נומרי: NA של העדשה בשימוש (יש לתקן אותה כאשר נעשה שימוש במדיית טבילה אחרת והעדשה הוקצתה). *3 - אורך גל: אורך גל פליטה מרבי של פלואורוכרום (ננומטר). *4 - סטייה כדורית אורכית: 0.00. *5 - מרווח בין פיקסלים בתמונה: גודל פיקסל CCD (nm)/הגדלה (לדוגמה, עדשת 3.4 מיקרומטר ו-100X, 3400/100 = 34 ננומטר). *6 - מרחק בין תמונות ציר Z. *7 - רוחב: הזן את רוחב התמונה לפירוק בפיקסלים. *8 - גובה: הזן את גובה התמונה כדי לפרק אותה בפיקסלים. *9 - עומק, פרוסות: מספר התמונות בערימת z. *10 - נורמליזציה: סכום ערכי הפיקסלים = 1. *11 - כותרת: השם הרצוי לקובץ PSF. הקובץ צריך להתאים לתמונת z-stack הייחודית הנתונה.
Discussion
נוירוגנזה בוגרת היא תהליך המתרחש בתדירות הגבוהה ביותר בנישות של תאים מבשרים עצביים בוגרים שיש להם פוטנציאל ליצור נוירונים חדשים לאורך תוחלת חייהם. תיוג Bromodeoxyuridine (BrdU) נמצא בשימוש נרחב באימונולוגיה כדי לאפיין את מספר התאים החדשים שנוצרו במוח בוגר. BrdU ישולב בעיקר בתאים של אזורי מוח בדידים (אזורים נוירוגניים). תאים אלה ממוקמים באזור התת-חדרי (SVZ), הפיתול המשונן של ההיפוקמפוס – בין ההילוס לתאים הגרעיניים המכונה אזור תת-גרגירי (SGZ)1,2,18. יתר על כן, ישנם אזורים שונים במוח המאופיינים ביכולת שגשוג נמוכה יותר בבגרות, כולל ההיפותלמוס, הסטריאטום, ניאוקורטקס ואמיגדלה19. כפי שהוזכר קודם לכן, צביעת BrdU היא השיטה הנפוצה למחקר נוירוגנזה למבוגרים לזיהוי התפשטות תאים. עם זאת, לשימוש ב- BrdU כסמן יש מגבלות ומלכודות. הראשון הוא כי BrdU הוא סמן מחזור התא. לכן, יש לבצע צביעה כפולה או משולשת כדי לזהות את גורל התא ולכלול סמני תאים כדי לזהות את השלב ההתפתחותי הספציפי של התאים המסומנים. דאגה נוספת לגבי BrdU היא שמדובר בתמיסה רעילה ומוטגנית המשנה את יציבות הדנ"א ועשויה לשנות את תפקוד התאים ואת מחזורי התאים. יש לתת את הדעת למידע הקודם כאשר מחליטים לעקוב אחר פרוטוקול מתן ומינוני מתן (50\u2012600 מ"ג/ק"ג). תכונה חיונית נוספת היא ש-BrdU הוא סמן סינתזת DNA, ולא סמן התפשטות תאים14. לכן, רלוונטי להבחין בין התפשטות תאים לבין אירועים אחרים כגון תיקון DNA, כניסה חוזרת של מחזור התא ושכפול גנים. החוקרים חייבים לעקוב אחר בקרות מתאימות כדי להבטיח את השימוש המתאים ב- BrdU. לדיון מפורט יותר על בעיות ומגבלות אלה, אנו ממליצים לעיין בעבודתו של טאופין14. תהליך התקינה של פרוטוקול אימונוהיסטוכימיה עשוי להיות איטי ומאתגר. בעבודה זו, הצגנו את כל השלבים הכלליים לניהול פרוטוקול IHC מוצלח. עם זאת, אנו ממליצים לכל קבוצת מחקר לבדוק ולהעריך מראש רקמות, נוגדנים ומצבים. בדיקות והערכות חייבות להתבצע עם לפחות שלוש רמות שונות של דגירה, שלבי שטיפה ועוצמות עבור כל נוגדן ורקמה שנבדקו. אנו ממליצים גם לחוקרים לסקור פרוטוקולים נוספים כדי שיוכלו לבחור את הטוב ביותר העונה על צרכים ודרישות ספציפיים 20,21,22,23,24,25.
כאמור, הנוהל כולל מספר שלבים ושיקולים מתודולוגיים המשמשים בדרך כלל ומוזכרים במאמרים מדעיים, אשר יידונו בהמשך. אנו ממליצים לחוקרים לבחור את הנוגדנים בקפידה ובצורה נכונה מבחינת טכניקה, תקציב, ציוד, התקנה ומטרת המחקר העיקרית. נוגדנים חייבים להיבדק עם אותו סוג של רקמה שתיבדק מאוחר יותר בניסוי. אנו ממליצים גם על שימוש בנוגדן שנבדק לאותה מטרה (IHC) (כלומר, לא רק בטכניקות של כתם מערבי או ציטומטריה של זרימה) כדי לבדוק את התאמתו לטכניקת הקיבוע. מסלולים שונים יכולים לשמש למתן מכתים BrdU כגון הזרקה תוך-צפקית, עירוי תוך-צפקי, בליעה דרך הפה או עירוי תוך-חדרי (לתיאור מפורט יותר של כל טכניקה, ראו הפניה26). אם נבחרה ההזרקה התוך-צפקית, ודא כי BrdU מנוהל לתוך חלל הצפק הימנעות מאזור המעי. מכיוון שבמעי יש מספר תאים בכפילות שיכולים למצות את ה- BrdU לפני שהוא מגיע למוח מה שישפיע על מספר התאים המסומנים. חשוב להשיג חתכים דקים שכן הם מאפשרים חדירה טובה יותר של פתרונות. פרוסות קורונליות בעובי 40 מיקרומטר נחתכו ברוסטרו-קאודאלי והועברו לצלחת תרבית תאים בת 24 בארות, בעקבות ההליך הסטריאולוגי שהוצע על ידי Kempermann et al.27. האימונוהיסטוכימיה יכולה להתבצע עם רקמה המותקנת על מגלשות או כקטעים צפים חופשיים. מכיוון ש-BrdU ממוקם עמוק בגרעיני התאים, הוא מאפשר חדירה של תמיסות במקטעים צפים חופשיים המספקים תוצאות טובות יותר וגישה טובה יותר לאזור העניין. חשוב לפתוח קשרי דנ"א (דנטורציה של דנ"א) כדי לאפשר גישה לנוגדנים העיקריים נגד BrdU. בעבודה זו, ביצענו את ההליכים הספציפיים הללו תוך שימוש בדגירה של HCI. מאידך גיסא, תהליך חסימת אפיטופים לא ספציפיים איפשר זיהוי מדויק יותר של אות סלולרי.
חלחול הממברנה הטוב מאפשר לנוגדנים לחדור כראוי לאזור העניין. הוספת פרמבילייזר כגון Triton X-100 לתמיסות PBS++ ו-PBS+ משפרת את חלחול הממברנה. ניתן להשתמש הן בריאגנטים של PBS והן בריאגנטים של מלח עם מאגר טריס (TBS) בפרוטוקול זה. במונחים של תקציב, TBS יכול להיות תורת היחסות זולה יותר מאשר PBS. עם זאת, PBS עלול להפריע לנוגדנים נגד פוספטים ולעכב נוגדנים מצומדים של פוספטאז אלקליין, לכן הימנע משימוש ב- PBS אם המטרה שונה לאחר תרגום על ידי זרחון (כלומר, זרחון). השתמשנו ב-PBS לעבודה זו, וגילינו ששלבי שטיפת רקמות נתנו אות ספציפי יותר. אנו גם ממליצים לחוקרים לבצע לפחות שלושה מחזורי כביסה באמצעות TBS o PBS. הפתרונות חייבים להיות מוכנים טריים. שליפת אנטיגן (AR) היא שיטה שנועדה להפחית את אובדן האנטיגניות הנגרמת על ידי הקיבוע המשנה את מבנה האנטיגנים השלישוניים והרבעוניים. הפחתה זו הופכת את האנטיגנים לבלתי ניתנים לגילוי על ידי נוגדנים28,29. שליפת האפיטופ המושרה בחום (HIER) המשמשת בפרוטוקול זה ניסתה להפוך את התגובות הכימיות בין פורמלדהיד לחלבונים על ידי טמפרטורה גבוהה או הידרוליזה אלקליין חזקה (עם תמיסות חיץ אחרות כמו EDTA pH 8.5 או Tris pH 9.5). חיוני לבדוק נוגדנים חדשים עם פרוטוקולי AR שונים כדי להשוות את התוצאות ולבחור את הטוב ביותר עבור הפרוטוקול. שלב אחרון זה עשוי להיות אופציונלי בפרוטוקול רגיל; עם זאת, טיפלנו ברקמות באמצעות פרוטוקול אחזור אנטיגן כדי לספק תוצאות טובות יותר עבור פרוטוקול זה.
חשוב לבחור את הצבע המנוגד הסופי הנכון ואת טכניקת הכתם הנגדי בהתחשב בצבע הצביעה הראשוני ובשיטה המשמשת להפיכת מבנה שאינו מכתים לגלוי לעין ולהימנע מהסתרת צבע הכתם הראשוני מהתגובה החיסונית. עבור המיקרוסקופיה הפלואורסצנטית, ה-DAPI (4', 6-diamidino-2-phenylindole) הוא כתם נגדי גרעיני וכרומוזומי פופולרי מאוד הפולט פלואורסצנטיות כחולה (ספיגה: 360 ננומטר, פליטה: 460 ננומטר) עם קשירתו לאזורי AT של הדנ"א. אמצעי הרכבה המכיל DAPI זמין וקל לשימוש; זה מספק שמירת אותות מצוינת לרכישת תמונה. עבור תגובת החמצן, IHC היה זמין באפשרויות שונות כגון צבע סגול קרזיל, המטוקסילין, אדום נייטרלי או כתמים בצבע ירוק מתיל. עבור טכניקות חיסוניות מרובות, חיוני לבחור נוגדן תואם עם טכניקת הקיבוע המשמשת למניעת תגובתיות צולבת30. כאשר נפתרות בעיות וסיבוכים עם צביעה בודדת, יש לבצע צביעת צבע נוספת לפי הצורך. חשוב לשלוט בקשירה הלא ספציפית בין הנוגדנים המשניים. ניתן לעשות זאת על ידי רוויית הנוגדנים הראשוניים לפני שימוש בנוגדן משני המיוצר באותו מין מארח של הנוגדנים הראשוניים. לדוגמה, בעת שימוש באנטי-עכבר המיוצר בארנב ואנטי-ארנב המיוצר בנוגדנים משניים של עזים, יש להשתמש בנוגדן האנטי-ארנב המיוצר בנוגדן עז לפני האנטי-עכבר המיוצר בנוגדן ארנב. כאשר השיטה הרציפה נשלטת לחלוטין, אז תהליך immunostaining בו זמנית ניתן ליזום. בשיטה זו, חיוני לבחור נוגדנים משניים כראוי. באופן אידיאלי, כל הנוגדנים האלה חייבים להגיע מאותה חיה מארחת כדי למנוע תגובתיות צולבת. אנו ממליצים לבצע בקרה חיובית כדי לוודא ששיטת הצביעה פועלת באופן מדויק ברקמת ההיפוקמפוס לאחר הלידה (נוירוגנזה בשפע סביב גיל זה). אם רקמת הבקרה החיובית מראה בעיות צביעה, בדקו ועברו על ההליך, בצעו תיקונים והתאמות, וחזרו על הפעולה עד ליצירת צביעה טובה. לאחר מכן, הפעל בקרה שלילית כדי לבדוק שהנוגדן פועל כראוי על ידי השמטה או החלפה של נוגדן ראשוני מסוים בסרום רגיל (אותו מין כמו הנוגדן הראשוני). כפי שצוין במבוא, פירוק תמונה הוא כלי רב עוצמה ומספק אלטרנטיבה כאשר מיקרוסקופ קונפוקלי אינו זמין. הוא יכול להחיל את פירוק התמונה על כל התמונות המתקבלות באמצעות שדה בהיר של אור המועבר, פלואורסצנציה של שדה רחב ומיקרוסקופיה פלואורסצנטית קונפוקלית. המטרה הסופית של פירוק תמונה היא לשחזר את האות המקורי כי מערכת הרכישה מתדרדרת10.
לסיכום, זיהוי התאים החדשים שנוצרו על ידי זיהוי חיסוני של תימידין אנלוגי BrdU הוא טכניקה מורכבת אך רבת עוצמה. עבודה זו היא ניסיון לסייע למדענים, במיוחד בתחום של נוירוגנזה בהיפוקמפוס בוגר, לכמת תאים חדשים בצורה מדויקת יותר. אנו מקווים שמאמץ זה היה מועיל לקהילה המדעית ומקל על כוונון עדין של חקר התפשטות התאים על ידי טכניקת האימונוהיסטוכימיה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות למר מיגל בורגוס ולגוסטבו לאגו על מתן סיוע טכני. אנו רוצים להודות גם לד"ר קלורינדה אריאס, ד"ר קרלה הרננדז וד"ר אוסקר גליציה על תמיכתם האדיבה במתן ריאגנטים וחומרים. אנו מודים גם ל- División de Investigación y Posgrado של אוניברסיטת איברואמריקנה סיודאד דה מקסיקו על מתן מימון לביצוע עבודה זו ועל כיסוי הוצאות הפקת וידאו.
Materials
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
References
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- Giannini, A., Giannini, J. 2D and 3D Fluorescence Deconvolution Manual. , Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016).
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667(2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551(2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166(2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved