Method Article
使用胸苷类似物BrdU分析大鼠细胞增殖和神经发生的免疫组织化学技术
* 这些作者具有相同的贡献
摘要
本文介绍了四种最常见的技术,用于可视化BrdU阳性细胞以测量大鼠的成年神经发生。这项工作包括试剂制备、胸苷类似物给药、经心灌注、组织制备、过氧化物酶免疫组织化学反应、免疫荧光、信号放大、复染、显微镜成像和细胞分析的说明。
摘要
成人海马神经发生(AHN)领域最重要的事情之一是识别新生成的细胞。胸苷类似物(如5-溴-2'-脱氧尿苷(BrdU))的免疫检测是用于可视化这些新生成的细胞的标准技术。因此,BrdU通常在小动物腹膜内注射,因此胸苷类似物在DNA合成过程中被掺入分裂细胞中。通过脑切片的免疫组织化学分析进行检测。每个使用这种技术的研究小组都可以体会到,它需要特别注意微小的细节才能获得成功的染色。例如,一个重要的步骤是用HCl使DNA变性,这允许它到达细胞核对其进行染色。然而,现有的科学报告很少详细描述这些步骤。因此,标准化该技术对于新实验室来说具有挑战性,因为可能需要几个月的时间才能产生积极和成功的结果。这项工作的目的是描述和阐述在使用胸苷类似物BrdU时获得免疫染色技术的积极和成功结果的步骤。该方案包括试剂制备和设置、在啮齿动物中给予胸苷类似物、经心灌注、组织制备、过氧化物酶免疫组织化学反应、亲和素-生物素复合物的使用、免疫荧光、复染、显微镜成像和细胞分析。
引言
几十年来,成年人的大脑中都会产生新的神经元,这一想法一直让科学界着迷。大脑在其整个生命周期中产生新神经元的知识是通过检测分裂1,2下的细胞获得的。首先通过在大鼠颅内注射氚化胸苷(胸苷-H3)并通过放射自显图检测细胞周期中的细胞来检测成人大脑中新生成的神经元。报道了神经胶质细胞分裂和神经母细胞的存在,这是关于产后神经发生的第一个有希望的数据1。然而,胸苷-H3的使用和检测意味着放射性的使用,这可能对管理它的人有害。Miller和Nowakowski3于1988年首次研究BrdU免疫组织化学在神经系统中细胞增殖,迁移和起源研究中的适用性。1998年,Eriksson及其同事发表的一篇论文表明,注射了5-溴-2′-脱氧尿苷(BrdU)4的患者在死后在人类成人大脑中可视化了新的神经元。这些患者接受BrdU注射(250mg静脉注射)以标记肿瘤的生长4。这种技术被应用于动物模型。这些方法的引入标志着该领域的一个里程碑,因为它允许在不使用放射性化合物的情况下检测新生成的细胞。该程序成为测量成人大脑生态位中细胞增殖的黄金标准,以促进该领域的进一步研究。
胸苷类似物技术的局限性在于它不允许确定新生成的细胞的细胞身份。然而,免疫组织化学允许我们对同一细胞进行双重或三重标记技术,从而验证新生成的细胞的细胞命运甚至它们的成熟阶段,从而导致该领域的进一步进化。该方法的特征在于将新生成的细胞分化为神经胶质细胞,未分化的神经元或完全成熟的颗粒细胞,甚至可以确定它们是否积极参与电路。该领域的另一个突破是使用转基因模型来鉴定巢蛋白结构域下的未分化细胞。巢蛋白-GFP转基因小鼠表达增强的绿色荧光蛋白(GFP),该蛋白在巢蛋白启动子的控制下。巢蛋白是一种中间丝,其特征在于祖细胞5。巢蛋白-GFP转基因小鼠允许建立参与神经发生的早期发育步骤6。然而,一个重大的局限性是能够在实验室设施中在特殊条件下维持巢蛋白-GFP转基因小鼠群体,这对于某些科学团体,特别是来自发展中国家的科学团体来说具有成本效益。
上面提到的技术有优点和缺点。然而,通过免疫组织化学(IHC)鉴定增殖细胞以及通过免疫荧光进行双重或三重标记技术以鉴定细胞成熟阶段或细胞命运的可能性是迄今为止测量成人神经发生的最可行方法。使用免疫组织化学的鉴定过程包括用特异性抗体标记蛋白质、蛋白质结构域或核苷酸,该抗体允许识别它们,称为一抗。后者由二抗识别,二抗用与二抗偶联的显色原(例如辣根过氧化物酶)或荧光染料(例如FITC)标记。显微镜可以检测色原和荧光染料信号。使用IHC,可以识别膜蛋白,细胞骨架蛋白或核成分,例如BrdU。另一方面,BrdU可以在细胞核中找到,因为它在S期通过竞争被掺入DNA。因此,一个关键步骤是用HCl进行DNA变性,它打开DNA键,允许BrdU抗体进入DNA内的BrdU。必须知道BrdU在腹膜内给药后分别以饱和浓度存在于小鼠和大鼠血清中15和60分钟,然后在60和120分钟分别迅速下降至检测不到的水平7。
在这里,我们描述了四种不同但密切相关的IHC技术:使用辣根过氧化物酶(HRP)反应与DAB(3,3'-二氨基联苯胺)无信号扩增的显色间接检测(步骤4.1),亲和素 - 生物素复合物(ABC)扩增(步骤4.1),无信号放大的间接免疫荧光检测(步骤4.4)和标记的链霉亲和素 - 生物素(LSAB)扩增(步骤4.3)。每种方法都有优点和缺点,可用于特定的组织要求(见 表1)。我们决定采用间接ICH方法,因为它们的价格实惠且简单,可以在使用非偶联的一抗时从显色检测方法更改为荧光检测方法。HRP方法是一种常用的IHC方法,因为它具有经济性,高稳定性,高周转率和底物的完全可用性。尽管如此,我们建议使用阳性对照来确认染色方法是否准确,并使用阴性对照来有效测试抗体功能。多重免疫染色或多重IHC方法(参见步骤6)是在单个实验中从组织切片获取大量数据的有效工具。当样品的可用性有限时,这种技术尤其重要。另一个优点是可以同时鉴定在同一细胞空间中共表达的特定蛋白质,同时保持组织完整性。多重检测允许对特定增殖阶段表达的不同标记物(例如巢蛋白、GFAP、DCX、Ki-67)进行染色,使我们能够进行更详细的增殖和分化研究8。选择与用于避免交叉反应的固定技术兼容的抗体至关重要。我们建议单独检测每种新抗体(包括BrdU),以调整和完善方法。然后,引入双序贯染色,最后,当序贯方法完全占主导地位时,开始同步免疫染色过程。为该方法选择合适的二抗至关重要。
| 方法 | 具体方法 | 优势 | 弊 |
| 间接检测方法 | 过氧化物酶与DAB的反应 | 1.比直接检测和间接荧光法灵敏度高。 2.比荧光染料具有更高的抗光漂白性。 3. 比荧光检测方法成本更低 | 1.难以用较少的彩色染料进行多路复用。 2. 对于同一细胞空间中的共表达靶标来说很复杂。 3. 降低同一组织上同时具有稀缺和高丰度靶标的动态范围。 |
| 荧光 | 1.最好和最容易使用更多颜色染料进行多路复用。 2. 最适合同一细胞空间中的共表达靶标。 3. 更好的动态范围,可在同一组织上同时处理稀缺和高丰度靶标。 4. 无需额外步骤。 | 1.灵敏度低于DAB法间接过氧化物酶反应。 2.随着时间的推移,对光漂白的抵抗力较弱。 3.更贵。 | |
| 信号放大方式 | 亲和素-生物素复合物(ABC) | 1.灵敏度高于直接和间接检测方法。 2. 减少背景 | 1. 附加步骤。 2.比不放大更昂贵。 |
| 标记链霉亲和素-生物素 (LSAB) | 1.灵敏度高于直接和间接检测方法。 2.比ABC方法更实质性的组织渗透。 3. 减少背景 | 1. 附加步骤。 2.比ABC方法贵。 | |
| 非额外扩增方法 | 1.成本更低。 2.无需额外步骤。 3. 高丰度靶标的理想选择。 | 1.灵敏度较低:有问题,没有丰富的靶标。 |
表1:IHC技术的优缺点。 下表显示了间接检测方法的优缺点:过氧化物酶与(3,3'-二氨基联苯胺)DAB反应和荧光;和信号放大方法:亲和素-生物素复合物(ABC),标记的链霉亲和素-生物素(LSAB),而不是额外的扩增方法。
高分辨率图像是执行正确分析和呈现结果的基础。有两种方法可以提高分辨率:1)使用更好的显微镜设计(例如,共聚焦,多光子)或2)使用反卷积9以数字反转模糊过程以增强图像。不幸的是,由于设备及其服务成本高昂,共聚焦显微镜负担不起10。宽场落射荧光显微镜和随后对z-stack图像的反卷积为共聚焦显微镜8,9提供了一种合适的低成本替代方案。如上所述,反卷积的目标是通过使用数学去除算法10减少落射荧光或共聚焦显微镜获得的图像中显示的模糊、离焦雾霾和失真来恢复被采集系统9降级的原始信号。采集的模糊图像可以通过数学建模,作为使用3D点扩散函数(PSF)卷积观察到的对象的结果。PSF是组织样品发射并由显微镜收集的光点的理论衍射图。PSF文件是用每个图像的特定条件创建的,例如相机的CCD单元间距,所用介质的折射率,物镜的数值孔径,荧光团的发射波长,图像尺寸,z-stack处理方法中的图像数量以及它们之间的空间(参见表2中的技术规格)。换句话说,PSF文件总结了成像设置对显微镜观察的影响9。但是,我们使用衍射PSF 3D插件(https://imagej.net/Diffraction_PSF_3D)为每个z堆栈图像创建我们自己的特定PSF文件。Z 堆栈图像是位于载玻片同一 XY 位置的一系列来自定义深度(z 轴)的数字化光学切片。计算机通过重新分配来自位于其他焦平面中的物体的信号来编译从焦点平面获得的信息。要创建z-stack图像,必须从载玻片的不同聚焦层中获取图像(例如,每1μm深度具有相同的XY区域的十个不同图像)。然后,我们使用制造商或斐济提供的显微镜软件来创建z-stack或3D图像。结果将是一个单堆栈图像文件(例如,具有不同焦点的十个图像)。有几种客户特定的工具和软件解决方案,例如用于反卷积显微镜的开源软件。我们将使用斐济11 插件 DeconvolutionLab29 展示反卷积过程的输出(ImageJ12 的分布)。反卷积将有助于提高最终显微照片的分辨率(见图1B,C)。如需更多信息和说明,我们强烈建议阅读参考文献 13。
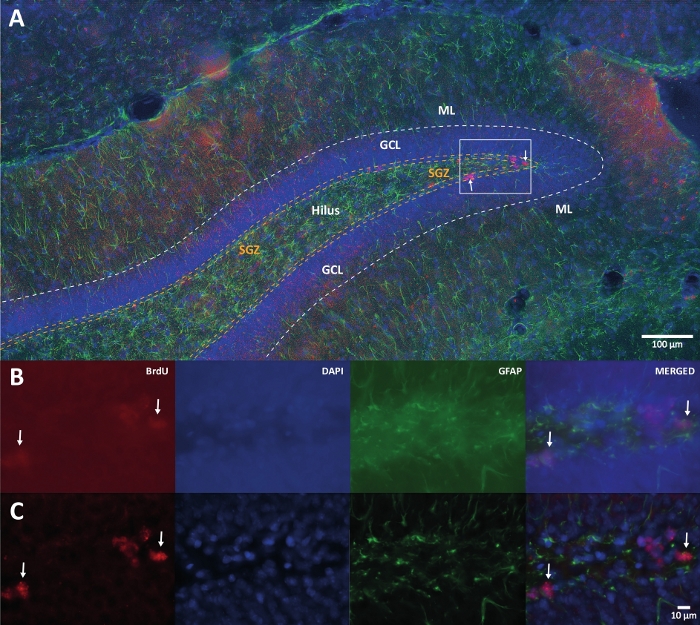
图 1:多个颜色通道的 3D 反卷积的代表性图像。 (A) 低倍率下的危险品。(B) 每个通道的原始 z 堆栈图像和合并图像。(C) 每个通道和合并图像的 3D 去卷积 z 堆栈图像。这个大脑来自大鼠,它是身体活动组的一部分。使用标记的链霉亲和素-生物素(LSAB)扩增方法。它显示了Cy3链霉亲和素偶联抗体,用于指示BrdU(红色),DAPI作为复染(蓝色)和神经胶质纤维酸性蛋白(GFAP)作为星形胶质细胞标志物(绿色)。ML = 分子层;GCL = 颗粒细胞层;SGZ = 亚粒度区域。 请点击此处查看此图的大图。
这项工作的目的是详细说明通过免疫染色获得积极和成功结果的步骤,并列出基于BrdU的研究中的常用步骤,而无需使用共聚焦显微镜。BrdU染色是一种需要几个步骤的技术,必须仔细遵循这些步骤才能获得成功的染色。标准化这些染色技术通常需要数月时间,并且需要大量时间和资源。我们预计本文可以通过减少时间和错误来为该领域的小组提供信息。
研究方案
所有程序均遵循美国国立卫生研究院实验动物护理和使用指南(NIH出版物第8023号,1978年修订)和墨西哥当地法律,以尽量减少使用的动物数量及其痛苦。伊比利亚美洲大学伦理委员会批准了在这项研究中使用动物的实验方案。
1. 试剂制备和设置
注意:除非另有说明,否则大多数溶液可以在使用前几天制备。
- 布杜解决方案
- 从-20°C冰箱中取出BrdU溶液,使其在室温(RT)下平衡。
- 根据大鼠的体重计算50mg / kg剂量所需的BrdU质量。计算 20 mg/mL 工作溶液所需的 0.9% 盐水溶液(0.9 g NaCl 在 100 mL 无菌 H2O 中)的体积。准备过量,每只大鼠每次注射至少0.5mL。
注意:给予实验动物的剂量应该是安全的,副作用最小,并且有效。据报道,与50 mg/kg剂量7相比,用100mg / kg BrdU染色的持续时间不会超过潜在的更高毒性。在大鼠7中,50和100mg / kg腹膜的BrdU标记细胞/ mm3的数量没有显着差异。最好注射小剂量以尽量减少动物的痛苦。 - 称出BrdU溶液并将其添加到锥形管中的盐溶液中并涡旋。
注意:在水浴中将盐溶液预热至45\u201250°C,体积大于1 mL。 - 将试管置于 50 °C 的水浴中 10\u201215 分钟,每 2\u20123 分钟涡旋一次直至完全溶解。用注射器过滤器过滤溶液以进行无菌注射。用锡箔覆盖管子,在室温下冷却并立即使用。
注意:BrdU溶液有毒且可能致癌。在通风橱中准备。BrdU溶液必须使用适当的防护设备(PPE)进行处理。建议在使用前立即准备溶液。然而,溶液在室温下稳定24小时。请避光。
- 为了在pH 7.4下制备1 L 0.1 M磷酸盐缓冲盐水(PBS),在恒定搅拌下将240mg磷酸二氢钾(KH 2 PO 4),1.44g磷酸二钠(Na 2 HPO4),200mg氯化钾(KCl)和8g氯化钠(NaCl)加入800mL双蒸水(ddH2O)中。将pH调节至7.4,并加入双蒸H2O,直至总体积为1L.在4°C下储存长达1周。
- 对于 100 mL PBS+,将 3% (3 mL) 正常马血清和 0.3% (300 μL) Triton X-100 添加到 0.1 M PBS (pH 7.4) 中。在 -20 °C 下以 20\u201250 mL 等分试样储存长达 3 个月。
注意:或者,可以使用 TBS 代替 PBS。任何其他不同于宿主抗体和实验组织的血清都是合适的。 - 对于 100 mL PBS++,将 10% (10 mL) 正常马血清和 0.3% (300 μL) Triton X-100 添加到 0.1 M PBS pH 7.4 中。在 -20 °C 下以 20\u201250 mL 等分试样储存长达 3 个月。
- 对于 1 L 冷冻保护剂溶液,混合 250 mL 乙二醇和 250 mL 甘油,不断搅拌直至混合。用PBS慢慢达到1升。用 4 级 (20\u201225 μm) 滤纸过滤。在4°C或室温下储存长达1年。
- 在0.1M PBS(PFA溶液)中制备4%多聚甲醛,如下所示。对于 1 L 溶液,在不断搅拌下将 40 g 多聚甲醛粉末缓慢加入 800 mL 的 60\u201265 °C 0.1 M PBS 中。搅拌至多聚甲醛完全溶解,同时控制温度(60\u201265°C)。如有必要,加入几滴1M NaOH以澄清溶液。当溶液达到室温时,用4级(20-25μm)滤纸过滤。
注意:多聚甲醛有毒,怀疑是致癌物,请在通风橱中准备。储存在4°C,最好在2天内使用。PFA即用型溶液已上市。 - 对于 pH 6 的 1 L 10 mM 柠檬酸钠缓冲液 (SCB),在恒定搅拌下将 1.204 g 柠檬酸钠(二水合物)和 1.134 g 柠檬酸加入 800 mL 双蒸 H2O 中。将pH调节至6.0,并添加ddH2O至1L.在4°C下储存长达6个月。
- 在不断搅拌下,将 8.25 mL 的 12 N HCl(浓缩储备溶液)缓慢加入 41.75 mL 的 ddH 2 O 中,制备 50 mL 的2N HCl。
注意:在通风橱中准备。溶液必须在使用前立即制备。
注意:2 N HCl将用于DNA变性,这是一个关键步骤。当BrdU被掺入DNA中时,HCl用于打开DNA键,允许BrdU抗体进入DNA内的BrdU。 - 制备内源性过氧化物酶阻断溶液如下。在恒定搅拌下将 2 mL 30% 过氧化氢与 98 mL ddH2O 混合,制备 100 mL 0.6% 过氧化氢。
注意:溶液必须在使用前立即制备。将其置于黑暗中,因为 H2O2 对光敏感。可以使用PBS或TBS代替水。 - 按照制造商的说明制备亲和素-生物素复合物(ABC)溶液。对于 0.1 M PBS 中的 5 mL ABC,加入 2 滴 (≈100 μL) 试剂 A 并混合,然后加入 2 滴 (≈100 μL) 试剂 B 并混合。
注意:使用前必须准备好溶液并使其滚筒滚动 20-30 分钟。 - 按照制造商的说明,使用试剂盒制备 DAB(二氨基联苯胺)过氧化物酶 (HRP) 底物。向 5 mL ddH2O 中加入 2 滴 (≈ 84 μL) 试剂 1 并混合,加入 4 滴 (≈ 100 μL) 试剂 2 并混合,然后加入 2 滴 (≈ 80 μL) 试剂 3 并混合。最后,如果需要,加入 2 滴 (≈ 80 μL) 试剂 4(镍)并混合。
注意:溶液必须在使用前立即制备。
注意:DAB有毒且可能致癌。必须小心处理,并根据每个机构的危险废物法规丢弃。要灭活DAB,请加入几滴漂白剂(次氯酸钠);溶液将变黑。 - 在 55\u201260 °C 下将 100 mg 醋酸甲酚紫和 250 μL 乙酸加入 80 mL ddH2O 中,制备 100 mL 甲酚紫溶液。 将体积调节至100mL,过滤,并在4°C下储存在深色容器中。
注意:鼓励用户在将甲酚紫溶液用于有价值的组织样品之前测试不同浓度的甲酚紫溶液。对于某些组织样品的复染,结果可能更暗,这可能会降低准确计数BrdU阳性细胞的能力。
2.胸苷类似物BrdU给药
- 通过固定下腹腔来约束实验动物(例如,体重350g的90日龄雄性Wistar大鼠)。
- 使用 23 G 针头和 1 mL 注射器腹膜内(ip)施用 BrdU 溶液 (50 mg/kg)。
注意:根据动物的体重调整注射量。成年大鼠使用 23\u201227 G 针头和 1\u20125 mL 注射器。成年大鼠最大可耐受腹膜内注射体积为10mL。可以使用不同的途径来管理BrdU溶液14。例如,腹膜内注射或通过饮用水口服给药。
3. 组织准备
注意:允许三个月大的老鼠随意进行体育活动(无尽的轮子)七天。在第6天,大鼠以12小时的间隔注射BrdU(步骤2)3次。在最后一次BrdU注射8小时后执行第3节中的步骤。
- 注射戊巴比妥(50mg / kg腹膜内),等待几分钟,直到动物被深度麻醉。
注意:在继续之前,请确保动物已完全麻醉。小心地捏住其中一条腿或尾巴。如果动物对刺激有反应,再等几分钟。如果动物对捏没有反应,请转到下一步。 - 通过切开胸骨下方的腹腔皮肤,拆开肋骨,切开横膈膜来暴露心脏。
- 经心灌注固定
- 将针插入左心室,并在右心房做一个小切口。使用泵或重力灌注(流速 5\u20127 mL/min)0.1 M PBS,直到排出全血,溶液变得透明。
- 使用泵或重力,用PFA溶液进行冷灌注(流速5\u20127 mL/min)以固定组织,直到尾部变硬。
注意:通常,一只 300 克的大鼠需要大约 100\u2012150 mL 的 PFA 溶液。组织固定是可选的。因此,可以提取大脑用于各种过程,以最大限度地减少实验中的动物使用。
- 解剖和固定后
- 将动物斩首,然后轻轻地从头骨中提取大脑。将大脑浸入含有PFA溶液(250mg大鼠~40mL)的锥形管中,在4°C下浸入1\u20122天。
注意:不要过度固定(超过48小时),因为这可能会由于抗原不可用而耗尽组织染色。 - 准备 100 mL 的 30% 蔗糖溶液,在不断搅拌下将 30 g 蔗糖加入 70 mL 的 0.1 M PBS 溶液中。将 0.1 M PBS 溶液加入 100 mL 中。将大脑浸入装有 30% 蔗糖溶液 (35 mL) 的锥形管中,在 4 °C 下浸入约 1-u20122 天,直到大脑沉入管底部。
- 将动物斩首,然后轻轻地从头骨中提取大脑。将大脑浸入含有PFA溶液(250mg大鼠~40mL)的锥形管中,在4°C下浸入1\u20122天。
- 切除冠状脑切片
注意:使用低温恒温切片机需要指导和培训。有关详细说明,请参阅参考文献 15。- 将整个大脑浸入-80°C的异戊烷中,并在-80°C下保持10分钟。将大脑置于低温恒温器切片板上的嵌入基质中。
注意:在某些条件下,在-80°C下快速冷冻大脑会导致骨折或组织损伤。用户应注意此问题。如果是这种情况,请使用-20°C异戊烷冷冻大脑。 - 使用低温恒温切片机(温度为-25至-20°C)切割40μm厚的冠状切片。按照 图2中的指南,将切片依次转移到带有冷冻保护溶液的24孔细胞培养板中。储存在-20°C直至使用,长达几个月。
注意:此后,在带有网状插入物的12孔板中以温和和连续的搅拌(10 rpm)处理40μm自由浮动系列切片中的所有组织。在适当的条件下,可以将大脑切片存储多年。
- 将整个大脑浸入-80°C的异戊烷中,并在-80°C下保持10分钟。将大脑置于低温恒温器切片板上的嵌入基质中。
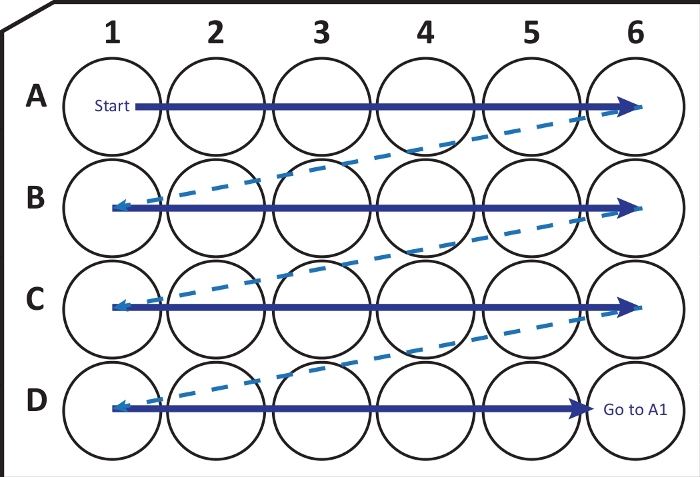
图 2:将切片机切片机的切片顺序转移到具有冷冻保护溶液的 24 孔细胞培养板中的示意图。 从A1孔开始,将下一个切片放入A行;A6 井后移动到下一行 B,依此类推。到达 D6 后,返回 A1 并继续行驶。这种安排允许对整个大脑区域进行第N个(例如,神经发生的第六个,相当于一列的内容)部分的定量。请点击此处查看此图的大图。
4. 免疫染色
注意:有关每种技术的优缺点的摘要,请参阅 表 1 。
- 使用过氧化物酶与DAB反应检测BrdU
注意:在第 1 天执行步骤 4.1.1 至 4.1.5。- 在室温下将切片从冷冻保护溶液转移到0.1 M PBS。用0.1M PBS冲洗三次,每次10分钟。
- 将切片在内源性过氧化物酶阻断溶液中孵育30分钟,以使内源性过氧化物酶失活。用0.1M PBS冲洗3次,每次10分钟。或者,进行抗原修复(见第5节)。将切片在37°C下用2N HCl孵育20分钟。 在0.1M硼酸盐缓冲液(8.5pH)中冲洗10分钟。冲洗3次,每次10分钟,用冰冷的0.1M PBS。
- 将切片在室温下用PBS ++(封闭溶液)孵育2小时。与抗BrdU一抗(小鼠宿主)在PBS +中浓度为1:250在4°C孵育过夜。
- 在第 2 天,用 0.1 M PBS 冲洗切片 3 次,每次 10 分钟。
- 在室温下与 PBS+ 中的 1:250 HRP 偶联二抗(抗小鼠)孵育 2\u20124 小时。用0.1M PBS冲洗3次,每次10分钟。
- 将切片转移到DAB过氧化物酶(HRP)底物溶液中,孵育2-10分钟。当切片变成深灰色时,用放大镜或显微镜观察组织。如果存在阳性细胞,请用自来水冲洗3次(每次15分钟)(以减少背景)。用0.1M PBS洗涤3次,每次10分钟。
- 使用软刷小心地将切片安装在糊化载玻片上,在室温下风干过夜。复染(见第7.1节),添加永久性安装介质并放置盖玻片。在4°C下储存长达6个月。
- 使用过氧化物酶与亲和素-生物素-过氧化物酶复合物反应检测BrdU
注意:在第 1 天执行步骤 4.2.1 至 4.2.5。- 将切片从冷冻保护溶液转移到0.1 M PBS中以达到室温。用0.1M PBS冲洗3次,每次10分钟。
- 用内源性过氧化物酶阻断溶液孵育30分钟以灭活内源性过氧化物酶。在0.1M PBS中冲洗3次,每次10分钟。或者,进行抗原修复(见第5节)。
- 在37°C下用2N HCl孵育20分钟。 在0.1M硼酸盐缓冲液(pH 8.5)中冲洗10分钟。用冰冷的0.1M PBS洗涤3次,每次10分钟。
- 在PBS ++(封闭溶液)中在室温下孵育2小时。
- 与抗BrdU一抗(小鼠宿主)在PBS+中以1:250在4°C下孵育过夜。
- 在第2天,用0.1M PBS冲洗3次,每次10分钟。
- 在室温下与PBS+中的1:250生物素化二抗(抗小鼠)孵育2\u20124小时。用0.1M PBS冲洗3次,每次10分钟。
- 在室温下在ABC溶液中孵育1小时。用0.1M PBS冲洗3次,每次10分钟。
- 将切片转移到 DAB 过氧化物酶 (HRP) 底物溶液中,孵育 2\u201210 分钟。当切片变成深灰色时,用放大镜或显微镜观察组织。如果存在阳性细胞,则用自来水冲洗3次(每次15分钟)(以减少背景),然后用0.1M PBS洗涤3次,每次10分钟。
注意:溶液必须在使用前立即制备。应注意避免脑切片由于组织中不规则的黑斑而相互粘连。 - 使用软刷小心地将切片安装在糊化载玻片上,然后在室温下风干过夜。
- 如果需要,复染(见步骤7.1),添加永久性安装介质并放置盖玻片。在4°C下储存长达6个月。
- 使用标记的链霉亲和素-生物素 (LSAB) 扩增通过免疫荧光检测 BrdU
注意:在第 1 天执行步骤 4.3.1 至 4.3.4。- 在室温下将切片从冷冻保护溶液转移到0.1 M PBS。用0.1M PBS冲洗3次,每次10分钟。或者,进行抗原修复(见第5节)。
- 在37°C下在2N HCl中孵育20分钟。 在0.1M硼酸盐缓冲液(8.5pH)中冲洗10分钟。在冰冷的0.1M PBS中冲洗3次,每次10分钟。
- 在PBS ++(封闭溶液)中在室温下孵育2小时。在PBS +中与1:250抗BrdU一抗(小鼠宿主)在4°C孵育过夜。
- 在第2天,用0.1M PBS冲洗3次,每次10分钟。
- 在室温下与PBS+中的1:250生物素化二抗(抗小鼠)孵育2\u20124小时。用0.1M PBS冲洗3次,每次10分钟。在室温下与 1:250 荧光染料偶联链霉亲和素 (Cy3) 在 PBS(不使用血清)中孵育 1\u20122 小时。用0.1M PBS冲洗3次,每次10分钟。
注意:血清可能含有生物素,不应添加到稀释剂中。相反,请使用含有 0.3% 的 Triton X-100 的 PBS。 - 使用软刷小心地将切片安装在糊化玻片上,在室温下风干过夜,或立即使用适当的封片剂进行封片。复染(见步骤7.2),添加永久性安装介质并放置盖玻片。在4°C下储存长达6个月。
- 通过间接免疫荧光检测BrdU
注意:在第 1 天执行步骤 4.4.1 至 4.4.4。- 将切片从冷冻保护溶液转移到0.1M PBS中,直到达到室温。用0.1M PBS冲洗3次,每次10分钟。如果需要,进行抗原修复(可选,见第5节)。
- 在37°C下在2N HCl中孵育20分钟。 在0.1M硼酸盐缓冲液(8.5pH)中冲洗10分钟。用冰冷的0.1M PBS冲洗3次,每次10分钟。用PBS ++(封闭溶液)在室温下孵育2小时。在PBS +中与1:250抗BrdU一抗(小鼠宿主)在4°C孵育过夜。
- 在第2天,用0.1M PBS冲洗3次,每次10分钟。
- 在室温下与 PBS+ 中的 1:250 荧光染料偶联二抗(抗小鼠)孵育 2\u20124 小时。用0.1M PBS冲洗3次,每次10分钟。
- 使用软刷小心地将切片安装在糊化玻片上,在室温下风干过夜,或立即使用适当的封片剂进行封片。复染(见步骤7.2),添加永久性安装介质并放置盖玻片。在4°C下储存长达6个月。
5. 抗原修复(可选)
注意:抗原修复是一个可选步骤,旨在纠正由固定引起的抗原性丧失,固定会改变许多抗原的三级和四级结构,使其无法被抗体检测到。此步骤可以添加到原始协议中。
- 在微波或水浴中,将10 mM柠檬酸钠缓冲液(SCB)pH 6溶液预热至90\u201295°C(根据海拔高度,溶液在此温度附近开始沸腾)。用预热的 SCB 填充 80% 的 50 mL 锥形管 (40 mL)。用SCB将切片转移到网状嵌件中。用带有 18\u201220 G 针头制成的孔的螺帽盖住管子。
- 将切片在 SCB 中以最小功率水平在 80\u201285 °C 下交替加热循环。如果需要,用 SCB 重新填充锥形管。立即将切片与网状插入物一起转移到冰冷的0.1M PBS中,冲洗3次,每次10分钟。
6. 多重免疫染色(可选)
注意:有关此步骤背后的基本原理,请参阅简介部分。
- 同时进行多重免疫染色
- 在 PBS+ 中制备含有靶标一抗(例如小鼠抗 BrdU 和兔抗 -GFAP)的鸡尾酒。对所使用的每种一抗使用不同的宿主。在4°C孵育过夜。 对每个协议继续执行相同的后续步骤。
- 为每个方案的相同稀释剂溶液中为所使用的每种一抗(例如,山羊抗小鼠 FITC、山羊抗兔 TRITC)准备具有相应二抗的鸡尾酒。对每个协议继续执行相同的后续步骤。理想情况下,使用来自相同宿主的二抗以避免交叉反应。
- 序贯多重免疫染色。
- 遵循第一个抗体靶标(例如,小鼠抗BrdU)的方案,并在安装切片之前停止。用PBS ++(封闭溶液)在室温下孵育2小时。
- 将第二种一抗(例如兔抗-GFAP)在PBS +中在4°C孵育过夜。 按照每个方案的后续步骤操作,包括孵育第二种二抗(例如,山羊抗兔TRITC)。继续每个协议的后续步骤,直到最后。
7. 复染(可选)
- 对于使用过氧化物酶反应的方案,将甲酚紫溶液预热至60°C。 用ddH2O水合载玻片1分钟。将载玻片在热甲酚紫溶液中孵育 5\u201220 分钟。
- 用ddH2O冲洗载玻片1分钟。用 70%、80%、90% 和 100% 乙醇冲洗载玻片,每次 1\u20123 分钟。用二甲苯冲洗载玻片 1-u20123 分钟。
- 加入永久性疏水性封片剂并放置盖玻片。
注意:在4°C下储存长达6个月。可以使用含有PVA(聚乙烯醇)-DABCO的自制封片剂。
- 对于使用免疫荧光的方案,添加少量 (25\u201250 μL) 含有 DAPI、碘化丙啶或类似物质的亲水封片剂。用指甲油或塑料密封剂密封周边。在4°C下储存长达6个月。
8. 成像和分析
注:显微镜设置规格见 表2 。通常,使用过氧化物酶反应染色切片(更便宜的方法)对染色的新细胞进行计数,但也可以使用免疫荧光进行。
- 为了量化细胞,首先,使用4倍放大镜正确识别齿状回(有关DG解剖细节的进一步说明,请参阅Amaral等人16)。
- 在齿状回的颗粒细胞层中搜索用BrdU标记的细胞核(使用40倍放大镜)。沿 z 轴详尽地执行单元格搜索,因为新单元格可以分布在不同的层中(请参阅 视频 1)。
- 选择一个间隔部分,用于在整个齿状回中进行细胞搜索(例如,每 6 个组织切片,相当于每 240 μm)。
- 计数所有BrdU阳性细胞。标记细胞核的形态可以根据细胞掺入的BrdU量而改变(参见 图3 作为指导)。在z轴上缓慢移动以量化集成集群的所有几个原子核(见 视频2)。
- 将计数细胞的总数与选择的间隔部分(例如,6)相乘,以估计BrdU标记的新细胞的总数。
- 理想情况下,在常规实验中,每只动物至少计算十个部分,每组至少计算五只动物。
- 图像反卷积(可选)
注意:有关此步骤的重要信息,请参阅简介部分。此过程需要单色图像(灰度)。将彩色图像转换为灰度。如果图像是 RGB 合成,请先拆分通道并将它们合并为单个图像(非合成),然后转换为 8 位灰度。- 从显微照片创建 z 堆栈文件。
- 创建一个点扩散函数 (PSF) 文件,从选项插件菜单中打开衍射 PSF 3D 插件 (https://imagej.net/Diffraction_PSF_3D)。填写所有必需的数据(见 表2)。按 确定 并保存文件。
- 从选项插件菜单 (http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/) 中打开反卷积实验室9 插件。将匹配的 z 堆栈图像和 PDF 文件拖动到相应的窗口插槽。
- 选择反卷积算法(例如,理查森-露西)和迭代次数(例如,20)。按 RUN。
- 将去卷积的图像合并到单个 z 堆栈图像中,从顶部的图像菜单中选择堆栈。然后单击"Z 项目"。从投影类型下拉菜单中选择最大强度,按 OK 并保存文件。
- 使用在上述步骤中创建的单个 z 堆栈图像文件创建 RGB 图像,并使用所需的伪彩色从顶部的"图像"菜单中选择"颜色"。然后点击合并频道。从下拉菜单中将相应的图像设置为所需的颜色通道。取消选中"创建复合"框,按"确定"并保存文件(请参阅图 4)。
- 如果有多个通道图像,请重复步骤 8.2.1-2.5。按照步骤 8.2.6 创建一个 RGB 图像文件,打开至少两个图像文件并为每个图像文件选择不同的颜色通道(请参阅 图 4)。
结果
上述方法用于量化自愿体力活动后成年大鼠海马体中的新生细胞,与没有任何额外体力活动的对照组相比。我们使用产后大鼠海马体作为阳性对照。3个月大的雄性大鼠在自愿体育活动方案(无尽轮)下7天。在第6天,大鼠注射BrdU(第2节),每12小时注射一次,直到三次完全注射。为了完成三次细胞周期分裂,在最后一次BrdU注射后8小时经心灌注动物(第3节)。对三个月大的大鼠使用相同的程序,这些大鼠没有进行身体活动以用作比较对照。作为阳性对照,如上文第2节所述,将一天大的大鼠幼崽(出生后第1天)注射一次BrdU。注射后一天(出生后第2天),幼崽被安乐死,它们的头部浸入PFA溶液中,如步骤3.4中所述。成年大鼠深度麻醉(步骤3.1),经心灌注,如步骤3.2所述。大脑被解剖和后固定(步骤3.4)。将大脑切成40μm冠状切片(步骤3.5)。处理切片以进行BrdU免疫组织化学,如步骤4中所述。
我们使用辣根过氧化物酶与DAB IHC反应进行染色(步骤4.1)并计数DG中的BrdU阳性细胞。 图5 显示了带有BrdU标记细胞的DG切片。 图5C,D 显示了在较高放大倍率下DG部分的代表性部分。标记的细胞显示出强烈的深色染色,用箭头标记。插图显示了实验组和对照组中标记细胞的平均数量(计数的阳性细胞乘以6,如步骤8.1中所述)。学生的t检验揭示了BrdU阳性细胞数量之间的显著差异(t(10) = 2.704,p = 0.0222)。未进行体力活动的对照组显示2,040±314个细胞(n = 6只大鼠)。相比之下,身体活动组平均显示3,606±486(n = 6大鼠)BrdU阳性细胞。如观察,体力活动暴露会增加BrdU阳性细胞。因此,这些结果与其他报告的结果一致,这些结果表明身体活动增加了成年齿状回17中的细胞增殖。
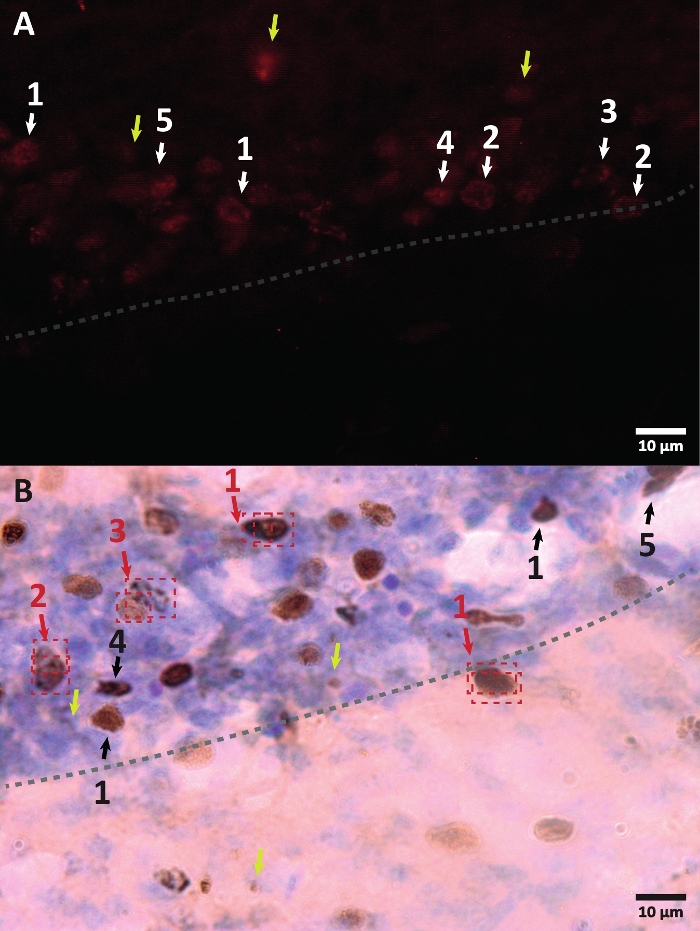
图3:BrdU标记细胞核不同形态的示例。 BrdU是一种标记细胞核的DNA合成标记物。在海马区,BrdU阳性细胞核呈半椭圆形,位于齿状回亚颗粒区。由于BrdU是通过竞争掺入的,因此每个细胞的掺入量将具有变化,稍后将反映在细胞核的可视化方式中。(A)免疫荧光图像。(B)给出了使用过氧化物酶反应的图像,无需额外的扩增方法。黄色箭头显示伪影和非特异性信号。黑色或白色箭头显示 BrdU+ 细胞。1 – 全锉形核,半椭圆形核高度着色。2 – 带点的细胞核,标记了细胞核的边界并在几个点内。3 – 点很少的细胞核,细胞核的边界被标记并且内部有少量点。4 – 小细胞核是可能处于不同分化阶段但仍然是生态位一部分的细胞。5 – 簇是分裂的前体细胞,因此可以观察到几个细胞在浓缩组中。在这些组中,计数必须特别小心,以避免错误标记阳性细胞。红色箭头显示分裂下的细胞核,可能会被混淆为单个细胞。每个单元格都包含在一个盒子中,并且可以在 Z 轴平面中实时区分。 请点击此处查看此图的大图。
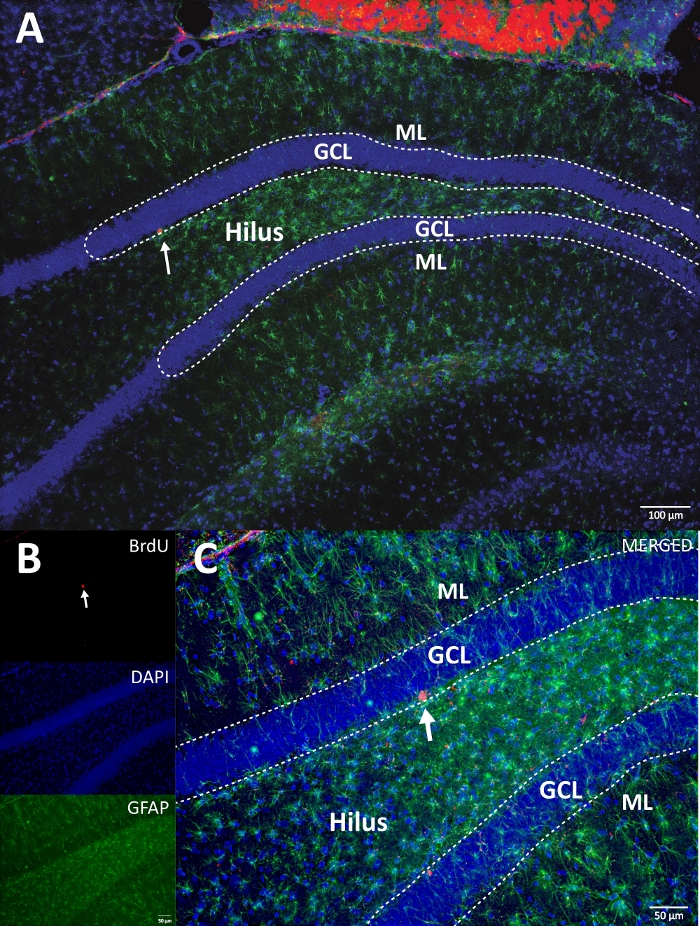
图 4:单通道和合并通道的代表性 RGB 图像。 上图显示原始 z 堆栈图像,下图显示 3D 去卷积 z 堆栈图像。(A) 危险品的低放大倍率。(B) 每个通道的 RGB 图像,以及 (C) RGB 合并图像。这是对照组的大脑。免疫荧光在没有额外扩增方法的情况下使用。BrdU(红色),DAPI作为复染(蓝色)和GFAP(胶质原纤维酸性蛋白)作为星形胶质细胞标志物(绿色)。ML = 分子层;GCL = 颗粒细胞层;SGZ = 亚粒度区域。 请点击此处查看此图的大图。
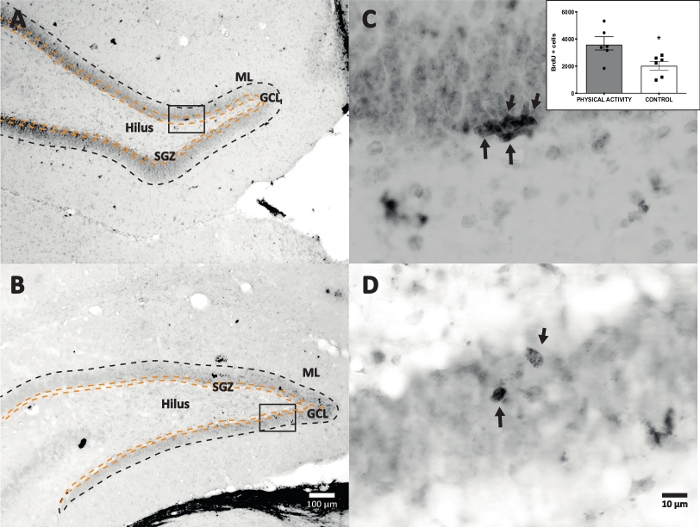
图5:具有每个实验组的BrdU标记细胞(深色)的代表性DG切片。 过氧化物酶反应采用亲和素-生物素-过氧化物酶复合物扩增法。(一、二)显示DG的低放大倍率,(C,D)显示较高放大倍率下的盒子区域。图A和图C是来自身体活动组的组织,图B和D来自对照组。插图显示了身体活动和对照组中标记细胞的平均数量(计数的阳性细胞乘以6,如步骤8.1中所述)。ML = 分子层;GCL = 颗粒细胞层;SGZ = 亚粒度区域;箭头表示 BrdU+ 细胞。 请点击此处查看此图的大图。
视频1:视频显示了沿z轴分布在不同层中的阳性细胞的不同焦点。请点击此处下载此视频。
视频2:视频显示了沿z轴分布在不同层中的阳性细胞簇的不同焦点。 在z轴上缓慢移动以量化整合集群的所有几个原子核。 请点击此处下载此视频。
| 显微镜类型: | 落射荧光显微镜 奥林巴斯BX53 | ||||
| 光源: | 高压 130 W 汞弧灯 | ||||
| 采集软件: | 赛尔森标准 | ||||
| 过滤器集: | 货号 | 激励范围 | 二色镜 | 抑制范围 | |
| U-福 | 340 - 490 纳米 | 410 纳米 | 420 纳米 | ||
| U-FBW | 460 - 495 纳米 | 505 纳米 | 510 纳米 | ||
| U-FGW | 530 - 550 纳米 | 570 纳米 | 575 纳米 | ||
| 照相机: | 型: | CCD 摄像机 UC50 | |||
| 光谱范围: | 290 – 1000 nm | ||||
| CCD芯片尺寸: | 2/3 英寸,2588(宽 *7)x 1960(高 *8)像素 | ||||
| 像素大小: | 3.4 X 3.4 微米 | ||||
| 荧光染料: | 名字 | 激发波长(纳米) | 发射 *3 波长 (nm) | 发光颜色 | |
| 4,6-二脒基-2-苯基吲哚盐酸盐 | 345 | 455 | 蓝 | ||
| 四甲基罗丹明-异甲状腺氰酸酯 | 541 | 572 | 红 | ||
| 异硫氰酸荧光素 | 494 | 519 | 绿 | ||
| 赛3 | 552 | 565 | 红 | ||
| 安装介质和浸油: | 名字 | 介质折射率 *1 | |||
| 空气(载玻片和镜头之间没有空气) | 1.00029 | ||||
| 带DAPI的抗淬灭安装介质 | 1.45 | ||||
| 永久安装介质 | 1.519 | ||||
| 低自发荧光浸油(MOIL-30 F 型) | 1.518 | ||||
| 放大镜(平面萤石) | 放大 | 数值孔径(NA)*2 | 分辨率(微米) | 图像像素间距(纳米)*5 | 切片间距Z轴(nm)*6 |
| 4 倍 | 0.13 | 2.12 | 850 | 3000 | |
| 10 倍 | 0.3 | 0.92 | 340 | 3000 | |
| 20 倍 | 0.5 | 0.55 | 27秒 | 2000 | |
| 40 倍 | 0.75 | 0.37 | 85 | 1000 | |
| 100倍 | 1.3 | 0.21 | 34 | 1000 | |
表2:显微镜设置规格和点扩散功能(PSF)文件创建要求。 衍射PSF 3D插件窗口中有11个插槽来创建PSF文件。每个插槽描述如下:*1 - 介质折射率:载玻片和镜头之间介质的折射率(例如,空气 = 1.00029)。*2 - 数值孔径:所用镜头的数值孔径(当使用不同的浸没介质并分配镜头时,必须进行校正)。*3 - 波长:荧光染料最大发射波长(nm)。*4 - 纵向球面像差:0.00。*5 - 图像像素间距:CCD 像素尺寸 (nm)/放大倍率(例如,3.4 μm 和 100X 镜头,3400/100 = 34 nm)。*6 - 图像Z轴之间的距离。*7 - 宽度:输入要反卷积的图像的宽度(以像素为单位)。*8 - 高度:输入要反卷积的图像的高度(以像素为单位)。*9 - 深度、切片:z 堆栈中的图像数量。*10 - 归一化:像素值的总和 = 1。*11 - 标题:PSF 文件的所需名称。该文件应与给定的唯一 z 堆栈图像匹配。
讨论
成人神经发生是一个最常发生在成人神经前体细胞生态位中的过程,这些细胞有可能在其整个生命周期中产生新的神经元。溴脱氧尿苷(BrdU)标记广泛用于免疫学,以表征成人大脑中新生成的细胞数量。BrdU将主要掺入离散大脑区域(神经源性区域)的细胞中。这些细胞位于脑室下区(SVZ),即海马体的齿状回,在肺门和颗粒细胞之间,称为亚颗粒区(SGZ)1,2,18。此外,有不同的大脑区域,其特征是成年期的增殖能力较低,包括下丘脑、纹状体、新皮层和杏仁核19。如前所述,BrdU染色是成人神经发生研究检测细胞增殖的常用方法。然而,使用BrdU作为标记具有局限性和陷阱。第一个是BrdU是一种细胞周期标记。因此,必须进行双重或三重染色以识别细胞命运,并包括细胞标记物以检测标记细胞的特定发育阶段。关于BrdU的另一个担忧是,它是一种有毒和诱变的溶液,可以改变DNA稳定性,可能会改变细胞功能和细胞周期。在决定遵循给药方案和给药剂量(50\u2012600 mg/kg)时,应考虑先前的信息。另一个关键特征是BrdU是DNA合成标记,而不是细胞增殖标记14。因此,将细胞增殖与其他事件(如DNA修复,流产细胞周期再入和基因复制)区分开来是相关的。研究人员必须遵循适当的控制措施,以确保BrdU的适当使用。有关这些问题和局限性的更详细讨论,我们建议回顾陶平的工作14。免疫组织化学方案的标准化过程可能缓慢且具有挑战性。在这项工作中,我们介绍了管理成功的IHC协议的所有一般步骤。但是,我们建议每个研究小组提前测试和评估组织、抗体和条件。对于每种测试的抗体和组织,必须使用至少三种不同水平的孵育、洗涤步骤和强度进行测试和评估。我们还建议研究人员审查其他协议,以便能够选择满足特定需求和要求的最佳协议20,21,22,23,24,25。
如前所述,该程序涉及科学文章中常用和提及的几个步骤和方法论考虑因素,稍后将讨论。我们建议研究人员在技术、预算、设备、设置和主要研究目标方面仔细正确地选择抗体。抗体必须使用稍后将在实验中测试的相同类型的组织进行测试。我们还建议使用针对相同目的(IHC)测试的抗体(即,不仅仅是蛋白质印迹或流式细胞术技术)来测试其与固定技术的相容性。可以使用不同的途径进行BrdU染色,例如腹膜内注射,腹膜内输注,口服摄入或心室内输注(有关每种技术的更详细说明,请参阅参考文献26)。如果选择腹膜内注射,请确保将BrdU施用到腹膜腔中,避开肠道区域。由于肠道有几个重复的细胞,可以在BrdU到达大脑之前耗尽BrdU,这将影响标记细胞的数量。获得薄切片至关重要,因为它们可以更好地渗透溶液。按照Kempermann等人提出的立体学程序,将40μm厚的冠状切片沿尾部切割并转移到24孔细胞培养板中。免疫组织化学可以用安装在载玻片上的组织或作为自由浮动部分进行。由于BrdU位于细胞核深处,因此它允许溶液渗透到自由浮动部分,从而提供更好的结果并更好地进入感兴趣的区域。重要的是打开DNA键(DNA变性)以允许一级抗BrdU抗体进入。在这项工作中,我们使用HCI孵育进行了这些特定程序。另一方面,阻断非特异性表位的过程允许更准确地识别细胞信号。
良好的膜透化性使抗体能够正确穿透感兴趣的区域。将Triton X-100等透化器添加到PBS++和PBS+溶液中可改善膜透化。PBS和Tris缓冲盐水(TBS)试剂都可以用于该方案。在预算方面,TBS可能比PBS便宜。然而,PBS 可能会干扰抗磷酸盐抗体并抑制碱性磷酸酶偶联抗体,因此如果靶标被磷酸化(即磷酸化)翻译后修饰,请避免使用 PBS。我们使用PBS进行这项工作,我们发现纸巾洗涤步骤给出了更具体的信号。我们还建议研究人员使用TBS或PBS进行至少三个洗涤周期。解决方案必须新鲜准备。抗原修复(AR)是一种旨在减少由改变三级和四级抗原结构的固定引起的抗原性丧失的方法。这种减少使得抗原无法被抗体检测到28,29。本协议中使用的热诱导表位修复(HIER)试图通过高温或强碱性水解(使用其他缓冲溶液如EDTA pH 8.5或Tris pH 9.5)逆转甲醛和蛋白质之间的化学反应。必须使用不同的AR方案测试新抗体,以比较结果并为该方案选择最佳抗体。最后一步在常规协议中可能是可选的;然而,我们用抗原修复方案处理组织,为该方案提供更好的结果。
考虑到初级染色颜色和用于使非染色结构可见并避免从免疫反应中掩盖主要染色颜色的方法,选择正确的最终对比颜色和复染技术至关重要。对于荧光显微镜,DAPI(4',6-二脒基-2-苯基吲哚)是一种非常常用的核和染色体复染剂,在与 DNA 的 AT 区域结合时发出蓝色荧光(吸收:360 nm,发射:460 nm)。提供含DAPI的封片剂,易于使用;这为图像采集提供了出色的信号保留。对于过氧化物反应,IHC有不同的选择,如甲酚紫、苏木精、中性红或甲基绿染色。对于多种免疫染色技术,选择与用于避免交叉反应的固定技术的兼容抗体至关重要30。当单次染色的问题和并发症得到解决时,根据需要进行另一次染色。控制二抗之间的非特异性结合至关重要。这可以通过使用在一抗的相同宿主物种中产生的二抗之前使一抗饱和来完成。例如,当使用兔中产生的抗小鼠和在山羊中产生的抗兔二抗时,必须在使用在山羊抗体中产生的抗兔抗体之前使用抗小鼠抗体。当顺序方法完全占主导地位时,可以启动同步免疫染色过程。在这种方法中,必须适当选择二抗。理想情况下,所有这些抗体必须来自同一宿主动物,以避免交叉反应。我们建议运行阳性对照,以确认染色方法在出生后海马组织中准确有效(该年龄左右有大量神经发生)。如果阳性对照组织显示染色问题,请回顾并检查该过程,进行校正和调整,然后重复直到产生良好的染色。然后,运行阴性对照,通过省略或用正常血清(与一抗相同的物种)替换特定的一抗来测试抗体是否正常工作。如引言中所述,图像反卷积是一种强大的工具,在没有共聚焦显微镜时提供了一种替代方案。它可以将图像反卷积应用于使用透射光明场、宽场荧光和共聚焦荧光显微镜获得的所有图像。图像反卷积的最终目的是重建采集系统劣化的原始信号10。
综上所述,通过胸苷类似物BrdU的免疫检测可视化的新生成细胞的鉴定是一项复杂但功能强大的技术。这项工作试图帮助科学家,特别是在成人海马神经发生领域,更准确地量化新细胞。我们希望这一努力对科学界有所帮助,并使通过免疫组织化学技术微调细胞增殖研究变得更加容易。
披露声明
作者没有什么可透露的。
致谢
我们要感谢米格尔·布尔戈斯先生和古斯塔沃·拉戈先生提供技术援助。我们还要感谢Clorinda Arias博士,Karla Hernandez博士和Oscar Galicia博士在提供试剂和材料方面的友好支持。我们还感谢墨西哥伊比利亚美洲大学调查和波斯格拉多司为开展这项工作提供资金,并支付录像制作费用。
材料
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
参考文献
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- . 2D and 3D Fluorescence Deconvolution Manual Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016)
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667 (2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551 (2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166 (2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。