Method Article
Immunhistochemische Techniken zur Analyse der zellulären Proliferation und Neurogenese bei Ratten unter Verwendung des Thymidin-Analogons BrdU
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In diesem Artikel werden vier der gebräuchlichsten Techniken zur Visualisierung von BrdU-positiven Zellen vorgestellt, um die adulte Neurogenese bei Ratten zu messen. Diese Arbeit umfasst Anweisungen für die Reagenzienvorbereitung, die Verabreichung von Thymidinanalogonen, die transkardiale Perfusion, die Gewebepräparation, die immunhistochemische Reaktion der Peroxidase, die Immunfluoreszenz, die Signalverstärkung, die Gegenfärbung, die mikroskopische Bildgebung und die Zellanalyse.
Zusammenfassung
Eines der wichtigsten Dinge auf dem Gebiet der adulten Hippocampus-Neurogenese (AHN) ist die Identifizierung der neu erzeugten Zellen. Der Immunnachweis von Thymidin-Analoga (z. B. 5-Brom-2'-Desoxyuridin (BrdU)) ist eine Standardtechnik zur Visualisierung dieser neu erzeugten Zellen. Daher wird BrdU in der Regel bei kleinen Tieren intraperitoneal injiziert, so dass das Thymidin-Analogon während der DNA-Synthese in sich teilende Zellen eingebaut wird. Der Nachweis erfolgt durch immunhistochemische Analyse von Hirnschnitten. Jede Forschungsgruppe, die diese Technik verwendet hat, kann verstehen, dass es besonderer Aufmerksamkeit für kleinste Details bedarf, um eine erfolgreiche Färbung zu erzielen. Ein wichtiger Schritt ist zum Beispiel die DNA-Denaturierung mit HCl, die es ermöglicht, in den Zellkern zu gelangen, um ihn zu färben. In den vorliegenden wissenschaftlichen Berichten werden jedoch nur sehr wenige solcher Schritte im Detail beschrieben. Daher ist die Standardisierung der Technik für neue Labore eine Herausforderung, da es mehrere Monate dauern kann, bis positive und erfolgreiche Ergebnisse erzielt werden. Der Zweck dieser Arbeit ist es, die Schritte zur Erzielung positiver und erfolgreicher Ergebnisse der Immunfärbungstechnik bei der Arbeit mit dem Thymidin-Analogon BrdU im Detail zu beschreiben und auszuarbeiten. Das Protokoll umfasst die Reagenzvorbereitung und -einrichtung, die Verabreichung von Thymidin-Analogon in einem Nagetier, die transkardiale Perfusion, die Gewebevorbereitung, die immunhistochemische Peroxidase-Reaktion, die Verwendung des Avidin-Biotin-Komplexes, die Immunfluoreszenz, die Gegenfärbung, die mikroskopische Bildgebung und die Zellanalyse.
Einleitung
Die Idee, dass im erwachsenen menschlichen Gehirn während der gesamten Lebensspanne neue Neuronen gebildet werden, fasziniert die wissenschaftliche Gemeinschaft seit Jahrzehnten. Die Erkenntnis, dass das Gehirn im Laufe seines Lebens neue Neuronen erzeugt, wurde durch die Detektion von Zellen unter Division 1,2 gewonnen. Der Nachweis von neu gebildeten Neuronen im erwachsenen Gehirn wurde zunächst durch intrakranielle Injektion von tritiiertem Thymidin (Thymidin-H3) bei Ratten und durch den Nachweis von Zellen im Zellzyklus durch Autoradiogrammeidentifiziert 1,2. Es wurde über die Zellteilung von Gliazellen und das Vorhandensein von Neuroblasten berichtet, was die ersten vielversprechenden Daten zur postnatalen Neurogenesedarstellte 1. Nichtsdestotrotz implizierte die Verwendung und der Nachweis von Thymidin-H3 die Verwendung von Radioaktivität, die für die Menschen, die damit umgehen, schädlich sein kann. Der erste Versuch, die Eignung der BrdU-Immunhistochemie bei der Untersuchung der Proliferation, Migration und des Ursprungs von Zellen im Nervensystem zu untersuchen, erschien 1988 von Miller und Nowakowski3. Im Jahr 1998 zeigte eine von Eriksson und Kollegen veröffentlichte Arbeit, dass neue Neuronen postmortal im menschlichen erwachsenen Gehirn von Patienten visualisiert wurden, denen 5-Bromo-2'-Desoxyuridin (BrdU)4 injiziert wurde. Diese Patienten erhielten die BrdU-Injektion (250 mg intravenös), um das Wachstum von Tumoren zu markieren4. Diese Technik wurde in Tiermodelle übernommen. Die Einführung dieser Methoden markierte einen Meilenstein für das Feld, da sie den Nachweis neu erzeugter Zellen ohne den Einsatz radioaktiver Verbindungen ermöglichten. Dieses Verfahren wurde zum Goldstandard, um die Zellproliferation in erwachsenen Gehirnnischen zu messen, um weitere Forschungen auf diesem Gebiet zu fördern.
Die Einschränkung der Thymidin-Analogtechnik besteht darin, dass sie die Bestimmung der zellulären Identität für die neu erzeugten Zellen nicht erlaubt. Die Immunhistochemie ermöglicht es uns jedoch, eine Doppel- oder Dreifachmarkierungstechnik derselben Zelle durchzuführen, die das zelluläre Schicksal der neu erzeugten Zellen und sogar ihre Reifungsstadien validiert, was zu einer weiteren Evolution des Feldes führt. Diese Methode wurde charakterisiert, um neu erzeugte Zellen in Glia, undifferenzierte Neuronen oder eine voll ausgereifte granulare Zelle zu differenzieren und sogar zu bestimmen, ob sie aktiv an der Schaltung beteiligt sind. Ein weiterer Durchbruch auf diesem Gebiet war die Verwendung transgener Modelle zur Identifizierung undifferenzierter Zellen unter der Domäne von Nestin. Die Nestin-GFP-transgenen Mäuse exprimieren ein verstärktes grün fluoreszierendes Protein (GFP), das unter der Kontrolle des Nestin-Promotors steht. Nestin ist ein intermediäres Filament, das durch Vorläuferzellengekennzeichnet ist 5. Die transgenen Nestin-GFP-Mäuse erlaubten es, frühe Entwicklungsschritte zu etablieren, die an der Neurogenese beteiligt sind6. Eine wesentliche Einschränkung besteht jedoch darin, eine Nestin-GFP-transgene Mäusekolonie unter besonderen Bedingungen in einer Laboreinrichtung halten zu können, die für einige wissenschaftliche Gruppen, insbesondere aus Entwicklungsländern, kostengünstig ist.
Die oben genannten Techniken haben Vor- und Nachteile. Die Identifizierung proliferierender Zellen durch Immunhistochemie (IHC) und die Möglichkeit, eine Doppel- oder Dreifachmarkierungstechnik durch Immunfluoreszenz durchzuführen, um das Zellreifungsstadium oder das Zellschicksal zu identifizieren, stellt jedoch den bisher praktikabelsten Weg zur Messung der adulten Neurogenese dar. Der Identifizierungsprozess mit Hilfe der Immunhistochemie besteht aus der Markierung von Proteinen, Proteindomänen oder Nukleotiden mit einem spezifischen Antikörper, der ihre Erkennung ermöglicht, der als primärer Antikörper bezeichnet wird. Letzteres wird durch den sekundären Antikörper erkannt, der mit einem Chromogen (z. B. Meerrettichperoxidase) oder einem Fluorochrom (z. B. FITC) markiert ist, das mit dem sekundären Antikörper gekoppelt ist. Mikroskope können sowohl Chromogene als auch Fluorochrome Signale erkennen. Mit Hilfe von IHC ist es möglich, Membranproteine, Zytoskelettproteine oder Kernkomponenten wie BrdU zu identifizieren. Auf der anderen Seite kann BrdU im Zellkern gefunden werden, da es während der S-Phase durch Konkurrenz in die DNA eingebaut wird. Ein entscheidender Schritt ist daher die DNA-Denaturierung mit HCl, die DNA-Bindungen öffnet, um dem BrdU-Antikörper den Zugang zu BrdU innerhalb der DNA zu ermöglichen. Es ist wichtig zu wissen, dass BrdU in einer gesättigten Konzentration in Mäusen und Rattenserum für 15 bzw. 60 Minuten nach intraperitonealer Verabreichung vorhanden ist und dann nach 60 bzw. 120 Minuten schnell auf nicht nachweisbare Werte abfällt7.
Hier beschreiben wir vier verschiedene, aber eng verwandte IHC-Techniken: chromogene indirekte Detektion mittels Meerrettichperoxidase (HRP) Reaktion mit DAB (3,3'-Diaminobenzidin) ohne Signalverstärkung (Schritt 4.1), Avidin-Biotin-Komplex (ABC)-Amplifikation (Schritt 4.1), indirekte Immunfluoreszenz-Detektion ohne Signalverstärkung (Schritt 4.4) und markierte Streptavidin-Biotin-(LSAB)-Amplifikation (Schritt 4.3). Jede Methode hat Vor- und Nachteile und kann für spezifische Gewebeanforderungen nützlich sein (siehe Tabelle 1). Wir haben uns für indirekte ICH-Methoden entschieden, da sie erschwinglich und einfach sind, um bei der Verwendung von unkonjugierten Primärantikörpern von chromogenen zu fluoreszierenden Detektionsmethoden zu wechseln. Der HRP-Ansatz ist aufgrund seiner Erschwinglichkeit, hohen Stabilität, hohen Fluktuationsrate und vollen Verfügbarkeit der Substrate eine häufig verwendete IHC-Methode. Nichtsdestotrotz empfehlen wir die Verwendung einer Positivkontrolle, um zu bestätigen, dass die Färbemethode genau funktioniert, und die Verwendung einer Negativkontrolle, um die Antikörperfunktion effektiv zu testen. Multiple Immunfärbungen oder Multiplex-IHC-Methoden (siehe Schritt 6) sind potente Werkzeuge, um große Datenmengen aus dem Gewebeschnitt in einem einzigen Experiment zu gewinnen. Diese Technik ist besonders wichtig, wenn die Verfügbarkeit von Proben begrenzt ist. Ein weiterer Vorteil ist die Möglichkeit, gleichzeitig spezifische Proteine zu identifizieren, die im selben Zellraum koexprimiert werden, während die Gewebeintegrität erhalten bleibt. Multiplex ermöglicht es, verschiedene Marker zu färben, die in bestimmten proliferativen Stadien exprimiert werden (z.B. Nestin, GFAP, DCX, Ki-67), was uns eine detailliertere Proliferations- und Differenzierungsforschung ermöglicht8. Es ist wichtig, Antikörper zu wählen, die mit der verwendeten Fixierungstechnik kompatibel sind, um Kreuzreaktivität zu vermeiden. Wir empfehlen, jeden neuen Antikörper (einschließlich BrdU) einzeln zu testen, um die Methode anzupassen und zu verfeinern. Führen Sie dann die doppelte sequentielle Färbung ein und starten Sie schließlich den simultanen Immunfärbungsprozess, wenn die sequentielle Methode vollständig dominiert wird. Es ist entscheidend, geeignete sekundäre Antikörper für diese Methode zu wählen.
| Methode | Spezifische Methode | Vorteile | Benachteiligungen |
| Indirekte Nachweismethode | Peroxidase-Reaktion mit DAB | 1. Höhere Empfindlichkeit als die direkte Detektions- und indirekte Fluoreszenzmethode. 2. Höhere Beständigkeit gegen Photobleaching als Fluorochrome. 3. Geringere Kosten als Fluoreszenz-Detektionsmethode | 1. Schwierig für Multiplexing mit weniger Farbstoffen. 2. Kompliziert für Co-exprimierte Ziele im selben Zellraum. 3. Reduzierter Dynamikumfang für gleichzeitig seltene und hohe Häufigkeit von Zielen auf demselben Gewebe. |
| Fluoreszenz | 1. Am besten und einfachsten für Multiplexing mit mehr Farbstoffen. 2. Am besten für co-exprimierte Ziele im selben Zellraum. 3. Besserer Dynamikumfang für gleichzeitig seltene und hohe Häufigkeit von Zielen auf demselben Gewebe. 4. Keine zusätzlichen Schritte. | 1. Geringere Empfindlichkeit als die indirekte Peroxidasereaktion mit der DAB-Methode. 2. Schwache Beständigkeit gegen Photobleaching im Laufe der Zeit. 3. Teurer. | |
| Signalverstärkungsverfahren | Avidin-Biotin-Komplex (ABC) | 1. Höhere Empfindlichkeit als die direkte und indirekte Nachweismethode. 2. Hintergrund reduzieren | 1. Zusätzliche Schritte. 2. Teurer als keine Verstärkung. |
| Markiertes Streptavidin-Biotin (LSAB) | 1. Höhere Empfindlichkeit als die direkte und indirekte Nachweismethode. 2. Stärkere Gewebepenetration als bei der ABC-Methode. 3. Hintergrund reduzieren | 1. Zusätzliche Schritte. 2. Teurer als die ABC-Methode. | |
| Keine zusätzliche Verstärkungsmethode | 1. Geringere Kosten. 2. Keine zusätzlichen Schritte. 3. Ideal für viele Ziele. | 1. Geringere Empfindlichkeit: problematisch ohne reichlich Ziele. |
Tabelle 1: Vor- und Nachteile von IHC-Techniken. Diese Tabelle zeigt die Vor- und Nachteile für indirekte Nachweismethoden: Peroxidase-Reaktion mit (3,3'-Diaminobenzidin)DAB und Fluoreszenz; und Signalverstärkungsmethoden: Avidin-Biotin-Komplex (ABC), markiertes Streptavidin-Biotin (LSAB) und keine zusätzliche Amplifikationsmethode.
Ein hochauflösendes Bild ist von grundlegender Bedeutung, um eine ordnungsgemäße Analyse durchzuführen und die Ergebnisse zu präsentieren. Es gibt zwei Ansätze, um die Auflösung zu verbessern: 1) Verwendung eines besseren Mikroskopdesigns (z. B. Konfokal, Multiphoton) oder 2) numerische Umkehrung des Unschärfeprozesses, um Bilder mit Dekonvolution9 zu verbessern. Leider ist die konfokale Mikroskopie aufgrund der hohen Kosten für Geräte und deren Wartung nicht erschwinglich10. Ein Weitfeld-Epifluoreszenzmikroskop und die anschließende Entfaltung der Z-Stack-Bilder stellen eine geeignete, kostengünstige Alternative zur konfokalen Mikroskopiedar 8,9. Wie oben erwähnt, besteht das Ziel der Dekonvolution darin, das ursprüngliche Signal wiederherzustellen, das durch das Erfassungssystem9 verschlechtert wurde, indem Unschärfe, unscharfe Trübung und Verzerrung, die in dem von einem Epifluoreszenz- oder Konfokalmikroskop erhaltenen Bild unter Verwendung mathematischer Entfernungsalgorithmen10 gezeigt werden, reduziert werden. Das aufgenommene verschwommene Bild kann mathematisch modelliert werden, indem die beobachteten Objekte mit einer 3D-Point-Spread-Funktion (PSF) gefaltet werden. PSF ist ein theoretisches Beugungsmuster der Lichtpunkte, die von der Gewebeprobe emittiert und vom Mikroskop gesammelt werden. Die PSF-Datei wird mit den spezifischen Bedingungen jedes Bildes erstellt, wie z. B. dem CCD-Zellabstand der Kamera, dem Brechungsindex des verwendeten Mediums, der numerischen Apertur des Objektivs, der Emissionswellenlänge des Fluorophors, den Bildgrößen, der Anzahl der Bilder in der Z-Stack-Verarbeitungsmethode und dem Abstand zwischen ihnen (siehe technische Spezifikation in Tabelle 2). Mit anderen Worten, die PSF-Datei fasst die Auswirkungen des Bildgebungsaufbaus auf die Mikroskopbeobachtungenzusammen 9. Wir verwenden jedoch das Beugungs-PSF-3D-Plugin (https://imagej.net/Diffraction_PSF_3D), um für jedes Z-Stack-Bild eine eigene spezifische PSF-Datei zu erstellen. Z-Stapelbilder sind eine Reihe von digitalisierten optischen Schnitten aus definierten Tiefen (z-Achse) an der gleichen XY-Position des Objektträgers. Ein Computer kompiliert die von der Fokusebene erhaltenen Informationen, indem er Signale, die von Objekten stammen, die sich in anderen Brennebenen befinden, neu zuordnet. Um Z-Stack-Bilder zu erstellen, ist es notwendig, Bilder von verschiedenen fokussierten Schichten der Folien aufzunehmen (z. B. zehn verschiedene Bilder der gleichen XY-Fläche alle 1 μm Tiefe). Dann verwenden wir eine Mikroskopiesoftware, die vom Hersteller oder von Fidschi zur Verfügung gestellt wird, um ein Z-Stack- oder 3D-Bild zu erstellen. Das Ergebnis ist eine einzelne Stapelbilddatei (z. B. zehn Bilder mit unterschiedlichen Schwerpunkten). Es gibt mehrere kundenspezifische Tools und Softwarelösungen, wie z.B. Open-Source-Software für die Dekonvolutionsmikroskopie. Wir zeigen die Ergebnisse des Dekonvolution-Prozesses mit DeconvolutionLab29, einem Fiji11-Plugin (Distribution von ImageJ12). Die Dekonvolution wird dazu beitragen, die Auflösung der Endaufnahmen zu verbessern (siehe Abbildung 1B, C ). Für weitere Informationen und Anweisungen empfehlen wir dringend die Lektürevon Referenz 13.
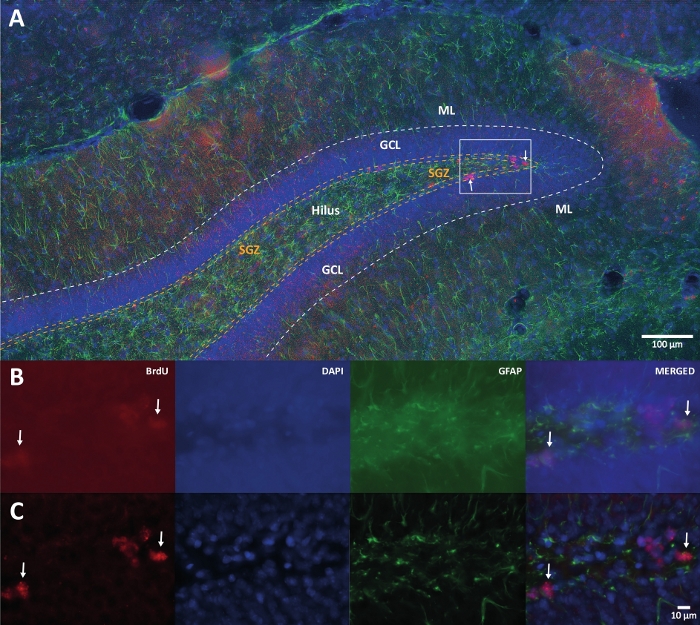
Abbildung 1: Repräsentatives Bild der 3D-Dekonvolution für mehrere Farbkanäle. (A) DG bei geringer Vergrößerung. (B) Die ursprünglichen Z-Stack-Bilder für jeden Kanal und das zusammengeführte Bild. (C) 3D-entfaltete Z-Stack-Bilder für jeden Kanal und das zusammengeführte Bild. Dieses Gehirn stammte von der Ratte, die Teil der Gruppe für körperliche Aktivität war. Es wurde eine markierte Streptavidin-Biotin-Amplifikationsmethode (LSAB) verwendet. Es zeigte Cy3-Streptavidin-konjugierten Antikörper zur Anzeige von BrdU (rot), DAPI als Gegenfärbung (blau) und saures Gliafibrillenprotein (GFAP) als astroglialer Marker (grün). ML = Molekülschicht; GCL = granuläre Zellschicht; SGZ = subgranulare Zone. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Der Zweck dieser Arbeit ist es, eine detaillierte Beschreibung der Schritte zu liefern, um positive und erfolgreiche Ergebnisse mit Immunfärbung zu erzielen und häufig verwendete Schritte in BrdU-basierten Studien ohne die Verwendung eines konfokalen Mikroskops aufzulisten. Die BrdU-Färbung ist eine Technik, die mehrere Schritte erfordert, die sorgfältig befolgt werden müssen, um eine erfolgreiche Färbung zu erzielen. Die Standardisierung dieser Färbetechniken dauert in der Regel Monate und ist zeit- und ressourcenintensiv. Wir gingen davon aus, dass dieser Artikel den Gruppen, die in diesem Bereich tätig sind, Informationen liefern könnte, indem er Zeit und Fehler reduziert.
Protokoll
Alle Verfahren folgen dem Leitfaden der National Institutes of Health für die Pflege und Verwendung von Labortieren (NIH-Veröffentlichungen Nr. 8023, überarbeitet 1978) und den lokalen mexikanischen Gesetzen, um die Anzahl der verwendeten Tiere und deren Leiden zu minimieren. Die Ethikkommission der Universidad Iberoamericana genehmigte die Versuchsprotokolle für die Verwendung von Tieren in dieser Studie.
1. Reagenzienvorbereitung und -einrichtung
HINWEIS: Die meisten Lösungen können Tage vor der Verwendung vorbereitet werden, sofern nicht anders angegeben.
- BrdU-Lösung
- Die BrdU-Lösung wird aus dem Gefrierschrank von -20 °C entnommen und bei Raumtemperatur (RT) ausbalanciert.
- Berechnen Sie die Masse an BrdU, die für eine Dosis von 50 mg/kg erforderlich ist, entsprechend dem Körpergewicht der Ratte. Berechnen Sie das Volumen von 0,9% Kochsalzlösung (0,9 g NaCl in 100 ml sterilemH2O), das für eine Arbeitslösung von 20 mg/ml erforderlich ist. Bereiten Sie einen Überschuss vor, um mindestens 0,5 ml pro Ratte und Injektion bereitzustellen.
HINWEIS: Die Dosis, die Versuchstieren verabreicht wird, sollte sicher, mit minimalen Nebenwirkungen und wirksam sein. Es wurde berichtet, dass die Dauer der Färbung mit 100 mg/kg BrdU die potenziell höhere Toxizität im Vergleich zur Dosis von 50 mg/kg7 nicht aufwiegt. Es wurden keine signifikanten Unterschiede in der Anzahl der BrdU-markierten Zellen/mm3 für 50 und 100 mg/kg i.p. bei Ratten gefunden7. Es ist vorzuziehen, eine kleine Dosis zu injizieren, um das Leiden der Tiere zu minimieren. - Wiegen Sie die BrdU-Lösung ab und fügen Sie sie der Kochsalzlösung in einem konischen Röhrchen und einem Wirbel hinzu.
HINWEIS: Die Kochsalzlösung wird bei 45 bis 5 °C in einem Wasserbad auf ein Volumen von mehr als 1 ml vorgewärmt. - Legen Sie das Röhrchen für 10 bis 15 min in ein Wasserbad bei 50 °C und wirbeln Sie alle 2 bis 20123 min, bis es vollständig aufgelöst ist. Filtern Sie die Lösung mit einem Spritzenvorsatzfilter für die sterile Injektion. Decken Sie das Röhrchen mit Zinnfolie ab, kühlen Sie es bei Raumtemperatur ab und verwenden Sie es sofort.
VORSICHT: BrdU-Lösung ist giftig und potentiell krebserregend. Bereiten Sie es im Abzug vor. Die BrdU-Lösung muss mit geeigneter Schutzausrüstung (PSA) gehandhabt werden. Es wird empfohlen, die Lösung unmittelbar vor Gebrauch vorzubereiten. Die Lösung ist jedoch für 24 h unter RT stabil. Bitte schützen Sie es vor Licht.
- Zur Herstellung von 1 l 0,1 M phosphatgepufferter Kochsalzlösung (PBS) bei einem pH-Wert von 7,4 werden 240 mg Kaliumphosphat monobasisch (KH2PO4), 1,44 g Natriumphosphat zweibasisch (Na2HPO4),200 mg Kaliumchlorid (KCl) und 8 g Natriumchlorid (NaCl) zu 800 ml doppelt destilliertem Wasser (ddH2O) unter ständigem Rühren gegeben. Stellen Sie den pH-Wert auf 7,4 ein und fügen Sie doppelt destilliertesH2Obis zu einem Gesamtvolumen von 1 l hinzu.
- Für 100 ml PBS+ werden 3 % (3 ml) normales Pferdeserum und 0,3 % (300 μl) Triton X-100 auf 0,1 M PBS (pH 7,4) gegeben. In 20 bis 50 ml Aliquots bei -20 °C bis zu 3 Monate lagern.
HINWEIS: Alternativ kann TBS anstelle von PBS verwendet werden. Jedes andere Serum, das sich von den Antikörpern und dem experimentellen Gewebe des Wirts unterscheidet, ist geeignet. - Für 100 ml PBS++ werden 10 % (10 ml) normales Pferdeserum und 0,3 % (300 μl) Triton X-100 auf 0,1 M PBS pH 7,4 gegeben. In 20 bis 50 ml Aliquots bei -20 °C bis zu 3 Monate lagern.
- Für 1 l Kryoschutzlösung 250 ml Ethylenglykol und 250 ml Glycerin mischen, ständig umrühren, bis sie gemischt sind. Mit PBS langsam auf 1 L bringen. Filter mit Filterpapier der Güteklasse 4 (20 bis 25 μm). Bis zu 1 Jahr bei 4 °C oder RT lagern.
- 4% Paraformaldehyd in 0,1 M PBS (PFA-Lösung) werden wie folgt hergestellt. Für 1 l Lösung werden 40 g Paraformaldehydpulver unter ständigem Rühren langsam zu 800 ml 60 bis 65 °C 0,1 M PBS gegeben. Unter Kontrolle der Temperatur (60 bis 60 bis 65 °C) umrühren, bis sich Paraformaldehyd vollständig aufgelöst hat. Falls erforderlich, fügen Sie einige Tropfen 1 M NaOH hinzu, um die Lösung zu klären. Wenn die Lösung Raumtemperatur erreicht hat, wird mit Filterpapier der Klasse 4 (20-25 μm) filtriert.
VORSICHT: Paraformaldehyd ist giftig und steht im Verdacht, krebserregend zu sein. Bei 4 °C lagern und vorzugsweise innerhalb von bis zu 2 Tagen verbrauchen. Die gebrauchsfertige PFA-Lösung ist im Handel erhältlich. - Für 1 l 10 mM Natriumcitratpuffer (SCB) bei pH 6 werden 1,204 g Natriumcitrat (Dihydrat) und 1,134 g Zitronensäure zu 800 ml doppelt destilliertemH2Ounter ständigem Rühren gegeben. Stellen Sie den pH-Wert auf 6,0 ein und fügen Sie ddH2O bis zu 1 l hinzu. Bei 4 °C bis zu 6 Monate lagern.
- 50 ml 2 N HCl werden hergestellt, indem unter ständigem Rühren langsam 8,25 mL 12 N HCl (konzentrierte Stammlösung) zu 41,75 mlddH2Ogegeben werden.
VORSICHT: Im Abzug vorbereiten. Die Lösung muss unmittelbar vor Gebrauch zubereitet werden.
HINWEIS: 2 N HCl wird für die DNA-Denaturierung verwendet, ein entscheidender Schritt. Da BrdU in die DNA eingebaut wird, wird HCl verwendet, um die DNA-Bindungen zu öffnen, die den BrdU-Antikörpern den Zugang zu BrdU innerhalb der DNA ermöglichen. - Bereiten Sie eine endogene Peroxidase-Blocklösung wie folgt vor. 100 mL 0,6%iges Wasserstoffperoxid werden durch Mischen von 2 mL 30%igem Wasserstoffperoxid mit 98 mLddH2Ounter ständigem Rühren hergestellt.
HINWEIS: Die Lösung muss unmittelbar vor der Verwendung vorbereitet werden. Bewahren Sie es im Dunkeln auf,da H 2 O2 lichtempfindlich ist. PBS oder TBS kann anstelle von Wasser verwendet werden. - Bereiten Sie die Lösung des Avidin-Biotin-Komplexes (ABC) gemäß den Anweisungen des Herstellers vor. Für 5 ml ABC in 0,1 M PBS werden 2 Tropfen (≈100 μl) Reagenz A hinzugefügt und gemischt, und dann 2 Tropfen (≈100 μl) Reagenz B hinzugefügt und gemischt.
HINWEIS: Die Lösung muss vorbereitet und vor Gebrauch 20 bis 30 Minuten im Trockner rollen gelassen werden. - Bereiten Sie DAB (Diaminobenzidin) Peroxidase (HRP) Substrat mit dem Kit vor, indem Sie die Anweisungen des Herstellers befolgen. Zu 5 mLddH2Owerden 2 Tropfen (≈ 84 μL) Reagenz 1 hinzugefügt und gemischt, 4 Tropfen (≈ 100 μL) Reagenz 2 hinzugefügt und gemischt, dann 2 Tropfen (≈ 80 μL) Reagenz 3 hinzugefügt und gemischt. Schließlich, falls gewünscht, fügen Sie 2 Tropfen (≈ 80 μL) Reagenz 4 (Nickel) hinzu und mischen Sie.
HINWEIS: Die Lösung muss unmittelbar vor Gebrauch vorbereitet werden.
VORSICHT: DAB ist giftig und potentiell krebserregend. Es muss vorsichtig behandelt und gemäß der Sonderabfallverordnung in jeder Einrichtung entsorgt werden. Um DAB zu deaktivieren, fügen Sie mehrere Tropfen Bleichmittel (Natriumhypochlorit) hinzu; Die Lösung wird schwarz. - 100 mL Kresylviolettlösung werden durch Zugabe von 100 mg Kresylviolettacetat und 250 μL Essigsäure zu 80 mLddH2Obei 55 bis 60 °C hergestellt. Stellen Sie das Volumen auf 100 ml ein, filtrieren Sie es und lagern Sie es bei 4 °C in einem dunklen Gefäß.
HINWEIS: Der Benutzer wird aufgefordert, verschiedene Konzentrationen der Kresylviolettlösung zu testen, bevor er sie an wertvollen Gewebeproben verwendet. Das Ergebnis kann bei einer Gegenfärbung mit einigen Gewebeproben dunkler sein, was die Fähigkeit zur genauen Zählung von BrdU-positiven Zellen verringern kann.
2. Thymidin-Analog-BrdU-Verabreichung
- Halten Sie das Versuchstier (z. B. eine 90 Tage alte männliche Wistar-Ratte mit einem Gewicht von 350 g) zurück, indem Sie die untere Bauchhöhle immobilisieren.
- Die BrdU-Lösung (50 mg/kg) wird intraperitoneal (i.p.) mit einer 23 g Nadel und einer 1 ml Spritze verabreicht.
HINWEIS: Passen Sie das Injektionsvolumen entsprechend dem Gewicht des Tieres an. Verwenden Sie eine 23 bis 27 g Nadel und eine 1 bis 20125 ml Spritze für erwachsene Ratten. Das maximal tolerierbare intraperitoneale Injektionsvolumen bei erwachsenen Ratten beträgt 10 ml. Für die Verabreichung der BrdU-Lösung14 können verschiedene Wege verwendet werden. Zum Beispiel intraperitoneale Injektion oder orale Verabreichung über Trinkwasser.
3. Gewebepräparation
HINWEIS: Drei Monate alte Ratten durften sieben Tage lang ad libitum Zugang zu körperlicher Aktivität (endloses Rad) haben. Am 6. Tag wurde den Ratten 3 Mal im Abstand von 12 Stunden BrdU (Schritt 2) injiziert. Führen Sie die Schritte in Abschnitt 3 nach 8 h nach der letzten BrdU-Injektion durch.
- Injizieren Sie Pentobarbital (50 mg/kg i.p.) und warten Sie einige Minuten, bis das Tier tief betäubt ist.
HINWEIS: Stellen Sie sicher, dass das Tier vollständig betäubt ist, bevor Sie fortfahren. Kneifen Sie vorsichtig eines der Beine oder den Schwanz zusammen. Wenn das Tier auf den Reiz reagiert, warten Sie noch einige Minuten. Wenn das Tier nicht auf das Einklemmen reagiert, fahren Sie mit dem nächsten Schritt fort. - Legen Sie das Herz frei, indem Sie die Bauchhöhlenhaut unter dem Brustbein schneiden, die Rippen auseinandernehmen und das Zwerchfell schneiden.
- Transkardiale Perfusionsfixierung
- Führen Sie eine Nadel in den linken Ventrikel ein und machen Sie einen kleinen Schnitt im rechten Vorhof. Mit einer Pumpe oder Schwerkraft wird 0,1 M PBS perfundiert (Flussrate 5 bis 20127 ml/min), bis das gesamte Blut abgelassen ist und die Lösung klar wird.
- Führen Sie mit einer Pumpe oder Schwerkraft eine kalte Perfusion (Flussrate 5 bis 5 ml / min) mit PFA-Lösung durch, um das Gewebe zu fixieren, bis der Schwanz steif wird.
HINWEIS: Normalerweise benötigt eine 300-g-Ratte etwa 100 bis 150 ml PFA-Lösung. Die Gewebefixierung ist optional. Dadurch kann das Gehirn für den Einsatz in verschiedenen Prozessen extrahiert werden, um den Einsatz von Tieren in den Experimenten zu minimieren.
- Dissektion und Nachfixierung
- Enthaupten Sie das Tier und ziehen Sie vorsichtig das Gehirn aus dem Schädel. Tauchen Sie das Gehirn für 1 bis 20122 Tage bei 4 °C in ein konisches Röhrchen mit PFA-Lösung (~ 40 ml für eine 250 mg Ratte).
HINWEIS: Nicht überfixieren (mehr als 48 h), da dies die Gewebefärbung aufgrund der Nichtverfügbarkeit von Antigenen erschöpfen kann. - 100 ml 30%ige Saccharoselösung werden unter ständigem Rühren mit 30 g Saccharose auf 70 ml 0,1 M PBS-Lösung gegeben. 0,1 M PBS-Lösung zu 100 ml hinzufügen. Tauchen Sie das Gehirn für ca. 1 bis 20122 Tage bei 4 °C in ein konisches Röhrchen mit einer 30%igen Saccharoselösung (35 ml), bis das Gehirn auf den Boden des Röhrchens sinkt.
- Enthaupten Sie das Tier und ziehen Sie vorsichtig das Gehirn aus dem Schädel. Tauchen Sie das Gehirn für 1 bis 20122 Tage bei 4 °C in ein konisches Röhrchen mit PFA-Lösung (~ 40 ml für eine 250 mg Ratte).
- Schneiden von koronalen Hirnschnitten
HINWEIS: Die Verwendung eines Kryostat-Mikrotoms erfordert Anleitung und Schulung. Detaillierte Anweisungen finden Sie in Referenz15.- Tauchen Sie das gesamte Gehirn bei -80 °C in Iso-Pentan ein und halten Sie es 10 Minuten lang bei -80 °C. Legen Sie das Gehirn in eine Einbettungsmatrix auf einer Kryostat-Mikrotomplatte.
HINWEIS: Unter bestimmten Bedingungen kann ein schnelles Einfrieren des Gehirns bei -80 °C zu Frakturen oder Schäden am Gewebe führen. Der Benutzer sollte sich dieses Problems bewusst sein. Wenn dies der Fall ist, verwenden Sie -20 °C Iso-Pentan, um das Gehirn einzufrieren. - Mit einem Kryostat-Mikrotom (Temperatur bei -25 bis -20 °C) wurden koronale Schnitte von 40 μm Dicke geschnitten. Übertragen Sie nacheinander Schnitte in eine 24-Well-Zellkulturplatte mit Kryoprotektionslösung gemäß der Anleitung in Abbildung 2. Bis zu einigen Monaten bei -20 °C lagern.
HINWEIS: Verarbeiten Sie im Folgenden das gesamte Gewebe in frei schwebenden seriellen Schnitten von 40 μm in 12-Well-Platten mit Netzeinsätzen unter sanftem und kontinuierlichem Rühren (10 U/min). Es ist möglich, Hirnschnitte jahrelang unter den richtigen Bedingungen zu lagern.
- Tauchen Sie das gesamte Gehirn bei -80 °C in Iso-Pentan ein und halten Sie es 10 Minuten lang bei -80 °C. Legen Sie das Gehirn in eine Einbettungsmatrix auf einer Kryostat-Mikrotomplatte.
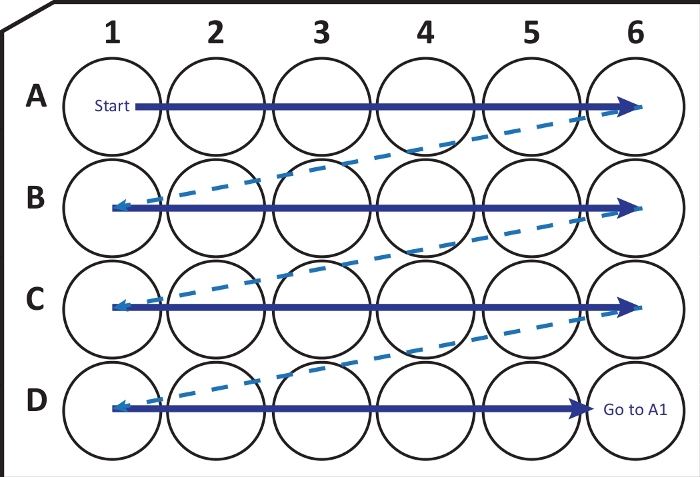
Abbildung 2: Schematische Darstellung des sequentiellen Transfers von Schnitten aus dem Kryostat-Mikrotom in eine 24-Well-Zellkulturplatte mit Kryoprotektionslösung. Beginnen Sie bei A1-Vertiefung und legen Sie die nächsten Scheiben in Reihe A; nach A6-Vertiefung in die nächste Reihe B gehen, so weiter. Wenn Sie die D6 erreichen, kehren Sie zur A1 zurück und fahren Sie weiter. Diese Anordnung ermöglicht die Quantifizierung des N-ten Abschnitts (z. B. Sechstel für die Neurogenese, entspricht dem Inhalt einer Spalte) einer gesamten Hirnregion. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
4. Immunfärbung
ANMERKUNG: In Tabelle 1 finden Sie eine Zusammenfassung der Vor- und Nachteile der einzelnen Techniken.
- Nachweis von BrdU mittels Peroxidase-Reaktion mit DAB
HINWEIS: Führen Sie die Schritte 4.1.1 bis 4.1.5 an Tag 1 durch.- Die Scheiben aus der Kryoschutzlösung werden bei Raumtemperatur auf 0,1 M PBS übertragen. Spülen Sie dreimal für jeweils 10 Minuten mit 0,1 M PBS.
- Inkubieren Sie die Scheiben für 30 min in endogener Peroxidase-Blocklösung, um die endogene Peroxidase zu inaktivieren. Spülen Sie 3 mal, jeweils 10 Minuten, mit 0,1 M PBS. Optional ist eine Antigenentnahme durchzuführen (siehe Abschnitt 5). Scheiben 20 min mit 2 N HCl bei 37 °C inkubieren. In 0,1 M Boratpuffer (8,5 pH) für 10 Minuten spülen. Spülen Sie 3 mal für jeweils 10 Minuten mit eiskaltem 0,1 M PBS.
- Inkubieren Sie die Scheiben für 2 h bei Raumtemperatur mit PBS++ (Blocklösung). Inkubation mit Anti-BrdU-Primärantikörper (Mauswirt) in einer Konzentration von 1:250 in PBS+ über Nacht bei 4 °C.
- An Tag 2 spülen Sie die Scheiben 3 mal für jeweils 10 Minuten mit 0,1 M PBS.
- Inkubieren Sie mit 1:250 HRP-konjugierten sekundären Antikörpern (Anti-Maus) in PBS+ für 2 bis 20124 h bei Raumtemperatur. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS.
- Scheiben in DAB-Peroxidase (HRP)-Substratlösung überführen und für 2 bis 10 Min. inkubieren. Wenn die Scheiben dunkelgrau werden, visualisieren Sie das Gewebe mit einer Lupe oder einem Mikroskop. Wenn positive Zellen vorhanden sind, spülen Sie 3 mal (für jeweils 15 Minuten) mit Leitungswasser (um den Hintergrund zu reduzieren). 3 mal für je 10 min mit 0,1 M PBS waschen.
- Montieren Sie die Scheiben vorsichtig mit einer weichen Bürste auf gelatinierten Objektträgern und trocknen Sie sie über Nacht bei Raumtemperatur. Verfärben Sie (siehe Abschnitt 7.1), fügen Sie dauerhaftes Montagemedium hinzu und legen Sie Deckgläser an. Bis zu 6 Monate bei 4 °C lagern.
- Nachweis von BrdU mittels Peroxidase-Reaktion mit dem Avidin-Biotin-Peroxidase-Komplex
HINWEIS: Führen Sie die Schritte 4.2.1 bis 4.2.5 an Tag 1 durch.- Scheiben aus der Kryoschutzlösung auf 0,1 M PBS übertragen, um sie auf Raumtemperatur zu bringen. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS.
- Inkubieren Sie für 30 min mit endogener Peroxidase-Blocklösung, um die endogene Peroxidase zu inaktivieren. Spülen Sie 3 mal für jeweils 10 Minuten in 0,1 M PBS. Optional ist eine Antigenentnahme durchzuführen (siehe Abschnitt 5).
- 20 min mit 2 N HCl bei 37 °C inkubieren. In 0,1 M Boratpuffer (pH 8,5) für 10 min abspülen. 3 mal für je 10 min mit eiskaltem 0,1 M PBS waschen.
- Inkubieren Sie für 2 h bei Raumtemperatur in PBS++ (Blocklösung).
- Inkubation mit Anti-BrdU-Primärantikörper (Mauswirt) 1:250 in PBS+ über Nacht bei 4°C.
- An Tag 2 3 mal für jeweils 10 min mit 0,1 M PBS spülen.
- Inkubieren Sie mit 1:250 biotinylierten sekundären Antikörpern (Anti-Maus) in PBS+ für 2 bis 20124 h bei Raumtemperatur. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS.
- In der ABC-Lösung für 1 h bei Raumtemperatur inkubieren. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS.
- Die Scheiben werden in die DAB-Peroxidase (HRP)-Substratlösung überführt und 2 bis 10 Min. inkubiert. Wenn die Scheiben dunkelgrau werden, visualisieren Sie das Gewebe mit einer Lupe oder einem Mikroskop. Wenn positive Zellen vorhanden sind, spülen Sie 3 mal (jeweils 15 Minuten) mit Leitungswasser (um den Hintergrund zu reduzieren), gefolgt von 3 Mal mit 0,1 M PBS Waschen für jeweils 10 Minuten.
HINWEIS: Die Lösung muss unmittelbar vor Gebrauch vorbereitet werden. Es sollte darauf geachtet werden, dass Hirnschnitte aufgrund unregelmäßiger dunkler Flecken im Gewebe nicht aneinander kleben. - Montieren Sie die Scheiben vorsichtig mit einer weichen Bürste auf gelatinierten Objektträgern und trocknen Sie sie dann über Nacht bei Raumtemperatur.
- Bei Bedarf gegenfärben (siehe Schritt 7.1), permanentes Montagemedium hinzufügen und Deckgläser anbringen. Bis zu 6 Monate bei 4 °C lagern.
- Nachweis von BrdU durch Immunfluoreszenz mittels markierter Streptavidin-Biotin (LSAB)-Amplifikation
HINWEIS: Führen Sie die Schritte 4.3.1 bis 4.3.4 an Tag 1 durch.- Die Scheiben aus der Kryoschutzlösung werden bei Raumtemperatur auf 0,1 M PBS übertragen. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS. Optional ist eine Antigenentnahme durchzuführen (siehe Abschnitt 5).
- 20 min in 2 N HCl bei 37 °C inkubieren. In 0,1 M Boratpuffer (8,5 pH) für 10 Minuten spülen. Spülen Sie 3 mal für jeweils 10 min in eiskaltem 0,1 M PBS.
- Inkubieren Sie für 2 h bei Raumtemperatur in PBS++ (Blocklösung). Inkubation mit 1:250 Anti-BrdU-Primärantikörper (Mauswirt) in PBS+ über Nacht bei 4 °C.
- An Tag 2 3 mal für jeweils 10 min mit 0,1 M PBS spülen.
- Inkubieren Sie mit 1:250 biotinylierten sekundären Antikörpern (Anti-Maus) in PBS+ für 2 bis 20124 h bei Raumtemperatur. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS. Mit 1:250 Fluorochrom-konjugiertem Streptavidin (Cy3) in PBS (kein Serum verwenden) für 1 bis 122 h bei Raumtemperatur inkubieren. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS.
HINWEIS: Serum kann Biotin enthalten und sollte nicht zu Verdünnungsmitteln hinzugefügt werden. Verwenden Sie stattdessen PBS, das 0,3 % Triton X-100 enthält. - Montieren Sie die Scheiben vorsichtig mit einer weichen Bürste auf gelatinierten Objektträgern, trocknen Sie sie über Nacht bei Raumtemperatur an der Luft oder montieren Sie sie sofort mit einem geeigneten Montagemedium. Gegenflecken (siehe Schritt 7.2), permanentes Einbettmedium hinzufügen und Deckgläser anbringen. Bis zu 6 Monate bei 4 °C lagern.
- Nachweis von BrdU durch indirekte Immunfluoreszenz
HINWEIS: Führen Sie die Schritte 4.4.1 bis 4.4.4 an Tag 1 durch.- Übertragen Sie Scheiben aus der Kryoschutzlösung auf 0,1 M PBS, bis sie Raumtemperatur erreicht hat. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS. Falls erforderlich, ist eine Antigenentnahme durchzuführen (fakultativ, siehe Abschnitt 5).
- 20 min in 2 N HCl bei 37 °C inkubieren. In 0,1 M Boratpuffer (8,5 pH) für 10 Minuten spülen. Spülen Sie 3 mal für jeweils 10 min mit eiskaltem 0,1 M PBS. Inkubieren Sie für 2 h bei Raumtemperatur mit PBS++ (Blocklösung). Inkubation mit 1:250 Anti-BrdU-Primärantikörper (Mauswirt) in PBS+ über Nacht bei 4 °C.
- An Tag 2 3 mal für jeweils 10 min mit 0,1 M PBS spülen.
- Inkubieren Sie mit 1:250 Fluorochrom-konjugierten sekundären Antikörpern (Anti-Maus) in PBS+ für 2 bis 20124 h bei Raumtemperatur. Spülen Sie 3 mal für jeweils 10 Minuten mit 0,1 M PBS.
- Montieren Sie die Scheiben vorsichtig mit einer weichen Bürste auf gelatinierten Objektträgern, trocknen Sie sie über Nacht bei Raumtemperatur an der Luft oder montieren Sie sie sofort mit einem geeigneten Montagemedium. Gegenflecken (siehe Schritt 7.2), permanentes Einbettmedium hinzufügen und Deckgläser anbringen. Bis zu 6 Monate bei 4 °C lagern.
5. Antigen-Retrieval (optional)
HINWEIS: Antigen-Retrieval ist ein optionaler Schritt, der dazu dient, den Verlust der Antigenität zu korrigieren, der durch die Fixierung verursacht wird, die die Tertiär- und Quartärstruktur vieler Antigene verändert, so dass sie von Antikörpern nicht mehr nachweisbar sind. Dieser Schritt kann dem ursprünglichen Protokoll hinzugefügt werden.
- In einer Mikrowelle oder einem Wasserbad wird 10 mM Natriumcitratpuffer (SCB) pH 6-Lösung auf 90 bis 90 bis 95 °C vorgeheizt (je nach Höhenlage beginnt die Lösung um diese Temperatur herum zu kochen). Füllen Sie 80% eines konischen 50-ml-Röhrchens (40 ml) mit vorgewärmtem SCB. Übertragen Sie Scheiben auf Netzeinsätze in das konische Rohr mit SCB. Decken Sie das Röhrchen mit einem Schraubverschluss mit Löchern ab, die mit einer Nadel von 18 bis 201220 G versehen sind.
- Die Scheiben werden 30 Minuten lang in SCB bei 80 bis 80 °C in abwechselnden Erwärmungszyklen in der Mikrowelle bei minimaler Leistung aufbewahrt. Füllen Sie das konische Röhrchen bei Bedarf mit SCB auf. Scheiben sofort danach zusammen mit den Netzeinsätzen in eiskalte 0,1 M PBS geben und 3 mal für jeweils 10 min spülen.
6. Mehrfache Immunfärbungen (optional)
HINWEIS: Die Gründe für diesen Schritt finden Sie im Einführungsabschnitt.
- Gleichzeitige mehrfache Immunfärbung
- Bereiten Sie einen Cocktail mit den primären Antikörpern gegen das Ziel (z. B. Maus-Anti-BrdU und Kaninchen-Anti-GFAP) in PBS+ vor. Verwenden Sie für jeden verwendeten primären Antikörper unterschiedliche Wirte. Über Nacht bei 4 °C brüten. Fahren Sie mit den gleichen nächsten Schritten für jedes Protokoll fort.
- Bereiten Sie einen Cocktail mit den entsprechenden sekundären Antikörpern für jeden verwendeten primären Antikörper (z. B. Ziegen-Anti-Maus-FITC, Ziegen-Anti-Kaninchen-TRITC) in der gleichen Verdünnungslösung für jedes Protokoll zu. Fahren Sie mit den gleichen nächsten Schritten für jedes Protokoll fort. Verwenden Sie idealerweise sekundäre Antikörper, die von denselben Wirten stammen, um Kreuzreaktionen zu vermeiden.
- Sequentielle multiple Immunfärbungen.
- Befolgen Sie das Protokoll für das erste Antikörperziel (z. B. Maus-Anti-BrdU) und stoppen Sie vor dem Montieren der Schnitte. Inkubieren Sie für 2 h bei Raumtemperatur mit PBS++ (Blocklösung).
- Inkubieren Sie den zweiten primären Antikörper (z. B. Kaninchen-Anti-GFAP) in PBS+ über Nacht bei 4 °C. Befolgen Sie die nächsten Schritte für jedes Protokoll, einschließlich der Inkubation des zweiten sekundären Antikörpers (z. B. Ziegen-Anti-Kaninchen-TRITC). Fahren Sie mit den nächsten Schritten für jedes Protokoll bis zum Ende fort.
7. Gegenfärbung (optional)
- Bei Protokollen, bei denen die Peroxidasereaktion verwendet wird, wird die Kresylviolettlösung auf 60 °C vorgeheizt. Hydratisieren Sie die Objektträger mit ddH2O für 1 min. Die Objektträger in der heißen Kresylviolettlösung 5 bis 20 Min. inkubieren.
- Spülen Sie die Objektträger 1 Minute lang mit ddH2O ab. Spülen Sie die Objektträger mit 70%, 80%, 90% und 100% Ethylalkohol für jeweils 1 bis 1 %. Spülen Sie die Objektträger 1 bis 1 bis 1 Min. lang mit Xylol ab.
- Fügen Sie permanentes hydrophobes Montagemedium hinzu und legen Sie Deckgläser an.
HINWEIS: Bis zu 6 Monate bei 4 °C lagern. Es kann ein selbst hergestelltes Montagemedium verwendet werden, das PVA (Polyvinylalkohol)-DABCO enthält.
- Für Protokolle, die Immunfluoreszenz verwenden, fügen Sie ein kleines Volumen (25-50 μL) hydrophiles Einbettungsmedium mit DAPI, Propidiumiodid oder ähnlichem hinzu. Versiegeln Sie den Umfang mit Nagellack oder einer Kunststoffversiegelung. Bis zu 6 Monate bei 4 °C lagern.
8. Bildgebung und Analyse
HINWEIS: Siehe Tabelle 2 für die Spezifikationen des Mikroskopaufbaus. In der Regel erfolgt die Zählung der gefärbten neuen Zellen mit Hilfe der Peroxidasereaktion gefärbte Schnitte (billigere Methode), kann aber auch unter Verwendung von Immunfluoreszenz durchgeführt werden.
- Um die Zellen zu quantifizieren, muss zunächst der Gyrus dentatus mit der Linse mit 4-facher Vergrößerung richtig identifiziert werden (weitere Anweisungen zu den anatomischen Details der DG finden Sie bei Amaral et al.16).
- Durchsuchen Sie die körnige Zellschicht des Gyrus dentatus nach Kernen, die mit BrdU markiert sind (mit der Linse mit 40-facher Vergrößerung). Führen Sie eine gründliche Zellsuche entlang der z-Achse durch, da neue Zellen in verschiedenen Schichten verteilt werden können (siehe Video 1).
- Wählen Sie einen Intervallschnitt für die Zellsuche im gesamten Gyrus dentatus (z. B. jeder 6. Gewebeschnitt, entspricht alle 240 μm).
- Zählen Sie alle BrdU-positiven Zellen. Die Morphologie des markierten Kerns kann sich ändern, je nachdem, wie viel BrdU die Zelle eingebaut hat (siehe Abbildung 3 als Leitfaden). Bewegen Sie sich langsam über die z-Achse, um alle Kerne zu quantifizieren, die einen Cluster integrieren (siehe Video 2).
- Multiplizieren Sie die Gesamtzahl der gezählten Zellen mit dem ausgewählten Intervallabschnitt (z. B. 6), um die Gesamtzahl der mit BrdU markierten neuen Zellen zu schätzen.
- Idealerweise zählen Sie in einem regulären Experiment mindestens zehn Schnitte pro Tier und mindestens fünf Tiere pro Gruppe.
- Bildentfaltung (optional)
HINWEIS: Wichtige Informationen zu diesem Schritt finden Sie im Einführungsabschnitt. Dieses Verfahren benötigt monochromatische Bilder (Graustufen). Wandeln Sie Farbbilder in Graustufen um. Wenn es sich bei den Bildern um ein RGB-Composite handelt, teilen Sie zuerst die Kanäle auf und fügen Sie sie als einzelnes Bild (nicht Composite) zusammen, und transformieren Sie sie dann in 8-Bit-Graustufen.- Erstellen Sie eine Z-Stack-Datei aus Mikrobildern.
- Erstellen Sie eine PSF-Datei (Point Spread Function) und öffnen Sie das Diffraction PSF 3D-Plugin (https://imagej.net/Diffraction_PSF_3D) über das Optionsmenü Plugins . Füllen Sie alle erforderlichen Daten aus (siehe Tabelle 2). Klicken Sie auf OK und speichern Sie die Datei.
- Öffnen Sie das DeconvolutionLab29 Plugin über das Optionsmenü Plugins (http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/). Ziehen Sie das übereinstimmende Z-Stack-Bild und die PDF-Datei in den entsprechenden Fenstersteckplatz.
- Wählen Sie den Dekonvolutionsalgorithmus (z. B. Richardson-Lucy) und die Anzahl der Iterationen (z. B. 20) aus. Drücken Sie auf AUSFÜHREN.
- Kombinieren Sie die entfalteten Bilder zu einem einzigen Z-Stack-Image, indem Sie oben im Menü "Image" die Option "Stacks" auswählen. Klicken Sie dann auf Z-Projekt. Wählen Sie im Dropdown-Menü "Projektionstyp" die Option "Maximale Intensität" aus, drücken Sie die Taste "O K"und speichern Sie die Datei.
- Erstellen Sie ein RGB-Bild mit der einzelnen Z-Stack-Bilddatei, die Sie im obigen Schritt mit der gewünschten Pseudofarbe erstellt haben, indem Sie oben im Menü "Bild" die Option "Farbe" auswählen. Klicken Sie dann auf Kanäle zusammenführen. Stellen Sie das entsprechende Bild aus dem Dropdown-Menü auf den gewünschten Farbkanal ein. Deaktivieren Sie das Kontrollkästchen Create Composite, drücken Sie OK und speichern Sie die Datei (siehe Abbildung 4).
- Wenn mehr als ein Kanalbild vorhanden ist, wiederholen Sie die Schritte 8.2.1 bis u20128.2.5. Erstellen Sie eine RGB-Bilddatei gemäß Schritt 8.2.6, öffnen Sie mindestens zwei Bilddateien und wählen Sie für jede Bilddatei unterschiedliche Farbkanäle aus (siehe Abbildung 4).
Ergebnisse
Die oben beschriebenen Methoden wurden angewendet, um neugeborene Zellen im Hippocampus von erwachsenen Ratten nach freiwilliger körperlicher Aktivität zu quantifizieren, im Gegensatz zu einer Kontrollgruppe ohne zusätzliche körperliche Aktivität. Wir verwendeten den postnatalen Ratten-Hippocampus als Positivkontrolle. Männliche Ratten im Alter von 3 Monaten wurden sieben Tage lang unter einem freiwilligen körperlichen Aktivitätsprotokoll (endloses Rad) durchgeführt. Am 6. Tag wurde den Ratten BrdU injiziert (Abschnitt 2) und danach alle 12 Stunden bis zu drei vollständige Injektionen. Um drei Zellzyklusteilungen abzuschließen, wurden die Tiere 8 Stunden nach der letzten BrdU-Injektion transkardial perfundiert (Abschnitt 3). Das gleiche Verfahren wurde bei drei Monate alten Ratten angewendet, die keiner körperlichen Aktivität unterzogen wurden, um als Vergleichskontrolle verwendet zu werden. Als Positivkontrolle wurde eintägig alten Rattenwelpen (postnataler Tag 1) einmal BrdU injiziert, wie in Abschnitt 2 oben beschrieben. Einen Tag nach der Injektion (postnataler Tag 2) wurden die Jungtiere eingeschläfert und ihre Köpfe in PFA-Lösung getaucht, wie in Schritt 3.4 beschrieben. Erwachsene Ratten wurden tief betäubt (Schritt 3.1) und transkardial perfundiert, wie in Schritt 3.2 beschrieben. Die Gehirne wurden seziert und nachfixiert (Schritt 3.4). Die Gehirne wurden in 40 μm große koronale Schnitte geschnitten (Schritt 3.5). Die Schnitte wurden für die BrdU-Immunhistochemie aufbereitet, wie in Schritt 4 beschrieben.
Wir verwendeten Meerrettichperoxidase-Reaktion mit DAB IHC zur Färbung (Schritt 4.1) und zur Zählung von BrdU-positiven Zellen in DG. Abbildung 5 zeigt einen DG-Schnitt mit BrdU-markierten Zellen. Abbildung 5C,D zeigt einen repräsentativen Ausschnitt des DG-Schnitts bei höherer Vergrößerung. Markierte Zellen zeigten eine intensive dunkle Färbung, die mit Pfeilen markiert war. Der Ausschnitt zeigt die durchschnittliche Anzahl der markierten Zellen in der Versuchs- und Kontrollgruppe (gezählte positive Zellen multipliziert mit sechs, wie in Schritt 8.1 beschrieben). Der t-Test eines Studenten ergab Signifikanzunterschiede zwischen der Anzahl der BrdU-positiven Zellen (t(10) = 2,704, p = 0,0222). Die Kontrollgruppe, die sich keiner körperlichen Aktivität unterzog, zeigte 2.040 ± 314 Zellen (n = 6 Ratten). Im Vergleich dazu zeigte die Bewegungsgruppe im Durchschnitt 3.606 ± 486 (n = 6 Ratten) BrdU-positive Zellen. Wie beobachtet, erhöht die Exposition gegenüber körperlicher Aktivität die BrdU-positiven Zellen. Daher stimmen diese Ergebnisse mit anderen berichteten Ergebnissen überein, die zeigen, dass körperliche Aktivität die Zellproliferation im erwachsenen Gyrus dentatus17 erhöht.
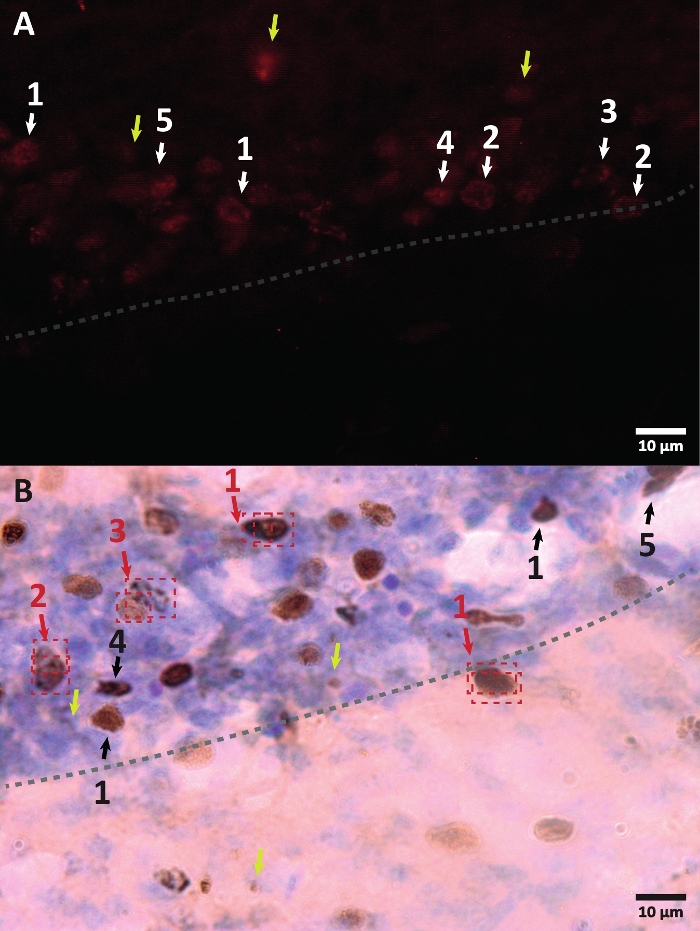
Abbildung 3: Beispiele für unterschiedliche Morphologie des BrdU-markierten Zellkerns. BrdU ist ein DNA-Synthesemarker, der den Zellkern markiert. In der Hippocampus-Region hatten die BrdU-positiven Kerne eine halbovale Form, die sich in der subgranulären Zone des Gyrus dentatus befand. Da BrdU durch Wettbewerb inkorporiert wird, wird die Menge, die für jede Zelle inkorporiert wird, eine Variation haben, die sich später in der Art und Weise widerspiegelt, wie der Kern visualisiert wird. (A) Immunfluoreszenzbild. (B) Es wird ein Bild unter Verwendung einer Peroxidasereaktion ohne zusätzliche Amplifikationsmethode dargestellt. Gelbe Pfeile zeigen Artefakte und unspezifische Signale. Schwarze oder weiße Pfeile zeigen BrdU+-Zellen. 1 – Vollständig abgerundeter Kern, halbovale Kerne stark gefärbt. 2 – Kerne mit Punkten, der Rand der Kerne ist markiert und hat innen mehrere Punkte. 3 – Kerne mit wenigen Punkten, die Ränder der Kerne sind markiert und haben eine kleine Anzahl von Punkten im Inneren. 4 – Kleiner Zellkern ist möglich, Zellen in einem anderen Differenzierungsstadium, aber immer noch Teil der Nische. 5 – Cluster sind Vorläuferzellen in Teilung, daher können mehrere Zellen zusammen in kondensierten Gruppen beobachtet werden. Innerhalb dieser Gruppen muss die Zählung besonders sorgfältig durchgeführt werden, um eine Fehlmarkierung positiver Zellen zu vermeiden. Rote Pfeile zeigen den Zellkern unter Teilung, der verwechselt werden kann, um eine einzelne Zelle zu sein. Jede Zelle ist in einem Kasten eingeschlossen und kann in Echtzeit in einer Z-Achsenebene unterschieden werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
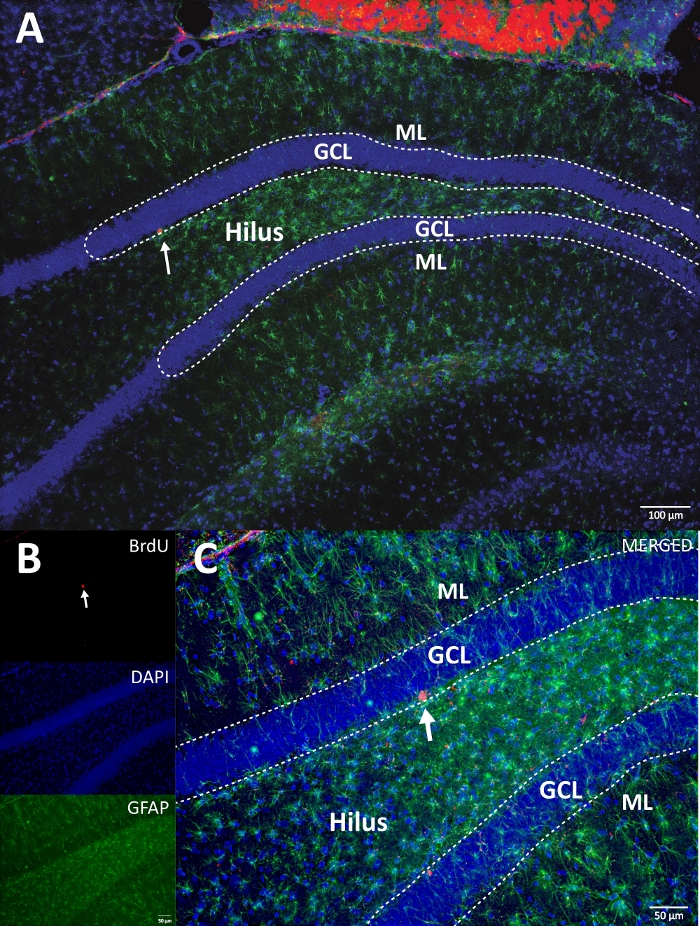
Abbildung 4: Repräsentatives RGB-Bild für einzelne und zusammengeführte Kanäle. Das obere Bild zeigt das ursprüngliche Z-Stack-Bild und das untere Bild zeigt das dekonvolutierte 3D-Z-Stack-Bild. (A) Geringe Vergrößerung der DG. (B) RGB-Bild für jeden Kanal und (C) RGB-zusammengeführtes Bild. Dies war ein Gehirn aus der Kontrollgruppe. Die Immunfluoreszenz wurde ohne zusätzliche Amplifikationsmethode verwendet. BrdU (rot), DAPI als Gegenfärbung (blau) und GFAP (glialfibrilläres saures Protein) als astroglialer Marker (grün). ML = Molekülschicht; GCL = granuläre Zellschicht; SGZ = subgranulare Zone. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
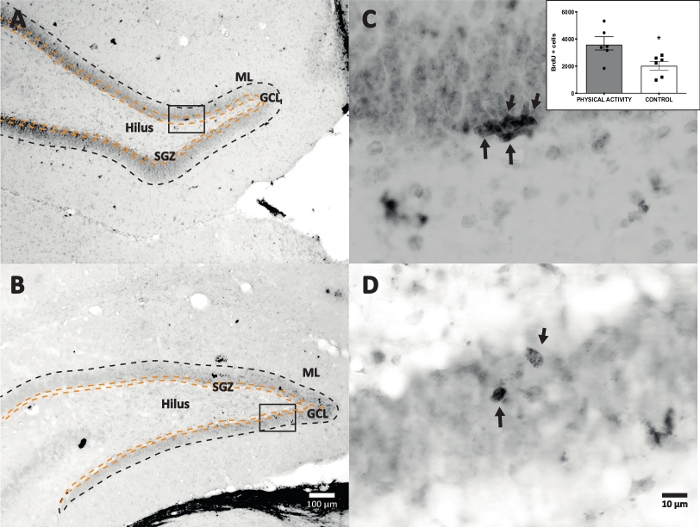
Abbildung 5: Repräsentativer DG-Schnitt mit BrdU-markierten Zellen (intensiv dunkel) für jede Versuchsgruppe. Die Peroxidase-Reaktion wurde mit der Avidin-Biotin-Peroxidase-Komplex-Amplifikationsmethode verwendet. (A, B) Zeigen Sie eine geringe Vergrößerung der DG und (C, D) zeigen Sie den Kastenbereich bei höherer Vergrößerung. Die Panels A und C sind Gewebe aus der Gruppe der körperlichen Aktivität, die Panels B und D aus der Kontrollgruppe. Der Einschub zeigt die durchschnittliche Anzahl der markierten Zellen in der körperlichen Aktivität und der Kontrollgruppe (gezählte positive Zellen multipliziert mit sechs, wie in Schritt 8.1 beschrieben). ML = Molekülschicht; GCL = granuläre Zellschicht; SGZ = subgranulare Zone; Pfeile zeigen BrdU+-Zellen an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Video 1: Das Video zeigt einen unterschiedlichen Fokus positiver Zellen entlang der z-Achse, die in verschiedenen Schichten verteilt sind. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Das Video zeigt einen unterschiedlichen Fokus positiver Zellcluster entlang der z-Achse, die in verschiedenen Schichten verteilt sind. Bewegen Sie sich langsam über die z-Achse, um alle verschiedenen Kerne zu quantifizieren, die einen Cluster integrieren. Bitte klicken Sie hier, um dieses Video herunterzuladen.
| Mikroskop-Typ: | Epifluoreszenzmikroskop Olympus BX53 | ||||
| Lichtquelle: | Hochdruck-130-W-Quecksilberbogenlampe (U-HGLGPS) | ||||
| Erfassungssoftware: | CellSens Standard | ||||
| Filter-Sets: | Katalog-Nr. | Anregungsbereich | Dichromatischer Spiegel | Unterdrückungsbereich | |
| U-FUW | 340 - 490 nm | 410 nm | 420 nm | ||
| U-FBW | 460 - 495 nm | 505 nm | 510 nm | ||
| U-FGW | 530 - 550 nm | 570 nm | 575 nm | ||
| Kamera: | Modell: | CCD-Kamera UC50 | |||
| Spektralbereich: | 290 – 1000 nm | ||||
| Größe des CCD-Chips: | 2/3 Zoll, 2588 (Breite *7) x 1960 (Höhe *8) Pixel | ||||
| Pixelgröße: | 3,4 x 3,4 μm | ||||
| Fluorochrom: | Name | Anregungswellenlänge (nm) | Emission *3 Wellenlänge (nm) | Emissionsfarbe | |
| 4,6-Diamidino-2-phenyl-indol HCI (DAPI) | 345 | 455 | Blau | ||
| Tetramethylrhodamin-Isothyocyanat (TRITC) | 541 | 572 | Rot | ||
| Fluorescein-Isothiocyanat (FITC) | 494 | 519 | Grün | ||
| Cy3 | 552 | 565 | Rot | ||
| Einbaumedium und Immersionsöl: | Name | Brechungsindex des Mediums *1 | |||
| Luft (nichts zwischen Dia und Objektiv) | 1.00029 | ||||
| Antifade-Montagemedium mit DAPI | 1.45 | ||||
| Halterungsmedium für Permount | 1.519 | ||||
| Immersionsöl mit niedriger Autofluoreszenz (MOIL-30 Typ F) | 1.518 | ||||
| Vergrößerungslinse (Plan Fluorite) | Vergrößerung | Numerische Apertur (NA) *2 | Auflösung (μm) | Bild-Pixelabstand (nm) *5 | Schichtabstand Z-Achse (nm) *6 |
| 4-fach | 0.13 | 2.12 | 850 | 3000 | |
| 10-fach | 0.3 | 0.92 | 340 | 3000 | |
| 20-fach | 0.5 | 0.55 | 170 | 2000 | |
| 40-fach | 0.75 | 0.37 | 85 | 1000 | |
| 100-fach | 1.3 | 0.21 | 34 | 1000 | |
Tabelle 2: Spezifikationen für den Mikroskopaufbau und Anforderungen an die Erstellung von PSF-Dateien (Point Spread Function). Es gibt 11 Steckplätze im Beugungs-PSF-3D-Plugin-Fenster, um die PSF-Datei zu erstellen. Jeder Schlitz wird wie folgt beschrieben: *1 - Brechungsindex des Mediums: Brechungsindex für das Medium zwischen Dia und Linse (z. B. Luft = 1,00029). *2 - Numerische Apertur: NA des verwendeten Objektivs (muss korrigiert werden, wenn ein anderes Immersionsmedium verwendet wird und das Objektiv zugewiesen wurde). *3 - Wellenlänge: Fluorochrom maximale Emissionswellenlänge (nm). *4 - Sphärische Longitudinalaberration: 0,00. *5 - Bild-Pixelabstand: CCD-Pixelgröße (nm)/Vergrößerung (z. B. 3,4 μm und 100-faches Objektiv, 3400/100 = 34 nm). *6 - Abstand zwischen den Bildern Z-Achse. *7 - Breite: Geben Sie die Breite des zu entfaltenden Bildes in Pixeln ein. *8 - Höhe: Geben Sie die Höhe des zu entfaltenden Bildes in Pixeln ein. *9 - Tiefe, Slices: die Anzahl der Bilder im Z-Stack. *10 - Normalisierung: Summe der Pixelwerte = 1. *11 - Titel: Gewünschter Name für die PSF-Datei. Die Datei sollte mit dem eindeutigen Z-Stack-Image übereinstimmen.
Diskussion
Die adulte Neurogenese ist ein Prozess, der am häufigsten in Nischen adulter neuronaler Vorläuferzellen auftritt, die das Potenzial haben, während ihrer gesamten Lebensdauer neue Neuronen zu bilden. Die Markierung von Bromdesoxyuridin (BrdU) wird häufig in der Immunologie verwendet, um die Anzahl der neu gebildeten Zellen in einem erwachsenen Gehirn zu charakterisieren. BrdU wird hauptsächlich in Zellen diskreter Hirnregionen (neurogene Zonen) eingebaut. Diese Zellen befinden sich in der subventrikulären Zone (SVZ), dem Gyrus dentatus des Hippocampus – zwischen Hilus und granulären Zellen, die als subgranuläre Zone (SGZ) bezeichnet werden1,2,18. Darüber hinaus gibt es verschiedene Hirnregionen, die durch eine geringere proliferative Kapazität im Erwachsenenalter gekennzeichnet sind, einschließlich des Hypothalamus, des Striatums, des Neokortex und der Amygdala19. Wie bereits erwähnt, ist die BrdU-Färbung die am häufigsten verwendete Methode für die Erforschung der adulten Neurogenese, um die Zellproliferation nachzuweisen. Die Verwendung von BrdU als Marker hat jedoch Einschränkungen und Fallstricke. Die erste ist, dass BrdU ein Zellzyklusmarker ist. Daher muss eine Doppel- oder Dreifachfärbung durchgeführt werden, um das Zellschicksal zu identifizieren und Zellmarker einzubeziehen, um das spezifische Entwicklungsstadium der markierten Zellen zu erkennen. Ein weiteres Problem bei BrdU ist, dass es sich um eine toxische und mutagene Lösung handelt, die die DNA-Stabilität verändert und die Zellfunktion und die Zellzyklen verändern kann. Bei der Entscheidung über die Einhaltung eines Verabreichungsprotokolls und der Verabreichungsdosen (50 bis 600 mg/kg) sollten die vorherigen Informationen berücksichtigt werden. Ein weiteres entscheidendes Merkmal ist, dass BrdU ein DNA-Synthesemarker und kein Zellproliferationsmarkerist 14. Daher ist es wichtig, die Zellproliferation von anderen Ereignissen wie einer DNA-Reparatur, einem abortiven Wiedereintritt in den Zellzyklus und einer Genduplikation zu unterscheiden. Die Forscher müssen geeignete Kontrollen befolgen, um die angemessene Verwendung von BrdU zu gewährleisten. Für eine detailliertere Erörterung dieser Probleme und Einschränkungen empfehlen wir die Lektüre von Taupins Werk14. Der Standardisierungsprozess eines immunhistochemischen Protokolls kann langsam und herausfordernd sein. In dieser Arbeit haben wir alle allgemeinen Schritte vorgestellt, um ein erfolgreiches IHC-Protokoll zu verwalten. Wir empfehlen jedoch, dass jede Forschungsgruppe Gewebe, Antikörper und Bedingungen im Vorfeld testet und bewertet. Tests und Auswertungen müssen mit mindestens drei verschiedenen Inkubationsstufen, Waschschritten und Stärken für jeden getesteten Antikörper und jedes getestete Gewebe durchgeführt werden. Wir empfehlen den Forschern auch, zusätzliche Protokolle zu überprüfen, um das beste zu wählen, das den spezifischen Bedürfnissen und Anforderungen entspricht 20,21,22,23,24,25.
Wie bereits erwähnt, umfasst das Verfahren mehrere Schritte und methodische Überlegungen, die häufig verwendet und in wissenschaftlichen Artikeln erwähnt werden, die später diskutiert werden. Wir empfehlen den Forschern, die Antikörper sorgfältig und korrekt in Bezug auf Technik, Budget, Ausrüstung, Aufbau und Hauptforschungsziel auszuwählen. Antikörper müssen mit der gleichen Art von Gewebe getestet werden, die später im Experiment getestet wird. Wir empfehlen auch die Verwendung eines Antikörpers, der für den gleichen Zweck (IHC) getestet wurde (d.h. nicht nur in Western-Blot- oder Durchflusszytometrie-Techniken), um seine Kompatibilität mit der Fixationstechnik zu testen. Für die Verabreichung der BrdU-Färbung können verschiedene Wege verwendet werden, wie z. B. intraperitoneale Injektion, intraperitoneale Infusion, orale Einnahme oder intraventrikuläre Infusion (für eine detailliertere Beschreibung der einzelnen Techniken siehe Referenz26). Wenn die intraperitoneale Injektion gewählt wird, stellen Sie sicher, dass BrdU in die Peritonealhöhle verabreicht wird, wobei der Darmbereich vermieden wird. Da der Darm mehrere Zellen in Duplikation hat, kann das BrdU erschöpft werden, bevor es zum Gehirn gelangt, was sich auf die Anzahl der markierten Zellen auswirkt. Es ist wichtig, dünne Schliffe zu erhalten, da sie ein besseres Eindringen von Lösungen ermöglichen. Koronale Scheiben von 40 μm Dicke wurden rostro-kaudal geschnitten und nach dem von Kempermann et al. vorgeschlagenen stereologischen Verfahren in eine 24-Well-Zellkulturplatte überführt.27 Die Immunhistochemie kann mit Gewebe auf Objektträgern oder als frei schwebende Schnitte durchgeführt werden. Da sich BrdU tief in den Zellkernen befindet, ermöglicht es das Eindringen von Lösungen in frei schwebenden Abschnitten, was zu besseren Ergebnissen und einem besseren Zugang zum interessierenden Bereich führt. Es ist wichtig, DNA-Bindungen zu öffnen (DNA-Denaturierung), um dem primären Anti-BrdU-Antikörper den Zugang zu ermöglichen. In dieser Arbeit haben wir diese spezifischen Verfahren mit Hilfe der HCI-Inkubation durchgeführt. Auf der anderen Seite ermöglichte der Prozess der Blockierung unspezifischer Epitope eine genauere Identifizierung des Zellsignals.
Die gute Membranpermeabilisierung ermöglicht es den Antikörpern, den Interessenbereich richtig zu durchdringen. Die Zugabe eines Permeabilizers wie Triton X-100 zu PBS++- und PBS+-Lösungen verbessert die Membranpermeabilisierung. Sowohl PBS- als auch Tris-gepufferte Kochsalzlösung (TBS) Reagenzien können in diesem Protokoll verwendet werden. In Bezug auf das Budget könnte die TBS relativ billiger sein als die PBS. PBS könnte jedoch Anti-Phosphat-Antikörper stören und alkalische Phosphatase-konjugierte Antikörper hemmen, so dass die Verwendung von PBS vermieden wird, wenn das Ziel posttranslational durch Phosphorylierung modifiziert (d.h. phosphoryliert) wird. Wir haben das PBS für diese Arbeit verwendet und herausgefunden, dass Gewebewaschschritte ein spezifischeres Signal geben. Wir empfehlen den Forschern auch, mindestens drei Waschzyklen mit TBS oder PBS durchzuführen. Die Lösungen müssen frisch zubereitet werden. Antigen-Retrieval (AR) ist eine Methode, die den Verlust der Antigenität reduzieren soll, der durch die Fixierung verursacht wird, die die Struktur der tertiären und quartären Antigene verändert. Diese Reduktion macht Antigene für Antikörper nicht nachweisbar28,29. Das in diesem Protokoll verwendete hitzeinduzierte Epitop-Retrieval (HIER) versuchte, die chemischen Reaktionen zwischen Formaldehyd und Proteinen durch hohe Temperaturen oder starke alkalische Hydrolyse (mit anderen Pufferlösungen wie EDTA pH 8,5 oder Tris pH 9,5) umzukehren. Es ist wichtig, neue Antikörper mit verschiedenen AR-Protokollen zu testen, um die Ergebnisse zu vergleichen und den besten für das Protokoll auszuwählen. Dieser letzte Schritt kann in einem regulären Protokoll optional sein. Wir haben jedoch Gewebe mit einem Antigen-Retrieval-Protokoll behandelt, um bessere Ergebnisse für dieses Protokoll zu erzielen.
Es ist wichtig, die richtige endgültige Kontrastfarbe und die Gegenfärbungstechnik unter Berücksichtigung der primären Färbefarbe und der Methode auszuwählen, die verwendet wird, um eine nicht färbende Struktur sichtbar zu machen und zu vermeiden, dass die primäre Färbefarbe von der Immunreaktion maskiert wird. Für die Fluoreszenzmikroskopie ist die DAPI (4', 6-Diamidino-2-phenylindol) eine sehr beliebte Kern- und Chromosomen-Gegenfärbung, die bei Bindung an AT-Bereiche der DNA blaue Fluoreszenz (Absorption: 360 nm, Emission: 460 nm) emittiert. DAPI-haltiges Montagemedium ist verfügbar und einfach zu bedienen; Dies bietet eine hervorragende Signalspeicherung für die Bildaufnahme. Für die Peroxidreaktion war IHC in verschiedenen Optionen wie Kresylviolett-, Hämatoxylin-, neutralroter oder methylgrüner Färbung erhältlich. Bei multiplen Immunfärbungstechniken ist es entscheidend, einen kompatiblen Antikörper mit der verwendeten Fixierungstechnik zu wählen, um eine Kreuzreaktivitätzu vermeiden 30. Wenn Probleme und Komplikationen mit der Einzelfärbung behoben sind, verabreichen Sie eine weitere Farbfärbung, wenn dies für notwendig erachtet wird. Entscheidend ist, die unspezifische Bindung zwischen den sekundären Antikörpern zu kontrollieren. Dies könnte durch Sättigung der primären Antikörper erfolgen, bevor ein sekundärer Antikörper verwendet wird, der in derselben Wirtsspezies der primären Antikörper produziert wird. Bei der Verwendung von Anti-Maus-Antikörpern, die in Kaninchen produziert werden, und Anti-Kaninchen, die in Ziegen-Sekundärantikörpern produziert werden, muss der Anti-Kaninchen-Antikörper, der in Ziege produziert wird, vor dem Anti-Maus-Antikörper verwendet werden, der in Kaninchen produziert wird. Wenn die sequentielle Methode vollständig dominiert wird, kann der simultane Immunfärbungsprozess eingeleitet werden. Bei dieser Methode ist es wichtig, sekundäre Antikörper entsprechend auszuwählen. Im Idealfall müssen alle diese Antikörper vom selben Wirtstier stammen, um eine Kreuzreaktivität zu vermeiden. Wir empfehlen, eine Positivkontrolle durchzuführen, um zu bestätigen, dass die Färbemethode im postnatalen Hippocampus-Gewebe (reichlich Neurogenese in diesem Alter) genau funktioniert. Wenn das positive Kontrollgewebe Färbungsprobleme aufweist, überprüfen und wiederholen Sie das Verfahren, nehmen Sie Korrekturen und Anpassungen vor und wiederholen Sie dies, bis eine gute Färbung erzielt wird. Führen Sie dann eine Negativkontrolle durch, um zu testen, ob der Antikörper korrekt funktioniert, indem Sie einen bestimmten primären Antikörper weglassen oder durch normales Serum ersetzen (dieselbe Spezies wie der primäre Antikörper). Wie in der Einleitung erwähnt, ist die Bildentfaltung ein leistungsfähiges Werkzeug und bietet eine Alternative, wenn ein konfokales Mikroskop nicht verfügbar ist. Es kann die Bildentfaltung auf alle Bilder anwenden, die mit Durchlicht-Hellfeld-, Weitfeldfluoreszenz- und konfokaler Fluoreszenzmikroskopie gewonnen wurden. Der letztendliche Zweck der Bildentfaltung besteht darin, das ursprüngliche Signal zu rekonstruieren, dass sich das Erfassungssystem verschlechtert10.
Zusammenfassend lässt sich sagen, dass die Identifizierung der neu erzeugten Zellen, die durch die Immundetektion des Thymidin-Analogons BrdU sichtbar gemacht werden, eine komplizierte, aber leistungsfähige Technik ist. Diese Arbeit ist ein Versuch, Wissenschaftlern, insbesondere auf dem Gebiet der adulten Hippocampus-Neurogenese, zu helfen, neue Zellen genauer zu quantifizieren. Wir hoffen, dass diese Bemühungen für die wissenschaftliche Gemeinschaft hilfreich waren und es einfacher machen, die Untersuchung der Zellproliferation durch die immunhistochemische Technik zu verfeinern.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Wir danken Herrn Miguel Burgos und Gustavo Lago für die technische Unterstützung. Wir möchten uns auch bei Dr. Clorinda Arias, Dr. Karla Hernandez und Dr. Oscar Galicia für ihre freundliche Unterstützung bei der Bereitstellung von Reagenzien und Material bedanken. Wir danken auch der División de Investigación y Posgrado der Universidad Iberoamericana Ciudad de México für die Bereitstellung von Mitteln für die Durchführung dieser Arbeit und für die Deckung der Kosten für die Videoproduktion.
Materialien
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
Referenzen
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- Giannini, A., Giannini, J. 2D and 3D Fluorescence Deconvolution Manual. , Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016).
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667(2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551(2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166(2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten