Method Article
Thymidine Analog BrdU Kullanarak Sıçanlarda Hücresel Proliferasyon ve Nörogenezi Analiz Etmek için İmmünohistokimya Teknikleri
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu makale, sıçanlarda yetişkin nörogenezini ölçmek için BrdU pozitif hücrelerini görselleştirmek için en yaygın tekniklerden dördünü sunmaktadır. Bu çalışma, reaktif hazırlama, timidin analog uygulaması, transkardiyal perfüzyon, doku hazırlığı, peroksidaz immünohistokimyasal reaksiyonu, immünofloresan, sinyal amplifikasyonu, karşı boyama, mikroskopi görüntüleme ve hücre analizi için talimatları içerir.
Özet
Yetişkin hipokampal nörogenez (AHN) alanındaki en önemli şeylerden biri, yeni üretilen hücrelerin tanımlanmasıdır. Timidin analoglarının (5-Bromo-2'-deoksiüridin (BrdU) gibi) immün tespiti, bu yeni üretilen hücreleri görselleştirmek için kullanılan standart bir tekniktir. Bu nedenle, BrdU genellikle küçük hayvanlara intraperitoneal olarak enjekte edilir, bu nedenle timidin analoğu DNA sentezi sırasında bölünen hücrelere dahil edilir. Tespit, beyin dilimlerinin immünohistokimyasal analizi ile gerçekleştirilir. Bu tekniği kullanan her araştırma grubu, başarılı bir leke elde etmek için küçük ayrıntılara özel dikkat gösterilmesi gerektiğini takdir edebilir. Örneğin, önemli bir adım, HCl ile DNA denatürasyonudur ve bu da onu boyamak için hücre çekirdeğine ulaşmasını sağlar. Bununla birlikte, mevcut bilimsel raporlar bu tür adımların çok azını ayrıntılı olarak açıklamaktadır. Bu nedenle, tekniğin standartlaştırılması yeni laboratuvarlar için zordur, çünkü olumlu ve başarılı sonuçlar elde etmek birkaç ay sürebilir. Bu çalışmanın amacı, timidin analog BrdU ile çalışırken immün boyama tekniğinin olumlu ve başarılı sonuçlarını elde etmek için atılan adımları ayrıntılı olarak tanımlamak ve detaylandırmaktır. Protokol, reaktif hazırlama ve kurulumu, bir kemirgende timidin analoğunun uygulanması, transkardiyal perfüzyon, doku preparasyonu, peroksidaz immünohistokimyasal reaksiyonu, avidin-biyotin kompleksinin kullanımı, immünofloresans, karşı boyama, mikroskopi görüntüleme ve hücre analizini içerir.
Giriş
Yaşam süresi boyunca yetişkin insan beyninde yeni nöronların üretildiği fikri, bilim camiasını on yıllardır büyülemiştir. Beynin ömrü boyunca yeni nöronlar ürettiği bilgisi,bölüm 1,2 altındaki hücrelerin tespiti ile elde edildi. Yetişkin beyninde yeni üretilen nöronların tespiti ilk olarak sıçanlarda intrakraniyal olarak tritiye timidin (timidin-H3) enjekte edilmesi ve hücre döngüsündeki hücrelerin otoradyogramlar 1,2 ile tespit edilmesi ile tanımlanmıştır. Glia'nın hücre bölünmesi ve nöroblastların varlığı bildirilmiştir, bu da doğum sonrası nörogenez1 ile ilgili ilk umut verici verilerdir. Bununla birlikte, timidin-H3'ün kullanımı ve tespiti, onu yöneten insanlara zararlı olabilecek radyoaktivite kullanımını ima etmiştir. BrdU immünohistokimyasının sinir sistemlerindeki hücrelerin proliferasyon, migrasyon ve kökeni çalışmalarındaki uygunluğunu inceleyen ilk çaba 1988'de Miller ve Nowakowski3 tarafından ortaya çıktı. 1998 yılında, Eriksson ve meslektaşları tarafından yayınlanan bir makale, 5-Bromo-2′-deoksiüridin (BrdU)4 enjekte edilen hastaların insan yetişkin beyninde yeni nöronların ölüm sonrası görselleştirildiğini gösterdi. Bu hastalara tümörlerin büyümesini etiketlemek için BrdU enjeksiyonu (250 mg intravenöz)4 verildi. Bu teknik hayvan modellerine uyarlandı. Bu yöntemlerin tanıtılması, alan için bir kilometre taşını işaret etti, çünkü bu, radyoaktif bileşikler kullanılmadan yeni üretilen hücrelerin tespit edilmesine izin verdi. Bu prosedür, bu alanda daha fazla araştırmayı teşvik etmek için yetişkin beyin nişlerinde hücre proliferasyonunu ölçmek için altın standart haline geldi.
Timidin analog tekniğinin sınırlılığı, yeni üretilen hücreler için hücresel kimliğin belirlenmesine izin vermemesidir. Bununla birlikte, immünohistokimya, aynı hücrenin çift veya üçlü etiketleme tekniğini gerçekleştirmemize izin verir, bu da yeni üretilen hücrelerin hücresel kaderini ve hatta olgunlaşma aşamalarını doğrular ve alanın daha da gelişmesine yol açar. Bu yöntem, yeni üretilen hücreleri glia, farklılaşmamış nöronlar veya tamamen olgun granüler bir hücreye ayırt etmek ve hatta devreye aktif olarak katılıp katılmadıklarını belirlemek için karakterize edildi. Bu alandaki bir diğer atılım, nestin alanı altındaki farklılaşmamış hücreleri tanımlamak için transgenik modellerin kullanılmasıydı. Nestin-GFP transgenik fareler, nestin promotörünün kontrolü altında olan gelişmiş bir yeşil floresan proteini (GFP) ifade eder. Nestin, progenitör hücreler5 ile karakterize bir ara filamenttir. Nestin-GFP transgenik fareler, nörogenez6'da yer alan erken gelişimsel adımları belirlemeye izin verdi. Bununla birlikte, önemli bir sınırlama, bir nestin-GFP transgenik fare kolonisini, bazı bilimsel gruplar, özellikle de gelişmekte olan ülkelerden gelenler için uygun maliyetli hale gelen bir laboratuvar tesisinde özel koşullar altında sürdürebilmektir.
Yukarıda belirtilen tekniklerin avantajları ve dezavantajları vardır. Bununla birlikte, proliferasyon yapan hücrelerin immünohistokimya (IHC) ile tanımlanması ve hücre olgunlaşma aşamasını veya hücre kaderini tanımlamak için immünofloresan ile çift veya üçlü etiketleme tekniği uygulama olasılığı, yetişkin nörogenezini ölçmenin şimdiye kadarki en uygun yolunu temsil etmektedir. İmmünohistokimyayı kullanan tanımlama işlemi, proteinlerin, protein alanının veya nükleotidlerin, birincil antikor olarak bilinen tanınmalarını sağlayan spesifik bir antikor ile etiketlenmesinden oluşur. İkincisi, ikincil antikor ile birlikte bir kromojen (örneğin, yaban turpu peroksidaz) veya bir florokrom (örneğin, FITC) ile işaretlenmiş ikincil antikor tarafından tanınır. Mikroskoplar hem kromojenler hem de florokrom sinyallerini algılayabilir. IHC kullanarak, membran proteinlerini, sitoiskelet proteinlerini veya BrdU gibi nükleer bileşenleri tanımlamak mümkündür. Öte yandan, BrdU, hücresel çekirdekte bulunabilir, çünkü S-fazı sırasında DNA'ya rekabet yoluyla dahil edilir. Bu nedenle, çok önemli bir adım, BrdU antikorunun DNA içindeki BrdU'ya erişmesine izin vermek için DNA bağlarını açan HCl ile DNA denatürasyonudur. BrdU'nun, intraperitoneal uygulamadan sonra sırasıyla 15 ve 60 dakika boyunca farelerde ve sıçan serumunda doymuş bir konsantrasyonda mevcut olduğunu bilmek önemlidir, daha sonra sırasıyla 60 ve 120 dakikada tespit edilemeyen seviyelere hızla düşer7.
Burada, dört farklı fakat yakından ilişkili IHC tekniğini tanımlamaktayız: yaban turpu peroksidaz (HRP) reaksiyonu kullanılarak kromojenik dolaylı tespit, DAB (3,3'-diaminobenzidin) sans sinyal amplifikasyonu (adım 4.1), avidin-biyotin kompleksi (ABC) amplifikasyonu (adım 4.1), sinyal amplifikasyonu olmadan dolaylı immünofloresan tespiti (adım 4.4) ve etiketli streptavidin-biyotin (LSAB) amplifikasyonu (adım 4.3). Her yöntemin avantajları ve dezavantajları vardır ve spesifik doku gereksinimleri için yararlı olabilir (bkz. Tablo 1). Konjuge olmayan primer antikorları kullanırken kromojenik tespit yöntemlerinden floresan tespit yöntemlerine geçiş yapmak için uygun fiyatlı olmaları ve basitlikleri nedeniyle dolaylı ICH yöntemlerini izlemeye karar verdik. HRP yaklaşımı, satın alınabilirliği, yüksek istikrarı, yüksek devir hızı ve alt tabakaların tam kullanılabilirliği nedeniyle yaygın olarak kullanılan bir IHC yöntemidir. Bununla birlikte, boyama yönteminin doğru çalıştığını doğrulamak için pozitif bir kontrol kullanılmasını ve antikor fonksiyonunu etkili bir şekilde test etmek için negatif kontrolün kullanılmasını öneririz. Çoklu immünoboyamalar veya multipleks IHC yöntemleri (bkz. adım 6), tek bir deneyde doku bölümünden büyük miktarda veri elde etmek için güçlü araçlardır. Bu teknik, numunelerin mevcudiyeti sınırlı olduğunda özellikle önemlidir. Diğer bir avantaj, doku bütünlüğünü korurken aynı hücresel alanda birlikte eksprese edilen spesifik proteinleri aynı anda tanımlama olasılığıdır. Multipleks, spesifik proliferatif aşamalarda (örneğin, nestin, GFAP, DCX, Ki-67) ifade edilen farklı belirteçlerin boyanmasına izin vererek daha ayrıntılı bir proliferasyon ve farklılaşma araştırmasına ulaşmamızı sağlar8. Çapraz reaktiviteyi önlemek için kullanılan fiksasyon tekniği ile uyumlu antikorların seçilmesi çok önemlidir. Yöntemi ayarlamak ve hassaslaştırmak için her yeni antikorun (BrdU dahil) ayrı ayrı test edilmesini öneririz. Daha sonra, çift sıralı boyamayı uygulayın ve son olarak, sıralı yönteme tamamen hakim olduğunda eşzamanlı immün boyama işlemine başlayın. Bu yöntem için uygun sekonder antikorların seçilmesi çok önemlidir.
| Yöntem | Özel Yöntem | Avantaj -ları | Dezavantaj -ları |
| Dolaylı Algılama Yöntemi | DAB ile peroksidaz reaksiyonu | 1. Doğrudan algılama ve dolaylı floresan yönteminden daha yüksek hassasiyet. 2. Fotobeyazlatmaya karşı florokromlardan daha yüksek direnç. 3. Floresan algılama yönteminden daha düşük maliyet | 1. Daha az renk boyasıyla Çoklama için zor. 2. Aynı hücresel uzaydaki Birlikte eksprese edilen hedefler için karmaşıktır. 3. Aynı doku üzerinde eşzamanlı kıt ve yüksek bol hedefler için Azaltılmış Dinamik Aralık. |
| Flore -san | 1. Daha fazla renk boyasıyla Çoklama için en iyi ve en kolay. 2. Aynı hücresel uzaydaki Birlikte ifade edilen hedefler için en iyisidir. 3. Aynı doku üzerinde eşzamanlı kıt ve yüksek bol hedefler için Daha İyi Dinamik Aralık. 4. Ek Adım Yok. | 1. DAB yöntemi ile dolaylı peroksidaz reaksiyonundan daha düşük hassasiyet. 2. Zamanla Fotobeyazlatmaya karşı zayıf direnç. 3. Daha pahalı. | |
| Sinyal Amplifikasyon Yöntemi | Avidin-Biotin Kompleksi (ABC) | 1. Doğrudan ve dolaylı algılama yönteminden daha yüksek hassasiyet. 2. Arka planı azaltın | 1. Ek Adımlar. 2. Amplifikasyondan daha pahalı. |
| Etiketli Streptavidin-Biotin (LSAB) | 1. Doğrudan ve dolaylı algılama yönteminden daha yüksek hassasiyet. 2. ABC yönteminden daha önemli doku penetrasyonu. 3. Arka planı azaltın | 1. Ek Adımlar. 2. ABC yönteminden daha pahalı. | |
| Ek amplifikasyon yöntemi değil | 1. Daha düşük maliyet. 2. Ek adım yok. 3. Yüksek bol hedefler için idealdir. | 1. Düşük hassasiyet: bol miktarda hedef olmadan sorunlu. |
Tablo 1: İHH tekniklerinin avantajları/dezavantajları. Bu tablo dolaylı tespit yöntemlerinin avantajlarını/dezavantajlarını göstermektedir: (3,3'-diaminobenzidin) DAB ve floresan ile peroksidaz reaksiyonu; ve sinyal amplifikasyon yöntemleri: avidin-biyotin kompleksi (ABC), streptavidin-biotin (LSAB) etiketli ve ek amplifikasyon yöntemi değil.
Yüksek çözünürlüklü bir görüntü, doğru analiz yapmak ve sonuçları sunmak için esastır. Çözünürlüğü artırmak için iki yaklaşım vardır: 1) daha iyi bir mikroskop tasarımının kullanılması (örneğin, konfokal, multifoton) veya 2) dekonvolüsyon kullanarak görüntüleri geliştirmek için bulanıklaştırma işlemini sayısal olarak tersine çevirmek9. Ne yazık ki, konfokal mikroskopi, ekipmanın yüksek maliyetleri ve servis10 nedeniyle uygun değildir. Geniş alan epifloresan mikroskobu ve ardından z-yığını görüntülerinin dekonvolüsyonu, konfokal mikroskopi 8,9'a uygun, düşük maliyetli bir alternatif sağlar. Yukarıda belirtildiği gibi, dekonvolüsyon amacı, matematiksel kaldırma algoritmalarını kullanarak bir epifloresan veya konfokal mikroskop tarafından elde edilen görüntüde gösterilen bulanıklığı, odak dışı bulanıklığı ve bozulmayı azaltarak edinme sistemi9 tarafından bozulan orijinal sinyali geri yüklemektir10. Elde edilen bulanık görüntü, gözlemlenen nesnelerin bir 3B nokta yayılma fonksiyonu (PSF) ile birleştirilmesinin sonucu olarak matematiksel olarak modellenebilir. PSF, doku örneği tarafından yayılan ve mikroskop tarafından toplanan ışık noktalarının teorik bir kırınım paternidir. PSF dosyası, kameranın CCD hücre aralığı, kullanılan ortamın kırılma indisi, objektif lensin sayısal açıklığı, floroforun emisyon dalga boyu, görüntü boyutları, z-yığını işleme yöntemindeki görüntü sayısı ve aralarındaki boşluk gibi her görüntünün özel koşullarıyla oluşturulur (bkz. Tablo 2'deki teknik özellikler). Başka bir deyişle, PSF dosyası görüntüleme kurulumunun mikroskop gözlemleri üzerindeki etkilerini özetlemektedir9. Ancak, her z-stack görüntüsü için kendi özel PSF dosyamızı oluşturmak üzere kırınım PSF 3D Eklentisini (https://imagej.net/Diffraction_PSF_3D) kullanıyoruz. Z-yığını görüntüleri, slaytın aynı XY konumundaki tanımlanmış derinliklerden (z ekseni) bir dizi sayısallaştırılmış optik bölümdür. Bir bilgisayar, diğer odak düzlemlerinde bulunan nesnelerden kaynaklanan sinyalleri yeniden atayarak odak düzleminden elde edilen bilgileri derler. Z-stack görüntüleri oluşturmak için, slaytların farklı odaklanmış katmanlarından görüntüler çekmek gerekir (örneğin, her 1 μm derinlikte aynı XY alanının on farklı görüntüsü). Ardından, bir z-yığını veya 3D görüntü oluşturmak için üretici veya Fiji tarafından sağlanan mikroskopi yazılımını kullanıyoruz. Sonuç tek bir yığın görüntü dosyası olacaktır (örneğin, farklı odaklara sahip on görüntü). Dekonvolüsyon mikroskobu için açık kaynaklı yazılım gibi müşteriye özel birkaç araç ve yazılım çözümü vardır. Bir Fiji 2 eklentisi olan DeconvolutionLab29'u (ImageJ12'nin dağıtımı) kullanarak dekonvolüsyon işleminin çıktılarını göstereceğiz. Dekonvolüsyon, nihai mikrografların çözünürlüğünü artırmaya yardımcı olacaktır (bkz. Şekil 1B, C). Daha fazla bilgi ve talimat için, referans13'ü okumanızı şiddetle tavsiye ederiz.
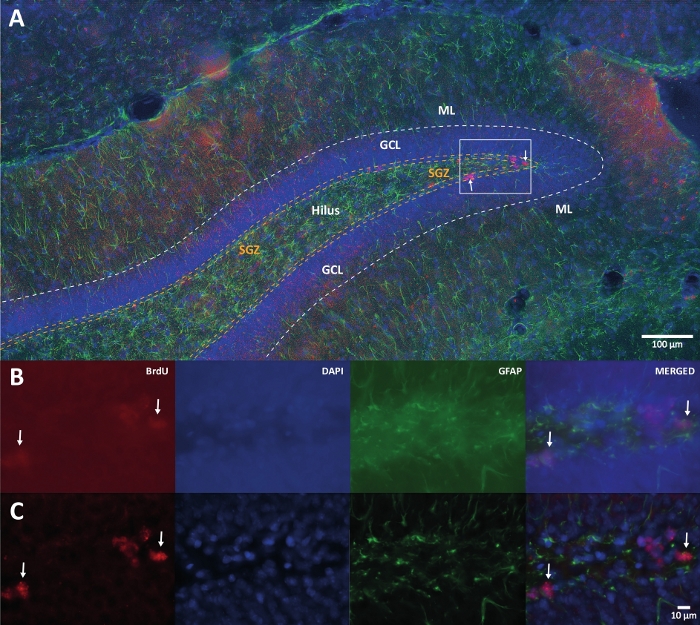
Şekil 1: Birden fazla renk kanalı için 3B dekonvolüsyonun temsili görüntüsü. (A) Düşük büyütmede DG. (B) Her kanal ve birleştirilmiş görüntü için orijinal z-stack görüntüleri. (C) Her kanal ve birleştirilmiş görüntü için 3B dekonvolüsyonlu z-stack görüntüleri. Bu beyin, fiziksel aktivite grubunun bir parçası olan sıçandandı. Etiketli streptavidin-biotin (LSAB) amplifikasyon yöntemi kullanıldı. BrdU'yu (kırmızı), karşı boyama (mavi) olarak DAPI'yi ve astroglial belirteç (yeşil) olarak glial fibriler asidik proteini (GFAP) belirtmek için Cy3 streptavidin konjuge antikoru gösterdi. ML = moleküler tabaka; GCL = granüler hücre tabakası; SGZ = alt granüler bölge. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Bu çalışmanın amacı, immünoboyama ile olumlu ve başarılı sonuçlar elde etmek için atılan adımların ayrıntılı bir tanımını sağlamak ve konfokal mikroskop kullanmadan BrdU tabanlı çalışmalarda yaygın olarak kullanılan adımları listelemektir. BrdU boyama, başarılı bir leke elde etmek için dikkatle izlenmesi gereken birkaç adım gerektiren bir tekniktir. Bu boyama tekniklerinin standartlaştırılması tipik olarak aylar sürer ve zaman ve kaynak yoğundur. Bu makalenin, zamanı ve hataları azaltarak bu alanda başlayan gruplara bilgi sağlayabileceğini öngördük.
Protokol
Tüm prosedürler, laboratuvar hayvanlarının bakımı ve kullanımı için Ulusal Sağlık Enstitüleri kılavuzunu (NIH Yayınları N°. 8023, 1978'de revize edilmiştir) ve kullanılan hayvan sayısını ve acılarını en aza indirmek için yerel Meksika yasalarını takip eder. Universidad Iberoamericana Etik Kurulu, bu çalışmada hayvanların kullanımı için deneysel protokolleri onayladı.
1. Reaktif hazırlama ve kurma
NOT: Çözümlerin çoğu, aksi belirtilmedikçe kullanımdan günler önce hazırlanabilir.
- BrdU çözümü
- BrdU çözeltisini -20 °C dondurucudan alın ve oda sıcaklığında (RT) dengelenmesini sağlayın.
- Sıçanın vücut ağırlığına göre 50 mg / kg'lık bir doz için gereken BrdU kütlesini hesaplayın. 20 mg/mL'lik bir çalışma çözeltisi için gerekli olan %0,9 tuzlu su çözeltisinin (100 mL steril H2O'da 0,9 g NaCl) hacmini hesaplayın. Enjeksiyon başına sıçan başına en az 0,5 mL sağlamak için bir fazlalık hazırlayın.
NOT: Deney hayvanlarına uygulanan doz güvenli, minimum yan etki ile ve etkili olmalıdır. 100 mg / kg BrdU ile boyama süresinin, 50 mg / kg doz7 ile karşılaştırıldığında potansiyel olarak daha yüksek toksisiteden daha ağır basmadığı bildirilmiştir. Sıçanlarda 50 ve 100 mg / kg i.p. için BrdU etiketli hücrelerin /mm3 sayısında anlamlı bir fark bulunmamıştır7. Hayvanların acısını en aza indirmek için küçük bir doz enjekte edilmesi tercih edilir. - BrdU çözeltisini tartın ve konik bir tüp ve girdaptaki tuzlu su çözeltisine ekleyin.
NOT: Tuzlu su çözeltisini 45\u201250 °C'de bir su banyosunda 1 mL'den büyük hacimler için önceden ısıtın. - Tüpü 10\u201215 dakika boyunca 50 °C'de bir su banyosuna yerleştirin ve tamamen çözünene kadar her 2\u20123 dakikada bir vorteks. Steril enjeksiyon için çözeltiyi bir şırınga filtresi ile filtreleyin. Tüpü teneke folyo ile örtün, oda sıcaklığında soğutun ve hemen kullanın.
DİKKAT: BrdU çözeltisi toksiktir ve potansiyel olarak kanserojendir. Duman davlumbazında hazırlayın. BrdU çözeltisi uygun koruyucu ekipman (KKD) ile kullanılmalıdır. Çözeltinin kullanımdan hemen önce hazırlanması önerilir. Bununla birlikte, çözelti RT altında 24 saat boyunca kararlıdır. Lütfen ışıktan koruyun.
- pH 7.4'te 1 L 0.1 M fosfat tamponlu salin (PBS) hazırlamak için, sürekli karıştırma altında 240 mg potasyum fosfat monobazik (KH 2 PO 4), 1.44 g sodyum fosfat dibazik (Na 2 HPO4), 200 mg potasyum klorür (KCl) ve 8 g sodyum klorür (NaCl) ila 800 mL çift damıtılmış su (ddH2O) ekleyin. PH'ı 7,4'e ayarlayın ve toplam 1 L hacme kadar çift damıtılmışH2O ekleyin.
- 100 mL PBS+ için, %3 (3 mL) normal at serumu ve %0,3 (300 μL) Triton X-100 ila 0,1 M PBS (pH 7,4) ekleyin. 20\u201250 mL alikotlarda -20 °C'de 3 aya kadar saklayın.
NOT: Alternatif olarak, PBS yerine TBS kullanılabilir. Konağın antikorlarından ve deney dokusundan farklı başka herhangi bir serum uygundur. - 100 mL PBS++ için, %10 (10 mL) normal at serumu ve %0,3 (300 μL) Triton X-100 ila 0,1 M PBS pH 7,4 ekleyin. 20\u201250 mL alikotlarda -20 °C'de 3 aya kadar saklayın.
- 1 L kriyoprotektan çözeltisi için, 250 mL etilen glikol ve 250 mL gliserol karıştırın, karışana kadar sürekli karıştırın. PBS ile yavaşça 1 L'ye getirin. 4. sınıf (20\u201225 μm) filtre kağıdı ile filtreleyin. 4 °C veya RT'de 1 yıla kadar saklayın.
- 0.1 M PBS (PFA çözeltisi) içinde% 4 paraformaldehit hazırlayın. 1 L çözelti için, sürekli karıştırma altında 800 mL'lik 60\u201265 °C 0.1 M PBS'ye yavaşça 40 g paraformaldehit tozu ekleyin. Sıcaklığı kontrol ederken paraformaldehit tamamen çözünene kadar karıştırın (60\u201265 °C). Gerekirse, çözeltiyi açıklığa kavuşturmak için birkaç damla 1 M NaOH ekleyin. Çözelti oda sıcaklığına ulaştığında, 4. sınıf (20-25 μm) filtre kağıdı ile filtreleyin.
DİKKAT: Paraformaldehit toksiktir ve duman başlığında hazırlanan kanserojen olduğundan şüphelenilmektedir. 4 ° C'de saklayın ve tercihen 2 gün içinde kullanın. PFA kullanıma hazır çözüm ticari olarak temin edilebilir. - pH 6'da 1 L 10 mM Sodyum sitrat tamponu (SCB) için, sürekli karıştırma altında 800 mL çift damıtılmış H2 O'ya1.204g sodyum sitrat (dihidrat) ve 1.134 g sitrik asit ekleyin. PH'ı 6,0'a ayarlayın ve ddH2O'yu 1 L'ye kadar ekleyin 4 °C'de 6 aya kadar saklayın.
- Sürekli karıştırma altında 41,75 mL ddH 2 O'ya yavaşça 8,25 mL 12 N HCl (konsantre stok çözeltisi) ekleyerek 50 mL2N HCl hazırlayın.
DİKKAT: Duman davlumbazında hazırlayın. Çözelti kullanımdan hemen önce hazırlanmalıdır.
NOT: 2 N HCl, DNA denatürasyonu için çok önemli bir adım olarak kullanılacaktır. BrdU DNA'ya dahil edildiğinden, HCl, BrdU antikorunun DNA içindeki BrdU'ya erişmesine izin veren DNA bağlarını açmak için kullanılır. - Endojen peroksidaz bloke edici çözeltiyi aşağıdaki gibi hazırlayın. Sürekli karıştırma altında 2 mL% 30 hidrojen peroksit ile 98 mLddH 2O karıştırarak 100 mL% 0.6 hidrojen peroksit hazırlayın.
NOT: Çözelti kullanımdan hemen önce hazırlanmalıdır. H2 O2 ışığa duyarlıolduğu için karanlıkta tutun. Su yerine PBS veya TBS kullanılabilir. - Avidin-biyotin kompleksi (ABC) çözeltisini üreticinin talimatlarına göre hazırlayın. 0.1 M PBS'de 5 mL ABC için, 2 damla (≈100 μL) reaktif A ekleyin ve karıştırın ve ardından 2 damla (≈100 μL) reaktif B ekleyin ve karıştırın.
NOT: Çözelti hazırlanmalı ve kullanımdan önce 20\u201230 dakika boyunca yuvarlanmasına izin verilmelidir. - Üreticinin talimatlarını izleyerek kiti kullanarak DAB (Diaminobenzidin) Peroksidaz (HRP) substratını hazırlayın. 5 mL'lik ddH 2 O'ya 2 damla (≈ 84 μL) reaktif 1 ekleyin ve karıştırın, 4 damla (≈ 100 μL) reaktif 2 ekleyin ve karıştırın, ardından2damla (≈ 80 μL) reaktif 3 ekleyin ve karıştırın. Son olarak, istenirse, 2 damla (≈ 80 μL) reaktif 4 (Nikel) ekleyin ve karıştırın.
NOT: Çözelti kullanımdan hemen önce hazırlanmalıdır.
DİKKAT: DAB toksiktir ve potansiyel olarak kanserojendir. Her kurumdaki tehlikeli atık yönetmeliğine göre dikkatli bir şekilde ele alınmalı ve atılmalıdır. DAB'ı inaktive etmek için, birkaç damla ağartıcı (sodyum hipoklorit) ekleyin; çözüm siyaha dönecektir. - 55\u201260 °C'de 80 mL ddH 2 O'ya 100 mg kreşil menekşe asetat ve250μL asetik asit ekleyerek 100 mL cresyl violet çözeltisi hazırlayın. Ses seviyesini 100 mL'ye ayarlayın, filtreleyin ve koyu renkli bir kapta 4 ° C'de saklayın.
NOT: Kullanıcının, değerli doku numuneleri üzerinde kullanmadan önce cresyl violet çözeltisinin farklı konsantrasyonlarını test etmesi önerilir. Sonuç, bazı doku örnekleriyle karşı boyama için daha koyu olabilir, bu da BrdU pozitif hücrelerini doğru bir şekilde sayma yeteneğini azaltabilir.
2. Timidin analog BrdU uygulaması
- Alt karın boşluğunu hareketsiz hale getirerek deney hayvanını (örneğin, 350 g ağırlığındaki 90 günlük erkek Wistar faresi) kısıtlayın.
- BrdU çözeltisini (50 mg / kg) intraperitoneal olarak (yani 23 G iğne ve 1 mL şırınga kullanarak uygulayın.
NOT: Enjeksiyon hacmini hayvanın ağırlığına göre ayarlayın. Yetişkin sıçanlar için 23\u201227 G iğne ve 1\u20125 mL şırınga kullanın. Yetişkin sıçanlarda maksimum tolere edilebilir intraperitoneal enjeksiyon hacmi 10 mL'dir. BrdU çözümü14'ü yönetmek için farklı yollar kullanılabilir. Örneğin, intraperitoneal enjeksiyon veya içme suyu yoluyla oral uygulama.
3. Doku hazırlığı
NOT: Üç aylık sıçanların yedi gün boyunca fiziksel aktiviteye (sonsuz tekerlek) ad libitum erişimine izin verildi. 6. günde, sıçanlara 12 saatlik aralıklarla 3 kez BrdU (adım 2) enjekte edildi. Son BrdU enjeksiyonundan 8 saat sonra bölüm 3'teki adımları uygulayın.
- Pentobarbital (50 mg / kg i.p.) enjekte edin ve hayvan derinlemesine uyuşturulana kadar birkaç dakika bekleyin.
NOT: Devam etmeden önce hayvanın tamamen anestezi aldığından emin olun. Bacaklardan birini veya kuyruğu dikkatlice sıkıştırın. Hayvan uyarana tepki verirse, birkaç dakika daha bekleyin. Hayvan sıkışmaya tepki vermezse, bir sonraki adıma geçin. - Göğüs kemiğinin altındaki karın boşluğu derisini keserek, kaburgaları ayırarak ve diyaframı keserek kalbi açığa çıkarın.
- Transkardiyal perfüzyon fiksasyonu
- Sol ventriküle bir iğne yerleştirin ve sağ atriyumda küçük bir kesi yapın. Bir pompa veya yerçekimi kullanarak, tüm kan boşaltılana ve çözelti netleşene kadar perfüze (akış hızı 5 \ u20127 mL / dak.) 0.1 M PBS.
- Bir pompa veya yerçekimi kullanarak, kuyruk sertleşene kadar dokuyu sabitlemek için PFA çözeltisi ile soğuk perfüzyon (akış hızı 5 \ u20127 mL / dak) gerçekleştirin.
NOT: Genellikle, 300 g'lık bir sıçan yaklaşık 100\u2012150 mL PFA çözeltisi gerektirir. Doku fiksasyonu isteğe bağlıdır. Böylece, deneylerde hayvan kullanımını en aza indirmek için beyin çeşitli süreçlerde kullanılmak üzere çıkarılabilir.
- Diseksiyon ve postfiksasyon
- Hayvanın kafasını kesin ve beyni kafatasından yavaşça çıkarın. Beyni, 4 ° C'de 1 \ u20122 gün boyunca PFA çözeltisi (250 mg'lık bir sıçan için ~ 40 mL) içeren konik bir tüpe daldırın.
NOT: Aşırı fiksasyon yapmayın (48 saatten fazla), çünkü bu, antijenlerin bulunmaması nedeniyle doku lekelenmesini tüketebilir. - Sürekli karıştırma altında 70 mL'lik 0,1 M PBS çözeltisine 30 g sakkaroz ekleyerek 100 mL% 30 sakkaroz çözeltisi hazırlayın. 100 mL'ye 0,1 M PBS çözümü ekleyin. Beyin tüpün dibine batana kadar beyni 4 ° C'de yaklaşık 1\u20122 gün boyunca% 30 sakkaroz çözeltisi (35 mL) ile konik bir tüpe batırın.
- Hayvanın kafasını kesin ve beyni kafatasından yavaşça çıkarın. Beyni, 4 ° C'de 1 \ u20122 gün boyunca PFA çözeltisi (250 mg'lık bir sıçan için ~ 40 mL) içeren konik bir tüpe daldırın.
- Koronal beyin bölümlerinin kesilmesi
NOT: Kriyostat-mikrotom kullanmak rehberlik ve eğitim gerektirir. Ayrıntılı talimatlar için referans15'e bakın.- Tüm beyni -80 ° C'de izo-pentana batırın ve 10 dakika boyunca -80 ° C'de tutun. Beyni kriyostat-mikrotom plakası üzerine gömme matrisine yerleştirin.
NOT: Belirli koşullar altında, beynin -80 ° C'de hızlı bir şekilde donması, dokuda kırılmaya veya hasara neden olabilir. Kullanıcı bu sorunun farkında olmalıdır. Bu durumda, beyni dondurmak için -20 °C izo-pentan kullanın. - Bir kriyostat-mikrotom kullanarak (-25 ila -20 ° C'de sıcaklık) 40 μm kalınlığındaki koronal bölümleri kesin. Kesitleri, Şekil 2'deki kılavuzu izleyerek kriyoproteksiyon çözeltisi ile 24 delikli bir hücre kültürü plakasına sırayla aktarın. Kullanıma kadar -20 °C'de birkaç aya kadar saklayın.
NOT: Bundan sonra, tüm dokuları 40 μm'lik serbest yüzen seri kesitlerde, 12 delikli plakalarda, ağ uçları ile nazik ve sürekli çalkalamada (10 rpm) işleyin. Beyin kesitlerini yıllarca doğru koşullarda saklamak mümkündür.
- Tüm beyni -80 ° C'de izo-pentana batırın ve 10 dakika boyunca -80 ° C'de tutun. Beyni kriyostat-mikrotom plakası üzerine gömme matrisine yerleştirin.
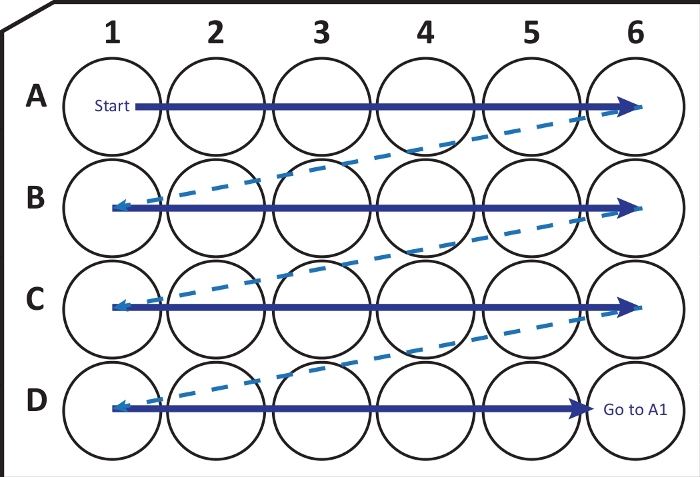
Şekil 2: Kriyostat-mikrotomdan kriyoproteksiyon çözeltisi ile 24 delikli bir hücre kültürü plakasına seksiyonların sırayla aktarılmasının şematik gösterimi. A1 kuyusundan başlayın ve sonraki dilimleri A satırına yerleştirin; A6 kuyusundan sonra bir sonraki B satırına geçin, vb. D6'ya vardığınızda, A1'e geri dönün ve devam edin. Bu düzenleme, tüm beyin bölgesinin Nth (örneğin, nörogenez için altıncı, bir sütunun içeriğine eşdeğer) bölüm nicelleştirilmesine izin verir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. İmmün boyama
NOT: Her tekniğin avantaj ve dezavantajlarının özeti için Tablo 1'e bakınız.
- DAB ile peroksidaz reaksiyonu kullanılarak BrdU'nun tespiti
NOT: 1. günde 4.1.1 ile 4.1.5 arasındaki adımları uygulayın.- Dilimleri kriyoproteksiyon çözeltisinden oda sıcaklığında 0,1 M PBS'ye aktarın. 0,1 M PBS ile her biri 10 dakika boyunca üç kez durulayın.
- Endojen peroksidazları inaktive etmek için endojen peroksidaz bloke edici çözeltide 30 dakika boyunca dilimleri inkübe edin. 0,1 M PBS ile her biri 10 dakika olmak üzere 3 kez durulayın. İsteğe bağlı olarak, antijen alımı gerçekleştirin (bkz. bölüm 5). 37 °C'de 2 N HCl ile dilimleri 20 dakika boyunca inkübe edin. 0,1 M borat tamponunda (8,5 pH) 10 dakika boyunca durulayın. Her biri 10 dakika boyunca 3 kez, buz gibi soğuk 0,1 M PBS ile durulayın.
- PBS++ (blokaj çözeltisi) ile oda sıcaklığında dilimleri 2 saat inkübe edin. 4 ° C'de bir gecede PBS + 'da 1:250 konsantrasyonunda anti-BrdU primer antikoru (fare konağı) ile inkübe edin.
- 2. günde, dilimleri her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- PBS+ 'da 1:250 HRP konjuge sekonjuge sekonder antikor (fare karşıtı) ile oda sıcaklığında 2\u20124 saat boyunca inkübe edin. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- Dilimleri DAB Peroksidaz (HRP) Substrat çözeltisine aktarın ve 2\u201210 dakika kuluçkaya yatırın. Dilimler koyu gri olduğunda, dokuyu bir büyüteç veya mikroskopla görselleştirin. Pozitif hücreler varsa, musluk suyuyla (arka planı azaltmak için) 3 kez (her biri 15 dakika boyunca) durulayın. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez yıkayın.
- Dilimleri jelatinli slaytlara yumuşak bir fırça kullanarak dikkatlice monte edin, oda sıcaklığında gece boyunca hava ile kurutun. Karşı leke (bakınız bölüm 7.1), kalıcı montaj ortamı ekleyin ve kapak fişleri yerleştirin. 4 °C'de 6 aya kadar saklayın.
- Avidin-biotin-peroksidaz kompleksi ile peroksidaz reaksiyonu kullanılarak BrdU'nun tespiti
NOT: 1. günde 4.2.1 ile 4.2.5 arasındaki adımları uygulayın.- Oda sıcaklığına getirmek için dilimleri kriyoproteksiyon çözeltisinden 0,1 M PBS'ye aktarın. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- Endojen peroksidazı inaktive etmek için endojen peroksidaz bloke edici çözelti ile 30 dakika boyunca inkübe edin. 0,1 M PBS'de her biri 10 dakika boyunca 3 kez durulayın. İsteğe bağlı olarak, antijen alımı gerçekleştirin (bkz. bölüm 5).
- 37 °C'de 2 N HCl ile 20 dakika boyunca kuluçkaya yatırın. 0,1 M borat tamponda (pH 8,5) 10 dakika durulayın. Her biri 10 dakika boyunca 3 kez buz gibi soğuk 0,1 M PBS ile yıkayın.
- PBS ++ 'da oda sıcaklığında 2 saat inkübe edin (engelleme çözeltisi).
- PBS+'da anti-BrdU primer antikoru (fare konağı) 1:250 ile gece boyunca 4°C'de inkübe edin.
- 2. günde, her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- PBS+'da 1:250 biyotinile sekonder antikor (fare karşıtı) ile oda sıcaklığında 2\u20124 saat boyunca inkübe edin. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- ABC çözeltisinde oda sıcaklığında 1 saat boyunca inkübe edin. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- Dilimleri DAB peroksidaz (HRP) substrat çözeltisine aktarın ve 2\u201210 dakika boyunca inkübe edin. Dilimler koyu gri olduğunda, dokuyu bir büyüteç veya mikroskopla görselleştirin. Pozitif hücreler varsa, musluk suyuyla (arka planı azaltmak için) 3 kez (her biri 15 dakika) durulayın, ardından her biri 10 dakika boyunca 0,1 M PBS ile 3 kez yıkayın.
NOT: Çözelti kullanımdan hemen önce hazırlanmalıdır. Dokudaki düzensiz koyu lekeler nedeniyle beyin dilimlerinin birbirine yapışmasını önlemeye özen gösterilmelidir. - Dilimleri yumuşak bir fırça kullanarak jelatinize slaytlara dikkatlice monte edin ve ardından oda sıcaklığında gece boyunca hava ile kurutun.
- Gerekirse karşı leke yapın (bkz. adım 7.1), kalıcı montaj ortamı ekleyin ve kapakları yerleştirin. 4 °C'de 6 aya kadar saklayın.
- BrdU'nun etiketli Streptavidin-Biotin (LSAB) amplifikasyonu kullanılarak immünofloresan ile tespiti
NOT: 1. günde 4.3.1 ile 4.3.4 arasındaki adımları uygulayın.- Dilimleri kriyoproteksiyon çözeltisinden oda sıcaklığında 0,1 M PBS'ye aktarın. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın. İsteğe bağlı olarak, antijen alımı gerçekleştirin (bkz. bölüm 5).
- 37 °C'de 2 N HCl'de 20 dakika boyunca inkübe edin. 0,1 M borat tamponunda (8,5 pH) 10 dakika boyunca durulayın. Buz gibi soğuk 0,1 M PBS'de her biri 10 dakika boyunca 3 kez durulayın.
- PBS ++ 'da oda sıcaklığında 2 saat inkübe edin (engelleme çözeltisi). PBS+'da 1:250 anti-BrdU primer antikoru (fare konağı) ile gece boyunca 4 °C'de inkübe edin.
- 2. günde, her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- PBS+'da 1:250 biyotinile sekonder antikor (fare karşıtı) ile oda sıcaklığında 2\u20124 saat boyunca inkübe edin. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın. PBS'de 1:250 florokrom konjuge streptavidin (Cy3) ile inkübe edin (serum kullanmayın) oda sıcaklığında 1\u20122 saat boyunca. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
NOT: Serum biyotin içerebilir ve seyrelticilere eklenmemelidir. Bunun yerine, Triton X-100'ün %0,3'ünü içeren PBS kullanın. - Dilimleri yumuşak bir fırça kullanarak jelatinize slaytlara dikkatlice monte edin, oda sıcaklığında gece boyunca hava ile kurutun veya uygun bir montaj ortamıyla hemen monte edin. Karşı leke (bkz. adım 7.2), kalıcı montaj ortamı ekleyin ve kapak kaymalarını yerleştirin. 4 °C'de 6 aya kadar saklayın.
- BrdU'nun dolaylı immünofloresan ile tespiti
NOT: 1. günde adım 4.4.1 ila 4.4.4 uygulayın.- Dilimleri kriyoproteksiyon çözeltisinden oda sıcaklığına ulaşana kadar 0,1 M PBS'ye aktarın. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın. Gerekirse antijen alımı yapın (isteğe bağlı, bkz. bölüm 5).
- 37 °C'de 2 N HCl'de 20 dakika boyunca inkübe edin. 0,1 M borat tamponunda (8,5 pH) 10 dakika boyunca durulayın. Her biri 10 dakika boyunca buz gibi soğuk 0,1 M PBS ile 3 kez durulayın. PBS++ (engelleme çözeltisi) ile oda sıcaklığında 2 saat inkübe edin. PBS+'da 1:250 anti-BrdU primer antikoru (fare konağı) ile gece boyunca 4 °C'de inkübe edin.
- 2. günde, her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- PBS+'da 1:250 florokrom konjuge sekonjuge sekonder antikor (fare karşıtı) ile oda sıcaklığında 2\u20124 saat boyunca inkübe edin. Her biri 0,1 M PBS ile 10 dakika boyunca 3 kez durulayın.
- Dilimleri yumuşak bir fırça kullanarak jelatinize slaytlara dikkatlice monte edin, oda sıcaklığında gece boyunca hava ile kurutun veya uygun bir montaj ortamıyla hemen monte edin. Karşı leke (bkz. adım 7.2), kalıcı montaj ortamı ekleyin ve kapak kaymalarını yerleştirin. 4 °C'de 6 aya kadar saklayın.
5. Antijen alımı (isteğe bağlı)
NOT: Antijen Alımı, birçok antijenin üçüncül ve kuaterner yapısını değiştiren ve antikorlar tarafından tespit edilemeyen fiksasyonun neden olduğu antijenite kaybını düzeltmeyi amaçlayan isteğe bağlı bir adımdır. Bu adım orijinal protokole eklenebilir.
- Bir mikrodalga veya su banyosunda, 10 mM sodyum sitrat tamponu (SCB) pH 6 çözeltisini 90\u201295 ° C'ye önceden ısıtın (yüksekliğe bağlı olarak, çözelti bu sıcaklık etrafında kaynamaya başlar). 50 mL'lik konik tüpün (40 mL) %80'ini önceden ısıtılmış SCB ile doldurun. Dilimleri SCB ile konik boru içine ağ eklere aktarın. Tüpü 18\u201220 G iğne ile yapılmış delikli bir vidalı kapakla örtün.
- Dilimleri SCB'de 30 dakika boyunca mikrodalgada minimum güç seviyesinde 80\u201285 °C alternatif ısınma döngülerinde tutun. Gerekirse, konik tüpü SCB ile doldurun. Dilimleri ağ uçlarıyla birlikte hemen sonra buz gibi soğuk 0,1 M PBS'ye aktarın ve her biri 10 dakika boyunca 3 kez durulayın.
6. Çoklu immün boyama (isteğe bağlı)
NOT: Bu adımın arkasındaki gerekçe için giriş bölümüne bakın.
- Eşzamanlı çoklu immün boyama
- PBS + 'da hedefe birincil antikorları (örneğin, fare anti-BrdU ve tavşan anti-GFAP) içeren bir kokteyl hazırlayın. Kullanılan her primer antikor için farklı konakçılar kullanın. Gece boyunca 4 ° C'de inkübe edin. Her protokol için aynı sonraki adımlarla devam edin.
- Her protokol için aynı seyreltici çözeltide kullanılan her birincil antikor (örneğin, keçi anti-fare FITC, keçi anti-tavşan TRITC) için karşılık gelen ikincil antikorlarla bir kokteyl hazırlayın. Her protokol için aynı sonraki adımlarla devam edin. İdeal olarak, çapraz reaksiyonu önlemek için aynı konakçılardan gelen ikincil antikorları kullanın.
- Sıralı çoklu immün boyamalar.
- İlk antikor hedefinin protokolünü izleyin (örneğin, fare anti-BrdU) ve dilimleri monte etmeden önce durun. PBS++ (engelleme çözeltisi) ile oda sıcaklığında 2 saat inkübe edin.
- İkinci birincil antikoru (örneğin, tavşan anti-GFAP) PBS + 'da gece boyunca 4 ° C'de inkübe edin. İkinci ikincil antikorun (örneğin, keçi anti-tavşan TRITC) inkübasyonu da dahil olmak üzere her protokol için sonraki adımları izleyin. Her protokol için sonuna kadar sonraki adımlarla devam edin.
7. Karşı boyama (isteğe bağlı)
- Peroksidaz reaksiyonu kullanan protokoller için, cresyl violet çözeltisini 60 ° C'ye önceden ısıtın. Slaytları ddH2O ile 1 dakika boyunca nemlendirin. Slaytları sıcak cresyl violet çözeltisinde 5\u201220 dakika boyunca inkübe edin.
- Slaytları ddH2O ile 1 dakika durulayın. Slaytları her biri 1\u20123 dakika boyunca %70, %80, %90 ve %100 etil alkol ile durulayın. Slaytları 1\u20123 dakika boyunca ksilen ile durulayın.
- Kalıcı hidrofobik montaj ortamı ekleyin ve kapakları yerleştirin.
NOT: 4 °C'de 6 aya kadar saklayın. PVA (Polivinil alkol)-DABCO içeren kendinden yapım montaj ortamı kullanılabilir.
- İmmünofloresan kullanan protokoller için, DAPI, propidium iyodür veya benzeri ile küçük bir hacimli (25\u201250 μL) hidrofilik montaj ortamı ekleyin. Çevrenin etrafını oje veya plastik bir sızdırmazlık maddesi ile kapatın. 4 °C'de 6 aya kadar saklayın.
8. Görüntüleme ve analiz
NOT: Mikroskop kurulum özellikleri için Tablo 2'ye bakınız. Genellikle, lekeli yeni hücrelerin sayımı peroksidaz reaksiyonu lekeli dilimler (daha ucuz yöntem) kullanılarak yapılır, ancak immünofloresan kullanılarak da yapılabilir.
- Hücreleri ölçmek için, önce dentat girusu 4x büyütme lensi ile düzgün bir şekilde tanımlayın (DG anatomik detayları hakkında daha fazla talimat için bkz.
- Dentat girusun granüler hücre tabakasında BrdU ile etiketlenmiş çekirdekler için arama yapın (40x büyütme lensini kullanarak). Yeni hücreler farklı katmanlara dağıtılabildiğinden, z ekseni boyunca hücre aramasını kapsamlı bir şekilde gerçekleştirin (bkz. Video 1).
- Dentat girusun her yerinde hücre araması için bir aralık bölümü seçin (örneğin, dokunun her 6. bölümü, her 240 μm'ye eşdeğer).
- Tüm BrdU pozitif hücrelerini sayın. Etiketli çekirdeğin morfolojisi, hücrenin ne kadar BrdU içerdiğine bağlı olarak değişebilir (kılavuz olarak Şekil 3'e bakınız). Bir kümeyi entegre eden birkaç çekirdeğin tümünü ölçmek için z ekseni üzerinde yavaşça hareket edin (bkz. Video 2).
- BrdU etiketli yeni hücrelerin toplam sayısını tahmin etmek için sayılan hücrelerin toplam sayısını seçilen aralık bölümüyle (ör. 6) çarpın.
- İdeal olarak, düzenli bir deneyde, hayvan başına en az on bölüm ve grup başına en az beş hayvan sayın.
- Görüntü dekonvolüsyonu (isteğe bağlı)
NOT: Bu adımla ilgili önemli bilgiler için giriş bölümüne bakın. Bu prosedür tek renkli görüntülere (gri tonlamalı) ihtiyaç duyar. Renkli görüntüleri gri tonlamaya dönüştürün. Görüntüler RGB kompozitse, önce kanalları bölün ve tek bir görüntü olarak birleştirin (bileşik değil), ardından 8 bit gri tonlamaya dönüştürün.- Mikrograflardan bir z-stack dosyası oluşturun.
- Eklenti seçeneğinden Diffraction PSF 3D eklentisini (https://imagej.net/Diffraction_PSF_3D) açarak bir nokta yayılma işlevi (PSF) dosyası oluşturun. Gerekli tüm verileri doldurun (bkz. Tablo 2). Tamam'a basın ve dosyayı kaydedin.
- DeconvolutionLab29 eklentisini Eklentiler menüsünden açın (http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/). Eşleşen z-stack görüntüsünü ve PDF dosyasını ilgili pencere yuvasına sürükleyin.
- Dekonvolüsyon algoritmasını (örneğin, Richardson-Lucy) ve yineleme sayısını (örneğin, 20) seçin. RUN tuşuna basın.
- Devolüe edilmiş görüntüleri, üstteki Görüntü menüsünden Yığınlar'ı seçerek tek bir z yığını görüntüsünde birleştirin. Ardından Z Projesi'ne tıklayın. Projeksiyon Türü açılır menüsünden Maksimum Yoğunluk'u seçin, OK'ya basın ve dosyayı kaydedin.
- Yukarıdaki adımda oluşturulan tek z-stack görüntü dosyasını kullanarak RGB görüntüsü oluşturun ve istediğiniz sözde renk üstteki Görüntü menüsünden Renk'i seçin. Ardından Kanalları Birleştir'e tıklayın. Açılır menüden karşılık gelen görüntüyü istenen renk kanalına ayarlayın. Bileşik Oluştur kutusunun işaretini kaldırın, Tamam'a basın ve dosyayı kaydedin (bkz. Şekil 4).
- Birden fazla kanal görüntüsü varsa, 8.2.1\u20128.2.5 adımlarını yineleyin. 8.2.6 adımını izleyerek en az iki görüntü dosyası açarak ve her görüntü dosyası için farklı renk kanalları seçerek bir RGB görüntü dosyası oluşturun (bkz. Şekil 4).
Sonuçlar
Yukarıda tarif edilen yöntemler, herhangi bir ekstra fiziksel aktivite olmadan bir kontrol grubunun aksine, gönüllü fiziksel aktiviteden sonra yetişkin sıçan hipokampüsündeki yenidoğan hücreleri ölçmek için uygulanmıştır. Doğum sonrası sıçan hipokampusunu pozitif kontrol olarak kullandık. 3 aylık erkek sıçanlar, yedi gün boyunca gönüllü bir fiziksel aktivite protokolü (sonsuz tekerlek) altındaydı. 6. günde, sıçanlara BrdU (bölüm 2) enjekte edildi ve üç tam enjeksiyona kadar her 12 saatte bir enjekte edildi. Üç hücre döngüsü bölünmesini tamamlamak için, hayvanlar son BrdU enjeksiyonundan 8 saat sonra transkardiyal olarak perfüze edildi (bölüm 3). Aynı prosedür, karşılaştırmalı bir kontrol olarak kullanılmak üzere fiziksel aktiviteye maruz kalmayan üç aylık sıçanlarda da kullanılmıştır. Pozitif bir kontrol olarak, bir günlük sıçan yavruları (doğum sonrası gün 1), yukarıdaki bölüm 2'de açıklandığı gibi bir kez BrdU ile enjekte edildi. Enjeksiyondan bir gün sonra (doğum sonrası 2. gün), yavrular ötenazi yapıldı ve kafaları adım 3.4'te açıklandığı gibi PFA çözeltisine daldırıldı. Yetişkin sıçanlar, adım 3.2'de tanımlandığı gibi, transkardiyal olarak perfüze edilmiş derin anestezi altına alındı (adım 3.1). Beyinler diseke edildi ve sonradan sabitlendi (adım 3.4). Beyinler 40 μm koronal bölümlere ayrıldı (adım 3.5). Kesitler, adım 4'te açıklandığı gibi BrdU immünohistokimyası için işlendi.
DG'de boyama (adım 4.1) ve BrdU-pozitif hücreleri sayma için DAB IHC ile yaban turpu peroksidaz reaksiyonu kullandık. Şekil 5 , BrdU etiketli hücrelere sahip bir DG bölümünü göstermektedir. Şekil 5C,D, DG bölümünün temsili bir bölümünü daha yüksek büyütmede göstermektedir. Etiketli hücreler, oklarla işaretlenmiş yoğun koyu lekelenme gösterdi. İç kısım, deney ve kontrol gruplarındaki etiketli hücrelerin ortalama sayısını gösterir (sayılan pozitif hücreler, adım 8.1'de açıklandığı gibi altı ile çarpılır). Bir öğrencinin t-testi, BrdU-pozitif hücrelerin sayıları arasında anlamlılık farklılıkları ortaya koymuştur (t(10) = 2.704, p = 0.0222). Fiziksel aktiviteye maruz kalmayan kontrol grubu 2.040 ± 314 hücre (n = 6 sıçan) gösterdi. Buna karşılık, fiziksel aktivite grubu, ortalama olarak, 3.606 ± 486 (n = 6 sıçan) BrdU pozitif hücre göstermiştir. Gözlemlendiği gibi, fiziksel aktiviteye maruz kalma BrdU-pozitif hücreleri arttırır. Bu nedenle, bu sonuçlar, fiziksel aktivitenin yetişkin dentat girus17'de hücresel proliferasyonu arttırdığını gösteren diğer bildirilen sonuçlarla tutarlıdır.
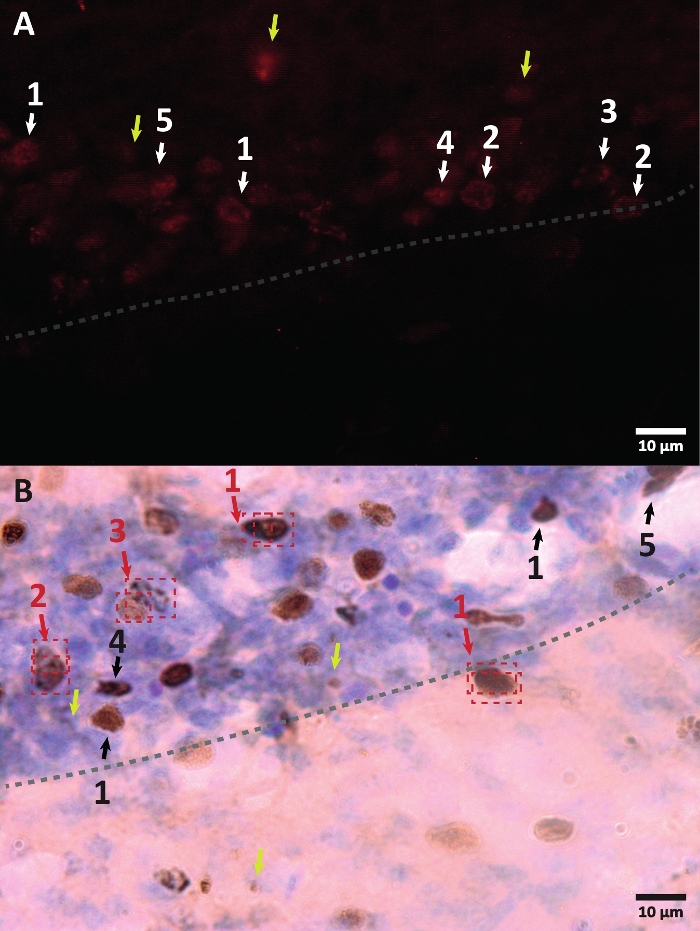
Şekil 3: BrdU etiketli hücre çekirdeğinin farklı morfolojisine örnekler. BrdU, çekirdeği etiketleyen bir DNA sentez belirtecidir. Hipokampus bölgesinde, BrdU-pozitif çekirdekler, dentat girus alt granüler bölgesinde bulunan yarı oval bir şekle sahipti. BrdU rekabet yoluyla dahil edildiğinden, her hücre için dahil edilen miktar, daha sonra çekirdeğin nasıl görselleştirileceğine yansıyacak bir varyasyona sahip olacaktır. (A) İmmünofloresan görüntü. (B) Ek bir amplifikasyon yöntemi olmadan peroksidaz reaksiyonu kullanan bir görüntü sunulur. Sarı oklar yapıları ve spesifik olmayan sinyalleri gösterir. Siyah veya beyaz oklar BrdU+ hücrelerini gösterir. 1 – Tamamen dosyalanmış çekirdek, yarı oval çekirdekler çok renklidir. 2 – Noktaları olan çekirdekler, çekirdeklerin sınırı işaretlenir ve içinde birkaç nokta vardır. 3 – Birkaç noktalı çekirdekler, çekirdeklerin sınırları işaretlenir ve içinde az sayıda nokta bulunur. 4 – Küçük çekirdek, farklı bir farklılaşma aşamasındaki ancak yine de nişin bir parçası olan olası hücrelerdir. 5 – Kümeler bölünme altındaki öncü hücrelerdir, bu nedenle yoğunlaşmış gruplarda birlikte birkaç hücre gözlenebilir. Bu gruplar içinde, pozitif hücrelerin yanlış etiketlenmesini önlemek için sayım özellikle dikkatli yapılmalıdır. Kırmızı oklar, tek bir hücre olarak karıştırılabilecek bölünme altındaki çekirdeği gösterir. Her hücre bir kutu içine alınır ve gerçek zamanlı olarak bir Z ekseni düzleminde ayırt edilebilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Şekil 4: Tek ve birleştirilmiş kanallar için temsili RGB görüntüsü. Üst resim orijinal z-stack görüntüsünü, alt resim ise 3B dekonvolüted z-stack görüntüsünü gösterir. (A) DG'nin düşük büyütmesi. (B) her kanal için RGB görüntü ve (C) RGB birleştirilmiş görüntü. Bu, kontrol grubundan bir beyindi. İmmünofloresan ek bir amplifikasyon yöntemi olmadan kullanıldı. BrdU (kırmızı), karşı boyama olarak DAPI (mavi) ve astroglial belirteç olarak GFAP (glial fibriler asidik protein) (yeşil). ML = moleküler tabaka; GCL = granüler hücre tabakası; SGZ = alt granüler bölge. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
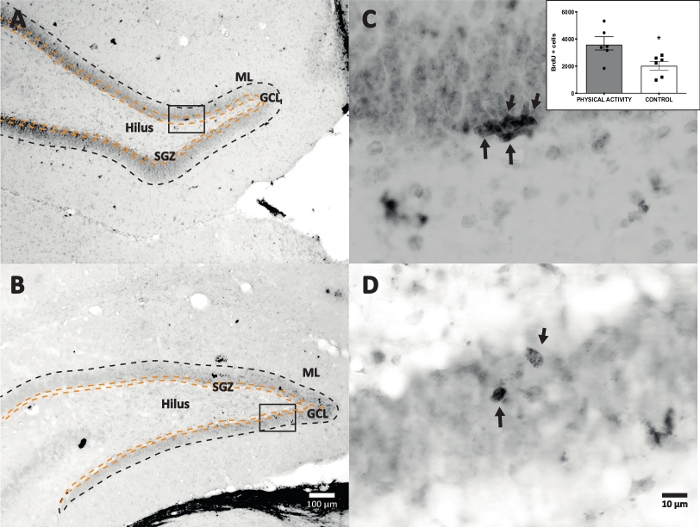
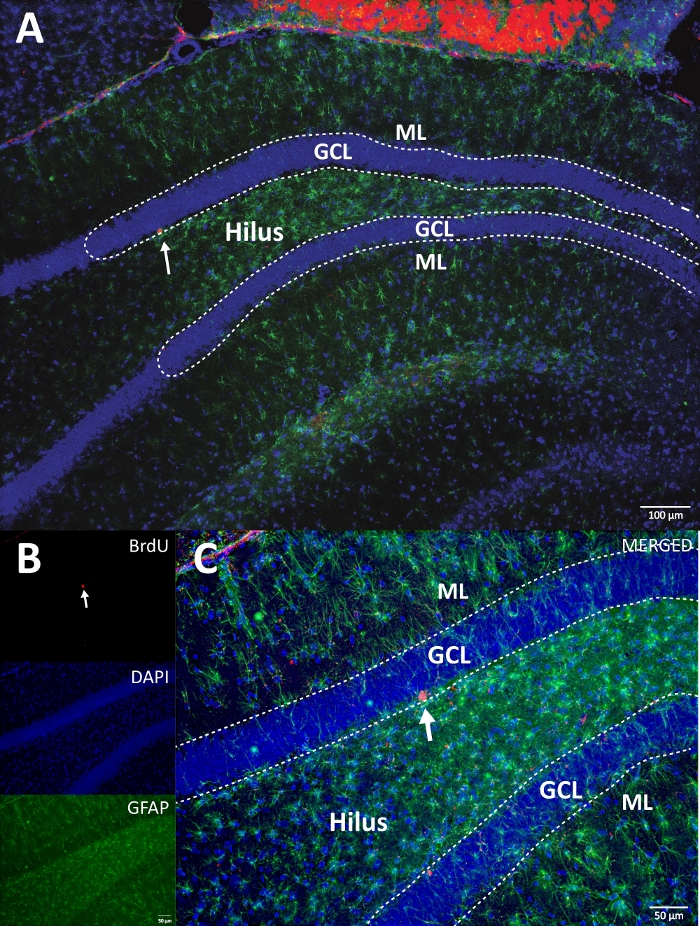
Şekil 5: Her deney grubu için BrdU etiketli hücrelere (yoğun karanlık) sahip temsili DG bölümü. Peroksidaz reaksiyonu avidin-biotin-peroksidaz kompleks amplifikasyon yöntemi ile kullanıldı. (A, B) DG'nin düşük büyütmesini gösterin ve (C, D) kutu alanını daha yüksek büyütmede gösterin. A ve C panelleri fiziksel aktivite grubundan, B ve D panelleri kontrol grubundan dokulardır. Girinti, fiziksel aktivite ve kontrol gruplarındaki etiketli hücrelerin ortalama sayısını gösterir (adım 8.1'de açıklandığı gibi altı ile çarpılan pozitif hücreler sayılır). ML = moleküler tabaka; GCL = granüler hücre tabakası; SGZ = alt granüler bölge; oklar BrdU+ hücrelerini gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Video 1: Farklı katmanlara dağılmış z ekseni boyunca pozitif hücrelerin farklı bir odağını gösteren video. Bu videoyu indirmek için lütfen tıklayınız.
Video 2: Farklı katmanlara dağılmış z ekseni boyunca pozitif hücre kümelerinin farklı bir odağını gösteren video. Bir kümeyi bütünleştiren birkaç çekirdeğin tümünü ölçmek için z ekseni üzerinde yavaşça hareket edin. Bu videoyu indirmek için lütfen tıklayınız.
| Mikroskop Tipi: | Epifloresan Mikroskop Olympus BX53 | ||||
| Işık kaynağı: | Yüksek basınçlı 130 W cıvalı ark lambası (U-HGLGPS) | ||||
| Satın Alma Yazılımı: | CellSens Standart | ||||
| Filtre Kümeleri: | Katalog Numarası | Uyarma Aralığı | Dikromatik ayna | Bastırma Aralığı | |
| U-FUW | 340 - 490 mil | 410 nm | 420 nm | ||
| U-FBW | 460 - 495 mil | 505 nm | 510 nm | ||
| U-FGW | 530 - 550 mil | 570 mil | 575 mil | ||
| Kamera: | Model: | UC50 CCD kamera | |||
| Spektral aralık: | 290 – 1000 mil | ||||
| CCD çip boyutu: | 2/3 in, 2588 (Genişlik *7) X 1960 (Yükseklik *8) piksel | ||||
| Piksel Boyutu: | 3,4 X 3,4 μm | ||||
| Florokrom: | Ad | Uyarma Dalga Boyu (nm) | Emisyon *3 Dalga Boyu (nm) | Emisyon Rengi | |
| 4, 6-diamidino-2-fenil-indol HCI (DAPI) | 345 | 455 | Mavi | ||
| Tetrametilrodamin-izotiyosiyanat (TRITC) | 541 | 572 | Kırmızı | ||
| Floresein-izotiyosiyanat (FITC) | 494 | 519 | Yeşil | ||
| Cy3 (Cy3) | 552 | 565 | Kırmızı | ||
| Montaj Orta ve daldırma yağı: | Ad | Ortamın kırılma indeksi *1 | |||
| Hava (slayt ve lens arasında hiçbir şey yok) | 1.00029 | ||||
| DAPI'li Antifade Montaj Ortamı | 1.45 | ||||
| Permount Montaj Ortamı | 1.519 | ||||
| Düşük otofloresan daldırma yağı (MOIL-30 Tip F) | 1.518 | ||||
| Büyütme Lensi (Plan Florit) | Büyütme | Sayısal Diyafram Açıklığı (NA) *2 | Çözünürlük (μm) | Görüntü piksel aralığı (nm) *5 | Dilim aralığı Z ekseni (nm) *6 |
| 4X | 0.13 | 2.12 | 850 | 3000 | |
| 10X | 0.3 | 0.92 | 340 | 3000 | |
| 20X | 0.5 | 0.55 | 170 | 2000 | |
| 40X | 0.75 | 0.37 | 85 | 1000 | |
| 100X | 1.3 | 0.21 | 34 | 1000 | |
Tablo 2: Mikroskop kurulum özellikleri ve nokta yayılma fonksiyonu (PSF) dosyası oluşturma gereksinimleri. PSF dosyasını oluşturmak için kırınım PSF 3D eklenti penceresinde 11 yuva vardır. Her yuva aşağıdaki gibi tanımlanır: *1 - Ortamın kırılma indeksi: slayt ve lens arasındaki ortam için kırılma indeksi (örneğin, hava = 1.00029). *2 - Sayısal Diyafram: Kullanılan lensin NA değeri (farklı bir daldırma ortamı kullanıldığında ve lense atandığında düzeltilmelidir). *3 - Dalga boyu: Florokrom maksimum emisyon dalga boyu (nm). *4 - Uzunlamasına Küresel Sapma: 0,00. *5 - Görüntü piksel aralığı: CCD piksel boyutu (nm)/Büyütme (ör. 3,4 μm ve 100X lens, 3400/100 = 34 nm). *6 - Görüntüler arasındaki mesafe Z ekseni. *7 - Genişlik: Ayrıştırılacak görüntünün genişliğini piksel cinsinden girin. *8 - Yükseklik: Ayrıştırılacak görüntünün yüksekliğini piksel cinsinden girin. *9 - Derinlik, dilimler: z yığınındaki görüntü sayısı. *10 - Normalleştirme: Piksel değerlerinin toplamı = 1. *11 - Başlık: PSF dosyası için istenen ad. Dosya, verilen benzersiz z-stack görüntüsüyle eşleşmelidir.
Tartışmalar
Yetişkin nörogenezi, yaşamları boyunca yeni nöronlar üretme potansiyeline sahip yetişkin nöral öncü hücrelerin nişlerinde en sık görülen bir süreçtir. Bromodeoksiüridin (BrdU) etiketlemesi, yetişkin bir beyinde yeni üretilen hücrelerin sayısını karakterize etmek için immünolojide yaygın olarak kullanılmaktadır. BrdU esas olarak ayrı beyin bölgelerinin (nörojenik bölgeler) hücrelerine dahil edilecektir. Bu hücreler, hipokampusun dentat girusu olan sub-ventriküler bölgede (SVZ) bulunur - hilus ve sub-granüler bölge (SGZ) olarak bilinen granüler hücreler arasında1,2,18. Dahası, yetişkinlikte hipotalamus, striatum, neokorteks ve amigdala19 dahil olmak üzere daha düşük proliferatif kapasite ile karakterize farklı beyin bölgeleri vardır. Daha önce de belirtildiği gibi, BrdU boyama, hücre proliferasyonunu tespit etmek için yetişkin nörogenez araştırmaları için yaygın olarak kullanılan yöntemdir. Bununla birlikte, BrdU'nun bir belirteç olarak kullanılmasının sınırlamaları ve tuzakları vardır. Birincisi, BrdU'nun bir hücre döngüsü belirteci olmasıdır. Bu nedenle, hücre kaderini tanımlamak için çift veya üçlü boyama yapılmalı ve etiketlenen hücrelerin spesifik gelişim aşamasını tespit etmek için hücre belirteçleri içermelidir. BrdU ile ilgili bir başka endişe, DNA stabilitesini değiştiren toksik ve mutajenik bir çözelti olmasının hücresel fonksiyonu ve hücre döngülerini değiştirebilmesidir. Bir uygulama protokolünü ve uygulama dozlarını (50 \ u2012600 mg / kg) izlemeye karar verirken önceki bilgilere dikkat edilmelidir. Bir diğer önemli özellik, BrdU'nun bir hücre çoğalma belirteci14 değil, bir DNA sentez belirteci olmasıdır. Bu nedenle, hücre proliferasyonunu DNA onarımı, abortif hücre döngüsü yeniden girişi ve gen duplikasyonu gibi diğer olaylardan ayırt etmek önemlidir. Araştırmacılar, BrdU'nun uygun kullanımını sağlamak için uygun kontrolleri takip etmelidir. Bu sorunlar ve sınırlamalar hakkında daha ayrıntılı bir tartışma için, Taupin'in14 numaralı çalışmasını gözden geçirmenizi öneririz. Bir immünohistokimya protokolünün standardizasyon süreci yavaş ve zorlu olabilir. Bu çalışmada, başarılı bir IHC protokolünü yönetmek için tüm genel adımları sunduk. Bununla birlikte, her araştırma grubunun doku, antikorlar ve koşulları önceden test etmesini ve değerlendirmesini öneririz. Test ve değerlendirmeler, test edilen her antikor ve doku için en az üç farklı inkübasyon seviyesi, yıkama adımları ve güçlü yönlerle yapılmalıdır. Ayrıca, araştırmacıların belirli ihtiyaçları ve gereksinimleri karşılayan en iyisini seçebilmeleri için ek protokolleri gözden geçirmelerini öneririz20,21,22,23,24,25.
Daha önce de belirtildiği gibi, prosedür, daha sonra tartışılacak olan bilimsel makalelerde yaygın olarak kullanılan ve bahsedilen birkaç adım ve metodolojik hususları içerir. Araştırmacıların antikorları teknik, bütçe, ekipman, kurulum ve ana araştırma hedefi açısından dikkatli ve doğru seçmelerini öneririz. Antikorlar, daha sonra deneyde test edilecek olan aynı doku türüyle test edilmelidir. Ayrıca, fiksasyon tekniği ile uyumluluğunu test etmek için aynı amaç için test edilmiş bir antikorun (IHC) (yani, sadece batı lekesi veya akış sitometrisi tekniklerinde değil) kullanılmasını öneririz. BrdU boyamasını uygulamak için intraperitoneal enjeksiyon, intraperitoneal infüzyon, oral alım veya intraventriküler infüzyon gibi farklı yollar kullanılabilir (her tekniğin daha ayrıntılı bir açıklaması için bkz. referans26). İntraperitoneal enjeksiyon seçilirse, BrdU'nun bağırsak bölgesinden kaçınarak periton boşluğuna uygulandığından emin olun. Bağırsak, BrdU'yu beyne ulaşmadan önce tüketebilecek ve etiketlenmiş hücrelerin sayısını etkileyecek olan çoğaltmada birkaç hücreye sahip olduğundan. İnce kesitler elde etmek çok önemlidir, çünkü çözeltilerin daha iyi nüfuz etmesine izin verirler. 40 μm kalınlığındaki koronal dilimler rostro-kaudal olarak kesildi ve Kempermann ve ark.27 tarafından önerilen stereolojik prosedürü izleyerek 24 kuyucuklu bir hücre kültürü plakasına aktarıldı. İmmünohistokimya, slaytlara monte edilmiş doku ile veya serbest yüzen bölümler halinde gerçekleştirilebilir. BrdU, hücre çekirdeklerinin derinliklerinde bulunduğundan, çözeltilerin serbest yüzen bölümlere nüfuz etmesine izin verir, bu da daha iyi sonuçlar ve ilgi alanına daha iyi erişim sağlar. Birincil anti-BrdU antikoruna erişim sağlamak için DNA bağlarını (DNA denatürasyonu) açmak önemlidir. Bu çalışmada, HCI inkübasyonunu kullanarak bu özel prosedürleri gerçekleştirdik. Öte yandan, spesifik olmayan epitopları bloke etme işlemi, hücre sinyalinin daha doğru bir şekilde tanımlanmasını sağladı.
İyi membran geçirgenliği, antikorların ilgi alanına düzgün bir şekilde nüfuz etmesini sağlar. PBS++ ve PBS+ çözümlerine Triton X-100 gibi bir geçirgenleştirici eklenmesi, membran geçirgenliğini artırır. Bu protokolde hem PBS hem de Tris arabelleğe alınmış salin (TBS) reaktifleri kullanılabilir. Bütçe açısından, TBS, PBS'den daha ucuz görelilik olabilir. Bununla birlikte, PBS anti-fosfat antikorlarına müdahale edebilir ve alkali fosfataz konjuge antikorları inhibe edebilir, bu nedenle hedef fosforilasyon ile translasyonel olarak modifiye edilmişse (yani fosforile edilmiş) PBS kullanımından kaçının. Bu çalışma için PBS'yi kullandık ve doku yıkama adımlarının daha spesifik bir sinyal verdiğini öğrendik. Ayrıca araştırmacıların TBS o PBS kullanarak en az üç yıkama döngüsü gerçekleştirmelerini öneririz. Çözeltiler taze hazırlanmalıdır. Antijen geri kazanımı (AR), üçüncül ve kuaterner antijenlerin yapısını değiştiren fiksasyonun neden olduğu antijenite kaybını azaltmayı amaçlayan bir yöntemdir. Bu azalma antijenleri antikorlar tarafından saptanamaz hale getirir28,29. Bu protokolde kullanılan ısıya bağlı epitop geri kazanımı (HIER), formaldehit ve proteinler arasındaki kimyasal reaksiyonları yüksek sıcaklık veya güçlü alkali hidroliz yoluyla (EDTA pH 8.5 veya Tris pH 9.5 gibi diğer tampon çözeltileri ile) tersine çevirmeye çalıştı. Sonuçları karşılaştırmak ve protokol için en iyisini seçmek için yeni antikorları farklı AR protokolleriyle test etmek önemlidir. Bu son adım normal bir protokolde isteğe bağlı olabilir; ancak bu protokol için daha iyi sonuçlar sağlamak amacıyla dokuları antijen geri alma protokolü ile tedavi ettik.
Lekelenmeyen bir yapıyı görünür kılmak ve birincil boyama rengini bağışıklık reaksiyonundan maskelemekten kaçınmak için kullanılan birincil boyama rengi ve yöntemi göz önünde bulundurularak doğru nihai kontrast rengin ve karşı leke tekniğinin seçilmesi çok önemlidir. Floresan mikroskobu için, DAPI (4', 6-diamidino-2-fenilindol), DNA'nın AT bölgelerine bağlandıktan sonra mavi floresan (emilim: 360 nm, emisyon: 460 nm) yayan çok popüler bir nükleer ve kromozom karşı boyasıdır. DAPI içeren montaj ortamı mevcuttur ve kullanımı kolaydır; bu, görüntü alımı için mükemmel sinyal tutma sağlar. Peroksit reaksiyonu için IHC, cresyl violet, hematoxylin, nötr kırmızı veya metil yeşili boyama gibi farklı seçeneklerde mevcuttu. Çoklu immün boyama teknikleri için, çapraz reaktiviteyi önlemek için kullanılan fiksasyon tekniği ile uyumlu bir antikor seçmek çok önemlidir30. Tek boyama ile ilgili sorunlar ve komplikasyonlar çözüldüğünde, gerekli gördüğü şekilde başka bir renk boyama uygulayın. Sekonder antikorlar arasındaki spesifik olmayan bağlanmayı kontrol etmek çok önemlidir. Bu, birincil antikorların aynı konakçı türünde üretilen ikincil bir antikor kullanılmadan önce birincil antikorların doyurulmasıyla yapılabilir. Örneğin, tavşanda üretilen anti-fare ve keçi sekonder antikorlarında üretilen anti-tavşan kullanıldığında, keçi antikorunda üretilen anti-tavşan, tavşan antikorunda üretilen anti-fareden önce kullanılmalıdır. Sıralı yönteme tamamen hakim olunduğunda, eşzamanlı immün boyama işlemi başlatılabilir. Bu yöntemde sekonder antikorların uygun şekilde seçilmesi esastır. İdeal olarak, çapraz reaktiviteyi önlemek için tüm bu antikorlar aynı konakçı hayvandan gelmelidir. Boyama yönteminin doğum sonrası hipokampus dokusunda (bu yaşta bol miktarda nörogenez) doğru çalıştığını doğrulamak için pozitif bir kontrol yapmanızı öneririz. Pozitif kontrol dokusu boyama problemleri gösteriyorsa, prosedürü gözden geçirin ve gözden geçirin, düzeltmeler ve ayarlamalar yapın ve iyi bir boyama oluşana kadar tekrarlayın. Ardından, belirli bir birincil antikoru atlayarak veya normal serum (birincil antikor ile aynı tür) ile değiştirerek antikorun doğru çalıştığını test etmek için negatif bir kontrol çalıştırın. Girişte belirtildiği gibi, görüntü dekonvolüsyonu güçlü bir araçtır ve konfokal mikroskop mevcut olmadığında bir alternatif sunar. Görüntü dekonvolüsyonunu, iletilen ışık parlak alanı, geniş alan floresansı ve konfokal floresan mikroskobu kullanılarak elde edilen tüm görüntülere uygulayabilir. Görüntü dekonvolüsyonunun nihai amacı, edinme sisteminin bozulduğu orijinal sinyali yeniden yapılandırmaktır10.
Özetle, timidin analog BrdU'nun immünostepsiyonu ile görselleştirilen yeni üretilen hücrelerin tanımlanması karmaşık ama güçlü bir tekniktir. Bu çalışma, özellikle yetişkin hipokampal nörogenez alanındaki bilim adamlarının yeni hücreleri daha doğru bir şekilde ölçmelerine yardımcı olma girişimidir. Bu çabanın bilimsel topluluğa yardımcı olduğunu ve immünohistokimya tekniği ile hücre proliferasyonu çalışmasına ince ayar yapmayı kolaylaştırdığını umuyoruz.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Sayın Miguel Burgos'a ve Gustavo Lago'ya teknik yardım sağladıkları için teşekkür ederiz. Ayrıca Dr. Clorinda Arias, Dr. Karla Hernandez ve Dr. Oscar Galicia'ya reaktifler ve malzeme sağlamadaki nazik destekleri için teşekkür ederiz. Ayrıca, Universidad Iberoamericana Ciudad de México'dan División de Investigación y Postuvo'ya, bu çalışmanın performansı için finansman sağladığı ve video prodüksiyon masraflarını karşıladığı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| REAGENT PREPARATION AND SETUP | |||
| Donor Horse Serum | BioWest | S0900 | Blocking and incubation solutions in PBS |
| Paraformaldehyde reagent grade, crystalline (PFA) | Sigma-Aldrich | P6148 | toxic, flammable |
| Potassium Chloride | Sigma-Aldrich | 746436-500G | |
| Potassium Phosphate, monobasic | J.T Bker | 3246-01 | |
| Sacarose | J.T Baker | 4072-01 | |
| Sodium Chloride | Meyer | 2365-500G | |
| Sodium Hydroxide | Sigma-Aldrich | S5881-500G | Corrisive, to calibrate pH |
| Sodium Phophate Dibasic | Sigma-Aldrich | S9763-5KG | |
| Triton-x 100 | Sigma-Aldrich | T8787 | |
| THYMIDINE ANALOGUE BRDU ADMINISTRATION | |||
| 5-Bromo-2′-deoxyuridine, BrdU | Sigma-Aldrich | B9285 | toxic (mutagenic, teratogenic) |
| 23–27G hypodermic needle | BD PrecisionGlide | ||
| Saline solution | PiSA | 30130032 | |
| Syringes 1 mL | NIPRO | ||
| TISSUE PREPARATION | |||
| 15-ml polypropylene conical tube | Thermo Scientific | 339650 | |
| 50-ml polypropylene conical tube | Thermo Scientific | 339652 | |
| Dissecting tools | |||
| Guillotine | Stoelting | ||
| Microtome Cryostat | MICROM | HM525 | |
| Netwell 15 mm polyester mesh membrane inserts | Corning | 3477 | pre-loaded in 12-well culture plates |
| Netwell plastic 12-well carrier kit | Corning | 3520 | for 15 mm polyester mesh membrane inserts |
| Netwell plastic 6-well carrier kit | Corning | 3521 | |
| Perfusion pump | Cole-Parmer | 7553-70 | |
| Shaker | IKA | ROKCER 3D Digital | |
| IMMUNOSTAINING | |||
| Cresyl violet | Sigma-Aldrich | C5042 | 1%, Light sensitive |
| DAB Peroxidase (HRP) Substrate Kit (with Nickel), 3,3’-diaminobenzidine | Vector Laboratories | SK-4100 | carcinogenic, light sensitive |
| Hydochloric Acid | J.T.Baker | 9535-05 | Corrosive, to calibrate pH |
| Hydrogen Peroxide, 50% | Meyer | 5375-1L | Toxic, oxidative |
| Permount Mounting Medium | Fisher Chemical | SP15-500 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | Light sensitive |
| VECTASTAIN® Elite® ABC Kit Peroxidase (HRP) | Vector Laboratories | PK-6100 | enzymatic, avidin/biotin based amplification system |
| Primary antibodies | |||
| Anti-GFAP antibody produced in rabbit | Sigma-Aldrich | HPA056030 | 1:500 |
| Monoclonal Anti-BrdU antibody produced in Mouse | Sigma-Aldrich | B2531 | 1:250 |
| Secondary antibodies | |||
| Biotin-SP (long spacer) AffiniPure Donkey Anti-Mouse IgG (H+L) | Jackson ImmunoResearch | 715-065-151 | 1:250 |
| Goat anti-Mouse IgG (H+L) Cross-Adsorbed Secondary Antibody, HRP | Invitrogen | G-21040 | 1:1000 |
| Goat Anti-Mouse IgG (whole molecule), TRITC | Sigma-Aldrich | T5393 | 1:250 |
| Goat Anti-Rabbit IgG (H+L) Cross-Adsorbed, FITC | Invitrogen | F-2765 | 1:250 |
| Streptavidin, Cy3 | Vector Laboratories | SA-1300 | 1:250 |
| IMAGING AND ANALYSIS | |||
| Computer | Dell Computer Company | T8P8T-7G8MR-4YPQV-96C2F-7THHB | For controlling and monitoring protocols’ processes |
| CCD-camera | Olympus | UC50 | |
| CellSens Standard software | Olympus | cellSens Standard Edition | Acquisition Software |
| Epifluorescent microscope | Olympus | BX53 | |
| High-pressure 130 W mercury arc lamp | Olympus | U-HGLGPS | |
| low autofluorescence immersion oil | Olympus | MOIL-30 Type F | |
| Micro cover-glasses (VWR, cat no 48404 454; 24 60 mm) | |||
| Microscope slides (VWR, cat no 48323-185; 76 26 mm) | |||
| U-FBW filter cube | Olympus | U-FBW | excitation 460 - 495 nm, dichroic mirror 505 nm, suppression 510 nm |
| U-FGW filter cube | Olympus | U-FGW | excitation 530 - 550 nm, dichroic mirror 570 nm, suppression 575 nm |
| U-FUW filter cube | Olympus | U-FUW | excitation 340 - 490 nm, dichroic mirror 410 nm, suppression 420 nm |
Referanslar
- Altman, J. Are new neurons formed in the brains of adult mammals. Science. 135 (3509), 1127-1128 (1962).
- Altman, J., Das, G. D. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. The Journal of Comparative Neurology. 124 (3), 319-335 (1965).
- Miller, M. W., Nowakowski, R. S. Use of bromodeoxyuridine-immunohistochemistry to examine the proliferation, migration and time of origin of cells in the central nervous system. Brain Research. 457 (1), 44-52 (1988).
- Eriksson, P. S., et al. Neurogenesis in the adult human hippocampus. Nature Medicine. 4 (11), 1313-1317 (1998).
- Filippov, V., et al. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes. Molecular and Cellular Neuroscience. 23 (3), 373-382 (2003).
- Kempermann, G., Jessberger, S., Steiner, B., Kronenberg, G. Milestones of neuronal development in the adult hippocampus. Trends in Neurosciences. 27 (8), 447-452 (2004).
- Matiašová, A., et al. Flow cytometric determination of 5-bromo-2'-deoxyuridine pharmacokinetics in blood serum after intraperitoneal administration to rats and mice. Histochemistry and Cell Biology. 142 (6), 703-712 (2014).
- Von Bohlen Und Halbach, O. Immunohistological markers for proliferative events, gliogenesis, and neurogenesis within the adult hippocampus. Cell and Tissue Research. 345 (1), 1-19 (2011).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Manz, W., Arp, G., Schumann-Kindel, G., Szewzyk, U., Reitner, J. Widefield deconvolution epifluorescence microscopy combined with fluorescence in situ hybridization reveals the spatial arrangement of bacteria in sponge tissue. Journal of Microbiological Methods. 40 (2), 125-134 (2000).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Abràmoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with imageJ. Biophotonics International. 11 (7), 36-41 (2004).
- Giannini, A., Giannini, J. 2D and 3D Fluorescence Deconvolution Manual. , Available from: https://pages.stolaf.edu/wp-content/uploads/sites/803/2016/12/Giannini_Giannini_Deconvolution_Manual_20161215.p (2016).
- Taupin, P. BrdU immunohistochemistry for studying adult neurogenesis: Paradigms, pitfalls, limitations, and validation. Brain Research Reviews. 53 (1), 198-214 (2007).
- Revilla, V., Jones, A. Cryostat sectioning of brains. International Review of Neurobiology. 47, 61-70 (2002).
- Amaral, D. G., Scharfman, H. E., Lavenex, P. The dentate gyrus: fundamental neuroanatomical organization (dentate gyrus for dummies). Progress in brain research. 163, 3-22 (2007).
- Eadie, B. D., Redila, V. A., Christie, B. R. Voluntary exercise alters the cytoarchitecture of the adult dentate gyrus by increasing cellular proliferation, dendritic complexity, and spine density. Journal of Comparative Neurology. 486 (1), 39-47 (2005).
- Leal-Galicia, P., Romo-Parra, H., Rodríguez-Serrano, L. M., Buenrostro-Jáuregui, M. Regulation of adult hippocampal neurogenesis exerted by sexual, cognitive and physical activity: An update. Journal of Chemical Neuroanatomy. 101, 101667(2019).
- Gould, E. How widespread is adult neurogenesis in mammals. Nature Reviews Neuroscience. 8 (6), 481-488 (2007).
- Ngwenya, L. B., Peters, A., Rosene, D. L. Light and electron microscopic immunohistochemical detection of bromodeoxyuridine-labeled cells in the brain: Different fixation and processing protocols. Journal of Histochemistry and Cytochemistry. 53 (7), 821-832 (2005).
- Ansorg, A., Bornkessel, K., Witte, O. W., Urbach, A. Immunohistochemistry and multiple labeling with antibodies from the same host species to study adult hippocampal neurogenesis. Journal of Visualized Experiments. (98), e52551(2015).
- Tuttle, A. H., et al. Immunofluorescent detection of two thymidine analogues (CldU and IdU) in primary tissue. Journal of Visualized Experiments. (46), e2166(2010).
- Tischler, A. S. Triple immunohistochemical staining for bromodeoxyuridine and catecholamine biosynthetic enzymes using microwave antigen retrieval. Journal of Histochemistry and Cytochemistry. 43 (1), 1-4 (1995).
- Taupin, P. Protocols for studying adult neurogenesis: Insights and recent developments. Regenerative Medicine. 2 (1), 51-62 (2007).
- Leuner, B., Glasper, E. R., Gould, E. Thymidine analog methods for studies of adult neurogenesis are not equally sensitive. Biosystems. 517 (2), 123-133 (2010).
- Magavi, S. S., MacKlis, J. D. Identification of newborn cells by BrdU labeling and immunocytochemistry in vivo. Methods in Molecular Biology. 438, 335-343 (2008).
- Kempermann, G., Gast, D., Kronenberg, G., Yamaguchi, M., Gage, F. H. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. , 391-399 (2003).
- Ramos-Vara, J. A., Beissenherz, M. E. Optimization of immunohistochemical methods using two different antigen retrieval methods on formalin-fixed, paraffin-embedded tissues: Experience with 63 markers. Journal of Veterinary Diagnostic Investigation. 12 (4), 307-311 (2000).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Wojtowicz, J. M., Kee, N. BrdU assay for neurogenesis in rodents. Nature Protocols. 1 (3), 1399-1405 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır