Method Article
تحضير وإدارة وتقييم الامتصاص الخلوي الخاص بالأنسجة الحية للجسيمات الشحمية الفلورية ذات العلامات الصبغية
In This Article
Summary
الهدف من هذا البروتوكول هو توليف الجسيمات الشحمية ذات العلامات الفلورية واستخدام قياس التدفق الخلوي لتحديد توطين الجسيمات الشحمية في الجسم الحي على المستوى الخلوي.
Abstract
هناك اهتمام متزايد باستخدام الجسيمات الشحمية لتوصيل المركبات في الجسم الحي خاصة لأساليب العلاج المستهدفة. اعتمادا على تركيبة الجسيمات الشحمية ، قد يتم تناول الجسيمات الشحمية بشكل تفضيلي من قبل أنواع مختلفة من الخلايا في الجسم. قد يؤثر هذا على فعالية الجسيم العلاجي لأن تطور الأمراض المختلفة خاص بالأنسجة ونوع الخلية. في هذا البروتوكول ، نقدم طريقة واحدة لتجميع وتسمية الجسيمات الشحمية بالفلورسنت باستخدام DSPC والكوليسترول و PEG-2000 DSPE وصبغة الدهون DiD كملصق فلوريسنت. يقدم هذا البروتوكول أيضا نهجا لتوصيل الجسيمات الشحمية في الجسم الحي وتقييم امتصاص الجسيمات الشحمية الخاصة بالخلية باستخدام قياس التدفق الخلوي. يمكن استخدام هذا النهج لتحديد أنواع الخلايا التي تمتص الجسيمات الشحمية وتحديد توزيع ونسبة امتصاص الجسيمات الشحمية عبر أنواع الخلايا والأنسجة. على الرغم من عدم ذكرها في هذا البروتوكول ، فإن المقايسات الإضافية مثل التألق المناعي والتصوير الفلوري أحادي الخلية على مقياس الخلايا ستعزز أي نتائج أو استنتاجات يتم التوصل إليها لأنها تسمح بتقييم التلوين داخل الخلايا. قد تحتاج البروتوكولات أيضا إلى التكيف اعتمادا على الأنسجة (الأنسجة) ذات الأهمية.
Introduction
مع تزايد الاهتمام بتطوير العلاجات التي تستخدم توصيل أدوية الجسيمات النانوية ، يجب أن تستمر طرق إعداد وتقييم توزيع الجسيمات وامتصاصها في التقدم والتوسع وتكون في متناول مجتمع البحث 1,2. تم تطوير هذا البروتوكول لتقييم أنواع الخلايا الدقيقة التي تناولت الجسيمات الشحمية في الجسم الحي بعد العلاج بالليبوزومات التي تحمل علامة DiD المحملة ب tesaglitazar ، وهو ناهض نشط لمستقبلات البيروكسيسوم المنشط (PPAR) -α / γ 3,4. في هذه الدراسات ، تمكنا من تقييم أنواع الخلايا التي تأثرت بشكل مباشر بعلاج tesaglitazar الشحمي ، وفعالية استهداف الشقوق ، وتوليد فرضيات لشرح نتائج العلاج التي لاحظناها. علاوة على ذلك ، تشير الوظائف البيولوجية الراسخة في مجموعة متنوعة من أنواع الخلايا إلى أن الخلايا البلعمية مثل الضامة والخلايا المتغصنة وخلايا كوبفر الخاصة بالكبد تمتص معظم الجسيمات الشحمية5،6،7. باستخدام هذا البروتوكول ، أثبتنا أن الخلايا البلعمية غير الكلاسيكية يمكن أن تمتص أيضا الجسيمات الشحمية 3,4.
يقدم هذا البروتوكول طريقة محسنة لإذابة tesaglitazar ، وإعداد الجسيمات الشحمية عن طريق تبخر الطور العكسي ، واستخدام أسيتات الكالسيوم كعامل جذب لتحميل الأدوية عن بعد. الطرق المقدمة متاحة للعديد من المختبرات وتفتقر إلى المواد التي يصعب الحصول عليها والخطوات التي تتطلب درجات حرارة عالية. ينتج البروتوكول الجسيمات الشحمية ذات الأحجام المثلى لزيادة الدورة الدموية في الجسم الحي8. علاوة على ذلك ، كما لخص Su et al. ، حتى الآن ، تمت دراسة طرق تقييم توزيع الجسيمات الشحمية في الجسم الحي وامتصاص الأنسجة واختبارها بعمق9. يتم تطبيق طرق التصوير المقطعي بالإصدار البوزيتروني (PET) والتصوير بالرنين المغناطيسي (MRI) والتصوير المقطعي الجزيئي الفلوري (FMT) لتحديد التوزيع الحيوي الخاص بالأنسجة وامتصاص9،10،11. في حين تم تحسين هذه الطرق لتحقيق أقصى قدر من الكشف في الجسم الحي ، إلا أنها لا تزال تفتقر إلى القدرة على تحديد امتصاص الجسيمات الشحمية في الجسم الحي بدقة خلوية. يهدف البروتوكول المقدم هنا إلى تلبية هذه الحاجة من خلال استخدام قياس التدفق الخلوي. أخيرا ، بالنسبة لهذا البروتوكول ، تم تضييق امتصاص الخلايا إلى عدد قليل من الأنسجة بما في ذلك الأنسجة الدهنية. هناك مجموعة متزايدة من الأدبيات التي تبحث في إمكانية استخدام الجسيمات النانوية لتقديم العلاجات في وضع السمنة ، وخلل التمثيل الغذائي ، والالتهابات12،13،14،15،16،17. على هذا النحو ، شعرنا أنه من المهم مشاركة بروتوكول مع طرق فعالة لمعالجة وتحليل الأنسجة الدهنية - أحد الأنسجة التي تلعب دورا مهما في هذه الأمراض.
Protocol
تمت الموافقة على جميع الخطوات الواردة في هذا البروتوكول من قبل لجنة رعاية واستخدام الحيوان في جامعة فيرجينيا وتتبع المبادئ التوجيهية لها.
ملاحظة: هناك بعض الضوابط الهامة التي يجب مراعاتها لخطوات التحليل اللاحقة ، والتي تم تلخيصها في الجدول 1 ويجب مراعاتها قبل إعطاء الجسيمات الشحمية.
1. تحضير الجسيمات الشحمية الموسومة بالفلورسنت ، محملة بأسيتات الكالسيوم و tesaglitazar
- الجمع بين DSPC (1،2-ديستيرويل-sn-glycero-3-فوسفوكولين) ، والكوليسترول ، PEG-2000-DSPE ، و DiD. لهذا ، قم بتجميع DSPC والكوليسترول و PEG-2000 DSPE بنسبة كتلة 2: 1: 1. أضف صبغة الدهون DiD بتركيز 1 مجم من DiD لكل 1 مل من الجسيمات الشحمية (النسبة المولية 46: 1 من DSPC: DiD).
ملاحظة: DiD هو اختصار مقبول لصبغة 1،1'-dioctadecyl-3،3،3' ، 3'tetramethylindocarbocyanine. نظرا لأنه يحتوي على اثنين من "ذيول دهنية" أوكتاديسيل متساوية الطول مع DSPC المستخدم في هذه التركيبة ، يجب أن يندمج في الغالب في الغشاء الدهني. تستخدم الأصباغ الدهنية مثل DiO و DiD و DiI بشكل روتيني لأبحاث الجسيمات الشحمية8 وتعتبر غير قابلة للاستبدال18. - استخدم قارورة تلألؤ سعة 20 مل لمستحلب الطور المقلوب وإعداد الجسيمات الشحمية. في هذه القارورة ، امزج محلول 2: 1 من الأثير الكلوروفورم من الدهون مع أسيتات الكالسيوم المائية (Ca-acetate ، 1 M ، pH 7.4). يجب أن تكون النسبة بين الطور العضوي والمائي 4: 1 ، على سبيل المثال ، 4 مل من الطور العضوي و 1 مل من الطور المائي.
- استحلاب محلول الأثير كلوروفورم من الدهون عن طريق صوتنة لمدة 30 ثانية في درجة حرارة الغرفة. قم بتشغيل جهاز الصوتنة عند 20 كيلو هرتز وطاقة 50٪ واستخدم 1/2 بوصة. مجس.
ملاحظة: حافظ على طرف مسبار الصوتيان أقرب إلى أسفل القارورة لتجنب الرغوة. لا تلمس الزجاج مع طرف التحقيق أثناء صوتنة ، فقد ينكسر. بالإضافة إلى ذلك ، يجب إضافة الكلوروفورم إلى الأثير كمذيب مشترك: في وجود الكوليسترول ، ينفصل مستحلب الأثير فقط بسرعة ، مما يجعل هذه الخطوة من الإجراء مستحيلة. - ضع القارورة على الفور مع مستحلب الماء في الزيت المتجانس على مبخر دوار مع محول خاص ومقياس ضغط وصمام منظم ضغط. يجب توصيل المبخر بخط فراغ لإزالة المذيبات العضوية. اضبط معدل الدوران عند 100 دورة في الدقيقة والفراغ عند 0.5 ضغط جوي ، ثم حرره إذا بدت رغوة المستحلب مفرطة. بعد أن يتشكل هلام ويختفي ، قم بزيادة الفراغ إلى 0.9 ضغط جوي.
ملاحظة: أثناء إزالة الطور العضوي المتطاير ، يجب ضبط مستوى الفراغ تدريجيا ، لتجنب الرغوة السريعة ، حيث قد يؤدي ذلك إلى فقدان المحتوى من القارورة إلى جسم المبخر الدوار. في النهاية ، عندما يتبخر الأثير والكلوروفورم جزئيا وتكون نسبة الحجم بين طور المذيبات المائية والعضوية قريبة من 1: 1 ، سيتشكل هلام. يجب أن يستمر التبخر حتى يختفي الجل وتصبح الوسائط المائية المتبقية سائلة تماما مرة أخرى. قد يساعد الخلط الإضافي في تسريع إزالة المذيبات العضوية. يمكن تحقيق ذلك عن طريق وضع قضيب تحريك بولي تترافلورو إيثيلين في دورق التبخر ، لتعزيز الحمل الحراري للهلام اللزج أثناء التبخر الدوار. - قم بتصفية الجسيمات الشحمية الناتجة باستخدام أغشية البولي كربونات المحفورة في المسار لتحقيق توزيع متجانس للحجم.
- قم بإجراء الترشيح عن طريق تمرير التشتت المائي للجسيم الشحمي ذهابا وإيابا عدة مرات من خلال مرشح بولي كربونات 200 نانومتر في آلة بثق الجسيمات الشحمية المجهزة بحقنتين محكمتين للغاز.
ملاحظة: يفضل استخدام المحاقن الأصغر (على سبيل المثال ، 0.5 مل) لأنها تضمن توليد ضغط كاف للترشيح. مع وجود نسبة عالية من الكوليسترول في غشاء الجسيمات الشحمية ، فإن ارتفاع درجة الحرارة ليس ضروريا ، ويمكن إجراء العملية في درجة حرارة الغرفة. يتم إجراء عدد فردي من الترشيحات (على سبيل المثال ، 21) ، بحيث تنتهي المادة الناتجة على الجانب الآخر من المرشح من البداية وإذا تم تعقيمها مسبقا ، يمكن جمع عينة معقمة من الجسيمات الشحمية المعدلة ذات الحجم المصفى. عادة ما يكون حجم الجسيمات الشحمية الناتجة قريبا من حجم مسام المرشح المحدد. يمكن تكديس مرشحين (بدلا من مرشح واحد) لإجراء ضبط دقيق لتقليل حجم الجسيمات. - تحقق من توزيع الحجم باستخدام تشتت ضوء الليزر الديناميكي (DLS)3,4.
- أضف 1 إلى 3 مل من المحلول الملحي إلى كفيت 1 سم بأربعة جوانب شفافة. أضف إلى ذلك 10-20 ميكرولتر من الجسيمات الشحمية واخلطها بعناية. ضع العينة في الجهاز وحدد المعلمات التالية لقياسها: لزوجة المذيبات ، معامل الانكسار ، معامل الانكسار للدهون. انقر فوق الزر ابدأ . ستستمر القياسات عدة دقائق وتتكون من 100 جولة أو أكثر.
- قم بإجراء الترشيح عن طريق تمرير التشتت المائي للجسيم الشحمي ذهابا وإيابا عدة مرات من خلال مرشح بولي كربونات 200 نانومتر في آلة بثق الجسيمات الشحمية المجهزة بحقنتين محكمتين للغاز.
- قم بإزالة أسيتات الكالسيوم الخارجية باستخدام عمود دوران محلى. إلى نصف الدفعة ، أضف tesaglitazar المائي في محلول HEPES 10 mM (درجة الحموضة 7.4) واحتضانها بالخلط عند 37 درجة مئوية لمدة 1 ساعة. استخدم النصف الثاني من الدفعة كتركيبة خالية من الأدوية للتحكم في الجسيمات الشحمية.
ملاحظة: قم بموازنة عمود الدوران المسطح سعة 2 مل مسبقا مع محلول HEPES 10 مللي متر ، درجة الحموضة 7.4 ، قبل الاستخدام. للقيام بذلك ، ضع 1 مل من المخزن المؤقت HEPES في العمود وقم بتدويره في جهاز طرد مركزي عند 1000 × جم لمدة 2 دقيقة. قم بإزالة المخزن المؤقت للتمرير وكرر ذلك أربع مرات. - إزالة tesaglitazar غير المحاصرة من الجسيمات الشحمية باستخدام عمود الدوران 2 مل ، وتحديد تركيز الدواء المحاصر طيفيا.
- أضف ما لا يزيد عن 0.5 مل من عينة الجسيمات الشحمية إلى طبقة هلام العمود الجاف وانتظر حتى تدخل كل العينة إلى الجل. أجهزة الطرد المركزي في نفس الظروف تماما كما في وقت سابق (1000 × غرام ، 2 دقيقة) وجمع عينة الجسيمات الشحمية في ممر تنقية من مركبات الكتلة الجزيئية الصغيرة.
- تحديد ميزات الجسيمات النهائية: حجم الجسيمات وتركيزها باستخدام DLS وجهد زيتا مع نظام تشتت الضوء الكهربائي DLS (ELS) المشترك 3,4 في 10 mM HEPES buffer pH 7.4 وعند 25 درجة مئوية.
- على غرار الخطوة 1.5.2 ، قم بتخفيف تشتت الجسيمات الشحمية في محلول القياس المؤقت (على سبيل المثال ، 10 ميكرولتر ليبوزومات لكل 1 مل من المحلول العازل) في كوفيت على شكل حرف U باستخدام حقنة Luer يمكن التخلص منها ، أو ماصة ذات طرف مقطوع. تأكد من عدم وجود فقاعات في "U" بحيث يكون هناك حل غير منقطع لتدفق التيار الكهربائي.
- ضع الكوفيت في الوحدة (يرجى الانتباه إلى الجزء الأمامي والخلفي من كوفيت ، بحيث يتم توصيل الأقطاب الكهربائية بشكل صحيح بالوحدة). أغلق باب الصك ؛ بعد ذلك ، يتم القياس (مع تكرارات متعددة) ، تحت سيطرة برنامج التوجيه.
2. تحضير الجسيمات الشحمية للإدارة في الجسم الحي
- في خزانة السلامة الحيوية ، قم بتخفيف الجسيمات الشحمية في محلول ملحي معقم إلى التركيز المناسب في حجم نهائي قدره 50 ميكرولتر للإعطاء في الجسم الحي.
ملاحظة: في الدراسات السابقة ، احتوى مستحضر الجسيمات الشحمية لدينا على 2 مجم / مل من tesaglitazar ، أي ما يعادل حوالي 4.89 ميكرولتر من tesaglitazar / مل ، وقمنا بإعطاء الجسيمات الشحمية بجرعة 1 ميكرولتر دواء / كجم. بالنسبة للفأر الذي وزنه 40 g ، سنجلب 8.2 μL من الجسيمات الشحمية إلى الحجم النهائي البالغ 50 μL في محلول ملحي. باستخدام DLS / ELS ، يجب أيضا تحديد عدد الجسيمات الشحمية لكل وحدة حجم لتحضير الجسيمات الشحمية المحملة بالأدوية والمركبات لضمان إعطاء عدد متساو من الجسيمات الشحمية للمركبة لكل جرام من وزن الفأر مقارنة بالليبوزومات المحملة بالأدوية. - قم بتحميل محلول الجسيمات الشحمية في إبرة 27 جم في خزانة السلامة الحيوية. احتفظ بهذا في درجة حرارة الغرفة لتجنب حقن محلول بارد في الماوس.
3. إدارة الجسيمات الشحمية عن طريق الحقن الوريدي خلف الحجاج
ملاحظة: من المناسب أيضا إجراء الحقن في الوريد بطرق أخرى ، مثل حقن الوريد الذيل إذا كان ذلك مفضلا. على الرغم من عدم تغطيتها في هذا البروتوكول ، تتوفر بروتوكولات منشورة تشرح هذه الطريقة19 .
- قم بإعداد مساحة العمل لتوصيل الجسيمات الشحمية.
- نظف طاولة العمل بنسبة 70٪ إيثانول. تأكد من تحديد مساحة تسمح باستخدام نظام التخدير isoflurane.
- قم بتشغيل وسادة تدفئة وضع وسادة نظيفة أو منشفة فوقها للحفاظ على الماوس على سطح نظيف. اترك وقتا كافيا للوسادة للإحماء قبل البدء في العمل مع الفئران.
- قم بإعداد نظام التخدير بحيث تكون الغرفة قريبة ومخروط الأنف على وسادة التدفئة.
- تأكد من أن جميع الجوانب الأخرى للنظام جاهزة (على سبيل المثال ، مستوى الأيزوفلوران مرتفع بدرجة كافية في المرذاذ ، وقد تم وزن مرشح الفحم ، وتم توصيل الأنبوب بشكل صحيح).
- اجمع المواد الأخرى اللازمة لهذا القسم من البروتوكول: جل تشحيم العيون ، مخدر موضعي لعلاج ما بعد الإعطاء ، ضمادات شاش معقمة.
- قم بتخدير الماوس باستخدام الأيزوفلوران في غرفة الحث. بمجرد عدم استجابته لنقرة القدم اللطيفة ، انقل الماوس بسرعة إلى مساحة العمل مع الحفاظ على التخدير من خلال مخروط الأنف.
ملاحظة: يجب الحفاظ على الحيوان عند 1.5٪ إلى 2.5٪ إيزوفلوران وتقييمه للحصول على عمق مناسب للتخدير (عن طريق عدم الاستجابة لقرص إصبع القدم) قبل الشروع في الإجراء. - انقل الماوس إلى جانب واحد لإدارة الجسيمات الشحمية. نظرا لأن الفأر لن يرمش أثناء التخدير ، ضع كمية صغيرة من مواد التشحيم العينية على كلتا العينين للحفاظ على ترطيبها خلال الفترة المتبقية من الإجراء.
- اضغط برفق على الجلد فوق وتحت العين المكشوفة. يجب أن ترفع العين فوق مستوى الوجه.
- أدخل طرف الإبرة بعناية في العلبة الإنسية ، مع التأكد من أن الإبرة أسفل العين وعدم لمسها. بمجرد إدخال الإبرة أسفل العين ، قم بحقن الجسيمات الشحمية ببطء في الفضاء خلف المدار. عند سحب الإبرة ، قد يكون من الضروري إغلاق الجفون لبضع ثوان لتحقيق الإرقاء.
- إذا لم يتم إدخال الإبرة بعيدا بما فيه الكفاية ، فقد يظهر المحلول حول العين. توقف عن الحقن فورا إذا شوهد ذلك وأعد وضع الإبرة.
- ضع مخدرا موضعيا ، مثل البروباراكايين ، على العين لمنع الألم وعدم الراحة بعد العملية.
- احتفظ بالماوس على وسادة تدفئة وراقبه حتى يستيقظ للتأكد من أنه جيد ويحافظ على درجة حرارة الجسم المناسبة.
- أعد الماوس إلى قفصه وبيئته السكنية العادية حتى تصل نقطة الاهتمام.
ملاحظة: يجب أن يتم ذلك بما يتماشى مع إرشادات IACUC المحلية.
4. إعداد المواد اللازمة لحصاد الأنسجة ، ومعالجة الأنسجة ، وتلطيخ التدفق الخلوي
- تحضير محاليل للحصاد والمعالجة والتلوين (الأقسام 5-7): محلول ملحي مخزن بالفوسفات (PBS) - الهيبارين ، HEPES Buffer ، 2 مجم / مل كولاجيناز من النوع الأول ، مخزن تحلل AKC ، مخزن FACS ، PBS ، مخزن التثبيت (الجدول 2). احتفظ بجميع المحاليل باستثناء المخزن المؤقت للتثبيت عند 4 درجات مئوية أو على الثلج أثناء الإجراء.
- تحضير الأنابيب مع المخازن المؤقتة وغيرها من المواد لحصاد ومعالجة الأنسجة.
- بالنسبة للدم من كل فأر ، أضف 10 ميكرولتر من 0.5 M EDTA إلى أنبوب طرد مركزي دقيق 1.5 أو 1.7 مل لجمع الدم. سيمنع EDTA الدم من التجلط. هناك حاجة أيضا إلى حقنة 1 مل بإبرة 25 جرام وأنبوب مخروطي 15 مل.
- بالنسبة للطحال ، اجمع أنبوب طرد مركزي صغير سعة 1.5 أو 1.7 مل مع 1 مل من المخزن المؤقت HEPES ، وحقنة سعة 1 مل ، وأنبوبين مخروطيين سعة 50 مل ، ومرشحين 70 ميكرومتر لكل طحال.
- لكل مستودع للأنسجة الدهنية ، اجمع قارورة بولي إيثيلين سعة 20 مل مع 1.5 مل من المخزن المؤقت HEPES لفرم الأنسجة ، وأنبوب مخروطي سعة 50 مل ، ومرشح 70 ميكرومتر لكل نوع من الأنسجة الدهنية لكل فأر.
- تحضير مساحة العمل للحصاد.
- نظف مساحة المقعد بنسبة 70٪ من الإيثانول. قم بإعداد صينية مطاطية لتثبيت الماوس أثناء الحصاد عن طريق تنظيفه بنسبة 70٪ من الإيثانول وتغطيته بوسادة ماصة أو مناشف ورقية. تأكد من توفر 5 دبابيس على الأقل للعمل معها.
- املأ حقنة سعة 10 مل ب PBS-heparin واربطها بإبرة 25 جم للتروية.
- اجمع الأدوات والمواد لاستخدامها أثناء الحصاد. هناك حاجة إلى ملقط (زوجان) ، ومقص ، ومناشف ورقية ، ومناديل خالية من النسالة ، وأنبوب (أنابيب) الطرد المركزي الدقيقة مع EDTA ، وأنبوب (أنابيب) الطرد المركزي الدقيقة مع عازل HEPES ، وقوارير (قوارير) البولي إيثيلين مع مخزن HEPES.
5. حصاد الأنسجة
- القتل الرحيم للفأر عن طريق الاختناق CO2 . لا تجري خلع عنق الرحم لأن هذا قد يمنع جمع الدم الفعال وتروية الأنسجة في خطوات لاحقة.
- في منطقة مقعد نظيفة مع مساحة عمل وإضاءة كافية لرؤية الماوس جيدا ، قم بإعداد صينية تشريح مطاطية ، ودلو من الثلج لتخزين العينات ، وزجاجة رذاذ تحتوي على 70٪ من الإيثانول. رش الماوس بنسبة 70٪ من الإيثانول لتقليل التلوث والتحكم في انتشار الشعر. ضع الماوس على ظهره على الدرج المطاطي وقم بتثبيت مخالبه المنتشرة بعيدا عن جسمه.
- للتحضير لجمع الدم ، قم بإجراء شق في الجلد بعناية على حافة الطرف الذيلي للقفص الصدري للفأر. اقطع خطا صغيرا مستقيما باتجاه رأس الفأر (حوالي 1 سم) حتى تنكشف عضلات الصدر.
- في موقع الشق الأولي ، قم بعمل قطعتين صغيرتين عموديتين على الخط باتجاه الرأس. ثم ، قطع بعناية العضلة الصدرية على جانب واحد من القفص الصدري في المنطقة المكشوفة. يتيح ذلك وصولا وتصورا أفضل للمكان الذي يجب إدخال الإبرة فيه.
- لجمع الدم ، أدخل الإبرة بين الضلعين الثالث والرابع على الجانب الذي تمت إزالة العضلات منه. نظرا لوجود قلب الفأر في وسط تجويف الصدر ، احتفظ بالإبرة بالقرب من الخط المركزي للقفص الصدري قدر الإمكان. بمجرد إدخاله ، اسحب المحقنة برفق لبدء جمع الدم.
- بمجرد جمعها ، انقل الدم إلى أنبوب الطرد المركزي الدقيق المحضر باستخدام EDTA واحفظه على الجليد.
ملاحظة: إذا تم سحب حوالي 100 ميكرولتر من الحجم لأعلى ولم يدخل أي دم إلى المحقنة ، فحاول تدوير المحقنة إلى اليمين أو اليسار في حالة ضغط فتحة الإبرة على جدار القلب. إذا لم يساعد ذلك ، حرك الإبرة ببطء في تجويف الصدر أو ابدأ في الإزالة. إذا بدأ الدم في التجمع في المحقنة في هذه المرحلة ، فاستمر في سحب المحقنة ببطء. ضع في اعتبارك تدوير المحقنة والإبرة للاستخراج الناجح. أخيرا ، إذا لم يتم جمع الدم ، فقم بإزالة الإبرة لأنها قد تكون فاتتها القلب. حاول إعادة إدخال الإبرة وتكرار العملية المذكورة أعلاه مرة أخرى.
- بعد ذلك ، لتخلل الماوس ، افتح تجويف الصدر للوصول إلى القلب.
- للقيام بذلك ، قم بقص الجلد على طول نهاية القفص الصدري وصولا إلى جانب الماوس على كل جانب. ثم استخدم الملقط لتثبيت القص بعيدا عن سطح العمل. قم بعمل شق صغير ضحل أسفل نهاية القص مباشرة لقطع التجويف البريتوني. قطع على طول الغشاء البريتوني على طول نهاية القفص الصدري على كل جانب من جوانب الماوس. هذا يجب أن يفضح الكبد والمرارة. احرص على عدم قطع أي من هذه الأنسجة.
- بعد ذلك ، قم بعمل قطع صغير ضحل في الحجاب الحاجز ، الجمجمة إلى الكبد. ثم اقطع الحجاب الحاجز على طول حافة القفص الصدري لفتح تجويف الصدر. تأكد من تجنب قطع أي من الأعضاء داخل تجويف الصدر.
- قم بعمل قطعتين على طول القفص الصدري باتجاه الرأس حوالي 2-3 مم من الخط المركزي للماوس وطوله حوالي 0.75 سم.
ملاحظة: إذا تم تقطيعه بدرجة عالية جدا ، قطع الشرايين الموجودة في الجزء العلوي من القفص الصدري. هذا سوف يتداخل مع فعالية التروية. - ارفع الجزء الأوسط من القفص الصدري للخلف لكشف تجويف الصدر. انقل أي دهون أو أنسجة بعيدا للوصول إلى القلب.
- قم بعمل قطع صغير في الأذين الأيمن لقلب الفأر لإنشاء فتحة يمكن من خلالها دفع الدم للخارج.
- باستخدام حقنة 10 مل من PBS-heparin ، أدخل الإبرة في البطين الأيسر لقلب الفأر.
- ابدأ برفق في دفع برنامج تلفزيوني إلى القلب ببطء قدر الإمكان.
ملاحظة: يجب ملاحظة خروج الدم من الأذينين الأيمن وملء تجويف الصدر. تأكد من إبقاء القلب في موقعه الفسيولوجي لتجنب تثبيط تدفق PBS-heparin من القلب عبر الشريان الأورطي. - بمجرد أن يتم إدخال كل 10 مل من PBS-heparin من خلال الماوس ، تخلص من المحقنة والإبرة وقم بإزالة الدم الزائد و PBS-Heparin من تجويف الصدر باستخدام مناشف ورقية أو مناديل خالية من النسالة.
- بعد ذلك ، لبدء استخراج الأنسجة ، قم بقطع الجلد والغشاء البريتوني باتجاه ذيل الفأر لفتح التجويف البريتوني.
- أولا ، قم باستخراج وسادة الأنسجة الدهنية الأربية من كل جانب من جوانب الماوس.
ملاحظة: اقرأ هذه العملية بعناية: تأكد من استخراج العقدة الليمفاوية الأربية من كل مستودع لتجنب تحريف التركيب الخلوي للأنسجة الدهنية في النتائج.- باستخدام مجموعة ثانية من الملقط ، أمسك الغشاء البريتوني بمجموعة واحدة من الملقط وحافة الجلد متراكبة فوق الغشاء على هذا الجانب مع الملقط الآخر. اسحب الجلد برفق بعيدا عن الغشاء البريتوني لفصل هذه الطبقات عن بعضها البعض. ابحث عن مستودع الأنسجة الدهنية الأربية على طول الجلد. ثبت الحافة الخارجية للجلد للوصول بشكل أفضل إلى المستودع الدهني.
- قبل الاستخراج ، حدد موقع العقدة الليمفاوية الأربية في وسط المستودع الدهني وقم بإزالتها باستخدام ملقط ومقص حسب الحاجة.
ملاحظة: إذا أمكن ، حدد موقع الشرايين الثلاثة الأكبر التي تمتد من الحواف الخارجية للمستودع باتجاه المركز. تقع العقدة الليمفاوية حول مكان التقاء هذه الشرايين. - بعد إزالة العقدة الليمفاوية ، أمسك بعناية نهاية المستودع الدهني الأقرب إلى النقطة المثبتة بالملقط وابدأ في عمل جروح صغيرة في الغشاء الضام بين الأنسجة الدهنية والجلد. ارفع الأنسجة الدهنية بعيدا عن الجلد أثناء إجراء جروح للوصول بشكل أفضل إلى الغشاء والتأكد من استخراج المستودع بالكامل.
- ضع المستودع الدهني في قارورة بولي إيثيلين محضرة مع مخزن مؤقت HEPES على الثلج للحفاظ على الأنسجة قابلة للحياة خلال الفترة المتبقية من الحصاد.
- كرر هذه العملية على الجانب الآخر من الماوس لاستخراج كلا المستودعين. يمكن هضم المستودعات ومعالجتها معا أو بشكل منفصل. إذا كان سيتم معالجة كل مستودع بشكل منفصل ، فيجب إعداد المزيد من الأنابيب.
- بعد ذلك ، استخرج مستودعات البربخ الدهنية من النهاية الذيلية للتجويف البريتوني. باستخدام الملقط ، اسحب برفق أول طريقة مستودع دهني للبربخ من الطرف الظهري للفأر وحدد موقع البربخ والأسهر المرفقة بهذا المستودع.
ملاحظة: يوجد مستودعان دهنيان للبربخ: أحدهما متصل بكل من البربخ والأسهر.- قطع بعناية بين المستودع الدهني والبربخ والأسهر لفصل الدهون عن هذه الأنسجة الأخرى. ضع المستودع الدهني في قارورة من البولي إيثيلين مع مخزن مؤقت HEPES على الثلج للحفاظ على الأنسجة قابلة للحياة خلال الفترة المتبقية من الحصاد.
- أخيرا ، استخرج الطحال الموجود على يسار المعدة بالقرب من الحجاب الحاجز. باستخدام الملقط ، اسحب المعدة برفق نحو مركز التجويف البريتوني لفضح الطحال.
- أمسك أحد طرفي الطحال برفق واسحبه بعيدا قليلا عن المعدة. قطع الغشاء بين الطحال والأنسجة المجاورة له حتى يتم فصل العضو. ضع الطحال في أنبوب الطرد المركزي الدقيق المجهز مع عازل HEPES واحفظه على الثلج.
- قبل معالجة المناديل أو حصاد الأنسجة من الفأر التالي ، تخلص من الذبيحة وأي مناشف أو وسادات ورقية متسخة. امسح الأدوات أيضا.
ملاحظة: إذا كان هناك العديد من الفئران ، كرر خطوات الحصاد هذه لكل فأر قبل الانتقال إلى خطوة المعالجة التالية. إذا تم تضمين فأر / فئران تحكم ، ففكر في حصادها قبل الفئران المعالجة بالليبوزوم لتجنب أي تلوث.
6. معالجة الأنسجة
ملاحظة: نظرا لأن الأنسجة الدهنية لديها حضانة هضم طويلة ، فمن المستحسن البدء بهذه العملية أولا والعمل على معالجة الدم والطحال خلال فترة الهضم.
- أولا ، اللحم المفروم وهضم الأنسجة الدهنية. باستخدام واحد أو اثنين من أزواج المقصات ، قم بفرم الأنسجة الدهنية في كل قارورة من البولي إيثيلين حتى يصبح النسيج في قطع صغيرة يقل حجمها عن 0.5 مم. هذا يسمح لعملية هضم أكثر كفاءة.
- بمجرد فرم الأنسجة في جميع القوارير ، أضف 1.5 مل من 2 مجم / مل من محلول كولاجيناز إلى كل قارورة. ضع القوارير في حاضنة اهتزاز مضبوطة على 37 درجة مئوية و 150 دورة في الدقيقة. احتضان لمدة 30 إلى 45 دقيقة.
ملاحظة: إذا كانت الأنسجة الدهنية كبيرة بشكل خاص ، ففكر في إضافة 0.5 مل أخرى إلى 1.5 مل من المخزن المؤقت HEPES وحجم متساو من محلول كولاجيناز إلى القارورة (القارورة) لضمان غمر الأنسجة بالكامل ووجود إنزيم كاف. يجب أن يكون التركيز النهائي للكولاجيناز من النوع الأول عند الهضم 1 مجم / مل بغض النظر عن حجم المحلول النهائي. علاوة على ذلك ، في حالة عدم توفر حاضنة اهتزاز ، يمكن وضع العينات في حمام مائي يتم تسخينه إلى 37 درجة مئوية. رج العينات برفق كل 5 دقائق لخلط وإعادة تعليق عملية الهضم. - تحقق من العينات في 30 دقيقة. استخدم ماصة سعة 1 مل لسحب العينة لأعلى ولأسفل. إذا كانت قطع الأنسجة لا تزال كبيرة جدا بحيث لا يمكن سحبها بسهولة ، فأعد العينات إلى الحاضنة لمدة 15 دقيقة إضافية.
- بمجرد هضم العينات بالكامل ، استمر في سحب العينة لأعلى ولأسفل 10 مرات أخرى لضمان إنشاء تعليق أحادي الخلية.
ملاحظة: (اختياري) افحص العينات في 30 دقيقة. استخدم ماصة سعة 1 مل لسحب العينة لأعلى ولأسفل. إذا كانت قطع الأنسجة لا تزال كبيرة جدا بحيث لا يمكن سحبها بسهولة ، فأعد العينات إلى الحاضنة لمدة 15 دقيقة إضافية. - ماصة تعليق الخلية من خلال مرشح 70 ميكرومتر في أنبوب مخروطي 50 مل. أضف 5 مل من المخزن المؤقت FACS إلى قارورة الهضم الفارغة لغسل القارورة. انقل هذا المخزن المؤقت للغسيل من خلال الفلتر لإضافته إلى تعليق الخلية.
- قم بتخزين العينات على الثلج بينما تتم معالجة عينات أخرى. بمجرد تصفية جميع العينات ، قم بتدويرها لأسفل عند 400 × جم ، 4 درجات مئوية لمدة 5 دقائق.
- قم بإزالة المادة الطافية للخلايا الشحمية عن طريق الشفط ثم قم بإزالة المادة تحت الحمراء بعناية بين طافد الخلايا الشحمية والحبيبات عن طريق الشفط لترك حبيبات الجزء اللحمي الوعائي (SVF).
- أعد تعليق هذه الحبيبات في 1 مل من المخزن المؤقت FACS وانقلها إلى أنبوب طرد مركزي دقيق نظيف سعة 1.5 أو 1.7 مل. خلايا القسمة الآن إذا رغبت في ذلك أو دعت الحاجة. احتفظ بالثلج حتى تصبح جميع العينات جاهزة لتلطيخ قياس التدفق الخلوي.
ملاحظة: إذا كانت المستودعات الدهنية المهضومة كبيرة ، ففكر فقط في استخدام 50٪ أو 25٪ من العينة لتلطيخ وتحليل التدفق الخلوي. بالإضافة إلى ذلك ، إذا كانت هناك حاجة إلى أي عناصر تحكم مضان ناقص واحد (FMO) أو عناصر تحكم إضافية لتحليل قياس التدفق الخلوي (الجدول 1) ، فتأكد من تنصيب عينة إضافية في أنبوب منفصل للمعالجة. تستخدم FMOs للتمييز بين الإشارة السلبية والإيجابية لجسم مضاد فردي مقترن بالفلوروفور داخل اللوحة الكاملة المستخدمة في التجربة.
- بمجرد فرم الأنسجة في جميع القوارير ، أضف 1.5 مل من 2 مجم / مل من محلول كولاجيناز إلى كل قارورة. ضع القوارير في حاضنة اهتزاز مضبوطة على 37 درجة مئوية و 150 دورة في الدقيقة. احتضان لمدة 30 إلى 45 دقيقة.
- ثانيا ، معالجة الدم.
- نقل 50 ميكرولتر من الدم إلى أنبوب مخروطي سعة 15 مل.
- أضف 1 مل من المخزن المؤقت لتحلل AKC إلى كل أنبوب واسحب لأعلى ولأسفل للوصول إلى تعليق أحادي الخلية. أضف 4 مل إضافية من محلول تحلل AKC إلى كل أنبوب واحتضانها لمدة 5-10 دقائق. في حالة توفر شاكر أو دوار ، أغلق أغطية الأنبوب بإحكام وضع الأنابيب على أحدها لتعزيز الخلط.
- أضف 5 مل من المخزن المؤقت FACS لإخماد عملية التحلل وتدوير العينات عند 400 × جم ، 4 درجات مئوية لمدة 5 دقائق. قم بإزالة المادة الطافية وتحقق من الحبيبات. إذا كان لا يزال أحمر تماما ، كرر عملية التحلل. خلاف ذلك ، أعد تعليق الكريات في 1 مل من المخزن المؤقت FACS وانقلها إلى أنبوب طرد مركزي دقيق نظيف 1.5 أو 1.7 مل. احتفظ بالثلج حتى تصبح جميع العينات جاهزة لتلطيخ قياس التدفق الخلوي.
- أخيرا ، قم بمعالجة الطحال. انقل الطحال إلى مرشح 70 ميكرومتر على أنبوب مخروطي سعة 50 مل. اغسل المنديل ب 1 مل من محلول FACS ثم اهرس الطحال من خلال المرشح باستخدام طرف المكبس لحقنة سعة 1 مل. خلال عملية الهرس ، اغسل الخلايا في أنبوب مخروطي سعة 50 مل باستخدام المزيد من المخزن المؤقت FACS. يجب أن يكون الحجم النهائي في الأنبوب المخروطي 10 مل.
- أدر الخلايا عند 300 × جم عند 4 درجات مئوية لمدة 5 دقائق. قم بإزالة المادة الطافية وأعد تعليقها في 1 مل من المخزن المؤقت لتحلل AKC. أضف 4 مل إضافية من محلول تحلل AKC واحتضانها لمدة 5 دقائق. أضف 5 مل من المخزن المؤقت FACS لإخماد عملية التحلل وتدوير العينات عند 300 × جم عند 4 درجات مئوية لمدة 5 دقائق.
- قم بإزالة المادة الطافية وأعد تعليق الحبيبات في 1 مل من المخزن المؤقت FACS. انقل التعليق من خلال مرشح ثان نظيف 70 ميكرومتر إلى أنبوب مخروطي سعة 50 مل. أضف 4 مل من المخزن المؤقت FACS لغسل الأنبوب الأصلي ونقل المخزن المؤقت عبر المرشح للحصول على حجم نهائي قدره 5 مل.
- انقل 50 ميكرولتر من تعليق الخلية إلى أنبوب طرد مركزي صغير نظيف سعة 1.5 أو 1.7 مل واحتفظ به على الجليد حتى تصبح جميع العينات جاهزة لتلطيخ قياس التدفق الخلوي. يمكن نقل القسامات الإضافية إلى الأنابيب إذا كان هناك المزيد من الرغبة أو الحاجة.
ملاحظة: الخلايا الطحالية هي خلايا ممتازة لاستخدامها في بقعة واحدة حية / ميتة. ضع في اعتبارك نقل حصة إضافية لعنصر التحكم هذا.
7. وصمة عار الخلايا من الأنسجة لقياس التدفق الخلوي
- قم بتدوير العينات المقتبسة عند 400 × جم ، 4 درجات مئوية لمدة 5 دقائق.
- إزالة المواد الطافية وإعادة تعليق العينات في 50 ميكرولتر من كتلة Fc (مخففة) (الجدول 2). احتضان على الجليد لمدة 5 دقائق.
- أضف 50 ميكرولتر من مزيج 2x من الأجسام المضادة (الجدول 3) لكل عينة. احتضان على الجليد في الظلام لمدة 20 دقيقة.
ملاحظة: لا ينبغي تلطيخ أي بقع مفردة بمزيج الأجسام المضادة هذا. بالإضافة إلى ذلك ، إذا كان سيتم استخدام FMOs ، يجب تحضير مزيج الأجسام المضادة FMO بشكل منفصل. - اغسل العينات ب 1 مل من PBS وقم بتدويرها عند 400 × جم ، 4 درجات مئوية لمدة 5 دقائق. إزالة المادة الطافية وإعادة تعليق العينات في 200 ميكرولتر من بقعة الصلاحية (الجدول 3). احتضان على الجليد في الظلام لمدة 20 دقيقة.
ملاحظة: لا تنس تلطيخ الخلايا التي تم وضعها جانبا لبقعة واحدة حية / ميتة خلال هذه الخطوة. - اغسل العينات ب 1 مل من محلول FACS وقم بتدويرها عند 400 × جم ، 4 درجات مئوية لمدة 5 دقائق. قم بإزالة المواد الطافية وإعادة تعليق العينات (باستثناء البقعة المفردة الحية / الميتة) في 50 ميكرولتر من وسط التثبيت (الكاشف أ) لإصلاح العينات. احتضان في درجة حرارة الغرفة في الظلام لمدة 15 دقيقة.
- أعد تعليق البقعة المفردة الحية / الميتة في 100 ميكرولتر من 2٪ PFA. احتضان في درجة حرارة الغرفة في الظلام لمدة 5 دقائق.
- اغسل العينة ب 1 مل من المخزن المؤقت FACS وقم بتدويرها عند 800 × جم ، 4 درجات مئوية لمدة 5 دقائق. إزالة المواد الطافية وإعادة تعليق العينات في 250 إلى 500 ميكرولتر من المخزن المؤقت FACS. يخزن في درجة حرارة 4 درجات مئوية حتى يمكن تشغيل العينات على مقياس التدفق الخلوي.
- اغسل العينات ب 1 مل من محلول FACS وقم بتدويرها عند 800 × جم ، 4 درجات مئوية لمدة 5 دقائق. قم بإزالة المادة الطافية وإعادة تعليق العينات في 50 ميكرولتر من وسط النفاذية (الكاشف B) بالإضافة إلى الأجسام المضادة / البروتينات داخل الخلايا. احتضان في درجة حرارة الغرفة في الظلام لمدة 20 دقيقة.
- اغسل العينات ب 1 مل من محلول FACS وقم بتدويرها عند 800 × جم عند 4 درجات مئوية لمدة 5 دقائق. قم بإزالة المادة الطافية وإعادة تعليق العينات في 100 ميكرولتر من 2٪ بارافورمالدهيد (PFA). احتضان في درجة حرارة الغرفة في الظلام لمدة 5 دقائق.
- اغسل العينات ب 1 مل من محلول FACS وقم بتدويرها عند 800 × جم ، 4 درجات مئوية لمدة 5 دقائق. إزالة المادة الطافية وإعادة تعليق العينات في 250 إلى 500 ميكرولتر من المخزن المؤقت FACS. يخزن في درجة حرارة 4 درجات مئوية حتى يمكن تشغيل العينات على مقياس التدفق الخلوي.
النتائج
إنتاج الجسيمات الشحمية
النتائج المنشورة هنا مشابهة لتلك الموجودة في عملناالمنشور سابقا 3،4،20. باستخدام البروتوكول المعروض هنا، نتوقع إنتاج جسيمات شحمية بحجم 150-160 نانومتر تقريبا. يكشف DLS عن متوسط قطر الجسيمات الشحمية البالغ 163.2 نانومتر وإمكانية زيتا -19.2 مللي فولت (الشكل 1 أ). يكشف التصوير المجهري الإلكتروني المبرد (cryo-EM) عن الجسيمات الشحمية الدائرية (الشكل 1 ب) ويكشف مخطط DLS عن انحراف معياري صغير نسبيا عن متوسط القطر (الشكل 1C).
يتطلب الارتباط الإيجابي للجسيم الشحمي تحكما معالجا ب PBS
بحثت الدراسات السابقة من مجموعتنا التي تستخدم هذا البروتوكول في مجموعات الخلايا الفرعية في SVF الدهنية والطحال والدم المرتبط بالليبوزومات بعد أسبوع واحد من الإدارة في الجسم الحي 3,4. باستخدام فأر معالج ب PBS ، تم تلطيخ التجويف البريتوني وخلايا الطحال بنفس لوحة الأجسام المضادة المستخدمة في عينات من الفئران المعالجة بالليبوزوم. تم حصاد الأنسجة بعد أسبوع واحد من العلاج (الشكل 2 أ). كانت العينات المأخوذة من الفأر المعالج ب PBS بمثابة DiD FMO لإنشاء بوابات DiD إيجابية (الشكل 2ب ، ج). يمكن إنشاء بوابة موجبة باستخدام إشارة DiD الإيجابية ، ولكن يجب أيضا استخدام العينات التي تفتقر إلى إشارة DiD للتحقق من أن البوابة الموجبة لا تتضمن أي عينات سلبية DiD.
هناك حاجة إلى المعايرة بالتحليل الحجمي لتحسين إشارات التألق
قبل تنفيذ تجربة كاملة ، يجب تحسين الظروف المختلفة بما في ذلك تركيز الأجسام المضادة المقترنة بالفلورسنت المستخدمة أثناء تلطيخ الخلايا وصبغة الدهون المستخدمة أثناء تحضير الجسيمات الشحمية. تحتوي مقاييس التدفق الخلوي على حد أعلى للكشف عن شدة التألق ، لذا فإن الكثير من الصبغة المدمجة في الجسيمات الشحمية ستؤدي إلى مستويات غير قابلة للقياس الكمي من إشارة DiD في العينات التي يتم تشغيلها عبر مقياس الخلايا. علاوة على ذلك ، قد يؤدي الكثير من DiD في الجسيمات الشحمية إلى مستويات عالية من نقل الصبغة غير المحددة ، مما قد يؤدي إلى انحراف نتائج امتصاص الخلايا. يوضح الشكل 3 نتائج تجربة تمت فيها معايرة تركيزات صبغة الدهون لتحديد التركيز الذي من شأنه أن ينتج إشارة مثالية ضمن نطاق الكشف عن مقياس التدفق الخلوي المستخدم. تم إجراء ذلك على الأنسجة ذات الأهمية للتجربة النهائية: الدم (الشكل 3 أ) ، SVF الدهني الإربي (الشكل 3 ب) ، و SVF الدهني البربخ (الشكل 3 ج). كانت التركيزات المختارة للاختبار 10 ملغ من DiD (مرتفع ، أحمر) ، 1 ملغ DiD (متوسط ، أزرق) ، أو 0.1 ملغ من DiD (منخفض ، رمادي) لكل 1 مل من الجسيمات الشحمية. كان أعلى تركيز مستخدم في الجسيمات الشحمية مرتفعا جدا وتجاوز النطاق القابل للقياس الكمي للمقياس الخلوي في الأنسجة الثلاثة (الشكل 3أ - ج ، أحمر). أظهر أدنى تركيز ل DiD بعض الإشارات (الشكل 3 A\u2012C، رمادي)، ولكن لم يلاحظ وجود مجموعة واضحة خارج الخلايا المعالجة ب PBS (الشكل 3 A\u2012C، أسود). عند القياس الكمي ، أظهر المتوسط الحسابي ل DiD MFI لكل نسيج وتركيز تمييزا واضحا بين عناصر تحكم PBS والتركيز الأوسط ل DiD (الشكل 3D). وهكذا ، كما هو موضح في البروتوكول ، اخترنا التركيز الأوسط (الشكل 3 ، الأزرق) لاستخدامه في تحضير الجسيمات الشحمية.
يسمح استخدام لوحة الأجسام المضادة المتعددة بتحديد امتصاص الجسيمات الشحمية بواسطة مجموعات فرعية مختلفة من الخلايا
باستخدام اللوحة الموضحة في الجدول 3 ، تم تلوين الخلايا بالأجسام المضادة ضد علامات البلاعم ، والخلايا البائية ، والخلايا التائية ، والخلايا المتغصنة ، والوحيدات ، والخلايا البطانية (الشكل 4). هناك حاجة إلى استراتيجيات بوابات مختلفة قليلا لكل نوع من الأنسجة ، ولكن يمكن تحديد معظم أنواع الخلايا نفسها في كل منها. تشمل بعض الاستثناءات الخلايا البطانية ، التي لا توجد عادة في الدم ، والوحيدات ، والتي عادة ما تكون بتردد أعلى في الدم من الأنسجة الأخرى. بمجرد تحديد السكان ، يمكن تحديد الحجم الإجمالي لكل خلية وعدد مرات DiD +. يمكن إجراء المزيد من الحسابات لتوصيف مجتمع DiD +: ما هي النسبة المئوية لخلايا DiD + هي الضامة والخلايا البطانية وما إلى ذلك. يرجى ملاحظة أن هذه أمثلة على استراتيجيات البوابات ، ولكنها ليست الطريقة الوحيدة لتحليل العينات. سيتم إملاء التحليل من خلال اللوحة المحددة ومقياس (مقياسات) التدفق الخلوي المتاح.
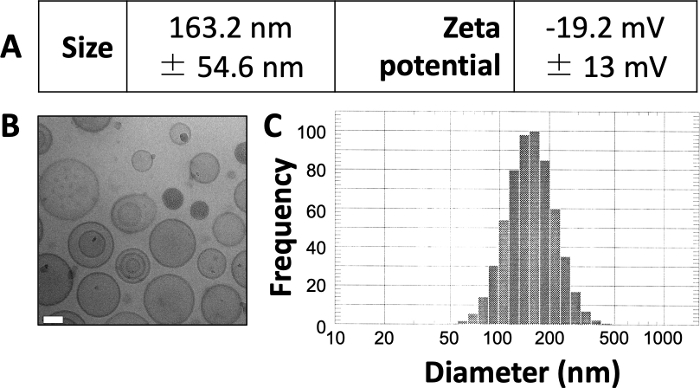
الشكل 1: مثال على خواص الجسيمات الشحمية المحضرة.
(أ) تم قياس الحجم وجهد زيتا كما هو موضح أعلاه وتم الإبلاغ عنهما في شكل جدول. يتم تقديم كل معلمة كمتوسط ± الانحراف المعياري. (ب) استخدم Cryo-EM لتصوير الجسيمات الشحمية المحضرة. يبلغ طول شريط المقياس الأبيض 50 نانومتر. (ج) استخدم DLS لتوليد مدرج تكراري لقطر الجسيمات الشحمية في هذا الإعداد. هذا الرقم مقتبس من Osinski et al.3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
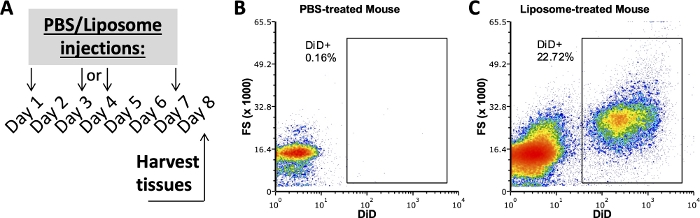
الشكل 2: تلطيخ DiD التمثيلي من الفئران المعالجة ب PBS أو الجسيمات الشحمية.
(أ) رسم تخطيطي تجريبي ل PBS وعلاجات الجسيمات الشحمية. تم حقن PBS أو الجسيمات الشحمية ثلاث مرات على مدار أسبوع واحد. تم حصاد الأنسجة في اليوم 8 من العلاج. (ب، ج) تكشف مخططات التدفق التمثيلية عن تلطيخ DiD إيجابي في الفئران المعالجة بالليبوزوم (C) ، ولكن ليس الفئران المعالجة ب PBS (B). FSC ، مبعثر إلى الأمام. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
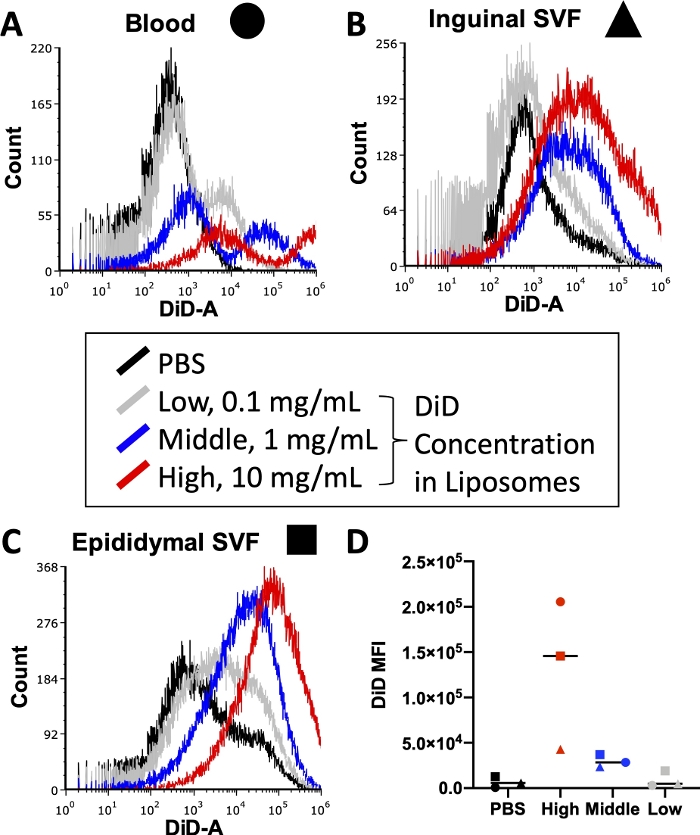
الشكل 3: معايرة DiD في الجسيمات الشحمية.
تم تحضير الجسيمات الشحمية بثلاثة تركيزات مختلفة من DiD وحقنها في الفئران. يشير اللون الرمادي إلى التركيز المنخفض عند 0.1 مجم DiD لكل 1 مل من الجسيمات الشحمية ، ويشير اللون الأزرق إلى التركيز المتوسط عند 1 مجم DiD / mL liposomes ، ويشير اللون الأحمر إلى التركيز العالي عند 10 مجم DiD / mL liposomes. تم استخدام ماوس معالج ب PBS كعنصر تحكم سلبي (أسود). تم حصاد الدم (A ، الدائرة) ، والدهون الأربية (B ، triange) ، والدهون البربخية (C ، مربعة) بعد 24 ساعة من الحقن ومعالجتها لعزل معلق أحادي الخلية. تم تشغيل هذه العينات على مقياس التدفق الخلوي إلى مستوى DiD القابل للكشف. يتم عرض الرسوم البيانية الخاصة بالأنسجة مع تراكبات كل مجموعة معالجة لإثبات شدة التألق لكل تركيز (A\u2012C). كما تم تحديد المتوسط الحسابي ل DiD لكل نسيج وتركيز ورسم (D). SSC = مبعثر جانبي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
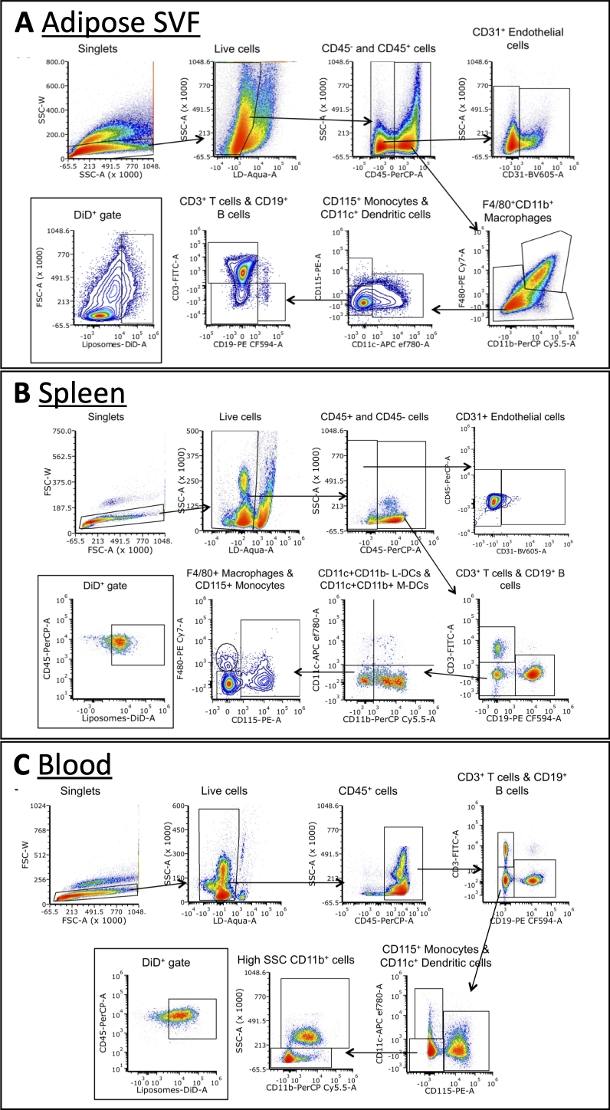
الشكل 4: تحليل قياس التدفق الخلوي التمثيلي للمجموعات الفرعية الخلوية في SVF الدهني والدم والطحال.
(أ\ج) ممثل تخطيطي لاستراتيجية البوابات لتحديد مجموعات فرعية من الخلايا وخلايا DiD + في SVF الدهنية (A) والطحال (B) والدم (C). الاختصارات: FSC = مبعثر أمامي ؛ LD = حي / ميت ؛ L-DCs = الخلايا المتغصنة اللمفاوية ؛ M-DCs = الخلايا المتغصنة النخاعية ؛ SSC = مبعثر جانبي. هذا الرقم مقتبس من Osinski et al.3. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| تحكم | قصد |
| الفأر المعالج ب PBS أو محلول ملحي | استخدم الخلايا من هذا الماوس لعناصر التحكم في قياس التدفق الخلوي التالية: |
| 1. الخلايا غير الملوثة | |
| 2. بقعة واحدة حية / ميتة | |
| 3. خلايا ملطخة باللوحة الكاملة ، ولكنها تفتقر إلى مضان الجسيمات الشحمية لتحديد إشارة الجسيمات الشحمية الإيجابية أثناء التحليل | |
| سيتم أيضا استخدام هذا / هذه الفئران / الفئران لتحديد ما إذا كان للجسيمات الشحمية أي تأثيرات في الجسم الحي حيث سيكون لديك تحكم غير ليبوزوم في تجربتك. | |
| الجسيمات الشحمية غير المحملة | إذا كنت تقوم بتحميل مركب في الجسيمات الشحمية الخاصة بك ، فيجب تصنيع جزء من دفعة الجسيمات الشحمية بدون المركب. هذا يفسر أي آثار في الجسم الحي للجسيمات الشحمية وحدها. |
| وحده | نظرا لأنه يمكن أيضا امتصاص DiD بواسطة الأغشية الخلوية ، فإن تخصيص بعض الفئران لتلقي صبغة مجانية بكمية مساوية لتلك الموجودة في الجسيمات الشحمية سيساعد في تفسير أي تلطيخ لغشاء الخلفية. |
| عناصر التحكم الفلورية ناقص واحد (FMO) | هذه خلايا ملطخة بجميع الأجسام المضادة الموجودة في اللوحة باستثناء واحد. مثل # 3 في المربع أعلاه ، يساعد هذا في تحديد إشارة إيجابية حقيقية لهذا الجسم المضاد أثناء التحليل |
الجدول 1: الضوابط التي يجب استخدامها في هذا البروتوكول.
| حل | مكونات | الحجم التقريبي المطلوب لكل دفعة / ماوس |
| إعداد الجسيمات الشحمية | ||
| خلات الكالسيوم | 1 M أسيتات الكالسيوم في H2O | 50 مل |
| العازلة HEPES | 10 mM HEPES في H2O ، درجة الحموضة 7.4 | 50 مل |
| تيساجليتازار في هيبس | في 10 مللي متر HEPES | 10 مل |
| حصاد الأنسجة ومعالجتها وتلطيخها | ||
| محلول مخزن بالفوسفات (PBS) | 137 مللي متر كلوريد الصوديوم ، 2.7 مللي مول KCl ، 10 مللي متر Na 2 HPO 4 ، 1.8 مللي متر KH 2 PO4 في H2O المقطر | 2 مل |
| برنامج تلفزيوني-هيبارين | 0.1 مللي متر الهيبارين في برنامج تلفزيوني | 10 مل |
| العازلة HEPES | 20 مللي متر HEPES في برنامج تلفزيوني | 5 مل |
| العازلة الهضم | 2 ملغ / مل كولاجيناز من النوع الأول في المخزن المؤقت HEPES | 5 مل |
| العازلة تحلل AKC | 0.158 م NH 3 Cl، 10 mM KHCO3 ، 0.1 mM Na 2 EDTA في ddH 2 O ، درجة الحموضة7.2 | 15 مل |
| المخزن المؤقت FACS | 1٪ BSA ، 0.05٪ NaN3 في PBS | 15 مل |
| كتلة Fc (مخففة) | 1:50 كتلة Fc في المخزن المؤقت FACS | 250 ميكرولتر |
| المخزن المؤقت للتثبيت | 2٪ بارافورمالدهيد في برنامج تلفزيوني | 200 ميكرولتر |
الجدول 2: حلول للتحضير.
| A | B | C | D |
| تلطيخ خارج الخلية (2x مزيج الأجسام المضادة) | |||
| مستضد | فلوروفور | حجم Ab لكل اختبار 100 ميكرولتر | الحجم الإجمالي المطلوب: |
| سي دي 45 | بيرسي بي | 0.5 ميكرولتر | العمود C × 1.2 × إجمالي # عينات |
| CD11b | بيركب سي 5.5 | 0.25 ميكرولتر | (0.5 ميكرولتر / اختبار) × (1.2) × (# عينات) |
| F4/80 | بي سي واي 7 | 0.25 ميكرولتر | (0.25 ميكرولتر / اختبار) × (1.2) × (# عينات) |
| سي دي 19 | بي-CF594 | 1 ميكرولتر | (0.25 ميكرولتر / اختبار) × (1.2) × (# عينات) |
| سي دي 3 | فيتك | 1 ميكرولتر | (1.0 ميكرولتر / اختبار) × (1.2) × (# عينات) |
| سي دي 31 | BV605 | 0.25 ميكرولتر | الخ... |
| CD11c | APC ef780 | 1 ميكرولتر | |
| سي دي 115 | بى | 1.5 ميكرولتر | |
| لإنشاء مزيج الأجسام المضادة الخاص بك ، ادمج الأجسام المضادة المحسوبة في العمود D مع المخزن المؤقت FACS أو Brilliant Violet Staining Buffer * إلى حجم نهائي يبلغ (50 ميكرولتر × 1.2 × إجمالي # عينات) | |||
| تلطيخ حي / ميت (1x) | |||
| حي/ميت | فلوروفور | حجم L / D لكل اختبار 200 uL | الحجم الإجمالي المطلوب: |
| حي/ميت | اكوا | 0.67 ميكرولتر | العمود C × 1.2 × إجمالي # عينات |
| تلطيخ داخل الخلايا (1x) | |||
| مستضد | فلوروفور | حجم Ab لكل اختبار 50 ميكرولتر | الحجم الإجمالي المطلوب: |
| αSMA | فيتك | 0.125 | العمود C × 1.2 × إجمالي # عينات |
| * يجب استخدام المخزن المؤقت للتلطيخ البنفسجي اللامع إذا تم استخدام أكثر من جسم مضاد واحد مقترن بفلوروفور بنفسجي لامع في لوحتك. | |||
الجدول 3: مثال على لوحة الأجسام المضادة وحسابات خلطات التلوين لاستخدامها في تلطيخ التدفق.
Discussion
هنا نصف بروتوكولا مكونا من ثلاثة أجزاء ل (i) تحضير الجسيمات الشحمية التي تحمل صبغة دهنية فلورية ومحملة بمركب مضاد للسكري ، tesaglitazar ، (ii) إعطاء الجسيمات الشحمية للفأر عن طريق الحقن المداري الخلفي ، و (iii) حصاد الأنسجة ومعالجتها وتلطيخها للكشف عن امتصاص الجسيمات الشحمية على المستوى الخلوي عن طريق قياس التدفق الخلوي. يستعرض هذا البروتوكول تحضير ما يقرب من 150 ميكرومتر من الجسيمات الشحمية وتقييم امتصاص الدهون والدم والطحال. يعد تحضير الجسيمات الشحمية قابلا للتطوير ، ويتم إجراؤه في الغالب في درجة حرارة الغرفة ، ويستخدم تبخر الطور العكسي لزيادة تحميل الدواء وإزالة المذيبات العضوية. باستخدام هذا البروتوكول ، يمكن تحقيق تركيز tesaglitazar يصل إلى 2 مجم / مل في عينة الجسيمات الشحمية المنقى. يمكن تخزين الجسيمات الشحمية المحضرة في مخزن HEPES المؤقت عند 4 درجات مئوية لأكثر من عام. في تجربتنا ، أظهروا الحد الأدنى من التباين في متوسط حجم الجسيمات. تم إثبات أقل من 10٪ من فقدان محتوى الدواء طيفيا ، بعد فصل الترشيح الفائق للجسيمات الشحمية عن الدواء الخارجي باستخدام مرشح طرد مركزي 10 كيلو دالتون.
أثناء تحضير الجسيمات الشحمية ، هناك بعض الخطوات والعوامل الحاسمة التي يجب مراعاتها. أولا ، ترتيب خطوات البروتوكول مهم ويجب الالتزام به. ثانيا ، يجب الحفاظ على الرقم الهيدروجيني للمحلول المستخدم عند تحميل tesaglitazar عند 7.4 من أجل زيادة الذوبان والتحميل الفعال. ثالثا ، يضمن التجميع الصحيح للمعدات والمرشحات أن يكون ناتج كل خطوة بالحجم والنقاء المناسبين. على سبيل المثال ، إذا لم يتم تجميع مرشحات 100 و 200 نانومتر بشكل صحيح ، فقد ينتج عن ذلك مجموعة أكثر تجانسا وغير مناسبة الحجم من الجسيمات الشحمية. رابعا ، هناك حاجة إلى الإزالة الكاملة لأسيتات الكالسيوم قبل تحميل الدواء لتحقيق أقصى قدر من نقل tesaglitazar إلى الجسيمات الشحمية. لاختبار الإزالة الكاملة لأسيتات الكالسيوم ، استخدم الترسيب عالي السرعة لإزالة الجسيمات الشحمية ثم قياس مستويات خلات الكالسيوم في المحلول غير الشحمي. خامسا ، من المهم وزن وتسجيل كتلة جميع المواد المضافة إلى إعداد الجسيمات الشحمية في كل خطوة. هذا يضمن إمكانية حساب التركيزات المناسبة والحفاظ على النسب المطلوبة من المواد. أخيرا ، إذا لم يتم تنفيذ التقنية بشكل صحيح ، فقد يكون هناك مستوى غير مرغوب فيه من عدم التجانس. من المهم التحقق بدقة من هذه المعلمة باستخدام DLS وطرق أخرى مثل المجهر الإلكتروني. لتحسين التجانس ، ضع في اعتبارك ضبط حجم المرشح المحدد أو تكديس مرشحين.
بالإضافة إلى ذلك ، من الأهمية بمكان أن يتم تخطيط وتحسين عناصر التحكم ولوحة الأجسام المضادة لقياس التدفق الخلوي قبل إجراء هذا البروتوكول بالكامل (الجدول 1 ، الجدول 3). يجب اختبار الأجسام المضادة لضمان استخدام التركيزات المناسبة للتلطيخ وأن التداخل بين الفلوروفورات ضئيل. يجب أيضا مراعاة إثارة وانبعاث الصبغة المستخدمة أثناء تحضير الجسيمات الشحمية في تخطيط اللوحة. في نتائجنا ، استخدمنا DiD ، الذي له إثارة وانبعاث مماثل للفلوروفورات مثل Allophycocyanin (APC) و AlexaFluor 647. وبالتالي ، لم نختار الأجسام المضادة المترافقة مع هذه الفلوروفورات في لوحة الأجسام المضادة الخاصة بنا. علاوة على ذلك ، لا يتم تضمين ضوابط النمط المتماثل في هذا البروتوكول. وذلك لأن الأجسام المضادة المختارة لهذا البروتوكول هي أجسام مضادة مثبتة جيدا ومتاحة تجاريا. ومع ذلك ، إذا كنت مهتما باستخدام جسم مضاد لم يتم تحسينه من قبل ، فيرجى التفكير في اختبار الجسم المضاد مقابل التحكم في النمط المتماثل على الأنسجة ذات الاهتمام قبل إجراء التجربة الكاملة.
بينما يوضح هذا البروتوكول كيفية استخراج ومعالجة الدم والطحال والأنسجة الدهنية الأربية والبربخ من الفأر بعد العلاج ، يمكن تطبيق هذا النهج العام على الأنسجة الأخرى. اعتمادا على الأنسجة ذات الأهمية ، قد تحتاج بروتوكولات المعالجة والهضم إلى التغيير كما هو منشور للأنسجة التالية: الرئة21 ، الكبد 22 ، التجويف البريتوني 3 ، نخاع العظام3،23 ، الدماغ 24.
أحد القيود المهمة لهذه الطريقة التي يجب مراعاتها هو أنه لا يمكن تقييم الامتصاص إلا في نقطة زمنية واحدة لكل. وبالتالي ، قد يكون من المفيد إقران هذا البروتوكول بتقنيات التصوير غير الغازية الأخرى أو التخطيط وفقا لذلك لضمان الموارد الكافية لإجراء التقييم. يعد توقيت الامتصاص الخلوي ودوران الخلايا من العوامل المهمة التي يجب مراعاتها: سوف تنتشر الجسيمات الشحمية في جميع أنحاء الجسم في أول 24 ساعة واعتمادا على عمر الخلايا التي تمتص الجسيمات الشحمية أو كيفية استجابتها للامتصاص ، قد يحدث موت الخلايا أو المزيد من البلعمة. أظهرت دراستنا السابقة تغيرات في الخصائص السكانية لمجموعات DiD + في نقاط زمنية مختلفة3. لهذا السبب ، من المهم تقييم الاستيعاب في نقاط زمنية مبكرة أو نقاط زمنية أكثر صلة ببيولوجيا آلية الاهتمام. بالإضافة إلى ذلك ، في حين يمكن إجراء القياس الكمي لامتصاص الخلايا في الأنسجة بأكملها باستخدام هذا البروتوكول ، لا يمكن أن يكشف قياس التدفق الخلوي عن توطين الأنسجة. يمكن أن يساعد اقتران هذا النهج بالأساليب النسيجية في معالجة هذا القيد.
بشكل عام ، يكمل هذا البروتوكول المنهجية الحالية مثل علم الأنسجة والتصوير الفلوري لكامل الجسم. مع التقدم المستمر في أدوات وأساليب قياس التدفق الخلوي ، سيصبح تطوير لوحات أكبر إلى مجموعات خلايا أكثر وأكثر تحديدا ممكنا. نقترح استخدام هذا البروتوكول بالإضافة إلى الطرق المذكورة أعلاه لأن هذا سيحسن تقييم الامتصاص الخلوي ويوفر أيضا الفرصة للتحقق من صحة النتائج التي لوحظها قياس التدفق الخلوي. على سبيل المثال ، إذا وجد أن غالبية الجسيمات في الأنسجة الدهنية قد تم تناولها بواسطة البلاعم عن طريق قياس التدفق الخلوي. يمكن حفظ التألق المناعي لقسمة إضافية من نفس الأنسجة الدهنية وتثبيتها وتقسيمها وتلطيخها لعلامات البلاعم للتحقق من أن نوع الخلية يمتص بالفعل الجسيمات الشحمية. يجب أن يضيف هذا النهج صرامة إلى فحوصات التوزيع الحيوي للجسيمات النانوية التي يتم إجراؤها: التحقق من صحة الاستهداف الخاص بالخلية ، وتحديد الامتصاص الخلوي ، وتحديد الامتصاص خارج الهدف ، ونأمل في توفير معلومات لتوليد فرضيات ميكانيكية للنتائج العلاجية المرصودة. يمكن أيضا تكييف هذا البروتوكول للدراسات المستقبلية باستخدام الجسيمات الشحمية المختلفة ، والتحقيق في امتصاص الأنسجة الأخرى ، واختبار مركبات جديدة في وضع السمنة وخلل التمثيل الغذائي أو أي مرض آخر يكون فيه توصيل الجسيمات النانوية خيارا علاجيا مجديا.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
يود المؤلفون أن يشكروا مايكل سولجا وبقية موظفي Flow Cytometry Core على توفير التدريب والخدمات على قياس التدفق الخلوي. يود المؤلفون أيضا أن يشكروا شيفا ساي كريشنا داسا ، وداستن ك. بوكنايت ، وميليسا أ. مارشال ، وجيمس سي جارمي ، وشانتيل ماكسيمينج ، وأديتي أوبادهي ، وبراساد سريكاكولابو لمساعدتهم في تحضير الجسيمات الشحمية (SSKD ، DKB) ، وحصاد الأنسجة (MAM ، JCG) ، وتلطيخ قياس التدفق الخلوي والحصول على العينات (AU ، PS ، CM). تم دعم هذا العمل من خلال منح AstraZeneca و R01HL 136098 و R01HL 141123 و R01HL 148109 و AHA 16PRE30770007 و T32 HL007284.
Materials
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
References
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved