Method Article
Preparação, Administração e Avaliação da Captação Celular Tecido-Específica In Vivo de Lipossomas Marcados com Corante Fluorescente
Neste Artigo
Resumo
O objetivo deste protocolo é sintetizar lipossomas fluorescentemente marcados e usar citometria de fluxo para identificar a localização in vivo de lipossomas em nível celular.
Resumo
Há um interesse crescente no uso de lipossomas para entregar compostos in vivo, particularmente para abordagens de tratamento direcionadas. Dependendo da formulação do lipossoma, os lipossomas podem ser preferencialmente absorvidos por diferentes tipos de células no corpo. Isso pode influenciar a eficácia da partícula terapêutica, uma vez que a progressão de diferentes doenças é específica do tipo tecidual e celular. Neste protocolo, apresentamos um método para síntese e marcação fluorescente de lipossomas usando DSPC, colesterol e DSPE PEG-2000 e o corante lipídico DiD como marcador fluorescente. Este protocolo também apresenta uma abordagem para a administração de lipossomas in vivo e avaliação da captação célula-específica de lipossomas usando citometria de fluxo. Esta abordagem pode ser usada para determinar os tipos de células que absorvem lipossomas e quantificar a distribuição e proporção de captação de lipossomas entre tipos celulares e tecidos. Embora não mencionados neste protocolo, ensaios adicionais, como imunofluorescência e imagem de fluorescência de célula única em um citômetro, fortalecerão quaisquer achados ou conclusões feitas, pois permitem a avaliação da coloração intracelular. Os protocolos também podem precisar ser adaptados dependendo do(s) tecido(s) de interesse.
Introdução
À medida que cresce o interesse no desenvolvimento de terapias utilizando nanopartículas para liberação de fármacos, os métodos para preparar e avaliar a distribuição e absorção de partículas devem continuar avançando, expandindo-se e sendo acessíveis à comunidade de pesquisa 1,2. Esse protocolo foi desenvolvido para avaliar os tipos celulares exatos que absorveram lipossomas in vivo após um tratamento com lipossomas marcados com DiD carregados com tesaglitazar, um agonista do receptor ativado por proliferadores de peroxissoma (PPAR)-α/γ 3,4. Nesses estudos, pudemos avaliar quais tipos celulares foram diretamente impactados pelo tratamento com tesaglitazar lipossomal, a eficácia de direcionar metades e gerar hipóteses para explicar os resultados do tratamento observados. Além disso, funções biológicas estabelecidas em uma variedade de tipos celulares sugerem que células fagocíticas como macrófagos, células dendríticas e células de Kupffer hepatoespecíficas absorvem a maioria dos lipossomas 5,6,7. Utilizando este protocolo, demonstramos que fagócitos não clássicos também poderiam absorver lipossomas 3,4.
Este protocolo apresenta um método otimizado para solubilização do tesaglitazar, preparo de lipossomas por evaporação em fase reversa e uso de acetato de cálcio como atrativo para carregamento remoto de fármacos. Os métodos apresentados são acessíveis a muitos laboratórios e carecem de materiais de difícil aquisição e etapas que exigem altas temperaturas. O protocolo produz lipossomas de tamanhos ideais para o aumento da circulação invivo8. Além disso, como resumido por Su et al., até o momento, métodos para avaliar in vivo a distribuição de lipossomas e a captação tecidual têm sido estudados e testados emprofundidade9. Os métodos de tomografia por emissão de pósitrons (PET), ressonância magnética (RM) e tomografia molecular de fluorescência (FMT) são aplicados para quantificar a biodistribuição e captação tecido-específica9,10,11. Embora esses métodos tenham sido otimizados para maximizar a detecção in vivo, eles ainda não têm a capacidade de quantificar a captação de lipossomas in vivo na resolução celular. O protocolo aqui apresentado visa suprir essa necessidade por meio do uso da citometria de fluxo. Finalmente, para esse protocolo, a captação celular foi reduzida a alguns tecidos, incluindo o tecido adiposo. Há uma crescente literatura investigando o potencial do uso de nanopartículas para administrar terapias no contexto de obesidade, dismetabolismo e inflamação 12,13,14,15,16,17. Como tal, sentimos que era importante partilhar um protocolo com métodos eficazes para processar e analisar o tecido adiposo – um dos tecidos que desempenha um papel importante nestas patologias.
Protocolo
Todas as etapas deste protocolo são aprovadas e seguem as diretrizes do Comitê de Cuidados e Uso de Animais da Universidade da Virgínia.
NOTA: Existem alguns controles importantes a serem considerados para as etapas posteriores de análise, que estão resumidos na Tabela 1 e devem ser considerados antes da administração do lipossoma.
1. Preparação de lipossomas fluorescentemente marcados, carregados com acetato de cálcio e tesaglitazar
- Combinar DSPC (1,2-distearoil-sn-glicero-3-fosfocolina), colesterol, PEG-2000-DSPE e DiD. Para isso, combime o DSPC, colesterol e PEG-2000 DSPE em uma proporção de massa de 2:1:1. Adicionar corante lipídico DiD a uma concentração de 1 mg de DiD por 1 mL de lipossomas (razão molar de 46:1 de DSPC:DiD).
NOTA: DiD é uma abreviatura aceita para o corante 1,1'-dioctadecil-3,3,3',3'tetrametilindocarbocianina. Por possuir duas "caudas gordurosas" octadecil de comprimento igual ao DSPC utilizado nesta formulação, deve ser incorporado principalmente à membrana lipídica. Corantes lipídicos como DiO, DiD e DiI são rotineiramente utilizados para pesquisa de lipossomas8 e são considerados não trocáveis18. - Use um frasco para injetáveis de cintilação de 20 mL para a emulsão de fase invertida e preparação de lipossomas. Neste frasco para injetáveis, misturar uma solução de éter-clorofórmio 2:1 de lípidos com acetato de cálcio aquoso (acetato de Ca, 1 M, pH 7,4). A relação entre fase orgânica e aquosa deve ser de 4:1, por exemplo, 4 mL de fase orgânica e 1 mL de fase aquosa.
- Emulsionar a solução éter-clorofórmio de lipídios por sonicação por 30 s à temperatura ambiente. Opere o sonicator a 20 KHz e 50% de potência e use um 1/2 in. sondar.
NOTA: Mantenha a ponta da sonda do sonicator mais próxima do fundo do frasco para injetáveis para evitar a formação de espuma. Não toque no vidro com a ponta da sonda durante a sonicação, ele pode quebrar. Além disso, o clorofórmio precisa ser adicionado ao éter como um co-solvente: na presença de colesterol, uma emulsão somente de éter se separa rapidamente, tornando essa etapa do procedimento impossível. - Coloque imediatamente o frasco para injetáveis com emulsão homogeneizada de água-em-óleo num evaporador rotativo com um adaptador especial, manómetro e uma válvula reguladora de pressão. O evaporador deve ser conectado a uma linha de vácuo para remover os solventes orgânicos. Defina a taxa de rotação em 100 rpm e o vácuo em 0,5 atm, e solte se a formação de espuma de emulsão parecer excessiva. Depois que um gel se forma e desaparece, aumente o vácuo para 0,9 atm.
NOTA: Durante a remoção da fase orgânica volátil, o nível de vácuo deve ser ajustado gradualmente, para evitar a formação rápida de espuma, pois pode levar à perda de conteúdo do frasco para injetáveis para o corpo do evaporador rotativo. Eventualmente, quando o éter e o clorofórmio evaporam parcialmente e a relação de volume entre a fase aquosa e solvente orgânica é próxima de 1:1, um gel se formará. A evaporação deve continuar até que o gel desapareça e o meio aquoso restante esteja completamente líquido novamente. A mistura adicional pode ajudar a acelerar a remoção de solventes orgânicos. Isto pode ser conseguido colocando-se uma barra de agitação de politetrafluoroetileno no balão de evaporação, para aumentar a convecção do gel viscoso durante a evaporação rotativa. - Filtre os lipossomas resultantes usando membranas de policarbonato gravadas em esteira para obter uma distribuição de tamanho homogênea.
- Realize a filtração passando a dispersão aquosa do lipossomo várias vezes através de um filtro de policarbonato de poros de 200 nm em uma extrusora lipossomal equipada com duas seringas à prova de gás.
NOTA: Seringas menores são preferidas (por exemplo, 0,5 mL), pois garantem a geração de pressão suficiente para filtração. Com um alto teor de colesterol na membrana lipossoma, uma temperatura alta não é necessária, e o procedimento pode ser realizado à temperatura ambiente. Um número ímpar de filtrações (por exemplo, 21) é realizado, de modo que o material resultante termina no lado oposto do filtro desde o início e, se pré-esterilizado, a amostra estéril de lipossomas ajustados de tamanho filtrado pode ser coletada. O tamanho dos lipossomas resultantes é tipicamente próximo ao tamanho dos poros do filtro selecionado. Dois filtros podem ser empilhados (em vez de um) para realizar um ajuste fino para diminuir o tamanho das partículas. - Verifique a distribuição de tamanho usando espalhamento dinâmico de luz a laser (DLS)3,4.
- Adicione 1 a 3 mL de soro fisiológico a uma cubeta de 1 cm com quatro lados transparentes. Para isso, adicione 10\u201220 μL de lipossomas e misture cuidadosamente. Coloque a amostra no aparelho e selecione os seguintes parâmetros para medir: viscosidade do solvente, índice de refração, índice de refração de lipídios. Clique no botão Iniciar . As medições durarão vários minutos e consistirão em 100 ou mais corridas.
- Realize a filtração passando a dispersão aquosa do lipossomo várias vezes através de um filtro de policarbonato de poros de 200 nm em uma extrusora lipossomal equipada com duas seringas à prova de gás.
- Remova o acetato de Ca-externo usando uma coluna de spin de dessalinização. À metade do lote, adicionar o tesaglitazar aquoso em tampão HEPES 10 mM (pH 7,4) e incubar com mistura a 37 °C durante 1 h. Use a segunda metade do lote como uma formulação de lipossomas de controle livre de drogas.
NOTA: Pré-equilibre a coluna de spin dessalinizante de 2 mL com tampão HEPES 10 mM, pH 7,4, antes do uso. Para fazer isso, coloque 1 mL de tampão HEPES na coluna e gire em uma centrífuga a 1000 x g por 2 min. Remova o buffer de passagem e repita isso quatro vezes. - Remova o tesaglitazar não aprisionado dos lipossomas usando uma coluna de spin de 2 mL e determine a concentração da droga aprisionada espectrofotometricamente.
- Adicionar no máximo 0,5 ml de amostra de lipossomas ao leito de gel de coluna seca e esperar até que toda a amostra entre no gel. Centrifugar exatamente nas mesmas condições anteriores (1000 x g, 2 min) e coletar a amostra de lipossomas na passagem purificada de compostos de massa molecular pequena.
- Quantificar as características finais das partículas: tamanho e concentração de partículas usando DLS e potencial zeta com um sistema combinado de espalhamento de luz eletroforético (ELS)DLS 3,4 em tampão HEPES 10 mM pH 7,4 e a 25 °C.
- Semelhante ao passo 1.5.2, diluir a dispersão dos lipossomas no tampão de medição (por exemplo, 10 μL de lipossomas por 1 mL de solução tampão) em uma cubeta em forma de U usando uma seringa Luer descartável ou uma pipeta com uma ponta de corte. Certifique-se de que não há bolhas no "U" para que haja solução ininterrupta para o fluxo de corrente elétrica.
- Coloque a cubeta na unidade (por favor, preste atenção à frente e atrás da cubeta, para que os eletrodos estejam devidamente conectados à unidade). Feche a porta do instrumento; Em seguida, ocorre a medição (com múltiplas repetições), sob controle do software de orientação.
2. Preparar lipossomas para administração in vivo
- Em um gabinete de biossegurança, diluir os lipossomas em solução salina estéril até a concentração adequada em um volume final de 50 μL para administração in vivo.
NOTA: Em estudos anteriores, nossa preparação de lipossomas continha 2 mg/mL de tesaglitazar, o que equivale a cerca de 4,89 μmol de tesaglitazar/mL, e administramos lipossomas na dose de 1 μmol droga/kg. Para um camundongo de 40 g, traríamos 8,2 μL de lipossomas até um volume final de 50 μL em solução salina. Usando DLS/ELS, o número de lipossomas por unidade de volume também deve ser quantificado para preparações de lipossomas carregados com drogas e veículos para garantir que um número igual de lipossomas veiculares seja administrado por grama de peso de camundongo em comparação com os lipossomas carregados com drogas. - Coloque a solução lipossomal em uma agulha de 27 G no armário de biossegurança. Mantenha-o à temperatura ambiente para evitar injetar solução fria no rato.
3. Administrar lipossomas por injeção intravenosa retro-orbital
NOTA: Também é apropriado conduzir a injeção intravenosa por outros métodos, como injeções na veia caudal, se for preferível. Embora não abordado neste protocolo, protocolos publicados explicando esse método19 estão disponíveis.
- Configure o espaço de trabalho para a entrega de lipossomas.
- Limpe a bancada com etanol 70%. Certifique-se de selecionar um espaço que permita o uso de um sistema de anestesia com isoflurano.
- Ligue uma almofada de aquecimento e coloque uma almofada ou toalha limpa sobre ela para manter o mouse em uma superfície limpa. Deixe tempo suficiente para a almofada aquecer antes de começar a trabalhar com ratos.
- Configure o sistema de anestesia para que a câmara esteja próxima e o cone do nariz esteja na almofada de aquecimento.
- Certifique-se de que todos os outros aspectos do sistema estejam prontos (por exemplo, o nível de isoflurano é alto o suficiente no vaporizador, o filtro de carvão foi pesado, a tubulação está conectada corretamente).
- Reúna os demais materiais necessários para esta seção do protocolo: gel lubrificante oftálmico, anestésico local para tratamento pós-administração, gazes estéreis.
- Sedar o camundongo usando isoflurano na câmara de indução. Uma vez que ele não responde a um toque suave do pé, transfira rapidamente o mouse para o espaço de trabalho, mantendo a sedação através de um cone nasal.
NOTA: O animal deve ser mantido a 1,5% a 2,5% de isoflurano e avaliado para uma profundidade adequada de anestesia (através da falta de resposta ao pinçamento dos dedos) antes de prosseguir com o procedimento. - Deslocar o rato para um lado para administração de lipossomas. Como o rato não piscará enquanto estiver anestesiado, aplique uma pequena quantidade de lubrificante oftálmico em ambos os olhos para mantê-los hidratados durante o restante do procedimento.
- Pressione suavemente a pele acima e abaixo do olho exposto. O olho deve se elevar acima do plano da face.
- Introduza cuidadosamente a ponta da agulha no canto medial, certificando-se de que a agulha está abaixo do olho e não a tocando. Uma vez que a agulha é inserida abaixo do olho, injete lentamente os lipossomas no espaço retro-orbital. Ao retirar a agulha, pode ser necessário fechar as pálpebras por alguns segundos para obter hemostasia.
- Se a agulha não for inserida o suficiente, a solução pode surgir ao redor do olho. Pare de injetar imediatamente se isso for visto e reposicione a agulha.
- Aplique um anestésico local, como proparacaína, no olho para evitar dor e desconforto pós-procedimento.
- Mantenha o mouse em uma almofada de aquecimento e monitore até que ele desperte para garantir que esteja bem e mantenha a temperatura corporal adequada.
- Devolva o rato à sua gaiola e ao seu ambiente normal de alojamento até chegar o ponto de interesse.
NOTA: Isso deve ser feito de acordo com as diretrizes locais da IACUC.
4. Preparar materiais para a colheita de tecidos, processamento de tecidos e coloração por citometria de fluxo
- Preparar soluções para a colheita, processamento e coloração (seções 5\u20127): solução salina tamponada com fosfato (PBS)-Heparina, tampão HEPES, 2 mg/mL de colagenase tipo I, tampão de lise AKC, tampão FACS, PBS, tampão de fixação (Tabela 2). Manter todas as soluções, excepto o tampão de fixação, a 4 °C ou no gelo durante o procedimento.
- Preparar tubos com tampões e outros materiais para colheita e processamento de tecidos.
- Para o sangue de cada rato, adicionar 10 μL de EDTA 0,5 M a um tubo de microcentrífuga de 1,5 ou 1,7 ml para recolher o sangue. O EDTA impedirá a coagulação do sangue. Também é necessária uma seringa de 1 mL com agulha de 25 G e um tubo cônico de 15 mL.
- Para o baço, juntar um tubo de microcentrífuga de 1,5 ou 1,7 mL com 1 mL de tampão HEPES, uma seringa de 1 mL, dois tubos cônicos de 50 mL e dois filtros de 70 μm por baço.
- Para cada depósito de tecido adiposo, reunir um frasco de polietileno de 20 mL com 1,5 mL de tampão HEPES para picar o tecido, um tubo cônico de 50 mL e um filtro de 70 μm por tipo de tecido adiposo por camundongo.
- Prepare o espaço de trabalho para a colheita.
- Limpe o espaço da bancada com etanol 70%. Prepare uma bandeja de borracha para prender o mouse durante a colheita, limpando-o com etanol 70% e cobrindo-o com uma almofada absorvente ou toalhas de papel. Certifique-se de que pelo menos 5 pinos estão disponíveis para trabalhar.
- Encher uma seringa de 10 mL com PBS-heparina e prender em uma agulha 25 G para perfusão.
- Reúna ferramentas e materiais para usar durante a colheita. São necessárias pinças (dois pares), tesouras, toalhas de papel, lenços sem fiapos, tubo(s) de microcentrífuga com EDTA, tubo(s) de microcentrífuga com tampão HEPES e frasco(s) de polietileno com tampão HEPES.
5. Colheita dos tecidos
- Eutanásia do camundongo por asfixia por CO2 . Não realize uma luxação cervical, pois isso pode impedir a coleta de sangue eficaz e a perfusão tecidual em etapas posteriores.
- Em uma área de bancada limpa, com espaço de trabalho e iluminação suficientes para ver bem o rato, monte uma bandeja de dissecação de borracha, um balde de gelo para armazenar amostras e um borrifador com etanol 70%. Borrife o rato com etanol a 70% para reduzir a contaminação e controlar a propagação do cabelo. Coloque o rato de costas na bandeja de borracha e prenda as patas afastadas do corpo.
- Para se preparar para a coleta de sangue, faça cuidadosamente uma incisão na pele na borda da extremidade caudal da caixa torácica do rato. Corte uma pequena linha reta em direção à cabeça do rato (cerca de 1 cm) até que os músculos peitorais estejam expostos.
- No local da incisão inicial, fazer dois pequenos cortes perpendiculares à linha em direção à cabeça. Em seguida, corte cuidadosamente o músculo peitoral de um lado da caixa torácica na área exposta. Isso permite melhor acesso e visualização do local onde a agulha deve ser inserida.
- Para coletar sangue, insira a agulha entre a terceira e a quarta costelas no lado onde o músculo foi removido. Como o coração do rato se encontra no centro da cavidade torácica, mantenha a agulha o mais próximo possível da linha central da caixa torácica. Uma vez inserida, puxe suavemente a seringa para começar a coletar sangue.
- Uma vez coletado, transfira o sangue para o tubo de microcentrífuga preparado com EDTA e armazene no gelo.
NOTA: Se cerca de 100 μL de volume for puxado para cima e não entrar sangue na seringa, tente girar a seringa para a direita ou para a esquerda, caso a abertura da agulha seja pressionada contra a parede do coração. Se isso não ajudar, mova lentamente a agulha ainda mais para dentro da cavidade torácica ou comece a remover. Se o sangue começar a acumular-se na seringa neste momento, continue a puxar a seringa lentamente. Considere girar a seringa e a agulha para uma extração bem-sucedida. Finalmente, se não houver coleta de sangue, remova a agulha, pois ela pode ter perdido o coração. Tente reinserir a agulha e repetir o processo acima mencionado novamente.
- Em seguida, para perfundir o mouse, abra a cavidade torácica para acessar o coração.
- Para fazer isso, corte a pele ao longo da extremidade da caixa torácica até o lado do mouse de cada lado. Em seguida, use a pinça para segurar o esterno longe da superfície de trabalho. Faça uma pequena incisão rasa logo abaixo da extremidade do esterno para cortar a cavidade peritoneal. Corte ao longo da membrana peritoneal ao longo da extremidade da caixa torácica em cada um dos lados do rato. Isso deve expor o fígado e a vesícula biliar. Tenha cuidado para não cortar em nenhum desses tecidos.
- Em seguida, faça um corte pequeno e raso no diafragma, cranial ao fígado. Em seguida, corte o diafragma ao longo da borda da caixa torácica para abrir a cavidade torácica. Certifique-se de evitar cortar qualquer um dos órgãos dentro da cavidade torácica.
- Faça dois cortes ao longo da caixa torácica em direção à cabeça cerca de 2-3 mm da linha central do mouse e cerca de 0,75 cm de comprimento.
NOTA: Se cortado muito alto, as artérias que residem no topo da caixa torácica serão cortadas. Isso vai interferir na eficácia da perfusão. - Levante de volta a peça central da caixa torácica para expor a cavidade torácica. Afaste qualquer gordura ou tecido para acessar o coração.
- Faça um pequeno corte no átrio direito do coração do rato para criar uma abertura através da qual empurrar o sangue.
- Usando uma seringa de 10 mL de PBS-heparina, insira a agulha no ventrículo esquerdo do coração do rato.
- Comece suavemente a empurrar PBS para o coração o mais lentamente possível.
NOTA: Deve-se observar sangue saindo dos átrios direitos e preenchendo a cavidade torácica. Certifique-se de manter o coração em sua localização fisiológica para evitar inibir o fluxo de PBS-heparina do coração através da aorta. - Depois que todos os 10 mL de PBS-heparina tiverem sido perfundidos através do mouse, descarte a seringa e a agulha e remova o excesso de sangue e PBS-Heparina da cavidade torácica usando toalhas de papel ou lenços sem fiapos.
- Em seguida, para começar a extrair tecidos, corte a pele e a membrana peritoneal em direção à cauda do camundongo para abrir a cavidade peritoneal.
- Primeiro, extraia o coxim de tecido adiposo inguinal de cada lado do rato.
NOTA: Leia este processo com atenção: certifique-se de extrair o linfonodo inguinal de cada depósito para evitar distorcer a composição celular do tecido adiposo nos resultados.- Usando um segundo conjunto de pinças, segure a membrana peritoneal com um conjunto de pinças e a borda da pele sobreposta acima da membrana desse lado com a outra pinça. Puxe suavemente a pele para longe da membrana peritoneal para separar essas camadas umas das outras. Procure o depósito de tecido adiposo inguinal ao longo da pele. Fixe a borda externa da pele para acessar melhor o depósito adiposo.
- Antes da extração, localize o linfonodo inguinal no centro do depósito adiposo e remova-o usando pinça e tesoura, conforme necessário.
NOTA: Se possível, localize as três artérias maiores que correm das bordas externas do depósito em direção ao centro. O linfonodo está localizado ao redor de onde essas artérias se encontram. - Depois que o linfonodo for removido, segure cuidadosamente a extremidade do depósito adiposo mais próximo do ponto fixado com a pinça e comece a fazer pequenos cortes na membrana conjuntiva entre o tecido adiposo e a pele. Levante o tecido adiposo para longe da pele enquanto faz cortes para fazer melhor acesso à membrana e garantir que todo o depósito seja extraído.
- Coloque o depósito adiposo em um frasco preparado de polietileno com tampão HEPES sobre gelo para manter o tecido viável durante o restante da colheita.
- Repita esse processo do outro lado do mouse para extrair ambos os depósitos. Os depósitos podem ser digeridos e processados juntos ou separadamente. Se cada depósito for processado separadamente, devem ser preparados mais tubos.
- Em seguida, extrair os depósitos adiposos epididimais da extremidade caudal da cavidade peritoneal. Usando pinças, puxe suavemente o primeiro depósito adiposo epididimal da extremidade dorsal do camundongo e localize o epidídimo e o ducto deferente anexados a esse depósito.
NOTA: Existem dois depósitos adiposos epididimais: um ligado a cada epidídimo e ducto deferente.- Cuidadosamente cortado entre o depósito adiposo e o epidídimo e ducto deferente para separar o adiposo desses outros tecidos. Coloque o depósito adiposo em um frasco de polietileno com tampão HEPES sobre gelo para manter o tecido viável durante o restante da colheita.
- Finalmente, extraia o baço, que é encontrado à esquerda do estômago perto do diafragma. Usando pinças, puxe suavemente o estômago em direção ao centro da cavidade peritoneal para expor o baço.
- Segure suavemente uma extremidade do baço e puxe-o ligeiramente para longe do estômago. Cortar a membrana entre o baço e seu tecido adjacente até que o órgão esteja desprendido. Coloque o baço no tubo de microcentrífuga preparado com tampão HEPES e armazene no gelo.
- Antes de processar tecidos ou colher tecidos do próximo rato, descarte a carcaça e quaisquer toalhas ou almofadas de papel sujas. Limpe as ferramentas também.
Observação : se houver vários mouses, repita essas etapas de coleta para cada mouse antes de passar para a próxima etapa de processamento. Se um rato/ratinho de controlo for incluído, considere colhê-los antes de ratos tratados com lipossomas para evitar qualquer contaminação.
6. Tecidos de processo
NOTA: Uma vez que o tecido adiposo tem uma longa incubação da digestão, recomenda-se começar com esse processo primeiro e trabalhar no processamento do sangue e baço durante o período de digestão.
- Primeiro, picar e digerir os tecidos adiposos. Usando um ou dois pares de tesouras, pique o tecido adiposo em cada frasco de polietileno até que o tecido esteja em pequenos pedaços de menos de 0,5 mm de tamanho. Isso permite uma digestão mais eficiente.
- Assim que os tecidos de todos os frascos para injetáveis estiverem picados, adicione 1,5 ml de tampão 2 mg/ml de colagenase a cada frasco para injetáveis. Coloque os frascos para injetáveis numa incubadora de agitação regulada para 37 °C e 150 rpm. Incubar por 30 a 45 min.
NOTA: Se os tecidos adiposos forem particularmente grandes, considere adicionar mais 0,5 mL a 1,5 mL de tampão HEPES e um volume igual de tampão colagenase ao(s) frasco(s) para garantir que os tecidos estejam totalmente submersos e que haja enzima suficiente. A concentração final de colagenase Tipo I na digestão deve ser de 1 mg/mL, independentemente do volume final da solução. Além disso, se não estiver disponível uma incubadora de agitação, as amostras podem ser colocadas num banho-maria aquecido a 37 °C. Agite suavemente as amostras a cada 5 min para misturar e ressuspender a digestão. - Verifique as amostras em 30 min. Use uma pipeta de 1 mL para pipetar a amostra para cima e para baixo. Se os pedaços de tecido ainda forem muito grandes para facilitar a pipetagem, devolva as amostras à incubadora por mais 15 minutos.
- Depois que as amostras estiverem totalmente digeridas, continue a pipetar a amostra para cima e para baixo mais 10 vezes para garantir que uma suspensão de célula única tenha sido criada.
NOTA: (Opcional) Verifique as amostras em 30 min. Use uma pipeta de 1 mL para pipetar a amostra para cima e para baixo. Se os pedaços de tecido ainda forem muito grandes para facilitar a pipetagem, devolva as amostras à incubadora por mais 15 minutos. - Pipetar a suspensão celular através de um filtro de 70 μm para um tubo cônico de 50 mL. Adicione 5 ml de tampão FACS ao frasco para injetáveis de digestão vazio para lavar o frasco para injetáveis. Transfira este tampão de lavagem através do filtro para adicionar à suspensão da célula.
- Armazene amostras no gelo enquanto outras estão sendo processadas. Depois de todas as amostras filtradas, fie-as a 400 x g, 4 °C durante 5 min.
- Remover o sobrenadante do adipócito por aspiração e, em seguida, remover cuidadosamente o infranadante entre o sobrenadante do adipócito e o pellet por aspiração para deixar a pastilha da fração estromal-vascular (FRS).
- Ressuspenda este pellet em 1 mL de tampão FACS e transfira para um tubo de microcentrífuga limpo de 1,5 ou 1,7 mL. Alíquotas agora se desejado ou necessário. Manter no gelo até que todas as amostras estejam prontas para a coloração por citometria de fluxo.
NOTA: Se os depósitos adiposos digeridos foram grandes, considere usar apenas 50% ou 25% da amostra para coloração e análise por citometria de fluxo. Além disso, se quaisquer controles de fluorescência menos um (FMO) ou controles adicionais para análise de citometria de fluxo (Tabela 1) forem necessários, certifique-se de aloquotar a amostra extra em um tubo separado para processamento. FMOs são usados para distinguir entre sinal negativo e positivo para um anticorpo conjugado com fluoróforo individual dentro do painel completo utilizado no experimento.
- Assim que os tecidos de todos os frascos para injetáveis estiverem picados, adicione 1,5 ml de tampão 2 mg/ml de colagenase a cada frasco para injetáveis. Coloque os frascos para injetáveis numa incubadora de agitação regulada para 37 °C e 150 rpm. Incubar por 30 a 45 min.
- Segundo, processar o sangue.
- Transferir 50 μL de sangue para um tubo cônico de 15 mL.
- Adicione 1 mL de tampão de lise AKC a cada tubo e pipete para cima e para baixo para alcançar uma suspensão de célula única. Adicione mais 4 mL de tampão de lise AKC a cada tubo e incube por 5\u201210 min. Se um agitador ou rotador estiver disponível, sele bem as tampas dos tubos e coloque os tubos em um deles para melhorar a mistura.
- Adicionar 5 ml de tampão FACS para extinguir o processo de lise e girar as amostras a 400 x g, 4 °C durante 5 min. Retire o sobrenadante e verifique o pellet. Se ainda estiver bastante vermelho, repita o processo de lise. Caso contrário, ressuspenda os pellets em 1 mL de tampão FACS e transfira para um tubo de microcentrífuga limpo de 1,5 ou 1,7 mL. Manter no gelo até que todas as amostras estejam prontas para a coloração por citometria de fluxo.
- Por fim, processe o baço. Transfira o baço para um filtro de 70 μm sobre um tubo cônico de 50 mL. Lave o tecido com 1 ml de tampão FACS e, em seguida, esmague o baço através do filtro utilizando a extremidade do êmbolo de uma seringa de 1 ml. Durante todo o processo de trituração, lave as células no tubo cônico de 50 mL usando mais tampão FACS. O volume final no tubo cônico deve ser de 10 mL.
- Gire as células a 300 x g a 4 °C durante 5 min. Remover o sobrenadante e ressuspender em 1 mL de tampão de lise AKC. Adicionar mais 4 mL de tampão de lise AKC e incubar por 5 min. Adicionar 5 ml de tampão FACS para extinguir o processo de lise e girar as amostras a 300 x g a 4 °C durante 5 min.
- Retire o sobrenadante e ressuspenda o pellet em 1 mL de tampão FACS. Transfira a suspensão através de um segundo filtro limpo de 70 μm para um tubo cônico de 50 mL. Adicionar 4 mL de tampão FACS para lavar o tubo original e transferir o tampão através do filtro para um volume final de 5 mL.
- Transfira 50 μL da suspensão celular para um tubo de microcentrífuga limpo de 1,5 ou 1,7 mL e mantenha no gelo até que todas as amostras estejam prontas para a coloração por citometria de fluxo. Alíquotas adicionais podem ser transferidas para tubos se mais forem desejadas ou necessárias.
NOTA: Os esplenócitos são excelentes células para usar em uma única coloração viva/morta. Considere transferir uma alíquota adicional para esse controle.
7. Coloração de células de tecidos para citometria de fluxo
- Gire as amostras alíquotas a 400 x g, 4 °C durante 5 min.
- Retirar o sobrenadante e ressuspender as amostras em 50 μL de Bloco Fc (diluído) (Tabela 2). Incubar no gelo por 5 min.
- Adicionar 50 μL de mistura de anticorpos 2x (Tabela 3) a cada amostra. Incubar no gelo no escuro por 20 min.
NOTA: Quaisquer manchas isoladas NÃO devem ser coradas com esta mistura de anticorpos. Além disso, se forem utilizados FMOs, as misturas de anticorpos FMO devem ser preparadas separadamente. - Lavar as amostras com 1 ml de PBS e girar a 400 x g, 4 °C durante 5 min. Retirar o sobrenadante e ressuspender as amostras em 200 μL da coloração de viabilidade (Tabela 3). Incubar no gelo no escuro por 20 min.
NOTA: Não se esqueça de manchar as células que foram reservadas para uma única mancha Viva/Morto durante esta etapa. - Lavar as amostras com 1 ml de tampão FACS e girar a 400 x g, 4 °C durante 5 min. Remover sobrenadante e ressuspender amostras (exceto coloração única Viva/Morta) em 50 μL de meio de fixação (Reagente A) para fixar amostras. Incubar à temperatura ambiente no escuro durante 15 minutos.
- Ressuspender a única coloração Live/Dead em 100 μL de PFA a 2%. Incubar à temperatura ambiente no escuro durante 5 minutos.
- Lavar a amostra com 1 ml de tampão FACS e girar a 800 x g, 4 °C durante 5 min. Remover o sobrenadante e ressuspender as amostras em 250 a 500 μL de tampão FACS. Conservar a 4 °C até que as amostras possam ser executadas no citómetro de fluxo.
- Lavar as amostras com 1 ml de tampão FACS e girar a 800 x g, 4 °C durante 5 min. Retirar o sobrenadante e ressuspender as amostras em 50 μL de meio de permeabilização (Reagente B) mais anticorpo(s) para proteínas intracelulares. Incubar à temperatura ambiente no escuro durante 20 minutos.
- Lavar as amostras com 1 ml de tampão FACS e girar a 800 x g a 4 °C durante 5 minutos. Retirar o sobrenadante e ressuspender as amostras em 100 μL de paraformaldeído (PFA) a 2%. Incubar à temperatura ambiente no escuro durante 5 minutos.
- Lavar as amostras com 1 ml de tampão FACS e girar a 800 x g, 4 °C durante 5 min. Remover o sobrenadante e ressuspender as amostras em 250 a 500 μL de tampão FACS. Conservar a 4 °C até que as amostras possam ser executadas no citómetro de fluxo.
Resultados
Produção de Lipossomas
Os resultados aqui publicados são semelhantes aos de nosso trabalho publicado anteriormente 3,4,20. Utilizando o protocolo aqui apresentado, esperamos produzir lipossomas de aproximadamente 150\u2012160 nm de tamanho. A DLS revela diâmetro médio dos lipossomas de 163,2 nm e potencial zeta de -19,2 mV (Figura 1A). A microscopia eletrônica criogênica (crio-EM) revela lipossomas circulares (Figura 1B) e o diagrama DLS revela um desvio padrão relativamente pequeno do diâmetro médio (Figura 1C).
A ligação positiva aos lipossomas requer um controle tratado com PBS
Estudos anteriores de nosso grupo empregando esse protocolo investigaram quais subtipos celulares em FVS, baço e sangue adiposos se ligavam a lipossomas após uma semana de administração in vivo 3,4. Usando um camundongo tratado com PBS, as células da cavidade peritoneal e do baço foram coradas com o mesmo painel de anticorpos usado em amostras de camundongos tratados com lipossomas. Os tecidos foram colhidos após uma semana de tratamentos (Figura 2A). As amostras do camundongo tratado com PBS serviram como um FMO DiD com o qual criar portas DiD positivas (Figura 2B,C). Uma porta positiva pode ser criada usando o sinal DiD-positivo, mas amostras sem sinal DiD também devem ser usadas para verificar se a porta positiva não inclui amostras DiD-negativas.
Titulações são necessárias para otimizar sinais de fluorescência
Antes de executar um experimento completo, várias condições, incluindo a concentração de anticorpos fluorescentemente conjugados usados durante a coloração celular e de corante lipídico usado durante a preparação de lipossomas, devem ser otimizadas. Os citômetros de fluxo têm um limite superior de detecção para intensidade de fluorescência, então muito corante incorporado nos lipossomas levará a níveis não quantificáveis de sinal DiD em amostras que passam pelo citômetro. Além disso, muito DiD nos lipossomas pode levar a altos níveis de transferência de corante inespecífico, o que poderia distorcer os resultados de captação celular. A Figura 3 relata os resultados de um experimento em que as concentrações de corante lipídico foram tituladas para identificar a concentração que produziria um sinal ótimo dentro da faixa de detecção do citômetro de fluxo utilizado. Este foi realizado nos tecidos de interesse para o experimento final: sangue (Figura 3A), FVS adiposa inguinal (Figura 3B) e FVS adiposa epididimal (Figura 3C). As concentrações selecionadas para teste foram 10 mg de DiD (Alto, vermelho), 1 mg de DiD (Médio, azul) ou 0,1 mg de DiD (Baixo, cinza) por 1 mL de lipossomas. A maior concentração utilizada nos lipossomas foi muito alta e ultrapassou a faixa quantificável do citômetro nos três tecidos (Figura 3A\u2012C, vermelho). A menor concentração de DiD mostrou algum sinal (Figura 3 A\u2012C, cinza), mas uma população clara além das células tratadas com PBS (Figura 3A\u2012C, preto) não foi observada. Quando quantificada, a média aritmética da IFM DiD para cada tecido e concentração demonstrou uma clara distinção entre os controles PBS e a concentração média de DiD (Figura 3D). Assim, conforme indicado no protocolo, selecionamos a concentração média (Figura 3, azul) para utilizar em nosso preparo lipossomo.
O uso do painel de múltiplos anticorpos permite a identificação da captação de lipossomas por diferentes subgrupos celulares
Utilizando o painel delineado na Tabela 3, as células foram coradas com anticorpos contra marcadores para macrófagos A, células B, células T, células dendríticas, monócitos e células endoteliais (Figura 4). Estratégias de gating ligeiramente diferentes são necessárias para cada tipo de tecido, mas a maioria dos mesmos tipos celulares pode ser identificada em cada um. Algumas exceções incluem células endoteliais, que normalmente não são encontradas no sangue, e monócitos, que normalmente estão em maior frequência no sangue do que outros tecidos. Uma vez identificadas as populações, pode-se quantificar o tamanho total de cada célula e a frequência com que são DiD+. Cálculos adicionais podem ser realizados para caracterizar a população DiD+: qual porcentagem de células DiD+ são macrófagos, células endoteliais, etc. Por favor, note que estas são estratégias de gating exemplo, mas não a única maneira de analisar as amostras. A análise será ditada pelo painel selecionado e citômetro(s) de fluxo disponíveis.
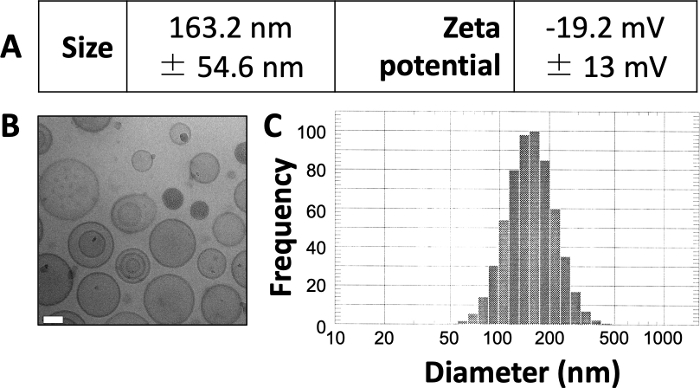
Figura 1: Exemplo de características dos lipossomas preparados.
(A) O tamanho e o potencial zeta foram medidos como descrito acima e foram relatados em forma de tabela. Cada parâmetro é apresentado como média ± desvio padrão. (B) Crio-ME foi utilizada para obtenção de imagens dos lipossomas preparados. A barra de escala branca tem 50 nm de comprimento. (C) A DLS foi utilizada para gerar um histograma do diâmetro dos lipossomas nessa preparação. Esta figura é adaptada de Osinski et al.3. Clique aqui para ver uma versão maior desta figura.
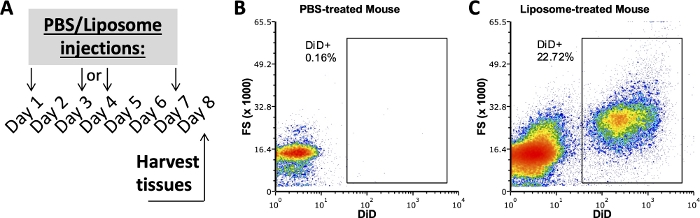
Figura 2: Coloração DiD representativa de camundongos tratados com PBS ou Lipossoma.
(A) Esquema experimental para PBS e tratamentos com lipossomas. PBS ou lipossomas foram injetados três vezes ao longo de uma semana. Os tecidos foram colhidos no 8º dia de tratamento. (B, C) Fluxogramas representativos revelam coloração DiD positiva em camundongos tratados com lipossomas (C), mas não tratados com PBS (B). FSC, dispersão para a frente. Clique aqui para ver uma versão maior desta figura.
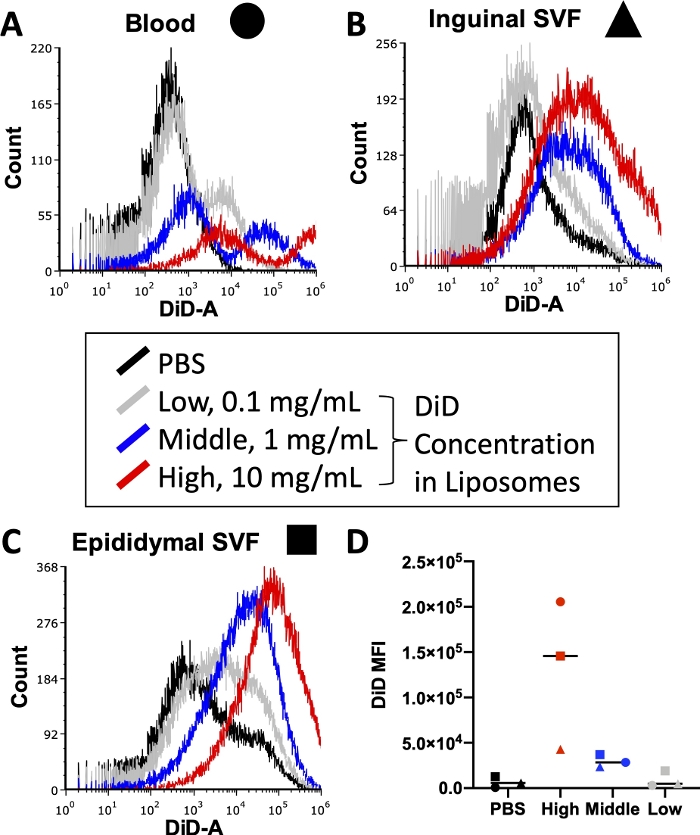
Figura 3: Titulação de DiD em lipossomas.
Lipossomas foram preparados com três diferentes concentrações de DiD e injetados em camundongos. O cinza indica a baixa concentração em 0,1 mg de DiD por 1 mL de lipossomas, o azul indica a concentração média em 1 mg de DiD/mL de lipossomas e o vermelho indica a alta concentração em 10 mg de DiD/mL de lipossomas. Um camundongo tratado com PBS foi usado como controle negativo (preto). Sangue (A, círculo), adiposo inguinal (B, triango) e adiposo epididimal (C, quadrado) foram colhidos 24 h após a injeção e processados para isolar uma suspensão unicelular. Essas amostras foram executadas em citômetro de fluxo até o nível de DiD detectável. Histogramas tecido-específicos com sobreposições de cada grupo de tratamento são apresentados para demonstrar a intensidade de fluorescência por concentração (A\u2012C). A média aritmética do DiD também foi quantificada para cada tecido e concentração e plotada (D). SSC = dispersão lateral. Clique aqui para ver uma versão maior desta figura.
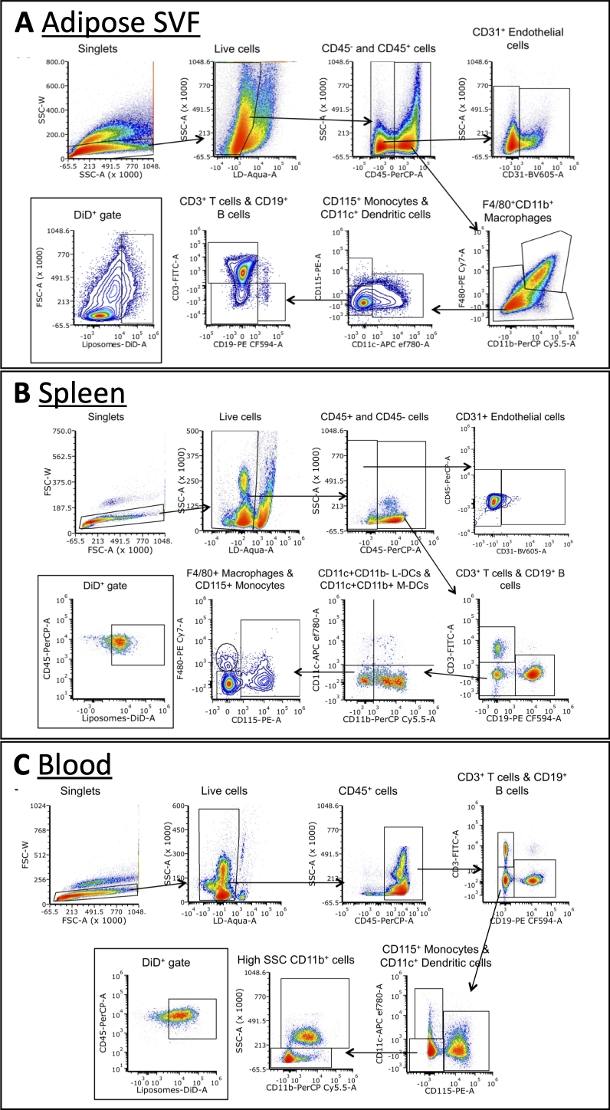
Figura 4: Análise representativa da citometria de fluxo dos subgrupos celulares em FVS adiposa, sangue e baço.
(A\u2012C) Representação esquemática da estratégia de gating para identificar subgrupos celulares e células DiD+ em FVA adiposa (A), baço (B) e sangue (C). Abreviações: FSC = forward scatter; DL = vivos/mortos; L-DCs = células dendríticas linfoides; M-DCs = células dendríticas mieloides; SSC = dispersão lateral. Esta figura é adaptada de Osinski et al.3. Clique aqui para ver uma versão maior desta figura.
| Controle | Propósito |
| Camundongo tratado com PBS ou soro fisiológico | Use as células deste mouse para os seguintes controles de citometria de fluxo: |
| 1. Células não coradas | |
| 2. Mancha única viva/morta | |
| 3. Células coradas com o painel completo, mas sem fluorescência lipossomal para determinar o sinal positivo do lipossomo durante a análise | |
| Este/estes ratinhos/ratinhos também serão utilizados para determinar se os lipossomas têm efeitos in vivo, uma vez que terá um controlo não lipossomal na sua experiência. | |
| Lipossomas descarregados | Se você estiver carregando um composto em seus lipossomas, uma parte do seu lote de lipossomas deve ser sintetizada sem o composto. Isso explica quaisquer efeitos in vivo dos lipossomas sozinhos. |
| DiD sozinho | Uma vez que o DiD também pode ser absorvido pelas membranas celulares, alocar alguns ratos para receber corante livre em uma quantidade igual à encontrada nos lipossomas ajudará a explicar qualquer coloração de membrana de fundo. |
| Controles de fluorescência-menos-um (FMO) | Estas são células coradas com todos os anticorpos, exceto um, em seu painel. Como #3 na caixa acima, isso ajuda a determinar o verdadeiro sinal positivo para esse anticorpo durante a análise |
Tabela 1: Controles a serem usados neste protocolo.
| Solução | Componentes | Volume aproximado necessário por lote/mouse |
| Preparação de lipossomas | ||
| Acetato de cálcio | 1 M de acetato de cálcio em H2O | 50 mL |
| Tampão HEPES | 10 mM HEPES em A2O, pH 7,4 | 50 mL |
| Tesaglitazar em HEPES | em 10 mM HEPES | 10 mL |
| Colheita, processamento e coloração de tecidos | ||
| Solução tamponada com fosfato (PBS) | 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mM KH 2 PO4 em destilado H2O | 2 mL |
| PBS-Heparina | Heparina 0,1 mM em PBS | 10 mL |
| Tampão HEPES | 20 mM HEPES em PBS | 5 mL |
| Tampão de digestão | 2 mg/mL de colagenase Tipo I em tampão HEPES | 5 mL |
| Buffer de lise AKC | 0,158 M NH 3 Cl,10 mM KHCO3, 0,1 mM Na 2 EDTA em ddH 2 O, pH7,2 | 15 mL |
| Buffer FACS | 1% BSA, 0,05% NaN3 em PBS | 15 mL |
| Bloco Fc (diluído) | Bloco Fc 1:50 no buffer FACS | 250 μL |
| Buffer de Fixação | Paraformaldeído a 2% em PBS | 200 μL |
Tabela 2: Soluções a serem preparadas.
| Um | B | C | D |
| Coloração extracelular (2x mistura de anticorpos) | |||
| Antígeno | Fluoróforo | Volume ab por teste de 100 μL | Volume total necessário: |
| CD45 | PerCP | 0,5 μL | Coluna C x 1,2 x Total # amostras |
| CD11b | PerCP Cy5,5 | 0,25 μL | (0,5 μL/teste) x (1,2) x (# amostras) |
| F4/80 | PE Cy7 | 0,25 μL | (0,25 μL/teste) x (1,2) x (# amostras) |
| CD19 | PE-CF594 | 1 μL | (0,25 μL/teste) x (1,2) x (# amostras) |
| CD3 | FITC | 1 μL | (1,0 μL/teste) x (1,2) x (# amostras) |
| CD31 | BV605 | 0,25 μL | etc... |
| CD11c | APC ef780 | 1 μL | |
| CD115 | PE | 1,5 μL | |
| Para criar sua mistura de anticorpos, combine os anticorpos calculados na coluna D com o tampão FACS ou o Brilliant Violet Staining Buffer* para um volume final de (50 μL x 1,2 x Total # amostras) | |||
| Coloração viva/morta (1x) | |||
| Vivo/Morto | Fluoróforo | Volume L/D por teste de 200 uL | Volume total necessário: |
| Vivo/Morto | Aqua | 0,67 μL | Coluna C x 1,2 x Total # amostras |
| Coloração Intracelular (1x) | |||
| Antígeno | Fluoróforo | Volume Ab por teste de 50 μL | Volume total necessário: |
| αSMA | FITC | 0.125 | Coluna C x 1,2 x Total # amostras |
| *Brilliant Violet Staining Buffer deve ser usado se mais de um anticorpo conjugado a um fluoróforo Brilliant Violet estiver sendo usado em seu painel. | |||
Tabela 3: Exemplo de painel de anticorpos e cálculos de misturas de coloração a serem utilizadas para coloração de fluxo.
Discussão
Aqui descrevemos um protocolo de três partes para (i) preparar lipossomas que são marcados com um corante lipídico fluorescente e carregados com um composto antidiabético, tesaglitazar, (ii) administrar lipossomas a um camundongo via injeção retro-orbital e (iii) coletar, processar e corar tecidos para detectar a captação de lipossomas em nível celular por citometria de fluxo. Este protocolo revisa o preparo de lipossomas de aproximadamente 150 μm e a avaliação da captação no tecido adiposo, no sangue e no baço. A preparação dos lipossomas é escalável, realizada principalmente à temperatura ambiente, e utiliza evaporação em fase reversa para maximizar a carga de fármacos e remoção de solventes orgânicos. Usando este protocolo, até 2 mg/mL de tesaglitazar pode ser alcançado na amostra de lipossomas purificada. Os lipossomas preparados podem ser armazenados em tampão HEPES a 4 °C por mais de um ano. Em nossa experiência, eles demonstraram variação mínima do tamanho médio das partículas. Menos de 10% de perda de conteúdo do fármaco foi demonstrada espectrofotometricamente, após separação por ultrafiltração dos lipossomas do fármaco externo com filtro centrífugo de 10 kDa.
Durante a preparação do lipossoma, existem algumas etapas e fatores críticos a serem considerados. Primeiramente, a ordem das etapas do protocolo é importante e deve ser respeitada. Em segundo lugar, o pH da solução utilizada durante o carregamento do tesaglitazar deve ser mantido em 7,4 para maximizar a solubilidade e o carregamento eficaz. Terceiro, a montagem adequada de equipamentos e filtros garante que a saída de cada etapa seja do tamanho e pureza adequados. Por exemplo, se os filtros de 100 e 200 nm não forem montados corretamente, um lote mais heterogêneo e de tamanho inadequado de lipossomas pode resultar. Quarto, a remoção completa do acetato de Ca-antes do carregamento da droga é necessária para maximizar a transferência de tesaglitazar para os lipossomas. Para testar a remoção completa de Ca-acetato, use sedimentação de alta velocidade para remover os lipossomas e, em seguida, medir os níveis de Ca-acetato na solução não lipossomal. Em quinto lugar, é importante pesar e registrar a massa de todos os materiais adicionados ao preparo dos lipossomas em cada etapa. Isso garante que as concentrações adequadas possam ser calculadas e as proporções necessárias de materiais sejam mantidas. Finalmente, se a técnica não for executada adequadamente, pode haver um nível indesejável de heterogeneidade. É importante verificar minuciosamente este parâmetro usando DLS e outras abordagens, como a microscopia eletrônica. Para melhorar a homogeneidade, considere ajustar o tamanho do filtro selecionado ou empilhar dois filtros.
Além disso, é fundamental que os controles e um painel de anticorpos para citometria de fluxo sejam planejados e otimizados antes da realização completa desse protocolo (Tabela 1, Tabela 3). Os anticorpos devem ser testados para garantir que concentrações adequadas sejam usadas para coloração e que a sobreposição entre os fluoróforos seja mínima. A excitação e emissão do corante usado durante a preparação dos lipossomas também devem ser levadas em consideração no planejamento do painel. Em nossos resultados, utilizamos o DiD, que tem excitação e emissão semelhantes a fluoróforos como Aloficocianina (APC) e AlexaFluor 647. Assim, não selecionamos anticorpos conjugados a esses fluoróforos em nosso painel de anticorpos. Além disso, controles isotípicos não estão incluídos neste protocolo. Isso ocorre porque os anticorpos selecionados para esse protocolo são anticorpos bem validados e disponíveis comercialmente. No entanto, se estiver interessado em usar um anticorpo que não tenha sido otimizado anteriormente, considere testar o anticorpo contra um controle de isótipo nos tecidos de interesse antes de realizar o experimento completo.
Embora este protocolo demonstre como extrair e processar o sangue, baço, tecido adiposo inguinal e tecido adiposo epididimal do camundongo pós-tratamento, esta abordagem geral pode ser aplicada a outros tecidos. Dependendo do tecido de interesse, os protocolos de processamento e digestão podem precisar ser alterados, como é publicado para os seguintes tecidos: pulmão 21, fígado22, cavidade peritoneal 3, medula óssea3,23, cérebro 24.
Uma limitação importante deste método a considerar é que a captação só pode ser avaliada em um momento por animal. Assim, pode ser vantajoso acoplar este protocolo a outras técnicas de imagem não invasivas ou planejar adequadamente para garantir recursos suficientes para a realização da avaliação. O tempo de captação celular e o turnover celular são fatores importantes a serem considerados: os lipossomas circularão por todo o corpo nas primeiras 24 h e, dependendo da vida útil das células que absorvem lipossomas ou como eles respondem à captação, pode ocorrer morte celular ou fagocitose adicional. Nosso estudo anterior demonstrou mudanças nas características populacionais de populações DiD+ em diferentes momentos3. Por essa razão, é importante avaliar a captação em momentos anteriores ou em momentos mais relevantes para a biologia do mecanismo de interesse. Além disso, embora a quantificação da captação celular em todo o tecido possa ser realizada com esse protocolo, a citometria de fluxo não pode revelar a localização tecidual. O acoplamento dessa abordagem com métodos histológicos pode ajudar a resolver essa limitação.
Em geral, esse protocolo complementa a metodologia existente, como a histologia e a imagem de fluorescência de corpo inteiro. Com os avanços contínuos nas ferramentas e métodos de citometria de fluxo, o desenvolvimento de painéis maiores para populações celulares cada vez mais específicas se tornará possível. Sugerimos que este protocolo seja utilizado em adição aos métodos supracitados, pois melhorará a avaliação da captação celular e também proporcionará a oportunidade de validar os resultados observados por citometria de fluxo. Por exemplo, caso se verifique que a maioria das partículas no tecido adiposo foi absorvida por macrófagos por citometria de fluxo. A imunofluorescência de uma alíquota adicional do mesmo tecido adiposo poderia ser salva, fixada, seccionada e corada para marcadores de macrófagos para verificar se o tipo celular realmente absorve lipossomas. Essa abordagem deve adicionar rigor aos ensaios de biodistribuição de nanopartículas realizados: validação de alvos específicos para células, quantificação da captação celular, identificação de captação fora do alvo e, esperançosamente, fornecer informações para gerar hipóteses mecanicistas para os resultados terapêuticos observados. Este protocolo também pode ser adaptado para estudos futuros utilizando diferentes lipossomas, investigando a captação em outros tecidos e testando novos compostos no contexto de obesidade e dismetabolismo ou qualquer outra doença em que a liberação de nanopartículas seja uma opção terapêutica viável.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer a Michael Solga e ao resto da equipe do Núcleo de Citometria de Fluxo por fornecer treinamento e serviços de citometria de fluxo. Os autores também gostariam de agradecer a Shiva Sai Krishna Dasa, Dustin K. Bauknight, Melissa A. Marshall, James C. Garmey, Chantel McSkimming, Aditi Upadhye e Prasad Srikakulapu por sua assistência com a preparação de lipossomas (SSKD, DKB), colheitas de tecidos (MAM, JCG) e coloração por citometria de fluxo e aquisição de amostras (AU, PS, CM). Este trabalho foi apoiado por AstraZeneca, R01HL 136098, R01HL 141123 e R01HL 148109, AHA 16PRE30770007 e T32 HL007284 subvenções.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
Referências
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados