Method Article
הכנה, מתן והערכה של ספיגה תאית ספציפית לרקמת in vivo של ליפוזומים בעלי תווית צבע פלואורסצנטי
In This Article
Summary
מטרת פרוטוקול זה היא לסנתז ליפוזומים בעלי תווית פלואורסצנטית ולהשתמש בציטומטריית זרימה כדי לזהות לוקליזציה in vivo של ליפוזומים ברמה התאית.
Abstract
יש עניין גובר בשימוש בליפוזומים כדי לספק תרכובות in vivo, במיוחד עבור גישות טיפול ממוקדות. בהתאם לנוסחת הליפוזומים, ליפוזומים עשויים להילקח באופן מועדף על ידי סוגי תאים שונים בגוף. זה עשוי להשפיע על היעילות של החלקיק הטיפולי כמו התקדמות של מחלות שונות הוא ספציפי רקמות וסוג התא. בפרוטוקול זה, אנו מציגים שיטה אחת לסינתזה ותיוג פלואורסצנטי של ליפוזומים באמצעות DSPC, כולסטרול ו-PEG-2000 DSPE וצבע השומנים DiD כתווית פלואורסצנטית. פרוטוקול זה מציג גם גישה להעברת ליפוזומים in vivo ולהערכת ספיגה ספציפית לתא של ליפוזומים באמצעות ציטומטריית זרימה. ניתן להשתמש בגישה זו כדי לקבוע את סוגי התאים שתופסים ליפוזומים ולכמת את ההתפלגות והפרופורציה של ספיגת הליפוזומים בין סוגי תאים ורקמות. למרות שלא הוזכרו בפרוטוקול זה, בדיקות נוספות כגון אימונופלואורסנציה והדמיית פלואורסצנטיות של תא בודד על ציטומטר יחזקו כל ממצאים או מסקנות שנעשו מכיוון שהם מאפשרים הערכה של צביעה תוך תאית. ייתכן שיהיה צורך להתאים פרוטוקולים בהתאם לרקמות המעניינות.
Introduction
ככל שהעניין בפיתוח טיפולים המשתמשים באספקת תרופות של ננו-חלקיקים גדל, השיטות להכין ולהעריך את התפלגות וקליטת החלקיקים חייבות להמשיך להתקדם, להתרחב ולהיות נגישות לקהילת המחקר 1,2. פרוטוקול זה פותח כדי להעריך את סוגי התאים המדויקים שלקחו ליפוזומים in vivo בעקבות טיפול בליפוזומים עם תווית DiD עמוסים בטסגליטזאר, קולטן פרוליפרטור המופעל על ידי פרוקסיזום (PPAR)-α/γ אגוניסט 3,4. במחקרים אלה, הצלחנו להעריך אילו סוגי תאים הושפעו ישירות מהטיפול בטסגליטזאר ליפוזומלי, את היעילות של מיקוד moieties, וליצור השערות כדי להסביר את תוצאות הטיפול שצפינו. יתר על כן, תפקודים ביולוגיים מבוססים במגוון סוגי תאים מצביעים על כך שתאים פגוציטיים כגון מקרופאגים, תאים דנדריטיים ותאי קופפר ספציפיים לכבד תופסים את רוב הליפוזומים 5,6,7. באמצעות פרוטוקול זה, הוכחנו כי פגוציטים לא קלאסיים יכולים גם לקחת ליפוזומים 3,4.
פרוטוקול זה מציג שיטה אופטימלית למסיסות טסגליטזאר, הכנת ליפוזומים על ידי אידוי בפאזה הפוכה, ושימוש בסידן אצטט כגורם מושך להעמסת תרופות מרחוק. השיטות המוצגות נגישות למעבדות רבות וחסרות חומרים קשים להשגה ושלבים הדורשים טמפרטורות גבוהות. הפרוטוקול מייצר ליפוזומים בגדלים אופטימליים להגברת זרימת הדם in vivo8. יתר על כן, כפי שסוכם על ידי Su et al., עד כה, שיטות להעריך פיזור ליפוזומים in vivo וספיגת רקמות נחקרו ונבדקו לעומק9. שיטות טומוגרפיה של פליטת פוזיטרונים (PET), דימות תהודה מגנטית (MRI) וטומוגרפיה מולקולרית פלואורסצנטית (FMT) מיושמות כדי לכמת התפלגות ביולוגית ספציפית לרקמה וספיגה 9,10,11. בעוד שיטות אלה עברו אופטימיזציה כדי למקסם את הזיהוי in vivo, הן עדיין חסרות את היכולת לכמת את ספיגת הליפוזומים in vivo ברזולוציה תאית. הפרוטוקול המוצג כאן נועד להשיג צורך זה באמצעות שימוש בציטומטריית זרימה. לבסוף, עבור פרוטוקול זה, ספיגת התאים צומצמה למספר רקמות, כולל רקמת שומן. ישנו גוף הולך וגדל של ספרות החוקרת את הפוטנציאל לשימוש בננו-חלקיקים כדי לספק טיפולים בסביבה של השמנת יתר, חוסר מטבוליזם ודלקת 12,13,14,15,16,17. לכן, היה לנו חשוב לשתף פרוטוקול עם שיטות יעילות לעיבוד וניתוח רקמת שומן – אחת הרקמות שממלאת תפקיד חשוב בפתולוגיות האלה.
Protocol
כל השלבים בפרוטוקול זה מאושרים על ידי ופועלים בהתאם להנחיות הוועדה לטיפול ושימוש בבעלי חיים באוניברסיטת וירג'יניה.
הערה: יש כמה בקרות חשובות שיש לקחת בחשבון עבור שלבי ניתוח מאוחרים יותר, המסוכמים בטבלה 1 ויש לשקול אותם לפני מתן ליפוזומים.
1. הכנת ליפוזומים מסומנים פלואורסצנטית, עמוסים בסידן אצטט וטסגליטזאר
- יש לשלב DSPC (1,2-distearoyl-sn-glycero-3-phosphocholine), כולסטרול, PEG-2000-DSPE ו-DiD. לשם כך, שלב את DSPC, כולסטרול ו- PEG-2000 DSPE ביחס מסה של 2:1:1. הוסף צבע שומנים DiD בריכוז של 1 מ"ג של DiD לכל 1 מ"ל של ליפוזומים (יחס מולארי של 46:1 של DSPC:DiD).
הערה: DiD הוא קיצור מקובל עבור 1,1'-dioctadecyl-3,3,3',3',3'tetramethylindocarbocyanine dye. מכיוון שיש לו שני "זנבות שומניים" אוקטדצילים באורך שווה ל- DSPC המשמש בניסוח זה, הוא אמור להשתלב בעיקר בקרום השומנים. צבעי שומנים כמו DiO, DiD ו-DiI משמשים באופן שגרתי למחקר ליפוזומים8 והם נחשבים לבלתי ניתנים להחלפה18. - השתמש בקבוקון scintillation 20 מ"ל עבור תחליב שלב הפוך הכנה ליפוזום. בבקבוקון זה, ערבבו תמיסת אתר-כלורופורם ביחס 2:1 של שומנים עם סידן אצטט מימי (Ca-אצטט, 1 M, pH 7.4). היחס בין הפאזה האורגנית למימית צריך להיות 4:1, למשל, 4 מ"ל של פאזה אורגנית ו-1 מ"ל של פאזה מימית.
- תחליב את תמיסת האתר-כלורופורם של שומנים על ידי סוניקציה במשך 30 שניות בטמפרטורת החדר. הפעל את הסוניקטור בהספק של 20 קילו-הרץ ו-50% והשתמש ב-1/2 אינץ'. בדיקה.
הערה: יש לקרב את קצה הגשושית הסוניקטורית לתחתית הבקבוקון כדי למנוע הקצפה. אין לגעת בכוס עם קצה הבדיקה במהלך סוניקציה, היא עלולה להישבר. בנוסף, יש להוסיף כלורופורם לאתר כממס משותף: בנוכחות כולסטרול, תחליב אתר בלבד נפרד במהירות, מה שהופך את השלב הזה של ההליך לבלתי אפשרי. - הניחו מיד את הבקבוקון עם תחליב מים בשמן הומוגני על מאייד סיבובי עם מתאם מיוחד, מד מנומטר ושסתום וסת לחץ. יש לחבר את המאייד לקו ואקום כדי להסיר את הממסים האורגניים. הגדר את קצב הסיבוב ב- 100 סל"ד ואת השואב ב- 0.5 אטמוספירה, ושחרר אם קצף התחליב נראה מוגזם. לאחר שנוצר ג'ל ונעלם, להגדיל את הוואקום ל 0.9 אטמוספרה.
הערה: במהלך הסרת פאזה אורגנית נדיפה, יש לכוונן את רמת הוואקום בהדרגה, כדי למנוע הקצפה מהירה, מכיוון שהיא עלולה להוביל לאובדן תוכן מהבקבוקון לגוף המאייד הסיבובי. בסופו של דבר, כאשר האתר והכלורופורם יתאדו חלקית ויחס הנפח בין פאזת הממס המימי והאורגני יהיה קרוב ל-1:1, ייווצר ג'ל. האידוי צריך להימשך עד שהג'ל נעלם והמדיה המימית הנותרת נוזלית לחלוטין. ערבוב נוסף עשוי לסייע בהאצת הסרת הממס האורגני. ניתן להשיג זאת על ידי הצבת מוט ערבוב פוליטטרה-פלואוראתילן לתוך בקבוק האידוי, כדי לשפר את הסעת הג'ל הצמיג במהלך אידוי סיבובי. - סנן את הליפוזומים המתקבלים באמצעות ממברנות פוליקרבונט חרוטות כדי להשיג פיזור גודל הומוגני.
- בצע סינון על ידי העברת הפיזור המימי הליפוזום קדימה ואחורה מספר פעמים דרך מסנן פוליקרבונט של 200 ננומטר נקבוביות במכבש ליפוזומים המצויד בשני מזרקים אטומים לגז.
הערה: מזרקים קטנים יותר עדיפים (למשל, 0.5 מ"ל) מכיוון שהם מבטיחים יצירת לחץ מספיק לסינון. עם תכולת כולסטרול גבוהה בקרום הליפוזום, אין צורך בטמפרטורה גבוהה, וניתן לבצע את ההליך בטמפרטורת החדר. מספר אי-זוגי של סינונים (למשל, 21) מבוצע, כך שהחומר המתקבל בסופו של דבר נמצא בצד הנגדי של המסנן מלכתחילה ואם מעוקר מראש, ניתן לאסוף את הדגימה הסטרילית של ליפוזומים מותאמים בגודל מסונן. גודל הליפוזומים המתקבלים הוא בדרך כלל קרוב לגודל נקבוביות המסנן שנבחר. ניתן לערום שני מסננים (במקום אחד) כדי לבצע התאמה עדינה לגודל חלקיקים נמוך יותר. - אמת את התפלגות הגודל באמצעות פיזור אור לייזר דינמי (DLS)3,4.
- מוסיפים 1 עד 3 מ"ל מלח לקובט בקוטר 1 ס"מ עם ארבעה צדדים שקופים. לזה מוסיפים 10\u201220 μL של ליפוזומים ומערבבים בזהירות. מקם את הדגימה לתוך המכשיר ובחר את הפרמטרים הבאים למדידה: צמיגות ממס, אינדקס שבירה, אינדקס שבירה של שומנים. לחץ על לחצן התחל . המדידות יימשכו מספר דקות ויכללו 100 ריצות או יותר.
- בצע סינון על ידי העברת הפיזור המימי הליפוזום קדימה ואחורה מספר פעמים דרך מסנן פוליקרבונט של 200 ננומטר נקבוביות במכבש ליפוזומים המצויד בשני מזרקים אטומים לגז.
- הסר Ca-אצטט חיצוני באמצעות עמוד ספין התפלה. למחצית האצווה, הוסיפו טסגליטזאר מימי במאגר HEPES של 10 מ"מ (pH 7.4) ודגרו עם ערבוב ב-37°C למשך שעה אחת. השתמשו בחצי השני של האצווה כנוסחה של ליפוזומי בקרה ללא תרופות.
הערה: יש לאזן מראש את עמודת הספין להתפלה בנפח 2 מ"ל עם מאגר HEPES של 10 mM, pH 7.4, לפני השימוש. לשם כך, מקם 1 מ"ל של חיץ HEPES לתוך העמוד ולסובב בצנטריפוגה ב 1000 x גרם במשך 2 דקות. הסר את מאגר המעבר וחזור על פעולה זו ארבע פעמים. - הסר טסגליטזאר לא לכוד מליפוזומים באמצעות עמודת ספין של 2 מ"ל, וקבע את ריכוז התרופה הכלואה באופן ספקטרופוטומטרי.
- יש להוסיף לא יותר מ-0.5 מ"ל דגימת ליפוזום למצע הג'ל של העמוד היבש ולהמתין עד שכל הדגימה תיכנס לג'ל. צנטריפוגה בדיוק באותם תנאים כמו קודם לכן (1000 x גרם, 2 דקות) ולאסוף את דגימת הליפוזום במעבר מטוהר מתרכובות מסה מולקולרית קטנה.
- כמת תכונות חלקיק סופיות: גודל וריכוז חלקיקים באמצעות DLS ופוטנציאל zeta עם מערכת משולבת של פיזור אור DLS-אלקטרופורקטי (ELS) 3,4 ב- 10 mM HEPES buffer pH 7.4 וב- 25 ° C.
- בדומה לשלב 1.5.2, יש לדלל את פיזור הליפוזומים במאגר המדידה (למשל, 10 μL ליפוזומים לכל 1 מ"ל של תמיסת חיץ) לקובט בצורת U באמצעות מזרק Luer חד פעמי, או פיפטה עם קצה חתוך. ודא שאין בועות ב- "U" כך שתהיה תמיסה רציפה לזרימת זרם חשמלי.
- הכניסו את הקובטה ליחידה (שימו לב לחלק הקדמי והאחורי של הקובט, כך שהאלקטרודות מחוברות כראוי ליחידה). סגור את דלת המכשיר; לאחר מכן, המדידה מתבצעת (עם חזרות מרובות), תחת שליטה של תוכנת הנחיה.
2. הכינו ליפוזומים למתן in vivo
- בארון בטיחות ביולוגית, מדללים ליפוזומים במי מלח סטריליים לריכוז המתאים בנפח סופי של 50 μL למתן in vivo.
הערה: במחקרים קודמים, תכשיר הליפוזומים שלנו הכיל 2 מ"ג/מ"ל של טסגליטזאר, השווה לכ-4.89 מיקרומול של טסגליטזאר/מ"ל, וניהלנו ליפוזומים במינון של 1 מיקרומול תרופה/ק"ג. עבור עכבר של 40 גרם, היינו מביאים 8.2 מיקרוליטר של ליפוזומים עד לנפח סופי של 50 מיקרוליטר במי מלח. באמצעות DLS/ELS, יש לכמת גם את מספר הליפוזומים ליחידת נפח עבור ההכנות של ליפוזומים טעונים בתרופות ובכלי רכב, כדי להבטיח שמספר שווה של ליפוזומים ברכב יינתן לכל גרם של משקל עכבר בהשוואה לליפוזומים עמוסי תרופות. - טען את תמיסת הליפוזום לתוך מחט 27 גרם בארון הבטיחות הביולוגית. שמור זאת בטמפרטורת החדר כדי למנוע הזרקת תמיסה קרה לעכבר.
3. מתן ליפוזומים באמצעות הזרקה רטרו-אורביטלית תוך ורידית
הערה: ראוי גם לבצע את ההזרקה תוך ורידי בשיטות אחרות, כגון זריקות ורידים זנב אם הוא מועדף. למרות שאינם מכוסים בפרוטוקול זה, פרוטוקולים שפורסמו המסבירים שיטהזו 19 זמינים.
- הגדר את סביבת העבודה לאספקת ליפוזומים.
- נקו את שולחן העבודה עם 70% אתנול. הקפידו לבחור חלל המאפשר שימוש במערכת הרדמה איזופלורנית.
- הפעל כרית חימום והנח מעליה כרית או מגבת נקייה כדי לשמור על העכבר על משטח נקי. הקדישו מספיק זמן להתחממות הפד לפני תחילת העבודה עם עכברים.
- הגדר את מערכת ההרדמה כך שהחדר יהיה קרוב וחרוט האף יהיה על כרית החימום.
- ודא שכל שאר ההיבטים של המערכת מוכנים (לדוגמה, רמת איזופלורן גבוהה מספיק בוופורייזר, מסנן הפחם נשקל, צינורות מחוברים כראוי).
- אספו את החומרים האחרים הדרושים לחלק זה של הפרוטוקול: ג'ל סיכה אופתלמי, חומר הרדמה מקומי לטיפול לאחר מתן התרופה, רפידות גזה סטריליות.
- להרגיע את העכבר באמצעות isoflurane בתא אינדוקציה. ברגע שהוא אינו מגיב לנקישה עדינה ברגל, העבר במהירות את העכבר לסביבת העבודה תוך שמירה על הרגעה דרך חרוט באף.
הערה: יש לשמור על בעל החיים באיזופלורן של 1.5% עד 2.5% ולהעריך את עומק ההרדמה המתאים (באמצעות חוסר תגובה לצביטת הבוהן) לפני המשך ההליך. - הזז את העכבר לצד אחד לצורך מתן ליפוזום. מכיוון שהעכבר לא ימצמץ בזמן הרדמה, יש למרוח כמות קטנה של חומר סיכה אופתלמי על שתי העיניים כדי לשמור על לחות במהלך שארית ההליך.
- לחץ בעדינות כלפי מטה על העור מעל ומתחת לעין החשופה. העין צריכה להתרומם מעל מישור הפנים.
- הכניסו בזהירות את קצה המחט לקנטוס המדיאלי, וודאו שהמחט נמצאת מתחת לעין ולא נוגעים בה. ברגע שהמחט מוחדרת מתחת לעין, מזריקים לאט את הליפוזומים לחלל הרטרו-מסלולי. עם משיכת המחט, ייתכן שיהיה צורך לסגור את העפעפיים במשך כמה שניות כדי להשיג hemostasis.
- אם המחט אינה מוחדרת מספיק רחוק פנימה, התמיסה עלולה להופיע סביב העין. יש להפסיק מיד את ההזרקה אם רואים זאת ולמקם מחדש את המחט.
- החל הרדמה מקומית, כגון proparacaine, על העין כדי למנוע כאב לאחר ההליך ואי נוחות.
- שמור את העכבר על כרית חימום ולפקח עד שהוא מתעורר כדי לוודא שהוא בריא ושומר על טמפרטורת גוף נאותה.
- החזירו את העכבר לכלוב ולסביבת הדיור הרגילה שלו עד שתגיע נקודת הזמן.
הערה: יש לעשות זאת בהתאם להנחיות IACUC המקומיות.
4. הכינו חומרים לקצירת הרקמות, עיבוד הרקמות, וצביעת ציטומטריית זרימה
- הכנת תמיסות לקטיף, עיבוד וצביעה (סעיפים 5\u20127): מלח חוצץ פוספט (PBS)-הפרין, מאגר HEPES, 2 מ"ג/מ"ל Collagenase סוג I, חיץ ליזיס AKC, מאגר FACS, PBS, חיץ קיבוע (טבלה 2). שמור את כל התמיסות למעט חיץ הקיבוע ב -4 ° C או על קרח במהלך ההליך.
- הכינו צינורות עם מאגרים וחומרים אחרים לקציר ועיבוד רקמות.
- עבור דם מכל עכבר, הוסף 10 μL של 0.5 M EDTA לצינור מיקרוצנטריפוגה 1.5 או 1.7 מ"ל לאיסוף הדם. ה- EDTA ימנע את קרישת הדם. מזרק 1 מ"ל עם מחט 25 G וצינור חרוטי 15 מ"ל נדרשים גם.
- עבור הטחול, לאסוף צינור מיקרוצנטריפוגה אחד 1.5 או 1.7 מ"ל עם 1 מ"ל של חיץ HEPES, מזרק 1 מ"ל, שני צינורות חרוטי 50 מ"ל, ושני מסננים 70 מיקרומטר לכל טחול.
- עבור כל מחסן רקמת שומן, אספו בקבוקון פוליאתילן של 20 מ"ל עם חיץ HEPES של 1.5 מ"ל לטחינת הרקמה, צינור חרוטי של 50 מ"ל ומסנן של 70 מיקרומטר לכל סוג רקמת שומן לכל עכבר.
- הכינו את סביבת העבודה לקראת הקציר.
- נקו את חלל הספסל עם 70% אתנול. הכינו מגש גומי להצמדת העכבר במהלך הקציר על ידי ניקויו באתנול 70% וכיסויו בפד סופג או מגבות נייר. ודא שלפחות 5 פינים זמינים לעבודה איתם.
- ממלאים מזרק 10 מ"ל עם PBS-הפרין ומהדקים על מחט 25 גרם לזילוח.
- אספו כלים וחומרים לשימוש במהלך הקציר. יש צורך במלקחיים (שני זוגות), מספריים, מגבות נייר, מגבונים ללא סיבים, שפופרות מיקרוצנטריפוגות עם EDTA, שפופרות מיקרוצנטריפוגות עם חיץ HEPES ובקבוקוני פוליאתילן עם חיץ HEPES.
5. לקצור את הרקמות
- הרדימו את העכבר על ידי חנק CO2 . אין לבצע נקע צוואר הרחם מכיוון שהדבר עלול למנוע איסוף דם יעיל וזילוח רקמות בשלבים מאוחרים יותר.
- באזור ספסל נקי עם מספיק מקום עבודה ותאורה כדי לראות את העכבר היטב, הציבו מגש דיסקציה מגומי, דלי קרח לאחסון דגימות ובקבוק תרסיס עם 70% אתנול. רססו את העכבר באתנול 70% כדי להפחית את הזיהום ולשלוט בהתפשטות השיער. הניחו את העכבר על גבו על מגש הגומי והצמידו את כפותיו הפרושות הרחק מגופו.
- כדי להתכונן לאיסוף דם, בזהירות לבצע חתך בעור בקצה הקצה הקאודלי של כלוב הצלעות של העכבר. חותכים קו קטן וישר כלפי מעלה לכיוון ראש העכבר (כ-1 ס"מ) עד לחשיפת שרירי החזה.
- באתר החתך הראשוני, בצע שני חתכים קטנים בניצב לקו לכיוון הראש. לאחר מכן, לחתוך בזהירות את שריר החזה בצד אחד של כלוב הצלעות באזור החשוף. זה מאפשר גישה טובה יותר ויזואליזציה עבור המקום שבו המחט צריכה להיות מוחדרת.
- כדי לאסוף דם, הכנס את המחט בין הצלעות השלישית והרביעית בצד שבו הוסר השריר. מכיוון שליבו של העכבר נמצא במרכז חלל החזה, שמור את המחט קרוב ככל האפשר לקו המרכזי של כלוב הצלעות. לאחר החדרתו, למשוך בעדינות על המזרק כדי להתחיל לאסוף דם.
- לאחר האיסוף, להעביר את הדם לצינור microcentrifuge מוכן עם EDTA ולאחסן על קרח.
הערה: אם כ-100 מיקרוליטר של נפח נמשך למעלה ולא נכנס דם למזרק, נסה לסובב את המזרק ימינה או שמאלה למקרה שפתח המחט נלחץ כנגד דופן הלב. אם זה לא עוזר, לאט לאט להזיז את המחט עוד לתוך חלל החזה או להתחיל להסיר. אם הדם מתחיל להצטבר במזרק בשלב זה, המשך למשוך בחזרה את המזרק לאט. שקול לסובב את המזרק והמחט לחילוץ מוצלח. לבסוף, אם לא נאסף דם, הסר את המחט מכיוון שהיא אולי פספסה את הלב. נסה להחדיר מחדש את המחט ולחזור על התהליך הנ"ל שוב.
- לאחר מכן, כדי לחורר את העכבר, לפתוח את חלל החזה כדי לגשת ללב.
- כדי לעשות זאת, לחתוך את העור לאורך קצה כלוב הצלעות למטה לצד של העכבר מכל צד. לאחר מכן, השתמש במלקחיים כדי להחזיק את עצם החזה הרחק ממשטח העבודה. בצע חתך קטן ורדוד ממש מתחת לקצה עצם החזה כדי לחתוך דרך חלל הצפק. חותכים לאורך קרום הצפק לאורך קצה כלוב הצלעות בכל אחד מצידי העכבר. זה אמור לחשוף את הכבד ואת כיס המרה. היזהר לא לחתוך לתוך אף אחת מהרקמות האלה.
- לאחר מכן, לעשות חתך קטן, רדוד לתוך הסרעפת, גולגולת לכבד. לאחר מכן, חתכו את הסרעפת לאורך קצה כלוב הצלעות כדי לפתוח את חלל החזה. הקפד להימנע מחיתוך כל אחד מהאיברים בתוך חלל החזה.
- בצע שני חתכים לאורך כלוב הצלעות לכיוון הראש כ 2-3 מ"מ מקו המרכז של העכבר וכ 0.75 ס"מ אורך.
הערה: אם נחתכים גבוה מדי, העורקים השוכנים בחלק העליון של כלוב הצלעות ייחתכו. זה יפריע ליעילות של זילוח. - הרימו לאחור את החלק המרכזי של כלוב הצלעות כדי לחשוף את חלל החזה. הרחיקו כל שומן או רקמה כדי לגשת ללב.
- בצע חתך קטן לתוך אטריום ימין של הלב של העכבר כדי ליצור פתח שדרכו לדחוף את הדם החוצה.
- באמצעות מזרק 10 מ"ל של PBS-הפרין, להחדיר את המחט לחדר השמאלי של הלב של העכבר.
- התחילו לדחוף בעדינות PBS לתוך הלב לאט ככל האפשר.
הערה: יש לראות דם יוצא מן האטריה הימנית וממלא את חלל החזה. הקפד לשמור על הלב במיקום הפיזיולוגי שלו כדי למנוע עיכוב זרימת PBS-הפרין מהלב דרך אבי העורקים. - לאחר שכל 10 מ"ל של PBS-הפרין נוקבו דרך העכבר, השליכו את המזרק והמחט והוציאו עודפי דם ו-PBS-הפרין מחלל החזה באמצעות מגבות נייר או מגבונים ללא מוך.
- לאחר מכן, כדי להתחיל לחלץ רקמות, לחתוך את העור ואת קרום הצפק לכיוון זנב העכבר כדי לפתוח את חלל הצפק.
- ראשית, חלצו את כרית רקמת השומן המפשעתית מכל צד של העכבר.
הערה: קרא תהליך זה בעיון: הקפד לחלץ את בלוטת הלימפה המפשעתית מכל מחסן כדי למנוע הטיית ההרכב התאי של רקמת השומן בתוצאות.- בעזרת קבוצה שנייה של מלקחיים, החזיקו את קרום הצפק עם סט אחד של מלקחיים ואת קצה העור מעל הקרום בצד זה עם המלקחיים האחרים. משכו בעדינות את העור מקרום הצפק כדי להפריד שכבות אלה זו מזו. חפשו את מחסן רקמת השומן המפשעתית לאורך העור. הצמידו את הקצה החיצוני של העור כדי לגשת טוב יותר למחסן השומן.
- לפני השאיבה יש לאתר את בלוטת הלימפה המפשעתית במרכז מחסן השומן ולהסירו באמצעות מלקחיים ומספריים לפי הצורך.
הערה: במידת האפשר, אתר את שלושת העורקים הגדולים יותר העוברים מהקצוות החיצוניים של המחסן לכיוון המרכז. בלוטת הלימפה ממוקמת סביב המקום שבו עורקים אלה נפגשים. - לאחר הסרת בלוטת הלימפה, החזיקו בזהירות את קצה מחסן השומן הקרוב ביותר לנקודה המוצמדת עם המלקחיים והתחילו לבצע חתכים קטנים בקרום החיבור שבין רקמת השומן לעור. הרימו את רקמת השומן הרחק מהעור תוך כדי ביצוע חתכים כדי לאפשר גישה טובה יותר לקרום ולהבטיח מיצוי של כל המחסן.
- הניחו את מחסן השומן בבקבוקון פוליאתילן מוכן עם חיץ HEPES על קרח כדי לשמור על הרקמה בת קיימא במהלך שארית הקציר.
- חזור על תהליך זה בצד השני של העכבר כדי לחלץ את שני המחסנים. ניתן לעכל ולעבד מחסנים יחד או בנפרד. אם רוצים לעבד כל מחסן בנפרד, יש להכין צינורות נוספים.
- לאחר מכן, לחלץ את מחסני שומן epididymal מן הקצה הקאודלי של חלל הצפק. בעזרת מלקחיים, משכו בעדינות את מחסן השומן האפידידימלי הראשון מהקצה הגבי של העכבר ואתרו את האפידידימיס והואס דפרנס המחוברים למחסן זה.
הערה: ישנם שני מחסני שומן אפידידימליים: אחד מחובר לכל אפידידימיס ו vas deferens.- חותכים בזהירות בין מחסן השומן לבין האפידידימיס והואס דפרנס כדי להפריד את השומן מרקמות אחרות אלה. הניחו את מחסן השומן בבקבוקון פוליאתילן עם חיץ HEPES על קרח כדי לשמור על הרקמה בת קיימא במהלך שארית הקציר.
- לבסוף, לחלץ את הטחול, אשר נמצא משמאל לבטן ליד הסרעפת. באמצעות מלקחיים, בעדינות למשוך את הבטן לכיוון מרכז חלל הצפק כדי לחשוף את הטחול.
- החזיקו בעדינות קצה אחד של הטחול ומשכו אותו מעט הרחק מהבטן. חותכים את הקרום בין הטחול לרקמה הסמוכה לו עד לניתוק האיבר. מניחים את הטחול בצינור מיקרוצנטריפוגה מוכן עם חיץ HEPES ולאחסן על קרח.
- לפני עיבוד רקמות או קצירת רקמות מהעכבר הבא, השליכו את הפגר וכל מגבות נייר מלוכלכות או פדים. נגבו גם כלים.
הערה: אם יש עכברים מרובים, חזור על שלבי הקציר הבאים עבור כל עכבר לפני המעבר לשלב העיבוד הבא. אם עכבר/עכברי ביקורת כלולים, שקול לקצור אותם לפני עכברים שטופלו בליפוזומים כדי למנוע זיהום.
6. תהליך רקמות
הערה: מכיוון שלרקמת השומן יש דגירה ארוכה של עיכול, מומלץ להתחיל בתהליך זה תחילה ולעבוד על עיבוד הדם והטחול במהלך תקופת העיכול.
- ראשית, לטחון ולעכל את רקמות השומן. בעזרת זוג אחד או שניים של מספריים, טוחנים את רקמת השומן בכל בקבוקון פוליאתילן עד שהרקמה נמצאת בחתיכות קטנות בגודל של פחות מ-0.5 מ"מ. זה מאפשר עיכול יעיל יותר.
- לאחר טחינת הרקמות בכל הבקבוקונים, יש להוסיף 1.5 מ"ל של 2 מ"ג/מ"ל חיץ Collagenase לכל בקבוקון. מניחים את הבקבוקונים באינקובטור רועד לטמפרטורה של 37 מעלות צלזיוס ו-150 סל"ד. יש לדגור במשך 30 עד 45 דקות.
הערה: אם רקמות השומן גדולות במיוחד, שקול להוסיף עוד 0.5 מ"ל עד 1.5 מ"ל של חיץ HEPES ונפח שווה של חיץ Collagenase לבקבוקון כדי להבטיח שהרקמות שקועות לחלוטין וקיים מספיק אנזים. הריכוז הסופי של Collagenase Type I בעיכול צריך להיות 1 מ"ג / מ"ל ללא קשר לנפח התמיסה הסופי. יתר על כן, אם אינקובטור רעד אינו זמין, דגימות ניתן להציב באמבט מים מחומם ל 37 מעלות צלזיוס. נערו בעדינות את הדגימות כל 5 דקות כדי לערבב ולהשעות מחדש את העיכול. - בדוק את הדגימות ב 30 דקות. השתמש בצינור של 1 מ"ל כדי לצנרת את הדגימה למעלה ולמטה. אם חתיכות הרקמה עדיין גדולות מדי לפיפטינג קל, החזירו את הדגימות לאינקובטור למשך 15 דקות נוספות.
- לאחר שהדגימות מתעכלות במלואן, המשיכו לזרום את הדגימה למעלה ולמטה עוד 10 פעמים כדי להבטיח שנוצר תרחיף חד-תאי.
הערה: (אופציונלי) בדוק את הדגימות ב- 30 דקות. השתמש פיפטה 1 מ"ל כדי pipet את הדגימה למעלה ולמטה. אם חתיכות הרקמה עדיין גדולות מדי לפיפטינג קל, החזירו את הדגימות לאינקובטור למשך 15 דקות נוספות. - מפטמים את תרחיף התא דרך מסנן של 70 מיקרומטר לתוך צינור חרוטי של 50 מ"ל. הוסף 5 מ"ל של חיץ FACS לבקבוקון העיכול הריק כדי לשטוף את הבקבוקון. העבירו את מאגר השטיפה הזה דרך המסנן כדי להוסיף למתלה התא.
- אחסנו דוגמאות על קרח בזמן שאחרות מעובדות. לאחר סינון כל הדגימות, סובבו אותן בטמפרטורה של 400 x גרם, 4°C למשך 5 דקות.
- הסר את supernatant אדיפוציט על ידי שאיפה ולאחר מכן בזהירות להסיר את infranatant בין supernatant אדיפוציט גלולה על ידי שאיפה לעזוב את החלק סטרומה-כלי הדם (SVF) גלולה.
- השהה מחדש את הגלולה ב -1 מ"ל של חיץ FACS והעבר לצינור מיקרוצנטריפוגה נקי של 1.5 או 1.7 מ"ל. תאי Aliquot עכשיו אם תרצה או נחוץ. יש לשמור על קרח עד שכל הדגימות מוכנות לצביעת ציטומטריית זרימה.
הערה: אם מחסני השומן שעוכלו היו גדולים, שקול להשתמש רק ב-50% או 25% מהדגימה לצורך צביעה ציטומטרית של זרימה וניתוח. בנוסף, אם יש צורך בפקדי פלואורסצנטיות מינוס אחד (FMO) או בקרות נוספות לניתוח ציטומטריית זרימה (טבלה 1), הקפד לחבר דגימה נוספת לצינור נפרד לעיבוד. FMOs משמשים להבחנה בין אות שלילי וחיובי עבור נוגדן מצומד פלואורופור בודד בתוך פאנל שלם אחרת ששימש בניסוי.
- לאחר טחינת הרקמות בכל הבקבוקונים, יש להוסיף 1.5 מ"ל של 2 מ"ג/מ"ל חיץ Collagenase לכל בקבוקון. מניחים את הבקבוקונים באינקובטור רועד לטמפרטורה של 37 מעלות צלזיוס ו-150 סל"ד. יש לדגור במשך 30 עד 45 דקות.
- שנית, לעבד את הדם.
- מעבירים 50 μL של דם לצינור חרוטי 15 מ"ל.
- הוסף 1 מ"ל של חיץ ליזיס AKC לכל צינור וצינור למעלה ולמטה כדי להגיע לתרחיף חד-תאי. הוסף 4 מ"ל נוספים של חיץ ליזיס AKC לכל צינור ודגרה למשך 5\u201210 דקות. אם יש שייקר או מסובב זמין, אטמו היטב את מכסי הצינור והניחו את הצינורות על אחד מהם כדי לשפר את הערבוב.
- הוסף 5 מ"ל של מאגר FACS כדי להרוות את תהליך הליזה ולסובב את הדגימות ב 400 x גרם, 4 ° C במשך 5 דקות. מוציאים את הסופרנאטנט ובודקים את הכדור. אם הוא עדיין אדום למדי, חזור על תהליך הליזיס. אחרת, להשעות מחדש את הכדורים ב 1 מ"ל של חיץ FACS ולהעביר צינור נקי 1.5 או 1.7 מ"ל מיקרוצנטריפוגה. יש לשמור על קרח עד שכל הדגימות מוכנות לצביעת ציטומטריית זרימה.
- לבסוף, לעבד את הטחול. מעבירים את הטחול למסנן 70 מיקרומטר על גבי צינור חרוטי בנפח 50 מ"ל. לשטוף את הרקמה עם 1 מ"ל של חיץ FACS ולאחר מכן למעוך את הטחול דרך המסנן באמצעות קצה הבוכנה של מזרק 1 מ"ל. במהלך תהליך המעיכה, שטפו את התאים לתוך צינור חרוטי 50 מ"ל באמצעות מאגר FACS נוסף. הנפח הסופי בצינור החרוטי צריך להיות 10 מ"ל.
- סובב את התאים ב- 300 x גרם ב- 4 ° C למשך 5 דקות. הסר את supernatant ו resuspend ב 1 מ"ל של חיץ ליזה AKC. מוסיפים עוד 4 מ"ל של חיץ ליזיס AKC ודגרים במשך 5 דקות. הוסף 5 מ"ל של מאגר FACS כדי להרוות את תהליך הליזה ולסובב את הדגימות ב 300 x גרם ב 4 ° C במשך 5 דקות.
- הסר את supernatant ו resuspend את הגלולה ב 1 מ"ל של מאגר FACS. העבירו את המתלה דרך מסנן שני, נקי של 70 מיקרומטר לתוך צינור חרוטי של 50 מ"ל. הוסף 4 מ"ל של מאגר FACS כדי לשטוף את הצינור המקורי ולהעביר את המאגר דרך המסנן לנפח סופי של 5 מ"ל.
- מעבירים 50 μL של תרחיף התא לצינור מיקרוצנטריפוגה נקי של 1.5 או 1.7 מ"ל ושומרים על קרח עד שכל הדגימות מוכנות לצביעת ציטומטריית זרימה. ניתן להעביר אליציטוטים נוספים לצינורות אם רוצים או נדרשים יותר.
הערה: טחול הם תאים מצוינים לשימוש עבור כתם יחיד חי/מת. שקול להעביר aliquot נוסף עבור פקד זה.
7. צביעת תאים מרקמות לצורך ציטומטריית זרימה
- סובב למטה דגימות aliquoted ב 400 x גרם, 4 ° C במשך 5 דקות.
- הסר דגימות supernatant והשהה מחדש ב- 50 μL של בלוק Fc (מדולל) (טבלה 2). דוגרים על קרח במשך 5 דקות.
- הוסף 50 μL של תערובת נוגדנים 2x (טבלה 3) לכל דגימה. דוגרים על קרח בחושך במשך 20 דקות.
הערה: אין להכתים כתמים בודדים בתערובת נוגדנים זו. בנוסף, אם רוצים להשתמש ב-FMO, יש להכין בנפרד תערובות נוגדני FMO. - יש לשטוף דגימות עם 1 מ"ל של PBS ולהסתובב ב 400 x גרם, 4 ° C במשך 5 דקות. הסר את דגימות הסופרנאטנט והשהה מחדש ב- 200 μL של כתם כדאיות (טבלה 3). דוגרים על קרח בחושך במשך 20 דקות.
הערה: אל תשכח להכתים תאים שהופרשו לכתם יחיד חי/מת במהלך שלב זה. - יש לשטוף דגימות עם 1 מ"ל של מאגר FACS ולסובב במהירות של 400 x גרם, 4°C למשך 5 דקות. הסר דגימות supernatant ו- resuspend (למעט כתם יחיד חי/מת) ב- 50 μL של מדיום קיבוע (מגיב A) כדי לתקן דגימות. דוגרים בטמפרטורת החדר בחושך במשך 15 דקות.
- יש להשהות מחדש את הכתם היחיד חי/מת ב-100 μL של 2% PFA. דוגרים בטמפרטורת החדר בחושך במשך 5 דקות.
- יש לשטוף את הדגימה עם 1 מ"ל של מאגר FACS ולסובב במהירות של 800 x גרם, 4°C למשך 5 דקות. הסר דגימות supernatant והשהה מחדש ב- 250 עד 500 μL של מאגר FACS. יש לאחסן בטמפרטורה של 4°C עד שניתן יהיה להפעיל דגימות על ציטומטר הזרימה.
- יש לשטוף דגימות עם 1 מ"ל של מאגר FACS ולסובב בטמפרטורה של 800 x גרם, 4°C למשך 5 דקות. הסר את דגימות הסופרנאטנט והשהה מחדש ב- 50 μL של מדיום חדירה (מגיב B) בתוספת נוגדן/ים לחלבונים תוך תאיים. דוגרים בטמפרטורת החדר בחושך במשך 20 דקות.
- שטפו את הדגימות עם 1 מ"ל של מאגר FACS וסחררו ב-800 x גרם ב-4°C למשך 5 דקות. הסר את supernatant ו resuspended את הדגימות ב 100 μL של 2% paraformaldehyde (PFA). דוגרים בטמפרטורת החדר בחושך במשך 5 דקות.
- יש לשטוף דגימות עם 1 מ"ל של מאגר FACS ולסובב בטמפרטורה של 800 x גרם, 4°C למשך 5 דקות. הסר את דגימות הסופרנאטנט והשהה מחדש במאגר FACS של 250 עד 500 מיקרוליטר. יש לאחסן בטמפרטורה של 4°C עד שניתן יהיה להפעיל דגימות על ציטומטר הזרימה.
תוצאות
ייצור ליפוזום
התוצאות המתפרסמות כאן דומות לאלהשבעבודתנו שפורסמה בעבר 3,4,20. תוך שימוש בפרוטוקול המוצג כאן, אנו מצפים לייצר ליפוזומים בגודל של כ-150-12160 ננומטר. DLS חושף קוטר ליפוזומי ממוצע של 163.2 ננומטר ופוטנציאל זטה של -19.2 mV (איור 1A). הדמיית מיקרוסקופ אלקטרונים קריוגני (cryo-EM) חושפת ליפוזומים מעגליים (איור 1B), ודיאגרמת DLS חושפת סטיית תקן קטנה יחסית מהקוטר הממוצע (איור 1C).
קשירת ליפוזום חיובית דורשת בקרה שטופלה ב-PBS
מחקרים קודמים מהקבוצה שלנו שהשתמשו בפרוטוקול זה בדקו אילו תת-קבוצות תאים בשומן, SVF, טחול ודם קשורים לליפוזומים לאחר שבוע של מתן in vivo 3,4. באמצעות עכבר שטופל ב-PBS, חלל הצפק ותאי הטחול הוכתמו באותו פאנל נוגדנים ששימש בדגימות מעכברים שטופלו בליפוזומים. רקמות נקצרו לאחר שבוע של טיפולים (איור 2A). הדגימות מהעכבר שטופל ב-PBS שימשו כ-DiD FMO שבאמצעותו ניתן היה ליצור שערי DiD חיוביים (איור 2B,C). ניתן ליצור שער חיובי באמצעות אות DiD-חיובי, אך יש להשתמש גם בדגימות חסרות אות DiD כדי לוודא שהשער החיובי אינו כולל דגימות DiD שליליות.
יש צורך בטיטרציות כדי למטב אותות פלואורסצנטיים
לפני ביצוע ניסוי מלא, יש לבצע אופטימיזציה של מצבים שונים, כולל ריכוז של נוגדנים מצומדים פלואורסצנטיים המשמשים במהלך צביעת תאים ושל צבע שומנים המשמש במהלך הכנת ליפוזומים. לציטומטרים של זרימה יש גבול עליון לזיהוי עוצמת פלואורסצנטיות, כך שיותר מדי צבע המשולב בליפוזומים יוביל לרמות בלתי ניתנות לכימות של אות DiD בדגימות העוברות דרך הציטומטר. יתר על כן, יותר מדי DiD בליפוזומים עלול להוביל לרמות גבוהות של העברת צבע לא ספציפית, מה שעלול להטות את תוצאות ספיגת התאים. איור 3 מדווח על תוצאות ניסוי שבו ריכוזי צבע שומנים עברו טיטרציה כדי לזהות את הריכוז שיפיק אות אופטימלי בטווח הגילוי של ציטומטר הזרימה שבו נעשה שימוש. זה נערך על הרקמות המעניינות עבור הניסוי האחרון: דם (איור 3A), שומן מפשעתי SVF (איור 3B), ושומן אפידידימלי SVF (איור 3C). הריכוזים שנבחרו לבדיקה היו 10 מ"ג של DiD (גבוה, אדום), 1 מ"ג DiD (אמצעי, כחול), או 0.1 מ"ג של DiD (נמוך, אפור) לכל 1 מ"ל של ליפוזומים. הריכוז הגבוה ביותר שנעשה בו שימוש בליפוזומים היה גבוה מדי ועבר את הטווח הניתן לכימות של הציטומטר בכל שלוש הרקמות (איור 3A\u2012C, אדום). הריכוז הנמוך ביותר של DiD הראה אות מסוים (איור 3 A\u2012C, אפור), אולם לא נצפתה אוכלוסייה ברורה מעבר לתאים שטופלו ב-PBS (איור 3A\u2012C, שחור). כאשר מכמתים, הממוצע האריתמטי של DiD MFI עבור כל רקמה וריכוז הראה הבחנה ברורה בין בקרות PBS לבין הריכוז האמצעי של DiD (איור 3D). לכן, כפי שמצוין בפרוטוקול, בחרנו את הריכוז האמצעי (איור 3, כחול) לשימוש בהכנת הליפוזומים שלנו.
השימוש בפאנל רב-נוגדנים מאפשר זיהוי ספיגת ליפוזום על ידי תת-קבוצות תאים שונות
באמצעות הפאנל המתואר בטבלה 3, תאים הוכתמו בנוגדנים כנגד סמנים של מקרופאגים, תאי B, תאי T, תאים דנדריטיים, מונוציטים ותאי אנדותל (איור 4). אסטרטגיות gating שונות במקצת נדרשות עבור כל סוג רקמה, אך ניתן לזהות את רוב סוגי התאים בכל אחד מהם. כמה יוצאים מן הכלל כוללים תאי אנדותל, אשר אינם נמצאים בדרך כלל בדם, מונוציטים, אשר בדרך כלל בתדירות גבוהה יותר בדם מאשר רקמות אחרות. לאחר זיהוי האוכלוסיות, ניתן לכמת את הגודל הכולל של כל אוכלוסיית תאים ואת התדירות שבה הם נמצאים ב-DiD+. ניתן לבצע חישובים נוספים כדי לאפיין את אוכלוסיית DiD+: איזה אחוז מתאי DiD+ הם מקרופאגים, תאי אנדותל וכו'. שימו לב, אלו הן אסטרטגיות לדוגמה, אך לא הדרך היחידה לנתח את הדגימות. הניתוח יוכתב על ידי הפאנל שנבחר וציטומטר הזרימה הזמין.
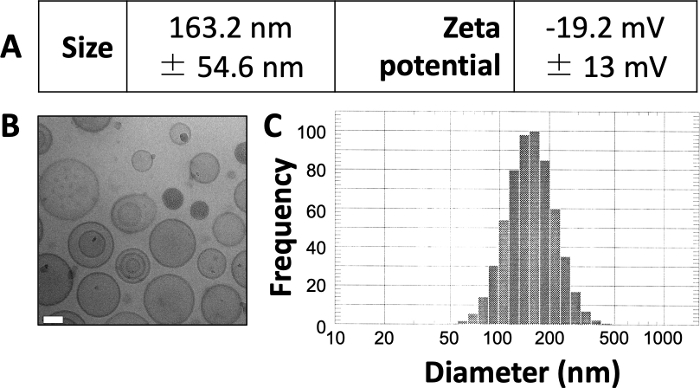
איור 1: מאפיינים לדוגמה של ליפוזומים מוכנים.
(א) הגודל ופוטנציאל הזטה נמדדו כמתואר לעיל ודווחו בצורת טבלה. כל פרמטר מוצג כממוצע ± סטיית התקן. (B) Cryo-EM שימש לדימוי הליפוזומים המוכנים. סרגל קנה המידה הלבן הוא באורך 50 ננומטר. (C) DLS שימש ליצירת היסטוגרמה של קוטר הליפוזומים בהכנה זו. איור זה נלקח מ Osinski et al.3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
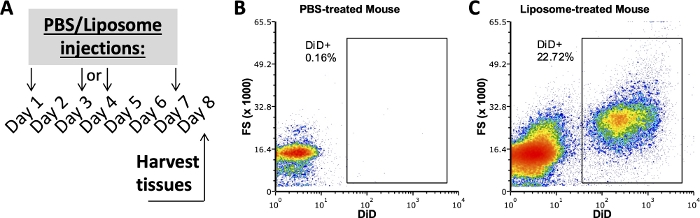
איור 2: צביעת DiD מייצגת מעכברים שטופלו ב-PBS או בליפוזום.
(A) סכמה ניסיונית עבור PBS וטיפולים ליפוזומים. PBS או ליפוזומים הוזרקו שלוש פעמים במהלך שבוע אחד. רקמות נקצרו ביום 8 של הטיפול. (ב, ג) חלקות זרימה מייצגות חושפות צביעת DiD חיובית בעכברים שטופלו בליפוזומים (C), אך לא בעכברים שטופלו ב-PBS (B). FSC, פיזור קדימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
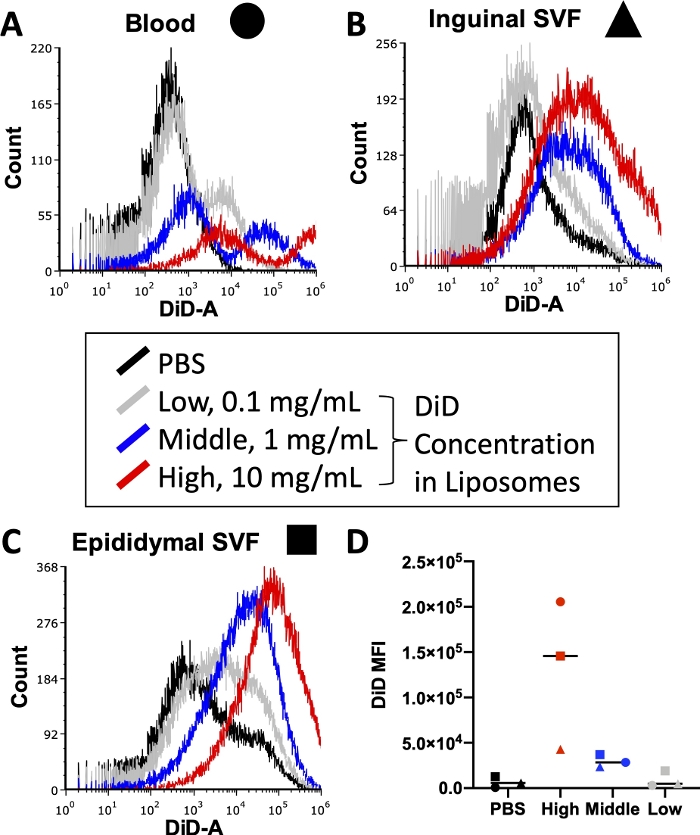
איור 3: טיטרציה של DiD בליפוזומים.
ליפוזומים הוכנו עם שלושה ריכוזים שונים של DiD והוזרקו לעכברים. אפור מציין את הריכוז הנמוך ב-0.1 מ"ג DiD לכל 1 מ"ל ליפוזומים, כחול מציין את הריכוז האמצעי ב-1 מ"ג DiD/mL ליפוזומים, ואדום מציין את הריכוז הגבוה ב-10 מ"ג DiD/mL ליפוזומים. עכבר שטופל ב-PBS שימש כבקרה שלילית (שחור). דם (A, עיגול), שומן מפשעתי (B, משולש) ושומן אפידידימלי (C, מרובע) נקצרו 24 שעות לאחר ההזרקה ועובדו כדי לבודד תרחיף חד-תאי. דגימות אלה הופעלו על ציטומטר זרימה לרמה של DiD לזיהוי. היסטוגרמות ספציפיות לרקמות עם שכבות-על של כל קבוצת טיפול מוצגות כדי להדגים את עוצמת הפלואורסצנטיות לריכוז (A\u2012C). הממוצע האריתמטי של DiD כומת גם עבור כל רקמה וריכוז ושורטט (D). SSC = פיזור צד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
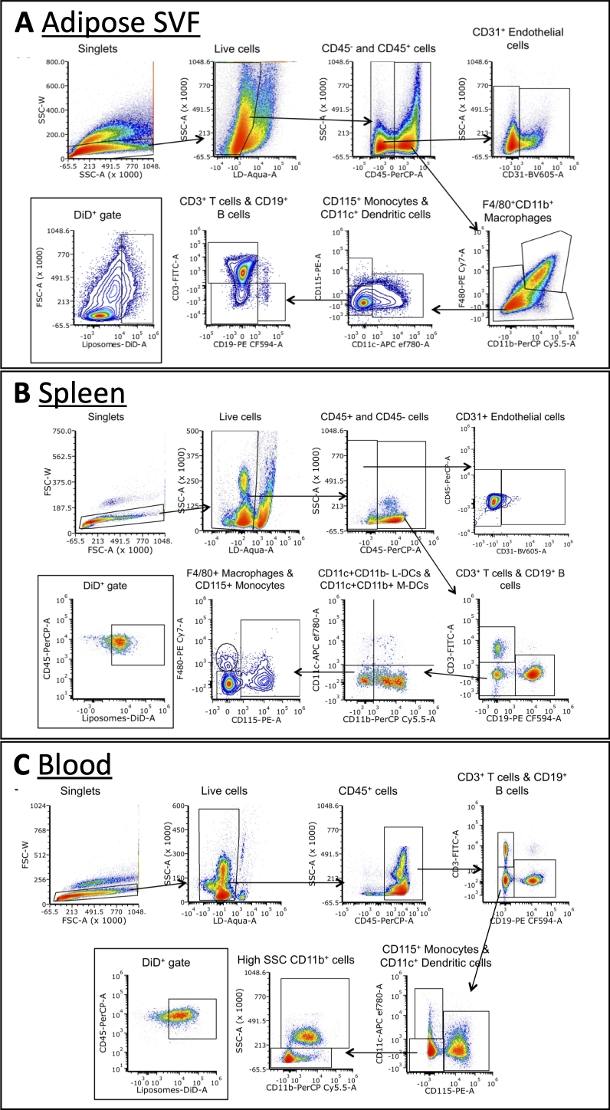
איור 4: ניתוח ציטומטריה של זרימה מייצגת של תת-קבוצות תאים בשומן SVF, דם וטחול.
(A\u2012C) נציג סכמטי של אסטרטגיית gating לזיהוי תת-קבוצות תאים ותאי DiD+ בשומן SVF (A), טחול (B) ודם (C). קיצורים: FSC = פיזור קדימה; LD = חי/מת; L-DCs = תאים דנדריטיים לימפואידים; M-DCs = תאים דנדריטיים מיאלואידים; SSC = פיזור צד. איור זה נלקח מ Osinski et al.3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| לשלוט | תכלית |
| עכבר שטופל ב-PBS או במי מלח | השתמש בתאים מעכבר זה עבור פקדי ציטומטריית הזרימה הבאים: |
| 1. תאים לא מוכתמים | |
| 2. כתם יחיד חי/מת | |
| 3. תאים מוכתמים בלוח המלא, אך חסרים את פלואורסצנטיות הליפוזום כדי לקבוע אות ליפוזומי חיובי במהלך הניתוח | |
| עכבר זה/עכבר זה / עכברים אלה ישמשו גם כדי לקבוע אם לליפוזומים יש השפעות כלשהן in vivo מכיוון שתהיה לך בקרה שאינה ליפוזומים בניסוי שלך. | |
| ליפוזומים פרוקים | אם אתם מעמיסים תרכובת בליפוזומים שלכם, חלק מאצווה הליפוזומים שלכם צריך להיות מסונתז ללא התרכובת. זה מסביר את כל ההשפעות in vivo של הליפוזומים בלבד. |
| DiD לבד | מאחר ש-DiD יכול להיקלט גם על ידי קרומי התא, הקצאת חלק מהעכברים לקבלת צבע חופשי בכמות השווה לזו המצויה בליפוזומים תעזור להסביר כל צביעת קרום רקע. |
| פקדי פלואורסצנטיות מינוס אחד (FMO) | אלה הם תאים מוכתמים עם כל הנוגדנים מלבד אחד בלוח שלך. כמו #3 בתיבה לעיל, זה מסייע בקביעת אות חיובי אמיתי עבור נוגדן זה במהלך הניתוח |
טבלה 1: פקדים לשימוש בפרוטוקול זה.
| תמיסה | רכיבים | אמצעי אחסון משוער הדרוש לכל אצווה/עכבר |
| הכנת ליפוזום | ||
| סידן אצטט | 1 M סידן אצטט ב H2O | 50 מ"ל |
| חיץ HEPES | 10 mM HEPES ב H2O, pH 7.4 | 50 מ"ל |
| Tesaglitazar ב HEPES | ב 10 mM HEPES | 10 מ"ל |
| קציר, עיבוד וצביעה של רקמות | ||
| תמיסה חוצצת פוספט (PBS) | 137 mM NaCl, 2.7 mM KCl, 10 mM Na 2 HPO 4, 1.8 mM KH 2 PO4 אינץ' מזוקק H 2O | 2 מ"ל |
| PBS-הפרין | 0.1 מ"מ הפרין ב PBS | 10 מ"ל |
| חיץ HEPES | 20 מ"מ HEPES ב PBS | 5 מ"ל |
| חיץ עיכול | 2 מ"ג/מ"ל Collagenase סוג I בחיץ HEPES | 5 מ"ל |
| חיץ ליזיס AKC | 0.158 מ' NH3 Cl, 10 mM KHCO3, 0.1 mM Na 2 EDTA in ddH 2 O, pH7.2 | 15 מ"ל |
| מאגר FACS | 1% BSA, 0.05% NaN3 ב-PBS | 15 מ"ל |
| בלוק Fc (מדולל) | 1:50 בלוק FC במאגר FACS | 250 מיקרוליטר |
| מאגר קיבוע | 2% פרפורמאלדהיד ב-PBS | 200 מיקרוליטר |
טבלה 2: פתרונות להכנה.
| A | B | C | D |
| צביעה חוץ-תאית (תערובת נוגדנים פי 2) | |||
| אנטיגן | פלואורופור | נפח Ab לבדיקת 100 μL | הנפח הכולל הדרוש: |
| CD45 | פרCP | 0.5 מיקרוליטר | עמודה C x 1.2 x סה"כ # דוגמאות |
| CD11b | PerCP Cy5.5 | 0.25 מיקרוליטר | (0.5 מיקרוליטר / בדיקה) x (1.2) x (# דגימות) |
| F4/80 | PE Cy7 | 0.25 מיקרוליטר | (0.25 מיקרוליטר / בדיקה) x (1.2) x (# דגימות) |
| CD19 | PE-CF594 | 1 μL | (0.25 מיקרוליטר / בדיקה) x (1.2) x (# דגימות) |
| CD3 | FITC | 1 μL | (1.0 μL / בדיקה) x (1.2) x (# דגימות) |
| CD31 | BV605 | 0.25 מיקרוליטר | וכו... |
| CD11c | APC ef780 | 1 μL | |
| CD115 | PE | 1.5 מיקרוליטר | |
| כדי ליצור את תמהיל הנוגדנים שלך, שלב את הנוגדנים המחושבים בעמודה D עם מאגר FACS או מאגר צביעה סגול מבריק* לנפח סופי של (50 μL x 1.2 x Total # samples) | |||
| כתמים חיים/מתים (1x) | |||
| חי/מת | פלואורופור | נפח L/D לבדיקת 200 uL | הנפח הכולל הדרוש: |
| חי/מת | אקווה | 0.67 מיקרוליטר | עמודה C x 1.2 x סה"כ # דוגמאות |
| צביעה תוך תאית (1x) | |||
| אנטיגן | פלואורופור | נפח Ab לבדיקת 50 μL | הנפח הכולל הדרוש: |
| αSMA | FITC | 0.125 | עמודה C x 1.2 x סה"כ # דוגמאות |
| *יש להשתמש ב-Brilliant Violet Staining Buffer אם משתמשים ביותר מנוגדן אחד המצומד לפלואורופור Brilliant Violet בפאנל. | |||
טבלה 3: לוח נוגדנים לדוגמה וחישובים של תערובות צביעה שישמשו לצביעת זרימה.
Discussion
כאן אנו מתארים פרוטוקול בן שלושה חלקים כדי (i) להכין ליפוזומים המסומנים בצבע שומנים פלואורסצנטי ועמוסים בתרכובת נגד סוכרת, tesaglitazar, (ii) לתת ליפוזומים לעכבר באמצעות הזרקה רטרו-מסלולית, ו-(iii) לקצור, לעבד ולהכתים רקמות כדי לזהות ספיגת ליפוזומים ברמה התאית על ידי ציטומטריית זרימה. פרוטוקול זה סוקר הכנה של ליפוזומים בגודל של כ-150 מיקרומטר והערכת ספיגה בשומן, בדם ובטחול. הכנת הליפוזום ניתנת להרחבה, מבוצעת בעיקר בטמפרטורת החדר, ומשתמשת באידוי בפאזה הפוכה כדי למקסם את העמסת התרופות וסילוקן של ממיסים אורגניים. באמצעות פרוטוקול זה, ניתן להשיג ריכוז של עד 2 מ"ג/מ"ל טסגליטזאר בדגימת הליפוזום המטוהר. ניתן לאחסן את הליפוזומים המוכנים במאגר HEPES בטמפרטורה של 4°C למשך למעלה משנה. מניסיוננו, הם הדגימו שונות מינימלית של גודל החלקיקים הממוצע. פחות מ-10% מאובדן תכולת התרופות הודגם באופן ספקטרופוטומטרי, לאחר הפרדת אולטרה-פילטרציה של ליפוזומים מתרופה חיצונית עם מסנן צנטריפוגלי של 10 kDa .
במהלך הכנת הליפוזומים, ישנם כמה שלבים וגורמים קריטיים שיש לקחת בחשבון. ראשית, סדר שלבי הפרוטוקול חשוב ויש להקפיד עליו. שנית, ה- pH של התמיסה המשמשת בעת טעינת tesaglitazar חייב להישמר על 7.4 על מנת למקסם מסיסות והעמסה יעילה. שלישית, הרכבה נכונה של ציוד ומסננים מבטיחה כי התפוקה של כל שלב היא בגודל וטוהר המתאימים. לדוגמה, אם מסננים של 100 ו-200 ננומטר אינם מורכבים כראוי, עלולה להיווצר אצווה הטרוגנית יותר ובגודל לא מתאים של ליפוזומים. רביעית, יש צורך בהסרה מלאה של Ca-אצטט לפני העמסת תרופות כדי למקסם את העברת הטסגליטזאר לליפוזומים. כדי לבדוק הסרה מלאה של Ca-אצטט, השתמש בשיקוע במהירות גבוהה כדי להסיר את הליפוזומים ולאחר מכן למדוד את רמות Ca-אצטט בתמיסה שאינה ליפוזומלית. חמישית, חשוב לשקול ולרשום את המסה של כל החומרים שנוספו להכנת הליפוזום בכל שלב. זה מבטיח שניתן לחשב ריכוזים נכונים ולשמור על יחסי החומרים הדרושים. לבסוף, אם הטכניקה אינה מבוצעת כראוי, עלולה להיות רמה לא רצויה של הטרוגניות. חשוב לבדוק היטב פרמטר זה באמצעות DLS וגישות אחרות כגון מיקרוסקופ אלקטרונים. כדי לשפר את ההומוגניות, שקול להתאים את גודל המסנן שנבחר או לערום שני מסננים.
בנוסף, קריטי שבקרות ולוח נוגדנים לציטומטריית זרימה יתוכננו ויעברו אופטימיזציה לפני ביצוע פרוטוקול זה במלואו (טבלה 1, טבלה 3). יש לבדוק נוגדנים כדי לוודא שריכוזים נאותים משמשים להכתמה ושהחפיפה בין הפלואורופורים היא מינימלית. העירור והפליטה של הצבע המשמש במהלך הכנת הליפוזומים חייבים להילקח בחשבון גם בתכנון הפאנל. בתוצאות שלנו, השתמשנו ב- DiD, שיש לו עירור ופליטה דומים לפלואורופורים כגון Allophycocyanin (APC) ו- AlexaFluor 647. לכן, לא בחרנו נוגדנים מצומדים לפלואורופורים אלה בלוח הנוגדנים שלנו. יתר על כן, בקרות איזוטיפ אינן כלולות בפרוטוקול זה. הסיבה לכך היא שהנוגדנים שנבחרו לפרוטוקול זה הם נוגדנים מאומתים היטב וזמינים מסחרית. עם זאת, אם מעוניינים להשתמש בנוגדן שלא עבר אופטימיזציה בעבר, אנא שקלו לבדוק את הנוגדן מול בקרת איזוטיפ על הרקמות המעניינות לפני ביצוע הניסוי המלא.
בעוד פרוטוקול זה מדגים כיצד לחלץ ולעבד את הדם, הטחול, השומן המפשעה ורקמות השומן האפידידימליות מהעכבר לאחר הטיפול, גישה כללית זו יכולה להיות מיושמת על רקמות אחרות. בהתאם לרקמה המעניינת, ייתכן שיהיה צורך לשנות את פרוטוקולי העיבוד והעיכול כפי שפורסם עבור הרקמות הבאות: ריאות 21, כבד22, חלל הצפק 3, מח עצם3,23, מוח 24.
מגבלה חשובה של שיטה זו שיש לקחת בחשבון היא שניתן להעריך ספיגה רק בנקודת זמן אחת לכל חיה. לכן, זה עשוי להיות יתרון לשלב פרוטוקול זה עם טכניקות הדמיה לא פולשניות אחרות או לתכנן בהתאם כדי להבטיח משאבים מספיקים לביצוע ההערכה. תזמון ספיגת התאים ותחלופת התאים הם גורמים חשובים שיש לקחת בחשבון: ליפוזומים יזרמו בכל הגוף ב-24 השעות הראשונות, ובהתאם לתוחלת החיים של התאים שקולטים ליפוזומים או לאופן שבו הם מגיבים לספיגה, מוות תאי או פגוציטוזה נוספת. המחקר הקודם שלנו הראה שינויים במאפייני האוכלוסייה של אוכלוסיות DiD+ בנקודות זמן שונות3. מסיבה זו, הערכת ספיגה בנקודות זמן מוקדמות יותר או בנקודות זמן הרלוונטיות ביותר לביולוגיה של מנגנון העניין היא חשובה. בנוסף, בעוד שניתן לבצע כימות של ספיגת תאים ברקמה כולה באמצעות פרוטוקול זה, ציטומטריית זרימה אינה יכולה לחשוף לוקליזציה של רקמות. שילוב גישה זו עם שיטות היסטולוגיות יכול לעזור להתמודד עם מגבלה זו.
באופן כללי, פרוטוקול זה משלים מתודולוגיה קיימת כגון היסטולוגיה והדמיית פלואורסצנטיות של כל הגוף. עם המשך ההתקדמות בכלים ובשיטות של ציטומטריית זרימה, יתאפשר פיתוח פאנלים גדולים יותר ליותר ויותר אוכלוסיות תאים ספציפיות. אנו מציעים להשתמש בפרוטוקול זה בנוסף לשיטות הנ"ל מכיוון שזה ישפר את הערכת ספיגת התאים וגם יספק את ההזדמנות לאמת את התוצאות שנצפו על ידי ציטומטריית זרימה. לדוגמה, אם יימצא שרוב החלקיקים ברקמת השומן נקלטו על ידי מקרופאגים על ידי ציטומטריית זרימה. אימונופלואורסנציה של אליציטוט נוסף של אותה רקמת שומן יכולה להישמר, לתקן, לחתוך ולהכתים עבור סמני מקרופאגים כדי לוודא שסוג התא אכן תופס ליפוזומים. גישה זו צריכה להוסיף קפדנות למבחני ההפצה הביולוגית של ננו-חלקיקים שנערכו: אימות מיקוד ספציפי לתא, כימות ספיגה תאית, זיהוי ספיגה מחוץ למטרה, ובתקווה לספק מידע ליצירת השערות מכניסטיות לתוצאות טיפוליות נצפות. פרוטוקול זה יכול להיות מותאם גם למחקרים עתידיים באמצעות ליפוזומים שונים, חקירת ספיגה ברקמות אחרות, ובדיקת תרכובות חדשות בסביבה של השמנת יתר ומטבוליזם או כל מחלה אחרת שבה העברת ננו-חלקיקים היא אפשרות טיפולית אפשרית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים רוצים להודות למייקל סולגה ולשאר צוות Flow Cytometry Core על מתן הדרכה ושירותים של ציטומטריית זרימה. המחברים רוצים גם להודות לשיווה סאי קרישנה דסה, דסטין ק. באוקנייט, מליסה א. מרשל, ג'יימס ס. גרמיי, שאנטל מקסקימינג, אדיטי אופאדי ופראסד סריקקולאפו על עזרתם בהכנת ליפוזום (SSKD, DKB), קציר רקמות (MAM, JCG), צביעת ציטומטריה של זרימה ורכישת דגימות (AU, PS, CM). עבודה זו נתמכה על ידי מענקי AstraZeneca, R01HL 136098, R01HL 141123 ו-R01HL 148109, AHA 16PRE30770007 ו-T32 HL007284.
Materials
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
References
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved