Method Article
Vorbereitung, Verabreichung und Bewertung der in vivo gewebespezifischen zellulären Aufnahme von fluoreszierenden farbstoffmarkierten Liposomen
In diesem Artikel
Zusammenfassung
Das Ziel dieses Protokolls ist es, fluoreszenzmarkierte Liposomen zu synthetisieren und die Durchflusszytometrie zu verwenden, um die In-vivo-Lokalisation von Liposomen auf zellulärer Ebene zu identifizieren.
Zusammenfassung
Es besteht ein wachsendes Interesse an der Verwendung von Liposomen zur Verabreichung von Verbindungen in vivo, insbesondere für gezielte Behandlungsansätze. Abhängig von der Liposomenformulierung können Liposomen bevorzugt von verschiedenen Zelltypen im Körper aufgenommen werden. Dies kann die Wirksamkeit des therapeutischen Partikels beeinflussen, da das Fortschreiten verschiedener Krankheiten gewebe- und zelltypspezifisch ist. In diesem Protokoll stellen wir eine Methode zur Synthese und Fluoreszenzmarkierung von Liposomen unter Verwendung von DSPC, Cholesterin und PEG-2000 DSPE und dem Lipidfarbstoff DiD als Fluoreszenzmarkierung vor. Dieses Protokoll stellt auch einen Ansatz für die Abgabe von Liposomen in vivo und die Bewertung der zellspezifischen Aufnahme von Liposomen mittels Durchflusszytometrie vor. Dieser Ansatz kann verwendet werden, um die Zelltypen zu bestimmen, die Liposomen aufnehmen, und die Verteilung und den Anteil der Liposomenaufnahme über Zelltypen und Gewebe hinweg zu quantifizieren. Obwohl in diesem Protokoll nicht erwähnt, werden zusätzliche Assays wie Immunfluoreszenz und Einzelzell-Fluoreszenzbildgebung auf einem Zytometer alle Befunde oder Schlussfolgerungen verstärken, da sie die Beurteilung der intrazellulären Färbung ermöglichen. Möglicherweise müssen die Protokolle auch angepasst werden, je nachdem, welche(s) Gewebe(s) von Interesse sind.
Einleitung
Da das Interesse an der Entwicklung von Therapien mit Nanopartikeln wächst, müssen die Methoden zur Vorbereitung und Bewertung der Partikelverteilung und -aufnahme weiter vorangetrieben, erweitert und für die Forschungsgemeinschaft zugänglich gemacht werden 1,2. Dieses Protokoll wurde entwickelt, um die genauen Zelltypen zu bewerten, die Liposomen in vivo nach einer Behandlung mit DiD-markierten Liposomen aufnahmen, die mit Tesaglitazar, einem Peroxisom-Proliferator-aktivierten Rezeptor (PPAR)-α/γ-Agonistenbeladen waren 3,4. In diesen Studien konnten wir beurteilen, welche Zelltypen direkt von der liposomalen Tesaglitazar-Behandlung betroffen waren, die Wirksamkeit von Targeting-Einheiten und Hypothesen aufstellen, um die von uns beobachteten Behandlungsergebnisse zu erklären. Darüber hinaus deuten etablierte biologische Funktionen in einer Vielzahl von Zelltypen darauf hin, dass phagozytische Zellen wie Makrophagen, dendritische Zellen und leberspezifische Kupffer-Zellen den größten Teil der Liposomen einnehmen 5,6,7. Mit Hilfe dieses Protokolls konnten wir zeigen, dass auch nicht-klassische Fresszellen Liposomen 3,4 aufnehmen können.
Dieses Protokoll stellt eine optimierte Methode zur Solubilisierung von Tesaglitazar dar, die Herstellung von Liposomen durch Umkehrphasenverdampfung und die Verwendung von Calciumacetat als Lockstoff für die entfernte Wirkstoffbeladung. Die vorgestellten Methoden sind für viele Labore zugänglich und es fehlen schwer zu beschaffende Materialien und Schritte, die hohe Temperaturen erfordern. Das Protokoll erzeugt Liposomen in einer Größe, die für eine erhöhte Durchblutung in vivooptimal ist 8. Darüber hinaus wurden, wie von Su et al. zusammengefasst, bisher Methoden zur Bewertung der In-vivo-Liposomenverteilung und der Gewebeaufnahme untersucht und eingehend getestet9. Methoden der Positronen-Emissions-Tomographie (PET), der Magnetresonanztomographie (MRT) und der Fluoreszenz-Molekulartomographie (FMT) werden eingesetzt, um die gewebespezifische Bioverteilung und -aufnahme zuquantifizieren 9,10,11. Obwohl diese Methoden optimiert wurden, um die Detektion in vivo zu maximieren, fehlt ihnen immer noch die Fähigkeit, die Liposomenaufnahme in vivo mit zellulärer Auflösung zu quantifizieren. Das hier vorgestellte Protokoll zielt darauf ab, diesen Bedarf durch den Einsatz der Durchflusszytometrie zu erfüllen. Schließlich wurde für dieses Protokoll die zelluläre Aufnahme auf wenige Gewebe einschließlich Fettgewebe eingegrenzt. Es gibt eine wachsende Zahl von Literatur, die das Potenzial der Verwendung von Nanopartikeln zur Durchführung von Therapien im Zusammenhang mit Fettleibigkeit, Stoffwechselstörungen und Entzündungen untersucht 12,13,14,15,16,17. Daher hielten wir es für wichtig, ein Protokoll mit effektiven Methoden zur Verarbeitung und Analyse von Fettgewebe zu teilen – eines der Gewebe, das bei diesen Pathologien eine wichtige Rolle spielt.
Protokoll
Alle Schritte in diesem Protokoll sind vom Animal Care and Use Committee der University of Virginia genehmigt und folgen den Richtlinien des Animal Care and Use Committee.
HINWEIS: Es gibt einige wichtige Kontrollen, die für spätere Analyseschritte zu berücksichtigen sind, die in Tabelle 1 zusammengefasst sind und vor der Verabreichung von Liposomen berücksichtigt werden sollten.
1. Herstellung von fluoreszenzmarkierten Liposomen, beladen mit Calciumacetat und Tesaglitazar
- Kombinieren Sie DSPC (1,2-Distearoyl-sn-glycero-3-phosphocholin), Cholesterin, PEG-2000-DSPE und DiD. Kombinieren Sie dazu DSPC, Cholesterin und PEG-2000 DSPE in einem Massenverhältnis von 2:1:1. Fügen Sie DiD-Lipidfarbstoff in einer Konzentration von 1 mg DiD pro 1 ml Liposomen hinzu (molare Beziehung von 46:1 von DSPC:DiD).
HINWEIS: DiD ist eine akzeptierte Abkürzung für 1,1'-Dioctadecyl-3,3,3',3'tetramethylindocarbocyanin. Da es zwei Octadecyl-"Fettschwänze" von gleicher Länge wie das in dieser Formulierung verwendete DSPC aufweist, sollte es hauptsächlich in die Lipidmembran eingebaut werden. Lipidfarbstoffe wie DiO, DiD und DiI werden routinemäßig für dieLiposomenforschung verwendet 8 und gelten als nicht austauschbar18. - Verwenden Sie ein 20-ml-Szintillationsfläschchen für die Invert-Phase-Emulsion und die Liposomenpräparation. Mischen Sie in dieser Durchstechflasche eine 2:1-Ether-Chloroform-Lösung von Lipiden mit wässrigem Calciumacetat (Ca-Acetat, 1 M, pH 7,4). Das Verhältnis zwischen organischer und wässriger Phase sollte 4:1 betragen, z. B. 4 ml organische Phase und 1 ml wässrige Phase.
- Emulgieren Sie die Ether-Chloroform-Lösung von Lipiden durch Beschallung für 30 s bei Raumtemperatur. Betreiben Sie das Ultraschallgerät mit 20 kHz und 50 % Leistung und verwenden Sie einen 1/2 Zoll. Sonde.
Anmerkungen: Halten Sie die Spitze der Ultraschallsonde näher am Boden der Durchstechflasche, um Schaumbildung zu vermeiden. Berühren Sie das Glas während der Beschallung nicht mit der Sondenspitze, da es brechen kann. Zusätzlich muss dem Äther Chloroform als Co-Lösungsmittel zugesetzt werden: In Gegenwart von Cholesterin trennt sich eine reine Ätheremulsion schnell, was diesen Schritt des Verfahrens unmöglich macht. - Stellen Sie die Durchstechflasche mit der homogenisierten Wasser-in-Öl-Emulsion sofort auf einen Rotationsverdampfer mit einem speziellen Adapter, einem Manometermanometer und einem Druckregelventil. Der Verdampfer sollte an eine Vakuumleitung angeschlossen werden, um die organischen Lösungsmittel zu entfernen. Stellen Sie die Drehzahl auf 100 U/min und das Vakuum auf 0,5 atm ein und lassen Sie sie los, wenn die Emulsion übermäßig schäumt. Nachdem sich ein Gel gebildet hat und verschwindet, erhöhen Sie das Vakuum auf 0,9 atm.
Anmerkungen: Während der Entfernung flüchtiger organischer Phasen sollte das Vakuumniveau schrittweise eingestellt werden, um eine schnelle Schaumbildung zu vermeiden, da dies zu einem Inhaltsverlust aus der Durchstechflasche in den Körper des Rotationsverdampfers führen kann. Schließlich, wenn der Ether und das Chloroform teilweise verdampfen und das Volumenverhältnis zwischen wässriger und organischer Lösungsmittelphase nahe bei 1:1 liegt, bildet sich ein Gel. Die Verdunstung sollte so lange fortgesetzt werden, bis das Gel verschwunden ist und das verbleibende wässrige Medium wieder vollständig flüssig ist. Zusätzliches Mischen kann dazu beitragen, die Entfernung organischer Lösungsmittel zu beschleunigen. Dies kann erreicht werden, indem ein Polytetrafluorethylen-Rührstab in den Verdampfungskolben eingesetzt wird, um die Konvektion des viskosen Gels während der Rotationsverdampfung zu verbessern. - Filtern Sie die resultierenden Liposomen mit spurgeätzten Polycarbonatmembranen, um eine homogene Größenverteilung zu erreichen.
- Führen Sie die Filtration durch, indem Sie die wässrige Liposomendispersion mehrmals durch einen 200-nm-Poren-Polycarbonatfilter in einem Liposomenextruder mit zwei gasdichten Spritzen hin- und herführen.
HINWEIS: Kleinere Spritzen werden bevorzugt (z. B. 0,5 ml), da sie einen ausreichenden Druck für die Filtration gewährleisten. Bei einem hohen Cholesteringehalt in der Liposomenmembran ist eine hohe Temperatur nicht erforderlich, und der Eingriff kann bei Raumtemperatur durchgeführt werden. Es wird eine ungerade Anzahl von Filtrationen (z. B. 21) durchgeführt, so dass das resultierende Material von Anfang an auf der gegenüberliegenden Seite des Filters landet und bei Vorsterilisation die sterile Probe der filtrierten größenangepassten Liposomen gesammelt werden kann. Die Größe der resultierenden Liposomen liegt typischerweise nahe an der gewählten Filterporengröße. Es können zwei Filter (anstelle von einem) gestapelt werden, um eine Feineinstellung auf eine geringere Partikelgröße vorzunehmen. - Überprüfung der Größenverteilung mit dynamischer Laserlichtstreuung (DLS)3,4.
- Geben Sie 1 bis 3 ml Kochsalzlösung in eine 1 cm Küvette mit vier transparenten Seiten. Dazu 10 bis 20 μl Liposomen geben und vorsichtig mischen. Legen Sie die Probe in das Gerät und wählen Sie die folgenden Parameter für die Messung aus: Lösungsmittelviskosität, Brechungsindex, Brechungsindex der Lipide. Klicken Sie auf die Schaltfläche Start . Die Messungen dauern mehrere Minuten und bestehen aus 100 oder mehr Durchläufen.
- Führen Sie die Filtration durch, indem Sie die wässrige Liposomendispersion mehrmals durch einen 200-nm-Poren-Polycarbonatfilter in einem Liposomenextruder mit zwei gasdichten Spritzen hin- und herführen.
- Entfernen Sie externes Ca-Acetat mit einer Entsalzungs-Spin-Säule. Zur Hälfte der Charge wässriges Tesaglitazar in 10 mM HEPES-Puffer (pH 7,4) geben und 1 h bei 37 °C inkubieren. Verwenden Sie die zweite Hälfte der Charge als medikamentenfreie Liposomenformulierung zur Kontrolle.
Anmerkungen: Die 2-ml-Entsalzungs-Spin-Säule vor der Verwendung mit 10 mM HEPES-Puffer, pH 7,4, voräquilibrieren. Geben Sie dazu 1 ml HEPES-Puffer in die Säule und schleudern Sie sie in einer Zentrifuge bei 1000 x g für 2 min. Entfernen Sie den Pass-Through-Puffer und wiederholen Sie diesen Vorgang viermal. - Entfernen Sie nicht eingeschlossenes Tesaglitazar mit einer 2-ml-Spin-Säule aus Liposomen und bestimmen Sie die Konzentration des eingeschlossenen Wirkstoffs spektrophotometrisch.
- Geben Sie nicht mehr als 0,5 ml Liposomenprobe in das trockene Säulengelbett und warten Sie, bis die gesamte Probe in das Gel gelangt ist. Zentrifugieren Sie unter genau den gleichen Bedingungen wie zuvor (1000 x g, 2 min) und sammeln Sie die Liposomenprobe im Durchlauf, gereinigt von Verbindungen mit kleiner Molekularmasse.
- Quantifizieren Sie die endgültigen Partikelmerkmale: Partikelgröße und -konzentration unter Verwendung von DLS und Zetapotenzial mit einem kombinierten DLS-elektrophorektischen Lichtstreuungssystem(ELS) 3,4 in 10 mM HEPES-Puffer pH 7,4 und bei 25 °C.
- Ähnlich wie in Schritt 1.5.2 wird die Liposomendispersion im Messpuffer (z. B. 10 μl Liposomen pro 1 ml Pufferlösung) mit einer Einweg-Luer-Spritze oder einer Pipette mit abgeschnittener Spitze in eine U-förmige Küvette verdünnt. Stellen Sie sicher, dass sich keine Blasen im "U" befinden, damit eine ununterbrochene Lösung für den elektrischen Stromfluss vorhanden ist.
- Setzen Sie die Küvette in das Gerät ein (bitte achten Sie auf die Vorder- und Rückseite der Küvette, damit die Elektroden richtig mit dem Gerät verbunden sind). Schließen Sie die Instrumentenklappe. Danach erfolgt die Messung (mit mehreren Wiederholungen) unter Kontrolle der Guidance-Software.
2. Liposomen für die In-vivo-Verabreichung vorbereiten
- In einer Biosicherheitswerkbank werden Liposomen in steriler Kochsalzlösung auf die entsprechende Konzentration in einem Endvolumen von 50 μl für die In-vivo-Verabreichung verdünnt.
HINWEIS: In früheren Studien enthielt unser Liposomenpräparat 2 mg/ml Tesaglitazar, was etwa 4,89 μmol Tesaglitazar/ml entspricht, und wir verabreichten Liposomen in einer Dosis von 1 μmol Medikament/kg. Für eine 40-g-Maus würden wir 8,2 μl Liposomen auf ein Endvolumen von 50 μl in Kochsalzlösung bringen. Unter Verwendung von DLS/ELS sollte die Anzahl der Liposomen pro Volumeneinheit auch für Zubereitungen von medikamenten- und vehikelbeladenen Liposomen quantifiziert werden, um sicherzustellen, dass im Vergleich zu den mit Medikamenten beladenen Liposomen die gleiche Anzahl von Vehikelliposomen pro Gramm Mausgewicht verabreicht wird. - Laden Sie die Liposomenlösung in eine 27-G-Nadel in der Biosicherheitswerkbank. Bewahren Sie dies bei Raumtemperatur auf, um zu vermeiden, dass kalte Lösung in die Maus injiziert wird.
3. Verabreichung von Liposomen durch retroorbitale intravenöse Injektion
Anmerkungen: Es ist auch angebracht, die intravenöse Injektion mit anderen Methoden durchzuführen, z. B. mit Schwanzveneninjektionen, wenn dies bevorzugt wird. Obwohl in diesem Protokoll nicht behandelt, sind veröffentlichte Protokolle, die diese Methode19 erläutern, verfügbar.
- Richten Sie den Arbeitsbereich für die Verabreichung von Liposomen ein.
- Reinigen Sie die Werkbank mit 70% Ethanol. Stellen Sie sicher, dass Sie einen Raum auswählen, der die Verwendung eines Isofluran-Anästhesiesystems zulässt.
- Schalten Sie ein Wärmekissen ein und legen Sie ein sauberes Pad oder Handtuch darüber, um die Maus auf einer sauberen Oberfläche zu halten. Lassen Sie dem Pad genügend Zeit, um sich aufzuwärmen, bevor Sie mit der Arbeit mit Mäusen beginnen.
- Stellen Sie das Anästhesiesystem so ein, dass sich die Kammer in der Nähe befindet und sich der Nasenkegel auf dem Wärmekissen befindet.
- Stellen Sie sicher, dass alle anderen Aspekte des Systems bereit sind (z. B. ist der Isoflurangehalt im Verdampfer hoch genug, der Aktivkohlefilter wurde gewogen, der Schlauch ist richtig angeschlossen).
- Sammeln Sie die anderen Materialien, die für diesen Abschnitt des Protokolls benötigt werden: ophthalmologisches Gleitgel, ein Lokalanästhetikum für die Behandlung nach der Verabreichung, sterile Mullbinden.
- Sedieren Sie die Maus mit Isofluran in der Induktionskammer. Sobald sie nicht mehr auf ein leichtes Fußklopfen reagiert, bringen Sie die Maus schnell an den Arbeitsplatz, während Sie die Sedierung durch einen Nasenkegel aufrechterhalten.
HINWEIS: Das Tier sollte bei 1,5 % bis 2,5 % Isofluran gehalten und auf eine angemessene Anästhesietiefe (durch mangelndes Ansprechen auf das Einklemmen der Zehen) beurteilt werden, bevor mit dem Eingriff fortgefahren wird. - Schieben Sie die Maus zur Seite, um Liposomen zu verabreichen. Da die Maus während der Betäubung nicht blinzelt, tragen Sie eine kleine Menge Augenschmiermittel auf beide Augen auf, um sie für den Rest des Eingriffs mit Feuchtigkeit zu versorgen.
- Drücken Sie sanft auf die Haut oberhalb und unterhalb des freiliegenden Auges. Das Auge sollte sich über die Gesichtsebene heben.
- Führen Sie die Nadelspitze vorsichtig an der medialen Kanthus ein und achten Sie darauf, dass sich die Nadel unter dem Auge befindet und es nicht berührt. Sobald die Nadel unterhalb des Auges eingeführt ist, injizieren Sie die Liposomen langsam in den Retroorbitalraum. Nach dem Herausziehen der Nadel kann es notwendig sein, die Augenlider für einige Sekunden zu schließen, um eine Blutstillung zu erreichen.
- Wenn die Nadel nicht weit genug eingeführt wird, kann die Lösung um das Auge herum austreten. Hören Sie sofort auf zu injizieren, wenn dies sichtbar ist, und positionieren Sie die Nadel neu.
- Tragen Sie ein Lokalanästhetikum wie Proparacain auf das Auge auf, um Schmerzen und Beschwerden nach dem Eingriff zu vermeiden.
- Halten Sie die Maus auf einem Wärmekissen und überwachen Sie, bis sie aufwacht, um sicherzustellen, dass es ihr gut geht und die richtige Körpertemperatur beibehalten wird.
- Bringen Sie die Maus in ihren Käfig und ihre normale Wohnumgebung zurück, bis der gewünschte Zeitpunkt erreicht ist.
HINWEIS: Dies sollte in Übereinstimmung mit den lokalen IACUC-Richtlinien erfolgen.
4. Bereiten Sie Materialien für die Gewebeentnahme, die Gewebeverarbeitung und die Durchflusszytometrie-Färbung vor
- Bereiten Sie Lösungen für die Ernte, Verarbeitung und Färbung vor (Abschnitte 5\u20127): phosphatgepufferte Kochsalzlösung (PBS)-Heparin, HEPES-Puffer, 2 mg/ml Kollagenase Typ I, AKC-Lysepuffer, FACS-Puffer, PBS, Fixierungspuffer (Tabelle 2). Bewahren Sie alle Lösungen außer dem Fixierpuffer während des Eingriffs bei 4 °C oder auf Eis auf.
- Bereiten Sie Röhrchen mit Puffern und anderen Materialien für die Entnahme und Verarbeitung von Geweben vor.
- Für das Blut jeder Maus geben Sie 10 μl 0,5 M EDTA in ein 1,5- oder 1,7-ml-Mikrozentrifugenröhrchen zur Blutentnahme. Das EDTA verhindert die Blutgerinnung. Eine 1-ml-Spritze mit einer 25-g-Nadel und ein konisches 15-ml-Röhrchen werden ebenfalls benötigt.
- Für die Milz entnehmen Sie ein 1,5- oder 1,7-ml-Mikrozentrifugenröhrchen mit 1 ml HEPES-Puffer, eine 1-ml-Spritze, zwei konische 50-ml-Röhrchen und zwei 70-μm-Filter pro Milz.
- Entnehmen Sie für jedes Fettgewebedepot eine 20-ml-Durchstechflasche aus Polyethylen mit 1,5 ml HEPES-Puffer zum Zerkleinern des Gewebes, ein konisches 50-ml-Röhrchen und einen 70-μm-Filter pro Fettgewebetyp und Maus.
- Bereiten Sie den Arbeitsbereich für die Ernte vor.
- Reinigen Sie den Platz auf der Werkbank mit 70% Ethanol. Bereiten Sie eine Gummischale vor, um die Maus während der Ernte festzunageln, indem Sie sie mit 70% Ethanol reinigen und mit einem saugfähigen Pad oder Papiertüchern abdecken. Stellen Sie sicher, dass mindestens 5 Pins zum Arbeiten zur Verfügung stehen.
- Füllen Sie eine 10-ml-Spritze mit PBS-Heparin und befestigen Sie sie zur Perfusion auf einer 25-g-Nadel.
- Sammle Werkzeuge und Materialien, die du während der Ernte verwenden kannst. Es werden eine Pinzette (zwei Paar), eine Schere, Papiertücher, fusselfreie Tücher, die Mikrozentrifugenröhrchen mit EDTA, die Mikrozentrifugenröhrchen mit HEPES-Puffer und die Polyethylen-Fläschchen mit HEPES-Puffer benötigt.
5. Ernten Sie die Taschentücher
- Euthanasieren Sie die Maus durch CO2 - Erstickung. Führen Sie keine Zervixluxation durch, da dies eine effektive Blutentnahme und Gewebedurchblutung bei späteren Schritten verhindern kann.
- Stellen Sie an einem gereinigten Tisch mit genügend Arbeitsfläche und Beleuchtung auf, um die Maus gut sehen zu können, und stellen Sie eine Sezierschale aus Gummi, einen Eimer mit Eis zur Aufbewahrung von Proben und eine Sprühflasche mit 70 % Ethanol auf. Besprühen Sie die Maus mit 70 % Ethanol, um die Kontamination zu reduzieren und die Haarausbreitung zu kontrollieren. Legen Sie die Maus auf den Rücken auf die Gummischale und halten Sie ihre Pfoten vom Körper weg gespreizt fest.
- Um sich auf die Blutentnahme vorzubereiten, machen Sie vorsichtig einen Schnitt in die Haut am Rand des kaudalen Endes des Brustkorbs der Maus. Schneiden Sie eine kleine, gerade Linie nach oben zum Kopf der Maus (ca. 1 cm), bis die Brustmuskeln freiliegen.
- Machen Sie an der ersten Einschnittstelle zwei kleine Schnitte senkrecht zur Linie zum Kopf. Schneiden Sie dann den Brustmuskel auf einer Seite des Brustkorbs an der exponierten Stelle vorsichtig weg. Dies ermöglicht einen besseren Zugang und eine bessere Visualisierung der Stelle, an der die Nadel eingeführt werden soll.
- Um Blut zu sammeln, führen Sie die Nadel zwischen der dritten und vierten Rippe auf der Seite ein, auf der der Muskel entfernt wurde. Da sich das Herz der Maus in der Mitte der Brusthöhle befindet, halten Sie die Nadel so nah wie möglich an der Mittellinie des Brustkorbs. Ziehen Sie die Spritze nach dem Einsetzen vorsichtig nach oben, um mit der Blutentnahme zu beginnen.
- Nach der Entnahme wird das Blut in das vorbereitete Mikrozentrifugenröhrchen mit EDTA überführt und auf Eis gelagert.
HINWEIS: Wenn etwa 100 μl Volumen entnommen werden und kein Blut in die Spritze eindringt, versuchen Sie, die Spritze nach rechts oder links zu drehen, falls die Nadelöffnung gegen die Wand des Herzens gedrückt wird. Wenn dies nicht hilft, führen Sie die Nadel langsam weiter in die Brusthöhle ein oder beginnen Sie mit der Entfernung. Wenn sich an dieser Stelle Blut in der Spritze zu sammeln beginnt, ziehen Sie die Spritze langsam zurück. Erwägen Sie, die Spritze und die Nadel für eine erfolgreiche Extraktion zu drehen. Wenn kein Blut entnommen wird, entfernen Sie die Nadel, da sie möglicherweise das Herz verfehlt hat. Versuchen Sie, die Nadel erneut einzuführen und wiederholen Sie den oben genannten Vorgang erneut.
- Um die Maus zu durchbluten, öffnen Sie als Nächstes die Brusthöhle, um Zugang zum Herzen zu erhalten.
- Schneiden Sie dazu die Haut entlang des Endes des Brustkorbs auf jeder Seite bis zur Seite der Maus ab. Verwenden Sie dann die Pinzette, um das Brustbein von der Arbeitsfläche fernzuhalten. Machen Sie einen kleinen, flachen Schnitt direkt unter dem Ende des Brustbeins, um die Bauchhöhle zu durchschneiden. Schneiden Sie entlang der Peritonealmembran entlang des Endes des Brustkorbs auf jeder Seite der Maus. Dadurch sollten Leber und Gallenblase freigelegt werden. Achten Sie darauf, nicht in eines dieser Gewebe zu schneiden.
- Als nächstes machst du einen kleinen, flachen Schnitt in das Zwerchfell, schädelig zur Leber. Schneiden Sie dann das Zwerchfell entlang der Kante des Brustkorbs, um die Brusthöhle zu öffnen. Achten Sie darauf, dass Sie keine Organe in der Brusthöhle durchtrennen.
- Machen Sie zwei Schnitte entlang des Brustkorbs in Richtung Kopf, etwa 2-3 mm von der Mittellinie der Maus entfernt und etwa 0,75 cm lang.
HINWEIS: Wenn die Arterien zu hoch aufgeschnitten werden, werden die Arterien oben am Brustkorb durchtrennt. Dies beeinträchtigt die Wirksamkeit der Perfusion. - Hebe das Mittelstück des Brustkorbs zurück, um die Brusthöhle freizulegen. Entfernen Sie jegliches Fett oder Gewebe, um Zugang zum Herzen zu erhalten.
- Machen Sie einen kleinen Schnitt in den rechten Vorhof des Mäuseherzens, um eine Öffnung zu schaffen, durch die das Blut herausgepresst werden kann.
- Führen Sie die Nadel mit einer 10-ml-Spritze PBS-Heparin in die linke Herzkammer der Maus ein.
- Beginnen Sie, PBS so langsam wie möglich sanft in das Herz zu drücken.
HINWEIS: Es sollte beobachtet werden, dass Blut aus den rechten Vorhöfen austritt und die Brusthöhle füllt. Achten Sie darauf, das Herz an seinem physiologischen Ort zu halten, um zu vermeiden, dass der Fluss von PBS-Heparin vom Herzen durch die Aorta gehemmt wird. - Sobald alle 10 ml PBS-Heparin durch die Maus perfundiert wurden, entsorgen Sie die Spritze und die Nadel und entfernen Sie überschüssiges Blut und PBS-Heparin aus der Brusthöhle mit Papiertüchern oder fusselfreien Tüchern.
- Um mit der Entnahme von Gewebe zu beginnen, schneiden Sie als Nächstes die Haut und die Peritonealmembran in Richtung des Mausschwanzes ab, um die Bauchhöhle zu öffnen.
- Ziehen Sie zunächst das Leistenfettgewebepolster von jeder Seite der Maus ab.
HINWEIS: Lesen Sie diesen Prozess sorgfältig durch: Achten Sie darauf, den Leistenlymphknoten aus jedem Depot zu entnehmen, um eine Verzerrung der zellulären Zusammensetzung des Fettgewebes in den Ergebnissen zu vermeiden.- Halten Sie mit einer zweiten Pinzette die Peritonealmembran mit einer Pinzette und den Hautrand auf dieser Seite mit der anderen Pinzette über die Membran. Ziehen Sie die Haut vorsichtig von der Peritonealmembran weg, um diese Schichten voneinander zu trennen. Achten Sie auf das Leistenfettgewebedepot entlang der Haut. Stecken Sie den äußeren Rand der Haut fest, um besser an das Fettdepot zu gelangen.
- Lokalisieren Sie vor der Entnahme den Leistenlymphknoten in der Mitte des Fettdepots und entfernen Sie ihn bei Bedarf mit Pinzette und Schere.
HINWEIS: Wenn möglich, suchen Sie die drei größeren Arterien, die von den äußeren Rändern des Depots zur Mitte verlaufen. Der Lymphknoten befindet sich an der Stelle, an der sich diese Arterien treffen. - Nachdem der Lymphknoten entfernt wurde, halten Sie mit der Pinzette vorsichtig das Ende des Fettdepots fest, das dem Nadelpunkt am nächsten liegt, und beginnen Sie, kleine Schnitte an der Bindehaut zwischen Fettgewebe und Haut zu machen. Heben Sie das Fettgewebe von der Haut ab, während Sie Schnitte machen, um einen besseren Zugang zur Membran zu erhalten und sicherzustellen, dass das gesamte Depot extrahiert wird.
- Legen Sie das Fettdepot in ein vorbereitetes Polyethylen-Fläschchen mit HEPES-Puffer auf Eis, um das Gewebe für den Rest der Ernte lebensfähig zu halten.
- Wiederholen Sie diesen Vorgang auf der anderen Seite der Maus, um beide Depots zu extrahieren. Depots können entweder zusammen oder getrennt verdaut und verarbeitet werden. Soll jedes Depot separat bearbeitet werden, müssen weitere Röhren vorbereitet werden.
- Als nächstes werden die Nebenhoden-Fettdepots aus dem kaudalen Ende der Peritonealhöhle entnommen. Ziehen Sie mit einer Pinzette vorsichtig das erste Nebenhoden-Fettdepot vom dorsalen Ende der Maus weg und lokalisieren Sie die Nebenhoden und den Samenleiter, die an diesem Depot befestigt sind.
HINWEIS: Es gibt zwei Nebenhoden-Fettdepots: eines, das an jedem Nebenhoden und Samenleiter befestigt ist.- Schneiden Sie vorsichtig zwischen dem Fettdepot und den Nebenhoden und Samenleitern, um das Fett von diesen anderen Geweben zu trennen. Legen Sie das Fettdepot in ein Polyethylen-Fläschchen mit HEPES-Puffer auf Eis, um das Gewebe für den Rest der Ernte lebensfähig zu halten.
- Zum Schluss wird die Milz entnommen, die sich links vom Magen in der Nähe des Zwerchfells befindet. Ziehen Sie den Bauch mit einer Pinzette sanft in die Mitte der Bauchhöhle, um die Milz freizulegen.
- Halte ein Ende der Milz sanft fest und ziehe es leicht vom Bauch weg. Durchtrennen Sie die Membran zwischen der Milz und dem angrenzenden Gewebe, bis sich das Organ ablöst. Die Milz in das vorbereitete Mikrozentrifugenröhrchen mit HEPES-Puffer geben und auf Eis lagern.
- Bevor Sie Taschentücher verarbeiten oder Taschentücher von der nächsten Maus ernten, entsorgen Sie den Kadaver und alle verschmutzten Papiertücher oder -pads. Wischen Sie auch Werkzeuge ab.
HINWEIS: Wenn es mehrere Mäuse gibt, wiederholen Sie diese Ernteschritte für jede Maus, bevor Sie mit dem nächsten Verarbeitungsschritt fortfahren. Wenn eine Kontrollmaus oder -mäuse enthalten sind, sollten Sie diese vor den mit Liposomen behandelten Mäusen ernten, um eine Kontamination zu vermeiden.
6. Gewebe verarbeiten
HINWEIS: Da das Fettgewebe eine lange Verdauungsinkubation hat, wird empfohlen, zuerst mit diesem Prozess zu beginnen und während der Verdauungsphase an der Verarbeitung von Blut und Milz zu arbeiten.
- Zerkleinern und verdauen Sie zuerst das Fettgewebe. Zerkleinern Sie mit einer oder zwei Scheren das Fettgewebe in jeder Durchstechflasche aus Polyethylen, bis das Gewebe in kleine Stücke von weniger als 0,5 mm Größe besteht. Dies ermöglicht eine effizientere Verdauung.
- Sobald die Taschentücher in allen Durchstechflaschen zerkleinert sind, fügen Sie jeder Durchstechflasche 1,5 ml 2 mg/ml Kollagenase-Puffer hinzu. Stellen Sie die Durchstechflaschen in einen Schüttelinkubator, der auf 37 °C und 150 U/min eingestellt ist. 30 bis 45 Minuten inkubieren.
Anmerkungen: Wenn das Fettgewebe besonders groß ist, sollten Sie weitere 0,5 ml bis 1,5 ml HEPES-Puffer und ein gleiches Volumen Kollagenase-Puffer in die Durchstechflasche(n) geben, um sicherzustellen, dass das Gewebe vollständig untergetaucht ist und genügend Enzym vorhanden ist. Die Endkonzentration von Kollagenase Typ I beim Aufschluss sollte unabhängig vom endgültigen Lösungsvolumen 1 mg/ml betragen. Wenn kein Schüttel-Inkubator zur Verfügung steht, können die Proben in ein auf 37 °C erhitztes Wasserbad gelegt werden. Schütteln Sie die Proben alle 5 Minuten vorsichtig, um den Aufschluss zu vermischen und zu resuspendieren. - Überprüfen Sie die Proben nach 30 Minuten. Verwenden Sie eine 1-ml-Pipette, um die Probe auf und ab zu pipentieren. Wenn die Gewebestücke immer noch zu groß sind, um ein einfaches Pipettieren zu ermöglichen, legen Sie die Proben für weitere 15 Minuten in den Inkubator.
- Sobald die Proben vollständig verdaut sind, pipetieren Sie die Probe weitere 10 Mal auf und ab, um sicherzustellen, dass eine Einzelzellsuspension hergestellt wurde.
Anmerkungen: (Optional) Überprüfen Sie die Proben nach 30 Minuten. Verwenden Sie eine 1-ml-Pipette, um die Probe auf und ab zu pipentieren. Wenn die Gewebestücke immer noch zu groß sind, um ein einfaches Pipettieren zu ermöglichen, legen Sie die Proben für weitere 15 Minuten in den Inkubator. - Pipettieren Sie die Zellsuspension durch einen 70 μm Filter in ein konisches 50 mL Röhrchen. Geben Sie 5 ml FACS-Puffer in die leere Aufschlussflasche, um die Durchstechflasche auszuwaschen. Übertragen Sie diesen Waschpuffer durch den Filter, um ihn in die Zellsuspension zu geben.
- Lagern Sie Proben auf Eis, während andere verarbeitet werden. Sobald alle Proben filtriert sind, schleudern Sie sie bei 400 x g und 4 °C für 5 Minuten.
- Entfernen Sie den Adipozytenüberstand durch Aspiration und entfernen Sie dann vorsichtig den Infraüberstand zwischen dem Adipozytenüberstand und dem Pellet durch Aspiration, um das Pellet der stromavaskulären Fraktion (SVF) zu verlassen.
- Resuspendieren Sie dieses Pellet in 1 ml FACS-Puffer und füllen Sie es in ein sauberes 1,5- oder 1,7-ml-Mikrozentrifugenröhrchen. Aliquot Zellen jetzt, wenn gewünscht oder erforderlich. Auf Eis aufbewahren, bis alle Proben für die Durchflusszytometrie-Färbung bereit sind.
HINWEIS: Wenn die verdauten Fettdepots groß waren, sollten Sie nur 50 % oder 25 % der Probe für die durchflusszytometrische Färbung und Analyse verwenden. Wenn Fluoreszenz-Minus-Eins-Kontrollen (FMO) oder zusätzliche Kontrollen für die Durchflusszytometrie-Analyse (Tabelle 1) benötigt werden, stellen Sie außerdem sicher, dass Sie zusätzliche Probe zur Verarbeitung in ein separates Röhrchen aliquotieren. FMOs werden verwendet, um zwischen negativem und positivem Signal für einen einzelnen Fluorophor-konjugierten Antikörper innerhalb des ansonsten vollständigen Panels zu unterscheiden, das im Experiment verwendet wird.
- Sobald die Taschentücher in allen Durchstechflaschen zerkleinert sind, fügen Sie jeder Durchstechflasche 1,5 ml 2 mg/ml Kollagenase-Puffer hinzu. Stellen Sie die Durchstechflaschen in einen Schüttelinkubator, der auf 37 °C und 150 U/min eingestellt ist. 30 bis 45 Minuten inkubieren.
- Zweitens: Verarbeiten Sie das Blut.
- Übertragen Sie 50 μl Blut in ein konisches 15-ml-Röhrchen.
- Geben Sie 1 ml AKC-Lysepuffer in jedes Röhrchen und pipetieren Sie auf und ab, um eine Einzelzellsuspension zu erhalten. Fügen Sie jedem Röhrchen weitere 4 ml AKC-Lysepuffer hinzu und inkubieren Sie es 5 bis 10 Minuten lang. Wenn ein Shaker oder Rotator zur Verfügung steht, verschließen Sie die Röhrchenkappen fest und legen Sie die Röhrchen auf eine dieser Kappen, um das Mischen zu verbessern.
- Fügen Sie 5 ml FACS-Puffer hinzu, um den Lyseprozess abzuschrecken, und schleudern Sie die Proben bei 400 x g, 4 °C für 5 min. Entfernen Sie den Überstand und überprüfen Sie das Pellet. Wenn es immer noch ziemlich rot ist, wiederholen Sie den Lysevorgang. Andernfalls resuspendieren Sie die Pellets in 1 ml FACS-Puffer und füllen Sie sie in ein sauberes 1,5- oder 1,7-ml-Mikrozentrifugenröhrchen. Auf Eis aufbewahren, bis alle Proben für die Durchflusszytometrie-Färbung bereit sind.
- Zum Schluss die Milz verarbeiten. Übertragen Sie die Milz über ein konisches 50-ml-Röhrchen auf einen 70-μm-Filter. Waschen Sie das Taschentuch mit 1 ml FACS-Puffer und zerdrücken Sie dann die Milz mit dem Kolbenende einer 1-ml-Spritze durch den Filter. Waschen Sie die Zellen während des gesamten Maischvorgangs mit mehr FACS-Puffer in das konische 50-ml-Röhrchen. Das Endvolumen im konischen Röhrchen sollte 10 ml betragen.
- Schleudern Sie die Zellen bei 300 x g bei 4 °C für 5 min. Entfernen Sie den Überstand und resuspendieren Sie ihn in 1 ml AKC-Lysepuffer. Fügen Sie weitere 4 ml AKC-Lysepuffer hinzu und inkubieren Sie sie 5 Minuten lang. Fügen Sie 5 ml FACS-Puffer hinzu, um den Lyseprozess abzuschrecken, und schleudern Sie die Proben bei 300 x g bei 4 °C für 5 min.
- Entfernen Sie den Überstand und resuspendieren Sie das Pellet in 1 ml FACS-Puffer. Übertragen Sie die Suspension durch einen zweiten, sauberen 70-μm-Filter in ein konisches 50-ml-Röhrchen. Fügen Sie 4 ml FACS-Puffer hinzu, um das Originalröhrchen auszuwaschen, und übertragen Sie den Puffer durch den Filter, um ein Endvolumen von 5 ml zu erhalten.
- Übertragen Sie 50 μl der Zellsuspension in ein sauberes 1,5- oder 1,7-ml-Mikrozentrifugenröhrchen und halten Sie es auf Eis, bis alle Proben für die Durchflusszytometrie-Färbung bereit sind. Zusätzliche Aliquots können auf Röhrchen übertragen werden, wenn mehr gewünscht oder benötigt werden.
HINWEIS: Splenozyten eignen sich hervorragend für eine lebende/tote Einzelfärbung. Erwägen Sie, ein zusätzliches Aliquot für dieses Steuerelement zu übertragen.
7. Färbung von Zellen aus Geweben für die Durchflusszytometrie
- Aliquotierte Proben bei 400 x g, 4 °C für 5 min abschleudern.
- Entfernen Sie den Überstand und resuspendieren Sie die Proben in 50 μl Fc-Block (verdünnt) (Tabelle 2). Auf Eis 5 Minuten inkubieren.
- Fügen Sie jeder Probe 50 μl 2x Antikörpermischung (Tabelle 3) hinzu. 20 Minuten auf Eis im Dunkeln inkubieren.
HINWEIS: Einzelne Färbungen sollten NICHT mit dieser Antikörpermischung gefärbt werden. Wenn FMOs verwendet werden sollen, müssen FMO-Antikörpermischungen separat hergestellt werden. - Waschen Sie die Proben mit 1 ml PBS und schleudern Sie sie bei 400 x g, 4 °C für 5 Minuten. Entfernen Sie den Überstand und resuspendieren Sie die Proben in 200 μl Viabilitätsfärbung (Tabelle 3). 20 Minuten auf Eis im Dunkeln inkubieren.
HINWEIS: Vergessen Sie nicht, Zellen, die für eine lebende/tote Einzelfärbung beiseite gelegt wurden, während dieses Schritts zu färben. - Waschen Sie die Proben mit 1 ml FACS-Puffer und schleudern Sie sie 5 Minuten lang bei 400 x g und 4 °C. Entfernen Sie den Überstand und resuspendieren Sie die Proben (mit Ausnahme von Lebenden/toten Einzelfärbungen) in 50 μl Fixiermedium (Reagenz A), um die Proben zu fixieren. Bei Raumtemperatur im Dunkeln 15 Minuten inkubieren.
- Resuspendieren Sie die lebende/tote Einzelfärbung in 100 μl 2% PFA. Bei Raumtemperatur im Dunkeln 5 min inkubieren.
- Die Probe wird mit 1 ml FACS-Puffer gewaschen und bei 800 x g, 4 °C 5 min lang geschleudert. Entfernen Sie den Überstand und resuspendieren Sie die Proben in 250 bis 500 μl FACS-Puffer. Bei 4 °C lagern, bis die Proben auf dem Durchflusszytometer verarbeitet werden können.
- Waschen Sie die Proben mit 1 ml FACS-Puffer und schleudern Sie sie bei 800 x g, 4 °C für 5 Minuten. Entfernen Sie den Überstand und resuspendieren Sie die Proben in 50 μl Permeabilisierungsmedium (Reagenz B) plus Antikörper gegen intrazelluläre Proteine. Bei Raumtemperatur im Dunkeln 20 Minuten inkubieren.
- Waschen Sie die Proben mit 1 ml FACS-Puffer und schleudern Sie sie bei 800 x g bei 4 °C für 5 min. Entfernen Sie den Überstand und resuspendieren Sie die Proben in 100 μl 2%igem Paraformaldehyd (PFA). Bei Raumtemperatur im Dunkeln 5 min inkubieren.
- Waschen Sie die Proben mit 1 ml FACS-Puffer und schleudern Sie sie bei 800 x g, 4 °C für 5 Minuten. Entfernen Sie den Überstand und resuspendieren Sie die Proben in 250 bis 500 μl FACS-Puffer. Bei 4 °C lagern, bis die Proben auf dem Durchflusszytometer verarbeitet werden können.
Ergebnisse
Herstellung von Liposomen
Die hier veröffentlichten Ergebnisse ähneln denen unserer zuvor veröffentlichten Arbeit 3,4,20. Unter Verwendung des hier vorgestellten Protokolls erwarten wir, Liposomen mit einer Größe von etwa 150 bis 160 nm herzustellen. DLS zeigt einen durchschnittlichen Liposomendurchmesser von 163,2 nm und ein Zetapotential von -19,2 mV (Abbildung 1A). Die kryogene Elektronenmikroskopie (Kryo-EM) zeigt zirkuläre Liposomen (Abbildung 1B) und das DLS-Diagramm zeigt eine relativ kleine Standardabweichung vom durchschnittlichen Durchmesser (Abbildung 1C).
Eine positive Liposomenbindung erfordert eine PBS-behandelte Kontrolle
Frühere Studien unserer Gruppe, die dieses Protokoll verwendeten, untersuchten, welche Zellsubpopulationen in Fett-SVF, Milz und Blut nach einer Woche In-vivo-Verabreichung an Liposomen gebundenwaren 3,4. Mit einer PBS-behandelten Maus wurden Peritonealhöhle und Milzzellen mit demselben Antikörperpanel gefärbt, das auch bei Proben von mit Liposomen behandelten Mäusen verwendet wurde. Das Gewebe wurde nach einer Woche Behandlung entnommen (Abbildung 2A). Die Proben der PBS-behandelten Maus dienten als DiD-FMO, mit dem positive DiD-Gates erzeugt werden konnten (Abbildung 2B,C). Ein positives Gate kann mit einem DiD-positiven Signal erzeugt werden, aber Proben ohne DiD-Signal müssen auch verwendet werden, um zu überprüfen, ob das positive Gate keine DiD-negativen Samples enthält.
Titrationen sind erforderlich, um Fluoreszenzsignale zu optimieren
Vor der Durchführung eines vollständigen Experiments müssen verschiedene Bedingungen optimiert werden, einschließlich der Konzentration von fluoreszenzkonjugierten Antikörpern, die während der Zellfärbung verwendet werden, und von Lipidfarbstoffen, die bei der Liposomenherstellung verwendet werden. Durchflusszytometer haben eine obere Nachweisgrenze für die Fluoreszenzintensität, so dass zu viel Farbstoff, der in die Liposomen eingearbeitet ist, zu nicht quantifizierbaren DiD-Signalen in Proben führt, die durch das Zytometer laufen. Darüber hinaus kann eine zu hohe Menge an DiD in den Liposomen zu einem hohen Maß an unspezifischem Farbstofftransfer führen, was die Ergebnisse der zellulären Aufnahme verzerren könnte. Abbildung 3 zeigt die Ergebnisse eines Experiments, bei dem die Konzentrationen von Lipidfarbstoff titriert wurden, um die Konzentration zu ermitteln, die ein optimales Signal innerhalb des Nachweisbereichs des verwendeten Durchflusszytometers erzeugen würde. Dies wurde an den Geweben durchgeführt, die für das abschließende Experiment von Interesse waren: Blut (Abbildung 3A), Leistenfett-SVF (Abbildung 3B) und Nebenhoden-Fett-SVF (Abbildung 3C). Die für den Test ausgewählten Konzentrationen betrugen 10 mg DiD (hoch, rot), 1 mg DiD (mittel, blau) oder 0,1 mg DiD (niedrig, grau) pro 1 ml Liposomen. Die höchste Konzentration, die in den Liposomen verwendet wurde, war zu hoch und übertraf in allen drei Geweben den quantifizierbaren Bereich des Zytometers (Abbildung 3A\u2012C, rot). Die niedrigste DiD-Konzentration zeigte ein gewisses Signal (Abbildung 3 A\u2012C, grau), aber eine deutliche Population außerhalb der PBS-behandelten Zellen (Abbildung 3A\u2012C, schwarz) wurde nicht beobachtet. Bei der Quantifizierung zeigte das arithmetische Mittel des DiD-MFI für jedes Gewebe und jede Konzentration eine klare Unterscheidung zwischen PBS-Kontrollen und der mittleren DiD-Konzentration (Abbildung 3D). Daher wählten wir, wie im Protokoll angegeben, die mittlere Konzentration (Abbildung 3, blau) für unsere Liposomenpräparation aus.
Die Verwendung eines Multi-Antikörper-Panels ermöglicht die Identifizierung der Liposomenaufnahme durch verschiedene Zellsubpopulationen
Unter Verwendung des in Tabelle 3 beschriebenen Panels wurden die Zellen mit Antikörpern gegen Marker für a-Makrophagen, B-Zellen, T-Zellen, dendritische Zellen, Monozyten und Endothelzellen gefärbt (Abbildung 4). Für jeden Gewebetyp sind leicht unterschiedliche Gating-Strategien erforderlich, aber in jedem können die meisten der gleichen Zelltypen identifiziert werden. Einige Ausnahmen sind Endothelzellen, die normalerweise nicht im Blut vorkommen, und Monozyten, die typischerweise häufiger im Blut vorkommen als andere Gewebe. Sobald die Populationen identifiziert sind, kann die Gesamtgröße jeder Zellpopulation und die Häufigkeit, mit der sie DiD+ sind, quantifiziert werden. Weitere Berechnungen können durchgeführt werden, um die DiD+-Population zu charakterisieren: Wie viel Prozent der DiD+-Zellen sind Makrophagen, Endothelzellen usw. Bitte beachten Sie, dass dies Beispiele für Gating-Strategien sind, aber nicht die einzige Möglichkeit, die Proben zu analysieren. Die Analyse wird durch das ausgewählte Panel und das/die verfügbare(n) Durchflusszytometer(n) bestimmt.
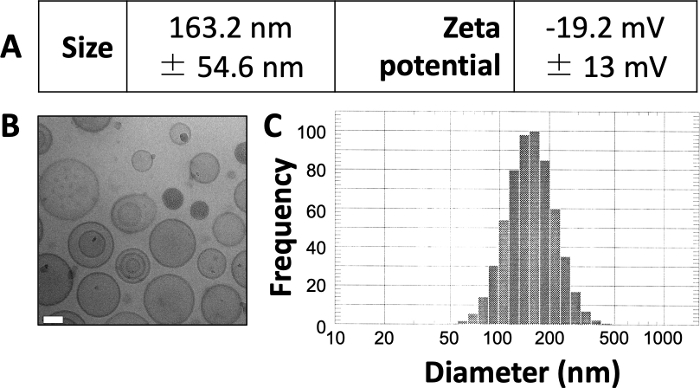
Abbildung 1: Beispielhafte Eigenschaften von präparierten Liposomen.
(A) Die Größe und das Zetapotenzial wurden wie oben beschrieben gemessen und in tabellarischer Form angegeben. Jeder Parameter wird als Mittelwert ± Standardabweichung dargestellt. (B) Kryo-EM wurde verwendet, um die präparierten Liposomen abzubilden. Der weiße Maßstabsbalken ist 50 nm lang. (C) DLS wurde verwendet, um ein Histogramm des Durchmessers der Liposomen in dieser Präparation zu erstellen. Diese Abbildung wurde von Osinski et al.3 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
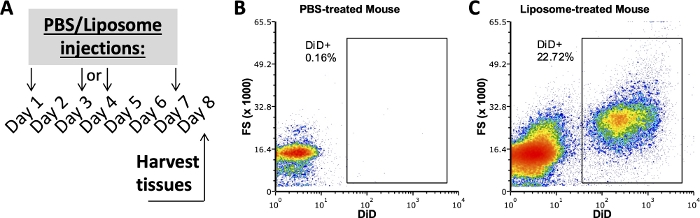
Abbildung 2: Repräsentative DiD-Färbung von PBS- oder Liposomen-behandelten Mäusen.
(A) Experimentelles Schema für PBS- und Liposomenbehandlungen. PBS oder Liposomen wurden innerhalb einer Woche dreimal injiziert. Das Gewebe wurde am 8. Tag der Behandlung entnommen. (B, C) Repräsentative Flussdiagramme zeigen eine positive DiD-Färbung bei mit Liposomen behandelten (C), aber nicht mit PBS behandelten (B) Mäusen. FSC, Vorwärtsstreuung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
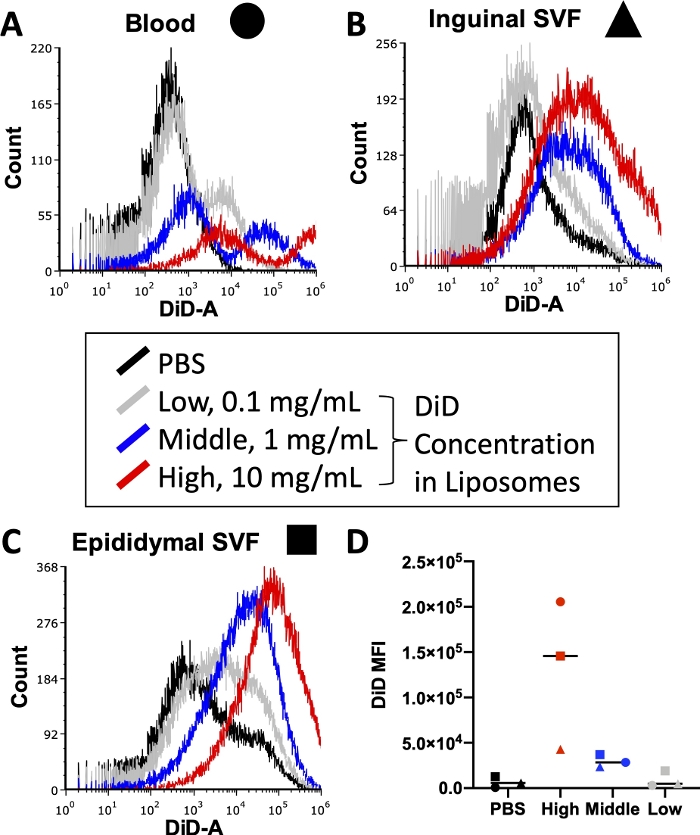
Abbildung 3: Titration von DiD in Liposomen.
Liposomen wurden mit drei verschiedenen DiD-Konzentrationen präpariert und Mäusen injiziert. Grau zeigt die niedrige Konzentration bei 0,1 mg DiD pro 1 ml Liposomen an, Blau zeigt die mittlere Konzentration bei 1 mg DiD/ml Liposomen an und Rot zeigt die hohe Konzentration bei 10 mg DiD/ml Liposomen an. Als Negativkontrolle wurde eine PBS-behandelte Maus verwendet (schwarz). Blut (A, Kreis), Leistenfett (B, Triange) und Nebenhodenfett (C, Quadrat) wurden 24 Stunden nach der Injektion entnommen und verarbeitet, um eine einzellige Suspension zu isolieren. Diese Proben wurden auf einem Durchflusszytometer auf das Niveau des nachweisbaren DiD gebracht. Gewebespezifische Histogramme mit Überlagerungen jeder Behandlungsgruppe werden präsentiert, um die Fluoreszenzintensität pro Konzentration (A\u2012C) zu demonstrieren. Das arithmetische Mittel von DiD wurde ebenfalls für jedes Gewebe und jede Konzentration quantifiziert und aufgetragen (D). SSC = seitliche Streuung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
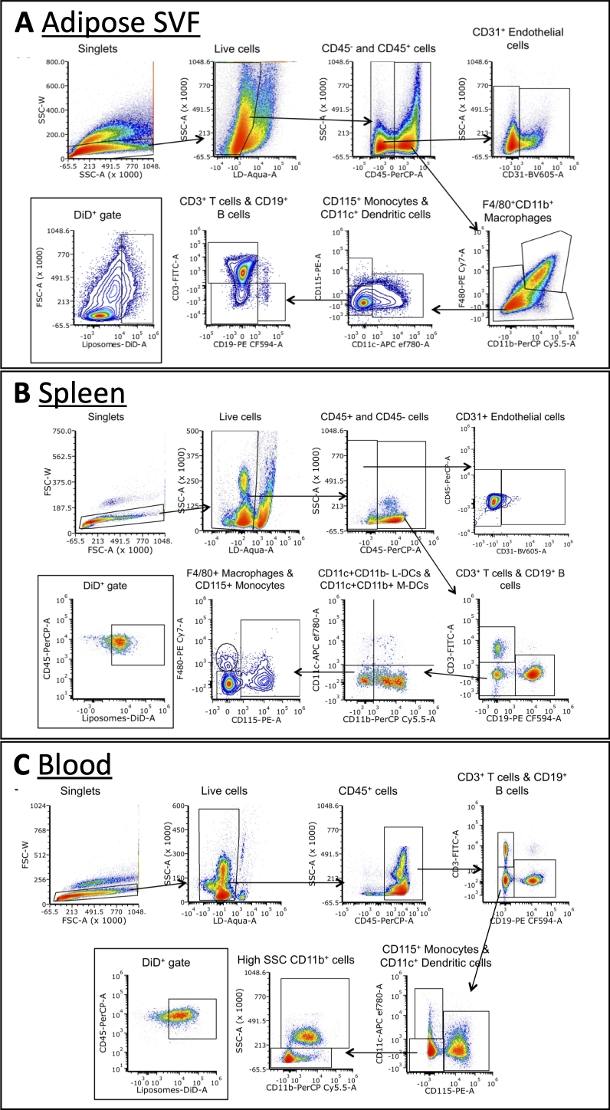
Abbildung 4: Repräsentative durchflusszytometrische Analyse von Zellsubpopulationen in adipöser SVF, Blut und Milz.
(A\u2012C) Schematische Darstellung der Gating-Strategie zur Identifizierung von Zelluntergruppen und DiD+- Zellen in adipösem SVF (A), Milz (B) und Blut (C). Abkürzungen: FSC = Vorwärtsstreuung; LD = lebend/tot; L-DCs = lymphatische dendritische Zellen; M-DCs = myeloische dendritische Zellen; SSC = seitliche Streuung. Diese Abbildung wurde von Osinski et al.3 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Steuerung | Zweck |
| Maus, die mit PBS oder Kochsalzlösung behandelt wurde | Verwenden Sie die Zellen dieser Maus für die folgenden Durchflusszytometrie-Kontrollen: |
| 1. Ungefärbte Zellen | |
| 2. Lebende/tote Einzelfärbung | |
| 3. Zellen, die mit dem vollständigen Panel gefärbt wurden, denen jedoch die Liposomenfluoreszenz fehlt, um ein positives Liposomensignal während der Analyse zu bestimmen | |
| Diese/diese Maus/Mäuse werden auch verwendet, um festzustellen, ob Liposomen in vivo irgendwelche Effekte haben, da Sie in Ihrem Experiment eine Nicht-Liposomenkontrolle haben. | |
| Entladene Liposomen | Wenn Sie eine Verbindung in Ihre Liposomen laden, sollte ein Teil Ihrer Liposomencharge ohne die Verbindung synthetisiert werden. Dies erklärt allein die In-vivo-Effekte der Liposomen. |
| DiD allein | Da DiD auch von zellulären Membranen aufgenommen werden kann, hilft die Zuweisung einiger Mäuse, um freien Farbstoff in einer Menge zu erhalten, die der in den Liposomen enthaltenen Menge entspricht, die Hintergrundfärbung der Membran zu berücksichtigen. |
| Fluoreszenz-Minus-Eins-Kontrollen (FMO) | Dabei handelt es sich um Zellen, die mit allen bis auf einen der Antikörper in Ihrem Panel gefärbt sind. Wie # 3 im obigen Kasten hilft dies bei der Bestimmung eines wirklich positiven Signals für diesen Antikörper während der Analyse |
Tabelle 1: Steuerelemente, die in diesem Protokoll verwendet werden sollen.
| Lösung | Komponenten | Ungefähres Volumen, das pro Stapel/Maus benötigt wird |
| Liposomen-Präparation | ||
| Calciumacetat | 1 M Calciumacetat inH2O | 50 ml |
| HEPES-Puffer | 10 mM HEPES in H2O, pH 7,4 | 50 ml |
| Tesaglitazar in HEPES | in 10 mM HEPES | 10 ml |
| Gewebeentnahme, -verarbeitung und -färbung | ||
| Phosphatgepufferte Lösung (PBS) | 137 mM NaCl, 2,7 mM KCl, 10 mM Na2HPO4, 1,8 mMKH2PO4in destilliertemH2O | 2 ml |
| PBS-Heparin | 0,1 mM Heparin in PBS | 10 ml |
| HEPES-Puffer | 20 mM HEPES in PBS | 5 mL |
| Aufschluss-Puffer | 2 mg/ml Kollagenase Typ I in HEPES-Puffer | 5 mL |
| AKC-Lysepuffer | 0,158 M NH3Cl, 10 mMKHCO3, 0,1 mMNa2EDTA in ddH 2 O, pH7,2 | 15 ml |
| FACS-Puffer | 1 % BSA, 0,05 % NaN3 in PBS | 15 ml |
| Fc-Block (verdünnt) | 1:50 Fc-Block im FACS-Puffer | 250 μL |
| Fixierungs-Puffer | 2% Paraformaldehyd in PBS | 200 μL |
Tabelle 2: Lösungen zur Vorbereitung.
| Ein | B | C | D |
| Extrazelluläre Färbung (2x Antikörper-Mix) | |||
| Antigen | Fluorophor | Ab-Volumen pro 100 μL Test | Benötigtes Gesamtvolumen: |
| CD45 | PerCP | 0,5 μL | Spalte C x 1,2 x Gesamt # Proben |
| CD11b | PerCP Cy5.5 | 0,25 μL | (0,5 μl/Test) x (1,2) x (# Proben) |
| F4/80 | PE Cy7 | 0,25 μL | (0,25 μL/Test) x (1,2) x (# Proben) |
| CD19 | PE-CF594 | 1 μL | (0,25 μL/Test) x (1,2) x (# Proben) |
| CD3 | FITC | 1 μL | (1,0 μL/Test) x (1,2) x (# Proben) |
| CD31 | BV605 | 0,25 μL | etc... |
| CD11c | APC ef780 | 1 μL | |
| CD115 | PE | 1,5 μL | |
| Um Ihre Antikörpermischung zu erstellen, kombinieren Sie die in Spalte D berechneten Antikörper mit FACS-Puffer oder Brilliant Violet Staining Buffer* zu einem Endvolumen von (50 μl x 1,2 x Gesamt # Proben) | |||
| Lebend-/Totfärbung (1x) | |||
| Lebend/tot | Fluorophor | L/D-Volumen pro 200 μL-Test | Benötigtes Gesamtvolumen: |
| Lebend/tot | Aqua | 0,67 μL | Spalte C x 1,2 x Gesamt # Proben |
| Intrazelluläre Färbung (1x) | |||
| Antigen | Fluorophor | Ab-Volumen pro 50 μl Test | Benötigtes Gesamtvolumen: |
| αSMA | FITC | 0.125 | Spalte C x 1,2 x Gesamt # Proben |
| *Brilliant Violet Färbepuffer sollte verwendet werden, wenn mehr als ein Antikörper, der mit einem Brilliant Violet Fluorophor konjugiert ist, in Ihrem Panel verwendet wird. | |||
Tabelle 3: Beispiel-Antikörper-Panel und Berechnungen von Färbemischungen, die für die Fließfärbung verwendet werden sollen.
Diskussion
Hier beschreiben wir ein dreiteiliges Protokoll zur (i) Herstellung von Liposomen, die mit einem fluoreszierenden Lipidfarbstoff markiert und mit einem Antidiabetikum, Tesaglitazar, beladen sind, (ii) Verabreichung von Liposomen an eine Maus durch retroorbitale Injektion und (iii) Ernte, Verarbeitung und Färbung von Geweben, um die Liposomenaufnahme auf zellulärer Ebene durch Durchflusszytometrie nachzuweisen. Dieses Protokoll überprüft die Herstellung von ca. 150-μm-Liposomen und die Beurteilung der Aufnahme in Fettgewebe, Blut und Milz. Die Liposomenpräparation ist skalierbar, wird meist bei Raumtemperatur durchgeführt und nutzt die Umkehrphasenverdampfung, um die Wirkstoffbeladung und die Entfernung organischer Lösungsmittel zu maximieren. Mit diesem Protokoll können bis zu 2 mg/ml Tesaglitazar-Konzentration in der gereinigten Liposomenprobe erreicht werden. Die hergestellten Liposomen können in HEPES-Puffer bei 4 °C über ein Jahr gelagert werden. Unserer Erfahrung nach zeigten sie eine minimale Variation der mittleren Partikelgröße. Weniger als 10 % des Verlusts des Wirkstoffgehalts wurden spektrophotometrisch nachgewiesen, nachdem die Ultrafiltration die Liposomen vom externen Arzneimittel mit einem 10 kDa Zentrifugalfilter getrennt hatte.
Bei der Herstellung von Liposomen sind einige wichtige Schritte und Faktoren zu berücksichtigen. Zunächst ist die Reihenfolge der Protokollschritte wichtig und muss eingehalten werden. Zweitens muss der pH-Wert der Lösung, die beim Laden von Tesaglitazar verwendet wird, bei 7,4 gehalten werden, um die Löslichkeit und effektive Beladung zu maximieren. Drittens stellt die ordnungsgemäße Montage von Geräten und Filtern sicher, dass die Leistung jedes Schritts die richtige Größe und Reinheit aufweist. Wenn beispielsweise 100- und 200-nm-Filter nicht richtig montiert werden, kann dies zu einer heterogeneren und falsch dimensionierten Charge von Liposomen führen. Viertens ist eine vollständige Entfernung von Ca-Acetat vor dem Beladen des Medikaments erforderlich, um den Transfer von Tesaglitazar in die Liposomen zu maximieren. Um die vollständige Entfernung von Ca-Acetat zu testen, verwenden Sie eine Hochgeschwindigkeitssedimentation, um die Liposomen zu entfernen, und messen Sie dann den Ca-Acetat-Gehalt in der nicht-liposomalen Lösung. Fünftens ist es wichtig, die Masse aller Materialien, die der Liposomenpräparation bei jedem Schritt zugesetzt werden, zu wiegen und aufzuzeichnen. Dadurch wird sichergestellt, dass die richtigen Konzentrationen berechnet werden können und die erforderlichen Materialverhältnisse eingehalten werden. Wenn die Technik nicht ordnungsgemäß ausgeführt wird, kann es zu einem unerwünschten Maß an Heterogenität kommen. Es ist wichtig, diesen Parameter mit DLS und anderen Ansätzen wie der Elektronenmikroskopie gründlich zu überprüfen. Um die Homogenität zu verbessern, sollten Sie die ausgewählte Filtergröße anpassen oder zwei Filter stapeln.
Darüber hinaus ist es von entscheidender Bedeutung, dass Kontrollen und ein Antikörperpanel für die Durchflusszytometrie geplant und optimiert werden, bevor dieses Protokoll vollständig durchgeführt wird (Tabelle 1, Tabelle 3). Antikörper sollten getestet werden, um sicherzustellen, dass die richtigen Konzentrationen für die Färbung verwendet werden und dass die Überlappung zwischen den Fluorophoren minimal ist. Auch die Anregung und Emission des bei der Liposomenpräparation verwendeten Farbstoffs muss bei der Plattenplanung berücksichtigt werden. In unseren Ergebnissen haben wir DiD verwendet, das eine ähnliche Anregung und Emission wie Fluorophore wie Allophycocyanin (APC) und AlexaFluor 647 aufweist. Daher haben wir in unserem Antikörper-Panel keine Antikörper ausgewählt, die an diese Fluorophore konjugiert sind. Darüber hinaus sind Isotypkontrollen in diesem Protokoll nicht enthalten. Dies liegt daran, dass es sich bei den für dieses Protokoll ausgewählten Antikörpern um gut validierte, kommerziell erhältliche Antikörper handelt. Wenn Sie jedoch daran interessiert sind, einen Antikörper zu verwenden, der zuvor nicht optimiert wurde, sollten Sie in Betracht ziehen, den Antikörper vor der Durchführung des vollständigen Experiments gegen eine Isotypkontrolle an den interessierenden Geweben zu testen.
Während dieses Protokoll zeigt, wie das Blut, die Milz, das Leistenfettgewebe und das Nebenhodenfettgewebe aus der Maus nach der Behandlung extrahiert und verarbeitet werden, kann dieser allgemeine Ansatz auf andere Gewebe angewendet werden. Abhängig vom interessierenden Gewebe müssen die Verarbeitungs- und Verdauungsprotokolle möglicherweise geändert werden, wie für die folgenden Gewebe veröffentlicht: Lunge21, Leber22, Peritonealhöhle 3, Knochenmark 3,23, Gehirn 24.
Eine wichtige Einschränkung dieser Methode besteht darin, dass die Aufnahme nur zu einem Zeitpunkt pro Tier bewertet werden kann. Daher kann es vorteilhaft sein, dieses Protokoll mit anderen nicht-invasiven bildgebenden Verfahren zu koppeln oder entsprechend zu planen, um ausreichende Ressourcen für die Durchführung der Beurteilung sicherzustellen. Der Zeitpunkt der Zellaufnahme und der Zellumsatz sind wichtige Faktoren, die es zu berücksichtigen gilt: Liposomen zirkulieren in den ersten 24 Stunden durch den Körper und je nach Lebensdauer der Zellen, die Liposomen aufnehmen, oder wie sie auf die Aufnahme reagieren, kann es zum Zelltod oder zu einer weiteren Phagozytose kommen. Unsere vorherige Studie zeigte Veränderungen in den Populationsmerkmalen von DiD+- Populationen zu verschiedenen Zeitpunkten3. Aus diesem Grund ist es wichtig, die Aufnahme zu früheren Zeitpunkten oder Zeitpunkten, die für die Biologie des interessierenden Mechanismus am relevantesten sind, zu bewerten. Während mit diesem Protokoll die Quantifizierung der Zellaufnahme im gesamten Gewebe durchgeführt werden kann, kann die Durchflusszytometrie keine Gewebelokalisation aufdecken. Die Kopplung dieses Ansatzes mit histologischen Methoden kann helfen, diese Einschränkung zu überwinden.
Im Allgemeinen ergänzt dieses Protokoll bestehende Methoden wie Histologie und Ganzkörperfluoreszenzbildgebung. Mit den kontinuierlichen Fortschritten bei den Instrumenten und Methoden der Durchflusszytometrie wird die Entwicklung größerer Panels für immer spezifischere Zellpopulationen möglich werden. Wir schlagen vor, dieses Protokoll zusätzlich zu den oben genannten Methoden zu verwenden, da dies die Bewertung der zellulären Aufnahme verbessert und auch die Möglichkeit bietet, die durch die Durchflusszytometrie beobachteten Ergebnisse zu validieren. Sollte sich beispielsweise herausstellen, dass ein Großteil der Partikel im Fettgewebe von Makrophagen durch Durchflusszytometrie aufgenommen wurde. Die Immunfluoreszenz eines zusätzlichen Aliquots desselben Fettgewebes konnte gespeichert, fixiert, geschnitten und für Makrophagenmarker gefärbt werden, um zu überprüfen, ob der Zelltyp tatsächlich Liposomen aufnimmt. Dieser Ansatz sollte die durchgeführten Assays zur Bioverteilung von Nanopartikeln präzisieren: Validierung des zellspezifischen Targetings, Quantifizierung der zellulären Aufnahme, Identifizierung der Off-Target-Aufnahme und hoffentlich Bereitstellung von Informationen zur Erstellung mechanistischer Hypothesen für beobachtete therapeutische Ergebnisse. Dieses Protokoll kann auch für zukünftige Studien mit verschiedenen Liposomen angepasst werden, um die Aufnahme in anderen Geweben zu untersuchen und neue Verbindungen im Zusammenhang mit Fettleibigkeit und Stoffwechselstörungen oder anderen Krankheiten zu testen, bei denen die Verabreichung von Nanopartikeln eine praktikable therapeutische Option ist.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren bedanken sich bei Michael Solga und dem Rest des Kernpersonals der Durchflusszytometrie für die Bereitstellung von Schulungen und Dienstleistungen im Bereich der Durchflusszytometrie. Die Autoren danken auch Shiva Sai Krishna Dasa, Dustin K. Bauknight, Melissa A. Marshall, James C. Garmey, Chantel McSkimming, Aditi Upadhye und Prasad Srikakulapu für ihre Unterstützung bei der Liposomenpräparation (SSKD, DKB), der Gewebeentnahme (MAM, JCG) und der Durchflusszytometrie-Färbung und Probengewinnung (AU, PS, CM). Diese Arbeit wurde durch Zuschüsse von AstraZeneca, R01HL 136098, R01HL 141123 und R01HL 148109, AHA 16PRE30770007 und T32 HL007284 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
Referenzen
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten