Method Article
Floresan Boya Etiketli Lipozomların İn Vivo Dokuya Özgü Hücresel Alımının Hazırlanması, Uygulanması ve Değerlendirilmesi
Bu Makalede
Özet
Bu protokolün amacı, floresan olarak etiketlenmiş lipozomları sentezlemek ve lipozomların hücresel düzeyde in vivo lokalizasyonunu tanımlamak için akış sitometrisini kullanmaktır.
Özet
Özellikle hedefli tedavi yaklaşımları için bileşikleri in vivo olarak vermek için lipozomların kullanılmasına artan bir ilgi vardır. Lipozom formülasyonuna bağlı olarak, lipozomlar tercihen vücuttaki farklı hücre tipleri tarafından alınabilir. Bu, terapötik parçacığın etkinliğini etkileyebilir, çünkü farklı hastalıkların ilerlemesi doku ve hücre tipine özgüdür. Bu protokolde, DSPC, kolesterol ve PEG-2000 DSPE ve lipit boya DiD'yi floresan etiket olarak kullanarak lipozomları sentezlemek ve floresan olarak etiketlemek için bir yöntem sunuyoruz. Bu protokol aynı zamanda in vivo lipozomlar vermek ve akış sitometrisi kullanarak lipozomların hücreye özgü alımını değerlendirmek için bir yaklaşım sunmaktadır. Bu yaklaşım, lipozomları alan hücre tiplerini belirlemek ve lipozom alımının hücre tipleri ve dokular arasındaki dağılımını ve oranını ölçmek için kullanılabilir. Bu protokolde belirtilmemiş olsa da, bir sitometre üzerinde immünofloresan ve tek hücreli floresan görüntüleme gibi ek testler, hücre içi boyamanın değerlendirilmesine izin verdikleri için yapılan bulguları veya sonuçları güçlendirecektir. Protokollerin, ilgilenilen doku (lar) a bağlı olarak da uyarlanması gerekebilir.
Giriş
Nanopartikül ilaç dağıtımını kullanan tedavilerin geliştirilmesine olan ilgi arttıkça, parçacık dağılımını ve alımını hazırlama ve değerlendirme yöntemleri ilerlemeye, genişlemeye ve araştırma topluluğu için erişilebilir olmaya devam etmelidir 1,2. Bu protokol, peroksizom proliferatör-aktive reseptör (PPAR)-α/γ agonisti 3,4 olan tesaglitazar yüklü DiD etiketli lipozomlarla yapılan bir tedaviyi takiben in vivo lipozomları alan kesin hücre tiplerini değerlendirmek için geliştirilmiştir. Bu çalışmalarda, lipozomal tesaglitazar tedavisinden hangi hücre tiplerinin doğrudan etkilendiğini, moieties hedeflemenin etkinliğini değerlendirebildik ve gözlemlediğimiz tedavi sonuçlarını açıklamak için hipotezler üretebildik. Ayrıca, çeşitli hücre tiplerinde yerleşik biyolojik fonksiyonlar, makrofajlar, dendritik hücreler ve karaciğere özgü Kupffer hücreleri gibi fagositik hücrelerin lipozomların çoğunu aldığını göstermektedir 5,6,7. Bu protokolü kullanarak, klasik olmayan fagositlerin de lipozomları alabileceğini gösterdik 3,4.
Bu protokol, tesaglitazarın çözünmesi, ters faz buharlaşması ile lipozomların hazırlanması ve uzaktan ilaç yüklemesi için bir çekici olarak kalsiyum asetat kullanılması için optimize edilmiş bir yöntem sunar. Sunulan yöntemler birçok laboratuvar tarafından erişilebilir durumdadır ve elde edilmesi zor malzemelerden ve yüksek sıcaklıklar gerektiren adımlardan yoksundur. Protokol, in vivo8'in artan dolaşımı için en uygun olan boyutlarda lipozomlar üretir. Ayrıca, Su ve ark. tarafından özetlendiği gibi, bugüne kadar, in vivo lipozom dağılımını ve doku alımını değerlendirmek için yöntemler derinlemesine çalışılmış ve test edilmiştir9. Pozitron emisyon tomografisi (PET), manyetik rezonans görüntüleme (MRG) ve floresan moleküler tomografi (FMT) yöntemleri dokuya özgü biyodağılımı ve alımı ölçmek içinuygulanmaktadır 9,10,11. Bu yöntemler in vivo tespiti en üst düzeye çıkarmak için optimize edilmiş olsa da, hala hücresel çözünürlükte in vivo lipozom alımını ölçme yeteneğinden yoksundurlar. Burada sunulan protokol, akış sitometrisi kullanarak bu ihtiyacı karşılamayı amaçlamaktadır. Son olarak, bu protokol için, hücresel alım, yağ dokusu da dahil olmak üzere birkaç dokuya daraltıldı. Obezite, dismetabolizma ve inflamasyon ortamında tedaviler sunmak için nanopartiküllerin kullanım potansiyelini araştıran büyüyen bir literatür grubu vardır 12,13,14,15,16,17. Bu nedenle, bu patolojilerde önemli bir rol oynayan dokulardan biri olan yağ dokusunu işlemek ve analiz etmek için etkili yöntemlerle bir protokolü paylaşmanın önemli olduğunu hissettik.
Protokol
Bu protokoldeki tüm adımlar, Virginia Üniversitesi Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır ve bunlara uymaktadır.
NOT: Tablo 1'de özetlenen ve lipozom uygulamasından önce göz önünde bulundurulması gereken daha sonraki analiz adımları için dikkate alınması gereken bazı önemli kontroller vardır.
1. Kalsiyum asetat ve tesaglitazar yüklü floresan etiketli lipozomların hazırlanması
- DSPC (1,2-distearoil-sn-glisero-3-fosfokolin), kolesterol, PEG-2000-DSPE ve DiD'yi birleştirin. Bunun için DSPC, kolesterol ve PEG-2000 DSPE'yi 2: 1: 1 kütle oranında birleştirin. 1 mL lipozom başına 1 mg DiD konsantrasyonunda DiD lipid boyası ekleyin (DSPC: DiD'nin 46: 1'inin molar oranı).
NOT: DiD, 1,1'-dioktadesil-3,3,3',3'tetrametilindokardosiyanin boyası için kabul edilen bir kısaltmadır. Bu formülasyonda kullanılan DSPC'ye eşit uzunlukta iki oktadesil "yağlı kuyruk" a sahip olduğundan, çoğunlukla lipit zarına dahil edilmelidir. DiO, DiD ve DiI gibi lipit boyaları lipozom araştırması için rutin olarak kullanılır8 ve değiştirilemez18 olarak kabul edilirler. - Ters faz emülsiyonu ve lipozom preparatı için 20 mL'lik bir sintilasyon şişesi kullanın. Bu şişede, 2: 1 eter-kloroform lipit çözeltisini sulu kalsiyum asetat (Ca-asetat, 1 M, pH 7.4) ile karıştırın. Organik ve sulu faz arasındaki oran 4: 1 olmalıdır, örneğin, 4 mL organik faz ve 1 mL sulu faz.
- Oda sıcaklığında 30 s boyunca sonikasyon ile lipitlerin eter-kloroform çözeltisini emülsifiye edin. Sonikatörünü 20 KHz ve% 50 güçte çalıştırın ve 1/2 inç kullanın. sonda.
NOT: Köpüklenmeyi önlemek için sonikatör probunun ucunu şişenin tabanına daha yakın tutun. Sonikasyon sırasında cama prob ucu ile dokunmayın, kırılabilir. Ek olarak, kloroformun etere bir ko-çözücü olarak eklenmesi gerekir: kolesterol varlığında, sadece eter emülsiyonu hızla ayrılır ve prosedürün bu adımını imkansız kılar. - Homojenize edilmiş yağda su emülsiyonlu şişeyi derhal özel bir adaptör, manometre göstergesi ve bir basınç regülatör valfi ile döner bir evaporatöre yerleştirin. Organik çözücüleri uzaklaştırmak için evaporatör bir vakum hattına bağlanmalıdır. Dönme hızını 100 rpm'ye ve vakumu 0,5 atm'ye ayarlayın ve emülsiyon köpüğü aşırı görünüyorsa serbest bırakın. Bir jel oluştuktan ve kaybolduktan sonra, vakumu 0.9 atm'ye yükseltin.
NOT: Uçucu organik faz giderimi sırasında, hızlı köpüklenmeyi önlemek için vakum seviyesi kademeli olarak ayarlanmalıdır, çünkü şişeden döner evaporatörün gövdesine içerik kaybına neden olabilir. Sonunda, eter ve kloroform kısmen buharlaştığında ve sulu ve organik çözücü fazı arasındaki hacim oranı 1: 1'e yakın olduğunda, bir jel oluşacaktır. Buharlaşma, jel kaybolana kadar devam etmeli ve kalan sulu ortam tekrar tamamen sıvı hale gelmelidir. Ek karıştırma, organik çözücünün uzaklaştırılmasını hızlandırmaya yardımcı olabilir. Bu, döner buharlaşma sırasında viskoz jelin konveksiyonunu arttırmak için evaporasyon şişesine bir politetrafloroetilen karıştırma çubuğu yerleştirilerek elde edilebilir. - Homojen boyut dağılımı elde etmek için iz kazınmış polikarbonat membranlar kullanarak elde edilen lipozomları filtreleyin.
- Lipozom sulu dispersiyonunu, iki gaz geçirmez şırıngayla donatılmış bir lipozom ekstrüderinde 200 nm gözenekli bir polikarbonat filtreden birkaç kez ileri geri geçirerek filtreleme gerçekleştirin.
NOT: Filtrasyon için yeterli basınç oluşturulmasını sağladıkları için daha küçük şırıngalar tercih edilir (örneğin, 0,5 mL). Lipozom zarında yüksek kolesterol içeriği ile yüksek bir sıcaklık gerekli değildir ve prosedür oda sıcaklığında gerçekleştirilebilir. Tek sayıda filtreleme (örneğin, 21) gerçekleştirilir, böylece elde edilen malzeme başlangıçtan itibaren filtrenin karşı tarafında sona erer ve önceden sterilize edilirse, filtrelenmiş boyut ayarlı lipozomların steril numunesi toplanabilir. Elde edilen lipozomların boyutu tipik olarak seçilen filtre gözenek boyutuna yakındır. Daha düşük parçacık boyutuna ince ayar yapmak için iki filtre (bir yerine) istiflenebilir. - Dinamik lazer ışık saçılımı (DLS) kullanarak boyut dağılımını doğrulayın3,4.
- Dört şeffaf tarafı olan 1 cm'lik bir küvete 1 ila 3 mL salin ekleyin. Buna 10\u201220 μL lipozom ekleyin ve dikkatlice karıştırın. Numuneyi cihaza yerleştirin ve ölçmek için aşağıdaki parametreleri seçin: çözücü viskozitesi, kırılma indisi, lipitlerin kırılma indisi. Başlat düğmesine tıklayın. Ölçümler birkaç dakika sürecek ve 100 veya daha fazla çalışmadan oluşacaktır.
- Lipozom sulu dispersiyonunu, iki gaz geçirmez şırıngayla donatılmış bir lipozom ekstrüderinde 200 nm gözenekli bir polikarbonat filtreden birkaç kez ileri geri geçirerek filtreleme gerçekleştirin.
- Harici Ca-asetatı tuzdan arındırıcı bir spin-kolon kullanarak çıkarın. Partinin yarısına, 10 mM HEPES tamponuna (pH 7.4) sulu tesaglitazar ekleyin ve 1 saat boyunca 37 ° C'de karıştırarak inkübe edin. Partinin ikinci yarısını ilaçsız bir kontrol lipozom formülasyonu olarak kullanın.
NOT: Kullanmadan önce 2-mL tuzdan arındırma spin kolonunu 10 mM HEPES tamponu, pH 7,4 ile önceden dengeleyin. Bunu yapmak için, kolona 1 mL HEPES tamponu yerleştirin ve 2 dakika boyunca 1000 x g'de bir santrifüjde döndürün. Doğrudan geçiş arabelleğini çıkarın ve bunu dört kez tekrarlayın. - Sıkışmamış tesaglitazarı 2 mL'lik bir spin sütunu kullanarak lipozomlardan çıkarın ve sıkışmış ilacın konsantrasyonunu spektrofotometrik olarak belirleyin.
- Kuru kolon jel yatağına 0,5 mL'den fazla lipozom numunesi eklemeyin ve tüm numune jele girene kadar bekleyin. Daha öncekiyle tam olarak aynı koşullarda (1000 x g, 2 dakika) santrifüj yapın ve lipozom örneğini küçük moleküler kütleli bileşiklerden saflaştırılmış geçişte toplayın.
- Nihai parçacık özelliklerini ölçün: DLS ve zeta potansiyelini kullanarak partikül boyutu ve konsantrasyonu, kombine DLS-elektroforektik ışık saçılması (ELS) sistemi ile 3,4 in 10 mM HEPES tampon pH 7,4 ve 25 °C'de.
- Adım 1.5.2'ye benzer şekilde, ölçüm tamponundaki lipozom dispersiyonunu (örneğin, 1 mL tampon çözeltisi başına 10 μL lipozom) tek kullanımlık bir Luer şırıngası veya kesilmiş uçlu bir pipet kullanarak U şeklinde bir küvete seyreltin. "U" da kabarcık olmadığından emin olun, böylece elektrik akımı akışı için kesintisiz bir çözüm olur.
- Küveti üniteye yerleştirin (lütfen küvetin önüne ve arkasına dikkat edin, böylece elektrotlar üniteye düzgün bir şekilde bağlanır). Cihaz kapağını kapatın; Bundan sonra, ölçüm rehberlik yazılımının kontrolü altında (çoklu tekrarlarla) gerçekleşir.
2. Lipozomları in vivo uygulama için hazırlayın
- Bir biyogüvenlik kabininde, in vivo uygulama için lipozomları steril salin içinde 50 μL'lik son bir hacimde uygun konsantrasyona seyreltin.
NOT: Önceki çalışmalarda, lipozom preparatımız yaklaşık 4.89 μmol tesaglitazar / mL'ye eşit olan 2 mg / mL tesaglitazar içeriyordu ve lipozomları 1 μmol ilaç / kg dozunda uyguladık. 40 g'lık bir fare için, 8.2 μL lipozomları, salin içinde 50 μL'lik son bir hacme kadar getireceğiz. DLS / ELS kullanarak, birim hacim başına lipozom sayısı, ilaç yüklü lipozomlara kıyasla fare ağırlığının gramı başına eşit sayıda araç lipozomunun uygulanmasını sağlamak için ilaç ve araç yüklü lipozomların preparatları için de ölçülmelidir. - Lipozom çözeltisini biyogüvenlik kabinindeki 27 G'lık bir iğneye yükleyin. Fareye soğuk çözelti enjekte etmekten kaçınmak için bunu oda sıcaklığında tutun.
3. Lipozomları retro-orbital intravenöz enjeksiyon yoluyla uygulayın
NOT: İntravenöz enjeksiyonun, tercih edilirse kuyruk damarı enjeksiyonları gibi başka yöntemlerle de yapılması uygundur. Bu protokolde yer almamakla birlikte, bu yöntemi açıklayan yayınlanmış protokoller19 mevcuttur.
- Lipozomları teslim etmek için çalışma alanını ayarlayın.
- Çalışma tezgahını %70 etanol ile temizleyin. İzofluran anestezi sisteminin kullanılmasına izin veren bir alan seçtiğinizden emin olun.
- Bir ısıtma yastığı açın ve fareyi temiz bir yüzeyde tutmak için üzerine temiz bir ped veya havlu yerleştirin. Farelerle çalışmaya başlamadan önce pedin ısınması için yeterli zaman tanıyın.
- Anestezi sistemini, oda yakınlarda olacak ve burun konisi ısınma yastığının üzerinde olacak şekilde ayarlayın.
- Sistemin diğer tüm yönlerinin hazır olduğundan emin olun (örneğin, izofluran seviyesi buharlaştırıcıda yeterince yüksek, kömür filtresi tartılmış, boru doğru şekilde bağlanmıştır).
- Protokolün bu bölümü için gerekli diğer malzemeleri toplayın: oftalmik yağlayıcı jel, uygulama sonrası tedavi için lokal anestezik, steril gazlı bez pedleri.
- İndüksiyon odasında izofluran kullanarak fareyi sakinleştirin. Nazik bir ayak dokunuşuna yanıt vermediğinde, burun konisinden sedasyonu korurken fareyi hızlı bir şekilde çalışma alanına aktarın.
NOT: Hayvan, prosedüre devam etmeden önce% 1.5 ila% 2.5 izofluranda tutulmalı ve uygun bir anestezi derinliği (ayak parmağı sıkışmasına yanıt eksikliği yoluyla) açısından değerlendirilmelidir. - Lipozom uygulaması için fareyi bir tarafa kaydırın. Fare anestezi sırasında göz kırpmayacağından, prosedürün geri kalanında nemli kalmalarını sağlamak için her iki göze de az miktarda oftalmik kayganlaştırıcı uygulayın.
- Maruz kalan gözün üstündeki ve altındaki cilde hafifçe bastırın. Göz, yüz düzleminin üzerinde kalmalıdır.
- İğnenin ucunu medial kanthusa dikkatlice yerleştirin, iğnenin gözün altında olduğundan ve dokunmadığından emin olun. İğne gözün altına sokulduktan sonra, lipozomları yavaşça retro-orbital boşluğa enjekte edin. İğneyi çektikten sonra, hemostaz elde etmek için göz kapaklarını birkaç saniye kapatmak gerekebilir.
- İğne yeterince uzağa sokulmazsa, çözelti göz çevresinde ortaya çıkabilir. Bu görülürse hemen enjekte etmeyi bırakın ve iğneyi yeniden konumlandırın.
- İşlem sonrası ağrı ve rahatsızlığı önlemek için göze proparakain gibi lokal bir anestezi uygulayın.
- Fareyi bir ısıtma pedi üzerinde tutun ve iyi olduğundan ve uygun vücut ısısını koruduğundan emin olmak için uyanana kadar izleyin.
- İlgilendiğiniz zaman gelene kadar fareyi kafesine ve normal barınma ortamına geri döndürün.
NOT: Bu, yerel IACUC yönergelerine uygun olarak yapılmalıdır.
4. Doku hasadı, doku işleme ve akış sitometrisi boyama için malzemeler hazırlayın
- Hasat, işleme ve boyama için çözeltiler hazırlayın (bölüm 5\u20127): fosfat tamponlu salin (PBS)-Heparin, HEPES Tamponu, 2 mg/mL Kollajenaz tip I, AKC lizis tamponu, FACS tamponu, PBS, Fiksasyon tamponu (Tablo 2). İşlem sırasında fiksasyon tamponu dışındaki tüm çözeltileri 4 ° C'de veya buz üzerinde tutun.
- Dokuların toplanması ve işlenmesi için tamponlar ve diğer malzemelerle tüpler hazırlayın.
- Her fareden gelen kan için, kanı toplamak için 1,5 veya 1,7 mL'lik bir mikrosantrifüj tüpüne 10 μL 0,5 M EDTA ekleyin. EDTA kanın pıhtılaşmasını önleyecektir. 25 G iğneli 1 mL'lik bir şırınga ve 15 mL'lik bir konik tüp de gereklidir.
- Dalak için, 1 mL HEPES tamponu, 1 mL şırınga, iki 50 mL konik tüp ve dalak başına iki 70 μm filtre içeren bir 1.5 veya 1.7 mL mikrosantrifüj tüpü toplayın.
- Her yağ dokusu deposu için, dokuyu kıymak için 1,5 mL HEPES tamponlu 20 mL'lik bir polietilen şişe, fare başına 50 mL'lik bir konik tüp ve yağ dokusu tipi başına 70 μm'lik bir filtre toplayın.
- Çalışma alanını hasat için hazırlayın.
- Tezgah alanını %70 etanol ile temizleyin. Hasat sırasında fareyi% 70 etanol ile temizleyerek ve emici bir ped veya kağıt havlu ile kaplayarak sabitlemek için lastik bir tepsi hazırlayın. Çalışmak için en az 5 pin bulunduğundan emin olun.
- 10 mL'lik bir şırıngayı PBS-heparin ile doldurun ve perfüzyon için 25 G'lik bir iğneye sabitleyin.
- Hasat sırasında kullanılacak alet ve malzemeleri toplayın. Forseps (iki çift), makas, kağıt havlu, tüy bırakmayan mendil, EDTA'lı mikrosantrifüj tüpü/tüpleri, HEPES tamponlu mikrosantrifüj tüp(ler)i ve HEPES tamponlu polietilen şişe(ler)e ihtiyaç vardır.
5. Dokuları toplayın
- CO2 boğulma ile fareyi ötenazi yapın. Servikal çıkık yapmayın, çünkü bu daha sonraki adımlarda etkili kan alımını ve doku perfüzyonunu önleyebilir.
- Fareyi iyi görmek için yeterli çalışma alanına ve aydınlatmaya sahip temizlenmiş bir tezgah alanında, bir lastik diseksiyon tepsisi, numuneleri saklamak için bir kova buz ve% 70 etanol içeren bir sprey şişesi ayarlayın. Kirlenmeyi azaltmak ve saç yayılımını kontrol etmek için fareye %70 etanol püskürtün. Fareyi sırt üstü lastik tepsiye yerleştirin ve pençelerini vücudundan uzağa doğru uzatarak sabitleyin.
- Kan toplamaya hazırlanmak için, farenin göğüs kafesinin kaudal ucunun kenarındaki deride dikkatlice bir kesi yapın. Pektoralis kasları açığa çıkana kadar farenin kafasına (yaklaşık 1 cm) doğru küçük, düz bir çizgi kesin.
- İlk kesi yerinde, kafaya doğru çizgiye dik iki küçük kesik yapın. Ardından, maruz kalan bölgedeki göğüs kafesinin bir tarafındaki pektoralis kasını dikkatlice kesin. Bu, iğnenin yerleştirilmesi gereken yere daha iyi erişim ve görselleştirme sağlar.
- Kan toplamak için, iğneyi kasın çıkarıldığı taraftaki üçüncü ve dördüncü kaburgaların arasına yerleştirin. Farenin kalbi göğüs boşluğunun merkezinde bulunduğundan, iğneyi göğüs kafesinin merkez çizgisine mümkün olduğunca yakın tutun. Yerleştirildikten sonra, kan toplamaya başlamak için şırıngayı yavaşça yukarı çekin.
- Toplandıktan sonra, kanı EDTA ile hazırlanan mikrosantrifüj tüpüne aktarın ve buz üzerinde saklayın.
NOT: Yaklaşık 100 μL hacim yukarı çekilirse ve şırıngaya kan girmezse, iğne açıklığının kalbin duvarına bastırılması durumunda şırıngayı sağa veya sola döndürmeyi deneyin. Bu işe yaramazsa, iğneyi yavaşça göğüs boşluğuna doğru hareket ettirin veya çıkarmaya başlayın. Bu noktada şırıngada kan toplanmaya başlarsa, şırıngayı yavaşça geri çekmeye devam edin. Başarılı ekstraksiyon için şırıngayı ve iğneyi döndürmeyi düşünün. Son olarak, kan toplanmazsa, kalbi kaçırmış olabileceğinden iğneyi çıkarın. İğneyi tekrar takmayı ve yukarıda belirtilen işlemi tekrarlamayı deneyin.
- Ardından, fareyi perfüze etmek için, kalbe erişmek için göğüs boşluğunu açın.
- Bunu yapmak için, cildi göğüs kafesinin ucu boyunca her iki tarafta farenin yanına kadar kesin. Ardından, sternumu çalışma yüzeyinden uzak tutmak için forsepsleri kullanın. Periton boşluğunu kesmek için sternumun ucunun hemen altında küçük, sığ bir kesi yapın. Periton zarı boyunca, farenin her iki tarafındaki göğüs kafesinin ucu boyunca kesin. Bu karaciğer ve safra kesesini açığa çıkarmalıdır. Bu dokulardan herhangi birine kesmemeye dikkat edin.
- Daha sonra, diyaframa küçük, sığ bir kesim yapın, karaciğere kafatası. Ardından, göğüs boşluğunu açmak için diyaframı göğüs kafesinin kenarı boyunca kesin. Göğüs boşluğundaki organların herhangi birini kesmekten kaçındığınızdan emin olun.
- Göğüs kafesi boyunca, farenin merkez çizgisinden yaklaşık 2-3 mm ve yaklaşık 0.75 cm uzunluğunda kafaya doğru iki kesim yapın.
NOT: Çok yüksek kesilirse, göğüs kafesinin üst kısmında bulunan arterler kesilecektir. Bu, perfüzyonun etkinliğine müdahale edecektir. - Göğüs boşluğunu ortaya çıkarmak için göğüs kafesinin orta parçasını geri kaldırın. Kalbe erişmek için herhangi bir yağ veya dokuyu uzaklaştırın.
- Kanı dışarı itmek için bir açıklık oluşturmak için farenin kalbinin sağ atriyumuna küçük bir kesim yapın.
- 10 mL'lik bir PBS-heparin şırıngası kullanarak, iğneyi farenin kalbinin sol ventrikülüne yerleştirin.
- PBS'yi yavaşça kalbe mümkün olduğunca yavaş itmeye başlayın.
NOT: Sağ atriyumdan çıkan ve göğüs boşluğunu dolduran kan gözlenmelidir. PBS-heparinin kalpten aort boyunca akışını engellemekten kaçınmak için kalbi fizyolojik konumunda tuttuğunuzdan emin olun. - 10 mL'lik PBS-heparinin tamamı fareden perfüze edildikten sonra, şırıngayı ve iğneyi atın ve fazla kanı ve PBS-Heparin'i kağıt havlu veya tüy bırakmayan mendiller kullanarak göğüs boşluğundan çıkarın.
- Daha sonra, dokuları çıkarmaya başlamak için, periton boşluğunu açmak için cildi ve periton zarını farenin kuyruğuna doğru kesin.
- İlk olarak, kasık yağ dokusu pedini farenin her iki tarafından çıkarın.
NOT: Bu işlemi dikkatlice okuyun: Sonuçlarda yağ dokusu hücresel yapısının çarpıtılmasını önlemek için her depodan kasık lenf nodunu çıkardığınızdan emin olun.- İkinci bir forseps seti kullanarak, periton zarını bir forseps seti ile ve cildin kenarını diğer forsepslerle birlikte bu taraftaki zarın üzerine bindirilmiş olarak tutun. Bu katmanları birbirinden ayırmak için cildi periton zarından yavaşça çekin. Cilt boyunca inguinal yağ dokusu deposunu arayın. Yağ deposuna daha iyi erişmek için cildin dış kenarını sabitleyin.
- Ekstraksiyondan önce, inguinal lenf nodunu yağ deposunun ortasına yerleştirin ve gerektiğinde forseps ve makas kullanarak çıkarın.
NOT: Mümkünse, deponun dış kenarlarından merkeze doğru uzanan üç büyük arteri bulun. Lenf nodu, bu arterlerin buluştuğu yerin etrafında bulunur. - Lenf nodu çıkarıldıktan sonra, yağ deposunun ucunu forseps ile sabitlenmiş noktaya en yakın şekilde dikkatlice tutun ve yağ dokusu ile cilt arasındaki bağ zarında küçük kesikler yapmaya başlayın. Membrana daha iyi erişmek ve tüm deponun çıkarıldığından emin olmak için kesikler yaparken yağ dokusunu deriden uzaklaştırın.
- Yağ deposunu, hasatın geri kalanında dokuyu canlı tutmak için buz üzerinde HEPES tamponlu hazırlanmış bir polietilen şişeye yerleştirin.
- Her iki depoyu da çıkarmak için bu işlemi farenin diğer tarafında tekrarlayın. Depolar birlikte veya ayrı ayrı sindirilebilir ve işlenebilir. Her depo ayrı ayrı işlenecekse, daha fazla tüp hazırlanmalıdır.
- Daha sonra, epididim yağ depolarını periton boşluğunun kaudal ucundan çıkarın. Forseps kullanarak, ilk epididim yağ deposunu farenin dorsal ucundan yavaşça çekin ve bu depoya bağlı epididimis ve vas deferens'i bulun.
NOT: İki epididim yağ deposu vardır: her epididimise bir tane ve vas deferens.- Yağ deposu ile epididimis ve vas deferens arasında dikkatlice kesilerek yağ miktarı bu diğer dokulardan ayrılır. Yağ deposunu, hasatın geri kalanında dokuyu canlı tutmak için buz üzerinde HEPES tamponlu bir polietilen şişeye yerleştirin.
- Son olarak, diyaframın yakınında midenin solunda bulunan dalağı çıkarın. Forseps kullanarak, dalağı açığa çıkarmak için mideyi yavaşça periton boşluğunun merkezine doğru çekin.
- Dalağın bir ucunu yavaşça tutun ve mideden hafifçe uzağa çekin. Dalak ve bitişik dokusu arasındaki zarı, organ ayrılana kadar kesin. Dalağı HEPES tamponlu hazırlanan mikrosantrifüj tüpüne yerleştirin ve buz üzerinde saklayın.
- Mendilleri işlemeden veya bir sonraki fareden doku toplamadan önce, karkası ve kirli kağıt havluları veya pedleri atın. Aletleri de silin.
NOT: Birden fazla fare varsa, bir sonraki işleme adımına geçmeden önce her fare için bu hasat adımlarını tekrarlayın. Bir kontrol faresi / faresi dahil edilmişse, herhangi bir kontaminasyonu önlemek için lipozomla tedavi edilmiş farelerden önce bunları toplamayı düşünün.
6. Proses dokuları
NOT: Yağ dokusu uzun bir sindirim inkübasyonuna sahip olduğundan, önce bu işlemle başlamanız ve sindirim döneminde kan ve dalağın işlenmesi üzerinde çalışılması önerilir.
- İlk olarak, yağ dokularını kıyın ve sindirin. Bir veya iki çift makas kullanarak, her bir polietilen şişedeki yağ dokusunu, doku 0,5 mm'den küçük küçük parçalar halinde olana kadar kıyın. Bu, daha verimli sindirim sağlar.
- Tüm şişelerdeki dokular kıyıldıktan sonra, her bir şişeye 1.5 mL 2 mg / mL Kollajenaz tamponu ekleyin. Şişeleri 37 ° C ve 150 rpm'ye ayarlanmış bir çalkalayıcı inkübatöre yerleştirin. 30 ila 45 dakika boyunca inkübe edin.
NOT: Yağ dokuları özellikle büyükse, dokuların tamamen suya batırıldığından ve yeterli enzimin bulunduğundan emin olmak için şişelere 0,5 mL ila 1,5 mL arasında başka bir HEPES tamponu ve eşit miktarda Kollajenaz tamponu eklemeyi düşünün. Sindirimdeki Kollajenaz Tip I'in nihai konsantrasyonu, nihai çözelti hacminden bağımsız olarak 1 mg / mL olmalıdır. Ayrıca, bir çalkalama inkübatörü mevcut değilse, numuneler 37 ° C'ye ısıtılmış bir su banyosuna yerleştirilebilir. Sindirimi karıştırmak ve askıya almak için numuneleri her 5 dakikada bir hafifçe sallayın. - Numuneleri 30 dakikada kontrol edin. Numuneyi yukarı ve aşağı borulamak için 1 mL'lik bir pipet kullanın. Doku parçaları kolay pipetleme için hala çok büyükse, numuneleri 15 dakika daha inkübatöre geri gönderin.
- Numuneler tamamen sindirildikten sonra, tek hücreli bir süspansiyonun oluşturulduğundan emin olmak için numuneyi 10 kez daha yukarı ve aşağı borulamaya devam edin.
NOT: (İsteğe bağlı) Numuneleri 30 dakikada kontrol edin. Numuneyi yukarı ve aşağı borulamak için 1 mL'lik bir pipet kullanın. Doku parçaları kolay pipetleme için hala çok büyükse, numuneleri 15 dakika daha inkübatöre geri gönderin. - Hücre süspansiyonunu 70 μm'lik bir filtreden 50 mL'lik bir konik tüpe pipetin. Şişeyi yıkamak için boş sindirim şişesine 5 mL FACS tamponu ekleyin. Hücre süspansiyonuna eklemek için bu yıkama tamponunu filtreden geçirin.
- Diğerleri işlenirken örnekleri buz üzerinde saklayın. Tüm numuneler filtrelendikten sonra, 5 dakika boyunca 400 x g, 4 ° C'de aşağı doğru döndürün.
- Adiposit süpernatantını aspirasyon yoluyla çıkarın ve daha sonra stromal-vasküler fraksiyon (SVF) peletini terk etmek için aspirasyonla adiposit süpernatant ve pelet arasındaki infranatantı dikkatlice çıkarın.
- Bu pelet 1 mL FACS tamponunda tekrar askıya alın ve temiz bir 1,5 veya 1,7 mL mikrosantrifüj tüpüne aktarın. İstenirse veya ihtiyaç duyulursa Aliquot hücreleri şimdi. Tüm numuneler akış sitometrisi boyamaya hazır olana kadar buz üzerinde tutun.
NOT: Sindirilen yağ depoları büyükse, akış sitometrik boyama ve analizi için numunenin sadece% 50 veya% 25'ini kullanmayı düşünün. Ek olarak, herhangi bir floresan-eksi-bir (FMO) kontrol veya akış sitometri analizi için ek kontrollere (Tablo 1) ihtiyaç duyulursa, işleme için ayrı bir tüpe fazladan numune ayırdığınızdan emin olun. FMO'lar, deneyde kullanılan aksi takdirde tamamlanmış panel içindeki bireysel bir florofor konjuge antikoru için negatif ve pozitif sinyal arasında ayrım yapmak için kullanılır.
- Tüm şişelerdeki dokular kıyıldıktan sonra, her bir şişeye 1.5 mL 2 mg / mL Kollajenaz tamponu ekleyin. Şişeleri 37 ° C ve 150 rpm'ye ayarlanmış bir çalkalayıcı inkübatöre yerleştirin. 30 ila 45 dakika boyunca inkübe edin.
- İkincisi, kanı işleyin.
- 50 μL kanı 15 mL'lik bir konik tüpe aktarın.
- Her tüpe 1 mL AKC lizis tamponu ekleyin ve tek hücreli bir süspansiyona ulaşmak için yukarı ve aşağı borulayın. Her tüpe ilave 4 mL AKC lizis tamponu ekleyin ve 5\u201210 dakika boyunca inkübe edin. Bir çalkalayıcı veya rotatör varsa, tüp kapaklarını sıkıca kapatın ve karıştırmayı arttırmak için tüpleri bunlardan birine yerleştirin.
- Lizis prosesini söndürmek için 5 mL FACS tamponu ekleyin ve numuneleri 5 dakika boyunca 400 x g, 4 ° C'de döndürün. Süpernatantı çıkarın ve peletleri kontrol edin. Hala oldukça kırmızıysa, lizis işlemini tekrarlayın. Aksi takdirde, peletleri 1 mL FACS tamponunda tekrar askıya alın ve temiz bir 1,5 veya 1,7 mL mikrosantrifüj tüpüne aktarın. Tüm numuneler akış sitometrisi boyamaya hazır olana kadar buz üzerinde tutun.
- Son olarak, dalağı işleyin. Dalağı, 50 mL'lik bir konik tüp üzerinden 70 μm'lik bir filtreye aktarın. Dokuyu 1 mL FACS tamponu ile yıkayın ve ardından 1 mL'lik bir şırınganın piston ucunu kullanarak dalağı filtreden geçirin. Ezilme işlemi boyunca, hücreleri daha fazla FACS tamponu kullanarak 50 mL konik tüpe yıkayın. Konik tüpteki son hacim 10 mL olmalıdır.
- Hücreleri 300 x g'de 4 ° C'de 5 dakika boyunca döndürün. Süpernatantı çıkarın ve 1 mL AKC lizis tamponunda tekrar askıya alın. Ek bir 4 mL AKC lizis tamponu ekleyin ve 5 dakika boyunca inkübe edin. Lizis prosesini söndürmek için 5 mL FACS tamponu ekleyin ve numuneleri 5 dakika boyunca 4 ° C'de 300 x g'de döndürün.
- Süpernatantı çıkarın ve peleti 1 mL FACS tamponunda tekrar askıya alın. Süspansiyonu ikinci, temiz 70 μm'lik bir filtreden 50 mL'lik bir konik tüpe aktarın. Orijinal tüpü yıkamak için 4 mL FACS tamponu ekleyin ve tamponu 5 mL'lik son hacim için filtreden aktarın.
- Hücre süspansiyonunun 50 μL'sini temiz bir 1.5 veya 1.7 mL mikrosantrifüj tüpüne aktarın ve tüm numuneler akış sitometri boyaması için hazır olana kadar buzda tutun. Daha fazla istenirse veya gerekirse ek alikotlar tüplere aktarılabilir.
NOT: Splenositler, Canlı / Ölü tek bir leke için kullanmak için mükemmel hücrelerdir. Bu denetim için ek bir aliquot aktarmayı düşünün.
7. Akış sitometrisi için dokulardan hücreleri lekeleyin
- Aliquote numuneleri 400 x g, 4 °C'de 5 dakika boyunca döndürün.
- Süpernatantı çıkarın ve numuneleri 50 μL Fc Blokta (seyreltilmiş) yeniden askıya alın (Tablo 2). 5 dakika boyunca buz üzerinde kuluçkaya yatırın.
- Her numuneye 50 μL 2x antikor karışımı ekleyin (Tablo 3). Karanlıkta buz üzerinde 20 dakika kuluçkaya yatırın.
NOT: Tek bir leke bu antikor karışımı ile boyanmamalıdır. Ek olarak, FMO'lar kullanılacaksa, FMO antikor karışımları ayrı ayrı hazırlanmalıdır. - Numuneleri 1 mL PBS ile yıkayın ve 5 dakika boyunca 400 x g, 4 °C'de döndürün. Süpernatantı çıkarın ve numuneleri 200 μL canlılık lekesinde yeniden askıya alın (Tablo 3). Karanlıkta buz üzerinde 20 dakika kuluçkaya yatırın.
NOT: Bu adımda Canlı/Ölü tek bir leke için ayrılan hücreleri boyamayı unutmayın. - Numuneleri 1 mL FACS tamponu ile yıkayın ve 5 dakika boyunca 400 x g, 4 °C'de döndürün. Numuneleri sabitlemek için süpernatantı çıkarın ve numuneleri (Canlı/Ölü tek leke hariç) 50 μL fiksasyon ortamında (Reaktif A) yeniden askıya alın. Karanlıkta oda sıcaklığında 15 dakika inkübe edin.
- Canlı/Ölü tek lekesini 100 μL'de %2 PFA'da yeniden askıya alın. Karanlıkta oda sıcaklığında 5 dakika inkübe edin.
- Numuneyi 1 mL FACS tamponu ile yıkayın ve 5 dakika boyunca 800 x g, 4 °C'de döndürün. Süpernatantı çıkarın ve numuneleri 250 ila 500 μL FACS tamponunda yeniden askıya alın. Numuneler akış sitometresinde çalıştırılana kadar 4 °C'de saklayın.
- Numuneleri 1 mL FACS tamponu ile yıkayın ve 5 dakika boyunca 800 x g, 4 °C'de döndürün. Süpernatantı çıkarın ve numuneleri 50 μL geçirgenlik ortamında (Reaktif B) artı hücre içi proteinlere karşı antikorlarda yeniden askıya alın. Karanlıkta oda sıcaklığında 20 dakika boyunca inkübe edin.
- Numuneleri 1 mL FACS tamponu ile yıkayın ve 5 dakika boyunca 4 °C'de 800 x g'de döndürün. Süpernatantı çıkarın ve numuneleri 100 μL% 2 paraformaldehit (PFA) içinde yeniden askıya alın. Karanlıkta oda sıcaklığında 5 dakika inkübe edin.
- Numuneleri 1 mL FACS tamponu ile yıkayın ve 5 dakika boyunca 800 x g, 4 °C'de döndürün. Süpernatantı çıkarın ve numuneleri 250 ila 500 μL FACS tamponunda yeniden askıya alın. Numuneler akış sitometresinde çalıştırılana kadar 4 °C'de saklayın.
Sonuçlar
Lipozom Üretimi
Burada yayınlanan sonuçlar, daha önce yayınlanmış olan 3,4,20 çalışmamızdakilere benzer. Burada sunulan protokolü kullanarak, yaklaşık 150 \ u2012160 nm boyutunda lipozomlar üretmeyi bekliyoruz. DLS, ortalama lipozom çapının 163.2 nm ve zeta potansiyelinin -19.2 mV olduğunu ortaya koymaktadır (Şekil 1A). Kriyojenik elektron mikroskobu (kriyo-EM) görüntülemesi dairesel lipozomları ortaya çıkarır (Şekil 1B) ve DLS diyagramı ortalama çaptan nispeten küçük bir standart sapma ortaya çıkarır (Şekil 1C).
Pozitif lipozom bağlanması, PBS ile tedavi edilen bir kontrol gerektirir
Bu protokolü kullanan grubumuzdan yapılan önceki çalışmalar, in vivo uygulamadan bir hafta sonra lipozomlara bağlı yağ SVF, dalak ve kandaki hangi hücre alt kümelerinin araştırıldığını araştırmıştır 3,4. PBS ile tedavi edilmiş bir fare kullanılarak, periton boşluğu ve dalak hücreleri, lipozomla tedavi edilen farelerden alınan örneklerde kullanılan aynı antikor paneli ile boyandı. Dokular bir haftalık tedavilerden sonra hasat edildi (Şekil 2A). PBS ile muamele edilmiş fareden alınan örnekler, pozitif DiD kapıları oluşturmak için bir DiD FMO görevi gördü (Şekil 2B, C). DiD-pozitif sinyal kullanılarak pozitif bir kapı oluşturulabilir, ancak pozitif kapının herhangi bir DiD-negatif numune içermediğini doğrulamak için DiD sinyali olmayan örnekler de kullanılmalıdır.
Floresan sinyallerini optimize etmek için titrasyonlara ihtiyaç vardır
Tam bir deney yapmadan önce, hücre boyama sırasında kullanılan floresan konjuge antikorların konsantrasyonu ve lipozom hazırlama sırasında kullanılan lipit boyası dahil olmak üzere çeşitli koşullar optimize edilmelidir. Akış sitometreleri, floresan yoğunluğu için bir üst algılama sınırına sahiptir, bu nedenle lipozomlara dahil edilen çok fazla boya, sitometreden geçen numunelerde ölçülemeyen DiD sinyal seviyelerine yol açacaktır. Ayrıca, lipozomlardaki çok fazla DiD, hücresel alım sonuçlarını çarpıtabilecek yüksek düzeyde spesifik olmayan boya transferine yol açabilir. Şekil 3, kullanılan akış sitometresinin algılama aralığında optimal bir sinyal üretecek konsantrasyonu tanımlamak için lipit boya konsantrasyonlarının titre edildiği bir deneyden elde edilen sonuçları bildirmektedir. Bu, son deney için ilgilenilen dokular üzerinde gerçekleştirildi: Kan (Şekil 3A), inguinal yağ SVF (Şekil 3B) ve epididim adipoz SVF (Şekil 3C). Test için seçilen konsantrasyonlar, 1 mL lipozom başına 10 mg DiD (Yüksek, kırmızı), 1 mg DiD (Orta, mavi) veya 0.1 mg DiD (Düşük, gri) idi. Lipozomlarda kullanılan en yüksek konsantrasyon çok yüksekti ve her üç dokuda da sitometrenin ölçülebilir aralığını aştı (Şekil 3A \ u2012C, kırmızı). En düşük DiD konsantrasyonu bir miktar sinyal gösterdi (Şekil 3 A\u2012C, gri), ancak PBS ile tedavi edilen hücrelerin ötesinde net bir popülasyon gözlenmedi (Şekil 3A\u2012C, siyah). Ölçüldüğünde, her doku ve konsantrasyon için DiD MFI'nın aritmetik ortalaması, PBS kontrolleri ile DiD'nin orta konsantrasyonu arasında net bir ayrım olduğunu göstermiştir (Şekil 3D). Bu nedenle, protokolde belirtildiği gibi, lipozom preparatımızda kullanmak üzere orta konsantrasyonu (Şekil 3, mavi) seçtik.
Çoklu antikor panelinin kullanılması, lipozom alımının farklı hücre alt kümeleri tarafından tanımlanmasına izin verir
Tablo 3'te özetlenen panel kullanılarak, hücreler makrofajlar, B hücreleri, T hücreleri, dendritik hücreler, monositler ve endotel hücreleri için belirteçlere karşı antikorlarla boyandı (Şekil 4). Her doku tipi için biraz farklı geçit stratejileri gereklidir, ancak her birinde aynı hücre tiplerinin çoğu tanımlanabilir. Bazı istisnalar, normalde kanda bulunmayan endotel hücrelerini ve kanda tipik olarak diğer dokulardan daha yüksek sıklıkta bulunan monositleri içerir. Popülasyonlar tanımlandıktan sonra, her hücre popülasyonunun toplam büyüklüğü ve DiD + oldukları frekans ölçülebilir. DiD + popülasyonunu karakterize etmek için daha fazla hesaplama yapılabilir: DiD + hücrelerinin yüzde kaçının makrofajlar, endotel hücreleri vb. Lütfen unutmayın, bunlar örnek geçit stratejileridir, ancak örnekleri analiz etmenin tek yolu değildir. Analiz, seçilen panel ve mevcut akış sitometreleri tarafından belirlenecektir.
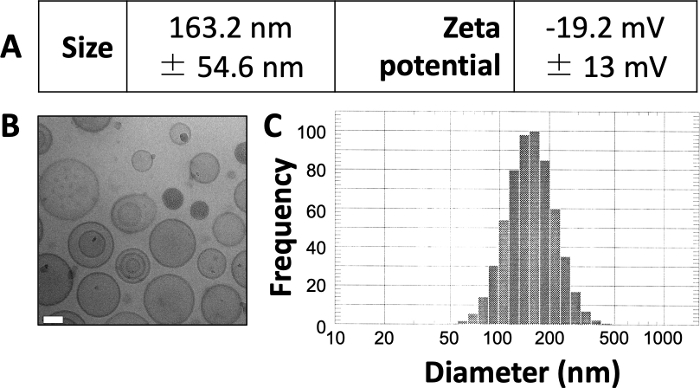
Şekil 1: Hazırlanan lipozomların örnek özellikleri.
(A) Boyut ve zeta potansiyeli yukarıda açıklandığı gibi ölçülmüş ve tablo şeklinde rapor edilmiştir. Her parametre ortalama ± standart sapma olarak sunulur. (B) Hazırlanan lipozomları görüntülemek için Cryo-EM kullanıldı. Beyaz ölçek çubuğunun uzunluğu 50 nm'dir. (C) DLS, bu hazırlıkta lipozomların çapının histogramını oluşturmak için kullanıldı. Bu rakam Osinski ve ark.3'ten uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
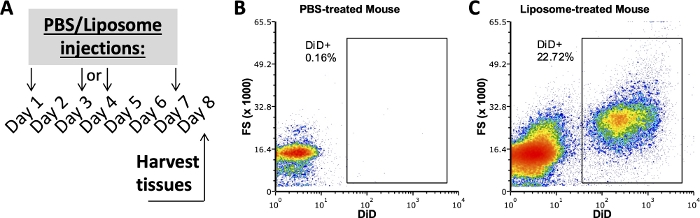
Şekil 2: PBS veya Lipozom ile tedavi edilen farelerden temsili DiD boyaması.
(A) PBS ve lipozom tedavileri için deneysel şema. PBS veya lipozomlar bir hafta boyunca üç kez enjekte edildi. Dokular tedavinin 8. gününde hasat edildi. (B, C) Temsili akış grafikleri, lipozomla tedavi edilen (C) farelerde pozitif DiD boyamasını ortaya çıkarır, ancak PBS ile tedavi edilen (B) farelerde değildir. FSC, ileri saçılma. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
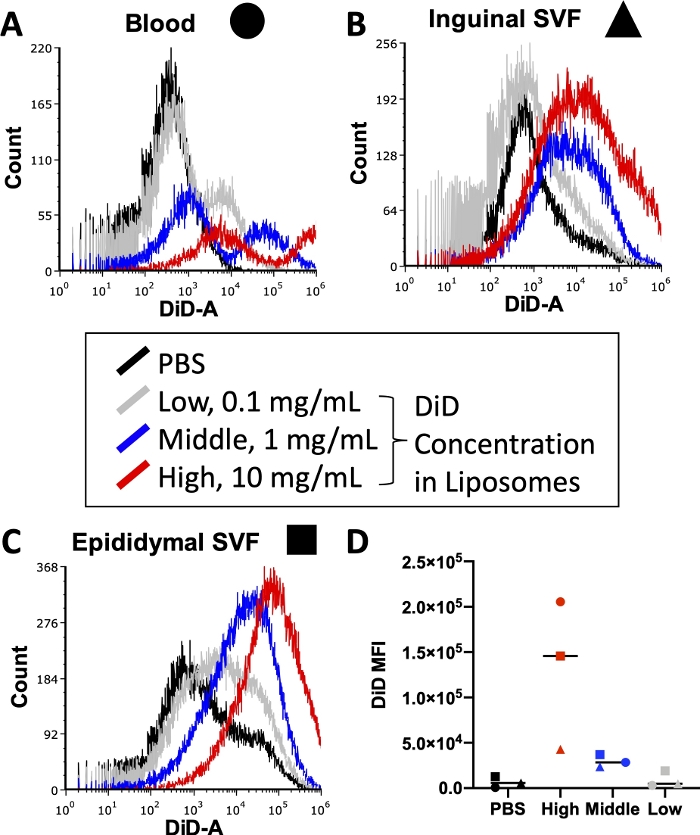
Şekil 3: Lipozomlarda DiD titrasyonu.
Lipozomlar üç farklı DiD konsantrasyonu ile hazırlandı ve farelere enjekte edildi. Gri, 1 mL lipozom başına 0.1 mg DiD'deki düşük konsantrasyonu, mavi 1 mg DiD / mL lipozomlardaki orta konsantrasyonu ve kırmızı 10 mg DiD / mL lipozomlardaki yüksek konsantrasyonu gösterir. PBS ile muamele edilmiş bir fare, negatif kontrol (siyah) olarak kullanılmıştır. Kan (A, daire), inguinal yağ (B, triange) ve epididim adipoz (C, kare) enjeksiyondan 24 saat sonra toplandı ve tek hücreli bir süspansiyonu izole etmek için işlendi. Bu örnekler, tespit edilebilir DiD seviyesine kadar bir akış sitometresi üzerinde çalıştırıldı. Her tedavi grubunun bindirmeleri ile dokuya özgü histogramlar, konsantrasyon başına floresan yoğunluğunu göstermek için sunulmuştur (A\u2012C). DiD'nin aritmetik ortalaması da her doku ve konsantrasyon için ölçüldü ve çizildi (D). SSC = yan saçılma. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
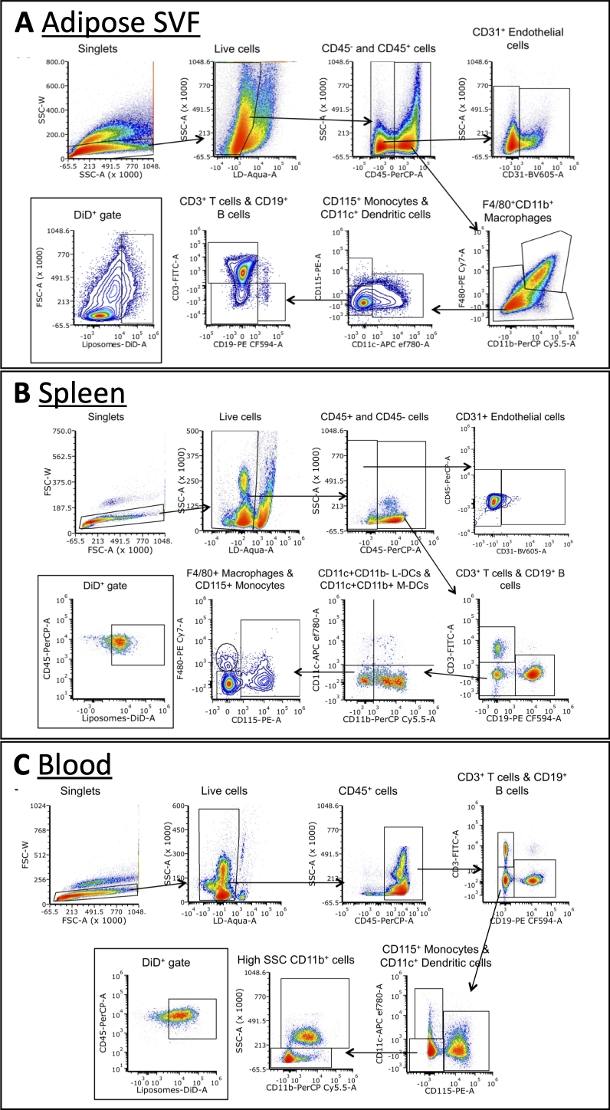
Şekil 4: Yağ SVF, kan ve dalaktaki hücre alt kümelerinin temsili akış sitometrisi analizi.
(A\u2012C) Yağ SVF (A), dalak (B) ve kandaki (C) hücre alt kümelerini ve DiD + hücrelerini tanımlamak için geçit stratejisinin şematik temsilcisi. Kısaltmalar: FSC = ileri saçılma; LD = canlı/ölü; L-DC'ler = lenfoid dendritik hücreler; M-DC'ler = miyeloid dendritik hücreler; SSC = yan saçılma. Bu rakam Osinski ve ark.3'ten uyarlanmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Kontrol | Amaç |
| PBS veya salin ile tedavi edilmiş fare | Aşağıdaki akış sitometri kontrolleri için bu faredeki hücreleri kullanın: |
| 1. Lekelenmemiş hücreler | |
| 2. Canlı / ölü tek leke | |
| 3. Tam panel ile boyanmış, ancak analiz sırasında pozitif lipozom sinyalini belirlemek için lipozom floresansından yoksun hücreler | |
| Bu / bu fare / fareler, deneyimizde lipozom olmayan bir kontrole sahip olacağınız için lipozomların in vivo herhangi bir etkisi olup olmadığını belirlemek için de kullanılacaktır. | |
| Yüksüz lipozomlar | Lipozomlarınıza bir bileşik yüklüyorsanız, lipozom partinizin bir kısmı bileşik olmadan sentezlenmelidir. Bu, tek başına lipozomların in vivo etkilerini açıklar. |
| Tek başına DiD | DiD, hücresel membranlar tarafından da alınabildiğinden, bazı farelerin lipozomlarda bulunana eşit miktarda serbest boya alması için tahsis edilmesi, herhangi bir arka plan zarı boyanmasının hesaba katılmasına yardımcı olacaktır. |
| Floresan eksi bir (FMO) kontrolleri | Bunlar, panelinizdeki antikorlardan biri hariç hepsiyle boyanmış hücrelerdir. Yukarıdaki kutudaki #3 gibi, bu da analiz sırasında bu antikor için gerçek pozitif sinyalin belirlenmesine yardımcı olur |
Tablo 1: Bu protokolde kullanılacak denetimler.
| Çözüm | Bileşen | Toplu iş/fare başına gereken yaklaşık hacim |
| Lipozom preparatı | ||
| Kalsiyum asetat | H2O cinsinden 1 M kalsiyum asetat | 50 mL |
| HEPES tamponu | H2O'da 10 mM HEPES, pH 7,4 | 50 mL |
| HEPES sınırlarındaki Tesaglitazar | 10 mM HEPES içinde | 10 mL |
| Doku toplama, işleme ve boyama | ||
| Fosfat tamponlu çözelti (PBS) | 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, damıtılmışH2O'da 1,8 mM KH2PO 4 | 2 mL |
| PBS-Heparin | PBS'de 0,1 mM Heparin | 10 mL |
| HEPES tamponu | PBS'de 20 mM HEPES | 5 mL |
| Sindirim tamponu | HEPES tamponunda 2 mg/mL Kollajenaz Tip I | 5 mL |
| AKC lizis tamponu | ddH 2 O cinsinden 0,158M NH 3 Cl, 10 mM KHCO3, 0,1 mM Na 2 EDTA, pH7,2 | 15 mL |
| FACS tamponu | %1 BSA, PBS'de %0,05 NaN3 | 15 mL |
| Fc Blok (seyreltilmiş) | 1:50 FACS tamponunda Fc Bloğu | 250 μL |
| Fiksasyon Tamponu | PBS'de %2 paraformaldehit | 200 μL |
Tablo 2: Hazırlanacak çözümler.
| A | B | C | D |
| Hücre Dışı Boyama (2x antikor karışımı) | |||
| Antijen | Florofor | 100 μL test başına Ab hacmi | Gerekli toplam hacim: |
| CD45 | PerCP | 0,5 μL | Sütun C x 1,2 x Toplam # örnekleri |
| CD11b | PerCP Cy5.5 | 0,25 μL | (0,5 μL/test) x (1,2) x (# örnekler) |
| F4/80 | PE Cy7 | 0,25 μL | (0,25 μL/test) x (1,2) x (# örnekler) |
| CD19 | PE-CF594 | 1 μL | (0,25 μL/test) x (1,2) x (# örnekler) |
| CD3 | FITC | 1 μL | (1,0 μL/test) x (1,2) x (# örnekler) |
| CD31 | BV605 | 0,25 μL | ve saire... |
| CD11c | APC ef780 | 1 μL | |
| CD115 | PE | 1,5 μL | |
| Antikor karışımınızı oluşturmak için, D sütununda hesaplanan antikorları FACS tamponu veya Brilliant Violet Boyama Tamponu* ile birleştirerek son hacme (50 μL x 1,2 x Toplam # numune) kadar birleştirin | |||
| Canlı/Ölü boyama (1x) | |||
| Canlı/Ölü | Florofor | 200 uL testi başına L/D hacmi | Gerekli toplam hacim: |
| Canlı/Ölü | Aqua | 0,67 μL | Sütun C x 1,2 x Toplam # örnekleri |
| Hücre İçi Boyama (1x) | |||
| Antijen | Florofor | 50 μL test başına Ab hacmi | Gerekli toplam hacim: |
| αSMA | FITC | 0.125 | Sütun C x 1,2 x Toplam # örnekleri |
| *Panelinizde Parlak Mor florofora konjuge edilmiş birden fazla antikor kullanılıyorsa Parlak Menekşe Boyama Tamponu kullanılmalıdır. | |||
Tablo 3: Örnek antikor paneli ve akış boyama için kullanılacak boyama karışımlarının hesaplanması.
Tartışmalar
Burada (i) floresan lipid boyası ile etiketlenmiş ve bir anti-diyabetik bileşik olan tesaglitazar ile yüklenmiş lipozomlar hazırlamak, (ii) retro-orbital enjeksiyon yoluyla bir fareye lipozomlar uygulamak ve (iii) akış sitometrisi ile hücresel düzeyde lipozom alımını tespit etmek için dokuları toplamak, işlemek ve lekelemek için üç bölümlü bir protokol açıklıyoruz. Bu protokol, yaklaşık 150-μm lipozomların hazırlanmasını ve yağ, kan ve dalaktaki alımın değerlendirilmesini gözden geçirir. Lipozom preparatı ölçeklenebilir, çoğunlukla oda sıcaklığında gerçekleştirilir ve ilaç yüklemesini ve organik çözücülerin uzaklaştırılmasını en üst düzeye çıkarmak için ters faz buharlaştırmasını kullanır. Bu protokolü kullanarak, saflaştırılmış lipozom numunesinde 2 mg / mL'ye kadar tesaglitazar konsantrasyonu elde edilebilir. Hazırlanan lipozomlar HEPES tamponunda 4 °C'de bir yıldan fazla saklanabilir. Deneyimlerimize göre, ortalama parçacık boyutunun minimum varyasyonunu gösterdiler. İlaç içeriği kaybının% 10'undan azı, lipozomların 10 kDa santrifüj filtre ile harici ilaçtan ultrafiltrasyon ile ayrılmasını takiben spektrofotometrik olarak gösterilmiştir.
Lipozom hazırlığı sırasında, dikkate alınması gereken bazı kritik adımlar ve faktörler vardır. İlk olarak, protokol adımlarının sırası önemlidir ve bunlara uyulmalıdır. İkincisi, tesaglitazar yüklenirken kullanılan çözeltinin pH'ı, çözünürlüğü ve etkili yüklemeyi en üst düzeye çıkarmak için 7.4'te tutulmalıdır. Üçüncüsü, ekipman ve filtrelerin uygun şekilde monte edilmesi, her adımın çıktısının uygun boyutta ve saflıkta olmasını sağlar. Örneğin, 100 ve 200 nm filtreler düzgün bir şekilde monte edilmezse, daha heterojen ve uygun olmayan boyutta bir lipozom grubu ortaya çıkabilir. Dördüncüsü, ilaç yüklemesinden önce Ca-asetatın tamamen çıkarılması, tesaglitazarın lipozomlara transferini en üst düzeye çıkarmak için gereklidir. Ca-asetatın tamamen çıkarılmasını test etmek için, lipozomları çıkarmak için yüksek hızlı çökeltme kullanın ve daha sonra lipozomal olmayan çözeltideki Ca-asetat seviyelerini ölçün. Beşinci olarak, her adımda lipozom preparatına eklenen tüm malzemelerin kütlesini tartmak ve kaydetmek önemlidir. Bu, uygun konsantrasyonların hesaplanabilmesini ve gerekli malzeme oranlarının korunmasını sağlar. Son olarak, teknik uygun şekilde uygulanmazsa, istenmeyen bir heterojenlik seviyesi olabilir. Bu parametreyi DLS ve elektron mikroskobu gibi diğer yaklaşımları kullanarak iyice kontrol etmek önemlidir. Homojenliği artırmak için, seçilen filtre boyutunu ayarlamayı veya iki filtreyi istiflemeyi düşünün.
Ek olarak, bu protokolü tam olarak yürütmeden önce kontrollerin ve akış sitometrisi için bir antikor panelinin planlanması ve optimize edilmesi kritik öneme sahiptir (Tablo 1, Tablo 3). Antikorlar, boyama için uygun konsantrasyonların kullanıldığından ve floroforlar arasındaki örtüşmenin minimum düzeyde olduğundan emin olmak için test edilmelidir. Lipozom hazırlama sırasında kullanılan boyanın uyarılması ve emisyonu da panel planlamasına dahil edilmelidir. Sonuçlarımızda, Allophycocyanin (APC) ve AlexaFluor 647 gibi floroforlara benzer bir uyarma ve emisyona sahip olan DiD'yi kullandık. Bu nedenle, antikor panelimizde bu floroforlara konjuge edilmiş antikorları seçmedik. Ayrıca, izotip kontrolleri bu protokole dahil değildir. Bunun nedeni, bu protokol için seçilen antikorların iyi doğrulanmış, ticari olarak temin edilebilen antikorlar olmasıdır. Bununla birlikte, daha önce optimize edilmemiş bir antikor kullanmakla ilgileniyorsanız, lütfen tam deneyi yapmadan önce antikoru ilgili dokular üzerinde izotip kontrolüne karşı test etmeyi düşünün.
Bu protokol, tedavi sonrası fareden kan, dalak, kasık yağ ve epididim yağ dokularının nasıl çıkarılacağını ve işleneceğini gösterirken, bu genel yaklaşım diğer dokulara da uygulanabilir. İlgilenilen dokuya bağlı olarak, işleme ve sindirim protokollerinin aşağıdaki dokular için yayınlandığı gibi değiştirilmesi gerekebilir: akciğer21, karaciğer22, periton boşluğu 3, kemik iliği3,23, beyin 24.
Bu yöntemin dikkate alınması gereken önemli bir sınırlaması, alımın hayvan başına yalnızca bir zaman noktasında değerlendirilebilmesidir. Bu nedenle, bu protokolü diğer non-invaziv görüntüleme teknikleriyle birleştirmek veya değerlendirmeyi yürütmek için yeterli kaynakları sağlamak için buna göre plan yapmak avantajlı olabilir. Hücresel alımın zamanlaması ve hücresel dönüşüm, dikkate alınması gereken önemli faktörlerdir: lipozomlar ilk 24 saat içinde vücutta dolaşır ve lipozomları alan hücrelerin ömrüne veya alıma nasıl tepki verdiklerine bağlı olarak, hücre ölümü veya daha fazla fagositoz oluşabilir. Önceki çalışmamız, DiD + popülasyonlarının popülasyon özelliklerinde farklı zaman noktalarındadeğişiklikler göstermiştir 3. Bu nedenle, daha erken zaman noktalarında veya ilgi mekanizmasının biyolojisi ile en alakalı zaman noktalarında alımı değerlendirmek önemlidir. Ek olarak, tüm dokudaki hücre alımının nicelleştirilmesi bu protokol ile yapılabilirken, akım sitometrisi doku lokalizasyonunu ortaya çıkaramaz. Bu yaklaşımın histolojik yöntemlerle birleştirilmesi bu sınırlamanın giderilmesine yardımcı olabilir.
Genel olarak, bu protokol histoloji ve tüm vücut floresan görüntüleme gibi mevcut metodolojiyi tamamlar. Akış sitometri araç ve yöntemlerindeki sürekli gelişmelerle, giderek daha spesifik hücre popülasyonlarına daha büyük panellerin geliştirilmesi mümkün olacaktır. Bu protokolün yukarıda belirtilen yöntemlere ek olarak kullanılmasını öneriyoruz, çünkü bu, hücresel alımın değerlendirilmesini iyileştirecek ve aynı zamanda akış sitometrisi ile gözlemlenen sonuçları doğrulama fırsatı sağlayacaktır. Örneğin, yağ dokusundaki parçacıkların çoğunluğunun makrofajlar tarafından akış sitometrisi ile alındığı tespit edilmelidir. Aynı yağ dokusunun ek bir alikotunun immünofloresansı, hücre tipinin gerçekten lipozomları aldığını doğrulamak için makrofaj belirteçleri için kaydedilebilir, sabitlenebilir, kesitlenebilir ve boyanabilir. Bu yaklaşım, yürütülen nanopartikül biyodağılım analizlerine titizlik katmalıdır: hücreye özgü hedeflemeyi doğrulamak, hücresel alımı ölçmek, hedef dışı alımı tanımlamak ve umarım gözlemlenen terapötik sonuçlar için mekanik hipotezler üretmek için bilgi sağlamak. Bu protokol aynı zamanda farklı lipozomlar kullanarak, diğer dokulardaki alımı araştırarak ve obezite ve dismetabolizma ortamında veya nanopartikül dağıtımının uygulanabilir bir terapötik seçenek olduğu başka herhangi bir hastalık ortamında yeni bileşikleri test ederek gelecekteki çalışmalar için uyarlanabilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Yazarlar, Michael Solga'ya ve Flow Cytometry Core personelinin geri kalanına akış sitometrisi eğitimi ve hizmetleri sağladıkları için teşekkür etmek ister. Yazarlar ayrıca Shiva Sai Krishna Dasa, Dustin K. Bauknight, Melissa A. Marshall, James C. Garmey, Chantel McSkimming, Aditi Upadhye ve Prasad Srikakupu'ya lipozom hazırlama (SSKD, DKB), doku hasadı (MAM, JCG) ve akış sitometri boyama ve numune edinme (AU, PS, CM) konusundaki yardımları için teşekkür eder. Bu çalışma AstraZeneca, R01HL 136098, R01HL 141123 ve R01HL 148109, AHA 16PRE30770007 ve T32 HL007284 hibeleri ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
Referanslar
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır