Method Article
형광 염료 표지 리포솜의 In Vivo Tissue-Specific Cellular Uptake의 준비, 투여 및 평가
요약
이 프로토콜의 목표는 형광 표지된 리포솜을 합성하고 유세포 분석을 사용하여 세포 수준에서 리포솜의 생체 내 국소화를 식별하는 것입니다.
초록
특히 표적 치료 접근법을 위해 생체 내에서 화합물을 전달하기 위해 리포솜을 사용하는 것에 대한 관심이 증가하고 있습니다. 리포솜 제형에 따라 리포솜은 신체의 다른 세포 유형에 의해 우선적으로 흡수될 수 있습니다. 이는 상이한 질환의 진행이 조직- 및 세포-유형-특이적이기 때문에 치료용 입자의 효능에 영향을 미칠 수 있다. 이 프로토콜에서는 DSPC, 콜레스테롤, PEG-2000 DSPE 및 지질 염료 DiD를 형광 표지로 사용하여 리포솜을 합성하고 형광 표지하는 한 가지 방법을 제시합니다. 이 프로토콜은 또한 생체 내에서 리포솜을 전달하고 유세포 분석을 사용하여 리포솜의 세포 특이적 흡수를 평가하기 위한 접근 방식을 제시합니다. 이 접근법은 리포솜을 흡수하는 세포 유형을 결정하고 세포 유형 및 조직 전반에 걸쳐 리포솜 흡수의 분포와 비율을 정량화하는 데 사용할 수 있습니다. 이 프로토콜에는 언급되지 않았지만 세포계의 면역형광 및 단일 세포 형광 이미징과 같은 추가 분석은 세포내 염색을 평가할 수 있으므로 모든 결과 또는 결론을 강화할 것입니다. 프로토콜은 관심 조직에 따라 조정해야 할 수도 있습니다.
서문
나노입자 약물 전달을 활용한 치료법 개발에 대한 관심이 높아짐에 따라 입자 분포 및 흡수를 준비하고 평가하는 방법은 계속해서 발전, 확장 및 연구 커뮤니티에서 접근할 수 있어야 합니다 1,2. 이 프로토콜은 과산화소체 증식제 활성화 수용체(PPAR)-α/γ 작용제인 테사글리타자르(tesaglitazar)가 로드된 DiD 표지 리포솜으로 처리한 후 생체 내에서 리포솜을 흡수한 정확한 세포 유형을 평가하기 위해 개발되었습니다 3,4. 이 연구에서 우리는 리포솜 테사글리타자르 치료에 의해 직접적인 영향을 받는 세포 유형, 표적 모이어티의 효능을 평가하고 관찰한 치료 결과를 설명하기 위한 가설을 생성할 수 있었습니다. 또한, 다양한 세포 유형에서 확립된 생물학적 기능은 대식세포, 수지상 세포 및 간 특이적 쿠퍼 세포와 같은 식세포가 리포솜의 대부분을 차지한다는 것을 시사합니다 5,6,7. 이 프로토콜을 활용하여 우리는 비고전적 식세포도 리포솜 3,4를 흡수할 수 있음을 입증했습니다.
이 프로토콜은 테사글리타자르를 가용화하고, 역상 증발에 의해 리포솜을 준비하고, 원격 약물 로딩을 위한 유인제로 칼슘 아세테이트를 사용하기 위한 최적화된 방법을 제시합니다. 제시된 방법은 많은 실험실에서 접근할 수 있으며 고온이 필요한 구하기 어려운 재료와 단계가 부족합니다. 이 프로토콜은 생체 내 순환 증가에 최적인 크기의 리포솜을 생산한다8. 또한, Su et al.에 의해 요약된 바와 같이, 현재까지 생체 내 리포솜 분포 및 조직 흡수를 평가하는 방법이 깊이9에서 연구되고 테스트되었습니다. 양전자 방출 단층 촬영 (PET), 자기 공명 영상 (MRI) 및 형광 분자 단층 촬영 (FMT) 방법을 사용하여 조직 특이 적 생체 분포 및 흡수를 정량화합니다 9,10,11. 이러한 방법은 생체 내 검출을 극대화하도록 최적화되었지만 세포 분해능에서 생체 내 리포솜 흡수를 정량화하는 능력은 여전히 부족합니다. 여기에 제시된 프로토콜은 유세포 분석을 사용하여 이러한 요구를 달성하는 것을 목표로 합니다. 마지막으로, 이 프로토콜의 경우 세포 흡수를 지방 조직을 포함한 몇 가지 조직으로 좁혔습니다. 비만, 신진 대사 장애 및 염증 12,13,14,15,16,17의 환경에서 치료법을 전달하기 위해 나노 입자를 사용할 가능성을 조사하는 문헌이 늘어나고 있습니다. 따라서 우리는 이러한 병리에서 중요한 역할을 하는 조직 중 하나인 지방 조직을 처리하고 분석하기 위한 효과적인 방법과 프로토콜을 공유하는 것이 중요하다고 느꼈습니다.
프로토콜
이 프로토콜의 모든 단계는 버지니아 대학교 동물 관리 및 사용 위원회의 승인을 받았으며 지침을 따릅니다.
참고: 이후 분석 단계를 위해 고려해야 할 몇 가지 중요한 대조군이 있으며, 이는 표 1 에 요약되어 있으며 리포솜 투여 전에 고려해야 합니다.
1. 칼슘 아세테이트 및 tesaglitazar가 적재된 형광 표지 리포솜의 제조
- DSPC(1,2-디스테아로일-sn-글리세로-3-포스포콜린), 콜레스테롤, PEG-2000-DSPE 및 DiD를 결합합니다. 이를 위해 DSPC, 콜레스테롤 및 PEG-2000 DSPE를 2:1:1의 질량비로 혼합합니다. 리포솜 1mL당 DiD 1mg 농도로 DiD 지질 염료를 추가합니다(DSPC:DiD의 몰비 46:1).
참고: DiD는 1,1'-디옥타데실-3,3,3',3'테트라메틸인도카르보시아닌 염료의 약어로 인정됩니다. 이 제형에 사용되는 DSPC와 동일한 길이의 두 개의 옥타데실 "지방 꼬리"가 있기 때문에 대부분 지질막에 통합되어야 합니다. 디오(DiO), 디디(DiD), 디이(DiI)와 같은 지질 염료는 리포솜 연구에 일상적으로 사용되며8 이들은 교환할 수 없는 것으로 간주된다18. - 반전 상 에멀젼 및 리포솜 준비를 위해 20mL 섬광 바이알을 사용합니다. 이 바이알에서 지질의 2:1 에테르-클로로포름 용액과 아세트산 칼슘(Ca-아세테이트, 1M, pH 7.4)을 혼합합니다. 유기상과 수성상 사이의 비율은 4:1이어야 합니다(예: 유기상 4mL 및 수성상 1mL).
- 에테르-클로로포름 용액을 실온에서 30초 동안 초음파 처리하여 지질을 유화합니다. 초음파 처리기를 20KHz 및 50% 전력으로 작동하고 1/2인치를 사용합니다. 탐침.
알림: 거품을 피하기 위해 초음파 처리기 프로브의 끝을 바이알 바닥에 더 가깝게 유지하십시오. 초음파 처리 중에 프로브 팁으로 유리를 만지지 마십시오, 깨질 수 있습니다. 또한, 클로로포름은 보조 용매로서 에테르에 첨가 될 필요가 있습니다 : 콜레스테롤의 존재 하에서, 에테르 전용 에멀젼은 빠르게 분리되어이 단계의 절차를 불가능하게 만듭니다. - 균질화된 유중수 에멀젼이 담긴 바이알을 특수 어댑터, 압력계 게이지 및 압력 조절 밸브가 있는 회전 증발기에 즉시 놓습니다. 증발기는 유기 용매를 제거하기 위해 진공 라인에 연결되어야 합니다. 회전 속도를 100rpm으로, 진공을 0.5기압으로 설정하고 에멀젼 발포가 과도해 보이면 해제합니다. 젤이 형성되고 사라진 후 진공을 0.9 기압으로 높입니다.
알림: 휘발성 유기상을 제거하는 동안 바이알에서 회전 증발기 본체로 내용물 손실이 발생할 수 있으므로 빠른 거품을 방지하기 위해 진공 수준을 점진적으로 조정해야 합니다. 결국, 에테르와 클로로포름이 부분적으로 증발하고 수성 용매와 유기 용매 상 사이의 부피 비율이 1 : 1에 가까워지면 겔이 형성됩니다. 증발은 겔이 사라지고 남아있는 수성 매질이 다시 완전히 액체가 될 때까지 계속되어야합니다. 추가 혼합은 유기 용매 제거를 가속화하는 데 도움이 될 수 있습니다. 이는 폴리테트라플루오로에틸렌 교반 막대를 증발 플라스크에 배치하여, 회전 증발 동안 점성 겔의 대류를 향상시킴으로써 달성될 수 있다. - 트랙 에칭된 폴리카보네이트 멤브레인을 사용하여 생성된 리포솜을 여과하여 균일한 크기 분포를 달성합니다.
- 두 개의 기밀 주사기가 장착된 리포좀 압출기에서 200nm-공극 폴리카보네이트 필터를 통해 리포좀 수성 분산액을 앞뒤로 여러 번 통과시켜 여과를 수행합니다.
참고: 더 작은 주사기(예: 0.5mL)는 여과를 위한 충분한 압력 생성을 보장하기 때문에 선호됩니다. 리포솜 막의 콜레스테롤 함량이 높으면 고온이 필요하지 않으며 실온에서 시술을 수행 할 수 있습니다. 홀수 번의 여과(예를 들어, 21)가 수행되어, 생성된 물질이 처음부터 필터의 반대편에 있게 되고, 사전 멸균된 경우, 여과된 크기 조절된 리포좀의 멸균 샘플이 수집될 수 있다. 생성된 리포솜의 크기는 전형적으로 선택된 필터 공극 크기에 가깝다. 두 개의 필터를 쌓아서 입자 크기를 낮추기 위해 미세 조정을 수행할 수 있습니다. - 동적 레이저 광 산란(DLS)을 사용하여 크기 분포를 확인합니다.3,4.
- 4개의 투명한 면이 있는 1cm 큐벳에 1-3mL의 식염수를 추가합니다. 여기에 리포솜 10-201220μL를 넣고 조심스럽게 섞는다. 샘플을 장치에 넣고 측정하기 위해 다음 매개 변수를 선택하십시오 : 용매 점도, 굴절률, 지질의 굴절률. 시작 버튼을 클릭합니다. 측정은 몇 분 동안 지속되며 100회 이상의 실행으로 구성됩니다.
- 두 개의 기밀 주사기가 장착된 리포좀 압출기에서 200nm-공극 폴리카보네이트 필터를 통해 리포좀 수성 분산액을 앞뒤로 여러 번 통과시켜 여과를 수행합니다.
- 탈염 스핀 컬럼을 사용하여 외부 Ca-아세테이트를 제거합니다. 배치의 절반에 수성 테사글리타자르를 10mM HEPES 완충액(pH 7.4)에 넣고 37°C에서 1시간 동안 혼합하면서 배양합니다. 배치의 후반부를 약물이 없는 대조군 리포솜 제형으로 사용합니다.
참고: 사용하기 전에 2mL 탈염 스핀 컬럼을 10mM HEPES 완충액, pH 7.4로 사전 평형화합니다. 이렇게 하려면 HEPES 버퍼 1mL를 컬럼에 넣고 1000 x g 의 원심분리기에서 2분 동안 회전시킵니다. 통과 버퍼를 제거하고 이 작업을 네 번 반복합니다. - 2mL 스핀 컬럼을 사용하여 리포솜에서 갇히지 않은 tesaglitazar를 제거하고 갇힌 약물의 농도를 분광광도계로 결정합니다.
- 건조 컬럼 겔 베드에 0.5mL 이하의 리포솜 샘플을 추가하고 모든 샘플이 겔에 들어갈 때까지 기다립니다. 이전과 정확히 동일한 조건(1000 x g, 2분)에서 원심분리하고 소분자 질량 화합물로부터 정제된 통과 리포솜 샘플을 수집합니다.
- 최종 입자 특징 정량화: pH 7.4 및 25°C에서 결합된 DLS-전기영동 광산란(ELS) 시스템 3,4와 함께 DLS 및 제타 전위를 사용하여 입자 크기 및 농도를 정량화합니다.
- 1.5.2단계와 유사하게, 측정 완충액(예: 완충액 1mL당 리포솜 10μL)의 리포솜 분산액을 일회용 Luer 주사기 또는 절단된 팁이 있는 피펫을 사용하여 U자형 큐벳에 희석합니다. 전류 흐름에 대한 중단 없는 솔루션이 있도록 "U"에 기포가 없는지 확인하십시오.
- 큐벳을 장치에 넣습니다(전극이 장치에 제대로 연결되도록 큐벳의 앞면과 뒷면에 주의하십시오). 기기 도어를 닫으십시오. 그 후, 측정은 안내 소프트웨어의 제어하에 (여러 번 반복하여) 이루어집니다.
2. 생체 내 투여를 위한 리포좀 준비
- 생물 안전 캐비닛에서, 생체 내 투여를 위해 50 μL의 최종 부피로 멸균 식염수에 리포좀을 적절한 농도로 희석한다.
참고: 이전 연구에서 우리의 리포솜 제제에는 약 4.89μmol의 tesaglitazar/mL에 해당하는 2mg/mL의 tesaglitazar가 포함되어 있었고 1μmol 약물/kg의 용량으로 리포솜을 투여했습니다. 40g 마우스의 경우 8.2μL의 리포솜을 식염수에서 최종 부피 50μL까지 가져옵니다. DLS/ELS를 사용하여, 약물 로딩 리포솜과 비교하여 마우스 체중 그램당 동일한 수의 비히클 리포솜이 투여되도록 하기 위해 약물 로딩 및 비히클 로딩 리포솜의 제조를 위해 단위 부피당 리포솜의 수를 정량화해야 합니다. - 리포솜 용액을 생물 안전 캐비닛의 27G 바늘에 넣습니다. 차가운 용액을 마우스에 주입하지 않도록 실온에 보관하십시오.
3. retro-orbital 정맥 주사를 통해 리포솜을 투여합니다.
참고: 선호하는 경우 꼬리 정맥 주사와 같은 다른 방법으로 정맥 주사를 수행하는 것도 적절합니다. 이 프로토콜에서 다루지는 않지만 이 방법(19 )을 설명하는 공개된 프로토콜을 사용할 수 있습니다.
- 리포솜을 전달하기 위한 작업 공간을 설정합니다.
- 70% 에탄올로 작업대를 청소하십시오. 이소플루란 마취 시스템을 사용할 수 있는 공간을 선택해야 합니다.
- 보온 패드를 켜고 그 위에 깨끗한 패드나 수건을 올려 마우스를 깨끗한 표면에 유지합니다. 마우스로 작업을 시작하기 전에 패드가 예열될 때까지 충분한 시간을 두십시오.
- 챔버가 근처에 있고 코 콘이 온난화 패드에 있도록 마취 시스템을 설정하십시오.
- 시스템의 다른 모든 측면이 준비되었는지 확인하십시오(예:ample, 기화기에서 이소플루란 수준이 충분히 높고, 숯 필터의 무게가 측정되었으며, 튜브가 올바르게 연결됨).
- 프로토콜의 이 섹션에 필요한 다른 재료(안과용 윤활제 젤, 투여 후 치료를 위한 국소 마취제, 멸균 거즈 패드)를 수집하십시오.
- 유도 챔버에서 이소플루란을 사용하여 마우스를 진정시킵니다. 부드러운 발 탭에 반응하지 않으면 노즈 콘을 통해 진정 작용을 유지하면서 마우스를 작업 공간으로 빠르게 옮깁니다.
참고: 동물은 1.5%에서 2.5% 이소플루란으로 유지되어야 하며 절차를 진행하기 전에 적절한 마취 깊이(발가락 꼬집음에 대한 반응 부족을 통해)를 평가해야 합니다. - 리포솜 투여를 위해 마우스를 한쪽으로 이동합니다. 마우스는 마취 중에 눈을 깜빡이지 않기 때문에 나머지 시술 동안 양쪽 눈에 소량의 안과용 윤활제를 바르면 촉촉한 상태를 유지할 수 있습니다.
- 노출된 눈 위와 아래 피부를 부드럽게 눌러줍니다. 눈은 얼굴의 평면 위로 들어 올려 야합니다.
- 바늘 끝을 내측 안각에 조심스럽게 삽입하여 바늘이 눈 아래에 있는지 확인하고 만지지 않도록하십시오. 바늘이 눈 아래에 삽입되면 리포솜을 안와 후 공간에 천천히 주입합니다. 바늘을 빼면 지혈을 위해 몇 초 동안 눈꺼풀을 닫아야 할 수도 있습니다.
- 바늘을 충분히 삽입하지 않으면 용액이 눈 주위에 나타날 수 있습니다. 이것이 보이면 즉시 주사를 중단하고 바늘의 위치를 바꾸십시오.
- 프로파라카인과 같은 국소 마취제를 눈에 바르면 시술 후 통증과 불편함을 예방할 수 있습니다.
- 마우스를 보온 패드에 놓고 깨어날 때까지 모니터링하여 마우스가 건강하고 적절한 체온을 유지하는지 확인하십시오.
- 관심 지점이 도착할 때까지 마우스를 케이지와 정상적인 주거 환경으로 되돌립니다.
참고: 이 작업은 현지 IACUC 지침에 따라 수행해야 합니다.
4. 조직 채취, 조직 처리 및 유세포 분석을 위한 재료 준비
- 수확, 가공 및 염색을 위한 용액 준비(섹션 5\u20127): 인산염 완충 식염수(PBS)-헤파린, HEPES 완충액, 2mg/mL 콜라게나제 유형 I, AKC 용해 완충액, FACS 완충액, PBS, 고정 완충액(표 2). 시술 중 고정 완충액을 제외한 모든 용액을 4°C 또는 얼음 위에 보관하십시오.
- 조직을 수확하고 처리하기 위해 완충액 및 기타 재료가 있는 튜브를 준비합니다.
- 각 마우스의 혈액에 대해 10μL의 0.5M EDTA를 1.5 또는 1.7mL 미세 원심분리 튜브에 추가하여 혈액을 수집합니다. EDTA는 혈액이 응고되는 것을 방지합니다. 25G 바늘과 15mL 원뿔형 튜브가 있는 1mL 주사기도 필요합니다.
- 비장의 경우 비장당 1mL의 HEPES 완충액, 1mL 주사기, 50mL 원추형 튜브 2개, 70μm 필터 2개가 있는 1.5mL 또는 1.7mL 미세원심분리기 튜브 1개를 수집합니다.
- 각 지방 조직 저장소에 대해 조직을 다지기 위한 1.5mL의 HEPES 완충액이 포함된 20mL 폴리에틸렌 바이알, 50mL 원뿔형 튜브 및 마우스당 지방 조직 유형당 70μm 필터를 수집합니다.
- 수확을위한 작업 공간을 준비하십시오.
- 70% 에탄올로 벤치 공간을 청소합니다. 수확하는 동안 마우스를 고정할 수 있는 고무 트레이를 70% 에탄올로 닦아내고 흡수성 패드나 종이 타월로 덮어 준비합니다. 최소 5개의 핀을 사용할 수 있는지 확인하십시오.
- 10mL 주사기에 PBS-헤파린을 채우고 관류를 위해 25G 바늘에 고정합니다.
- 수확하는 동안 사용할 도구와 재료를 모으십시오. 겸자(2쌍), 가위, 종이 타월, 보푸라기가 없는 물티슈, EDTA가 있는 미세 원심분리기 튜브, HEPES 버퍼가 있는 미세 원심분리기 튜브, HEPES 버퍼가 있는 폴리에틸렌 바이알이 필요합니다.
5. 조직 채취
- 마우스를CO2 질식으로 안락사시킨다. 경추 탈구는 이후 단계에서 효과적인 혈액 수집 및 조직 관류를 방해할 수 있으므로 수행하지 마십시오.
- 마우스를 잘 볼 수 있는 충분한 작업 공간과 조명이 있는 깨끗한 벤치 공간에 고무 해부 트레이, 샘플을 보관할 얼음 양동이, 70% 에탄올이 함유된 스프레이 병을 설치합니다. 마우스에 70% 에탄올을 분사하여 오염을 줄이고 모발 퍼짐을 조절합니다. 고무 트레이에 마우스를 등을 대고 몸에서 멀리 뻗은 발을 고정합니다.
- 혈액 채취를 준비하려면 마우스 흉곽의 꼬리 끝 가장자리에서 피부를 조심스럽게 절개하십시오. 가슴 근육이 노출될 때까지 쥐의 머리 쪽으로 작은 직선(약 1cm)을 자릅니다.
- 초기 절개 부위에서 머리를 향한 선에 수직으로 두 개의 작은 절단을 만듭니다. 그런 다음 노출된 부위의 흉곽 한쪽에 있는 가슴 근육을 조심스럽게 잘라냅니다. 이를 통해 바늘을 삽입해야 하는 위치에 대한 더 나은 접근과 시각화가 가능합니다.
- 혈액을 채취하려면 근육이 제거 된쪽의 세 번째와 네 번째 갈비뼈 사이에 바늘을 삽입하십시오. 마우스의 심장은 흉강 중앙에 있으므로 바늘을 흉곽의 중심선에 최대한 가깝게 유지하십시오. 삽입되면 주사기를 부드럽게 당겨 혈액 수집을 시작합니다.
- 일단 수집되면, EDTA와 함께 준비된 미세 원심 분리기 튜브에 혈액을 옮기고 얼음에 보관하십시오.
알림: 약 100μL의 부피를 끌어올렸고 주사기에 혈액이 들어가지 않으면 바늘 구멍이 심장 벽에 눌려질 경우를 대비하여 주사기를 오른쪽이나 왼쪽으로 돌려보십시오. 이것이 도움이되지 않으면 바늘을 천천히 흉강 안으로 더 옮기거나 제거를 시작하십시오. 이 시점에서 주사기에 혈액이 모이기 시작하면 주사기를 천천히 뒤로 당깁니다. 성공적인 추출을 위해 주사기와 바늘을 회전시키는 것이 좋습니다. 마지막으로, 혈액이 채취되지 않으면 심장을 놓쳤을 수 있으므로 바늘을 제거하십시오. 바늘을 다시 삽입하고 앞서 언급한 과정을 다시 반복해 보십시오.
- 다음으로, 마우스를 관류하기 위해 흉강을 열어 심장에 접근하십시오.
- 이렇게하려면 흉곽 끝을 따라 피부를 양쪽의 마우스 쪽까지 자릅니다. 그런 다음 집게를 사용하여 흉골을 작업 표면에서 멀리 유지합니다. 흉골 끝 바로 아래에 작고 얕은 절개를 하여 복강을 절단합니다. 마우스 양쪽의 흉곽 끝을 따라 복막을 따라 자릅니다. 이것은 간과 담낭을 노출시켜야합니다. 이 조직들 중 하나를 자르지 않도록주의하십시오.
- 다음으로, 간에서 두개골로 횡격막에 작고 얕은 절단을하십시오. 그런 다음 흉곽의 가장자리를 따라 횡격막을 잘라 흉강을 엽니다. 흉강 내의 장기를 절단하지 마십시오.
- 흉곽을 따라 마우스 중심선에서 약 2-3mm, 길이 약 0.75cm의 머리를 향해 두 번 자릅니다.
알림: 너무 높게 절단하면 흉곽 상단에 있는 동맥이 절단됩니다. 이것은 관류의 효능을 방해합니다. - 흉곽의 중앙 부분을 들어 올려 흉강을 노출시킵니다. 심장에 접근하기 위해 지방이나 조직을 멀리 옮기십시오.
- 쥐 심장의 우심방에 작은 절개를 만들어 혈액을 밀어낼 수 있는 구멍을 만듭니다.
- PBS-헤파린 10mL 주사기를 사용하여 마우스 심장의 좌심실에 바늘을 삽입합니다.
- 가능한 한 천천히 PBS를 심장에 부드럽게 밀어 넣으십시오.
참고: 혈액이 우심방에서 나와 흉강을 채우는 것을 관찰해야 합니다. 심장에서 대동맥을 통해 PBS- 헤파린의 흐름을 억제하지 않도록 심장을 생리적 위치에 유지하십시오. - PBS-헤파린 10mL가 모두 마우스를 통해 관류되면 주사기와 바늘을 버리고 종이 타월이나 보푸라기가 없는 물티슈를 사용하여 흉강에서 과도한 혈액과 PBS-헤파린을 제거합니다.
- 다음으로, 조직 추출을 시작하려면 마우스의 꼬리 쪽으로 피부와 복막을 잘라 복강을 엽니다.
- 먼저, 마우스의 양쪽에서 사타구니 지방 조직 패드를 추출합니다.
참고: 이 과정을 주의 깊게 읽으십시오: 결과에서 지방 조직 세포 구성이 왜곡되지 않도록 각 저장소에서 사타구니 림프절을 추출해야 합니다.- 두 번째 집게를 사용하여 한 세트의 집게로 복막을 잡고 다른 집게와 함께 그 쪽의 막 위에 겹쳐진 피부 가장자리를 잡습니다. 복막에서 피부를 부드럽게 당겨 이 층을 서로 분리합니다. 피부를 따라 사타구니 지방 조직 저장소를 찾으십시오. 지방 저장소에 더 잘 접근할 수 있도록 피부의 바깥쪽 가장자리를 고정합니다.
- 추출하기 전에 지방 저장소 중앙에 사타구니 림프절을 찾아 필요에 따라 집게와 가위를 사용하여 제거합니다.
알림: 가능하면 저장소의 바깥쪽 가장자리에서 중앙으로 이어지는 세 개의 더 큰 동맥을 찾습니다. 림프절은 이러한 동맥이 만나는 곳 주변에 있습니다. - 림프절을 제거한 후 집게로 고정 지점에 가장 가까운 지방 저장소의 끝을 조심스럽게 잡고 지방 조직과 피부 사이의 결합막을 작게 절개하기 시작합니다. 멤브레인에 더 잘 접근할 수 있도록 절단하는 동안 지방 조직을 피부에서 들어 올리고 전체 저장소가 추출되도록 합니다.
- 얼음 위에 hepes 완충액이 든 준비된 폴리에틸렌 바이알에 지방 저장소를 넣어 나머지 수확 기간 동안 조직이 생존 할 수 있도록 유지합니다.
- 마우스의 다른 쪽에서 이 과정을 반복하여 두 저장소를 모두 추출합니다. 창고는 함께 또는 별도로 소화 및 처리 할 수 있습니다. 각 저장소를 별도로 처리해야 하는 경우 더 많은 튜브를 준비해야 합니다.
- 다음으로, 복강의 꼬리 끝에서 부고환 지방 저장소를 추출합니다. 집게를 사용하여 마우스의 등쪽 끝에서 첫 번째 부고환 지방 저장소를 부드럽게 당기고 이 저장소에 부착된 부고환과 정관을 찾습니다.
참고: 두 개의 부고환 지방 저장소가 있습니다: 하나는 각 부고환과 정관에 부착되어 있습니다.- 지방 저장소와 부고환 사이를 조심스럽게 자르고 정관을 통해 지방을 다른 조직과 분리합니다. 얼음 위에 hepes 완충액이 든 폴리에틸렌 바이알에 지방 저장소를 넣어 나머지 수확 기간 동안 조직이 생존 할 수 있도록 유지합니다.
- 마지막으로 횡격막 근처의 위 왼쪽에서 발견되는 비장을 추출합니다. 집게를 사용하여 위를 복강 중앙쪽으로 부드럽게 당겨 비장을 노출시킵니다.
- 비장의 한쪽 끝을 부드럽게 잡고 위에서 약간 잡아 당깁니다. 장기가 분리 될 때까지 비장과 인접 조직 사이의 막을 자릅니다. HEPES 완충액이 든 준비된 미세 원심 분리기 튜브에 비장을 넣고 얼음에 보관하십시오.
- 조직을 처리하거나 다음 마우스에서 조직을 채취하기 전에 시체와 더러워진 종이 타월 또는 패드를 버리십시오. 도구도 닦아냅니다.
참고: 마우스가 여러 개인 경우 다음 처리 단계로 이동하기 전에 각 마우스에 대해 이러한 수확 단계를 반복합니다. 대조군 마우스/마우스가 포함된 경우 오염을 방지하기 위해 리포솜 처리 마우스보다 먼저 수확하는 것이 좋습니다.
6. 공정 조직
참고: 지방 조직은 소화 배양 기간이 길기 때문에 먼저 해당 과정을 시작하여 소화 기간 동안 혈액과 비장을 처리하는 작업을 하는 것이 좋습니다.
- 먼저 지방 조직을 다지고 소화합니다. 하나 또는 두 쌍의 가위를 사용하여 조직이 크기가 0.5mm 미만인 작은 조각이 될 때까지 각 폴리에틸렌 바이알에서 지방 조직을 다집니다. 이를 통해 보다 효율적인 소화가 가능합니다.
- 모든 바이알의 조직을 다진 후 각 바이알에 1.5mL의 2mg/mL Collagenase 버퍼를 추가합니다. 바이알을 37°C 및 150 rpm으로 설정된 진탕 인큐베이터에 넣습니다. 30-45 분 동안 배양하십시오.
참고: 지방 조직이 특히 큰 경우 바이알에 0.5mL에서 1.5mL의 HEPES 완충액과 동일한 부피의 콜라게나제 완충액을 추가하여 조직이 완전히 잠기고 충분한 효소가 존재하는지 확인하는 것이 좋습니다. 소화 시 Collagenase Type I의 최종 농도는 최종 용액 부피에 관계없이 1mg/mL여야 합니다. 또한, 진탕 배양기를 사용할 수 없는 경우 샘플을 37°C로 가열된 수조에 넣을 수 있습니다. 샘플을 5분마다 부드럽게 흔들어 혼합하고 소화를 다시 일시 중단합니다. - 30분에 샘플을 확인하십시오. 1mL 피펫을 사용하여 샘플을 위아래로 피펫팅합니다. 조직 조각이 여전히 너무 커서 쉽게 피펫팅할 수 없는 경우 샘플을 추가로 15분 동안 인큐베이터로 되돌립니다.
- 샘플이 완전히 소화되면 샘플을 계속 위아래로 10회 피펫하여 단일 세포 현탁액이 생성되었는지 확인합니다.
알림: (선택 사항) s를 확인하십시오.amp30분에서. 1mL 피펫을 사용하여 샘플을 위아래로 피펫팅합니다. 조직 조각이 여전히 너무 커서 쉽게 피펫팅할 수 없는 경우 샘플을 추가로 15분 동안 인큐베이터로 되돌립니다. - 세포 현탁액을 70μm 필터를 통해 50mL 원뿔형 튜브에 피펫합니다. 빈 소화 바이알에 FACS 버퍼 5mL를 추가하여 바이알을 씻어냅니다. 이 세척 버퍼를 필터를 통해 옮겨 세포 현탁액에 추가합니다.
- 다른 샘플이 처리되는 동안 얼음에 보관하십시오. 모든 샘플이 여과되면 400 x g, 4°C에서 5분 동안 회전시킵니다.
- 흡인에 의해 지방세포 상층액을 제거한 후 흡인에 의해 지방세포 상층액과 펠렛 사이의 하층부를 조심스럽게 제거하여 기질-혈관 분획(SVF) 펠렛을 남겼다.
- 이 펠릿을 1mL의 FACS 버퍼에 재현탁하고 깨끗한 1.5mL 또는 1.7mL 미세 원심분리기 튜브로 옮깁니다. 원하거나 필요한 경우 지금 부분 표본 셀. 모든 샘플이 유세포 분석 염색을 위해 준비될 때까지 얼음 상태를 유지하십시오.
참고: 소화된 지방 저장소가 큰 경우 유세포 분석 염색 및 분석을 위해 샘플의 50% 또는 25%만 사용하는 것이 좋습니다. 또한 유세포 분석을 위한 형광 마이너스 원(FMO) 대조군 또는 추가 대조군(표 1)이 필요한 경우 처리를 위해 추가 샘플을 별도의 튜브에 분취해야 합니다. FMO는 실험에 사용된 완전한 패널 내에서 개별 형광단 접합 항체에 대한 음성 신호와 양성 신호를 구별하는 데 사용됩니다.
- 모든 바이알의 조직을 다진 후 각 바이알에 1.5mL의 2mg/mL Collagenase 버퍼를 추가합니다. 바이알을 37°C 및 150 rpm으로 설정된 진탕 인큐베이터에 넣습니다. 30-45 분 동안 배양하십시오.
- 둘째, 혈액을 처리하십시오.
- 50μL의 혈액을 15mL 원뿔형 튜브로 옮깁니다.
- 각 튜브에 AKC 용해 완충액 1mL를 넣고 위아래로 피펫하여 단일 세포 현탁액에 도달합니다. 각 튜브에 AKC 용해 완충액 4mL를 추가로 추가하고 5-10분 동안 배양합니다. 셰이커 또는 로테이터를 사용할 수 있는 경우 튜브 캡을 단단히 밀봉하고 이들 중 하나에 튜브를 놓아 혼합을 향상시킵니다.
- 5mL의 FACS 완충액을 첨가하여 용해 과정을 소멸시키고 샘플을 400 x g, 4°C에서 5분 동안 회전시킵니다. 상층액을 제거하고 펠릿을 확인하십시오. 여전히 빨간색이면 용해 과정을 반복하십시오. 그렇지 않으면 펠릿을 1mL의 FACS 완충액에 재현탁하고 깨끗한 1.5mL 또는 1.7mL 미세원심분리기 튜브로 옮깁니다. 모든 샘플이 유세포 분석 염색을 위해 준비될 때까지 얼음 상태를 유지하십시오.
- 마지막으로 비장을 처리하십시오. 비장을 50mL 원뿔형 튜브를 통해 70μm 필터로 옮깁니다. 1mL의 FACS 완충액으로 조직을 세척한 다음 1mL 주사기의 플런저 끝을 사용하여 필터를 통해 비장을 으깬다. 매싱 공정 전반에 걸쳐 더 많은 FACS 버퍼를 사용하여 세포를 50mL 원뿔형 튜브로 세척합니다. 원추형 튜브의 최종 부피는 10mL여야 합니다.
- 세포를 4°C에서 300 x g 에서 5분 동안 회전시킵니다. 상층액을 제거하고 AKC 용해 완충액 1mL에 재현탁합니다. AKC 용해 완충액 4mL를 추가로 추가하고 5분 동안 배양합니다. 5mL의 FACS 완충액을 첨가하여 용해 공정을 소멸시키고 샘플을 4°C에서 300 x g에서 5분 동안 회전시킵니다.
- 상층액을 제거하고 펠릿을 1mL의 FACS 완충액에 재현탁합니다. 두 번째 깨끗한 70μm 필터를 통해 현탁액을 50mL 원뿔형 튜브로 옮깁니다. 4mL의 FACS 버퍼를 추가하여 원래 튜브를 세척하고 버퍼를 필터를 통해 5mL의 최종 부피로 옮깁니다.
- 50μL의 세포 현탁액을 깨끗한 1.5mL 또는 1.7mL 미세원심분리기 튜브로 옮기고 모든 샘플이 유세포 분석 염색을 위해 준비될 때까지 얼음 위에 보관하십시오. 더 많은 분취량을 원하거나 필요한 경우 추가 분취량을 튜브로 옮길 수 있습니다.
참고: 비장세포는 Live/Dead 단일 염색에 사용하기에 우수한 세포입니다. 이 컨트롤에 대한 추가 부분 표본을 전송하는 것이 좋습니다.
7. 유세포 분석을 위한 조직의 염색 세포
- 분취된 시료를 400 x g, 4°C에서 5분 동안 스핀다운합니다.
- 상층액을 제거하고 50 μL의 Fc Block(희석)에 샘플을 재현탁합니다(표 2). 얼음에서 5분 동안 배양합니다.
- 50 μL의 2x 항체 혼합물(표 3)을 각 샘플에 추가합니다. 어둠 속에서 얼음 위에서 20분 동안 배양합니다.
참고: 단일 얼룩은 이 항체 혼합물로 염색해서는 안 됩니다. 또한 FMO를 사용하는 경우 FMO 항체 혼합물을 별도로 준비해야 합니다. - 시료를 1mL의 PBS로 세척하고 400 x g, 4°C에서 5분 동안 회전시킵니다. 상층액을 제거하고 샘플을 200 μL의 생존도 염색에 재현탁합니다(표 3). 어둠 속에서 얼음 위에서 20분 동안 배양합니다.
참고: 이 단계에서 Live/Dead 단일 염색을 위해 따로 보관된 세포를 염색하는 것을 잊지 마십시오. - 샘플을 1mL의 FACS 완충액으로 세척하고 400 x g, 4°C에서 5분 동안 회전시킵니다. 상층액을 제거하고 샘플을 고정하기 위해 50μL의 고정 배지(시약 A)에 샘플(Live/Dead 단일 염색 제외)을 재현탁합니다. 실온에서 어두운 곳에서 15분 동안 배양합니다.
- 100μL의 2% PFA에 Live/Dead 단일 염색을 재현탁합니다. 어두운 곳에서 실온에서 5분 동안 배양합니다.
- 1mL의 FACS 완충액으로 샘플을 세척하고 800 x g, 4°C에서 5분 동안 회전시킵니다. 상층액을 제거하고 250 내지 500 μL의 FACS 완충액에 샘플을 재현탁한다. 유세포 분석기에서 샘플을 실행할 수 있을 때까지 4°C에서 보관하십시오.
- 샘플을 1mL의 FACS 완충액으로 세척하고 800 x g, 4°C에서 5분 동안 회전시킵니다. 상층액을 제거하고 샘플을 50μL의 투과화 배지(시약 B)와 세포내 단백질에 대한 항체에 재현탁합니다. 실온에서 어둠 속에서 20 분 동안 배양하십시오.
- 샘플을 1mL의 FACS 완충액으로 세척하고 4°C에서 800 x g 에서 5분 동안 회전시킵니다. 상층액을 제거하고 100μL의 2% 파라포름알데히드(PFA)에 샘플을 재현탁합니다. 어두운 곳에서 실온에서 5분 동안 배양합니다.
- 샘플을 1mL의 FACS 완충액으로 세척하고 800 x g, 4°C에서 5분 동안 회전시킵니다. 상청액을 제거하고 250 내지 500 μL의 FACS 완충액에 샘플을 재현탁한다. 유세포 분석기에서 샘플을 실행할 수 있을 때까지 4°C에서 보관하십시오.
결과
리포솜 생산
여기에 게시 된 결과는 이전에 게시 된 작업 3,4,20의 결과와 유사합니다. 여기에 제시된 프로토콜을 활용하여 약 150-150nm 크기의 리포솜을 생산할 것으로 예상합니다. DLS는 163.2 nm의 평균 리포솜 직경과 -19.2 mV의 제타 전위를 나타냅니다(그림 1A). 극저온 전자 현미경(Cryo-EM) 이미징은 원형 리포솜을 보여주며(그림 1B), DLS 다이어그램은 평균 직경에서 상대적으로 작은 표준 편차를 보여줍니다(그림 1C).
양성 리포솜 결합에는 PBS 처리된 대조군이 필요합니다.
이 프로토콜을 사용하는 우리 그룹의 이전 연구에서는 생체 내 투여 1주 후 지방 SVF, 비장 및 혈액의 세포 하위 집합이 리포솜에 결합하는지 조사했습니다 3,4. PBS 처리된 마우스를 사용하여, 복강 및 비장 세포를 리포좀 처리된 마우스로부터의 샘플에 사용된 것과 동일한 항체 패널로 염색하였다. 처리 1주일 후에 조직을 채취하였다(도 2A). PBS 처리된 마우스의 샘플은 양성 DiD 게이트를 생성하는 DiD FMO 역할을 했습니다(그림 2B,C). DiD 양성 신호를 사용하여 포지티브 게이트를 생성할 수 있지만 DiD 신호가 없는 샘플은 양성 게이트에 DiD 음성이 포함되어 있지 않은지 확인하는 데에도 사용해야 합니다.
형광 신호를 최적화하기 위해 적정이 필요합니다
전체 실험을 실행하기 전에 세포 염색 중에 사용되는 형광 접합 항체의 농도 및 리포솜 준비 중에 사용되는 지질 염료의 농도를 포함한 다양한 조건을 최적화해야 합니다. 유세포 분석기는 형광 강도에 대한 검출 상한이 있으므로 리포솜에 너무 많은 염료가 포함되면 세포분석기를 통과하는 샘플에서 정량화할 수 없는 수준의 DiD 신호가 발생합니다. 또한 리포솜에 DiD가 너무 많으면 높은 수준의 비특이적 염료 전달이 발생하여 세포 흡수 결과가 왜곡될 수 있습니다. 그림 3은 사용된 유세포분석기의 검출 범위 내에서 최적의 신호를 생성할 수 있는 농도를 식별하기 위해 지질 염료의 농도를 적정한 실험의 결과를 보고합니다. 이것은 최종 실험을 위해 관심 조직인 혈액(그림 3A), 사타구니 지방 SVF(그림 3B) 및 부고환 지방 SVF(그림 3C)에 대해 수행되었습니다. 테스트를 위해 선택된 농도는 리포솜 1mL당 10mg의 DiD(높음, 빨간색), 1mg DiD(중간, 파란색) 또는 0.1mg의 DiD(낮음, 회색)였습니다. 리포솜에 사용된 최고 농도는 너무 높았고 세 조직 모두에서 세포분석기의 정량화 가능한 범위를 초과했습니다(그림 3A\u2012C, 빨간색). DiD의 가장 낮은 농도는 약간의 신호를 보였지만(그림 3 A\u2012C, 회색), PBS 처리된 세포(그림 3A\u2012C, 검은색)를 넘어서는 명확한 집단은 관찰되지 않았습니다. 정량화할 때 각 조직 및 농도에 대한 DiD MFI의 산술 평균은 PBS 대조군과 DiD 중간 농도 간의 명확한 차이를 보여주었습니다(그림 3D). 따라서 프로토콜에 표시된 대로 리포솜 준비에 사용할 중간 농도(그림 3, 파란색)를 선택했습니다.
다중 항체 패널을 사용하면 서로 다른 세포 하위 집합에 의한 리포솜 흡수를 식별할 수 있습니다
표 3에 요약된 패널을 사용하여, 세포를 대식세포, B 세포, T 세포, 수지상 세포, 단핵구 및 내피 세포에 대한 마커에 대한 항체로 염색하였다(도 4). 각 조직 유형에 대해 약간 다른 게이팅 전략이 필요하지만 각각에서 동일한 세포 유형의 대부분을 식별할 수 있습니다. 일부 예외에는 일반적으로 혈액에서 발견되지 않는 내피 세포와 일반적으로 다른 조직보다 혈액에서 더 높은 빈도를 갖는 단핵구가 포함됩니다. 집단이 식별되면 각 세포 집단의 총 크기와 DiD+ 빈도를 정량화할 수 있습니다. DiD+ 모집단을 특성화하기 위해 추가 계산을 수행할 수 있습니다: DiD+ 세포의 몇 퍼센트가 대식세포, 내피 세포 등인지. 이는 게이팅 전략의 예이지만 샘플을 분석하는 유일한 방법은 아닙니다. 분석은 선택한 패널과 사용 가능한 유세포 분석기에 의해 결정됩니다.
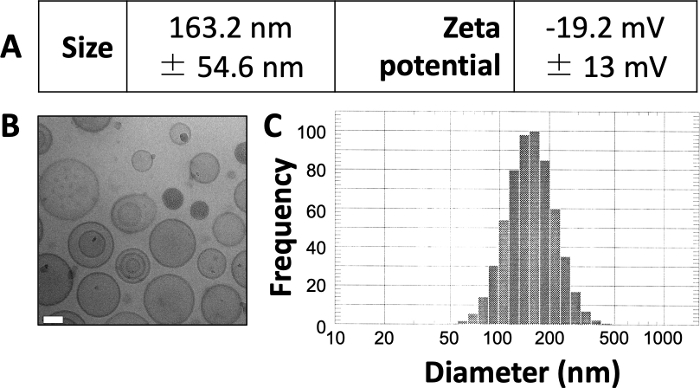
그림 1: 제조된 리포좀의 특성 예.
(A) 크기 및 제타 전위는 전술한 바와 같이 측정되었으며, 표 형태로 보고되었다. 각 모수는 표준 편차± 평균으로 표시됩니다. (B) Cryo-EM을 사용하여 제조된 리포좀을 이미지화했습니다. 흰색 눈금 막대의 길이는 50nm입니다. (C) DLS는 이 프렙에서 리포솜의 직경의 히스토그램을 생성하는 데 사용되었습니다. 이 그림은 Osinski et al.3에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
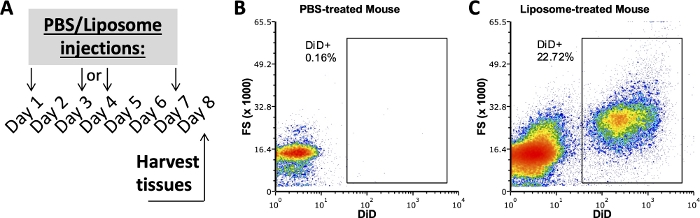
그림 2: PBS 또는 리포솜 처리된 마우스의 대표적인 DiD 염색.
(A) PBS 및 리포솜 치료에 대한 실험적 개략도. PBS 또는 리포솜을 1주일 동안 3회 주사하였다. 조직은 치료 8일째에 적출하였다. (비, 씨) 대표적인 흐름 플롯은 리포솜 처리(C)에서 양성 DiD 염색을 나타내지만 PBS 처리(B) 마우스에서는 그렇지 않습니다. FSC, 전방 산란. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
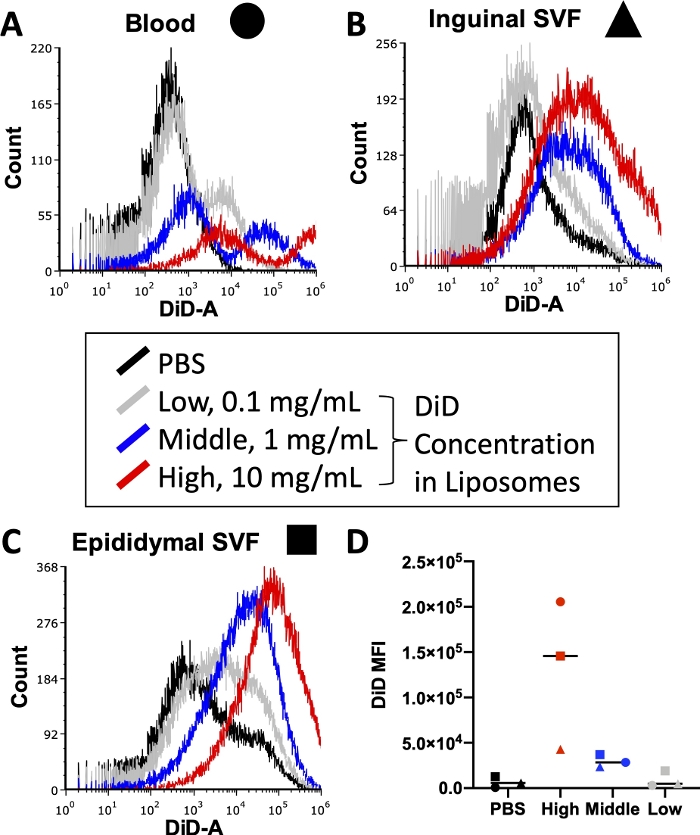
그림 3: 리포솜의 DiD 적정.
리포솜은 세 가지 다른 농도의 DiD로 준비되고 마우스에 주입되었습니다. 회색은 리포솜 1mL당 0.1mg DiD에서 낮은 농도를 나타내고, 파란색은 1mg DiD/mL 리포솜에서 중간 농도를 나타내며, 빨간색은 10mg DiD/mL 리포솜에서 높은 농도를 나타냅니다. PBS 처리된 마우스를 음성 대조군(검정색)으로 사용하였다. 혈액(A, 원), 사타구니 지방(B, 삼각형) 및 부고환 지방(C, 사각형)을 주사 후 24시간 후에 수확하고 처리하여 단세포 현탁액을 분리했습니다. 이 샘플은 유세포 분석기에서 검출 가능한 DiD 수준까지 실행되었습니다. 농도당 형광 강도(A\u2012C)를 입증하기 위해 각 처리 그룹의 오버레이가 있는 조직별 히스토그램이 제공됩니다. DiD의 산술 평균도 각 조직 및 농도에 대해 정량화하고 플롯팅했습니다(D). SSC = 측면 산란. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
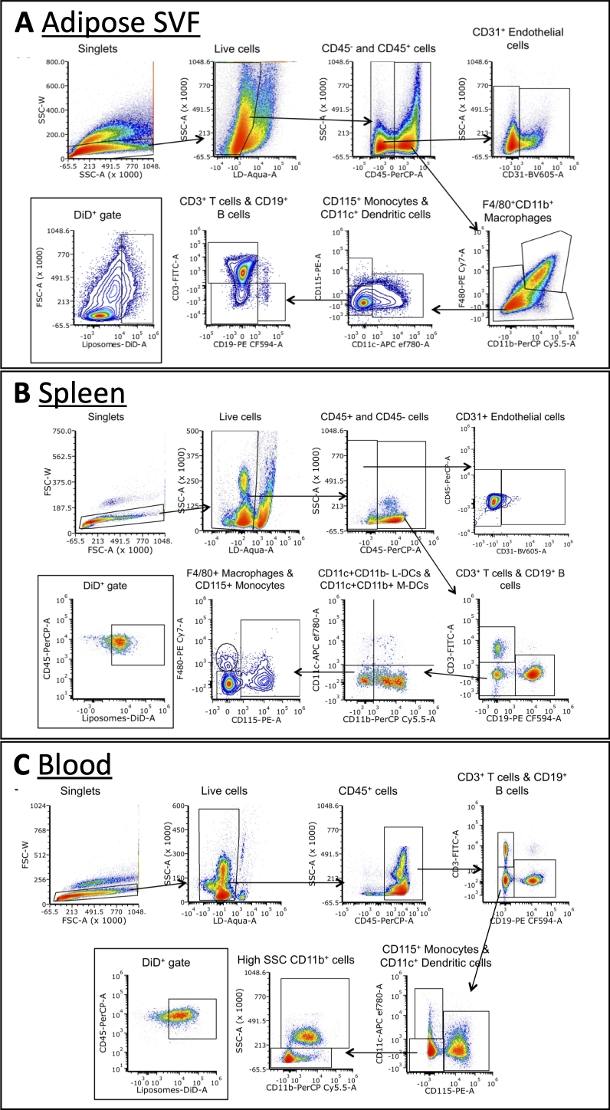
그림 4: 지방 SVF, 혈액 및 비장의 세포 하위 집합에 대한 대표적인 유세포 분석 분석.
(A\u2012C) 지방 SVF(A), 비장(B) 및 혈액(C)에서 세포 하위 집합 및 DiD+ 세포를 식별하기 위한 게이팅 전략의 개략도를 나타냅니다. 약어: FSC = 전방 산란; LD = 살아있는/죽은; L-DCs = 림프성 수지상 세포; M-DCs = 골수 수지상 세포; SSC = 측면 산란. 이 그림은 Osinski et al.3에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 제어 | 목적 |
| PBS 또는 식염수로 치료한 마우스 | 이 마우스의 세포를 사용하여 다음과 같은 유세포 분석 제어를 수행할 수 있습니다. |
| 1. 염색되지 않은 세포 | |
| 2. 살아있는/죽은 단일 얼룩 | |
| 3. 전체 패널로 염색되었지만 분석 중 리포솜 양성 신호를 결정하기 위한 리포솜 형광이 부족한 세포 | |
| 이 / 이 마우스 / 마우스는 실험에서 비 리포솜 대조군을 갖기 때문에 리포솜이 생체 내에서 어떤 영향을 미치는지 확인하는 데에도 사용됩니다. | |
| 언로딩된 리포솜 | 리포솜에 화합물을 로드하는 경우 리포솜 배치의 일부는 화합물 없이 합성되어야 합니다. 이것은 리포솜 단독의 생체 내 효과를 설명합니다. |
| DiD 단독 | DiD는 또한 세포막에 의해 흡수 될 수 있기 때문에, 리포솜에서 발견되는 것과 동일한 양으로 유리 염료를 받기 위해 일부 마우스를 할당하면 배경 막 염색을 설명하는 데 도움이 될 것입니다. |
| FMO(Fluorescence-minus-one) 제어 | 이들은 패널에 있는 항체 중 하나를 제외한 모든 항체로 염색된 세포입니다. 위 상자의 #3과 마찬가지로 분석 중에 해당 항체에 대한 진양성 신호를 결정하는 데 도움이 됩니다 |
표 1: 이 프로토콜에서 사용할 컨트롤
| 용액 | 구성 요소 | 배치/마우스당 필요한 대략적인 부피 |
| 리포솜 준비 | ||
| 칼슘 아세테이트 | H2O중 1 M 칼슘 아세테이트 | 50 밀리리터 |
| hepes 버퍼 | H2O, pH 7.4에서 10 mM HEPES | 50 밀리리터 |
| 헤페스의 테사글리타자르 | 10mM 헤페스에서 | 10 mL |
| 조직 채취, 가공 및 염색 | ||
| 인산염 완충 용액(PBS) | 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4 중 증류된 H2O | 2 밀리리터 |
| PBS-헤파린 | PBS의 0.1 mM 헤파린 | 10 mL |
| hepes 버퍼 | PBS의 20mM HEPES | 5 mL |
| 소화 완충액 | HEPES 완충액의 2mg/mL Collagenase Type I | 5 mL |
| AKC 용해 완충액 | ddH2O, pH 7.2에서 0.158 MNH3Cl, 10 mMKHCO3, 0.1 mMNa2EDTA | 15 mL의 |
| FACS 버퍼 | PBS에서 1% BSA, 0.05%NaN3 | 15 mL의 |
| Fc 블록 (희석) | FACS 버퍼의 1:50 Fc 블록 | 250 μL |
| 고정 버퍼 | PBS의 2% 파라포름알데히드 | 200 μL |
표 2: 준비할 솔루션.
| A | B | C | D |
| 세포외 염색(2x 항체 혼합물) | |||
| 항원 | 형광단 | 100 μL 시험당 Ab 부피 | 필요한 총 볼륨: |
| CD45 (CD45) | 퍼CP | 0.5 μL | 컬럼 C x 1.2 x 총 # 샘플 |
| CD11b입니다 | 퍼씨프 Cy5.5 | 0.25 μL | (0.5 μL/테스트) x (1.2) x (# 샘플) |
| F4/80 키 | PE Cy7 | 0.25 μL | (0.25 μL/테스트) x (1.2) x (# 샘플) |
| CD19 | PE-CF594〈화이트〉 | 1 μL | (0.25 μL/테스트) x (1.2) x (# 샘플) |
| CD3 (영어) | 핏 | 1 μL | (1.0 μL/테스트) x (1.2) x (# 샘플) |
| CD31 (영어) | BV605 시리즈 | 0.25 μL | 등... |
| CD11c | APC ef780 | 1 μL | |
| CD115 (CD115) | 체육 | 1.5 μL | |
| 항체 혼합물을 만들려면 컬럼 D에서 계산된 항체를 FACS 버퍼 또는 브릴리언트 바이올렛 염색 버퍼*와 결합하여 최종 부피(50μL x 1.2 x 총 # 샘플)로 만듭니다. | |||
| 라이브/데드 염색(1x) | |||
| 라이브/데드 | 형광단 | 200 uL 테스트 당 L / D 부피 | 필요한 총 볼륨: |
| 라이브/데드 | 아쿠아 | 0.67 μL | 컬럼 C x 1.2 x 총 # 샘플 |
| 세포내 염색(1x) | |||
| 항원 | 형광단 | 50 μL 시험당 Ab 부피 | 필요한 총 볼륨: |
| αSMA (영문) | 핏 | 0.125 | 컬럼 C x 1.2 x 총 # 샘플 |
| *브릴리언트 바이올렛 염색 버퍼는 브릴리언트 바이올렛 형광단에 결합된 항체가 두 개 이상 패널에 사용되는 경우 사용해야 합니다. | |||
표 3: 유동 염색에 사용할 염색 혼합물의 예시 및 항체 패널 계산.
토론
여기에서는 (i) 형광 지질 염료로 표지되고 항당뇨 화합물인 테사글리타자르가 로드된 리포솜을 준비하고, (ii) 역궤도 주사를 통해 마우스에 리포솜을 투여하고, (iii) 유세포 분석을 통해 세포 수준에서 리포솜 흡수를 감지하기 위해 조직을 수확, 처리 및 염색합니다. 이 프로토콜은 약 150μm 리포솜의 준비와 지방, 혈액 및 비장의 흡수 평가를 검토합니다. 리포솜 제제는 확장 가능하고 대부분 실온에서 수행되며 역상 증발을 활용하여 약물 로딩 및 유기 용매 제거를 극대화합니다. 이 프로토콜을 사용하면 정제된 리포솜 샘플에서 최대 2mg/mL 테사글리타자르 농도를 달성할 수 있습니다. 제조된 리포솜은 4°C의 HEPES 완충액에 1년 이상 보관할 수 있습니다. 우리의 경험에서, 그들은 평균 입자 크기의 최소한의 변화를 보여주었습니다. 10kDa 원심 필터를 사용하여 외부 약물로부터 리포솜을 한외여과 분리한 후 10% 미만의 약물 함량 손실이 분광광도계로 입증되었습니다.
리포솜을 준비하는 동안 고려해야 할 몇 가지 중요한 단계와 요소가 있습니다. 첫째, 프로토콜 단계의 순서가 중요하며 준수해야 합니다. 둘째, 테사글리타자르를 로딩할 때 사용되는 용액의 pH는 용해도와 효과적인 로딩을 최대화하기 위해 7.4로 유지되어야 합니다. 셋째, 장비와 필터의 적절한 조립은 각 단계의 출력이 적절한 크기와 순도를 갖도록 합니다. 예를 들어, 100nm 및 200nm 필터가 제대로 조립되지 않으면 더 이질적이고 부적절한 크기의 리포솜 배치가 발생할 수 있습니다. 넷째, 테사글리타자르가 리포솜으로 전달되는 것을 최대화하기 위해서는 약물 로딩 전에 Ca-아세테이트를 완전히 제거해야 합니다. Ca-아세테이트의 완전한 제거를 테스트하려면 고속 침전을 사용하여 리포솜을 제거한 다음 비리포솜 용액에서 Ca-아세테이트 수준을 측정합니다. 다섯째, 각 단계에서 리포솜 제제에 첨가되는 모든 물질의 질량을 측정하고 기록하는 것이 중요합니다. 이를 통해 적절한 농도를 계산할 수 있고 필요한 재료 비율을 유지할 수 있습니다. 마지막으로, 기술이 제대로 실행되지 않으면 바람직하지 않은 수준의 이질성이 있을 수 있습니다. DLS 및 전자 현미경과 같은 다른 접근 방식을 사용하여 이 매개변수를 철저히 확인하는 것이 중요합니다. 균질성을 향상시키려면 선택한 필터 크기를 조정하거나 두 개의 필터를 쌓는 것이 좋습니다.
또한 이 프로토콜을 완전히 수행하기 전에 유세포 분석을 위한 대조군 및 항체 패널을 계획하고 최적화하는 것이 중요합니다(표 1, 표 3). 항체는 염색에 적절한 농도가 사용되고 형광단 간의 겹침이 최소화되는지 확인하기 위해 테스트해야 합니다. 리포솜 준비 중에 사용되는 염료의 여기 및 방출도 패널 계획에 포함되어야 합니다. 우리의 결과에서, 우리는 Allophycocyanin (APC) 및 AlexaFluor 647과 같은 형광단과 유사한 여기 및 방출을 갖는 DiD를 활용했습니다. 따라서, 우리는 항체 패널에서 이러한 형광단에 접합된 항체를 선택하지 않았습니다. 또한 isotype 컨트롤은 이 프로토콜에 포함되지 않습니다. 이는 이 프로토콜을 위해 선택된 항체가 잘 검증되고 상업적으로 이용 가능한 항체이기 때문입니다. 그러나 이전에 최적화되지 않은 항체를 사용하는 데 관심이 있는 경우 전체 실험을 수행하기 전에 관심 조직의 이소타입 대조군에 대해 항체를 테스트하는 것을 고려하십시오.
이 프로토콜은 치료 후 마우스에서 혈액, 비장, 사타구니 지방 및 부고환 지방 조직을 추출하고 처리하는 방법을 보여주지만 이 일반적인 접근 방식은 다른 조직에 적용할 수 있습니다. 관심 조직에 따라 처리 및 소화 프로토콜을 변경해야 할 수도 있습니다: 폐21, 간22, 복강강 3, 골수3,23, 뇌 24.
고려해야 할 이 방법의 중요한 한계는 흡수가 동물당 한 시점에서만 평가될 수 있다는 것입니다. 따라서, 이 프로토콜을 다른 비침습적 이미징 기술과 결합하거나 평가를 수행하기 위한 충분한 자원을 보장하기 위해 그에 따라 계획하는 것이 유리할 수 있다. 리포솜은 처음 24시간 동안 몸 전체를 순환하며 리포솜을 흡수하는 세포의 수명 또는 흡수에 반응하는 방식에 따라 세포 사멸 또는 추가 식균 작용이 발생할 수 있습니다. 우리의 이전 연구는 다른 시점에서 DiD+ 인구의 인구 특성의 변화를 보여주었습니다3. 이러한 이유로 관심 메커니즘의 생물학과 가장 관련이 있는 초기 시점 또는 시점에서의 섭취를 평가하는 것이 중요합니다. 또한 이 프로토콜을 사용하여 전체 조직에서 세포 흡수의 정량화를 수행할 수 있지만 유세포 분석으로는 조직 국소화를 밝힐 수 없습니다. 이 접근법을 조직학적 방법과 결합하면 이러한 한계를 해결하는 데 도움이 될 수 있습니다.
일반적으로 이 프로토콜은 조직학 및 전신 형광 이미징과 같은 기존 방법론을 보완합니다. 유세포 분석 도구 및 방법의 지속적인 발전으로 점점 더 구체적인 세포 집단에 대한 더 큰 패널의 개발이 가능해질 것입니다. 앞서 언급한 방법과 함께 이 프로토콜을 사용하면 세포 흡수 평가가 향상되고 유세포 분석으로 관찰된 결과를 검증할 수 있는 기회를 제공할 수 있습니다. 예를 들어, 지방 조직에 있는 대부분의 입자가 유세포 분석에 의해 대식세포에 흡수되었다는 것이 밝혀져야 합니다. 동일한 지방 조직의 추가 분취액의 면역형광은 세포 유형이 실제로 리포솜을 흡수하는지 확인하기 위해 대식세포 마커에 대해 저장, 고정, 절편 및 염색될 수 있습니다. 이 접근법은 세포 특이적 표적화 검증, 세포 흡수 정량화, 표적 이탈 흡수 식별, 관찰된 치료 결과에 대한 기계론적 가설을 생성하기 위한 정보 제공 등 수행된 나노입자 생체분포 분석에 엄격함을 더해야 합니다. 이 프로토콜은 또한 다른 리포솜을 사용하고, 다른 조직에서의 흡수를 조사하고, 비만 및 대사 장애 또는 나노 입자 전달이 실현 가능한 치료 옵션인 기타 질병 환경에서 새로운 화합물을 테스트하는 향후 연구에 적용할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 유세포 분석 교육 및 서비스를 제공한 Michael Solga와 나머지 Flow Cytometry Core 직원에게 감사를 표합니다. 저자는 또한 리포솜 준비(SSKD, DKB), 조직 수확(MAM, JCG), 유세포 분석 염색 및 샘플 수집(AU, PS, CM)에 도움을 준 Shiva Sai Krishna Dasa, Dustin K. Bauknight, Melissa A. Marshall, James C. Garmey, Chantel McSkimming, Aditi Upadhye 및 Prasad Srikakulapu에게 감사를 표합니다. 이 작업은 AstraZeneca, R01HL 136098, R01HL 141123 및 R01HL 148109, AHA 16PRE30770007 및 T32 HL007284 보조금의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
참고문헌
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유