Method Article
Preparazione, somministrazione e valutazione dell'assorbimento cellulare tessuto-specifico in vivo di liposomi marcati con coloranti fluorescenti
In questo articolo
Riepilogo
L'obiettivo di questo protocollo è sintetizzare liposomi marcati con fluorescenza e utilizzare la citometria a flusso per identificare la localizzazione in vivo dei liposomi a livello cellulare.
Abstract
C'è un crescente interesse nell'uso dei liposomi per fornire composti in vivo, in particolare per approcci terapeutici mirati. A seconda della formulazione del liposoma, i liposomi possono essere assorbiti preferenzialmente da diversi tipi di cellule nel corpo. Ciò può influenzare l'efficacia della particella terapeutica poiché la progressione di diverse malattie è specifica del tipo di tessuto e della cellula. In questo protocollo, presentiamo un metodo per sintetizzare e marcare fluorescentmente i liposomi usando DSPC, colesterolo e DSPE PEG-2000 e il colorante lipidico DiD come etichetta fluorescente. Questo protocollo presenta anche un approccio per la somministrazione di liposomi in vivo e la valutazione dell'assorbimento cellulo-specifico dei liposomi utilizzando la citometria a flusso. Questo approccio può essere utilizzato per determinare i tipi di cellule che assorbono i liposomi e quantificare la distribuzione e la proporzione di assorbimento dei liposomi tra i tipi di cellule e i tessuti. Sebbene non menzionati in questo protocollo, ulteriori test come l'immunofluorescenza e l'imaging a fluorescenza a singola cellula su un citometro rafforzeranno qualsiasi risultato o conclusione fatta in quanto consentono la valutazione della colorazione intracellulare. I protocolli possono anche dover essere adattati a seconda del tessuto o dei tessuti di interesse.
Introduzione
Con l'aumento dell'interesse per lo sviluppo di terapie che utilizzano la somministrazione di farmaci con nanoparticelle, i metodi per preparare e valutare la distribuzione e l'assorbimento delle particelle devono continuare a progredire, espandersi ed essere accessibili alla comunità di ricerca 1,2. Questo protocollo è stato sviluppato per valutare i tipi esatti di cellule che hanno assorbito liposomi in vivo a seguito di un trattamento con liposomi marcati con DiD caricati con tesaglitazar, unagonista 3,4 del recettore attivato dal proliferatore dei perossisomi (PPAR)-α/γ. In questi studi, siamo stati in grado di valutare quali tipi di cellule sono stati direttamente influenzati dal trattamento liposomiale con tesaglitazar, l'efficacia delle frazioni mirate e generare ipotesi per spiegare i risultati del trattamento che abbiamo osservato. Inoltre, le funzioni biologiche stabilite in una varietà di tipi di cellule suggeriscono che le cellule fagocitiche come i macrofagi, le cellule dendritiche e le cellule di Kupffer specifiche del fegato assorbono la maggior parte dei liposomi 5,6,7. Utilizzando questo protocollo, abbiamo dimostrato che anche i fagociti non classici potrebbero assorbire i liposomi 3,4.
Questo protocollo presenta un metodo ottimizzato per solubilizzare tesaglitazar, preparare liposomi mediante evaporazione a fase inversa e utilizzare l'acetato di calcio come attrattivo per il carico remoto del farmaco. I metodi presentati sono accessibili a molti laboratori e mancano di materiali difficili da acquisire e passaggi che richiedono alte temperature. Il protocollo produce liposomi di dimensioni ottimali per una maggiore circolazione in vivo8. Inoltre, come riassunto da Su et al., ad oggi, sono stati studiati e testati in profondità9 metodi per valutare la distribuzione dei liposomi in vivo e l'assorbimento tissutale. I metodi di tomografia ad emissione di positroni (PET), risonanza magnetica (MRI) e tomografia molecolare a fluorescenza (FMT) vengono applicati per quantificare la biodistribuzione e l'assorbimento tessuto-specifici 9,10,11. Mentre questi metodi sono stati ottimizzati per massimizzare il rilevamento in vivo, mancano ancora della capacità di quantificare l'assorbimento dei liposomi in vivo alla risoluzione cellulare. Il protocollo qui presentato mira a soddisfare questa esigenza attraverso l'uso della citometria a flusso. Infine, per questo protocollo, l'assorbimento cellulare è stato ristretto a pochi tessuti, incluso il tessuto adiposo. C'è un crescente corpo di letteratura che studia il potenziale per l'uso di nanoparticelle per fornire terapie nel contesto di obesità, dismetabolismo e infiammazione 12,13,14,15,16,17. Pertanto, abbiamo ritenuto importante condividere un protocollo con metodi efficaci per l'elaborazione e l'analisi del tessuto adiposo, uno dei tessuti che svolge un ruolo importante in queste patologie.
Protocollo
Tutti i passaggi di questo protocollo sono approvati e seguono le linee guida del Comitato per la cura e l'uso degli animali presso l'Università della Virginia.
NOTA: Ci sono alcuni controlli importanti da considerare per le fasi successive dell'analisi, che sono riassunti nella Tabella 1 e devono essere considerati prima della somministrazione del liposoma.
1. Preparazione di liposomi marcati fluorescentmente, caricati con acetato di calcio e tesaglitazar
- Combinare DSPC (1,2-distearoyl-sn-glicero-3-fosfocolina), colesterolo, PEG-2000-DSPE, e DiD. Per questo, combinare il DSPC, il colesterolo e il DSPE PEG-2000 con un rapporto di massa di 2: 1: 1. Aggiungere il colorante lipidico DiD ad una concentrazione di 1 mg di DiD per 1 mL di liposomi (rapporto molare di 46:1 di DSPC:DiD).
NOTA: DiD è un'abbreviazione accettata per il colorante 1,1'-dioctadecil-3,3,3',3'tetramethylindocarbocyanine. Poiché ha due "code grasse" ottadeciliche di uguale lunghezza al DSPC utilizzato in questa formulazione, dovrebbe incorporarsi principalmente nella membrana lipidica. I coloranti lipidici come DiO, DiD e DiI sono abitualmente utilizzati per la ricerca sui liposomi8 e sono considerati non scambiabili18. - Utilizzare un flaconcino a scintillazione da 20 mL per l'emulsione in fase invertita e la preparazione dei liposomi. In questo flaconcino, mescolare una soluzione 2:1 di etere-cloroformio di lipidi con acetato acquoso di calcio (Ca-acetato, 1 M, pH 7,4). Il rapporto tra fase organica e fase acquosa dovrebbe essere 4:1, ad esempio, 4 ml di fase organica e 1 ml di fase acquosa.
- Emulsionare la soluzione etere-cloroformio dei lipidi mediante sonicazione per 30 s a temperatura ambiente. Utilizzare il sonicatore a 20 KHz e 50% di potenza e utilizzare un 1/2 in. sonda.
NOTA: Tenere la punta della sonda sonicatore più vicina al fondo del flaconcino per evitare la formazione di schiuma. Non toccare il vetro con la punta della sonda durante la sonicazione, potrebbe rompersi. Inoltre, il cloroformio deve essere aggiunto all'etere come co-solvente: in presenza di colesterolo, un'emulsione di solo etere si separa rapidamente, rendendo impossibile questa fase della procedura. - Posizionare immediatamente il flaconcino con emulsione acqua-in-olio omogeneizzato su un evaporatore rotante con un adattatore speciale, un manometro e una valvola regolatrice di pressione. L'evaporatore deve essere collegato a una linea di vuoto per rimuovere i solventi organici. Impostare la velocità di rotazione a 100 giri/min e il vuoto a 0,5 atm e rilasciare se la schiuma dell'emulsione sembra eccessiva. Dopo che un gel si forma e scompare, aumentare il vuoto a 0,9 atm.
NOTA: Durante la rimozione della fase organica volatile, il livello di vuoto deve essere regolato gradualmente, per evitare una rapida formazione di schiuma, poiché potrebbe portare alla perdita di contenuto dal flaconcino nel corpo dell'evaporatore rotante. Alla fine, quando l'etere e il cloroformio evaporano parzialmente e il rapporto di volume tra la fase acquosa e quella organica del solvente è vicino a 1: 1, si formerà un gel. L'evaporazione deve continuare fino a quando il gel scompare e il mezzo acquoso rimanente è di nuovo completamente liquido. Una miscelazione aggiuntiva può aiutare ad accelerare la rimozione del solvente organico. Ciò può essere ottenuto posizionando una barra di agitazione in politetrafluoroetilene nel pallone di evaporazione, per migliorare la convezione del gel viscoso durante l'evaporazione rotante. - Filtrare i liposomi risultanti utilizzando membrane in policarbonato incise su tracce per ottenere una distribuzione dimensionale omogenea.
- Eseguire la filtrazione facendo passare la dispersione acquosa liposomica avanti e indietro più volte attraverso un filtro in policarbonato a pori 200 nm in un estrusore liposomico dotato di due siringhe a tenuta di gas.
NOTA: Le siringhe più piccole sono preferite (ad esempio, 0,5 ml) in quanto assicurano la generazione di una pressione sufficiente per la filtrazione. Con un alto contenuto di colesterolo nella membrana liposomica, non è necessaria una temperatura elevata e la procedura può essere eseguita a temperatura ambiente. Viene eseguito un numero dispari di filtrazioni (ad esempio, 21), in modo che il materiale risultante finisca sul lato opposto del filtro fin dall'inizio e, se pre-sterilizzato, può essere raccolto il campione sterile di liposomi aggiustati di dimensioni filtrate. La dimensione dei liposomi risultanti è tipicamente vicina alla dimensione dei pori del filtro selezionati. Due filtri possono essere impilati (invece di uno) per eseguire una regolazione fine per ridurre la dimensione delle particelle. - Verificare la distribuzione delle dimensioni utilizzando la diffusione dinamica della luce laser (DLS)3,4.
- Aggiungere da 1 a 3 ml di soluzione salina in una cuvetta di 1 cm con quattro lati trasparenti. A questo, aggiungere 10-20120 μL di liposomi e mescolare accuratamente. Inserire il campione nell'apparecchio e selezionare i seguenti parametri da misurare: viscosità del solvente, indice di rifrazione, indice di rifrazione dei lipidi. Fare clic sul pulsante Start . Le misurazioni dureranno diversi minuti e consisteranno in 100 o più esecuzioni.
- Eseguire la filtrazione facendo passare la dispersione acquosa liposomica avanti e indietro più volte attraverso un filtro in policarbonato a pori 200 nm in un estrusore liposomico dotato di due siringhe a tenuta di gas.
- Rimuovere l'acetato di Ca esterno utilizzando una colonna di spin dissalante. A metà del lotto aggiungere tesaglitazar acquoso in tampone HEPES da 10 mM (pH 7,4) e incubare miscelando a 37 °C per 1 ora. Utilizzare la seconda metà del lotto come formulazione liposomica di controllo priva di farmaci.
NOTA: Pre-equilibrare la colonna di spin-colonna di desalinizzazione da 2 mL con tampone HEPES da 10 mM, pH 7,4, prima dell'uso. Per fare ciò, posizionare 1 mL di tampone HEPES nella colonna e centrifugare in una centrifuga a 1000 x g per 2 minuti. Rimuovere il buffer pass-through e ripetere questa operazione quattro volte. - Rimuovere tesaglitazar non intrappolato dai liposomi utilizzando una colonna di spin di 2 ml e determinare la concentrazione di farmaco intrappolato spettrofotometricamente.
- Aggiungere non più di 0,5 ml di campione di liposoma al letto di gel a colonna asciutta e attendere che tutto il campione entri nel gel. Centrifugare esattamente nelle stesse condizioni di prima (1000 x g, 2 min) e raccogliere il campione di liposoma nel pass-through purificato da piccoli composti di massa molecolare.
- Quantificare le caratteristiche finali delle particelle: dimensione e concentrazione delle particelle utilizzando il potenziale DLS e zeta con un sistema combinato DLS-elettroforessaggio di diffusione della luce (ELS)3,4 in tampone HEPES 10 mM pH 7,4 e a 25 °C.
- Analogamente al punto 1.5.2, diluire la dispersione dei liposomi nel tampone di misurazione (ad esempio, 10 μL di liposomi per 1 mL di soluzione tampone) in una cuvetta a forma di U utilizzando una siringa Luer monouso o una pipetta con punta tagliata. Assicurarsi che non ci siano bolle nella "U" in modo che ci sia una soluzione ininterrotta per il flusso di corrente elettrica.
- Posizionare la cuvetta nell'unità (prestare attenzione alla parte anteriore e posteriore della cuvetta, in modo che gli elettrodi siano collegati correttamente all'unità). Chiudere lo sportello dello strumento; Successivamente, la misurazione avviene (con più ripetizioni), sotto il controllo del software di guida.
2. Preparare i liposomi per la somministrazione in vivo
- In un armadio di biosicurezza, diluire i liposomi in soluzione salina sterile alla concentrazione appropriata in un volume finale di 50 μL per la somministrazione in vivo.
NOTA: In studi precedenti, la nostra preparazione di liposomi conteneva 2 mg / ml di tesaglitazar, che equivale a circa 4,89 μmol di tesaglitazar / ml e abbiamo somministrato liposomi alla dose di 1 μmol di farmaco / kg. Per un topo da 40 g, porteremmo 8,2 μL di liposomi fino a un volume finale di 50 μL in soluzione salina. Utilizzando DLS/ELS, il numero di liposomi per unità di volume deve essere quantificato anche per le preparazioni di liposomi caricati con farmaci e veicoli per garantire che venga somministrato un numero uguale di liposomi veicolo per grammo di peso del topo rispetto ai liposomi caricati con farmaco. - Caricare la soluzione liposomica in un ago da 27 G nell'armadio di biosicurezza. Tenerlo a temperatura ambiente per evitare di iniettare soluzione fredda nel mouse.
3. Somministrare liposomi tramite iniezione endovenosa retroorbitale
NOTA: È anche opportuno effettuare l'iniezione endovenosa con altri metodi, come le iniezioni di vene caudali, se si preferisce. Sebbene non sia coperto da questo protocollo, sono disponibili protocolli pubblicati che spiegano questo metodo19 .
- Impostare l'area di lavoro per la consegna dei liposomi.
- Pulire il banco di lavoro con etanolo al 70%. Assicurati di selezionare uno spazio che consenta l'uso di un sistema di anestesia isoflurano.
- Accendi un pad riscaldante e posizionaci sopra un tampone pulito o un asciugamano per mantenere il mouse su una superficie pulita. Lasciare abbastanza tempo per riscaldare il pad prima di iniziare a lavorare con i topi.
- Impostare il sistema di anestesia in modo che la camera sia vicina e il cono del naso sia sul pad riscaldante.
- Assicurati che tutti gli altri aspetti del sistema siano pronti (ad esempio, il livello di isoflurano è abbastanza alto nel vaporizzatore, il filtro al carbone è stato pesato, il tubo è collegato correttamente).
- Raccogliere gli altri materiali necessari per questa sezione del protocollo: gel lubrificante oftalmico, un anestetico locale per il trattamento post-somministrazione, garze sterili.
- Sedare il mouse usando l'isoflurano nella camera di induzione. Una volta che non risponde a un leggero tocco del piede, trasferire rapidamente il mouse nello spazio di lavoro mantenendo la sedazione attraverso un cono nasale.
NOTA: L'animale deve essere mantenuto all'1,5% al 2,5% di isoflurano e valutato per un'adeguata profondità di anestesia (attraverso una mancanza di risposta al pizzico del piede) prima di procedere con la procedura. - Spostare il mouse su un lato per la somministrazione di liposomi. Poiché il topo non batte le palpebre mentre è anestetizzata, applicare una piccola quantità di lubrificante oftalmico su entrambi gli occhi per mantenerli idratati durante il resto della procedura.
- Premere delicatamente sulla pelle sopra e sotto l'occhio esposto. L'occhio dovrebbe sollevarsi sopra il piano del viso.
- Inserire con cautela la punta dell'ago in corrispondenza del canto mediale, assicurandosi che l'ago sia sotto l'occhio e non toccarlo. Una volta inserito l'ago sotto l'occhio, iniettare lentamente i liposomi nello spazio retro-orbitale. Dopo aver ritirato l'ago, potrebbe essere necessario chiudere le palpebre per alcuni secondi per ottenere l'emostasi.
- Se l'ago non è inserito abbastanza lontano, la soluzione può emergere intorno all'occhio. Interrompa immediatamente l'iniezione se si vede questo e riposiziona l'ago.
- Applicare un anestetico locale, come la proparacaina, sull'occhio per prevenire il dolore e il disagio post-procedura.
- Tenere il mouse su un pad riscaldante e monitorare fino a quando non si risveglia per assicurarsi che stia bene e mantenga la corretta temperatura corporea.
- Riportare il topo nella sua gabbia e nel suo normale ambiente abitativo fino all'arrivo del punto di interesse.
NOTA: Questo dovrebbe essere fatto in linea con le linee guida IACUC locali.
4. Preparare i materiali per la raccolta dei tessuti, la lavorazione dei tessuti e la colorazione della citometria a flusso
- Preparare soluzioni per la raccolta, la lavorazione e la colorazione (sezioni 5-0127): soluzione salina tamponata fosfato (PBS)-eparina, tampone HEPES, 2 mg/ml di collagenasi di tipo I, tampone di lisi AKC, tampone FACS, PBS, tampone di fissazione (Tabella 2). Conservare tutte le soluzioni tranne il tampone di fissazione a 4 °C o su ghiaccio durante la procedura.
- Preparare tubi con tamponi e altri materiali per la raccolta e la lavorazione dei tessuti.
- Per il sangue di ciascun topo, aggiungere 10 μL di 0,5 M EDTA a una provetta da microcentrifuga da 1,5 o 1,7 ml per la raccolta del sangue. L'EDTA impedirà la coagulazione del sangue. Sono necessari anche una siringa da 1 mL con un ago da 25 G e un tubo conico da 15 ml.
- Per la milza, raccogliere una provetta da microcentrifuga da 1,5 o 1,7 ml con 1 ml di tampone HEPES, una siringa da 1 ml, due tubi conici da 50 ml e due filtri da 70 μm per milza.
- Per ogni deposito di tessuto adiposo, raccogliere una fiala di polietilene da 20 ml con 1,5 ml di tampone HEPES per tritare il tessuto, un tubo conico da 50 ml e un filtro da 70 μm per tipo di tessuto adiposo per topo.
- Preparare l'area di lavoro per il raccolto.
- Pulire lo spazio del banco con etanolo al 70%. Preparare un vassoio di gomma per appuntare il mouse durante la raccolta pulendolo con etanolo al 70% e coprendolo con un tampone assorbente o asciugamani di carta. Assicurati che siano disponibili almeno 5 pin con cui lavorare.
- Riempire una siringa da 10 mL con eparina PBS e fissare su un ago da 25 G per la perfusione.
- Raccogli strumenti e materiali da utilizzare durante la raccolta. Sono necessarie pinze (due paia), forbici, asciugamani di carta, salviette prive di lanugine, i tubi della microcentrifuga con EDTA, i tubi della microcentrifuga con tampone HEPES e i flaconcini di polietilene con tampone HEPES.
5. Raccogli i tessuti
- Eutanasia del topo mediante asfissia da CO2 . Non condurre una lussazione cervicale in quanto ciò potrebbe impedire un'efficace raccolta di sangue e la perfusione dei tessuti nelle fasi successive.
- In un'area del banco pulita con spazio di lavoro e illuminazione sufficienti per vedere bene il mouse, installare un vassoio di dissezione in gomma, un secchio di ghiaccio per conservare i campioni e un flacone spray con etanolo al 70%. Spruzzare il mouse con etanolo al 70% per ridurre la contaminazione e controllare la diffusione dei capelli. Posiziona il mouse sulla schiena sul vassoio di gomma e fissa le zampe distese lontano dal suo corpo.
- Per prepararsi alla raccolta del sangue, praticare con attenzione un'incisione nella pelle sul bordo dell'estremità caudale della gabbia toracica del topo. Tagliare una piccola linea retta verso la testa del topo (circa 1 cm) fino a quando i muscoli pettorali sono esposti.
- Nel sito di incisione iniziale, eseguire due piccoli tagli perpendicolari alla linea verso la testa. Quindi, tagliare con cura il muscolo pettorale su un lato della gabbia toracica nella zona esposta. Ciò consente un migliore accesso e visualizzazione del punto in cui deve essere inserito l'ago.
- Per raccogliere il sangue, inserire l'ago tra la terza e la quarta costola sul lato in cui è stato rimosso il muscolo. Poiché il cuore del topo si trova al centro della cavità toracica, tenere l'ago il più vicino possibile alla linea centrale della gabbia toracica. Una volta inserita, tirare delicatamente la siringa per iniziare a raccogliere il sangue.
- Una volta raccolto, trasferire il sangue nella provetta di microcentrifuga preparata con EDTA e conservare su ghiaccio.
NOTA: Se circa 100 μL di volume vengono tirati verso l'alto e nessun sangue entra nella siringa, provare a ruotare la siringa a destra o a sinistra nel caso in cui l'apertura dell'ago venga premuta contro la parete del cuore. Se questo non aiuta, spostare lentamente l'ago ulteriormente nella cavità toracica o iniziare a rimuovere. Se il sangue inizia a raccogliersi nella siringa a questo punto, continuare a tirare indietro la siringa lentamente. Considerare la rotazione della siringa e dell'ago per un'estrazione di successo. Infine, se non viene raccolto sangue, rimuovere l'ago in quanto potrebbe aver perso il cuore. Prova a reinserire l'ago e ripetere nuovamente il processo di cui sopra.
- Successivamente, per perfondere il mouse, aprire la cavità toracica per accedere al cuore.
- Per fare questo, tagliare la pelle lungo l'estremità della gabbia toracica fino al lato del mouse su ciascun lato. Quindi, utilizzare la pinza per tenere lo sterno lontano dalla superficie di lavoro. Fai una piccola incisione poco profonda appena sotto la fine dello sterno per tagliare la cavità peritoneale. Tagliare lungo la membrana peritoneale lungo l'estremità della gabbia toracica su ciascuno dei lati del topo. Questo dovrebbe esporre il fegato e la cistifellea. Fare attenzione a non tagliare in nessuno di questi tessuti.
- Quindi, fai un piccolo taglio superficiale nel diaframma, cranico al fegato. Quindi, tagliare il diaframma lungo il bordo della gabbia toracica per aprire la cavità toracica. Assicurati di evitare di tagliare uno qualsiasi degli organi all'interno della cavità toracica.
- Fai due tagli lungo la gabbia toracica verso la testa a circa 2-3 mm dalla linea centrale del mouse e lunga circa 0,75 cm.
NOTA: Se tagliato troppo in alto, le arterie che risiedono nella parte superiore della gabbia toracica verranno tagliate. Ciò interferirà con l'efficacia della perfusione. - Sollevare indietro il pezzo centrale della gabbia toracica per esporre la cavità toracica. Spostare qualsiasi grasso o tessuto via per accedere al cuore.
- Fai un piccolo taglio nell'atrio destro del cuore del topo per creare un'apertura attraverso la quale spingere fuori il sangue.
- Utilizzando una siringa da 10 mL di eparina PBS, inserire l'ago nel ventricolo sinistro del cuore del topo.
- Inizia delicatamente a spingere PBS nel cuore il più lentamente possibile.
NOTA: Il sangue deve essere osservato emergere dagli atri giusti e riempire la cavità toracica. Assicurati di mantenere il cuore nella sua posizione fisiologica per evitare di inibire il flusso di eparina PBS dal cuore attraverso l'aorta. - Una volta che tutti i 10 ml di eparina PBS sono stati perfusi attraverso il mouse, gettare la siringa e l'ago e rimuovere il sangue in eccesso e l'eparina PBS dalla cavità toracica usando asciugamani di carta o salviette prive di lanugine.
- Successivamente, per iniziare a estrarre i tessuti, tagliare la pelle e la membrana peritoneale verso la coda del topo per aprire la cavità peritoneale.
- In primo luogo, estrarre il cuscinetto di tessuto adiposo inguinale da ciascun lato del mouse.
NOTA: Leggere attentamente questo processo: assicurarsi di estrarre il linfonodo inguinale da ciascun deposito per evitare di distorcere la composizione cellulare del tessuto adiposo nei risultati.- Utilizzando una seconda serie di pinze, tenere la membrana peritoneale con una pinza e il bordo della pelle sovrapposto sopra la membrana su quel lato con l'altra pinza. Tirare delicatamente la pelle lontano dalla membrana peritoneale per separare questi strati l'uno dall'altro. Cerca il deposito di tessuto adiposo inguinale lungo la pelle. Appuntare il bordo esterno della pelle per accedere meglio al deposito adiposo.
- Prima dell'estrazione, individuare il linfonodo inguinale al centro del deposito adiposo e rimuoverlo con pinze e forbici, se necessario.
NOTA: Se possibile, individuare le tre arterie più grandi che corrono dai bordi esterni del deposito verso il centro. Il linfonodo si trova intorno a dove queste arterie si incontrano. - Dopo aver rimosso il linfonodo, tenere con cura l'estremità del deposito adiposo più vicina al punto appuntato con la pinza e iniziare a fare piccoli tagli alla membrana connettiva tra il tessuto adiposo e la pelle. Sollevare il tessuto adiposo lontano dalla pelle mentre si eseguono tagli per rendere migliore l'accesso alla membrana e assicurarsi che l'intero deposito venga estratto.
- Posizionare il deposito adiposo in una fiala di polietilene preparata con tampone HEPES sul ghiaccio per mantenere il tessuto vitale durante il resto del raccolto.
- Ripetere questo processo dall'altra parte del mouse per estrarre entrambi i depositi. I depositi possono essere digeriti e lavorati insieme o separatamente. Se ogni deposito deve essere lavorato separatamente, devono essere preparati più tubi.
- Quindi, estrarre i depositi adiposi epididimali dall'estremità caudale della cavità peritoneale. Usando una pinza, tirare delicatamente il primo deposito adiposo dell'epididimo dall'estremità dorsale del topo e individuare l'epididimo e i dotti deferenti attaccati a questo deposito.
NOTA: Ci sono due depositi adiposi epididimali: uno attaccato a ciascun epididimo e dotto deferente.- Tagliare con cura tra il deposito adiposo e l'epididimo e il dotto deferente per separare l'adiposo da questi altri tessuti. Posizionare il deposito adiposo in una fiala di polietilene con tampone HEPES sul ghiaccio per mantenere il tessuto vitale durante il resto del raccolto.
- Infine, estrarre la milza, che si trova a sinistra dello stomaco vicino al diaframma. Usando una pinza, tirare delicatamente lo stomaco verso il centro della cavità peritoneale per esporre la milza.
- Tenere delicatamente un'estremità della milza e allontanarla leggermente dallo stomaco. Tagliare la membrana tra la milza e il suo tessuto adiacente fino a quando l'organo non si stacca. Posizionare la milza nel tubo di microcentrifuga preparato con tampone HEPES e conservare su ghiaccio.
- Prima di lavorare i tessuti o raccogliere i tessuti dal topo successivo, scartare la carcassa e tutti gli asciugamani o gli assorbenti di carta sporchi. Cancella anche gli strumenti.
NOTA: se sono presenti più mouse, ripetere questi passaggi di raccolta per ciascun mouse prima di passare alla fase di elaborazione successiva. Se è incluso un topo / topi di controllo, prendere in considerazione la raccolta di questi prima di topi trattati con liposomi per evitare qualsiasi contaminazione.
6. Tessuti di processo
NOTA: Poiché il tessuto adiposo ha una lunga incubazione della digestione, si consiglia di iniziare prima con quel processo e lavorare sull'elaborazione del sangue e della milza durante il periodo di digestione.
- In primo luogo, tritare e digerire i tessuti adiposi. Utilizzando una o due paia di forbici, tritare il tessuto adiposo in ogni fiala di polietilene fino a quando il tessuto è in piccoli pezzi di dimensioni inferiori a 0,5 mm. Ciò consente una digestione più efficiente.
- Una volta tritati i tessuti in tutti i flaconcini, aggiungere 1,5 ml di 2 mg/ml di tampone collagenasi a ciascun flaconcino. Introdurre i flaconcini in un incubatore agitatore impostato a 37 °C e 150 giri/min. Incubare per 30-45 min.
NOTA: Se i tessuti adiposi sono particolarmente grandi, considerare l'aggiunta di altri 0,5 ml a 1,5 ml di tampone HEPES e un volume uguale di tampone collagenasi alle fiale per garantire che i tessuti siano completamente immersi e sia presente abbastanza enzima. La concentrazione finale di collagenasi di tipo I alla digestione deve essere di 1 mg/ml indipendentemente dal volume finale della soluzione. Inoltre, se non è disponibile un incubatore vibrante, i campioni possono essere posti a bagnomaria riscaldati a 37 °C. Agitare delicatamente i campioni ogni 5 minuti per mescolare e risospendere la digestione. - Controllare i campioni a 30 min. Utilizzare un pipet da 1 mL per pipettare il campione su e giù. Se i pezzi di tessuto sono ancora troppo grandi per un facile pipettaggio, riportare i campioni all'incubatore per altri 15 minuti.
- Una volta che i campioni sono completamente digeriti, continuare a pipetare il campione su e giù altre 10 volte per assicurarsi che sia stata creata una sospensione a cella singola.
NOTA: (Opzionale) Controllare i campioni a 30 min. Utilizzare una pipetta da 1 mL per pipettare il campione su e giù. Se i pezzi di tessuto sono ancora troppo grandi per un facile pipettaggio, riportare i campioni all'incubatore per altri 15 minuti. - Pipet la sospensione cellulare attraverso un filtro da 70 μm in un tubo conico da 50 ml. Aggiungere 5 mL di tampone FACS al flaconcino di digestione vuoto per lavare il flaconcino. Trasferire questo tampone di lavaggio attraverso il filtro per aggiungerlo alla sospensione della cella.
- Conservare i campioni sul ghiaccio mentre altri sono in fase di elaborazione. Una volta filtrati tutti i campioni, ruotarli a 400 x g, 4 °C per 5 minuti.
- Rimuovere il surnatante adipocitario mediante aspirazione e quindi rimuovere con attenzione l'infranatante tra il surnatante adipocitario e il pellet mediante aspirazione per lasciare il pellet della frazione stromale-vascolare (SVF).
- Risospendere questo pellet in 1 mL di tampone FACS e trasferirlo in una provetta pulita da 1,5 o 1,7 mL di microcentrifuga. Celle aliquote ora se desiderato o necessario. Conservare in ghiaccio fino a quando tutti i campioni sono pronti per la colorazione con citometria a flusso.
NOTA: Se i depositi adiposi digeriti erano grandi, considerare di utilizzare solo il 50% o il 25% del campione per la colorazione e l'analisi citometrica a flusso. Inoltre, se sono necessari controlli di fluorescenza meno uno (FMO) o controlli aggiuntivi per l'analisi della citometria a flusso (Tabella 1), assicurarsi di aliquote campione extra in una provetta separata per l'elaborazione. Gli FMO sono utilizzati per distinguere tra segnale negativo e positivo per un singolo anticorpo coniugato con fluorofori all'interno del pannello altrimenti completo utilizzato nell'esperimento.
- Una volta tritati i tessuti in tutti i flaconcini, aggiungere 1,5 ml di 2 mg/ml di tampone collagenasi a ciascun flaconcino. Introdurre i flaconcini in un incubatore agitatore impostato a 37 °C e 150 giri/min. Incubare per 30-45 min.
- In secondo luogo, elaborare il sangue.
- Trasferire 50 μL di sangue in un tubo conico da 15 ml.
- Aggiungere 1 mL di tampone di lisi AKC a ciascun tubo e pipettare su e giù per raggiungere una sospensione a cella singola. Aggiungere altri 4 ml di tampone di lisi AKC a ciascuna provetta e incubare per 5-10 minuti. Se è disponibile uno shaker o un rotatore, sigillare saldamente i tappi del tubo e posizionare i tubi su uno di questi per migliorare la miscelazione.
- Aggiungere 5 mL di tampone FACS per spegnere il processo di lisi e centrifugare i campioni a 400 x g, 4 °C per 5 minuti. Rimuovere il surnatante e controllare il pellet. Se è ancora abbastanza rosso, ripetere il processo di lisi. In caso contrario, risospendere i pellet in 1 mL di tampone FACS e trasferirli in una provetta da microcentrifuga pulita da 1,5 o 1,7 ml. Conservare in ghiaccio fino a quando tutti i campioni sono pronti per la colorazione con citometria a flusso.
- Infine, elaborare la milza. Trasferire la milza su un filtro da 70 μm su un tubo conico da 50 ml. Lavare il fazzoletto con 1 mL di tampone FACS e quindi schiacciare la milza attraverso il filtro utilizzando l'estremità dello stantuffo di una siringa da 1 ml. Durante tutto il processo di ammostamento, lavare le celle nel tubo conico da 50 mL utilizzando più tampone FACS. Il volume finale nel tubo conico dovrebbe essere di 10 ml.
- Ruotare le cellule a 300 x g a 4 °C per 5 minuti. Rimuovere il surnatante e risospendere in 1 mL di tampone di lisi AKC. Aggiungere altri 4 ml di tampone di lisi AKC e incubare per 5 minuti. Aggiungere 5 mL di tampone FACS per spegnere il processo di lisi e centrifugare i campioni a 300 x g a 4 °C per 5 minuti.
- Rimuovere il surnatante e risospendere il pellet in 1 mL di tampone FACS. Trasferire la sospensione attraverso un secondo filtro pulito da 70 μm in un tubo conico da 50 ml. Aggiungere 4 mL di tampone FACS per lavare il tubo originale e trasferire il tampone attraverso il filtro per un volume finale di 5 ml.
- Trasferire 50 μL della sospensione cellulare in una provetta da microcentrifuga pulita da 1,5 o 1,7 mL e tenerli in ghiaccio fino a quando tutti i campioni sono pronti per la colorazione con citometria a flusso. Ulteriori aliquote possono essere trasferite ai tubi se ne desiderano o se ne richiedono di più.
NOTA: Gli splenociti sono cellule eccellenti da utilizzare per una singola colorazione viva / morta. Prendere in considerazione la possibilità di trasferire un'aliquota aggiuntiva per questo controllo.
7. Colorare le cellule dai tessuti per la citometria a flusso
- Spingiare i campioni aliquotati a 400 x g, 4 °C per 5 min.
- Rimuovere i campioni surnatanti e risospendere i campioni in 50 μL di blocco Fc (diluito) (Tabella 2). Incubare su ghiaccio per 5 min.
- Aggiungere 50 μL di miscela di anticorpi 2x (Tabella 3) a ciascun campione. Incubare sul ghiaccio al buio per 20 min.
NOTA: Qualsiasi singola macchia NON deve essere colorata con questa miscela di anticorpi. Inoltre, se devono essere utilizzati FMO, le miscele di anticorpi FMO devono essere preparate separatamente. - Lavare i campioni con 1 mL di PBS e centrifugare a 400 x g, 4 °C per 5 min. Rimuovere il surnatante e risospendere i campioni in 200 μL di colorazione vitalità (Tabella 3). Incubare sul ghiaccio al buio per 20 min.
NOTA: non dimenticare di colorare le celle che sono state messe da parte per una singola macchia viva / morta durante questo passaggio. - Lavare i campioni con 1 mL di tampone FACS e centrifugare a 400 x g, 4 °C per 5 minuti. Rimuovere il surnatante e risospendere i campioni (eccetto la singola colorazione viva/morta) in 50 μL di mezzo di fissazione (reagente A) per fissare i campioni. Incubare a temperatura ambiente al buio per 15 min.
- Risospendere la singola colorazione Live/Dead in 100 μL di PFA al 2%. Incubare a temperatura ambiente al buio per 5 min.
- Lavare il campione con 1 mL di tampone FACS e centrifugare a 800 x g, 4 °C per 5 min. Rimuovere il surnatante e risospendere i campioni in 250-500 μL di tampone FACS. Conservare a 4 °C fino a quando i campioni possono essere eseguiti sul citometro a flusso.
- Lavare i campioni con 1 mL di tampone FACS e centrifugare a 800 x g, 4 °C per 5 minuti. Rimuovere il surnatante e risospendere i campioni in 50 μL di mezzo di permeabilizzazione (Reagente B) più anticorpi/i alle proteine intracellulari. Incubare a temperatura ambiente al buio per 20 min.
- Lavare i campioni con 1 mL di tampone FACS e centrifugare a 800 x g a 4 °C per 5 minuti. Rimuovere il surnatante e risospendere i campioni in 100 μL di paraformaldeide (PFA) al 2%. Incubare a temperatura ambiente al buio per 5 min.
- Lavare i campioni con 1 mL di tampone FACS e centrifugare a 800 x g, 4 °C per 5 minuti. Rimuovere il surnatante e risospendere i campioni in 250-500 μL di tampone FACS. Conservare a 4 °C fino a quando i campioni possono essere eseguiti sul citometro a flusso.
Risultati
Produzione di liposomi
I risultati pubblicati qui sono simili a quelli del nostro lavoro pubblicato in precedenza 3,4,20. Utilizzando il protocollo qui presentato, ci aspettiamo di produrre liposomi di circa 150-160 nm. DLS rivela un diametro medio del liposoma di 163,2 nm e un potenziale zeta di -19,2 mV (Figura 1A). L'imaging criogenico al microscopio elettronico (crio-EM) rivela liposomi circolari (Figura 1B) e il diagramma DLS rivela una deviazione standard relativamente piccola dal diametro medio (Figura 1C).
Il legame positivo dei liposomi richiede un controllo trattato con PBS
Studi precedenti del nostro gruppo che impiegano questo protocollo hanno studiato quali sottogruppi cellulari in SVF adiposo, milza e sangue legato ai liposomi dopo una settimana di somministrazione in vivo 3,4. Utilizzando un topo trattato con PBS, la cavità peritoneale e le cellule della milza sono state colorate con lo stesso pannello anticorpale utilizzato su campioni di topi trattati con liposomi. I tessuti sono stati raccolti dopo una settimana di trattamenti (Figura 2A). I campioni del mouse trattato con PBS sono serviti come FMO DiD con cui creare porte DiD positive (Figura 2B,C). Un gate positivo può essere creato usando il segnale DiD-positivo, ma i campioni privi di segnale DiD devono essere utilizzati anche per verificare che il gate positivo non includa campioni DiD-negativi.
Le titolazioni sono necessarie per ottimizzare i segnali di fluorescenza
Prima di eseguire un esperimento completo, devono essere ottimizzate varie condizioni, tra cui la concentrazione di anticorpi coniugati fluorescentmente utilizzati durante la colorazione cellulare e di colorante lipidico utilizzato durante la preparazione dei liposomi. I citometri a flusso hanno un limite superiore di rilevazione per l'intensità della fluorescenza, quindi troppo colorante incorporato nei liposomi porterà a livelli non quantificabili di segnale DiD nei campioni attraversati dal citometro. Inoltre, troppo DiD nei liposomi può portare ad alti livelli di trasferimento di coloranti non specifici, che potrebbero distorcere i risultati dell'assorbimento cellulare. La figura 3 riporta i risultati di un esperimento in cui le concentrazioni di colorante lipidico sono state titolate per identificare la concentrazione che produrrebbe un segnale ottimale all'interno dell'intervallo di rilevamento del citometro a flusso utilizzato. Questo è stato condotto sui tessuti di interesse per l'esperimento finale: sangue (Figura 3A), SVF adiposo inguinale (Figura 3B) e SVF adiposo epididimo (Figura 3C). Le concentrazioni selezionate per il test erano 10 mg di DiD (alto, rosso), 1 mg di DiD (medio, blu) o 0,1 mg di DiD (basso, grigio) per 1 ml di liposomi. La concentrazione più alta utilizzata nei liposomi era troppo alta e superava l'intervallo quantificabile del citometro in tutti e tre i tessuti (Figura 3A\u2012C, rosso). La concentrazione più bassa di DiD ha mostrato qualche segnale (Figura 3 A\u2012C, grigio), ma non è stata osservata una popolazione chiara oltre le cellule trattate con PBS (Figura 3A\u2012C, nero). Quando quantificata, la media aritmetica della MFI DiD per ciascun tessuto e concentrazione ha dimostrato una chiara distinzione tra i controlli PBS e la concentrazione media di DiD (Figura 3D). Pertanto, come indicato nel protocollo, abbiamo selezionato la concentrazione media (Figura 3, blu) da utilizzare nella nostra preparazione dei liposomi.
L'uso del pannello multi-anticorpo consente l'identificazione dell'assorbimento dei liposomi da parte di diversi sottogruppi cellulari
Utilizzando il pannello delineato nella Tabella 3, le cellule sono state colorate con anticorpi contro marcatori per macrofagi a, cellule B, cellule T, cellule dendritiche, monociti e cellule endoteliali (Figura 4). Sono necessarie strategie di gating leggermente diverse per ogni tipo di tessuto, ma la maggior parte degli stessi tipi di cellule può essere identificata in ciascuno. Alcune eccezioni includono le cellule endoteliali, che normalmente non si trovano nel sangue, e i monociti, che sono tipicamente a più alta frequenza nel sangue rispetto ad altri tessuti. Una volta identificate le popolazioni, è possibile quantificare la dimensione totale di ciascuna popolazione cellulare e la frequenza con cui sono DiD+. Ulteriori calcoli possono essere eseguiti per caratterizzare la popolazione DiD +: quale percentuale di cellule DiD + sono macrofagi, cellule endoteliali, ecc. Si prega di notare che queste sono strategie di gating di esempio, ma non l'unico modo per analizzare i campioni. L'analisi sarà dettata dal pannello selezionato e dal citometro a flusso disponibili.
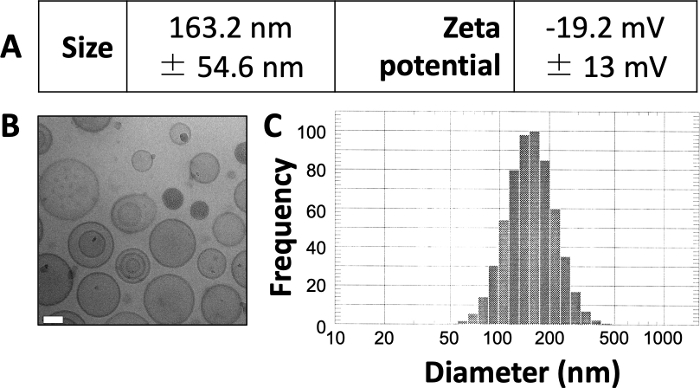
Figura 1: Caratteristiche di esempio dei liposomi preparati.
(A) Le dimensioni e il potenziale zeta sono stati misurati come descritto sopra e sono stati riportati sotto forma di tabella. Ogni parametro è presentato come media ± deviazione standard. (B) Cryo-EM è stato utilizzato per visualizzare i liposomi preparati. La barra della scala bianca è lunga 50 nm. (C) DLS è stato utilizzato per generare un istogramma del diametro dei liposomi in questa preparazione. Questa figura è adattata da Osinski et al.3. Fare clic qui per visualizzare una versione ingrandita di questa figura.
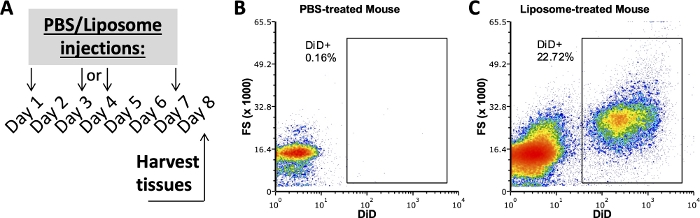
Figura 2: Colorazione rappresentativa di DiD da topi trattati con PBS o Liposomi.
(A) Schema sperimentale per trattamenti PBS e liposomiali. PBS o liposomi sono stati iniettati tre volte nel corso di una settimana. I tessuti sono stati raccolti il giorno 8 del trattamento. (B, C) I grafici di flusso rappresentativi rivelano una colorazione DiD positiva nei topi trattati con liposomi (C), ma non trattati con PBS (B). FSC, dispersione in avanti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
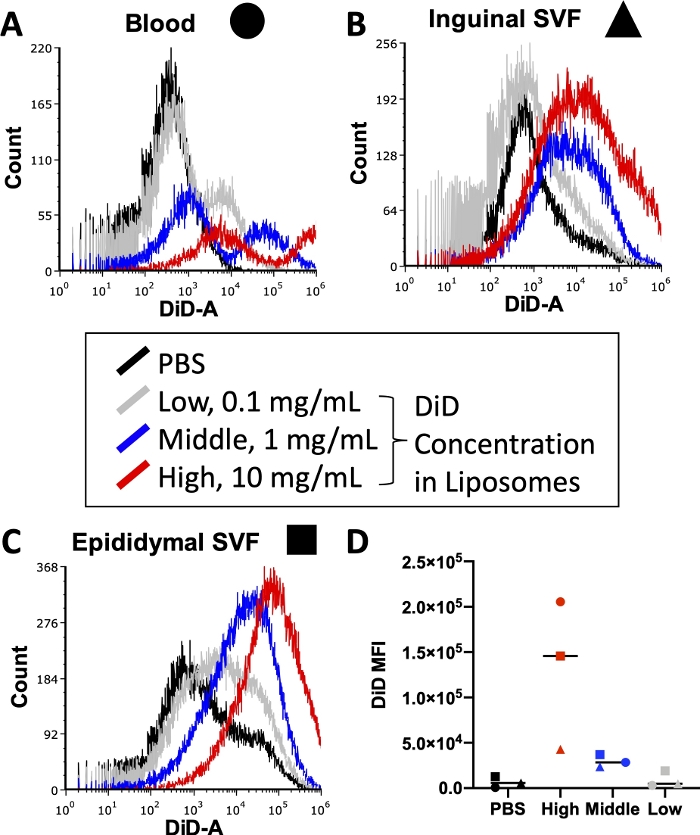
Figura 3: Titolazione del DiD nei liposomi.
I liposomi sono stati preparati con tre diverse concentrazioni di DiD e iniettati nei topi. Il grigio indica la bassa concentrazione a 0,1 mg di DiD per 1 mL di liposomi, il blu indica la concentrazione media a 1 mg di liposomi DiD/mL e il rosso indica l'alta concentrazione a 10 mg di liposomi DiD/mL. Un mouse trattato con PBS è stato utilizzato come controllo negativo (nero). Il sangue (A, cerchio), l'adiposo inguinale (B, triange) e l'epididimo adiposo (C, quadrato) sono stati raccolti 24 ore dopo l'iniezione e trattati per isolare una sospensione unicellulare. Questi campioni sono stati eseguiti su un citometro a flusso al livello di DiD rilevabile. Vengono presentati istogrammi tessuto-specifici con sovrapposizioni di ciascun gruppo di trattamento per dimostrare l'intensità della fluorescenza per concentrazione (A\u2012C). La media aritmetica di DiD è stata anche quantificata per ciascun tessuto e concentrazione e tracciata (D). SSC = dispersione laterale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
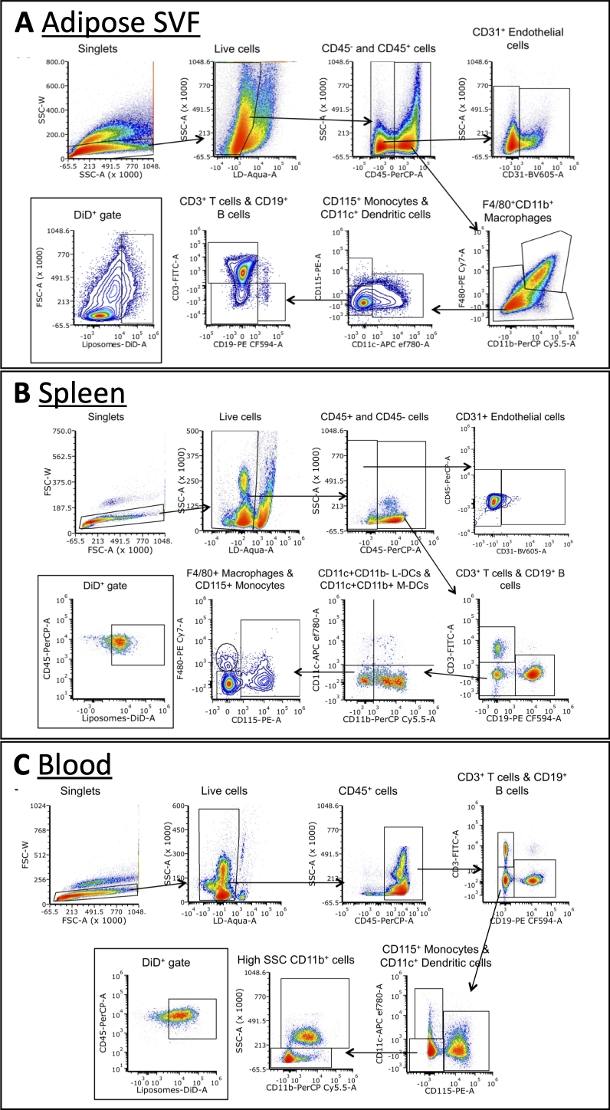
Figura 4: Analisi rappresentativa della citometria a flusso di sottogruppi cellulari in SVF adiposo, sangue e milza.
(A\u2012C) Rappresentativo schematico della strategia di gating per identificare sottoinsiemi cellulari e cellule DiD+ in SVF adiposo (A), milza (B) e sangue (C). Abbreviazioni: FSC = forward scatter; LD = vivi/morti; L-DC = cellule dendritiche linfoidi; M-DC = cellule dendritiche mieloidi; SSC = dispersione laterale. Questa figura è adattata da Osinski et al.3. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Controllo | Scopo |
| Mouse trattato con PBS o soluzione salina | Utilizzare le cellule di questo mouse per i seguenti controlli di citometria a flusso: |
| 1. Celle non colorate | |
| 2. Macchia singola viva / morta | |
| 3. Cellule colorate con il pannello completo, ma prive della fluorescenza liposomica per determinare il segnale liposomico positivo durante l'analisi | |
| Questo / questi mouse / topi saranno utilizzati anche per determinare se i liposomi hanno effetti in vivo in quanto si avrà un controllo non liposomico nel vostro esperimento. | |
| Liposomi scaricati | Se stai caricando un composto nei tuoi liposomi, una parte del tuo lotto di liposomi dovrebbe essere sintetizzata senza il composto. Questo spiega eventuali effetti in vivo dei soli liposomi. |
| DiD da solo | Poiché il DiD può anche essere assorbito dalle membrane cellulari, allocare alcuni topi per ricevere colorante libero in una quantità pari a quella trovata nei liposomi aiuterà a spiegare qualsiasi colorazione della membrana di fondo. |
| Controlli a fluorescenza meno uno (FMO) | Queste sono cellule colorate con tutti tranne uno degli anticorpi nel tuo pannello. Come #3 nella casella sopra, questo aiuta a determinare il vero segnale positivo per quell'anticorpo durante l'analisi |
Tabella 1: Controlli da utilizzare in questo protocollo.
| Soluzione | Componenti | Volume approssimativo necessario per batch/mouse |
| Preparazione dei liposomi | ||
| Acetato di calcio | 1 M acetato di calcio in H2O | 50 ml |
| Tampone HEPES | 10 mM HEPES in H2O, pH 7,4 | 50 ml |
| Tesaglitazar in HEPES | in 10 mM HEPES | 10 ml |
| Raccolta, lavorazione e colorazione dei tessuti | ||
| Soluzione tamponata fosfato (PBS) | 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mM KH 2 PO4 in H 2O distillato | 2 ml |
| PBS-Eparina | 0,1 mM di eparina in PBS | 10 ml |
| Tampone HEPES | 20 mM HEPES in PBS | 5 ml |
| Tampone di digestione | 2 mg/mL di collagenasi di tipo I nel tampone HEPES | 5 ml |
| Tampone di lisi AKC | 0,158 m NH 3 cl, 10 mM KHCO3, 0,1 mM Na 2 EDTA in ddH 2 O, pH7,2 | 15 ml |
| Buffer FACS | 1% BSA, 0,05% NaN3 in PBS | 15 ml |
| Blocco Fc (diluito) | Blocco Fc 1:50 nel buffer FACS | 250 μL |
| Buffer di fissazione | 2% paraformaldeide in PBS | 200 μL |
Tabella 2: Soluzioni da preparare.
| Un | B | C | D |
| Colorazione extracellulare (2x mix di anticorpi) | |||
| Antigene | Fluoroforo | Volume Ab per 100 μL di prova | Volume totale necessario: |
| CD45 | PerCP | 0,5 μL | Colonna C x 1,2 x Totale # esempi |
| CD11b | PerCP Cy5.5 | 0,25 μL | (0,5 μL/test) x (1,2) x (# campioni) |
| F4/80 | PE Cy7 | 0,25 μL | (0,25 μL/test) x (1,2) x (# campioni) |
| CD19 | PE-CF594 | 1 μL | (0,25 μL/test) x (1,2) x (# campioni) |
| CD3 | FITC | 1 μL | (1,0 μL/test) x (1,2) x (# campioni) |
| CD31 | BV605 | 0,25 μL | and so on... |
| CD11c | APC ef780 | 1 μL | |
| CD115 | PE | 1,5 μL | |
| Per creare la tua miscela di anticorpi, combina gli anticorpi calcolati nella colonna D con tampone FACS o tampone colorante viola brillante* per un volume finale di (50 μL x 1,2 x campioni # totali) | |||
| Colorazione viva/morta (1x) | |||
| Vivi/Morti | Fluoroforo | Volume L/D per 200 uL test | Volume totale necessario: |
| Vivi/Morti | Acqua | 0,67 μL | Colonna C x 1,2 x Totale # esempi |
| Colorazione intracellulare (1x) | |||
| Antigene | Fluoroforo | Volume Ab per prova da 50 μL | Volume totale necessario: |
| αSMA | FITC | 0.125 | Colonna C x 1,2 x Totale # esempi |
| *Il tampone per colorazione viola brillante deve essere utilizzato se nel pannello viene utilizzato più di un anticorpo coniugato a un fluoroforo viola brillante. | |||
Tabella 3: Esempio di pannello anticorpale e calcoli delle miscele di colorazione da utilizzare per la colorazione del flusso.
Discussione
Qui descriviamo un protocollo in tre parti per (i) preparare liposomi etichettati con un colorante lipidico fluorescente e caricati con un composto antidiabetico, tesaglitazar, (ii) somministrare liposomi a un topo tramite iniezione retro-orbitale e (iii) raccogliere, elaborare e colorare i tessuti per rilevare l'assorbimento dei liposomi a livello cellulare mediante citometria a flusso. Questo protocollo esamina la preparazione di circa 150 μm liposomi e la valutazione dell'assorbimento in adiposo, sangue e milza. La preparazione del liposoma è scalabile, eseguita principalmente a temperatura ambiente e utilizza l'evaporazione a fase inversa per massimizzare il carico del farmaco e la rimozione dei solventi organici. Utilizzando questo protocollo, è possibile ottenere fino a 2 mg/ml di concentrazione di tesaglitazar nel campione di liposoma purificato. I liposomi preparati possono essere conservati in tampone HEPES a 4 °C per oltre un anno. Nella nostra esperienza, hanno dimostrato una variazione minima della dimensione media delle particelle. Meno del 10% della perdita di contenuto di farmaco è stata dimostrata spettrofotometricamente, dopo la separazione per ultrafiltrazione dei liposomi dal farmaco esterno con un filtro centrifugo da 10 kDa.
Durante la preparazione dei liposomi, ci sono alcuni passaggi critici e fattori da considerare. Innanzitutto, l'ordine dei passaggi del protocollo è importante e deve essere rispettato. In secondo luogo, il pH della soluzione utilizzata durante il caricamento di tesaglitazar deve essere mantenuto a 7,4 per massimizzare la solubilità e il carico efficace. In terzo luogo, il corretto assemblaggio di apparecchiature e filtri garantisce che l'output di ogni passaggio sia delle dimensioni e della purezza adeguate. Ad esempio, se i filtri da 100 e 200 nm non sono assemblati correttamente, può verificarsi un lotto di liposomi più eterogeneo e di dimensioni improprie. In quarto luogo, è necessaria la rimozione completa di Ca-acetato prima del carico del farmaco per massimizzare il trasferimento di tesaglitazar nei liposomi. Per testare la rimozione completa del Ca-acetato, utilizzare la sedimentazione ad alta velocità per rimuovere i liposomi e quindi misurare i livelli di Ca-acetato nella soluzione non liposomiale. In quinto luogo, è importante pesare e registrare la massa di tutti i materiali aggiunti alla preparazione del liposoma in ogni fase. Ciò garantisce che possano essere calcolate le concentrazioni corrette e che vengano mantenuti i rapporti necessari dei materiali. Infine, se la tecnica non viene eseguita correttamente, potrebbe esserci un livello indesiderato di eterogeneità. È importante controllare accuratamente questo parametro utilizzando DLS e altri approcci come la microscopia elettronica. Per migliorare l'omogeneità, è consigliabile regolare la dimensione del filtro selezionato o impilare due filtri.
Inoltre, è fondamentale che i controlli e un pannello anticorpale per la citometria a flusso siano pianificati e ottimizzati prima di condurre questo protocollo in modo completo (Tabella 1, Tabella 3). Gli anticorpi devono essere testati per garantire che vengano utilizzate concentrazioni adeguate per la colorazione e che la sovrapposizione tra i fluorofori sia minima. Anche l'eccitazione e l'emissione del colorante utilizzato durante la preparazione dei liposomi devono essere prese in considerazione nella pianificazione del pannello. Nei nostri risultati, abbiamo utilizzato DiD, che ha un'eccitazione ed emissione simili ai fluorofori come l'alloficocianina (APC) e AlexaFluor 647. Pertanto, non abbiamo selezionato anticorpi coniugati a questi fluorofori nel nostro pannello di anticorpi. Inoltre, i controlli isotype non sono inclusi in questo protocollo. Questo perché gli anticorpi selezionati per questo protocollo sono anticorpi ben convalidati e disponibili in commercio. Tuttavia, se interessati a utilizzare un anticorpo che non è stato ottimizzato in precedenza, si prega di considerare di testare l'anticorpo contro un controllo isotipo sui tessuti di interesse prima di condurre l'esperimento completo.
Mentre questo protocollo dimostra come estrarre ed elaborare il sangue, la milza, il tessuto adiposo inguinale e l'epididimo dal topo dopo il trattamento, questo approccio generale può essere applicato ad altri tessuti. A seconda del tessuto di interesse, potrebbe essere necessario modificare i protocolli di elaborazione e digestione come pubblicato per i seguenti tessuti: polmone21, fegato22, cavità peritoneale 3, midollo osseo3,23, cervello24.
Un'importante limitazione di questo metodo da considerare è che l'assorbimento può essere valutato solo in un punto temporale per animale. Pertanto, può essere vantaggioso accoppiare questo protocollo con altre tecniche di imaging non invasive o pianificare di conseguenza per garantire risorse sufficienti per condurre la valutazione. I tempi di assorbimento cellulare e il turn over cellulare sono fattori importanti da considerare: i liposomi circoleranno in tutto il corpo nelle prime 24 ore e, a seconda della durata della vita delle cellule che assorbono i liposomi o di come rispondono all'assorbimento, può verificarsi la morte cellulare o un'ulteriore fagocitosi. Il nostro studio precedente ha dimostrato cambiamenti nelle caratteristiche della popolazione delle popolazioni DiD + in diversi punti temporali3. Per questo motivo, è importante valutare l'assorbimento in punti temporali precedenti o punti temporali più rilevanti per la biologia del meccanismo di interesse. Inoltre, mentre la quantificazione dell'assorbimento cellulare nell'intero tessuto può essere eseguita con questo protocollo, la citometria a flusso non può rivelare la localizzazione tissutale. L'accoppiamento di questo approccio con metodi istologici può aiutare ad affrontare questa limitazione.
In generale, questo protocollo integra la metodologia esistente come l'istologia e l'imaging a fluorescenza di tutto il corpo. Con i continui progressi negli strumenti e nei metodi di citometria a flusso, diventerà possibile lo sviluppo di pannelli più grandi per popolazioni cellulari sempre più specifiche. Suggeriamo che questo protocollo venga utilizzato in aggiunta ai metodi sopra menzionati in quanto ciò migliorerà la valutazione dell'assorbimento cellulare e fornirà anche l'opportunità di convalidare i risultati osservati dalla citometria a flusso. Ad esempio, si dovesse scoprire che la maggior parte delle particelle nel tessuto adiposo sono state assorbite dai macrofagi mediante citometria a flusso. L'immunofluorescenza di un'aliquota aggiuntiva dello stesso tessuto adiposo potrebbe essere salvata, fissata, sezionata e colorata per i marcatori macrofagici per verificare che il tipo di cellula assorba effettivamente i liposomi. Questo approccio dovrebbe aggiungere rigore ai saggi di biodistribuzione delle nanoparticelle condotti: convalidare il targeting specifico delle cellule, quantificare l'assorbimento cellulare, identificare l'assorbimento off-target e, si spera, fornire informazioni per generare ipotesi meccanicistiche per i risultati terapeutici osservati. Questo protocollo può anche essere adattato per studi futuri utilizzando diversi liposomi, studiando l'assorbimento in altri tessuti e testando nuovi composti nel contesto dell'obesità e del dismetabolismo o di qualsiasi altra malattia in cui la consegna di nanoparticelle è un'opzione terapeutica fattibile.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Michael Solga e il resto dello staff del Flow Cytometry Core per aver fornito formazione e servizi di citometria a flusso. Gli autori desiderano anche riconoscere Shiva Sai Krishna Dasa, Dustin K. Bauknight, Melissa A. Marshall, James C. Garmey, Chantel McSkimming, Aditi Upadhye e Prasad Srikakulapu per la loro assistenza nella preparazione dei liposomi (SSKD, DKB), nella raccolta dei tessuti (MAM, JCG), nella colorazione con citometria a flusso e nell'acquisizione del campione (AU, PS, CM). Questo lavoro è stato sostenuto da sovvenzioni AstraZeneca, R01HL 136098, R01HL 141123 e R01HL 148109, AHA 16PRE30770007 e T32 HL007284.
Materiali
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
Riferimenti
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon