Method Article
Preparación, administración y evaluación de la captación celular in vivo específica del tejido de liposomas marcados con colorante fluorescente
En este artículo
Resumen
El objetivo de este protocolo es sintetizar liposomas marcados con fluorescencia y utilizar la citometría de flujo para identificar la localización in vivo de liposomas a nivel celular.
Resumen
Existe un creciente interés en el uso de liposomas para administrar compuestos in vivo, particularmente para enfoques de tratamiento dirigidos. Dependiendo de la formulación del liposoma, los liposomas pueden ser absorbidos preferentemente por diferentes tipos de células en el cuerpo. Esto puede influir en la eficacia de la partícula terapéutica, ya que la progresión de diferentes enfermedades es específica del tejido y del tipo celular. En este protocolo, presentamos un método para sintetizar y etiquetar fluorescentemente liposomas utilizando DSPC, colesterol y PEG-2000 DSPE y el colorante lipídico DiD como marcador fluorescente. Este protocolo también presenta un enfoque para administrar liposomas in vivo y evaluar la absorción de liposomas específicos de células mediante citometría de flujo. Este enfoque se puede utilizar para determinar los tipos de células que absorben liposomas y cuantificar la distribución y la proporción de la absorción de liposomas entre los tipos de células y tejidos. Si bien no se mencionan en este protocolo, los ensayos adicionales, como la inmunofluorescencia y las imágenes de fluorescencia unicelular en un citómetro, fortalecerán cualquier hallazgo o conclusión que se haga, ya que permiten la evaluación de la tinción intracelular. Los protocolos también pueden necesitar ser adaptados dependiendo de los tejidos de interés.
Introducción
A medida que crece el interés en el desarrollo de terapias que utilicen la administración de fármacos con nanopartículas, los métodos para preparar y evaluar la distribución y absorción de partículas deben continuar avanzando, expandiéndose y siendo accesibles para la comunidad de investigación 1,2. Este protocolo fue desarrollado para evaluar los tipos celulares exactos que absorbieron liposomas in vivo después de un tratamiento con liposomas marcados con DiD cargados con tesaglitazar, un agonista del receptor activado por proliferador de peroxisomas (PPAR)-α/γ 3,4. En estos estudios, pudimos evaluar qué tipos de células se vieron directamente afectados por el tratamiento liposomal con tesaglitazar, la eficacia de dirigirse a las mitades y generar hipótesis para explicar los resultados del tratamiento que observamos. Además, las funciones biológicas establecidas en una variedad de tipos de células sugieren que las células fagocíticas como los macrófagos, las células dendríticas y las células de Kupffer específicas del hígado absorben la mayoría de los liposomas 5,6,7. Utilizando este protocolo, hemos demostrado que los fagocitos no clásicos también podrían absorber liposomas 3,4.
Este protocolo presenta un método optimizado para solubilizar tesaglitazar, preparar liposomas por evaporación en fase inversa y usar acetato de calcio como atrayente para la carga remota de fármacos. Los métodos presentados son accesibles para muchos laboratorios y carecen de materiales difíciles de adquirir y pasos que requieren altas temperaturas. El protocolo produce liposomas de tamaños que son óptimos para el aumento de la circulación in vivo8. Además, como resumen Su et al., hasta la fecha, los métodos para evaluar la distribución de liposomas in vivo y la absorción tisular han sido estudiados y probados en profundidad9. Los métodos de tomografía por emisión de positrones (PET), resonancia magnética (RM) y tomografía molecular de fluorescencia (TMF) se aplican para cuantificar la biodistribución y captación específicas del tejido 9,10,11. Si bien estos métodos se han optimizado para maximizar la detección in vivo, aún carecen de la capacidad de cuantificar la absorción de liposomas in vivo a resolución celular. El protocolo presentado aquí tiene como objetivo lograr esta necesidad mediante el uso de la citometría de flujo. Finalmente, para este protocolo, la captación celular se redujo a unos pocos tejidos, incluido el tejido adiposo. Existe un creciente cuerpo de literatura que investiga el potencial de uso de nanopartículas para administrar terapias en el contexto de la obesidad, el dismetabolismo y la inflamación 12,13,14,15,16,17. Como tal, sentimos que era importante compartir un protocolo con métodos efectivos para procesar y analizar el tejido adiposo, uno de los tejidos que juega un papel importante en estas patologías.
Protocolo
Todos los pasos de este protocolo están aprobados y siguen las pautas del Comité de Cuidado y Uso de Animales de la Universidad de Virginia.
NOTA: Hay algunos controles importantes a considerar para pasos de análisis posteriores, que se resumen en la Tabla 1 y deben considerarse antes de la administración de liposomas.
1. Preparación de liposomas marcados con fluorescencia, cargados con acetato de calcio y tesaglitazar
- Combine DSPC (1,2-distearoil-sn-glycero-3-phosphocholine), colesterol, PEG-2000-DSPE y DiD. Para esto, combine el DSPC, el colesterol y el DSPE PEG-2000 en una proporción de masa de 2: 1: 1. Añadir colorante lipídico DiD a una concentración de 1 mg de DiD por 1 ml de liposomas (relación molar de 46:1 de DSPC:DiD).
NOTA: DiD es una abreviatura aceptada para el colorante 1,1'-dioctadecil-3,3,3',3'tetrametilindocarbocianina. Como tiene dos "colas grasas" de octadecilo de igual longitud que el DSPC utilizado en esta formulación, debe incorporarse principalmente a la membrana lipídica. Los colorantes lipídicos como DiO, DiD y DiI se utilizan rutinariamente para la investigación de liposomas8 y se consideran no intercambiables18. - Use un vial de centelleo de 20 ml para la emulsión de fase invertida y la preparación de liposomas. En este vial, mezclar una solución de éter-cloroformo 2:1 de lípidos con acetato de calcio acuoso (acetato de Ca, 1 M, pH 7.4). La relación entre la fase orgánica y acuosa debe ser de 4:1, por ejemplo, 4 ml de fase orgánica y 1 ml de fase acuosa.
- Emulsionar la solución éter-cloroformo de lípidos por sonicación durante 30 s a temperatura ambiente. Opere el sonicador a 20 KHz y 50% de potencia y use una 1/2 pulgada. sonda.
NOTA: Mantenga la punta de la sonda del sonicador más cerca de la parte inferior del vial para evitar la formación de espuma. No toque el vidrio con la punta de la sonda durante la sonicación, puede romperse. Además, el cloroformo debe agregarse al éter como cosolvente: en presencia de colesterol, una emulsión solo de éter se separa rápidamente, lo que hace imposible este paso del procedimiento. - Coloque inmediatamente el vial con emulsión homogeneizada de agua en aceite en un evaporador rotativo con un adaptador especial, manómetro y una válvula reguladora de presión. El evaporador debe estar conectado a una línea de vacío para eliminar los disolventes orgánicos. Ajuste la velocidad de rotación a 100 rpm y el vacío a 0,5 atm, y suelte si la espuma de emulsión parece excesiva. Después de que se forme y desaparezca un gel, aumente el vacío a 0.9 atm.
NOTA: Durante la eliminación de la fase orgánica volátil, el nivel de vacío debe ajustarse gradualmente, para evitar la formación rápida de espuma, ya que puede conducir a la pérdida de contenido del vial en el cuerpo del evaporador rotativo. Eventualmente, cuando el éter y el cloroformo se evaporan parcialmente y la relación de volumen entre la fase acuosa y la fase solvente orgánica es cercana a 1: 1, se formará un gel. La evaporación debe continuar hasta que el gel desaparezca y los medios acuosos restantes vuelvan a ser completamente líquidos. La mezcla adicional puede ayudar a acelerar la eliminación de disolventes orgánicos. Esto se puede lograr colocando una barra agitadora de politetrafluoroetileno en el matraz de evaporación, para mejorar la convección del gel viscoso durante la evaporación rotativa. - Filtre los liposomas resultantes utilizando membranas de policarbonato grabadas en pistas para lograr una distribución homogénea del tamaño.
- Realice la filtración pasando la dispersión acuosa liposoma hacia adelante y hacia atrás varias veces a través de un filtro de policarbonato de 200 nm de poro en una extrusora liposomal equipada con dos jeringas herméticas al gas.
NOTA: Se prefieren jeringas más pequeñas (por ejemplo, 0,5 ml) ya que aseguran la generación de suficiente presión para la filtración. Con un alto contenido de colesterol en la membrana liposómica, no es necesaria una temperatura alta, y el procedimiento se puede realizar a temperatura ambiente. Se realiza un número impar de filtraciones (por ejemplo, 21), de modo que el material resultante termina en el lado opuesto del filtro desde el principio y, si se esteriliza previamente, se puede recolectar la muestra estéril de liposomas de tamaño ajustado filtrado. El tamaño de los liposomas resultantes suele estar cerca del tamaño de poro del filtro seleccionado. Se pueden apilar dos filtros (en lugar de uno) para realizar un ajuste fino para reducir el tamaño de partícula. - Verifique la distribución del tamaño mediante la dispersión dinámica de luz láser (DLS)3,4.
- Agregue de 1 a 3 ml de solución salina a una cubeta de 1 cm con cuatro lados transparentes. A eso, agregue 10\u201220 μL de liposomas y mezcle cuidadosamente. Coloque la muestra en el aparato y seleccione los siguientes parámetros para medir: viscosidad del disolvente, índice de refracción, índice de refracción de los lípidos. Haga clic en el botón Inicio . Las mediciones durarán varios minutos y consistirán en 100 o más carreras.
- Realice la filtración pasando la dispersión acuosa liposoma hacia adelante y hacia atrás varias veces a través de un filtro de policarbonato de 200 nm de poro en una extrusora liposomal equipada con dos jeringas herméticas al gas.
- Retire el Ca-acetato externo usando una columna de espín de desalinización. A la mitad del lote, añadir tesaglitazar acuoso en tampón HEPES de 10 mM (pH 7,4) e incubar mezclando a 37 °C durante 1 h. Use la segunda mitad del lote como una formulación de liposomas de control sin medicamentos.
NOTA: Preequilibre la columna de centrifugado de desalinización de 2 ml con tampón HEPES de 10 mM, pH 7.4, antes de su uso. Para hacer esto, coloque 1 ml de tampón HEPES en la columna y gire en una centrífuga a 1000 x g durante 2 min. Retire el búfer de paso y repita esto cuatro veces. - Eliminar tesaglitazar no atrapado de los liposomas utilizando una columna de espín de 2 ml y determinar la concentración del fármaco atrapado espectrofotométricamente.
- No agregue más de 0,5 ml de muestra de liposomas al lecho de gel de columna seca y espere hasta que toda la muestra entre en el gel. Centrifugar exactamente en las mismas condiciones que antes (1000 x g, 2 min) y recoger la muestra de liposomas en el paso purificado a partir de pequeños compuestos de masa molecular.
- Cuantificar las características finales de las partículas: tamaño y concentración de partículas utilizando DLS y potencial zeta conun sistema combinado DLS-electroforectic light scattering (ELS) 3,4 en 10 mM HEPES tampón pH 7.4 y a 25 °C.
- Similar al paso 1.5.2, diluya la dispersión de liposomas en el tampón de medición (por ejemplo, 10 μL de liposomas por 1 ml de solución tampón) en una cubeta en forma de U usando una jeringa Luer desechable o una pipeta con una punta cortada. Asegúrese de que no haya burbujas en la "U" para que haya una solución ininterrumpida para el flujo de corriente eléctrica.
- Coloque la cubeta en la unidad (preste atención a la parte delantera y trasera de la cubeta, para que los electrodos estén conectados correctamente a la unidad). Cierre la puerta del instrumento; Después de esto, la medición tiene lugar (con múltiples repeticiones), bajo el control del software de guiado.
2. Preparar los liposomas para la administración in vivo
- En un gabinete de bioseguridad, diluir los liposomas en solución salina estéril a la concentración apropiada en un volumen final de 50 μL para administración in vivo.
NOTA: En estudios previos, nuestra preparación de liposomas contenía 2 mg / ml de tesaglitazar, lo que equivale a aproximadamente 4.89 μmol de tesaglitazar / ml, y administramos liposomas a una dosis de 1 μmol de fármaco / kg. Para un ratón de 40 g, llevaríamos 8,2 μL de liposomas hasta un volumen final de 50 μL en solución salina. Usando DLS/ELS, el número de liposomas por unidad de volumen también debe cuantificarse para las preparaciones de liposomas cargados con fármacos y vehículos para garantizar que se administre un número igual de liposomas vehiculares por gramo de peso de ratón en comparación con los liposomas cargados con fármacos. - Cargue la solución de liposomas en una aguja de 27 G en el gabinete de bioseguridad. Mantenga esto a temperatura ambiente para evitar inyectar solución fría en el ratón.
3. Administrar liposomas mediante inyección intravenosa retroorbitaria
NOTA: También es apropiado realizar la inyección intravenosa por otros métodos, como inyecciones en la vena de la cola, si se prefiere. Aunque no están cubiertos en este protocolo, los protocolos publicados que explican este método19 están disponibles.
- Configure el espacio de trabajo para administrar liposomas.
- Limpie el banco de trabajo con etanol al 70%. Asegúrese de seleccionar un espacio que permita el uso de un sistema de anestesia con isoflurano.
- Encienda una almohadilla de calentamiento y coloque una almohadilla limpia o una toalla sobre ella para mantener el mouse sobre una superficie limpia. Deje suficiente tiempo para que la almohadilla se caliente antes de comenzar a trabajar con ratones.
- Configure el sistema de anestesia de modo que la cámara esté cerca y el cono de la nariz esté en la almohadilla de calentamiento.
- Asegúrese de que todos los demás aspectos del sistema estén listos (por ejemplo, el nivel de isoflurano es lo suficientemente alto en el vaporizador, el filtro de carbón se ha pesado, el tubo está conectado correctamente).
- Reúna los otros materiales necesarios para esta sección del protocolo: gel lubricante oftálmico, un anestésico local para el tratamiento posterior a la administración, gasas estériles.
- Sedar al ratón usando isoflurano en la cámara de inducción. Una vez que no responda a un suave toque en el pie, transfiera rápidamente el mouse al espacio de trabajo mientras mantiene la sedación a través de un cono nasal.
NOTA: El animal debe mantenerse con isoflurano al 1,5% a 2,5% y evaluarse para una profundidad adecuada de anestesia (a través de la falta de respuesta al pellizco del dedo del pie) antes de proceder con el procedimiento. - Mueva el ratón hacia un lado para la administración de liposomas. Debido a que el ratón no parpadeará mientras está anestesiado, aplique una pequeña cantidad de lubricante oftálmico en ambos ojos para mantenerlos hidratados durante el resto del procedimiento.
- Presione suavemente sobre la piel por encima y por debajo del ojo expuesto. El ojo debe elevarse por encima del plano de la cara.
- Inserte cuidadosamente la punta de la aguja en el canto medial, asegurándose de que la aguja esté debajo del ojo y no la toque. Una vez que la aguja se inserta debajo del ojo, inyecte lentamente los liposomas en el espacio retroorbital. Al retirar la aguja, puede ser necesario cerrar los párpados durante unos segundos para lograr la hemostasia.
- Si la aguja no se inserta lo suficiente, la solución puede emerger alrededor del ojo. Deje de inyectar inmediatamente si esto se ve y vuelva a colocar la aguja.
- Aplique un anestésico local, como proparacaína, en el ojo para prevenir el dolor y la incomodidad después del procedimiento.
- Mantenga el mouse en una almohadilla de calentamiento y monitoree hasta que se despierte para asegurarse de que esté bien y mantenga la temperatura corporal adecuada.
- Devuelva el ratón a su jaula y a su entorno de alojamiento normal hasta que llegue el punto de tiempo de interés.
NOTA: Esto debe hacerse de acuerdo con las directrices locales de IACUC.
4. Preparar materiales para la recolección de tejidos, el procesamiento de tejidos y la tinción por citometría de flujo
- Preparar soluciones para la cosecha, el procesamiento y la tinción (secciones 5-127): solución salina tamponada con fosfato (PBS)-heparina, tampón HEPES, 2 mg/ml de colagenasa tipo I, tampón de lisis AKC, tampón FACS, PBS, tampón de fijación (Tabla 2). Conservar todas las soluciones, excepto el tampón de fijación, a 4 °C o en hielo durante el procedimiento.
- Prepare tubos con tampones y otros materiales para cosechar y procesar tejidos.
- Para la sangre de cada ratón, añadir 10 μL de EDTA 0,5 M a un tubo de microcentrífuga de 1,5 o 1,7 ml para recoger la sangre. El EDTA evitará que la sangre se coagule. También se necesita una jeringa de 1 ml con una aguja de 25 G y un tubo cónico de 15 ml.
- Para el bazo, reúna un tubo de microcentrífuga de 1,5 o 1,7 ml con 1 ml de tampón HEPES, una jeringa de 1 ml, dos tubos cónicos de 50 ml y dos filtros de 70 μm por bazo.
- Para cada depósito de tejido adiposo, reúna un vial de polietileno de 20 ml con 1,5 ml de tampón HEPES para picar el tejido, un tubo cónico de 50 ml y un filtro de 70 μm por tipo de tejido adiposo por ratón.
- Prepare el espacio de trabajo para la cosecha.
- Limpie el espacio del banco con etanol al 70%. Prepare una bandeja de goma para sujetar el ratón durante la cosecha limpiándolo con etanol al 70% y cubriéndolo con una almohadilla absorbente o toallas de papel. Asegúrese de que haya al menos 5 pines disponibles para trabajar.
- Llene una jeringa de 10 ml con heparina PBS y sujete una aguja de 25 G para perfusión.
- Reúna herramientas y materiales para usar durante la cosecha. Se necesitan pinzas (dos pares), tijeras, toallas de papel, toallitas sin pelusa, los tubos de microcentrífuga con EDTA, los tubos de microcentrífuga con tampón HEPES y los viales de polietileno con tampón HEPES.
5. Cosecha los tejidos
- Eutanasia al ratón por asfixia deCO2 . No realice una dislocación cervical, ya que esto puede impedir la recolección efectiva de sangre y la perfusión de tejido en pasos posteriores.
- En un área de banco limpia con suficiente espacio de trabajo e iluminación para ver bien el ratón, instale una bandeja de disección de goma, un cubo de hielo para almacenar muestras y una botella de spray con etanol al 70%. Rocíe el ratón con etanol al 70% para reducir la contaminación y controlar la propagación del cabello. Coloque el ratón sobre su espalda en la bandeja de goma y fije sus patas extendidas lejos de su cuerpo.
- Para prepararse para recolectar sangre, haga cuidadosamente una incisión en la piel en el borde del extremo caudal de la caja torácica del ratón. Corte una línea pequeña y recta hacia la cabeza del ratón (aproximadamente 1 cm) hasta que los músculos pectorales estén expuestos.
- En el sitio de la incisión inicial, haga dos pequeños cortes perpendiculares a la línea hacia la cabeza. Luego, corte cuidadosamente el músculo pectoral en un lado de la caja torácica en el área expuesta. Esto permite un mejor acceso y visualización de dónde se debe insertar la aguja.
- Para recolectar sangre, inserte la aguja entre la tercera y cuarta costilla en el lado donde se extrajo el músculo. Dado que el corazón del ratón se encuentra en el centro de la cavidad torácica, mantenga la aguja lo más cerca posible de la línea central de la caja torácica. Una vez insertado, tire suavemente de la jeringa para comenzar a recolectar sangre.
- Una vez recolectada, transfiera la sangre al tubo de microcentrífuga preparado con EDTA y guárdela en hielo.
NOTA: Si se extrae aproximadamente 100 μL de volumen y no entra sangre en la jeringa, intente girar la jeringa hacia la derecha o hacia la izquierda en caso de que la abertura de la aguja se presione contra la pared del corazón. Si esto no ayuda, mueva lentamente la aguja más adentro de la cavidad torácica o comience a retirarla. Si la sangre comienza a acumularse en la jeringa en este punto, continúe tirando lentamente de la jeringa. Considere rotar la jeringa y la aguja para una extracción exitosa. Finalmente, si no se recolecta sangre, retire la aguja, ya que puede haber pasado por alto el corazón. Intente volver a insertar la aguja y repetir el proceso mencionado anteriormente.
- A continuación, para perfundir el ratón, abra la cavidad torácica para acceder al corazón.
- Para hacer esto, corte la piel a lo largo del extremo de la caja torácica hasta el lado del ratón en cada lado. Luego, use los fórceps para sostener el esternón lejos de la superficie de trabajo. Haga una incisión pequeña y poco profunda justo debajo del extremo del esternón para cortar a través de la cavidad peritoneal. Corte a lo largo de la membrana peritoneal a lo largo del extremo de la caja torácica en cada uno de los lados del ratón. Esto debería exponer el hígado y la vesícula biliar. Tenga cuidado de no cortar ninguno de estos tejidos.
- Luego, haga un corte pequeño y poco profundo en el diafragma, craneal al hígado. Luego, corte el diafragma a lo largo del borde de la caja torácica para abrir la cavidad torácica. Asegúrese de evitar cortar cualquiera de los órganos dentro de la cavidad torácica.
- Haga dos cortes a lo largo de la caja torácica hacia la cabeza a unos 2-3 mm de la línea central del ratón y aproximadamente 0,75 cm de largo.
NOTA: Si se corta demasiado alto, se cortarán las arterias que residen en la parte superior de la caja torácica. Esto interferirá con la eficacia de la perfusión. - Levante hacia atrás la pieza central de la caja torácica para exponer la cavidad torácica. Aleje cualquier grasa o tejido para acceder al corazón.
- Haga un pequeño corte en la aurícula derecha del corazón del ratón para crear una abertura a través de la cual expulsar la sangre.
- Con una jeringa de 10 ml de heparina PBS, inserte la aguja en el ventrículo izquierdo del corazón del ratón.
- Comience suavemente a empujar PBS hacia el corazón lo más lentamente posible.
NOTA: Se debe observar sangre emergiendo de las aurículas derechas y llenando la cavidad torácica. Asegúrese de mantener el corazón en su ubicación fisiológica para evitar inhibir el flujo de PBS-heparina desde el corazón a través de la aorta. - Una vez que todos los 10 ml de PBS-heparina se hayan perfundido a través del ratón, deseche la jeringa y la aguja y retire el exceso de sangre y PBS-heparina de la cavidad torácica con toallas de papel o toallitas sin pelusa.
- Luego, para comenzar a extraer tejidos, corte la piel y la membrana peritoneal hacia la cola del ratón para abrir la cavidad peritoneal.
- Primero, extraiga la almohadilla de tejido adiposo inguinal de cada lado del ratón.
NOTA: Lea este proceso cuidadosamente: asegúrese de extraer el ganglio linfático inguinal de cada depósito para evitar sesgar la composición celular del tejido adiposo en los resultados.- Usando un segundo juego de fórceps, sostenga la membrana peritoneal con un juego de fórceps y el borde de la piel superpuesto sobre la membrana en ese lado con los otros fórceps. Tire suavemente de la piel de la membrana peritoneal para separar estas capas entre sí. Busque el depósito de tejido adiposo inguinal a lo largo de la piel. Fije el borde exterior de la piel para acceder mejor al depósito adiposo.
- Antes de la extracción, localice el ganglio linfático inguinal en el centro del depósito adiposo y retírelo con fórceps y tijeras según sea necesario.
NOTA: Si es posible, ubique las tres arterias más grandes que van desde los bordes exteriores del depósito hacia el centro. El ganglio linfático se encuentra alrededor de donde se unen estas arterias. - Después de extraer el ganglio linfático, sostenga cuidadosamente el extremo del depósito adiposo más cercano al punto fijado con los fórceps y comience a hacer pequeños cortes en la membrana conectiva entre el tejido adiposo y la piel. Levante el tejido adiposo lejos de la piel mientras hace cortes para facilitar el acceso a la membrana y asegurarse de que se extraiga todo el depósito.
- Coloque el depósito adiposo en un vial de polietileno preparado con tampón HEPES en hielo para mantener el tejido viable durante el resto de la cosecha.
- Repita este proceso en el otro lado del ratón para extraer ambos depósitos. Los depósitos pueden ser digeridos y procesados juntos o por separado. Si cada depósito se va a procesar por separado, se deben preparar más tubos.
- A continuación, extraer los depósitos adiposos del epidídimo del extremo caudal de la cavidad peritoneal. Usando fórceps, tire suavemente del primer depósito adiposo epididimario del extremo dorsal del ratón y localice el epidídimo y el conducto deferente unidos a este depósito.
NOTA: Hay dos depósitos adiposos epididimarios: uno unido a cada epidídimo y conducto deferente.- Cortar cuidadosamente entre el depósito adiposo y el epidídimo y el conducto deferente para separar el tejido adiposo de estos otros tejidos. Coloque el depósito adiposo en un vial de polietileno con tampón HEPES en hielo para mantener el tejido viable durante el resto de la cosecha.
- Finalmente, extraiga el bazo, que se encuentra a la izquierda del estómago cerca del diafragma. Con fórceps, tire suavemente del estómago hacia el centro de la cavidad peritoneal para exponer el bazo.
- Sostenga suavemente un extremo del bazo y tire ligeramente lejos del estómago. Corte la membrana entre el bazo y su tejido adyacente hasta que el órgano se desprenda. Coloque el bazo en el tubo de microcentrífuga preparado con tampón HEPES y guárdelo en hielo.
- Antes de procesar los tejidos o cosechar los tejidos del siguiente ratón, deseche la carcasa y las toallas o almohadillas de papel sucias. Limpie las herramientas también.
NOTA: Si hay varios ratones, repita estos pasos de cosecha para cada ratón antes de pasar al siguiente paso de procesamiento. Si se incluye un ratón / ratones de control, considere cosecharlos antes de los ratones tratados con liposomas para evitar cualquier contaminación.
6. Procesar tejidos
NOTA: Dado que el tejido adiposo tiene una incubación de digestión larga, se recomienda comenzar con ese proceso primero y trabajar en el procesamiento de la sangre y el bazo durante el período de digestión.
- Primero, picar y digerir los tejidos adiposos. Usando uno o dos pares de tijeras, picar el tejido adiposo en cada vial de polietileno hasta que el tejido esté en trozos pequeños de menos de 0,5 mm de tamaño. Esto permite una digestión más eficiente.
- Una vez que los tejidos de todos los viales estén picados, agregue 1,5 ml de tampón de colagenasa de 2 mg/ml a cada vial. Colocar los viales en una incubadora agitadora a 37 °C y 150 rpm. Incubar durante 30 a 45 min.
NOTA: Si los tejidos adiposos son particularmente grandes, considere agregar otros 0.5 ml a 1.5 ml de tampón HEPES y un volumen igual de tampón de colagenasa al vial (s) para garantizar que los tejidos estén completamente sumergidos y haya suficiente enzima presente. La concentración final de colagenasa tipo I en la digestión debe ser de 1 mg/ml, independientemente del volumen final de la solución. Además, si no se dispone de una incubadora de agitación, las muestras se pueden colocar en un baño maría calentado a 37 °C. Agitar suavemente las muestras cada 5 min para mezclar y resuspender la digestión. - Comprobar las muestras a los 30 min. Use una pipeta de 1 ml para pipetear la muestra hacia arriba y hacia abajo. Si las piezas de tejido aún son demasiado grandes para un pipeteo fácil, devuelva las muestras a la incubadora durante 15 minutos adicionales.
- Una vez que las muestras estén completamente digeridas, continúe pipeteando la muestra hacia arriba y hacia abajo otras 10 veces para asegurarse de que se haya creado una suspensión de una sola célula.
NOTA: (Opcional) Compruebe las muestras a los 30 min. Utilice una pipeta de 1 ml para pipetear la muestra hacia arriba y hacia abajo. Si las piezas de tejido aún son demasiado grandes para un pipeteo fácil, devuelva las muestras a la incubadora durante 15 minutos adicionales. - Pipet la suspensión celular a través de un filtro de 70 μm en un tubo cónico de 50 ml. Añadir 5 ml de tampón FACS al vial de digestión vacío para lavar el vial. Transfiera este tampón de lavado a través del filtro para agregarlo a la suspensión celular.
- Almacene las muestras en hielo mientras se procesan otras. Una vez filtradas todas las muestras, hiéralas girar hacia abajo a 400 x g, 4 °C durante 5 min.
- Retire el sobrenadante de adipocitos por aspiración y luego retire cuidadosamente el infranadante entre el sobrenadante de adipocitos y el pellet por aspiración para dejar el pellet de fracción estromal vascular (SVF).
- Vuelva a suspender este pellet en 1 ml de tampón FACS y transfiéralo a un tubo de microcentrífuga limpio de 1,5 o 1,7 ml. Células alícuotas ahora si se desea o se necesita. Mantener en hielo hasta que todas las muestras estén listas para la tinción por citometría de flujo.
NOTA: Si los depósitos adiposos digeridos fueran grandes, considere usar solo el 50% o 25% de la muestra para la tinción y el análisis de la citometría de flujo. Además, si se necesitan controles de fluorescencia menos uno (FMO) o controles adicionales para el análisis de citometría de flujo (Tabla 1), asegúrese de alícuota la muestra adicional en un tubo separado para su procesamiento. Los FMO se utilizan para distinguir entre la señal negativa y positiva para un anticuerpo individual conjugado con fluoróforos dentro del panel completo utilizado en el experimento.
- Una vez que los tejidos de todos los viales estén picados, agregue 1,5 ml de tampón de colagenasa de 2 mg/ml a cada vial. Colocar los viales en una incubadora agitadora a 37 °C y 150 rpm. Incubar durante 30 a 45 min.
- Segundo, procesa la sangre.
- Transfiera 50 μL de sangre a un tubo cónico de 15 ml.
- Agregue 1 ml de tampón de lisis AKC a cada tubo y pipete hacia arriba y hacia abajo para alcanzar una suspensión de una sola celda. Agregue 4 ml adicionales de tampón de lisis AKC a cada tubo e incube durante 5\u201210 min. Si hay un agitador o rotador disponible, selle las tapas del tubo herméticamente y coloque los tubos en uno de estos para mejorar la mezcla.
- Añadir 5 ml de tampón FACS para apagar el proceso de lisis y centrifugar las muestras a 400 x g, 4 °C durante 5 min. Retire el sobrenadante y compruebe el pellet. Si todavía está bastante rojo, repita el proceso de lisis. De lo contrario, vuelva a suspender los gránulos en 1 ml de tampón FACS y transfiéralos a un tubo de microcentrífuga limpio de 1,5 o 1,7 ml. Mantener en hielo hasta que todas las muestras estén listas para la tinción por citometría de flujo.
- Finalmente, procesa el bazo. Transfiera el bazo a un filtro de 70 μm sobre un tubo cónico de 50 ml. Lave el tejido con 1 ml de tampón FACS y luego triture el bazo a través del filtro usando el extremo del émbolo de una jeringa de 1 ml. A lo largo del proceso de maceración, lave las células en el tubo cónico de 50 ml utilizando más tampón FACS. El volumen final en el tubo cónico debe ser de 10 ml.
- Girar las celdas a 300 x g a 4 °C durante 5 min. Retire el sobrenadante y vuelva a suspender en 1 ml de tampón de lisis AKC. Agregue 4 ml adicionales de tampón de lisis AKC e incube durante 5 min. Añadir 5 ml de tampón FACS para apagar el proceso de lisis y girar las muestras a 300 x g a 4 °C durante 5 min.
- Retire el sobrenadante y vuelva a suspender el pellet en 1 ml de tampón FACS. Transfiera la suspensión a través de un segundo filtro limpio de 70 μm a un tubo cónico de 50 ml. Agregue 4 ml de tampón FACS para lavar el tubo original y transfiera el tampón a través del filtro para obtener un volumen final de 5 ml.
- Transfiera 50 μL de la suspensión celular a un tubo de microcentrífuga limpio de 1,5 o 1,7 ml y manténgalo en hielo hasta que todas las muestras estén listas para la tinción por citometría de flujo. Se pueden transferir alícuotas adicionales a los tubos si se desean o requieren más.
NOTA: Los esplenocitos son excelentes células para usar en una tinción única viva / muerta. Considere la posibilidad de transferir una alícuota adicional para este control.
7. Teñir células de tejidos para citometría de flujo
- Girar muestras alícitas a 400 x g, 4 °C durante 5 min.
- Retirar sobrenadante y resuspender las muestras en 50 μL de Fc Block (diluido) (Tabla 2). Incubar en hielo durante 5 min.
- Añadir 50 μL de mezcla de anticuerpos 2x (Tabla 3) a cada muestra. Incubar en hielo en la oscuridad durante 20 min.
NOTA: Cualquier tinción individual NO debe teñirse con esta mezcla de anticuerpos. Además, si se van a utilizar FMO, las mezclas de anticuerpos FMO deben prepararse por separado. - Lavar las muestras con 1 ml de PBS y centrifugar a 400 x g, 4 °C durante 5 min. Retirar el sobrenadante y resuspender las muestras en 200 μL de tinción de viabilidad (Tabla 3). Incubar en hielo en la oscuridad durante 20 min.
NOTA: No olvide teñir las células que se reservaron para una sola tinción Vivo / Muerto durante este paso. - Lavar las muestras con 1 ml de tampón FACS y centrifugar a 400 x g, 4 °C durante 5 min. Retirar el sobrenadante y resuspender las muestras (excepto la tinción única viva/muerta) en 50 μL de medio de fijación (reactivo A) para fijar las muestras. Incubar a temperatura ambiente en la oscuridad durante 15 min.
- Resuspender la tinción única Live/Dead en 100 μL de PFA al 2%. Incubar a temperatura ambiente en la oscuridad durante 5 min.
- Lavar la muestra con 1 ml de tampón FACS y centrifugar a 800 x g, 4 °C durante 5 min. Eliminar el sobrenadante y resuspender las muestras en 250 a 500 μL de tampón FACS. Conservar a 4 °C hasta que las muestras puedan funcionar en el citómetro de flujo.
- Lavar las muestras con 1 ml de tampón FACS y centrifugar a 800 x g, 4 °C durante 5 min. Extraer el sobrenadante y resuspender las muestras en 50 μL de medio de permeabilización (Reactivo B) más anticuerpo/s contra proteínas intracelulares. Incubar a temperatura ambiente en la oscuridad durante 20 min.
- Lavar las muestras con 1 ml de tampón FACS y centrifugar a 800 x g a 4 °C durante 5 min. Retirar el sobrenadante y resuspender las muestras en 100 μL de paraformaldehído (PFA) al 2%. Incubar a temperatura ambiente en la oscuridad durante 5 min.
- Lavar las muestras con 1 ml de tampón FACS y centrifugar a 800 x g, 4 °C durante 5 min. Retirar el sobrenadante y resuspender las muestras en 250 a 500 μL de tampón FACS. Conservar a 4 °C hasta que las muestras puedan funcionar en el citómetro de flujo.
Resultados
Producción de liposomas
Los resultados publicados aquí son similares a los de nuestro trabajo publicado anteriormente 3,4,20. Utilizando el protocolo presentado aquí, esperamos producir liposomas de aproximadamente 150\u2012160 nm de tamaño. DLS revela un diámetro promedio de liposomas de 163.2 nm y un potencial zeta de -19.2 mV (Figura 1A). Las imágenes de microscopía electrónica criogénica (crio-EM) revelan liposomas circulares (Figura 1B) y el diagrama DLS revela una desviación estándar relativamente pequeña del diámetro promedio (Figura 1C).
La unión positiva a liposomas requiere un control tratado con PBS
Estudios previos de nuestro grupo que emplea este protocolo investigaron qué subconjuntos celulares en SVF adiposo, bazo y sangre se unieron a los liposomas después de una semana de administración in vivo 3,4. Usando un ratón tratado con PBS, la cavidad peritoneal y las células del bazo se tiñeron con el mismo panel de anticuerpos utilizado en muestras de ratones tratados con liposomas. Los tejidos se recolectaron después de una semana de tratamientos (Figura 2A). Las muestras del ratón tratado con PBS sirvieron como un DiD FMO con el que crear puertas DiD positivas (Figura 2B, C). Se puede crear una puerta positiva utilizando una señal DiD-positiva, pero las muestras que carecen de señal DiD también deben usarse para verificar que la puerta positiva no incluya ninguna muestra DiD-negativa.
Las valoraciones son necesarias para optimizar las señales de fluorescencia
Antes de ejecutar un experimento completo, se deben optimizar varias condiciones, incluida la concentración de anticuerpos conjugados fluorescentes utilizados durante la tinción celular y del colorante lipídico utilizado durante la preparación de liposomas. Los citómetros de flujo tienen un límite superior de detección de la intensidad de fluorescencia, por lo que demasiado colorante incorporado en los liposomas conducirá a niveles no cuantificables de señal DiD en muestras que pasan por el citómetro. Además, demasiado DiD en los liposomas puede conducir a altos niveles de transferencia de tinte no específico, lo que podría sesgar los resultados de captación celular. La Figura 3 informa los resultados de un experimento en el que se ajustaron concentraciones de colorante lipídico para identificar la concentración que produciría una señal óptima dentro del rango de detección del citómetro de flujo que se utilizó. Esto se realizó en los tejidos de interés para el experimento final: Sangre (Figura 3A), SVF adiposa inguinal (Figura 3B) y SVF adiposa epididimaria (Figura 3C). Las concentraciones seleccionadas para la prueba fueron 10 mg de DiD (alto, rojo), 1 mg de DiD (medio, azul) o 0,1 mg de DiD (bajo, gris) por 1 ml de liposomas. La concentración más alta utilizada en los liposomas fue demasiado alta y superó el rango cuantificable del citómetro en los tres tejidos (Figura 3A\u2012C, rojo). La concentración más baja de DiD mostró alguna señal (Figura 3 A\u2012C, gris), pero no se observó una población clara más allá de las células tratadas con PBS (Figura 3A\u2012C, negra). Cuando se cuantificó, la media aritmética de la DiD MFI para cada tejido y concentración demostró una clara distinción entre los controles de PBS y la concentración media de DiD (Figura 3D). Por lo tanto, como se indica en el protocolo, seleccionamos la concentración media (Figura 3, azul) para usar en nuestra preparación de liposomas.
El uso de un panel de anticuerpos múltiples permite la identificación de la captación de liposomas por diferentes subconjuntos celulares
Usando el panel descrito en la Tabla 3, las células se tiñeron con anticuerpos contra marcadores para macrófagos a, células B, células T, células dendríticas, monocitos y células endoteliales (Figura 4). Se requieren estrategias de compuerta ligeramente diferentes para cada tipo de tejido, pero la mayoría de los mismos tipos de células se pueden identificar en cada uno. Algunas excepciones incluyen las células endoteliales, que normalmente no se encuentran en la sangre, y los monocitos, que suelen tener una frecuencia más alta en la sangre que otros tejidos. Una vez que se identifican las poblaciones, se puede cuantificar el tamaño total de cada población celular y la frecuencia con la que son DiD +. Se pueden realizar cálculos adicionales para caracterizar la población de DiD +: qué porcentaje de células DiD + son macrófagos, células endoteliales, etc. Tenga en cuenta que estas son estrategias de compuerta de ejemplo, pero no la única forma de analizar las muestras. El análisis será dictado por el panel seleccionado y el citómetro de flujo disponible.
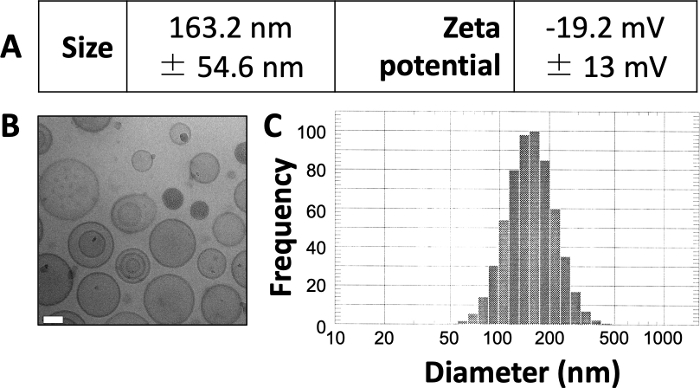
Figura 1: Ejemplo de características de los liposomas preparados.
(A) El tamaño y el potencial zeta se midieron como se describió anteriormente y se han informado en forma de tabla. Cada parámetro se presenta como la media ± la desviación estándar. (B) Se utilizó Cryo-EM para obtener imágenes de los liposomas preparados. La barra de escala blanca tiene una longitud de 50 nm. (C) Se utilizó DLS para generar un histograma del diámetro de los liposomas en esta preparación. Esta figura está adaptada de Osinski et al.3. Haga clic aquí para ver una versión más grande de esta figura.
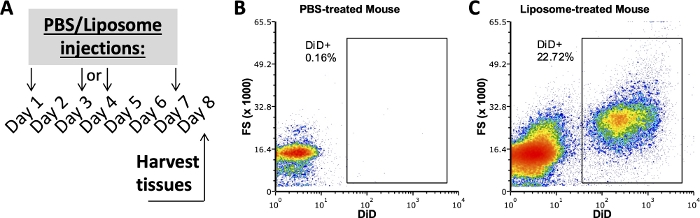
Figura 2: Tinción DiD representativa de ratones tratados con PBS o liposomas.
(A) Esquema experimental para PBS y tratamientos liposómicos. PBS o liposomas se inyectaron tres veces en el transcurso de una semana. Los tejidos se cosecharon el día 8 de tratamiento. (B, C) Los diagramas de flujo representativos revelan tinción DiD positiva en ratones tratados con liposomas (C), pero no tratados con PBS (B). FSC, dispersión hacia adelante. Haga clic aquí para ver una versión más grande de esta figura.
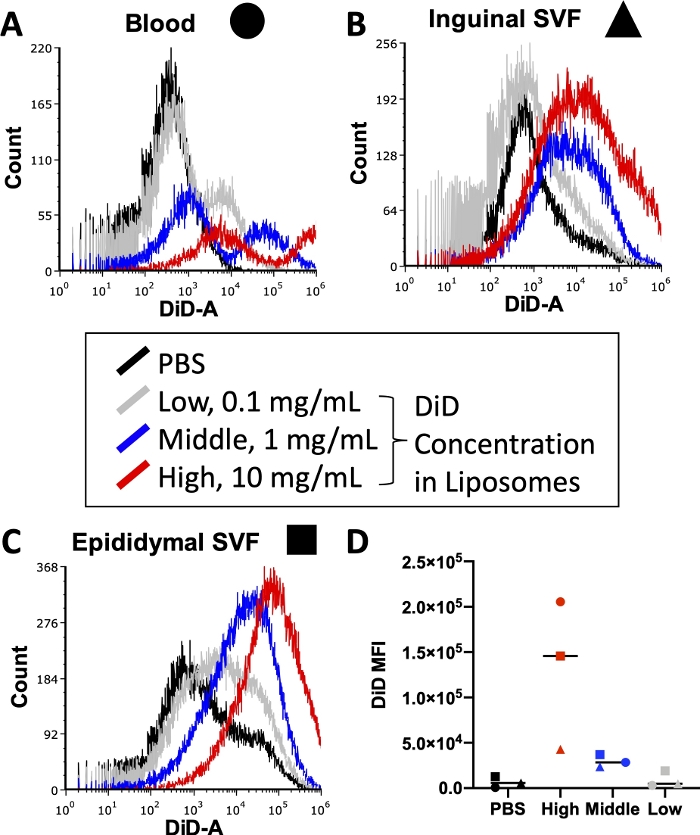
Figura 3: Titulación de DiD en liposomas.
Los liposomas se prepararon con tres concentraciones diferentes de DiD y se inyectaron en ratones. El gris indica la baja concentración a 0,1 mg de DiD por 1 ml de liposomas, el azul indica la concentración media a 1 mg de liposomas DiD/ml y el rojo indica la alta concentración a 10 mg de liposomas DiD/ml. Se utilizó un ratón tratado con PBS como control negativo (negro). La sangre (A, círculo), adiposo inguinal (B, triángulo) y el adiposo epididimario (C, cuadrado) se recolectaron 24 h después de la inyección y se procesaron para aislar una suspensión unicelular. Estas muestras se ejecutaron en un citómetro de flujo hasta el nivel de DiD detectable. Se presentan histogramas específicos de tejido con superposiciones de cada grupo de tratamiento para demostrar la intensidad de fluorescencia por concentración (A\u2012C). La media aritmética de DiD también se cuantificó para cada tejido y concentración y se graficó (D). SSC = dispersión lateral. Haga clic aquí para ver una versión más grande de esta figura.
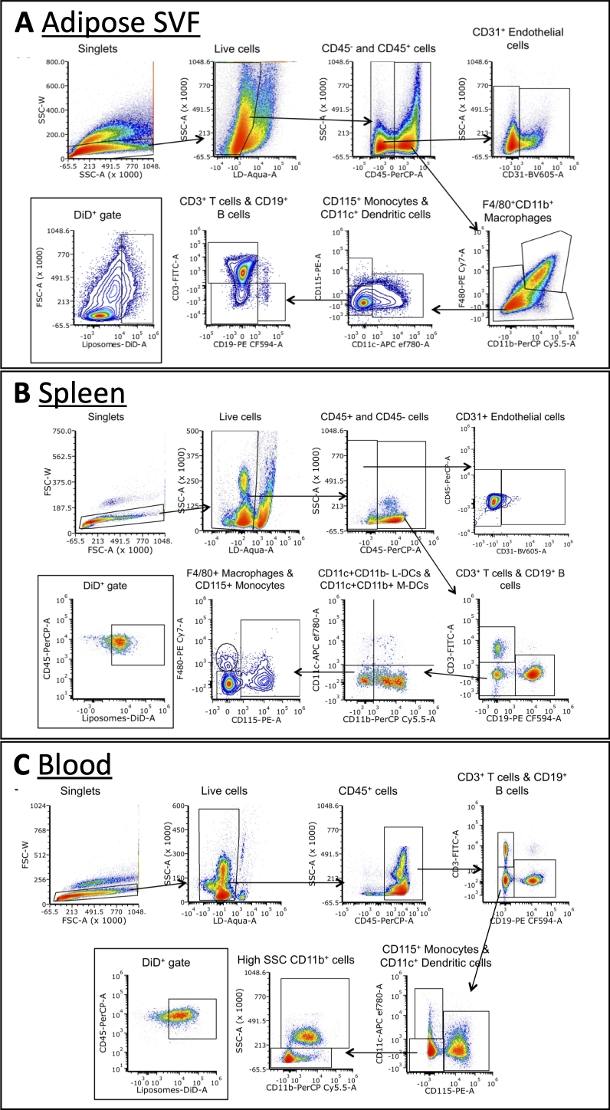
Figura 4: Análisis de citometría de flujo representativa de subconjuntos celulares en SVF adiposo, sangre y bazo.
(A\u2012C) Esquema representativo de la estrategia de compuerta para identificar subconjuntos celulares y células DiD+ en SVF adiposo (A), bazo (B) y sangre (C). Abreviaturas: FSC = dispersión hacia adelante; LD = vivo/muerto; L-DC = células dendríticas linfoides; M-DC = células dendríticas mieloides; SSC = dispersión lateral. Esta figura está adaptada de Osinski et al.3. Haga clic aquí para ver una versión más grande de esta figura.
| Control | Propósito |
| Ratón tratado con PBS o solución salina | Utilice las células de este ratón para los siguientes controles de citometría de flujo: |
| 1. Células no teñidas | |
| 2. Mancha única viva/muerta | |
| 3. Células teñidas con el panel completo, pero que carecen de la fluorescencia del liposoma para determinar la señal positiva del liposoma durante el análisis | |
| Este / estos ratones / ratones también se utilizarán para determinar si los liposomas tienen algún efecto in vivo, ya que tendrá un control no liposomático en su experimento. | |
| Liposomas descargados | Si está cargando un compuesto en sus liposomas, una porción de su lote de liposomas debe sintetizarse sin el compuesto. Esto explica cualquier efecto in vivo de los liposomas solos. |
| DiD solo | Dado que DiD también puede ser absorbido por las membranas celulares, la asignación de algunos ratones para recibir tinte libre en una cantidad igual a la que se encuentra en los liposomas ayudará a explicar cualquier tinción de membrana de fondo. |
| Controles de fluorescencia menos uno (FMO) | Estas son células teñidas con todos menos uno de los anticuerpos en su panel. Al igual que # 3 en el cuadro anterior, esto ayuda a determinar la verdadera señal positiva para ese anticuerpo durante el análisis. |
Tabla 1: Controles a utilizar en este protocolo.
| Solución | Componentes | Volumen aproximado necesario por lote/ratón |
| Preparación de liposomas | ||
| Acetato de calcio | 1 M de acetato de calcio enH2O | 50 ml |
| Búfer HEPES | 10 mM HEPES enH2O, pH 7.4 | 50 ml |
| Tesaglitazar en HEPES | en HEPES de 10 mM | 10 ml |
| Cosecha, procesamiento y tinción de tejidos | ||
| Solución tamponada con fosfato (PBS) | 137 mM NaCl, 2,7 mM KCl, 10 mM Na 2 HPO 4, 1,8 mM KH 2 PO4 en H 2O destilado | 2 ml |
| PBS-Heparina | Heparina de 0,1 mM en PBS | 10 ml |
| Búfer HEPES | 20 mM HEPES en PBS | 5 ml |
| Tampón de digestión | 2 mg/ml de colagenasa tipo I en tampón HEPES | 5 ml |
| Tampón de lisis AKC | 0,158 M NH 3 Cl,10 mM KHCO3, 0,1 mM Na 2 EDTA en ddH 2 O, pH7,2 | 15 ml |
| Tampón FACS | 1% BSA, 0.05% NaN3 en PBS | 15 ml |
| Bloque Fc (diluido) | Bloque Fc 1:50 en búfer FACS | 250 μL |
| Tampón de fijación | Paraformaldehído al 2% en PBS | 200 μL |
Tabla 2: Soluciones para preparar.
| Un | B | C | D |
| Tinción extracelular (mezcla de anticuerpos 2x) | |||
| Antígeno | Fluoróforo | Volumen Ab por ensayo de 100 μL | Volumen total necesario: |
| CD45 | PerCP | 0,5 μL | Columna C x 1.2 x Total # muestras |
| CD11b | PerCP Cy5.5 | 0,25 μL | (0,5 μL/prueba) x (1,2) x (# muestras) |
| F4/80 | PE Cy7 | 0,25 μL | (0,25 μL/prueba) x (1,2) x (# muestras) |
| CD19 | PE-CF594 | 1 μL | (0,25 μL/prueba) x (1,2) x (# muestras) |
| CD3 | FITC | 1 μL | (1,0 μL/prueba) x (1,2) x (# muestras) |
| CD31 | BV605 | 0,25 μL | etc... |
| CD11c | APC ef780 | 1 μL | |
| CD115 | PEI | 1,5 μL | |
| Para crear su mezcla de anticuerpos, combine los anticuerpos calculados en la columna D con tampón FACS o tampón de tinción violeta brillante* hasta un volumen final de (50 μL x 1.2 x Total # muestras) | |||
| Tinción viva/muerta (1x) | |||
| Vivo/Muerto | Fluoróforo | Volumen L/D por ensayo de 200 uL | Volumen total necesario: |
| Vivo/Muerto | Aqua | 0,67 μL | Columna C x 1.2 x Total # muestras |
| Tinción intracelular (1x) | |||
| Antígeno | Fluoróforo | Volumen Ab por ensayo de 50 μL | Volumen total necesario: |
| αSMA | FITC | 0.125 | Columna C x 1.2 x Total # muestras |
| *Se debe usar el tampón de tinción violeta brillante si se usa más de un anticuerpo conjugado con un fluoróforo violeta brillante en su panel. | |||
Tabla 3: Ejemplo de panel de anticuerpos y cálculos de mezclas de tinción para usar para la tinción de flujo.
Discusión
Aquí describimos un protocolo de tres partes para (i) preparar liposomas marcados con un colorante lipídico fluorescente y cargados con un compuesto antidiabético, tesaglitazar, (ii) administrar liposomas a un ratón mediante inyección retroorbitaria, y (iii) cosechar, procesar y teñir tejidos para detectar la absorción de liposomas a nivel celular mediante citometría de flujo. Este protocolo revisa la preparación de liposomas de aproximadamente 150 μm y la evaluación de la captación en tejido adiposo, sangre y bazo. La preparación de liposomas es escalable, se realiza principalmente a temperatura ambiente y utiliza la evaporación de fase inversa para maximizar la carga de fármaco y la eliminación de disolventes orgánicos. Usando este protocolo, se puede alcanzar una concentración de tesaglitazar de hasta 2 mg/ml en la muestra de liposoma purificada. Los liposomas preparados pueden almacenarse en tampón HEPES a 4 °C durante más de un año. En nuestra experiencia, demostraron una variación mínima del tamaño medio de partícula. Menos del 10% de pérdida de contenido de fármaco se demostró espectrofotométricamente, después de la separación por ultrafiltración de liposomas de fármaco externo con un filtro centrífugo de 10 kDa.
Durante la preparación de los liposomas, hay algunos pasos críticos y factores a considerar. En primer lugar, el orden de los pasos del protocolo es importante y debe cumplirse. En segundo lugar, el pH de la solución utilizada al cargar tesaglitazar debe mantenerse en 7.4 para maximizar la solubilidad y la carga efectiva. En tercer lugar, el montaje adecuado de equipos y filtros garantiza que la salida de cada paso sea del tamaño y la pureza adecuados. Por ejemplo, si los filtros de 100 y 200 nm no se ensamblan correctamente, puede resultar un lote de liposomas más heterogéneo y de tamaño incorrecto. En cuarto lugar, se necesita la eliminación completa del acetato de Ca-antes de la carga del fármaco para maximizar la transferencia de tesaglitazar a los liposomas. Para probar la eliminación completa del acetato de Ca, use sedimentación de alta velocidad para eliminar los liposomas y luego mida los niveles de acetato de Ca-en la solución no liposomal. En quinto lugar, es importante pesar y registrar la masa de todos los materiales añadidos a la preparación de liposomas en cada paso. Esto garantiza que se puedan calcular las concentraciones adecuadas y que se mantengan las proporciones necesarias de materiales. Finalmente, si la técnica no se ejecuta correctamente, puede haber un nivel indeseable de heterogeneidad. Es importante verificar minuciosamente este parámetro utilizando DLS y otros enfoques como la microscopía electrónica. Para mejorar la homogeneidad, considere ajustar el tamaño del filtro seleccionado o apilar dos filtros.
Además, es fundamental que los controles y un panel de anticuerpos para la citometría de flujo se planifiquen y optimicen antes de realizar este protocolo en su totalidad (Tabla 1, Tabla 3). Los anticuerpos deben probarse para garantizar que se utilicen las concentraciones adecuadas para la tinción y que la superposición entre los fluoróforos sea mínima. La excitación y emisión del tinte utilizado durante la preparación de liposomas también debe tenerse en cuenta en la planificación del panel. En nuestros resultados, utilizamos DiD, que tiene una excitación y emisión similares a los fluoróforos como la aloficocianina (APC) y AlexaFluor 647. Por lo tanto, no seleccionamos anticuerpos conjugados a estos fluoróforos en nuestro panel de anticuerpos. Además, los controles de isotipo no están incluidos en este protocolo. Esto se debe a que los anticuerpos seleccionados para este protocolo son anticuerpos bien validados y disponibles comercialmente. Sin embargo, si está interesado en usar un anticuerpo que no se haya optimizado previamente, considere probar el anticuerpo contra un control de isotipo en los tejidos de interés antes de realizar el experimento completo.
Si bien este protocolo demuestra cómo extraer y procesar la sangre, el bazo, el tejido adiposo inguinal y el tejido adiposo epididimario del ratón después del tratamiento, este enfoque general se puede aplicar a otros tejidos. Dependiendo del tejido de interés, puede ser necesario alterar los protocolos de procesamiento y digestión como se publica para los siguientes tejidos: pulmón21, hígado22, cavidad peritoneal 3, médula ósea3,23, cerebro 24.
Una limitación importante de este método a considerar es que la absorción solo puede evaluarse en un punto de tiempo por animal. Por lo tanto, puede ser ventajoso acoplar este protocolo con otras técnicas de imagen no invasivas o planificar en consecuencia para garantizar recursos suficientes para realizar la evaluación. El momento de la absorción celular y el cambio celular son factores importantes a considerar: los liposomas circularán por todo el cuerpo en las primeras 24 h y, dependiendo de la vida útil de las células que absorben los liposomas o de cómo responden a la absorción, puede ocurrir la muerte celular o una fagocitosis adicional. Nuestro estudio previo demostró cambios en las características poblacionales de las poblaciones de DiD+ en diferentes puntos temporales3. Por esa razón, es importante evaluar la absorción en puntos de tiempo anteriores o puntos de tiempo más relevantes para la biología del mecanismo de interés. Además, aunque la cuantificación de la captación celular en todo el tejido se puede realizar con este protocolo, la citometría de flujo no puede revelar la localización del tejido. Combinar este enfoque con métodos histológicos puede ayudar a abordar esta limitación.
En general, este protocolo complementa la metodología existente, como la histología y las imágenes de fluorescencia de cuerpo entero. Con los continuos avances en las herramientas y métodos de citometría de flujo, será posible el desarrollo de paneles más grandes para poblaciones celulares cada vez más específicas. Sugerimos que este protocolo se utilice además de los métodos antes mencionados, ya que esto mejorará la evaluación de la captación celular y también brindará la oportunidad de validar los resultados observados por citometría de flujo. Por ejemplo, ¿debería encontrarse que la mayoría de las partículas en el tejido adiposo fueron absorbidas por macrófagos por citometría de flujo? La inmunofluorescencia de una alícuota adicional del mismo tejido adiposo podría guardarse, fijarse, seccionarse y teñirse para los marcadores de macrófagos para verificar que el tipo de célula realmente absorbe liposomas. Este enfoque debería agregar rigor a los ensayos de biodistribución de nanopartículas realizados: validar la orientación específica de la célula, cuantificar la absorción celular, identificar la absorción fuera del objetivo y, con suerte, proporcionar información para generar hipótesis mecanicistas para los resultados terapéuticos observados. Este protocolo también se puede adaptar para futuros estudios utilizando diferentes liposomas, investigando la captación en otros tejidos y probando nuevos compuestos en el contexto de la obesidad y el dismetabolismo o cualquier otra enfermedad en la que la administración de nanopartículas sea una opción terapéutica factible.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a Michael Solga y al resto del personal del Núcleo de Citometría de Flujo por proporcionar capacitación y servicios de citometría de flujo. Los autores también desean agradecer a Shiva Sai Krishna Dasa, Dustin K. Bauknight, Melissa A. Marshall, James C. Garmey, Chantel McSkimming, Aditi Upadhye y Prasad Srikakulapu por su ayuda con la preparación de liposomas (SSKD, DKB), las cosechas de tejidos (MAM, JCG) y la tinción por citometría de flujo y la adquisición de muestras (AU, PS, CM). Este trabajo fue apoyado por las subvenciones de AstraZeneca, R01HL 136098, R01HL 141123 y R01HL 148109, AHA 16PRE30770007 y T32 HL007284.
Materiales
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
Referencias
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados