Method Article
荧光染料标记脂质体体内组织特异性细胞摄取的制备、给药和评估
摘要
该协议的目标是合成荧光标记的脂质体,并使用流式细胞术在细胞水平上鉴定脂质体的体内定位。
摘要
人们对使用脂质体在体内递送化合物的兴趣日益浓厚,特别是对于靶向治疗方法。根据脂质体配方,脂质体可以优先被体内不同的细胞类型吸收。这可能会影响治疗颗粒的疗效,因为不同疾病的进展是组织和细胞类型特异性的。在该协议中,我们提出了一种使用DSPC,胆固醇和PEG-2000 DSPE以及脂质染料DiD作为荧光标记合成和荧光标记脂质体的方法。该协议还提供了一种在体内递送脂质体和使用流式细胞术评估脂质体的细胞特异性摄取的方法。这种方法可用于确定吸收脂质体的细胞类型,并量化脂质体摄取在细胞类型和组织中的分布和比例。虽然本协议中未提及,但额外的测定(例如细胞仪上的免疫荧光和单细胞荧光成像)将加强所做的任何发现或结论,因为它们允许评估细胞内染色。方案可能还需要根据感兴趣的组织进行调整。
引言
随着对开发利用纳米颗粒药物递送的疗法的兴趣不断增长,制备和评估颗粒分布和摄取的方法必须继续推进,扩展,并为研究界所用1,2。该协议旨在评估在用装有tesaglitazar(一种过氧化物酶体增殖物激活受体(PPAR)-α/γ激动剂3,4)的DiD标记脂质体处理后在体内吸收脂质体的确切细胞类型。在这些研究中,我们能够评估脂质体tesaglitazar治疗直接影响哪些细胞类型,靶向部分的功效,并生成假设来解释我们观察到的治疗结果。此外,在多种细胞类型中建立的生物学功能表明吞噬细胞如巨噬细胞、树突状细胞和肝脏特异性库普弗细胞占据了大部分脂质体5,6,7。利用该协议,我们已经证明非经典吞噬细胞也可以吸收脂质体3,4。
该协议提供了一种优化的方法,用于溶解tesaglitazar,通过反相蒸发制备脂质体,并使用醋酸钙作为远程药物加载的引诱剂。所提供的方法可供许多实验室使用,并且缺乏难以获得的材料和需要高温的步骤。该方案产生大小的脂质体,最适合增加体内循环8。此外,正如Su等人所总结的那样,迄今为止,已经对评估体内脂质体分布和组织摄取的方法进行了深入研究和测试9。正电子发射断层扫描(PET),磁共振成像(MRI)和荧光分子断层扫描(FMT)方法用于量化组织特异性生物分布和摄取9,10,11。虽然这些方法已经过优化以最大限度地提高体内检测率,但它们仍然缺乏以细胞分辨率量化体内脂质体摄取的能力。这里介绍的方案旨在通过使用流式细胞术来满足这一需求。最后,对于该协议,细胞摄取缩小到包括脂肪组织在内的一些组织。越来越多的文献调查了在肥胖,代谢障碍和炎症的情况下使用纳米颗粒提供治疗的潜力12,13,14,15,16,17。因此,我们认为与处理和分析脂肪组织的有效方法共享协议很重要 - 脂肪组织是在这些病理中起重要作用的组织之一。
研究方案
本协议中的所有步骤均由弗吉尼亚大学动物护理和使用委员会批准并遵循其指南。
注意:在以后的分析步骤中需要考虑一些重要的对照,这些对照总结在 表1 中,应在脂质体给药前考虑。
1.制备荧光标记的脂质体,负载醋酸钙和替格列塔唑
- 联合使用 DSPC(1,2-二硬脂酰基-sn-甘油-3-磷酸胆碱)、胆固醇、PEG-2000-DSPE 和 DiD。为此,将DSPC,胆固醇和PEG-2000 DSPE以2:1:1的质量比组合。加入 DiD 脂质染料,浓度为 1 mg 每 1 mL 脂质体 DiD(DSPC:DiD 的摩尔比为 46:1)。
注意:DiD是1,1'-二十八烷基-3,3,3',3'四甲基吲哚羚花青染料的公认缩写。由于它具有两个与该配方中使用的DSPC长度相等的十八烷基"脂肪尾",因此它应主要掺入脂质膜中。DiO、DiD 和 DiI 等脂质染料通常用于脂质体研究8 ,它们被认为是不可交换的18。 - 使用 20 mL 闪烁瓶进行倒相乳液和脂质体制备。在该小瓶中,将脂质的2:1醚氯仿溶液与乙酸钙水溶液(乙酸钙,1M,pH 7.4)混合。有机相和水相的比例应为4:1,例如,4 mL 有机相和 1 mL 水相。
- 在室温下超声处理30秒,使脂质的乙醚-氯仿溶液乳化。以 20 KHz 和 50% 功率操作超声仪,并使用 1/2 英寸。探针。
注意:将超声探头的尖端靠近小瓶底部,以免起泡。超声处理过程中不要用探头尖端触摸玻璃,否则可能会破裂。此外,氯仿需要作为助溶剂添加到乙醚中:在胆固醇存在的情况下,仅醚乳液会迅速分离,使该过程的这一步变得不可能。 - 立即将装有均质油包水乳液的小瓶放在带有特殊适配器、压力计和压力调节阀的旋转蒸发器上。蒸发器应连接到真空管路以除去有机溶剂。将转速设置为 100 rpm,将真空设置为 0.5 atm,如果乳液起泡看起来过多,则释放。凝胶形成并消失后,将真空度增加到0.9个大气压。
注意:在挥发性有机相去除过程中,应逐渐调整真空度,以避免快速起泡,因为这可能导致内容物从小瓶流失到旋转蒸发器的主体中。最终,当乙醚和氯仿部分蒸发并且水相和有机溶剂相之间的体积比接近1:1时,将形成凝胶。蒸发应继续,直到凝胶消失,剩余的水介质再次完全液态。额外的混合可能有助于加速有机溶剂的去除。这可以通过将聚四氟乙烯搅拌棒放入蒸发瓶中来实现,以增强旋转蒸发过程中粘性凝胶的对流。 - 使用轨道蚀刻聚碳酸酯膜过滤所得脂质体,以实现均匀的尺寸分布。
- 通过在配备两个气密注射器的脂质体挤出机中多次来回通过 200 nm 孔聚碳酸酯过滤器来回传递脂质体水分散体来执行过滤。
注意:最好使用较小的注射器(例如,0.5 mL),因为它们可确保产生足够的过滤压力。由于脂质体膜中的胆固醇含量高,因此不需要高温,并且可以在室温下进行该过程。进行奇数次过滤(例如,21次),以便所得材料从一开始就最终位于过滤器的另一侧,并且如果预先灭菌,则可以收集过滤尺寸调整的脂质体的无菌样品。所得脂质体的大小通常接近所选的过滤器孔径。可以堆叠两个过滤器(而不是一个)以执行微调以减小粒径。 - 使用动态激光散射 (DLS) 验证尺寸分布3,4。
- 将 1 至 3 mL 生理盐水加入具有四个透明侧面的 1 cm 比色皿中。为此,加入 10\u201220 μL 脂质体并仔细混合。将样品放入设备中并选择以下参数进行测量:溶剂粘度,折射率,脂质折射率。单击 "开始" 按钮。测量将持续几分钟,包括 100 次或更多次运行。
- 通过在配备两个气密注射器的脂质体挤出机中多次来回通过 200 nm 孔聚碳酸酯过滤器来回传递脂质体水分散体来执行过滤。
- 使用脱盐离心柱除去外部醋酸钙。向一半的批次中加入10mM HEPES缓冲液(pH 7.4)中的替格列塔扎水溶液,并在37°C下混合孵育1小时。使用该批次的后半部分作为无药物对照脂质体制剂。
注意:使用前,用 10 mM HEPES 缓冲液(pH 7.4)预平衡 2 mL 脱盐离心柱。为此,将1 mL HEPES缓冲液放入色谱柱中,并在1000 x g 离心机中旋转2分钟。取出直通缓冲液并重复此操作四次。 - 使用 2 mL 离心柱从脂质体中去除未包埋的特格列唑,并通过分光光度法测定包埋药物的浓度。
- 向干柱凝胶床中加入不超过0.5 mL的脂质体样品,并等待所有样品进入凝胶。在与之前完全相同的条件下离心(1000 x g ,2分钟),并将脂质体样品收集在从小分子量化合物纯化的直通中。
- 量化最终颗粒特征:使用 DLS 和 zeta 电位以及组合 DLS-电泳光散射 (ELS) 系统3,4 在 10 mM HEPES 缓冲液 pH 7.4 和 25 °C 下量化最终颗粒特征。
- 与步骤1.5.2类似,使用一次性鲁尔注射器或带有切头的移液器将测量缓冲液中的脂质体分散体(例如,每1 mL缓冲溶液10 μL脂质体)稀释到U形比色皿中。确保"U"形中没有气泡,以便电流流动有不间断的解决方案。
- 将比色皿放入设备中(请注意比色皿的正面和背面,以便电极正确连接到设备)。关闭仪器门;之后,在制导软件的控制下进行测量(多次重复)。
2.制备脂质体用于体内给药
- 在生物安全柜中,将无菌盐水中的脂质体稀释至适当浓度,最终体积为 50 μL,用于体内给药。
注意:在以前的研究中,我们的脂质体制剂含有 2 mg/mL 的 tesaglitazar,相当于约 4.89 μmol 的 tesaglitazar/mL,我们以 1 μmol 药物/kg 的剂量施用脂质体。对于 40 g 小鼠,我们将携带 8.2 μL 脂质体,最终体积为 50 μL 盐水。使用DLS / ELS,还应量化每单位体积的脂质体数量,以制备药物和载载脂质体,以确保与载药脂质体相比,每克小鼠体重施用相同数量的载体脂质体。 - 将脂质体溶液装入生物安全柜中的27 G针中。将其保持在室温下,以避免将冷溶液注入鼠标。
3.通过眶后静脉注射给予脂质体
注意:如果愿意,也可以通过其他方法进行静脉注射,例如尾静脉注射。虽然该协议未涵盖,但已公布的解释该方法的协议19 是可用的。
- 设置用于递送脂质体的工作区。
- 用70%乙醇清洁工作台。确保选择允许使用异氟醚麻醉系统的空间。
- 打开加热垫,并在上面放上干净的垫子或毛巾,以保持鼠标在干净的表面上。在开始与小鼠一起工作之前,留出足够的时间让垫子预热。
- 设置麻醉系统,使腔室在附近,鼻锥在加热垫上。
- 确保系统的所有其他方面都已准备就绪(例如,汽化器中的异氟醚水平足够高,木炭过滤器已称重,管道连接正确)。
- 收集本协议本节所需的其他材料:眼科润滑剂凝胶,用于给药后治疗的局部麻醉剂,无菌纱布垫。
- 在诱导室中使用异氟醚镇静小鼠。一旦它对轻轻的脚拍没有反应,请迅速将鼠标转移到工作区,同时通过鼻锥保持镇静。
注意:在进行手术之前,动物应保持在1.5%至2.5%的异氟醚,并评估适当的麻醉深度(通过对脚趾捏没有反应)。 - 将鼠标移到一侧进行脂质体给药。由于鼠标在麻醉时不会眨眼,因此请在双眼上涂抹少量眼科润滑剂,以在剩余的手术过程中保持湿润。
- 轻轻按压暴露在外露的眼睛上方和下方的皮肤上。眼睛应该抬到面部平面上方。
- 小心地将针尖插入内眦,确保针在眼睛下方并且不要接触它。一旦针头插入眼睛下方,慢慢将脂质体注射到眶后空间。拔出针头后,可能需要闭上眼睑几秒钟以达到止血效果。
- 如果针头插入的距离不够远,溶液可能会出现在眼睛周围。如果看到这种情况,请立即停止注射并重新定位针头。
- 在眼睛上涂抹局部麻醉剂,如丙帕卡因,以防止术后疼痛和不适。
- 将鼠标放在加热垫上并监测直到它醒来以确保它健康并保持适当的体温。
- 将鼠标放回笼子和正常的住房环境,直到感兴趣的时间点到达。
注意:这应按照当地的IACUC指南进行。
4. 准备组织收获、组织处理和流式细胞术染色的材料
- 制备用于收获、处理和染色的溶液(第 5\u20127 节):磷酸盐缓冲盐水 (PBS)-肝素、HEPES 缓冲液、2 mg/mL I 型胶原酶、AKC 裂解缓冲液、FACS 缓冲液、PBS、固定缓冲液(表 2)。在操作过程中,将除固定缓冲液以外的所有溶液保持在4°C或冰上。
- 准备带有缓冲液和其他材料的试管,用于收获和处理组织。
- 对于每只小鼠的血液,将 10 μL 0.5 M EDTA 加入 1.5 或 1.7 mL 微量离心管中以收集血液。EDTA将防止血液凝固。还需要一个带有 25 G 针头的 1 mL 注射器和一个 15 mL 锥形管。
- 对于脾脏,收集一个 1.5 或 1.7 mL 微量离心管,每个脾脏装有 1 mL HEPES 缓冲液、一个 1 mL 注射器、两个 50 mL 锥形管和两个 70 μm 过滤器。
- 对于每个脂肪组织库,收集一个 20 mL 聚乙烯小瓶,其中含有 1.5 mL HEPES 缓冲液以切碎组织、50 mL 锥形管和每只小鼠每种脂肪组织类型的 70 μm 过滤器。
- 为收获准备工作空间。
- 用70%乙醇清洁工作台空间。准备一个橡胶托盘,用于在收获期间用 70% 乙醇将其清除并用吸收垫或纸巾覆盖来固定鼠标。确保至少有 5 个引脚可供使用。
- 用PBS-肝素填充10mL注射器,并固定在25G针头上进行灌注。
- 收集收获期间使用的工具和材料。需要镊子(两对)、剪刀、纸巾、不起毛湿巾、带有EDTA的微量离心管、带有HEPES缓冲液的微量离心管和带有HEPES缓冲液的聚乙烯小瓶。
5. 收获纸巾
- 通过CO2 窒息对小鼠实施安乐死。不要进行颈椎脱位,因为这可能会妨碍后续步骤的有效采血和组织灌注。
- 在具有足够工作空间和照明的清洁工作台区域,可以很好地看到鼠标,设置一个橡胶解剖托盘,一桶用于储存样品的冰和一个装有70%乙醇的喷雾瓶。用70%乙醇喷洒鼠标,以减少污染并控制头发扩散。将鼠标仰放在橡胶托盘上,然后用爪子从身体上伸开。
- 为了准备收集血液,请小心地在小鼠胸腔尾端边缘的皮肤上切开一个切口。在小鼠头部(约 1 厘米)上切一条小的直线,直到胸大肌暴露出来。
- 在初始切口部位,垂直于朝向头部的线做两个小切口。然后,小心地切掉暴露区域肋骨一侧的胸大肌。这样可以更好地访问和可视化针头的插入位置。
- 要收集血液,请将针头插入去除肌肉一侧的第三和第四肋骨之间。由于小鼠的心脏位于胸腔的中心,因此请使针头尽可能靠近肋骨的中心线。插入后,轻轻拉起注射器开始收集血液。
- 收集后,将血液转移到带有EDTA的制备的微量离心管中并储存在冰上。
注意:如果拉起大约 100 μL 的体积并且没有血液进入注射器,请尝试向右或向左旋转注射器,以防针头开口压在心脏壁上。如果这没有帮助,请慢慢将针头进一步移入胸腔或开始移除。如果此时血液开始聚集在注射器中,请继续缓慢拉回注射器。考虑旋转注射器和针头以成功提取。最后,如果没有收集血液,请取下针头,因为它可能错过了心脏。尝试重新插入针头并再次重复上述过程。
- 接下来,要灌注鼠标,打开胸腔以进入心脏。
- 为此,将皮肤沿着肋骨的末端切到小鼠的每一侧。然后,用镊子将胸骨从工作表面抬起。在胸骨末端下方做一个小而浅的切口,以切开腹膜腔。沿着小鼠两侧肋骨末端的腹膜切割。这应该暴露肝脏和胆囊。小心不要切入这些组织中的任何一个。
- 接下来,在横膈膜上做一个小的浅切口,颅骨到肝脏。然后,沿着肋骨边缘切割横膈膜以打开胸腔。一定要避免切开胸腔内的任何器官。
- 沿着肋骨向头部切开两次,距离小鼠中心线约2-3毫米,长约0.75厘米。
注意:如果切得太高,位于肋骨顶部的动脉将被切开。这会干扰灌注的功效。 - 向后提起肋骨的中心部分,露出胸腔。移开任何脂肪或组织以进入心脏。
- 在老鼠心脏的右心房做一个小切口,创造一个开口,通过这个开口将血液排出。
- 使用10mL注射器PBS-肝素,将针头插入小鼠心脏的左心室。
- 尽可能缓慢地开始将PBS推入心脏。
注意:应观察血液从右心房流出并充满胸腔。确保心脏保持在生理位置,以避免抑制PBS-肝素从心脏流经主动脉。 - 一旦所有10mL的PBS-肝素通过小鼠灌注,丢弃注射器和针头,并使用纸巾或不起毛的湿巾从胸腔中去除多余的血液和PBS-肝素。
- 接下来,要开始提取组织,将皮肤和腹膜切向小鼠的尾巴以打开腹膜腔。
- 首先,从小鼠的每一侧提取腹股沟脂肪组织垫。
注意:仔细阅读此过程:确保从每个仓库中提取腹股沟淋巴结,以避免结果中扭曲脂肪组织细胞组成。- 使用第二组镊子,用一组镊子握住腹膜,用另一组镊子覆盖在该侧膜上方的皮肤边缘。轻轻地将皮肤从腹膜上拉开,将这些层彼此分开。寻找沿皮肤的腹股沟脂肪组织库。将皮肤的外边缘固定下来,以更好地进入脂肪库。
- 拔牙前,将腹股沟淋巴结定位在脂肪库的中心,并根据需要使用镊子和剪刀将其取出。
注意:如果可能,请找到从仓库外边缘向中心延伸的三条较大的动脉。淋巴结位于这些动脉相遇的地方附近。 - 切除淋巴结后,用镊子小心地握住脂肪库最靠近固定点的末端,并开始在脂肪组织和皮肤之间的结缔膜上做小切口。在切口时将脂肪组织从皮肤上抬起,以便更好地接近膜并确保提取整个仓库。
- 将脂肪库放入准备好的聚乙烯小瓶中,在冰上放置HEPES缓冲液,以在收获的剩余时间内保持组织存活。
- 在鼠标的另一侧重复此过程以提取两个库。仓库可以一起消化和处理,也可以单独处理。如果要单独处理每个仓库,则必须准备更多的管子。
- 接下来,从腹膜腔尾端提取附睾脂肪库。使用镊子,轻轻地从小鼠的背端拉出第一个附睾脂肪库,并找到连接到该库的附睾和输精管。
注意:有两个附睾脂肪库:每个附睾和输精管各有一个。- 小心地切开脂肪库与附睾和输精管之间,将脂肪与这些其他组织分开。将脂肪库放入带有HEPES缓冲液的聚乙烯小瓶中,以在收获的剩余时间内保持组织存活。
- 最后,提取脾脏,脾脏位于胃左侧靠近横膈膜的地方。使用镊子,轻轻地将胃拉向腹膜腔的中心以露出脾脏。
- 轻轻握住脾脏的一端,将其稍微拉离胃部。切开脾脏与其邻近组织之间的膜,直到器官分离。将脾脏放入带有HEPES缓冲液的制备的微量离心管中并储存在冰上。
- 在处理组织或从下只小鼠那里收获组织之前,丢弃尸体和任何弄脏的纸巾或垫子。也擦掉工具。
注意:如果有多个小鼠,请在继续下一个处理步骤之前对每只小鼠重复这些收获步骤。如果包括对照小鼠/小鼠,请考虑在脂质体处理的小鼠之前收获这些小鼠以避免任何污染。
6. 工艺组织
注意:由于脂肪组织具有较长的消化潜伏期,因此建议先从该过程开始,然后在消化期间处理血液和脾脏。
- 首先,切碎并消化脂肪组织。使用一把或两把剪刀,将每个聚乙烯小瓶中的脂肪组织切碎,直到组织成小于0.5毫米的小块。这样可以更有效地消化。
- 将所有小瓶中的组织切碎后,向每个小瓶中加入 1.5 mL 的 2 mg/mL 胶原酶缓冲液。将小瓶放入设置为37°C和150rpm的振荡培养箱中。孵育30至45分钟。
注意:如果脂肪组织特别大,请考虑在小瓶中再添加0.5 mL至1.5 mL的HEPES缓冲液和等体积的胶原酶缓冲液,以确保组织完全浸没并存在足够的酶。无论最终溶液体积如何,消化时I型胶原酶的最终浓度应为1 mg/mL。此外,如果没有摇动培养箱,可以将样品置于加热至37°C的水浴中。 每5分钟轻轻摇动样品以混合并重悬消化。 - 在30分钟时检查样品。使用 1 mL 移液管上下移液样品。如果组织块仍然太大而无法轻松移液,请将样品再放回培养箱中15分钟。
- 样品完全消化后,继续上下移液样品10次,以确保产生单细胞悬液。
注意:(可选)在30分钟时检查样品。使用 1 mL 移液器上下移液样品。如果组织块仍然太大而无法轻松移液,请将样品再放回培养箱中15分钟。 - 通过 70 μm 过滤器将细胞悬液移液到 50 mL 锥形管中。将 5 mL FACS 缓冲液加入空消化瓶中以洗出小瓶。将该洗涤缓冲液通过过滤器转移以添加到细胞悬液中。
- 将样品储存在冰上,而其他样品正在处理中。过滤所有样品后,将其在400× g,4°C下旋转5分钟。
- 通过抽吸除去脂肪细胞上清液,然后通过抽吸小心地除去脂肪细胞上清液和沉淀之间的凝聚糖,以留下基质血管部分(SVF)沉淀。
- 将该沉淀重悬于 1 mL FACS 缓冲液中,并转移到干净的 1.5 或 1.7 mL 微量离心管中。如果需要或需要,现在就等分细胞。保持冰上,直到所有样品都准备好进行流式细胞术染色。
注意:如果消化的脂肪库很大,请考虑仅使用50%或25%的样品进行流式细胞术染色和分析。此外,如果需要任何荧光负一(FMO)对照或用于流式细胞术分析的其他对照(表1),请务必将额外的样品等分到单独的管中进行处理。FMO用于区分实验中使用的其他完整面板中单个荧光团偶联抗体的阴性和阳性信号。
- 将所有小瓶中的组织切碎后,向每个小瓶中加入 1.5 mL 的 2 mg/mL 胶原酶缓冲液。将小瓶放入设置为37°C和150rpm的振荡培养箱中。孵育30至45分钟。
- 第二,处理血液。
- 将 50 μL 血液转移到 15 mL 锥形管中。
- 向每个试管中加入 1 mL AKC 裂解缓冲液,上下移液以达到单细胞悬液。向每根试管中额外添加 4 mL AKC 裂解缓冲液,孵育 5\u201210 分钟。如果有摇床或旋转器,请紧紧密封管盖并将管子放在其中一个上以增强混合。
- 加入 5 mL FACS 缓冲液以淬灭裂解过程,并将样品在 400 x g、4 °C 下旋转 5 分钟。取出上清液并检查沉淀。如果它仍然很红,请重复裂解过程。否则,将沉淀重悬于 1 mL FACS 缓冲液中,并转移到干净的 1.5 或 1.7 mL 微量离心管中。保持冰上,直到所有样品都准备好进行流式细胞术染色。
- 最后,处理脾脏。将脾脏转移到 50 mL 锥形管上的 70 μm 过滤器上。用 1 mL FACS 缓冲液清洗组织,然后使用 1 mL 注射器的柱塞端通过过滤器捣碎脾脏。在整个糖化过程中,使用更多的 FACS 缓冲液将细胞洗涤到 50 mL 锥形管中。锥形管中的最终体积应为 10 mL。
- 在4°C下以300× g 旋转细胞5分钟。取出上清液并重悬于 1 mL AKC 裂解缓冲液中。再加入 4 mL AKC 裂解缓冲液并孵育 5 分钟。加入 5 mL FACS 缓冲液以淬灭裂解过程,并在 4 °C 下以 300 x g 离心样品 5 分钟。
- 除去上清液并将沉淀重悬于 1 mL FACS 缓冲液中。将悬浮液通过第二个干净的 70 μm 过滤器转移到 50 mL 锥形管中。加入 4 mL FACS 缓冲液以冲洗出原始管,并通过过滤器转移缓冲液,最终体积为 5 mL。
- 将 50 μL 细胞悬液转移到干净的 1.5 或 1.7 mL 微量离心管中,并保持在冰上,直到所有样品都准备好进行流式细胞术染色。如果需要或需要更多,可以将额外的等分试样转移到试管中。
注意:脾细胞是用于活/死单染色的极好细胞。请考虑为此控件转移额外的等分试样。
7. 对组织中的细胞进行染色以进行流式细胞术
- 在400× g,4°C下旋转等分样品5分钟。
- 除去上清液并将样品重悬于50 μLFc块(稀释)中(表2)。在冰上孵育5分钟。
- 向每个样品中加入 50 μL 的 2x 抗体混合物(表 3)。在黑暗中在冰上孵育20分钟。
注意:任何单一染色剂都不应用这种抗体混合物染色。此外,如果要使用FMO,则必须单独制备FMO抗体混合物。 - 用1mL PBS洗涤样品,并在400× g,4°C下旋转5分钟。除去上清液并将样品重悬于200 μL活性染色剂中(表3)。在黑暗中在冰上孵育20分钟。
注意:不要忘记在此步骤中对留作活/死单染色的细胞进行染色。 - 用1mL FACS缓冲液洗涤样品,并在400× g,4°C下旋转5分钟。取出上清液并将样品(活/死单染色剂除外)重悬于 50 μL 固定培养基(试剂 A)中以固定样品。在室温下在黑暗中孵育15分钟。
- 将活/死单染色重悬于 100 μL 2% PFA 中。在室温下在黑暗中孵育5分钟。
- 用1mL FACS缓冲液洗涤样品,并在800× g,4°C下旋转5分钟。去除上清液并将样品重悬于 250 至 500 μL FACS 缓冲液中。储存在4°C,直到样品可以在流式细胞仪上运行。
- 用1mL FACS缓冲液洗涤样品,并在800× g,4°C下旋转5分钟。取出上清液并将样品重悬于 50 μL 透化培养基(试剂 B)和细胞内蛋白的抗体中。在室温下在黑暗中孵育20分钟。
- 用1mL FACS缓冲液洗涤样品,并在4°C下以800× g 旋转5分钟。除去上清液并将样品重悬于 100 μL 2% 多聚甲醛 (PFA) 中。在室温下在黑暗中孵育5分钟。
- 用1mL FACS缓冲液洗涤样品,并在800× g,4°C下旋转5分钟。除去上清液并将样品重悬于 250 至 500 μL FACS 缓冲液中。储存在4°C,直到样品可以在流式细胞仪上运行。
结果
脂质体生产
这里发表的结果与我们之前发表的工作3,4,20中的结果相似。利用此处介绍的方案,我们期望产生大小约为150-150-160 nm的脂质体。DLS 显示平均脂质体直径为 163.2 nm,zeta 电位为 -19.2 mV(图 1A)。低温电子显微镜(cryo-EM)成像显示环状脂质体(图1B),DLS图显示与平均直径的标准偏差相对较小(图1C)。
脂质体结合阳性需要 PBS 处理的对照
我们小组先前使用该协议的研究调查了体内给药一周后脂肪SVF,脾脏和血液中与脂质体结合的细胞亚群3,4。使用PBS处理的小鼠,用脂质体处理小鼠样品上使用的相同抗体组合对腹膜腔和脾脏细胞进行染色。治疗一周后收获组织(图2A)。来自PBS处理的小鼠的样品用作DiD FMO,用于创建阳性DiD门(图2B,C)。可以使用DiD正信号创建正栅极,但缺少DiD信号的样品也必须用于验证正栅不包含任何DiD阴性样本。
需要滴定以优化荧光信号
在进行完整实验之前,必须优化各种条件,包括细胞染色期间使用的荧光偶联抗体的浓度和脂质体制备期间使用的脂质染料的浓度。流式细胞仪具有荧光强度的检测上限,因此脂质体中掺入的染料过多会导致通过细胞仪的样品中DiD信号水平无法量化。此外,脂质体中过多的DiD可能导致高水平的非特异性染料转移,这可能会扭曲细胞摄取结果。图3报告了一项实验的结果,在该实验中,滴定脂质染料的浓度以确定在使用流式细胞仪检测范围内产生最佳信号的浓度。这是在最终实验感兴趣的组织上进行的:血液(图3A),腹股沟脂肪SVF(图3B)和附睾脂肪SVF(图3C)。选择用于测试的浓度为每1 mL脂质体10mg DiD(高,红色),1mg DiD(中,蓝色)或0.1mg DiD(低,灰色)。脂质体中使用的最高浓度过高,在所有三种组织中都超过了细胞仪的可定量范围(图3A\u2012C,红色)。最低浓度的DiD显示出一些信号(图3 A\u2012C,灰色),但没有观察到PBS处理的细胞之外的清晰群体(图3A\u2012C,黑色)。量化时,每种组织和浓度的DiD MFI的算术平均值表明PBS对照与DiD的中等浓度之间存在明显区别(图3D)。因此,如协议所示,我们选择了中间浓度(图3,蓝色)用于我们的脂质体制备。
使用多抗体组合可以鉴定不同细胞亚群对脂质体的摄取
使用表3中概述的面板,用针对巨噬细胞,B细胞,T细胞,树突状细胞,单核细胞和内皮细胞标记物的抗体对细胞进行染色(图4)。每种组织类型需要略有不同的门控策略,但可以在每种组织中鉴定出大多数相同的细胞类型。一些例外包括内皮细胞,这通常不在血液中发现,以及单核细胞,它们在血液中的频率通常高于其他组织。一旦确定了群体,就可以量化每个细胞群的总大小及其DiD +的频率。可以进行进一步的计算来表征DiD +群体:DiD +细胞中巨噬细胞,内皮细胞等的百分比是多少。请注意,这些是示例门控策略,但不是分析样本的唯一方法。分析将由所选的试剂盒和可用的流式细胞仪决定。
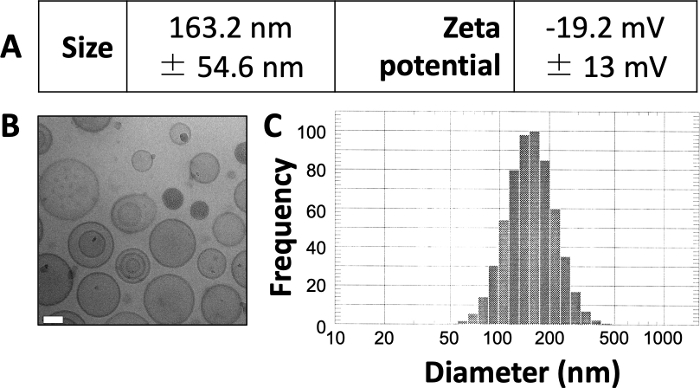
图1:制备的脂质体的示例特征。
(A)如上所述测量大小和zeta电位,并以表格形式报告。每个参数都表示为平均值±标准差。(B)冷冻电镜用于对制备的脂质体进行成像。白色比例尺的长度为 50 nm。(C)在该制备中,使用DLS生成脂质体直径的直方图。该图改编自Osinski等人3。请点击此处查看此图的大图。
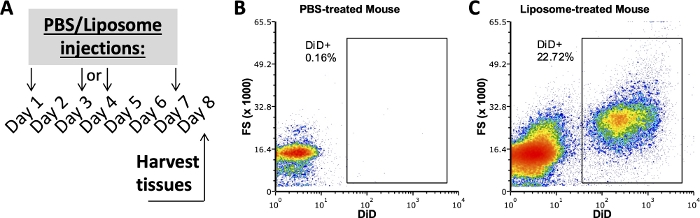
图2:来自PBS或脂质体处理小鼠的代表性DiD染色。
(A)PBS和脂质体处理的实验示意图。PBS或脂质体在一周内注射三次。在治疗的第8天收获组织。(乙、丙)代表性流图显示脂质体处理的(C)小鼠的DiD染色阳性,但未显示PBS处理的(B)小鼠的DiD染色阳性。FSC,前向散射。 请点击此处查看此图的大图。
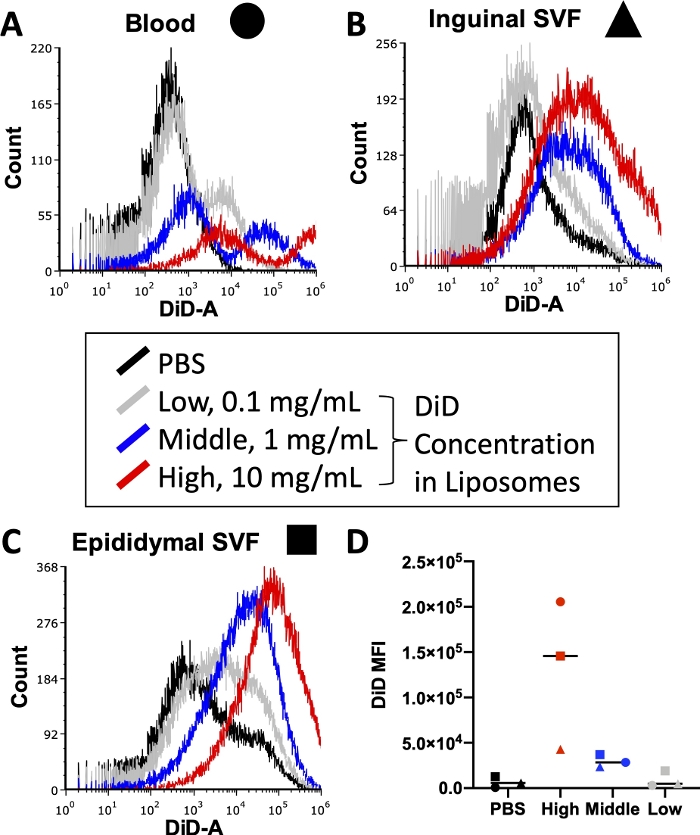
图 3:脂质体中 DiD 的滴定。
用三种不同浓度的DiD制备脂质体并注射到小鼠体内。灰色表示每 1 mL 脂质体 0.1 mg DiD 的低浓度,蓝色表示 1 mg DiD/mL 脂质体的中等浓度,红色表示 10 mg DiD/mL 脂质体的高浓度。使用PBS处理的小鼠作为阴性对照(黑色)。注射后24小时收获血液(A,圆形),腹股沟脂肪(B,三角形)和附睾脂肪(C,方形),并进行处理以分离单细胞悬液。这些样品在流式细胞仪上运行至可检测的DiD水平。呈现每个治疗组叠加的组织特异性直方图,以显示每个浓度的荧光强度(A\u2012C)。还量化了每种组织和浓度的DiD的算术平均值,并绘制了(D)。SSC = 侧向散射。 请点击此处查看此图的大图。
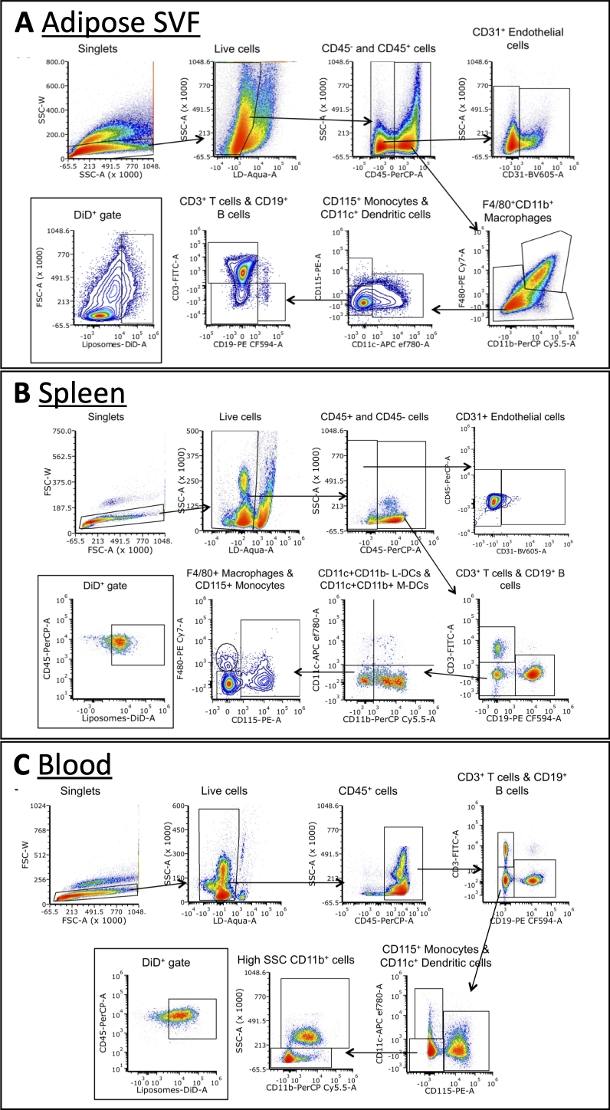
图 4:脂肪 SVF、血液和脾脏中细胞亚群的代表性流式细胞术分析。
(A\u2012C)用于识别脂肪SVF(A),脾脏(B)和血液(C)中的细胞亚群和DiD +细胞的门控策略的示意图。缩写:FSC = 前向散射;LD = 活/死;L-DC = 淋巴样树突状细胞;M-DC = 髓系树突状细胞;SSC = 侧向散射。该图改编自Osinski等人3。请点击此处查看此图的大图。
| 控制 | 目的 |
| 用PBS或生理盐水处理的小鼠 | 使用该小鼠的细胞进行以式细胞术对照: |
| 1. 未染色细胞 | |
| 2. 活/死单污渍 | |
| 3. 用全面板染色的细胞,但缺乏脂质体荧光,无法在分析过程中确定阳性脂质体信号 | |
| 这/这些小鼠/小鼠也将用于确定脂质体在体内是否有任何影响,因为您将在实验中具有非脂质体对照。 | |
| 卸载的脂质体 | 如果您在脂质体中加载化合物,则应在没有该化合物的情况下合成部分脂质体批次。这解释了脂质体单独对体内的任何影响。 |
| 单独使用迪德 | 由于DiD也可以被细胞膜吸收,因此分配一些小鼠以等于脂质体中发现的量接受游离染料将有助于解释任何背景膜染色。 |
| 荧光负一 (FMO) 控制 | 这些细胞被面板中除一种抗体以外的所有抗体染色。与上面框中的#3一样,这有助于在分析过程中确定该抗体的真阳性信号 |
表 1:要在此协议中使用的控件。
| 溶液 | 组件 | 每批/小鼠所需的近似体积 |
| 脂质体制备 | ||
| 醋酸钙 | 1 M 乙酸钙在 H2O | 50毫升 |
| HEPES缓冲液 | 10 mM HEPES H2O,pH 7.4 | 50毫升 |
| 赫佩斯的特萨格利塔扎 | 在 10 mM HEPES 中 | 10毫升 |
| 组织采集、处理和染色 | ||
| 磷酸盐缓冲溶液 | 137 mM 氯化钠、2.7 mM 氯化钾、10 mM Na 2 HPO 4、1.8 mM KH 2 PO4 蒸馏 H 2O溶液 | 2毫升 |
| PBS-肝素 | 0.1 mM 肝素在 PBS 中 | 10毫升 |
| HEPES缓冲液 | 20 毫米丙二醇中的 HEPES | 5毫升 |
| 消化缓冲液 | HEPES 缓冲液中的 2 mg/mL I 型胶原酶 | 5毫升 |
| AKC裂解缓冲液 | 0.158 米 NH3厘升, 10 毫米氢氧化钾3, 0.1 毫米钠 2 EDTA 在 ddH 2 O, pH7.2中 | 15毫升 |
| FACS 缓冲液 | 1% BSA, 0.05% NaN3 在 PBS 中 | 15毫升 |
| Fc 块(稀释) | FACS 缓冲液中的 1:50 Fc 块 | 250 微升 |
| 固定缓冲液 | PBS中2%多聚甲醛 | 200 微升 |
表 2:要准备的解决方案。
| 一个 | B | C | D |
| 细胞外染色(2x 抗体混合物) | |||
| 抗原 | 荧光基团 | 每 100 μL 测试的 Ab 体积 | 所需总量: |
| CD45 | 全氯乙烯 | 0.5 微升 | C 列 x 1.2 x 总计 # 个样本 |
| CD11b | 全氯乙烯5.5 | 0.25 微升 | (0.5 μL/测试) x (1.2) x (# 样品) |
| F4/80 | PE Cy7 | 0.25 微升 | (0.25 μL/测试) x (1.2) x (# 样品) |
| CD19 | 聚乙烯-CF594 | 1 微升 | (0.25 μL/测试) x (1.2) x (# 样品) |
| CD3 | FITC | 1 微升 | (1.0 μL/测试) x (1.2) x (# 样品) |
| CD31 | BV605 | 0.25 微升 | 等。。。 |
| CD11c | APC ef780 | 1 微升 | |
| CD115 | 体育 | 1.5 微升 | |
| 要创建抗体混合物,请将 D 列中计算的抗体与 FACS 缓冲液或亮紫染色缓冲液*合并至最终体积(50 μL x 1.2 x 总 # 样品) | |||
| 活/死染色 (1x) | |||
| 生/死 | 荧光基团 | 每 200 uL 测试的 L/D 体积 | 所需总量: |
| 生/死 | 水 | 0.67 微升 | C 列 x 1.2 x 总计 # 个样本 |
| 细胞内染色 (1x) | |||
| 抗原 | 荧光基团 | 每 50 μL 测试的 Ab 体积 | 所需总量: |
| αSMA | FITC | 0.125 | C 列 x 1.2 x 总计 # 个样本 |
| *如果您的组合中使用了多种与亮紫荧光团偶联的抗体,则应使用亮紫染色缓冲液。 | |||
表 3:用于流式染色的示例抗体组合和染色混合物的计算。
讨论
在这里,我们描述了一个由三部分组成的方案,用于(i)制备用荧光脂质染料标记并加载有抗糖尿病化合物tesaglitazar的脂质体,(ii)通过眶后注射将脂质体施用于小鼠,以及(iii)收获,处理和染色组织以通过流式细胞术检测细胞水平的脂质体摄取。该协议回顾了大约150μm脂质体的制备和脂肪,血液和脾脏摄取的评估。脂质体制备是可扩展的,主要在室温下进行,并利用反相蒸发来最大化药物负载和有机溶剂的去除。使用该协议,纯化的脂质体样品中可以达到高达2 mg / mL的tesaglitazar浓度。制备的脂质体可以在4°C的HEPES缓冲液中储存一年以上。根据我们的经验,它们证明了平均粒径的最小变化。在用10 kDa离心过滤器超滤分离脂质体与外部药物后,通过分光光度法证明了低于10%的药物含量损失。
在脂质体制备过程中,需要考虑一些关键步骤和因素。首先,协议步骤的顺序很重要,必须遵守。其次,上样替格列塔扎时所用溶液的pH值必须保持在7.4,以最大限度地提高溶解度和有效上样量。第三,设备和过滤器的正确组装确保每个步骤的输出具有适当的尺寸和纯度。例如,如果 100 纳米和 200 纳米滤光片组装不当,则可能会导致一批异质性和尺寸不合适的脂质体。第四,需要在载药前完全去除醋酸钙,以最大限度地将替格列塔唑转移到脂质体中。要测试乙酸钙的完全去除,请使用高速沉降去除脂质体,然后测量非脂质体溶液中的乙酸钙水平。第五,重要的是在每一步称重并记录添加到脂质体制剂中的所有材料的质量。这确保了可以计算出适当的浓度并保持所需的材料比例。最后,如果技术执行不当,则可能存在不希望的异质性水平。使用DLS和其他方法(如电子显微镜)彻底检查此参数非常重要。要提高均匀性,请考虑调整所选过滤器尺寸或堆叠两个过滤器。
此外,在完全实施此方案之前,计划和优化流式细胞术的对照和抗体组合至关重要(表1, 表3)。应检测抗体,以确保使用适当的浓度进行染色,并且荧光团之间的重叠最小。脂质体制备过程中所用染料的激发和发射也必须考虑在组合规划中。在我们的结果中,我们使用了DiD,它与异藻蓝蛋白(APC)和AlexaFluor 647等荧光团具有相似的激发和发射。因此,我们没有在抗体组合中选择与这些荧光团偶联的抗体。此外,同种型对照不包括在该协议中。这是因为为该方案选择的抗体是经过充分验证的市售抗体。但是,如果有兴趣使用以前未优化的抗体,请考虑在进行完整实验之前对感兴趣的组织进行针对同种型对照的抗体测试。
虽然该协议演示了如何从小鼠治疗后提取和处理血液,脾脏,腹股沟脂肪和附睾脂肪组织,但这种通用方法可以应用于其他组织。根据感兴趣的组织,可能需要改变以下组织的处理和消化方案:肺21,肝22,腹膜腔3,骨髓3,23,脑24。
这种方法的一个重要局限性是,每只动物只能在一个时间点评估摄取。因此,将该协议与其他非侵入性成像技术相结合或相应地计划以确保有足够的资源进行评估可能是有利的。细胞摄取和细胞周转的时间是需要考虑的重要因素:脂质体将在前24小时内在全身循环,并且取决于吸收脂质体的细胞的寿命或它们对摄取的反应,可能会发生细胞死亡或进一步吞噬作用。我们之前的研究表明,DiD+ 种群在不同时间点的种群特征发生了变化3。因此,评估较早的时间点或与目的机制生物学最相关的时间点的摄取非常重要。此外,虽然可以使用该协议对整个组织中的细胞摄取进行定量,但流式细胞术不能揭示组织定位。将这种方法与组织学方法相结合有助于解决这一限制。
通常,该协议补充了现有方法,例如组织学和全身荧光成像。随着流式细胞术工具和方法的不断进步,为越来越多的特异性细胞群开发更大的组合将成为可能。我们建议在上述方法之外使用该协议,因为这将改善细胞摄取的评估,并提供验证流式细胞术观察到的结果的机会。例如,是否应该发现脂肪组织中的大部分颗粒被流式细胞术的巨噬细胞吸收。可以保存,固定,切片和染色相同脂肪组织的额外等分试样的免疫荧光以获取巨噬细胞标志物,以验证细胞类型确实吸收脂质体。这种方法应该增加纳米颗粒生物分布测定的严谨性:验证细胞特异性靶向,量化细胞摄取,识别脱靶摄取,并希望提供信息以产生观察到的治疗结果的机制假设。该协议也可以适用于使用不同脂质体的未来研究,研究其他组织中的摄取,以及在肥胖和代谢障碍或任何其他疾病的情况下测试新化合物,其中纳米颗粒递送是一种可行的治疗选择。
披露声明
作者没有什么可透露的。
致谢
作者要感谢Michael Solga和其他流式细胞术核心工作人员提供流式细胞术培训和服务。作者还要感谢Shiva Sai Krishna Dasa,Dustin K. Bauknight,Melissa A. Marshall,James C. Garmey,Chantel McSkimming,Aditi Upadhye和Prasad Srikakulapu在脂质体制备(SSKD,DKB),组织收获(MAM,JCG)以及流式细胞术染色和样品采集(AU,PS,CM)方面的帮助。这项工作得到了阿斯利康,R01HL 136098,R01HL 141123和R01HL 148109,AHA 16PRE30770007和T32 HL007284资助的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1-mL syringe | BD | 309659 | |
| 10-mL syringe | BD | 302995 | |
| 25-gauge needle, sterile for retro-orbital injection | BD | 305122 | |
| 27-gauge needle, sterile for retro-orbital injection | BD | 305620 | |
| Anti-mouse B220 BV421 | Biolegend | 103251 | Clone RA3-6B2 |
| Anti-mouse CD115 PE | eBioscience | 12-1152-82 | Clone AFS98 |
| Anti-mouse CD11b PerCP Cy5.5 antibody | BD Biosciences | 550993 | Clone M1/70 |
| Anti-mouse CD11c APC ef780 antibody | eBioscience | 47-0114-82 | Clone N418 |
| Anti-mouse CD19 PE CF594 | BD Biosciences | 562291 | Clone 1D3 |
| Anti-mouse CD3 FITC antibody | BD Biosciences | 553061 | Clone 145-2C11 |
| Anti-mouse CD31 BV605 | Biolegend | 102427 | Clone 390 |
| Anti-mouse CD45 PerCP | BD Biosciences | 557235 | Clone 30-F11 |
| Anti-mouse F4/80 PE Cy7 | Biolegend | 123114 | Clone BM8 |
| Bovine serum albumin | Gemini Bio-products | 700-107P | |
| Desalting spin-column | ThermoFisher | 89889, 89890 | Zeba spin column |
| DPBS | Gibco | 14190-144 | |
| Dynamic Light Scattering, Nicomp 370 | Particle Sizing System, Inc | ||
| FIX & PERM Cell Permeabilization Kit | ThermoFisher Scientific | GAS004 | |
| Gauze sponges | Dermacea | 441211 | |
| Heparin | Sigma | 3393-1MU | |
| Liposome extruder | Millipore Sigma | Z373400 | LiposoFast |
| Live/Dead Aqua | ThermoFisher Scientific | L34957 | |
| Nanosight | Malvern Instruments Ltd | NS300 | |
| Ophthalmic lubricant | Optixcare | 20g/70 oz Sterile | |
| Paraformaldehyde, 16% w/v aq. soln., methanol free | Alfa Aesar | 433689L | |
| Polyethylene vial for mincing | Wheaton | 986701 | |
| Rotary evaporator | Buchi | Re111 | |
| Sonicator | Misonix | XL2020 | |
| T/Pump Heat therapy pump and pad | Gaymer Industries | TP-500 | |
| Tesaglitazar | Tocris | 3965 | |
| Track-etched polycarbonate membranes | Thomas Scientific | 1141Z** | Whatman, Nuclepore Polycarbonate hydrophilic membranes |
| ZetaSizer/DLS-ELS system | Malvern Instruments Ltd |
参考文献
- Allen, T. M., Cullis, P. R. Liposomal drug delivery systems: from concept to clinical applications. Advanced Drug Delivery Reviews. 65 (1), 36-48 (2013).
- Sercombe, L., et al. Advances and Challenges of Liposome Assisted Drug Delivery. Frontiers in Pharmacology. 6, 286 (2015).
- Osinski, V., et al. In vivo liposomal delivery of PPARα/γ dual agonist tesaglitazar in a model of obesity enriches macrophage targeting and limits liver and kidney drug effects. Theranostics. 10 (2), (2020).
- Bauknight, D. K., et al. Importance of thorough tissue and cellular level characterization of targeted drugs in the evaluation of pharmacodynamic effects. PLoS ONE. 14 (11), (2019).
- Rosales, C., Uribe-Querol, E. Phagocytosis: A Fundamental Process in Immunity. BioMed Research International. , (2017).
- He, H., Ghosh, S., Yang, H. Nanomedicines for dysfunctional macrophage-associated diseases. Journal of Controlled Release. 247, 106-126 (2017).
- Song, G., Petschauer, J. S., Madden, A. J., Zamboni, W. C. Nanoparticles and the mononuclear phagocyte system: pharmacokinetics and applications for inflammatory diseases. Current Rheumatology Reviews. 10 (1), 22-34 (2014).
- Litzinger, D. C., Buiting, A. M. J., van Rooijen, N., Huang, L. Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. BBA - Biomembranes. , (1994).
- Su, C., Liu, Y., He, Y., Gu, J. Analytical methods for investigating in vivo fate of nanoliposomes: A review. Journal of Pharmaceutical Analysis. , (2018).
- Vasquez, K. O., Casavant, C., Peterson, J. D. Quantitative whole body biodistribution of fluorescent-labeled agents by non-invasive tomographic imaging. PLoS One. 6 (6), 20594 (2011).
- Larmann, J., et al. In vivo fluorescence-mediated tomography for quantification of urokinase receptor-dependent leukocyte trafficking in inflammation. Anesthesiology. 113 (3), 610-618 (2010).
- Feng, B., et al. Clodronate liposomes improve metabolic profile and reduce visceral adipose macrophage content in diet-induced obese mice. PLoS One. 6 (9), 1-11 (2011).
- Bu, L., Gao, M., Qu, S., Liu, D. Intraperitoneal injection of clodronate liposomes eliminates visceral adipose macrophages and blocks high-fat diet-induced weight gain and development of insulin resistance. The AAPS Journal. 15 (4), 1001-1011 (2013).
- Toita, R., Kawano, T., Murata, M., Kang, J. H. Anti-obesity and anti-inflammatory effects of macrophage-targeted interleukin-10-conjugated liposomes in obese mice. Biomaterials. 110, 81-88 (2016).
- Sakurai, Y., Kajimoto, K., Hatakeyama, H., Harashima, H. Advances in an active and passive targeting to tumor and adipose tissues. Expert Opin Drug Deliv. 12 (1), 41-52 (2015).
- Nakhlband, A., et al. Combating atherosclerosis with targeted nanomedicines: Recent advances and future prospective. BioImpacts. , (2018).
- Sibuyi, N. R. S., Meyer, M., Onani, M. O., Skepu, A., Madiehe, A. M. Vascular targeted nanotherapeutic approach for obesity treatment. International Journal of Nanomedicine. , (2018).
- Honig, M. G., Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. Journal of Cell Biology. , (1986).
- Warren, J. S. A., Feustel, P. J., Lamar, J. M. Combined Use of Tail Vein Metastasis Assays and Real-Time In Vivo Imaging to Quantify Breast Cancer Metastatic Colonization and Burden in the Lungs. Journal of visualized experiments : JoVE. , (2019).
- Dasa, S. S. K., et al. Plectin-targeted liposomes enhance the therapeutic efficacy of a PARP inhibitor in the treatment of ovarian cancer. Theranostics. , (2018).
- Morrison, B. E., Park, S. J., Mooney, J. M., Mehrad, B. Chemokine-mediated recruitment of NK cells is a critical host defense mechanism in invasive aspergillosis. Journal of Clinical Investigation. , (2003).
- Finlon, J. M., Burchill, M. A., Jirón Tamburini, B. A. Digestion of the murine liver for a flow cytometric analysis of lymphatic endothelial cells. Journal of Visualized Experiments. , e58621 (2019).
- Upadhye, A., et al. Diversification and CXCR4-Dependent Establishment of the Bone Marrow B-1a Cell Pool Governs Atheroprotective IgM Production Linked to Human Coronary Atherosclerosis. Circulation research. , (2019).
- O'Brien, C. A., Harris, T. H. ICOS-deficient and ICOS YF mutant mice fail to control Toxoplasma gondii infection of the brain. PLoS ONE. , (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。