A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياسات FLIM-FRET للتفاعلات البروتينية البروتينية في البكتيريا الحية.
In This Article
Summary
نحن نصف هنا بروتوكولاً لتوصيف التفاعلات البروتينية بين بروتينين مختلفين للغاية في Pseudomonas aeruginosa باستخدام قياسات FLIM-FRET. ويشمل البروتوكول المنشآت سلالة البكتيريا، وشل البكتيريا، والتصوير، وما بعد التصوير الروتينية تحليل البيانات.
Abstract
تتحكم التفاعلات البروتينية البروتينية (PPIs) في العمليات الرئيسية المختلفة في الخلايا. يوفر التحليل المجهري للتصوير الشعاعي للتصوير الشعاعي (FLIM) المُدمج مع نقل طاقة الرنين بالرنين الفلوري (FRET) معلومات دقيقة حول مؤشرات أسعار المنتجين في الخلايا الحية. FLIM-FRET يعتمد على قياس اضمحلال الفلوريسنس مدى الحياة من المتبرع FRET في كل بكسل من الصورة FLIM، وتوفير معلومات كمية ودقيقة حول PPIs ومنظماتها الخلوية المكانية. نقترح هنا بروتوكول مفصل لقياسات FLIM-FRET التي طبقناها لمراقبة PPIs في Live Pseudomonas aeruginosa في حالة معينة من اثنين من البروتينات المتفاعلة التي أعرب عنها بأرقام نسخ مختلفة للغاية لإثبات جودة وقوة التقنية في الكشف عن الميزات الحرجة لـ PPIs. يصف هذا البروتوكول بالتفصيل جميع الخطوات اللازمة لتوصيف مؤشر أسعار المنتجين - بدءا من المنشآت البكتيرية المتحولة حتى التحليل النهائي باستخدام أدوات وضعت مؤخرا توفير إمكانيات التصور المتقدمة لتفسير مباشر للبيانات FLIM-FRET المعقدة.
Introduction
البروتين البروتين التفاعلات (PPIs) السيطرة على العمليات الرئيسية المختلفة في الخلايا1. تختلف أدوار PPIs على أساس تكوين البروتين ووظائف التقارب والمواقع في الخلايا2. يمكن التحقيق PPIs عن طريق تقنيات مختلفة3. على سبيل المثال، إن التشارك في المناعة هو تقنية بسيطة نسبياً وقوية وغير مكلفة تستخدم عادة لتحديد أو تأكيد مؤشرات أسعار المنتجين. ومع ذلك، يمكن أن تكون دراسة مؤشرات أسعار المنتجين صعبة عندما يكون البروتينات المتفاعلة ذات مستويات تعبير منخفضة أو عندما تكون التفاعلات عابرة أو ذات صلة فقط في بيئات محددة. دراسة PPIs التي تحدث بين الإنزيمات المختلفة للمسار p. aeruginosa يتطلب أن قمع الحديد العام- شارك في عوامل قمع الفراء هو تخفيف للسماح للتعبير عن جميع البروتينات من المسار pyoverdine للتعبير عنها في الخلية4,5,6. هذا التنظيم المشترك لجميع البروتينات من المسار النتائج في الوقت المناسب التعبيرات في الخلية المتوقع أن تعزز تفاعلاتها. إن التنوع من حيث الحجم والطبيعة ومستويات التعبير وعدد البروتينات لهذا المسار الأيضي يجعل من الصعب الدراسة في النظم المعاد تشكيلها6. ولذلك فإن استكشاف مؤشرات أسعار المنتجين في بيئتها الخلوية أمر بالغ الأهمية لزيادة فهم الوظائف البيولوجية للبروتينات في سياقها الأصلي.
فقط بعض الطرق بما في ذلك fluorescence تسمح استكشاف PPIs في الخلايا الحية7. من بين معلمات الفلوريسنس المختلفة التي يمكن قياسها ، فإن عمر الفلوريسنس (أي متوسط الوقت الذي يبقى فيه الفلوروفور في حالته المتحمسة قبل انبعاث فوتون) هو على الأرجح أحد أكثر المعلمات إثارة للاهتمام لاستكشافها في الخلايا الحية. عمر الفلوروفور الفلوري حساس جداً لبيونته، وبالتالي يمكن لـ FLIM توفير معلومات كيميائية أو فيزيائية فيما يتعلق بمحيط الفلوروفور8. وهذا يشمل وجود Förster نقل الطاقة الرنين (فريت) التي يمكن أن تحدث في وجود "مقبول" من الفلوريس تقع على مسافة قصيرة من "المانحة" fluorescence. نقل الطاقة النتائج في تقصير كبير من فلورية المانحة مدى الحياة (الشكل 1A)، مما يجعل الفلوريسنس التصوير المجهرية مدى الحياة (FLIM) نهجا قويا لاستكشاف البروتين البروتين التفاعلات مباشرة في الخلايا الحية. يمكن لـ FLIM بالإضافة إلى ذلك توفير معلومات مكانية حول مكان حدوث التفاعلات في الخلايا7و8. وهذا النهج قوي للغاية في التحقيق في مؤشرات أسعار المنتجين في الحالات التي يكون فيها وضع العلامات مع الفلوروفوريس من الشريكين المتفاعلين ممكناً.
لFRET أن يحدث - الظروف الحرجة على المسافة بين اثنين من الفلوروفور مطلوب8،9. وينبغي أن لا يكون الفلوروفورين بعيدين عن بعضهما البعض بأكثر من 10 نانومتر. لذلك، يجب أخذ التحذيرات عند تصميم تجارب FLIM-FRET لضمان أن المانح ومقبل الفلوريسنس لديهم فرصة ليكونوا قريبين من بعضهم البعض في المجمع المتفاعل. وفي حين أن هذا قد يبدو مقيداً، فإنه في الواقع ميزة حقيقية لأن الاعتماد على المسافة من فريت يضمن أن اثنين من البروتينات الموسومة التي تخضع لفريت يجب أن تتفاعل جسدياً(الشكل 1A). ولذلك فإن الصعوبات في الحصول على إجابات واضحة عن مؤشر أسعار المنتجين في تجارب الميكالوك (قد لا يتفاعل بالضرورة بروتينان مُقَدَّمان) ليست مشكلة باستخدام FLIM-FRET.
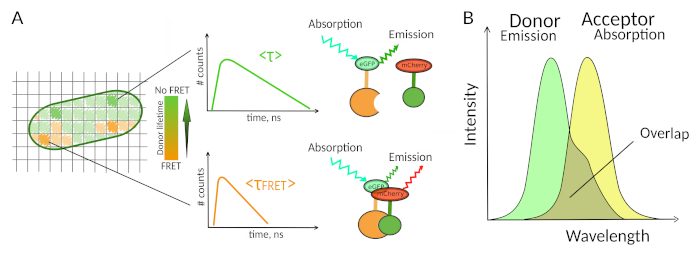
الشكل 1: مبدأ التحليل FLIM-FRET. كل بكسل من FLIM-FRET صورة متعددة الأبعاد يحتوي على معلومات حول تسوس الفلوريس سجلت في هذا الموقع المحدد (#counts = عدد الفوتونات المكتشفة في قناة t). (A) التمثيل الكلاسيكي لصورة FLIM هو عادةً صورة 2D مشفرة بالألوان الخاطئة (يسار). ويمكن ملاحظة انخفاض متوسط عمر المفلورة للمتبرع - كما يتضح من تغير في مقياس اللون - في وجود فريت، وهو مفيد بشأن وجود مؤشرات أسعار المنتجين في هذه المنطقة المكانية. (B) التداخل بين طيف الانبعاثات من المتبرع وطيف امتصاص المتقبل ضروري لحدوث فريت. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
وثمة شرط ثان لفريت هو أن الطيف انبعاث من المانح وأطياف امتصاص من المتقبل ينبغي أن تتداخل8 (الشكل 1B). وينبغي أن يكون استثارة المفلورة من المانح في أطوال موجية التي تسهم قليلا جدا في الإثارة المفلورة المباشرة للمقبل. ليس كل تركيبات من الفلوروفورات ممكنة، ونحن نوصي بالإضافة إلى ذلك لاستخدام الجهات المانحة بشكل تفضيلي مع تحلل الفلورين أحادية النطاق لتسهيل تفسيرات FLIM-FRET10. العديد من الأزواج من البروتينات fluorescence تلبية هذه المتطلبات، بما في ذلك زوجين eGFP-mCherry شعبية11 (لاستعراض على لوحة من البروتين الفلوري المتاحة FRET أزواج انظر12،13).
FLIM-FRET يسمح قياس تسوس عمر الفلوريسنس من المتبرع FRET في كل بكسل من صورة FLIM(الشكل 1A). هناك تقنيتان رئيسيتان لتحديد عمر الفلور الذي يختلفان في الاكتساب والتحليل: مجال التردد (FD)14 والمجال الزمني (TD). TD FLIM هو أكثر انتشارا ويتم تنفيذها باستخدام الإضاءة النبضية جنبا إلى جنب مع مختلف تكوينات الكشف المحتمل بما في ذلك طرق الغاء15، كاميرا16 خط أو وقت الفوتون واحد المترابطة العد (TCSPC) تقنيات8. وبالنسبة لكل من تقنيات FD و TD، لا يقاس عمر الفلوريسنسي بشكل مباشر ولكنه يتطلب تحليلاً للبيانات المقاسة لتقدير العمر أو مدى وجود التفاعلات. بالنسبة لتقنيات TCSPC، يعتمد التحليل الأكثر استخدامًا على تركيب التحللات مع وظائف مفردة أو متعددة الأسية باستخدام أقل تكراري تربيعي من إعادة الالتواء التي تقلل من مجموع المرجح للمخلفات.
وأخيراً، FLIM-FRET يمكن تنفيذها باستخدام الإثارة الفوتونية أو متعددة الصور على حد سواء. أحدث مزايا عدة مثل الحد من autofluorescence وphotodamage من الطائرة المحورية. الإثارة متعددة الصور تسمح أيضا عمق الإثارة أطول إذا كان يعمل في عينات سميكة 3D8. على العكس من ذلك، الإثارة الفوتون واحد عادة ما يكون أكثر كفاءة كما يتم تحديد المقاطع العرضية امتصاص اثنين فوتون من البروتينات الفلورسنت17.
هنا، نقترح بروتوكولا لقياسات FLIM-FRET من PPIs في حي P. aeruginosa في حالة معينة من اثنين من البروتينات التفاعل (PvdA وPvdL) أعرب عن ذلك مع أعداد مختلفة جدا من النسخ لإثبات جودة ومتانة تقنية في الكشف عن السمات الحرجة من PPIs. وتشارك البروتينات PvdA وPvdL في التركيب الحيوي pyoverdine. PvdA هو L-ornithine N5-oxygenase ويركب L-N5-formyl-N5-hydroxyornithine من L-ornithine بواسطة الهيدروكسيل (PvdA) و formylation (PvdF)18. PvdL هو إنزيم غير الريبوسومي الببتيد (NRPS) يتكون من أربع وحدات. الوحدة الأولى تحفز الأحماض الميرية. الوحدة الثانية تحفز تفعيل L-Glu والتكثيف إلى الميرستية-coA. ثم, الوحدة الثالثة يكثف الأحماض الأمينية L-تاير التي يتم بعد ذلك isomerized في D-تاير. وأخيرا، فإن الوحدة الرابعة تربط L-Dab (حمض ديامنوبتيريك) من الأحماض الأمينية لتشكيل ثلاثية الptide L-Glu/D-Tyr/L-Dab6. وهكذا فإن PvdL هي المسؤولة عن تخليق الأحماض الأمينية الثلاثة الأولى من السلائف pyoverdine. إن تفاعل بروتين PvdA مع PvdL يثير الدهشة حيث أن PvdL ، على العكس من PvdI و PvdJ ، لا يحمل وحدة خاصة بـ L-N5-formyl-N5-hydroxyornithine. هذا التفاعل تشير إلى أن جميع الانزيمات المسؤولة عن السلائف البيوفردين يتم ترتيبها في مجمعات متعددة الأنزيمات العابرة والديناميكية19,20.
في هذا التقرير نشرح بالتفصيل كيفية بناء السلالات البكتيرية التي تعبر عن أصلين تتفاعل eGFP و mCherry وصفت البروتينات. كما أننا نُصف إعداد العينات وظروف التصوير الفعال لخلية FLIM-FRET. وأخيرا ، نقترح خطوة بخطوة تعليمي لتحليل الصور بما في ذلك أداة وضعت مؤخرا توفير إمكانيات التصور المتقدمة للتفسير المباشر للبيانات FLIM -FRET معقدة. مع هذا التقرير، نود أن نقنع ليس فقط المغامرة ولكن معظم علماء الأحياء أن فريت-FLIM هو تقنية سهلة الوصول وقوية قادرة على معالجة أسئلتهم حول PPIs مباشرة في البيئة الخلوية الأصلية.
Protocol
1- بناء بلاسميد
- تضخيمها من قبل اثنين PCR (PCR1 و 3) تسلسل الحمض النووي (استخدام الحمض النووي الجينومي P. aeruginosa PAO1) من 700 أزواج قاعدة المنبع والمصب من المناطق المقابلة لموقع الإدراج في P. aeruginosa الجينوم مع البوليميراز الحمض النووي عالية الدقة. إضافة مواقع تقييد التمهيديات باللونين الأزرق والأخضر وإضافة تسلسل متداخل مع mCherry إلى التمهيديات باللون الأحمر (الشكل 2).
- لPpvdA وصفت في C-terminus مع eGFP، تضخيم منطقة 700 BP المنبع بالنسبة إلى كودون وقف من قبل التمهيديات باللون الأزرق، وتضخيم 700 BP منطقة المصب التي تحتوي على كودون وقف مع التمهيديات باللون الأخضر.
- لPvdL وصفت في N-terminus مع mCherry، تضخيم منطقة 700 BP المنبع إلى الجين PvdL، بما في ذلك كودون البداية، من قبل الزبيب باللون الأزرق، وتضخيم منطقة المصب 700 BP مع التمهيديات باللون الأخضر.
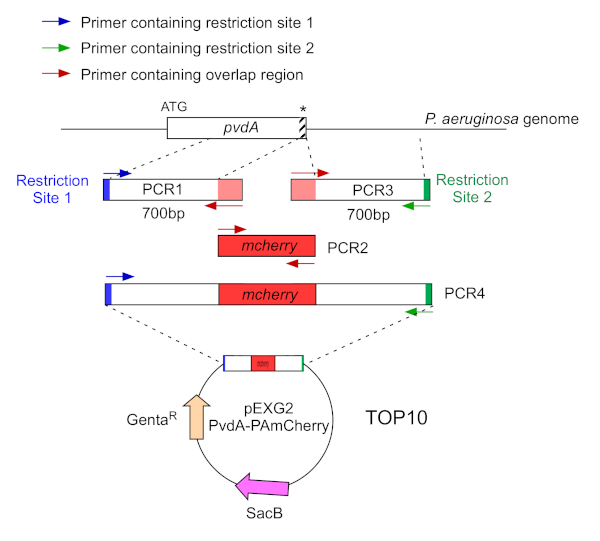
الشكل 2: نظرة عامة على استراتيجية البوليسولون البوليسترات وبناء البلازميدات المستخدمة في بناء PvdA-mCherry. انظر النص للحصول على التفاصيل - ترميز pvdA إنزيم المشاركة في التركيب الحيوي للpyoverdine siderope، وهو المستقلب الثانوية المشاركة في اقتناء الحديد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تضخيم الحمض النووي ترميز eGFP (دون بداية ووقف codons) مع الأحرف الأولية باللون الأحمر مع البوليميراز الحمض النووي عالية الدقة.
- تنقية منتجات PCR على PCR تنظيف العمود(جدول المواد).
- اخلطي منتجات PCR المتداخلة في نسبة متساوية واجرِي PCR ثانية باستخدام البهات الأولية مع موقع التقييد المستخدم في PCR 1 و 3 (الأخضر والأزرق في الشكل 2).
- ترحيل المنتج PCR في agarose-1x TAE (تريس قاعدة خلات EDTA الرقم الH 8.0) هلام، وقطع الفرقة المقابلة واستخراج amplicon مع PCR تنظيف عدة (جدول المواد).
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا. - هضم PCR amplicon وpEXG2 plasmid باستخدام الإنزيمات تقييد المقابلة21.
- Ligate plasmid وإدراج مع T4 الحمض النووي ligase باستخدام 90 نانوغرام من البلازميد والنسبة الجزيئية 1:1 (plasmid:insert).
- تحويل بناء البلازميدات في الخلايا المختصة كيميائيا E. كولاي TOP10 الخلايا عن طريق خلط المنتج الربط و 100 ميكرولتر من TOP10. احتضان البكتيريا المختصة / خليط plasmid على الجليد لمدة 30 دقيقة قبل المضي قدما مع 42 درجة مئوية صدمة الحرارة لمدة 60 s. ثم، وضع أنبوب على الجليد لمدة 10 دقيقة.
- إضافة 1 مل من مرق lysogeny (LB) إلى البكتيريا واحتضان في 37 درجة مئوية لمدة 1 ساعة.
- لوحة 100 البكتيريا μL على LB أجار تحتوي على 15 ميكروغرام / مل جنتاميسين.
- احتضان ليلة وضحاها في 37 درجة مئوية.
- فحص وجود إدراج من قبل مستعمرة PCR: من مستعمرة تحويل معزولة واحدة، والتقاط كمية دقيقة من البكتيريا التي تضاف إلى مزيج PCR تحتوي على التمهيديين التهجين على البلازميد في مثل هذه الطريقة التي يمكن الكشف عن وجود أمبيركون عن طريق تشغيل المنتج على هلام agarose (البوليميراز الحمض النووي). من نفس المستعمرة المستخدمة في PCR، نقل كمية صغيرة من البكتيريا على لوحة جديدة تحتوي على 15 ميكروغرام / مل gentamicin لتكون معزولة وتستخدم لاستخراج البلازميد. وأخيرا ، عزل وتنقية البلازميد (جدول المواد) والتحقق من إدراج عن طريق التسلسل.
- تخزين البكتيريا TOP10 التي تحتوي على البلازميد في LB مع 20 ٪ الجلسرين في 1.5 مل microtube في -80 درجة مئوية وbsmid المنقى في -20 درجة مئوية في 1.5 مل أنبوب.
ملاحظة: يمكن إيقاف البروتوكول مؤقتاً هنا
2. الفلورسنت إدراج العلامة في الجينوم الكروموسومات من P. aeruginosa (الشكل 3)
- تنمو P. aeruginosa، TOP10 و E. القولونية مساعد البكتيريا، كل واحد في 5 مل من LB دون مضاد حيوي في 30 درجة مئوية تحت اهتزاز المدارية بين عشية وضحاها22. توليد الفلورسنت إدراج الوسم في الجينوم P. aeruginosa عن طريق نقل البلازميد من E. القولونية TOP10 في سلالة PAO1 ودمج البلازميد في الجينوم عن طريق إعادة التركيب المتماثل. ثاني عبور عبر حدث استئصال المتجه توليد متحولة المقابلة.
- قياس الكثافة البصرية في 600 نانومتر (OD600 نانومتر)من الثقافة البكتيرية ومزيج كمية متساوية من P. aeruginosa (500 ميكرولتر، OD600 نانومتر = 1.0) مع E. القولونية TOP10 pEXG2 (500 ميكرولتر، OD600 نانومتر = 1.0) و E. القولونية HB101 pRK600 المساعد (500 ميكرولتر، OD600 نانومتر = 1.0) في 1.5 مل microtube.
- جهاز طرد مركزي 5 دقيقة في 9300 س ز ل بيليه البكتيريا.
ملاحظة: يمكن استخدام الأدوات عبر الإنترنت لتحويل قوة الطاردة المركزية إلى الدوران في الدقيقة (دورة في الدقيقة) لضبط سرعة الطرد المركزي. - الحفاظ على بيليه البكتيرية والتخلص من افرا.
- Resuspend بيليه التي تحتوي على البكتيريا في 50 ميكرولتر من LB.
- لوحة بقعة (~ 50 ميكرولتر) من الخليط على منتصف أجار LB (سخن على 37 درجة مئوية) واحتضان 5 ح في 37 درجة مئوية.
- الخردة بقعة مع حلقة تطعيم عقيمة و resuspend في 1 مل من LB.
- لوحة 100 ميكرولتر من هذا التعليق البكتيري على أجار LB تحتوي على 10 ميكروغرام / مل الكلورافينيكول للقضاء على E. القولونية (E. القولونية TOP10 pEXG2 و E. القولونية HB101 pRK600 المساعد حساسة لكلورامفينيكول ولكن P. aeruginosa هو مقاومة طبيعية) و 30 ميكروغرام / مل جنتاميسين واحتضان 2 أيام في 37 درجة مئوية.
- Resuspend مستعمرة واحدة في 1 مل LB واحتضان في 37 درجة مئوية تحت اهتزاز المداري 4H.
- الطرد المركزي 3 دقيقة في 9300 س ز والتخلص من 950 ميكرولتر من الفائق. Resuspend بيليه في 50 ميكرولتر من LB وعزل الخليط على LB agar تحتوي على السكروز وبدون NaCl.
- احتضان ليلة وضحاها في 30 درجة مئوية.
- بقعة المستعمرات المعزولة على LB agar و LB أجار التي تحتوي على 15 ملغ / مل جنتاميسين من أجل التحقق من حساسية gentamicin.
- تحقق من إدخال eGFP أو mCherry بواسطة مستعمرات PCR (بوليميراز الحمض النووي) والتسلسل باستخدام التمهيديات المحددة.
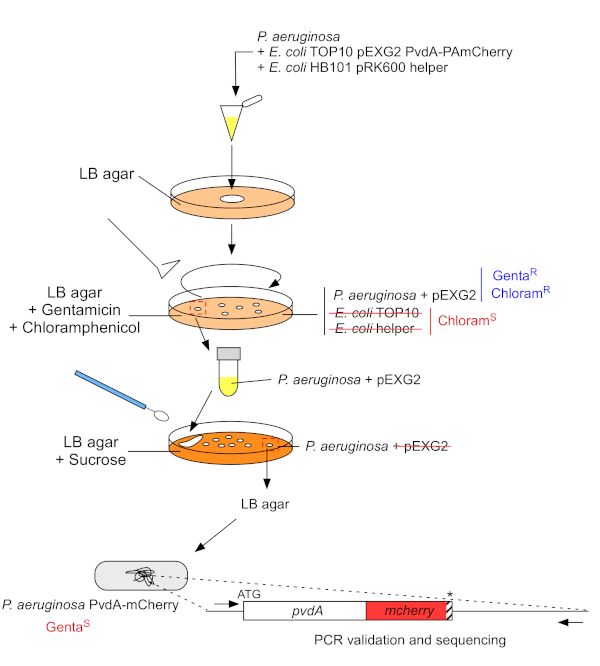
الشكل 3: بروتوكول بناء سلالات P. aeruginosa عن طريق إدراج علامة الفلورسنت. راجع النص للحصول على التفاصيل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. قياس Pyoverdine
- تنمو البكتيريا في 5 مل من LB في 30 درجة مئوية تحت اهتزاز المدارية بين عشية وضحاها.
- بكتيريا بيليه عن طريق الطرد المركزي، وغسلها وتنميتها في 5 مل من SM (Succinate المتوسطة، التركيب: 6 g∙ L−1 K2HPO4, 3 g∙L −1 KH2PO4, 1 g ∙L −1 (NH4)2 SO4, 0.2 g • L−1 MgSO4,7 H2O و 4 g∙ L-1 صوديوم succinate مع درجة حِسِّي معدَّل إلى 7.0 بإضافة NA) عند 30 درجة مئوية تحت الاهتزاز المداري بين عشية وضحاها. SM هو وسيلة محرومة من الحديد - غياب الحديد سوف تنشيط التعبير عن البروتينات من مسار البيفيردين قمعها عادة في وجود الحديد.
- قياس OD600 نانومتر وتمييع البكتيريا مرة أخرى في المتوسطة SM الطازجة في600 نانومتر تحت ضغطة تحت ضغط = 0.1 وتنمو لهم في 30 درجة مئوية تحت اهتزاز المدارية بين عشية وضحاها.
- قياس OD600 نانومتر لتحديد كمية البكتيريا في كل عينة.
- إعداد كروفت الكوارتز التي تحتوي على 100 ميكرولتر من ثقافة P. aeruginosa وكاملة إلى 1 مل من SM (900 ميكرولتر). إعداد cuvette الكوارتز التي تحتوي على 1 مل من متوسطة SM (فارغة).
- باستخدام مطياف الأشعة فوق البنفسجية المرئية، وقياس امتصاص في أقصى ذروة الامتصاص. في درجة الH 7.0، الحد الأقصى لامتصاص pyoverdine يحدث في ~ 400 نانومتر. تحديد تركيز البيوفردين (شكل apo) في العينة باستخدام قانون بير لامبرت باستخدام معامل انقراض الضرس في 400 نانومتر من ه = 19 000 M-1•سم-1.
ملاحظة: يمكن قياس البيوفردين كمياً في نطاق الامتصاص من ~0.1 إلى ~1 (اعتماداً على مقياس الطيف الضوئي المرئي للأشعة فوق البنفسجية) الذي يزيد فيه الامتصاص خطياً مع التركيز.
4. ثقافة البكتيريا والظروف للخلايا للتعبير عن PvdA، PvdL وPvdJ
- في اليوم 1، تلقيح أنبوب مع 5 مل من LB من مخزون الجلسرين المناسب من البكتيريا وتنمو البكتيريا على مدى الليل في 30 درجة مئوية في 200 دورة في الدقيقة في حاضنة شاكر المدارية.
- في اليوم 2، خلايا بيليه عن طريق الطرد المركزي في 3،000 س ز لمدة 3 دقائق والتخلص من السوبر.
- إعادة تعليق الخلايا في 10 مل من SM.
- كرر الخطوات 4.2-4.3 مرة واحدة وتنمو البكتيريا في SM بين عشية وضحاها عند 30 درجة مئوية 200 دورة في الدقيقة.
- في اليوم 3، تمييع 1/10 ثقافة البكتيريا في SM الطازجة.
- تنمو البكتيريا المخففة مرة أخرى بين عشية وضحاها في نفس الظروف.
ملاحظة: يمكن الكشف عن وجود pyoverdine بصريا كما أنه الألوان في الأصفر والأخضر وسائل الإعلام المتنامية. ويبين أن التعبير عن البروتينات من مسار pyoverdine قد تم تفعيلها، وأن يتم التعبير عن الإنزيمات من الفائدة في الخلايا.
5. إعداد لوحة agarose (الشكل 4)
- ضع مجهر الزجاج الشريحة على سطح أفقي مستو. ترتيب اثنين من الشرائح الزجاجية يعلوها طبقتان من شريط لاصق على كل جانب من الشريحة الأولية.
ملاحظة: احتفظ بمسافة 1-2 مم بين الشرائح الثلاثة المحاذة لمنع أغروز meleted لتنتشر في نهاية المطاف على الشرائح مع شريط لاصق. - الميّزة وتصب قطرة من 70 ميكرولتر من 1٪ ذاب agarose على الشريحة الزجاجية. أضف شريحة رابعة على الجزء العلوي لتسطيح قطرات أغاروز واضغط لأسفل بلطف. انتظر دقيقة
- خلع الشريحة العليا وإسقاط مع ماصة حوالي 3 ميكرولتر من البكتيريا في 3 إلى 4 بقع في مواقع مختلفة على لوحة agarose.
- تغطية مع غطاء الزجاج المجهري (على سبيل المثال 22x22 مم #1.5 سمك).
ملاحظة: التسطيح وسمك الأغطية مهمان للعمل مع الإثارة ذات الفوتونتين. يغطي الدقة مع التسطيح موحدة تسيطر عليها وانخفاض autofluorescence عادة ما تكون خيارا جيدا. - إصلاح غطاء مع البارافين الذائبة لختم الغطاء على الشريحة الزجاجية. ابدأ بتثبيت الزوايا الأربعة للأغطية.
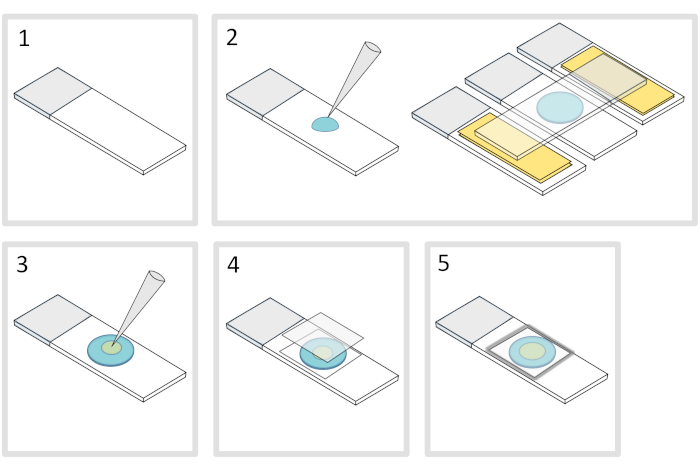
الشكل 4: إعداد لوحة أغاروز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
6. التصوير مع إعداد المجهر فوتون اثنين
ملاحظة: نحن نستخدم مجهر مسح ضوئي مقلوب منزلي الصنع مع 60x 1.2NA هدف الغمر المائي الذي يعمل في وضع جمع الفلوريسينس المُسَدَس. يتم تعيين الطول الموجي الإثارة اثنين من الفوتون في 930 نانومتر. يتم توفيره بواسطة تي: الياقوت الليزر (80 ميغاهرتز معدل التكرار، ≈ 70 fs عرض النبض) تعمل في 10-20 ميغاواط. تم جمع فوتونات الفلوريسنس من خلال مرشح تمريرة قصيرة 680 نانومتر و525/50 نانومتر شريط تمرير مرشح قبل أن توجه إلى انهيار جليدي يقترن الألياف صورة الصمام الثنائي متصلة الوقت المترابطة الفوتون واحد العد (TCSPC) وحدة. كما تم تجهيز المجهر مع مصباح الفلورانس انتقال. العديد من المجاهر FLIM-FRET متاحة تجاريا الآن والعديد من مرافق التصوير مجهزة بأجهزة قادرة على إجراء قياسات FLIM-FRET.
- استخدام مصباح الفلوريسنس لتركيز الهدف على أحادية من البكتيريا في العينة وتحديد المناطق ذات الأهمية.
- تأكد من أن مصراع الليزر الإثارة مغلق وأن ضوء الأشعة تحت الحمراء القادم من الليزر مسدود ولا يدخل المجهر.
تحذير: يجب إيلاء عناية دقيقة ويقظة مستمرة العمل مع الليزر نبض الأشعة تحت الحمراء كما ضوء الليزر لا يمكن أن ينظر إليها من قبل العينين ولكن أي وحتى عرض مباشر عابر أو انعكاس الليزر يمكن أن تكون ضارة للغاية وخلق أضرار العين لا رجعة فيها. يرجى الرجوع إلى إجراءات السلامة بالليزر المحلية والتدريب قبل استخدام أجهزة الفحص المجهري. - ضع الشريحة المجهرية على المسرح مع الأغطية التي تواجه الهدف.
- تحقق من أن مصباح الفلوريسين هو تشغيل.
- بدوره برج مكعب مرشح لتحديد مكعب eGFP وفتح مصراع مصباح الفلوريسين.
- إرسال ضوء الفلوريسنس نحو العدسة من المجهر.
تحذير:تأكد من التخلص من المرشحات المناسبة في مسار الضوء للتخلص من ضوء الإثارة المباشر القادم من مصباح الفلورسين الذي يمكن أن يضر العينين. - تركيز الهدف على البكتيريا باستخدام مقبض المجهر.
- حدد منطقة ذات أهمية في العينة عن طريق ترجمتها باستخدام عصا التحكم التي تتحكم في المرحلة الآلية
ملاحظة: التركيز أسهل مع عينة فلورية عالية تسمح لفلوريسنس أن ينظر إليها مباشرة مع العينين. - تبديل الإثارة بالليزر 2PE لقياسات FLIM-FRET.
- أرسل مسار انبعاث الفلوريسين إلى الخلف نحو الكاشف.
- العودة إلى الوراء برج مكعب مرشح لتحديد مكعب dichroic ليزر 930 نانومتر.
- تعيين قوة الليزر إلى 20 ميغاواط.
- تعيين حجم المنطقة ذات الأهمية إلى 30 ميكرومتر. هذه العملية يضبط الجهد تشغيل المرايا galvo ويحدد نطاق تحركاتها (الشكل 5).
- تشغيل كاشف والبدء في مسح العينة - أزرار بدء ووقف السيطرة على المسح الضوئي أيضا السيطرة على فتح وإغلاق مصراع الليزر على حد سواء لأسباب تتعلق بالسلامة والحد من photobleaching من العينة(الشكل 5).
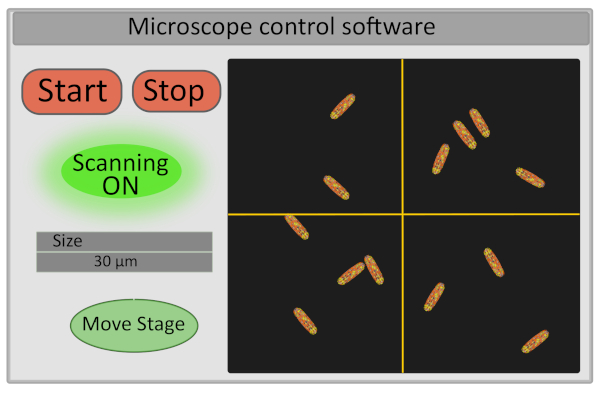
الشكل 5: التمثيل التخطيطي للواجهة من برنامج التحكم بالمجهر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- إذا لزم الأمر، ضبط التركيز عن طريق تحريك قليلا مقبض التركيز المجهر غرامة.
- اختر مجال الرؤية للتصوير عن طريق تحريك المرحلة بدقة من واجهة الكمبيوتر. ويمكن القيام بذلك على الإعداد عن طريق تحريك الصليب على الصورة في برنامج التحكم في المجهر (الشكل 5) التي ستحدد مركز جديد للصورة والضغط على مرحلة التحرك. حقل جيد من الرؤية للحصول على يتوافق مع صورة مع 10-30 البكتيريا غير متحركة، وركزت جميع بشكل صحيح (جميع البكتيريا على نفس المستوى). إذا كانت مهتمة في استخراج الخلايا المفردة FLIM-FRET البيانات، وضمان أن البكتيريا بشكل جيد فردية (تجزئة الصورة سيكون أسهل بكثير).
- افتح برنامج SPCM (برنامج تجاري للحصول على البيانات) وتحقق من أن معدل عدد الفوتونات ليس مرتفعًا جدًا لتجنب تأثير التراكم الذي يمكن أن يؤثر على القياسات مدى الحياة. إذا لزم الأمر، خفض أسفل كثافة الليزر للحفاظ على معدل العد الفوتون منخفضة (حوالي 1٪ من معدل التكرار الليزر).
ملاحظة: يصف تأثير كومة المتابعة تأثيرات الفوتونات المفقودة في معدلات عدد الفوتونات العالية بسبب الوقت الميت لأجهزة العد الفوتونية الأحادية المرتبطة بالوقت (TCSPC). إذا حدث كومة لأعلى، يصبح متوسط العمر المقاس أقصر بشكل مصطنع مع ربما مكون أقصر إضافي يمكن أن يظهر في الاضمحلال بسبب الإفراط في اإفقامات الفوتونات سريعة الانبعاثات. - ضبط المعلمات الامتلاك بما في ذلك وقت جمع الاكتساب (عادة 60 s إلى 180 s مطلوبة لجمع الفوتونات كافية).
- اضغط على زر ابدأ وانتظر حتى تكتمل عملية الاستحواذ.
- حفظ البيانات.
- توقف عن مسح العينة وإيقاف تشغيل جهاز الكشف.
- حدد حقل رؤية آخر في العينة وكرر الخطوات 6.14-6.22 أو قم بـ صورة شريحة مجهرية جديدة بتكرار الخطوات 6.1-6.22.
ملاحظة: P. aeruginosa يمكن أن يعيش ويقسم لمدة تصل إلى 6-8 ساعات في درجة حرارة الغرفة على لوحة agarose (المقابلة في الماضي ~ 4 تضاعف الوقت في 20 درجة مئوية). من الناحية المثالية، لا تنتظر طويلا جدا لتنفيذ FLIM-فريت القياس لتجنب مراقبة وسادة مغطاة تماما مع البكتيريا.
7 - تحليل البيانات
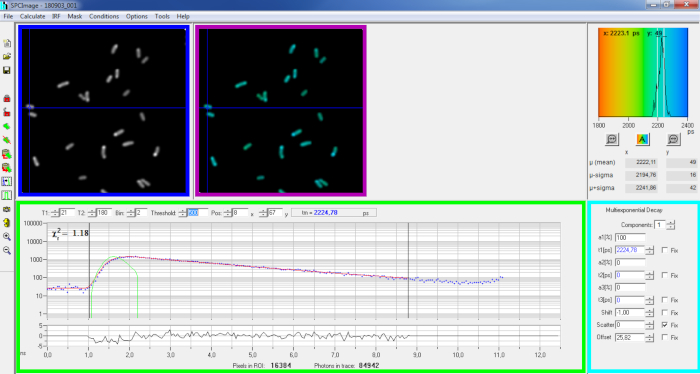
الشكل 6: اللوحة الرئيسية من نافذة تحليل البيانات من برنامج SPCImage. صورة كثافة (مربع أزرق)، صورة مدى الحياة (مربع الأرجواني)، الرسم البياني مدى الحياة (أعلى اليمين)، منحنى الاضمحلال في موقف محدد (مربع أخضر)، ومعلمات الاضمحلال في موقف محدد (مربع سماوي) من اضمحلال PvdA-eGFP تمثيلية مسجلة في العيش P. aeruginosa باستخدام بطاقة اقتناء bh SPC830 على إعداد ثيرسيشن فوتونتين مصنوع منزليا- FLIM-FRET. منحنى الاضمحلال التجريبي للبكسل المشار إليه في الصورة أعلاه ، يمكن رؤيته في اللوحة الخضراء في تناسبها أحادي الأسي (المنحنى الأحمر) الذي يتحلل من وظيفة الاستجابة الآلية المحسوبة (المنحنى الأخضر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- التحليل الأساسي
- تشغيل برنامج SPCImage.
- استيراد ملف SPCM المحفوظة. يتم عرض صورة كثافة على اللوحة العلوية اليسرى من البرنامج(الشكل 6 المربع الأزرق).
- فحص نافذة منحنى الاضمحلال(الشكل 6 مربع أخضر) الذي يعرض بيانات الاضمحلال المقابلة للبكسل المحدد في صورة الكثافة(الشكل 6 المربع الأزرق). يتم عرض أرقام الفوتون في كل مرة كنقاط زرقاء ويتم رسم تناسب الاضمحلال كخط أحمر. لاحظ أنه بعد تحميل البيانات يعرض البرنامج ألمع بكسل من الصورة. حرك الصليب الأزرق عبر الصورة لفحص البيكسلات ذات الكثافة الأقل. سيتم تحديث نافذة الاضمحلال تلقائيا في كل موقف بكسل جديد.
ملاحظة: من الصعب جداً قياس وظيفة الاستجابة الفعالة (IRF) لنظام المسح الضوئي بالليزر. يمكن استخدام نموذج IRF محسوب من الحافة الصاعدة من منحنيات اضمحلال الفلوريس في بيانات FLIM للتحلل. هذا هو الخيار القيام به افتراضيا في SPCimage(الشكل 6 منحنى أخضر). - ضبط نطاق المناسب عن طريق تحريك قنوات البداية والنهاية من مربع المناسب (T1 و T2 في المربع الأخضر). T1 يجب أن تبدأ في القنوات القليلة الأولى من ارتفاع الاضمحلال و T2 تعريف القناة الأخيرة في نهاية الاضمحلال ويمكن اختيارها باعتبارها واحدة من القنوات الأخيرة من الاضمحلال مع عدد من الفوتونات فوق تعويض عدد الفوتونات (أي، مستويات الفوتونات التي تم عدها قبل ارتفاع الاضمحلال).
- اختر binning بتغيير قيمة سلة. يدمج اضمحلال المنحنى الفوتونات من البكسل المحدد مع مساحة من البكسل i حول موضع المؤشر المحدد بواسطة معلمة الحاويات (زيادة binning سيزيد عدد الفوتونات في الاضمحلال وقد يكون مفيدًا للوصول إلى عدد الفوتونات المطلوبة لنماذج متعددة الأسية).
- ضبط قيمة الحد. لن يتم تضمين وحدات البكسل التي ليس لديها قناة واحدة على الأقل تحتوي على عدد من الفوتونات أعلى من قيمة العتبة في إجراء التركيب. بالطبع كلما ارتفع عدد وحدات البكسل التي يجب احتواؤها ، كلما كان التحليل أطول.
ملاحظة: يمكن أن تحتوي بيانات FLIM على عدد هائل من وحدات البكسل وقنوات الوقت. تسمح الإصدارات الأخيرة من البرنامج باستخدام وحدة معالجة الرسومات (GPU) لمعالجة عدد كبير من وحدات البكسل بالتوازي ، مما يقلل بشكل كبير من أوقات المعالجة. يمكن أن يكون من المثير للاهتمام لضبط المعلمات binning وعتبة باستخدام الصور المقابلة للمنشآت البكتيريا التي تظهر أدنى كثافة fluorescence (على سبيل المثال، مع سلالات بكتيرية مع أدنى مستويات التعبير). وسيكفل ذلك أن تستوفي التحللات ذات الصلة التي لوحظت في هذه العينات معايير التصفية، وسوف تدرج في التحليل. يمكن استخدام هذه المعلمات بعد ذلك لكافة الصور. - ضبط، إذا لزم الأمر، المعلمات الاضمحلال (مربع سماوي). اسمحوا التحول تختلف، معظم الوقت مبعثر وتعويض يمكن أن تكون ثابتة إلى الصفر إذا نظرة على وظائف الاضمحلال تظهر أن مساهمتها لا تذكر. يمكن تقدير الإزاحة التي تبحث في القنوات الأولى من الاضمحلال - لاحظ أن التصوير لفترة طويلة بسبب انخفاض الفلورسيه في العينة عادة ما يؤدي إلى تعويض غير صفر. يحدث التشتت في الغالب في عينات سميكة ويمكن اعتباره لا يذكر خلاف ذلك.
- قبل تشغيل الملاءمة، حدد خوارزمية التركيب. افتح نافذة إعدادات الخوارزمية في إظهار/إخفاء خيارات الطراز. حدد الحد الأقصى لتقدير الاحتمال (MLE) خوارزمية (الشكل 7A).
- تشغيل تركيب الصورة بالنقر فوق حساب | مصفوفة الاضمحلال. بمجرد الانتهاء، تظهر الصورة FLIM المرمزة مدى الحياة في لوحة الصور مدى الحياة(الشكل 6 المربع الأرجواني).
ملاحظة: على نافذة منحنى الاضمحلال(الشكل 6 مربع أخضر) فمن الممكن أن نرى قيمة العمر الذي يتوافق مع كل بكسل من الصورة عن طريق تحريك الصليب الأزرق.
ملاحظة: لمعالجة عدد كبير من ملفات البيانات FLIM مشابهة تلقائياً، يمكن استخدام وضع معالجة دفعة. - تحقق من جودة الملاءمة التي تنظر إلى المخلفات (الموزعة بشكل مثالي بشكل عشوائي حول 0) وقيمة مربعة تشي قريبة من 1.
- يمكن تصدير البيانات المجهزة في أشكال مختلفة. لتصدير الملفات في ملفات txt، انتقل إلى ملف | تصدير. في إطار خيارات التصدير (الشكل 7B) ، اختر تحديد الكل ثم انقر فوق تصدير.
- وأخيراً حفظ ملف التحليل. ملفات التحليل يتم حفظها كملفات *.img ويمكن إعادة فتحها مباشرة في SPCImage.
ملاحظة: في حالات معينة من الكميات غير المتوازنة من المانحين/المقبولين، يمكن أن يكشف FLIM-FRET عن مجموعات فرعية في خليط من مجمعات البروتين المتفاعلة - خاصة عندما تكون تركيزات الشريكين مختلفة جداً، مما يؤدي إلى خليط من الأنواع المعقدة والحرّة. الأنواع غير المتفاعلة (التي تتميز بتسوس مشابه جداً للانحلال الوحيد للمتبرع) يمكن تمييزها من الأنواع المتفاعلة على افتراض عدم وجود ثوابت مكانية لمكونات عمر المتبرع عبر مجموعة البيانات. وبالمثل، قد تشكل مجمعات التفاعل غير الرصينة مع المانحين أكثر أو أكثر قبولاً من الفلور. عادة ما يكون من الصعب تفسير تحلل الفلوريسنس لمثل هذه المجمعات. يمكن استخدام مخطط FLIM لتوفير معلومات هامة حول قياس الرصين ووضع الربط لـ PPIs20,23. مخطط FLIM هو تمثيل رسومي مكون أقصر عمر كدالة السعة الخاصة به. ويمكن استخدامه لتصور بكسل مع توقيعات تسوس مماثلة. لرسم مثل هذه التمثيلات، تحلل الفلورس التجريبية يجب أن تكون مزودة نموذجين الأسي. يمكن أن تكون الخطوات التالية دليلًا خلال هذه العملية. - ابدأ بتحليل بيانات الجهة المانحة فقط. وسوف تسمح بتحديد قيمة عمر المتبرع. ومن الناحية المثالية، قياس هذه القيمة على عدة صور المسجلة في نفس الظروف مثل المنشآت المانحة / قبول لاسترداد قيمة عمر قوية للمتبرع.
- مرة واحدة تحدد، تناسب تحلل fluorescence من المنشآت المانحة / قبل مع نموذج اثنين أسية. في مربع المعلمة اضمحلال السماوي (الشكل 6) ، تعيين عدد المكونات إلى 2. إصلاح المعلمة t2(ps) إلى قيمة عمر قوية من المانحة المحددة في الخطوة 1 وحدد المربع لإصلاح هذه المعلمة.
ملاحظة: من المهم إصلاح عمر طويل العمر τ2 من أجل الحد من الإفراط في المناسب، لتحسين التقارب المناسب، والحصول على أكثر موثوقية اثنين من المعايير تناسب أسي24،25،26. - حفظ ملف img * وتصدير البيانات كملفات *.asc كما هو الحال في الخطوة 7.1.11.
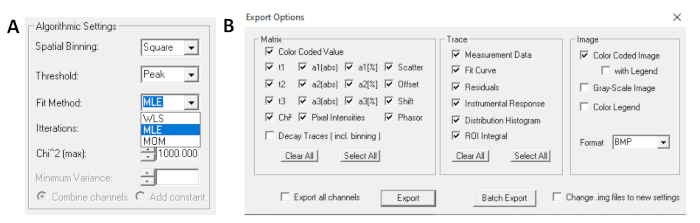
الشكل 7: (أ) إعدادات الخوارزمية لتركيب الاضمحلال مع نماذج أسية. تحديد MLE (خوارزمية الاحتمال الأقصى أو تقدير الاحتمال الأقصى، MLE) كنموذج مناسب، و (B) نافذة خيارات التصدير. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- تحليل متقدم لصور FLIM في R
- تثبيت R (https://cran.r-project.org) و RStudio (https://rstudio.com) إذا لزم الأمر.
- افتح RStudio ثم أنشئ مشروعًا جديدًا.
- نقل كافة ملف التحليل *.asc في مجلد يسمى "البيانات" في المجلد الرئيسي للمشروع.
- افتح ملف برنامج نصي جديد (أو افتح البرنامج النصي التكميلي FLIM_analysis. (ر).
- تثبيت حزمة flimDiagRam مخصصة لتحليل البيانات flim https://github.com/jgodet/flimDiagRam. استدعاء الحزمة في مساحة العمل. (راجع الإشعار HowTo_FlimDiagRam)
ملاحظة: تثبيت الحزم يجب أن يتم مرة واحدة فقط. بمجرد تركيبها، يمكن استدعاء الحزم من أي جلسة R جديدة. يتطلب تنزيل حزم R من github تثبيت حزمة "devtools". تركيب 'devtools' يمكن أن يستغرق عدة دقائق. يمكن استخدام الحزمة flimDiagRam لتمثيل المعلمات والتوزيعات للبيانات FLIM، لاستخراج بيانات FLIM على مستوى الخلايا الفردية الفردية، لمقارنة نتائج FLIM عبر الظروف أو السلالات واستكشاف بيانات FLIM باستخدام أدوات المرئية المتقدمة مثل رسم الرسم التخطيطي FLIM. - استخدم رمز التعليق خطوة بخطوة وتتاح البيانات بشكل مستقل لإعادة إنتاج جميع الأرقام الفرعية المعروضة في قسم نتائج التمثيل أدناه. يمكن العثور على هذا البرنامج التعليمي في HowTo_FlimDiagRam إشعار في https://github.com/jgodet/flimDiagRam/blob/master/HowTo.pdf. يمكن أن يكون رمز بسهولة نقلها لتحليل البيانات.
النتائج
تظهر وظائف التوزيع التراكمي التجريبي (ecdf) لمدى عمر الفلوريسنس مقاسة لسلالات بكتيرية مختلفة في الشكل 8. إذا حدث فريت، يتم تحويل ecdfs نحو حياة أقصر عمر (الشكل 8A, 8B). لاحظ أنه عندما ينتج عن تفاعل البروتينين مسافة طويلة بين الفلوروفوريس، لا يمكن أن يحدث فر...
Discussion
FLIM-FRET يقدم بعض المزايا الرئيسية على كثافة القائم على التصوير فريت. عمر الفلوريسنس هو معلمة جوهرية من الفلوروفور. ونتيجة لذلك، فإنه لا يعتمد على تركيزات محلية من الفلوروفهور لا على شدة الإثارة الخفيفة. بالإضافة إلى ذلك ، يتأثر عمر الفلوريسنس أيضًا بشكل سيئ بتبييض الصور. ومن المثير للاهتمام...
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
ونحن نعترف الدكتور لودوفيك ريتشرت لمساعدته القيمة على الحصول على البيانات FLIM وللصيانة التقنية وتطوير الإعداد FLIM. وقد تم تمويل هذا العمل من خلال منح من مؤسسة من أجل إعادة التشيرش (https://icfrc.fr/). يتم تمويل VN من قبل مؤسسة من أجل Recherche Médicale (FRM-SPF201809006906). تعرب جمعية الشبان المسيحية عن امتنانها لـ Institut Universitaire de France (IUF) لدعمه وتوفيره وقتًا إضافيًا للأبحاث. 41- ويعترف معهد الخدمات العامة وشركة جي جي بالمعهد المعني بتسليم المخدرات في ستراسبورغ لدعمه المالي.
Materials
| Name | Company | Catalog Number | Comments |
| 525/50 nm band-pass filter | F37-516, AHF, Germany | ||
| 680 nm short pass filter | F75-680, AHF, Germany | ||
| Agarose | Sigma-Aldrich | A9539 | |
| Ammonium Sulfate (NH4)2SO4 | Sigma-Aldrich | A4418 | |
| DreamTaq DNA polymerase 5U/μL | ThermoFisher Scientific | EP0714 | |
| E. coli TOP10 | Invitrogen | C404010 | |
| Fiber-coupled avalanche photo-diode | SPCM-AQR-14- FC, Perkin Elmer | ||
| Glass coverslips (Thickness No. 1.5, 20×20mm | Knitel glass | MS0011 | |
| High-Fidelity DNA polymerase Phusion 2U/μL | ThermoFisher Scientific | F530S | |
| Lysogeny broth (LB) | Millipore | 1.10285 | |
| Magnesium Sulfate Heptahydrate (MgSO4 . 7H2O) | Sigma-Aldrich | 10034-99-8 | |
| Microscope slides (25×75mm) | Knitel glass | MS0057 | |
| NucleoSpin Gel and PCR Clean-up | Macherey-Nagel | 740609.50 | |
| NucleoSpin Plasmid | Macherey-Nagel | 740588.10 | |
| Potassium Phosphate Dibasic (K2HPO4) | Sigma-Aldrich | RES20765 | |
| Potassium Phosphate Monobasic (KH2PO4) | Sigma-Aldrich | P5655 | |
| Sodium Succinate (Disodium) | Sigma-Aldrich | 14160 | |
| SPCImage, SPCM software | Becker & Hickl | ||
| Sterile inoculating loop | Nunc | 7648-1PAK | |
| T4 DNA ligase 1U/μL | ThermoFisher Scientific | 15224017 | |
| TCSPC module | SPC830, Becker & Hickl, Germany | ||
| Ti:Sapphire laser | Insight DeepSee, Spectra Physics | ||
| Tubes 50mL | Falcon | 352070 |
References
- Braun, P., Gingras, A. C. History of protein-protein interactions: From egg-white to complex networks. Proteomics. 12, 1478-1498 (2012).
- Nooren, I. M. A., Thornton, J. M. Structural characterisation and functional significance of transient protein-protein interactions. Journal of Molecular Biology. 325, 991-1018 (2003).
- Hayes, S., Malacrida, B., Kiely, M., Kiely, P. A. Studying protein-protein interactions: Progress, pitfalls and solutions. Biochemical Society Transactions. 44, 994-1004 (2016).
- Guillon, L., Altenburger, S., Graumann, P. L., Schalk, I. J. Deciphering protein dynamics of the siderophore pyoverdine pathway in Pseudomonas aeruginosa. PLoS ONE. 8, 1-9 (2013).
- Ringel, M. T., Brüser, T. The biosynthesis of pyoverdines. Microbial Cell. 5, 424-437 (2018).
- Schalk, I. J., Rigouin, C., Godet, J. An overview of siderophore biosynthesis among fluorescent Pseudomonads and new insights into their complex cellular organization. Environmental Microbiology. 22, 1447-1466 (2020).
- Cui, Y., et al. Techniques for detecting protein-protein interactions in living cells: principles, limitations, and recent progress. Science China Life Sciences. , (2019).
- Day, R. N., Mazumder, N., Sun, Y., Christopher, K. G. FRET microscopy: Basics, issues and advantages of FLIM-FRET imaging. Springer Series in Chemical Physics. 111, 249-276 (2015).
- Bastiaens, P. I. H., Squire, A. Fluorescence lifetime imaging microscopy: Spatial resolution of biochemical processes in the cell. Trends in Cell Biology. 9, 48-52 (1999).
- Yasuda, R. Imaging spatiotemporal dynamics of neuronal signaling using fluorescence resonance energy transfer and fluorescence lifetime imaging microscopy. Current Opinion in Neurobiology. 16, 551-561 (2006).
- Tramier, M., Zahid, M., Mevel, J. -. C., Masse, M. -. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry Pairs to Donor Photobleaching on FRET Determination by Fluorescence Lifetime Imaging Microscopy in Living Cells. Microscopy Research and Technique. 71, 146-157 (2008).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A guide to fluorescent protein FRET pairs. Sensors (Switzerland). 16, 1-24 (2016).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends in Biochemical Sciences. 32, 407-414 (2007).
- Leray, A., et al. Optimized protocol of a frequency domain fluorescence lifetime imaging microscope for fret measurements. Microscopy Research and Technique. 72, 371-379 (2009).
- Elson, D. S., et al. Real-time time-domain fluorescence lifetime imaging including single-shot acquisition with a segmented optical image intensifier. New Journal of Physics. 6, 1-13 (2004).
- Rajoria, S., Zhao, L., Intes, X., Barroso, M. FLIM-FRET for Cancer Applications. Current Molecular Imaging. 3, 144-161 (2014).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nature Methods. 8, 393-399 (2011).
- Visca, P., Ciervo, A., Orsi, N. Cloning and nucleotide sequence of the pvdA gene encoding the pyoverdin biosynthetic enzyme L-ornithine N5-oxygenase in Pseudomonas aeruginosa. Journal of Bacteriology. 176, 1128-1140 (1994).
- Imperi, F., Visca, P. Subcellular localization of the pyoverdine biogenesis machinery of Pseudomonas aeruginosa: A membrane-associated 'siderosome'. FEBS Letters. 587, 3387-3391 (2013).
- Gasser, V., et al. In cellulo FRET-FLIM and single molecule tracking reveal the supra-molecular organization of the pyoverdine bio-synthetic enzymes in Pseudomonas aeruginosa. Quarterly Reviews of Biophysics. , 1-11 (2019).
- Rietsch, A., Mekalanos, J. J. Metabolic regulation of type III secretion gene expression in Pseudomonas aeruginosa. Molecular Microbiology. 59, 807-820 (2006).
- Herrero, M., De Lorenzo, V., Timmis, K. N. Transposon vectors containing non-antibiotic resistance selection markers for cloning and stable chromosomal insertion of foreign genes in gram-negative bacteria. Journal of Bacteriology. 172, 6557-6567 (1990).
- Godet, J., Mély, Y. Exploring protein-protein interactions with large differences in protein expression levels using FLIM-FRET. Methods and Applications in Fluorescence. 8, 014007 (2019).
- El Meshri, S. E., et al. Role of the nucleocapsid domain in HIV-1 gag oligomerization and trafficking to the plasma membrane: A fluorescence lifetime imaging microscopy investigation. Journal of Molecular Biology. 427, 1480-1494 (2015).
- Becker, W. The bh TCSPC Handbook. Scanning. , 1 (2010).
- Richert, L., Didier, P., de Rocquigny, H., Mély, Y. Monitoring HIV-1 protein oligomerization by FLIM FRET microscopy. Springer Series in Chemical Physics. , 111 (2015).
- Fereidouni, F., Blab, G. A., Gerritsen, H. C. Phasor based analysis of FRET images recorded using spectrally resolved lifetime imaging. Methods and Applications in Fluorescence. 2, (2014).
- Fereidouni, F., Gorpas, D., Ma, D., Fatakdawala, H., Marcu, L. Rapid fluorescence lifetime estimation with modified phasor approach and Laguerre deconvolution: a comparative study. Methods and Applications in Fluorescence. 5, 035003 (2017).
- Margineanu, A., et al. Screening for protein-protein interactions using Förster resonance energy transfer (FRET) and fluorescence lifetime imaging microscopy (FLIM). Scientific Reports. 6, (2016).
- Guzmán, C., Oetken-Lindholm, C., Abankwa, D. Automated High-Throughput Fluorescence Lifetime Imaging Microscopy to Detect Protein-Protein Interactions. Journal of Laboratory Automation. 21, 238-245 (2016).
- Liu, W., Cui, Y., Ren, W., Irudayaraj, J. Epigenetic biomarker screening by FLIM-FRET for combination therapy in ER+ breast cancer. Clinical Epigenetics. 11, 1-9 (2019).
- Liu, X., et al. Fast fluorescence lifetime imaging techniques: A review on challenge and development. Journal of Innovative Optical Health Sciences. 12, 1-27 (2019).
- Padilla-Parra, S., Auduge, N., Coppey-Moisan, M., Tramier, M. Non fitting based FRET-FLIM analysis approaches applied to quantify protein-protein interactions in live cells. Biophysical Reviews. 3, 63-70 (2011).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95, 2976-2988 (2008).
- Stringari, C., et al. Phasor approach to fluorescence lifetime microscopy distinguishes different metabolic states of germ cells in a live tissue. Proceedings of the National Academy of Sciences of the United States of America. 108, 13582-13587 (2011).
- Digman, M. A., Caiolfa, V. R., Zamai, M., Gratton, E. The phasor approach to fluorescence lifetime imaging analysis. Biophysical Journal. 94, 14-16 (2008).
- Liang, Z., Lou, J., Scipioni, L., Gratton, E., Hinde, E. Quantifying nuclear wide chromatin compaction by phasor analysis of histone Förster resonance energy transfer (FRET) in frequency domain fluorescence lifetime imaging microscopy (FLIM) data. Data in Brief. 30, 105401 (2020).
- Grimm, J. B., Heckman, L. M., Lavis, L. D. The chemistry of small-molecule fluorogenic probes. Progress in Molecular Biology and Translational Science. 113, (2013).
- Li, L., Sun, H. Next Generation of Small-Molecule Fluorogenic Probes for Bioimaging. Biochemistry. 59, 216-217 (2020).
- Yao, R., Ochoa, M., Yan, P., Intes, X. Net-FLICS: fast quantitative wide-field fluorescence lifetime imaging with compressed sensing - deep learning approach. Light: Science and Applications. 8, 1-7 (2019).
- Smith, J. T., et al. Fast fit-free analysis of fluorescence lifetime imaging via deep learning. Proceedings of the National Academy of Sciences of the United States of America. 116, 24019-24030 (2019).
- Yao, R., Ochoa, M., Intes, X., Yan, P. Deep compressive macroscopic fluorescence lifetime imaging. Proceedings - International Symposium on Biomedical Imaging. 2018, 908-911 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved