Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Canlı Bakterilerde Protein-Protein Etkileşimlerinin FLIM-FRET Ölçümleri.
Bu Makalede
Özet
Burada FLIM-FRET ölçümleri kullanılarak canlı Pseudomonas aeruginosa'da çok farklı ifade edilmiş iki protein arasındaki protein-protein etkileşimlerini karakterize eden bir protokol uyguluyoruz. Protokol, bakteri gerinim konstrüksiyonları, bakteri immobilizasyonu, görüntüleme ve görüntüleme sonrası veri analizi rutinlerini içermektedir.
Özet
Protein-protein etkileşimleri (PPI) hücrelerdeki çeşitli önemli süreçleri kontrol eder. Förster rezonans enerji transferi (FRET) ile birlikte floresan yaşam boyu görüntüleme mikroskobu (FLIM) canlı hücrelerde PPI'lar hakkında doğru bilgi sağlar. FLIM-FRET, FLIM görüntüsünün her pikselinde bir FRET donörünün floresan ömür boyu çürümesini ölçmeye ve PPI'lar ve bunların uzamsal hücresel organizasyonları hakkında nicel ve doğru bilgi sağlamaya dayanır. Burada, PPI'lerin kritik özelliklerini ortaya çıkarırken tekniğin kalitesini ve sağlamlığını göstermek için son derece farklı kopya numaralarıyla ifade edilen iki etkileşim proteinin in canlı Pseudomonas aeruginosa'da PPI'ları izlemek için uyguladığımız FLIM-FRET ölçümleri için ayrıntılı bir protokol öneriyoruz. Bu protokol, ÜFE karakterizasyonu için gerekli tüm adımları ayrıntılı olarak açıklar - karmaşık FLIM-FRET verilerinin basit bir yorumu için gelişmiş görselleştirme olanakları sağlayan son geliştirilen araçları kullanarak son analize kadar bakteriyel mutant yapılardan başlayarak.
Giriş
Protein-protein etkileşimleri (PPI) hücrelerde çeşitli anahtar süreçleri kontrol1. PPI rolleri protein bileşimi, yakınlık fonksiyonları vehücrelerdekonumları 2 dayalı farklıdır. PPI'lar farklı teknikler ile araştırılabilir3. Örneğin, co-immünopresid, ppis tanımlamak veya onaylamak için yaygın olarak kullanılan nispeten basit, sağlam ve ucuz bir tekniktir. Ancak, etkileşimhalinde olan proteinlerin ifade düzeyleri düşük olduğunda veya etkileşimler geçici veya yalnızca belirli ortamlarda ilgili olduğunda PPI'ların incelenmesi zor olabilir. P. aeruginosa pyoverdine yolunun farklı enzimler arasında meydana gelen PPIs incelenmesi genel demir ko-faktörlü baskı fur baskı hücre4ifade edilecek pyoverdine yolunun tüm proteinlerin ifade sağlamak için rahatlamış olduğunu gerektirir4 ,5,6. Yolun tüm proteinleri için bu ortak düzenleme hücrede zamanında ifadeler onların etkileşimlerini teşvik etmesi bekleniyor sonuçları. Boyut, doğa, ifade düzeyleri ve bu metabolik yolun protein sayısı açısından çeşitlilik, yeniden yapılı sistemlerde çalışmayı zorlaştırır6. Bu nedenle hücresel ortamlarında PPI'ları keşfetmek, proteinlerin biyolojik işlevlerini kendi yerel bağlamlarında daha iyi anlamak için çok önemlidir.
Floresan dahil olmak üzere sadece birkaç yöntem canlı hücrelerde PPI keşfetmek sağlar7. Ölçülebilen farklı floresan parametreleri arasında, floresan ömrü (yani, bir florofor bir foton yaymadan önce heyecanlı durumda kalır ortalama süre) muhtemelen canlı hücrelerde keşfetmek için en ilginç parametrelerden biridir. Bir florofor floresan ömrü çevresine son derece duyarlıdır ve FLIM bu nedenle florofor çevresi ile ilgili kimyasal veya fiziksel bilgi sağlayabilir8. Bu förster rezonans enerji transferi varlığı içerir (FRET) bir floresan kısa bir mesafede bulunan floresan bir "kabul" varlığında oluşabilir "donör". Enerji transferi, donör floresan süresinin(Şekil 1A)önemli ölçüde kısalmasıyla sonuçlanır ve floresan Yaşam Boyu Görüntüleme Mikroskobu'nu (FLIM) canlı hücrelerdeki protein-protein etkileşimlerini doğrudan araştırmak için güçlü bir yaklaşım haline getirir. FLIM ayrıca etkileşimlerin7,8hücrelerinde nerede gerçekleştiği hakkında uzamsal bilgi sağlayabilir. Bu yaklaşım, etkileşen iki ortağın floroforlarıyla etiketlemenin mümkün olduğu durumlarda PPI'ları araştırmak için son derece güçlüdür.
FRET gerçekleşmesi için - iki floroforlar arasındaki mesafe kritik koşullar8gereklidir ,9. İki florofor 10 nm'den fazla birbirlerinden uzak olmamalıdır. Bu nedenle, flim-FRET deneyleri tasarlarken, vericinin ve floresan kabul edenin etkileşim kompleksinde birbirine yakın bir konuma sahip olmasını sağlamak için dikkatli olunmalıdır. Bu kısıtlayıcı gibi görünse de, FRET'in uzaklık bağımlılığı, FRET geçiren iki etiketli proteinin fiziksel olarak etkileşime girmesini sağladığından gerçek bir avantajdır(Şekil 1A). Kolocalizasyon deneylerinde ÜFE hakkında net cevaplar almadaki güçlükler (iki kolokalize protein mutlaka etkileşime girmeyebilir) bu nedenle FLIM-FRET kullanılarak bir sorun değildir.
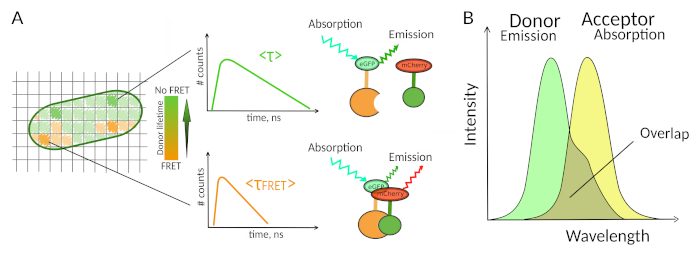
Şekil 1: FLIM-FRET analiz prensibi. FLIM-FRET çok boyutlu görüntünün her pikseli, bu belirli konumda kaydedilen floresan bozunma hakkında bilgi içerir (#counts = t kanalında algılanan fotonların sayısı). (A) FLIM görüntünün klasik gösterimi genellikle sahte renkli bir yaşam boyu kodlanmış 2B görüntüdür (solda). Donörün ortalama floresan ömründe bir azalma - renk skalasında ki bir değişiklikten de görüldüğü gibi - FRET'nin varlığında görülebilir ve bu mekansal alanda PPI varlığı hakkında bilgilendiricidir. (B) FRET'in oluşabilmesi için donör emisyon spektrumu ile kabul eden emilim spektrumu arasında çakışma gereklidir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
FRET için ikinci bir gereklilik donörün emisyon spektrumu ve kabul edenin emilim spektrumunun8 ile çakışmasıdır (Şekil 1B). Donörün floresan uyarma kabul edenin doğrudan floresan uyarma çok az katkıda dalga boylarında olmalıdır. Tüm florofor kombinasyonları mümkün değildir ve ayrıca FLIM-FRET yorumlarını kolaylaştırmak için monokonsenyel floresan bozunan donörleri tercihen kullanmanızı tavsiye ediyoruz10. Floresan proteinlerin birkaç çift popüler eGFP-mCherry çift11 de dahil olmak üzere bu gereksinimleri karşılamak (mevcut floresan protein FRET çiftleri paletüzerinde bir inceleme içinbkz 12,13).
FLIM-FRET, Bir FLIM görüntüsünün her pikselinde bir FRET donörünün floresan ömür boyu çürümesini ölçmeye olanak sağlar (Şekil 1A). Floresan yaşam süresini belirlemek için, kazanım ve analizde farklılık gösteren iki temel teknik vardır: frekans-etki alanı (FD)14 ve zaman-etki alanı (TD). TD FLIM daha yaygındır ve gating yöntemleri 15 dahil olmak üzere farklı olası algılama yapılandırmaları ile birlikte darbeli bir aydınlatma kullanılarak gerçekleştirilir15, çizgi kamera16 veya zaman korelasyon tek foton sayma (TCSPC) teknikleri8. Hem FD hem de TD teknikleri için floresan ömrü doğrudan ölçülmez, ancak yaşam sürelerini veya etkileşimlerin varlığını tahmin etmek için ölçülen verilerin analizini gerektirir. TCSPC teknikleri için, en yaygın olarak kullanılan analiz, artıkların ağırlıklı toplamını en aza indiren en az kare yinelemeli yeniden kıvrımlar kullanarak bozunmaların tek veya çok üstel fonksiyonlarla donatılmasına dayanır.
Son olarak, FLIM-FRET hem tek foton hem de multifoton uyarma kullanılarak gerçekleştirilebilir. En son odak düzleminin dışında otomatik floresan ve fotohasarı azaltmak gibi çeşitli avantajları vardır. Kalın 3Dnumunelerde8 çalışıyorsa multifoton uyarmalar da daha uzun bir uyarma derinliği sağlar. Aksine, floresan proteinlerin iki foton emilimi kesitleri sınırlı olarak tek foton uyarma genellikle daha verimli17.
Burada, ppis kritik özelliklerini ortaya çıkarmada tekniğin kalitesini ve sağlamlığını göstermek için kopyaların çok farklı sayıda ifade iki etkileşim protein (PvdA ve PvdL) belirli bir durumda canlı P. aeruginosa PPIs FLIM-FRET ölçümleri için bir protokol öneriyoruz. PvdA ve PvdL proteinleri pyoverdine biyosentezinde rol oynarlar. PvdA bir L-ornitin N5-oxygenaz ve hidroksilasyon (PvdA) ve formilasyon (PvdF) tarafından L-ornithine L-N5-formyl-N5-hidroksiincenin sentezler18. PvdL, dört modülden oluşan ribozomal olmayan bir peptit sentezi (NRPS) enzimidir. İlk modül mistik asit inyaklasını katalizler. İkinci modül, L-Glu'nun aktivasyonunu ve yoğunlaşmasını mistik-coA'ya katalizler. Daha sonra, üçüncü modül daha sonra D-Tyr izomerize bir L-Tyr amino asit yoğunlaştırır. Son olarak, dördüncü modül bir L-Dab (Diaminobutyric asit) amino asit bağlar acylated tripeptid L-Glu/D-Tyr/L-Dab6oluşturmak için . PvdL böylece pyoverdine öncülüüç ilk amino asitlerin sentezinden sorumludur. PvdL ile PvdA protein etkileşimi şaşırtıcı, PvdL aksine, L-N5-formyl-N5-hidroksyorltin için özel bir modül taşımaz. Bu etkileşim, piradenin öncüsentezinden sorumlu tüm enzimlerin büyük geçici ve dinamik çok enzimli komplekslerde düzenlendiğini göstermektedir19,20.
Bu raporda, etkileşen iki eGFP ve mCherry etiketli proteinleri doğal olarak ifade eden bakteri suşlarının nasıl inşa edilebildiğini ayrıntılı olarak açıklıyoruz. Ayrıca, etkili FLIM-FRET hücre görüntülemesi için numune hazırlama ve koşulları da açıklıyoruz. Son olarak, karmaşık FLIM-FRET verilerinin basit yorumu için gelişmiş görselleştirme olanakları sağlayan yeni geliştirilen bir araç da dahil olmak üzere görüntü analizi için adım adım öğretici öneriyoruz. Bu raporla, sadece maceracı değil, çoğu biyologu FRET-FLIM'in yerel hücresel ortamda ppis'lerle ilgili sorularını doğrudan ele alabilecek erişilebilir ve güçlü bir teknik olduğuna ikna etmek istiyoruz.
Protokol
1. Plazmid yapımı
- P. aeruginosa genomuna karşılık gelen bölgelerin 700 baz çiftinin iki PCR (PCR1 ve 3) DNA dizilerini (P. aeruginosa PAO1 genomik DNA'sını kullanın) yükseltin. Mavi ve yeşil astarlara kısıtlama siteleri ekleyin ve kırmızı daki astarlara mCherry ile örtüşen bir sıra ekleyin(Şekil 2).
- EGFP ile C-terminus etiketli PvdA için, mavi astarlar tarafından stop codon göre 700 bp bölge upstream yükseltmek, ve yeşil astarile stop codon içeren 700 bp downstream bölge yükseltmek.
- MCherry ile N-terminus etiketli PvdL için, 700 bp bölge yukarı PvdL geni, başlangıç kodonu da dahil olmak üzere, mavi astarlar tarafından yükseltmek ve yeşil astarile 700 bp downstream bölge yükseltmek.
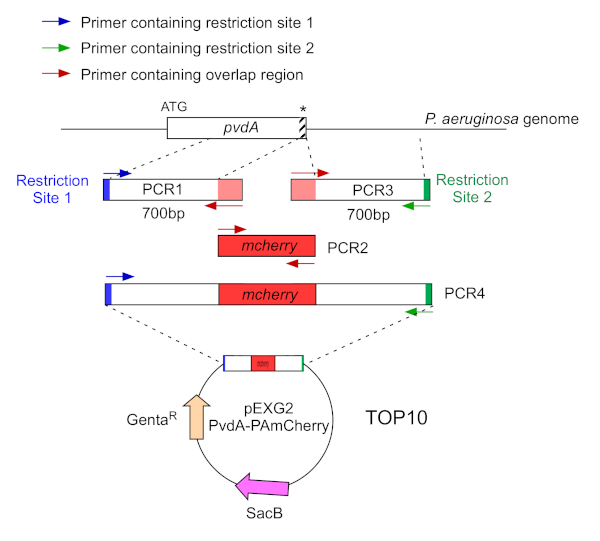
Şekil 2: PvdA-mCherry'nin yapımında kullanılan PCR stratejisi ve plazmid yapımına genel bakış. Ayrıntılar için metin e-bakınız - pvdA siderophore pirositin biyosentezinde yer alan bir enzim kodlar, demir edinimi dahil ikincil bir metabolit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- EGFP kodlama DNA'sını (başlangıç ve durdurma kodonu olmadan) Yüksek SadakatLI DNA polimeraz ile kırmızı astarlarla yükseltin.
- PCR temizleme sütunundaki PCR ürünlerini arındırın(Malzeme Tablosu).
- Çakışan PCR ürünlerini equimolar oranda karıştırın ve PCR 1 ve 3 için kullanılan kısıtlama alanı ile ikinci bir PCR gerçekleştirin (Şekil 2'deyeşil ve mavi).
- AGAROSE-1x TAE (Tris-Base Asetat EDTA pH 8.0) jel PCR ürün geçirin, ilgili bant kesmek ve bir PCR temizleme kiti ile amplicon ayıklayın(Malzeme Tablosu).
NOT: Protokol burada duraklatılabilir. - İlgili restriksiyon enzimleri kullanılarak PCR amplicon ve pEXG2 plazmidsi sindirin21.
- 90 ng plazmid ve moleküler oran 1:1 (plazmid:insert) kullanarak T4 DNA ligaz ile ligate plazmid ve insert.
- Ligasyon ürününün ve 100 μL TOP10'un karıştırılarak kimyasal olarak yetkin hücrelerde plazmid yapımını dönüştürün. 60 s için 42 °C ısı şoku ile devam etmeden önce 30 dakika boyunca buz üzerinde yetkili bakteri / plazmid karışımı kuluçka. Sonra, 10 dakika buz üzerine tüp koyun.
- Bakterilere 1 mL lysogeny suyu (LB) ekleyin ve 37 °C'de 1 saat kuluçkaya yatırın.
- 15 μg/mL gentamisin içeren LB agar üzerinde plaka 100 μL bakteri.
- Bir gecede 37 °C'de kuluçkaya yatırın.
- Koloni PCR ile kesici uç varlığını ekran: bir izole transformant koloniden, bir agarose jel (DNA polimeraz) üzerinde ürün çalıştırılarak amfinkin varlığı tespit edilebilir şekilde plazmid üzerinde melezleme astar içeren bir PCR karışımı eklenecek bakteri bir dakika miktarda almak. PCR için kullanılan aynı koloniden, izole ve plazmid ekstraksiyon için kullanılan 15 g/mL gentamicin içeren taze bir plaka üzerinde bakteri küçük bir miktar transfer. Son olarak, plazmidi izole edin ve arındırın(Malzeme Tablosu)ve eklemeyi sıralama ile doğrulayın.
- -80 °C'de 1,5 mL mikrotüpte %20 gliserol ve 1,5 mL tüpte -20 °C'de saflaştırılmış plazmid ile LB'de plazmid içeren TOP10 bakterisini saklayın.
NOT: Protokol burada duraklatılmış olabilir
2. P. aeruginosa kromozom genomuna floresan etiket takılması (Şekil 3)
- Büyümek P. aeruginosa, TOP10 ve E. coli yardımcı bakteri, her biri 5 mL LB antibiyotik olmadan 30 °C orbital sallayarak altında gece22. Plazmidi E. coli TOP10'dan PAO1 gerilimine aktararak ve plazmidi homolog rekombinasyon ile genoma entegre ederek P. aeruginosa genomuna floresan etiket ekleme üretin. Vektörü çıkaran ikinci bir geçiş olayı ilgili mutantı oluşturur.
- Bakteri kültürünün 600 nm (OD600 nm)optik yoğunluğunu ölçün ve eşit miktarda P'yi karıştırın. aeruginosa (500 μL, OD600 nm = 1.0) E. coli TOP10 pEXG2 (500 μL, OD600 nm = 1.0) ve E. coli HB101 pRK600 yardımcı (500 μL, OD600 nm = 1.0) 1,5 mL mikrotüp.
- 9.300 x g de santrifüj 5 dk bakteri pelet.
NOT: Çevrimiçi araçlar, santrifüj hızını ayarlamak için santrifüj g-kuvvetini dakikada döndürmeye (rpm) dönüştürmek için kullanılabilir. - Bakteriyel pelet tutun ve supernatant atın.
- 50 μL LB bakteri içeren peleti yeniden askıya alın.
- LB agar'ın ortasında karışımın bir noktasını (~50 μL) plakalayın (37 °C'de ön ısıtma) ve 37 °C'de 5 saat kuluçkaya yatırın.
- Steril bir aşılama döngüsü ile noktayı hurdaya ve 1 mL LB'de yeniden askıya alın.
- E. coli (E. coli TOP10 pEXG2 ve E. coli HB101 pRK600 yardımcı) ortadan kaldırmak için 10 μg/mL kloramfenikol içeren LB agar üzerinde bu bakteriyel süspansiyon plaka 100 μL kloramfenikol ama P. aeruginosa doğal dirençlidir) ve 37 Ccuba 20 g/mL gentamisin.
- 1 mL LB'de bir koloniyi yeniden askıya alın ve 37 °C'de orbital sallayarak 4h altında kuluçkaya yatırın.
- Santrifüj 3 dk 9,300 x g ve supernatant 950 μL atın. 50 μL LB pelet resuspend ve sakaroz içeren LB agar üzerinde karışımı izole ve NaCl olmadan.
- Bir gecede 30 °C'de kuluçkaya yatırın.
- 15 mg/mL gentamisin içeren LB agar ve LB agar üzerinde spot izole koloniler gentamisin duyarlılığını kontrol etmek için.
- PcR kolonileri (DNA polimeraz) ve belirli astarlar kullanarak sıralama tarafından eGFP veya mCherry ekleme doğrulayın.
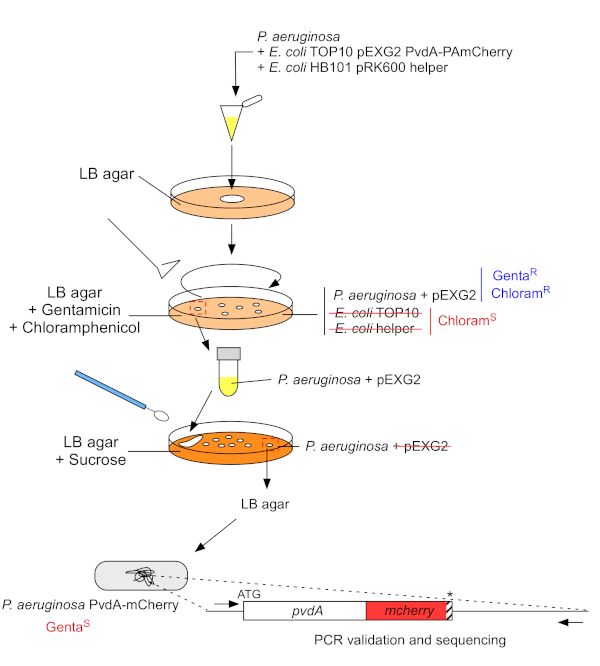
Şekil 3: Floresan etiket takılması ile P. aeruginosa suşlarının yapım protokolü. Ayrıntılar için metne bakın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
3. Pyoverdine ölçümü
- Bir gecede orbital sallayarak altında 30 °C'de LB 5 mL bakteri büyümek.
- Pelet bakterileri santrifüj ile yıkayın ve 5 mL SM 'de yetiştirin (Succinate Medium, bileşimi: 6 g−L−1 K2HPO4, 3 g−L−1 KH2PO4, 1 g−L−1 (NH4)2 SO4, 0.2 g¡L−1 MgSO4, 7 H2O ve 4 g−L−1 sodyum süksinat pH ile 7.0'a ayarlı) 30 °C orbital sallayarak bir gecede sallayarak. SM demir yoksun bir orta - demir yokluğu normalde demir varlığında bastırılmış pyoverdine yolunun proteinlerin ekspresyonu aktive edecektir.
- OD600 nm ölçün ve od600 nm = 0.1 taze SM ortamda tekrar seyreltin ve bir gecede orbital sallayarak altında 30 °C'de yetiştirin.
- Her numunedeki bakteri miktarını belirlemek için OD600 nm ölçün.
- 100 μL P. aeruginosa kültürü içeren ve 1 mL'ye (900 μL) kadar tamamlanmış bir kuvars cuvette hazırlayın. 1 mL SM orta (boş) içeren bir kuvars cuvette hazırlayın.
- UV görünür bir spektrofotometre kullanarak, emme pik maksimum emici ölçer. pH 7.0'da pyoverdine emiliminin maksimum uyğun sayısı ~400 nm'de gerçekleşir. 400 nm e = 19 000 M-100M -1 000 M-cm -1molar yok olma katsayısı kullanarak Bira-Lambert yasasını kullanarak numunedeki pioverdine (apo formu) konsantrasyonu belirleyin.
NOT: Pyoverdine absorbans aralığında ~0.1 ile ~1 arasında (UV-Görünür spektrofotometreye bağlı olarak) arasında ölçülebilir ve emicilik konsantrasyonla birlikte doğrusal olarak artar.
4. Bakteri kültürü ve hücrelerin PvdA, PvdL ve PvdJ ifade koşulları
- 1. gün, uygun gliserol bakteri stoğundan 5 mL LB içeren bir tüpü aşılamak ve bir orbital shaker inkübatörde 200 rpm'de 30 °C'de gece boyunca bakteri yetiştirin.
- 2. günde, 3 dk için 3000 x g santrifüj ile pelet hücreleri ve supernatant atın.
- SM'nin 10 mL'lik hücrelerini yeniden askıya alın.
- Adımları 4.2-4.3'ün bir kez tekrarlayın ve bir gecede SM'de 30 °C 200 rpm'de bakteri yetiştirin.
- 3. günde, taze SM bakteri kültürünü 1/10 seyreltin.
- Aynı koşullarda tekrar bir gecede seyreltilmiş bakteri büyümek.
NOT: Pyoverdine varlığı sarı-yeşil büyüyen medya renkleri olarak görsel olarak tespit edilebilir. Bu pioverdine yolu proteinlerin ekspresyonu aktive edilmiş ve ilgi enzimleri hücrelerde ifade edilmektedir gösterir.
5. Agarose ped hazırlanması (Şekil 4)
- Düz yatay bir yüzeye bir mikroskop cam slayt yerleştirin. İlk slaydın her iki tarafında iki kat yapışkan bantla süslenmiş iki cam slayt düzenleyin.
NOT: Üç hizalanmış slayt arasında 1-2 mm boşluk takla tarak, meletli agarose'un sonunda yapışkan bantla slaytlara yayılmasını önleyin. - Pipet ve cam slayt üzerinde% 1 erimiş agarose 70 μL bir damlacık dökün. Agarose damlacık düzleştirmek için üstüne dördüncü bir slayt ekleyin ve yavaşça aşağı basın. Bir dakika kadar bekle.
- Üst kaydırağı çıkarın ve agarose ped üzerine farklı yerlerde 3-4 noktalar içine bakteri yaklaşık 3 μL bir pipet ile bırakın.
- Bir mikroskopi cam kapak lı kapak (örneğin 22x22 mm #1,5 kalınlığında) ile kaplayın.
NOT: Kapak kapaklarının düzlüğü ve kalınlığı iki foton uyarma ile çalışmak için önemlidir. Kontrollü düzgün düzlük ve düşük otofloresans ile Hassas coverlips genellikle iyi bir seçimdir. - Coverslip'i erimiş parafinle düzelterek kapağı cam kaydıranın üzerine kapatın. Kapak kaymasının dört köşesini sabitleyerek başlayın.
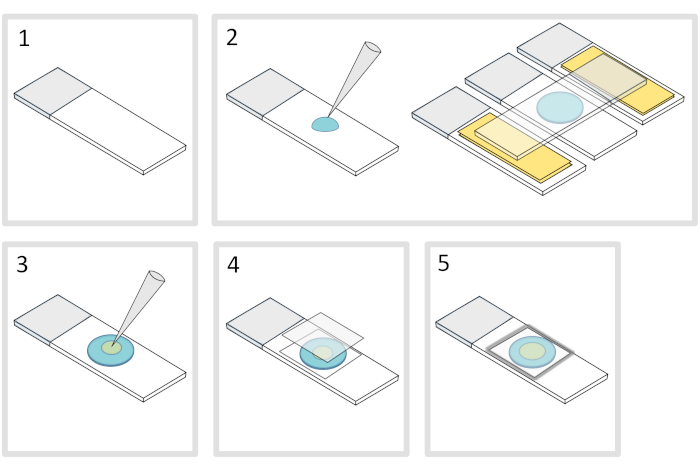
Şekil 4: Agarose ped hazırlama. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
6. İki fotonlu mikroskopi kurulumu ile görüntüleme
NOT: 60x 1.2NA su daldırma amacı ile ters mikroskop tarama ile ev yapımı iki foton uyarma kullanıyoruz de-taranmış floresan toplama modunda faaliyet. İki foton uyarma dalga boyu 930 nm olarak ayarlanır. 10-20 mW çalışan bir Ti:Safir lazer (80 MHz tekrarlama hızı, ≈ 70 fs darbe genişliği) ile sağlanmaktadır. Floresan fotonlar 680 nm kısa geçiş filtresi ve 525/50 nm bant geçiş filtresi ile toplanarak zaman ilişkili tek foton sayma (TCSPC) modülüne bağlı fiber bir çığ foto-diyotuna yönlendirildi. Mikroskop aynı zamanda bir şanzıman floresan lamba ile donatılmıştır. Çeşitli FLIM-FRET mikroskopları artık ticari olarak mevcuttur ve birçok görüntüleme tesisi FLIM-FRET ölçümlerini gerçekleştirebilen kurulumlarla donatılmıştır.
- Floresan lambayı kullanarak, hedefi numunedeki ve belirli ilgi bölgelerindeki bakterilerin monokatmanına odaklayın.
- Uyarma lazer deklanşörükapalı olup olmadığını ve lazerden gelen kızılötesi ışığın tıkanıp mikroskoba girmediğini kontrol edin.
Dikkat: Lazer ışığı gözlerden görülemediğinden, IR darbeli lazerlerle çalışırken dikkatli olunmalı, ancak herhangi bir ve hatta geçici doğrudan sergi veya lazer yansıması son derece zararlı olabilir ve geri dönüşü olmayan göz hasarları oluşturabilir. Mikroskopi kurulumlarını kullanmadan önce lütfen yerel lazer güvenlik prosedürlerine ve eğitimine bakın. - Mikroskopi slaytını hedefe bakan kapaklar ile sahneye yerleştirin.
- Floresan lambanın AÇI OLUP OLMADıĞıNı kontrol edin.
- eGFP küpünü seçmek ve floresan lamba deklanşörünü açmak için filtre küptürün.
- Floresan ışığını mikroskobun merceğine doğru gönderin.
Dikkat: Göz lerden zarar verebilecek floresan lambadan gelen doğrudan uyarma ışığını atmak için uygun filtrelerin ışık yoluna atıldığından emin olun. - Mikroskop tonlarını kullanarak bakterilerin amacını odakla.
- Motorlu sahneyi kontrol eden joystick'i kullanarak çevirerek numunenin ilgi çekici bir bölgesini seçin
NOT: Floresan'ın doğrudan gözlerle görülmesini sağlayan yüksek floresan numune ile odaklama daha kolaydır. - FLIM-FRET ölçümleri için 2PE lazer için uyarma geçiş.
- Floresan emisyon yolunu dedektöre geri gönderin.
- 930 nm lazer için dikroik küp için seçmek için filtre küptürün geri dönün.
- Lazer gücünü 20 mW'a ayarlayın.
- İlgi alanının boyutunu 30 μm olarak ayarlayın. Bu işlem galvo-aynaları çalıştıran gerilimi ayarlar ve hareketlerinin aralığını tanımlar(Şekil 5).
- Dedektörü açın ve numuneyi taramaya başlayın - taramayı kontrol eden start ve stop düğmeleri aynı zamanda lazer deklanşörünün hem güvenlik nedenleriyle açılmasını hem de kapanmasını hem de numunenin fotobeyazmasını sınırlamayı kontrol eder(Şekil 5).
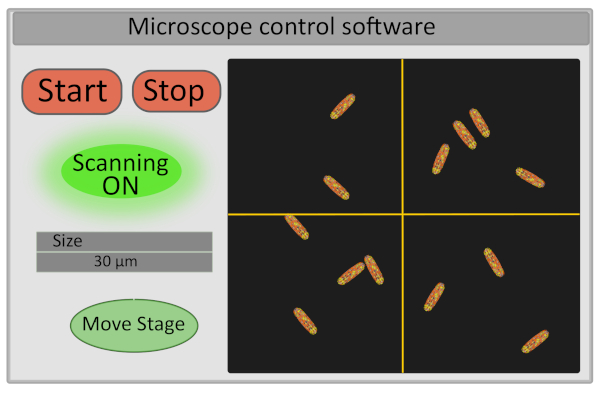
Şekil 5: Mikroskop kontrol yazılımı arabiriminin şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Gerekirse, mikroskop ince odak lama düğmesini hafifçe hareket ettirerek odağı ayarlayın.
- Bilgisayarın arabiriminden sahneyi ince hareket ettirerek görüntüleme için görüş alanını seçin. Bu, görüntünün yeni merkezini tanımlayacak mikroskop kontrol yazılımında(Şekil 5)görüntü üzerindeki çapraz hareket ettirilerek ve Move Stagetuşuna basarak kurulumda yapılabilir. Edinim için iyi bir görüş alanı 10-30 hareketsiz bakteri, tüm doğru odaklanmış (tüm bakteriler aynı düzlemde) ile bir görüntü karşılık gelir. Tek hücre FLIM-FRET veri ayıklama ilgileniyorsanız, bakterilerin iyi bireyselleştirilmiş olduğundan emin olun (görüntü segmentasyonu çok daha kolay olacaktır).
- SPCM yazılımını (veri toplama için ticari yazılım) açın ve fotonların sayım oranının ömür boyu ölçümleri etkileyebilecek yığılma etkisini önlemek için çok yüksek olmadığını kontrol edin. Gerekirse, foton sayımı oranını düşük tutmak için lazer yoğunluğunu düşürün (lazer tekrarlama oranının yaklaşık %1'i).
NOT: Pile-Up etkisi, Zaman Korelasyonlu Tek Foton Sayımı (TCSPC) cihazlarının ölü zamanı nedeniyle yüksek foton sayımı oranlarında kaybolan fotonların etkilerini açıklar. Yığın-Up oluşursa, ölçülen ortalama ömür yapay olarak kısa olur muhtemelen hızlı yayan fotonların aşırı örnekleme nedeniyle çürüme görünebilir ek bir kısa bileşeni ile. - Edinme toplama süresi de dahil olmak üzere edinme parametrelerini ayarlayın (genellikle yeterli foton toplamak için 60 s ila 180 s gerekir).
- Başlat düğmesine basın ve satın almanın tamamlanmasını bekleyin.
- Verileri kaydedin.
- Örneği aramayı bırakın ve dedektörü kapatın.
- Örnekteki başka bir görünüm alanı seçin ve 6.14-6.22 adımlarını tekrarlayın veya 6.1-6.22 adımlarını yineleyerek yeni bir mikroskopi slaytı görüntüleyin.
NOT: P. aeruginosa agarose ped üzerinde oda sıcaklığında 6-8 saate kadar yaşayabilir ve bölebilir (20°C'de sonunda ~4 katlama süresine karşılık gelen). İdeal olarak, tamamen bakteri ile kaplı bir ped gözlemlemekten kaçınmak için FLIM-FRET ölçümü gerçekleştirmek için çok uzun süre beklemeyin.
7. Veri analizi
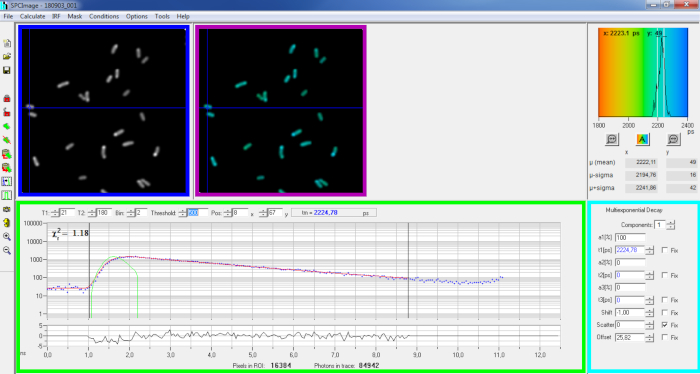
Şekil 6: SPCImage yazılımının veri analizi penceresinin ana paneli. Yoğunluk görüntü (mavi kutu), ömür boyu görüntü (mor kutu), ömür boyu histogram (sağ üst), seçilen pozisyonda çürüme eğrisi (yeşil kutu), ve bir temsilci PvdA-eGFP çürüme seçilen konumda çürüme parametreleri (siyanm kutusu) canlı P. aeruginosa bir bh SPC830 satın alma kartı kullanarak kaydedilmiş iki-Foton Excitation-FLIM-FRET kurulum. Yukarıdaki görüntüde işaret pikselin deneysel bozunma eğrisi, onun mono-üstel uyum (kırmızı eğri) hesaplanan enstrümantal tepki fonksiyonu (yeşil eğri) çürüme deconvoluting yeşil panelde görülebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Temel analiz
- SPCImage yazılımını çalıştırın.
- Kaydedilen SPCM dosyasını içe aktarın. Yoğunluk görüntüsü yazılımın sol üst panelinde görüntülenir(Şekil 6 mavi kutu).
- Yoğunluk görüntüsünde seçilen piksele karşılık gelen bozunma verilerini görüntüleyen bozunma eğrisi penceresini(Şekil 6 yeşil kutu) inceleyin(Şekil 6 mavi kutu). Her zaman kanalın foton numaraları mavi nokta olarak gösterilir ve çürümenin sığlığı kırmızı bir çizgi olarak çizilir. Verileri yükledikten sonra yazılımın görüntünün en parlak pikselini görüntülediğini unutmayın. Daha düşük yoğunluktaki pikselleri incelemek için mavi çaprazı görüntü üzerinde hareket ettirin. Bozunma penceresi her yeni piksel konumunda otomatik olarak yenilenir.
NOT: Lazer tarama sisteminin Enstrümental Yanıt Fonksiyonunun (IRF) ölçülmesi çok zordur. FLIM verilerindeki floresan bozunma eğrilerinin yükselen kenarından hesaplanan bir IRF, çürüme dekonvolution için kullanılabilir. Bu, SPCimage'de varsayılan olarak yapılan seçenektir(Şekil 6 yeşil eğri). - Montaj kutusunun başlangıç ve bitiş kanallarını (yeşil kutudaki T1 ve T2) hareket ettirerek montaj aralığını ayarlayın. T1 yükselen çürüme nin ilk birkaç kanaldan başlamalıdır ve T2 çürümenin sonundaki son kanalı tanımlamalıdır ve fotonların üzerinde bir dizi foton içeren çürümenin son kanallarından biri olarak seçilebilir (yani, çürüme yükselmeden önce sayılan fotonların seviyeleri).
- Bin değerini değiştirerek binning'i seçin. Eğri bozunması, seçili pikselin foton sayımını, imleç parametresi tarafından tanımlanan imleç pozisyonunun etrafındaki i pikselalanıyla birlikte bütünleştirir (binning'in artırılması bozunmadaki foton sayısını artırır ve çok üstel modeller için gerekli foton sayılarına ulaşmak için yararlı olabilir).
- Eşik değerini ayarlayın. Eşik değerinden daha yüksek foton sayısına sahip en az bir kanalı olmayan pikseller montaj prosedürüne dahil edilmez. Tabii ki sığacak piksel sayısı arttı, analiz uzadı.
NOT: FLIM verileri çok sayıda piksel ve zaman kanalı içerebilir. Yazılımın son sürümleri, gpu (Grafik İşlemci Birimi) kullanarak paralel olarak çok sayıda piksel işlemek için izin verir, hangi büyük işlem sürelerini azaltır. En düşük floresan yoğunluğunu sergileyen bakteri yapılarına karşılık gelen görüntüleri kullanarak binning ve eşik parametrelerini ayarlamak ilginç olabilir (örn. en düşük ifade seviyelerine sahip bakteriyel suşlarla). Bu, bu örneklerde gözlenen ilgili çürümelerin filtreleme kriterlerini karşılamasını ve analize dahil edilmesini sağlayacaktır. Bu parametreler daha sonra tüm görüntüler için kullanılabilir. - Gerekirse bozunma parametrelerini (zil kutusu) ayarlayın. Kayma değişsin, çoğu zaman dağılım ve ofset, bozunma işlevlerine bir göz atmanın katkılarının önemsiz olduğunu gösteriyorsa sıfıra sabitlenebilir. Ofset çürümenin ilk kanallarına bakarak tahmin edilebilir - örnekteki düşük floresan nedeniyle uzun bir süre görüntüleme genellikle sıfır olmayan ofset sonuçları unutmayın. Saçılma çoğunlukla kalın örneklerde oluşur ve aksi göz ardı edilebilir.
- Sığdırma çalıştırmadan önce, montaj algoritmasını seçin. Model Seçeneklerini Göster/Gizle'dekialgoritma ayarları penceresini açın. Maksimum olasılık tahmini (MLE) algoritması(Şekil 7A)seçin.
- | Bozunma matrisini hesapla'ya tıklayarak görüntünün montajını çalıştırın. Tamamlandığında, ömür boyu kodlanmış FLIM görüntü ömür boyu görüntü panelinde görünür(Şekil 6 mor kutu).
NOT: Bozunma eğrisi penceresinde(Şekil 6 yeşil kutu) mavi haçı hareket ettirerek görüntünün her pikseline karşılık gelen yaşam boyu değerini görmek mümkündür.
NOT: Çok sayıda benzer FLIM veri dosyasını otomatik olarak işlemek için toplu işlem modu kullanılabilir. - Artıklara (ideal olarak 0'ın etrafında rasgele dağıtılan) ve 1'e yakın bir Chi kare değerine bakarak uyumun kalitesini kontrol edin.
- Takılı veriler farklı biçimlerde dışa aktarılabilir. TXT dosyalarındaki dosyaları dışa aktarmak için Dosya | Dışa aktarma. Dışa Aktarma seçenekleri penceresinde(Şekil 7B), Tümünü Seç'i seçin ve sonra Dışa Aktar'ıtıklatın.
- Son olarak çözümleme dosyasını kaydedin. Analiz dosyaları *.img dosyaları olarak kaydedilir ve doğrudan SPCImage'de yeniden açılabilir.
NOT: Özellikle dengesiz donör/kabul edici miktardurumlarında, FLIM-FRET etkileşen protein komplekslerinin karışımında alt popülasyonları ortaya çıkarabilir - özellikle iki ortağın konsantrasyonları çok farklı olduğunda, böylece karmaşık ve serbest türlerin karışımları ortaya çıkar. Etkileşime geçmeyen türler (donörün sadece çürümesine çok benzer bir çürüme ile karakterizedir) veri seti boyunca donör yaşam boyu bileşenlerinin mekansal bir değişmezliği varsayarak etkileşimhalinde olanlardan ayırt edilebilir. Benzer şekilde, daha fazla donör veya floresan daha fazla kabul ile non-stokiyometrik etkileşim kompleksleri oluşabilir. Bu tür komplekslerin floresan bozunmaları genellikle yorumlamak zordur. Bir FLIM diyagramı arsa ppis20,23stokiyometri ve bağlama modu hakkında kritik bilgi sağlamak için kullanılabilir. FLIM diyagramı çizimi, genlik fonksiyonu olarak en kısa ömür boyu bileşenin grafiksel gösterimidir. Benzer bozunma imzalarına sahip pikselleri görselleştirmek için kullanılabilir. Bu tür temsilleri çizmek için, deneysel floresan çürümeleri iki üstel model ile donatılmış olması gerekir. Aşağıdaki adımlar bu işlem boyunca bir kılavuz olabilir. - Donörün sadece inşaat verilerini analiz ederek başlayın. Donörün ömür boyu değerinin belirlenmesine olanak sağlayacak. İdeal olarak, donör için sağlam bir ömür boyu değer elde etmek için donör/kabul eden yapılarla aynı koşullarda kaydedilen birkaç görüntü üzerinde bu değeri ölçün.
- Belirlendikten sonra, iki üstel bir modelle donör/alıcı konstrüksiyonlarının floresan bozunmalarını sığdırın. Siyan bozunma parametre kutusunda(Şekil 6),bileşen sayısını 2 olarak ayarlayın. T2(ps) parametresini, 1.
NOT: Aşırı uyumu sınırlamak, yakınsamayı iyileştirmek ve daha güvenilir iki üstel uyum parametreleri24,25,26elde etmek için uzun ömürlü τ2'yi düzeltmek önemlidir. - *img dosyasını ve verileri *.asc dosyaları olarak 7.1.11 adımda kaydedin.
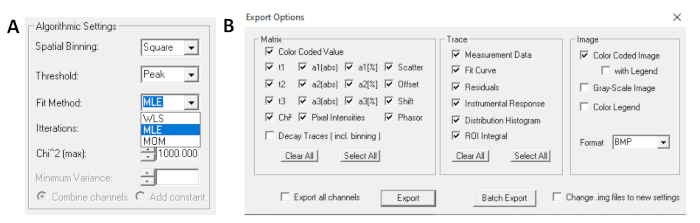
Şekil 7: (A) Bozunmaların üstel modellerle donatılması için algoritma ayarları. Uygun model olarak MLE (maksimum olasılık algoritması veya maksimum olasılık tahmini, MLE) ve (B) dışa aktarma seçenekleri penceresi seçilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- R'deki FLIM görüntülerinin gelişmiş analizi
- Gerekirse R (https://cran.r-project.org) ve RStudio (https://rstudio.com) yükleyin.
- RStudio'yi açın ve yeni bir proje oluşturun.
- Tüm çözümleme *.asc dosyasını proje ana klasöründe "veri" adlı bir klasöre taşıyın.
- Yeni bir komut dosyası dosyası açın (veya ek komut dosyası FLIM_analysis açın. R).
- flim veri analizi için özel flimDiagRam paketini https://github.com/jgodet/flimDiagRam yükleyin. Paketi çalışma alanından arayın. (Bildirime HowTo_FlimDiagRam bakın)
NOT: Paketlerin kurulumu sadece bir kez yapılmalıdır. Yüklendikten sonra, paketler herhangi bir yeni R oturumundan çağrılabilir. Github'dan R paketlerini indirmek için 'devtools' paketi yüklenmesi gerekmektedir. 'Devtools' kurulumu birkaç dakika sürebilir. FlimDiagRam paketi, FLIM verilerinin parametrelerini ve dağıtımlarını temsil etmek, FLIM verilerini tek kişiselleştirilmiş hücreler düzeyinde ayıklamak, koşullar veya suşlar arasında FLIM sonuçlarını karşılaştırmak ve FLIM diyagramı çizimi gibi gelişmiş görselleştirme araçlarını kullanarak FLIM verilerini keşfetmek için kullanılabilir. - Adım adım yorumlanan kodu kullanın ve veriler aşağıdaki Temsilci Sonuçları bölümünde sunulan tüm alt rakamları bağımsız olarak çoğaltmak için kullanılabilir hale getirin. Bu öğretici https://github.com/jgodet/flimDiagRam/blob/master/HowTo.pdfde HowTo_FlimDiagRam bildirimi bulunabilir. Kod, verileri çözümlemek için kolayca aktarılabilir.
Sonuçlar
Farklı bakteriyel suşlar için ölçülen floresan ömürlerinin ampirik kümülatif dağılım fonksiyonları (ecdf) Şekil 8'degösterilmiştir. FRET oluşursa, ekdfler daha kısa ömürlü yaşam sürelerine doğru kaydırılır(Şekil 8A,8B). İki proteinin etkileşimi iki floroforarasında uzun bir mesafeyle sonuçlandığında, HIÇBIR FRET oluşabilir(Şekil 8C). Bu durum, FLIM'deki iki ortak arasındaki et...
Tartışmalar
FLIM-FRET, yoğunluk tabanlı FRET görüntülemeye göre bazı önemli avantajlar sunar. Floresan ömür, floroforun içsel bir parametresi. Sonuç olarak, ne ışık uyarma yoğunluğu floroforların yerel konsantrasyonları bağlı değildir. Floresan ömrü ayrıca fotoğraf beyazlatma dan da kötü etkilenir. Özellikle lokal protein konsantrasyonlarının hücre altı bölmeleri veya bölgeleri boyunca son derece heterojen olabileceği hücrelerde PPI'ların kanıt edilmesi ilginçtir. FLIM-FRET, hem proteinlerin h...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Dr. Ludovic Richert'i FLIM veri toplama ve FLIM kurulumunun teknik bakım ve geliştirmesi konusundaki değerli yardımlarından dolayı kabul ediyoruz. Bu çalışma Fondation pour la Recherche en Chimie (https://icfrc.fr/) bağışları ile finanse edilmiştir. VN Fondation pour la Recherche Médicale (FRM-SPF201809006906) tarafından finanse edilmektedir. YM, Institut Universitaire de France'a (IUF) destek ve araştırmaya yardımcı olmak için ek süre sağladığı için müteşekkirdir. IJS ve JG, Strazburg İlaç Dağıtım Enstitüsü'nü mali desteğinden ötürü kabul ediyorlar.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 525/50 nm band-pass filter | F37-516, AHF, Germany | ||
| 680 nm short pass filter | F75-680, AHF, Germany | ||
| Agarose | Sigma-Aldrich | A9539 | |
| Ammonium Sulfate (NH4)2SO4 | Sigma-Aldrich | A4418 | |
| DreamTaq DNA polymerase 5U/μL | ThermoFisher Scientific | EP0714 | |
| E. coli TOP10 | Invitrogen | C404010 | |
| Fiber-coupled avalanche photo-diode | SPCM-AQR-14- FC, Perkin Elmer | ||
| Glass coverslips (Thickness No. 1.5, 20×20mm | Knitel glass | MS0011 | |
| High-Fidelity DNA polymerase Phusion 2U/μL | ThermoFisher Scientific | F530S | |
| Lysogeny broth (LB) | Millipore | 1.10285 | |
| Magnesium Sulfate Heptahydrate (MgSO4 . 7H2O) | Sigma-Aldrich | 10034-99-8 | |
| Microscope slides (25×75mm) | Knitel glass | MS0057 | |
| NucleoSpin Gel and PCR Clean-up | Macherey-Nagel | 740609.50 | |
| NucleoSpin Plasmid | Macherey-Nagel | 740588.10 | |
| Potassium Phosphate Dibasic (K2HPO4) | Sigma-Aldrich | RES20765 | |
| Potassium Phosphate Monobasic (KH2PO4) | Sigma-Aldrich | P5655 | |
| Sodium Succinate (Disodium) | Sigma-Aldrich | 14160 | |
| SPCImage, SPCM software | Becker & Hickl | ||
| Sterile inoculating loop | Nunc | 7648-1PAK | |
| T4 DNA ligase 1U/μL | ThermoFisher Scientific | 15224017 | |
| TCSPC module | SPC830, Becker & Hickl, Germany | ||
| Ti:Sapphire laser | Insight DeepSee, Spectra Physics | ||
| Tubes 50mL | Falcon | 352070 |
Referanslar
- Braun, P., Gingras, A. C. History of protein-protein interactions: From egg-white to complex networks. Proteomics. 12, 1478-1498 (2012).
- Nooren, I. M. A., Thornton, J. M. Structural characterisation and functional significance of transient protein-protein interactions. Journal of Molecular Biology. 325, 991-1018 (2003).
- Hayes, S., Malacrida, B., Kiely, M., Kiely, P. A. Studying protein-protein interactions: Progress, pitfalls and solutions. Biochemical Society Transactions. 44, 994-1004 (2016).
- Guillon, L., Altenburger, S., Graumann, P. L., Schalk, I. J. Deciphering protein dynamics of the siderophore pyoverdine pathway in Pseudomonas aeruginosa. PLoS ONE. 8, 1-9 (2013).
- Ringel, M. T., Brüser, T. The biosynthesis of pyoverdines. Microbial Cell. 5, 424-437 (2018).
- Schalk, I. J., Rigouin, C., Godet, J. An overview of siderophore biosynthesis among fluorescent Pseudomonads and new insights into their complex cellular organization. Environmental Microbiology. 22, 1447-1466 (2020).
- Cui, Y., et al. Techniques for detecting protein-protein interactions in living cells: principles, limitations, and recent progress. Science China Life Sciences. , (2019).
- Day, R. N., Mazumder, N., Sun, Y., Christopher, K. G. FRET microscopy: Basics, issues and advantages of FLIM-FRET imaging. Springer Series in Chemical Physics. 111, 249-276 (2015).
- Bastiaens, P. I. H., Squire, A. Fluorescence lifetime imaging microscopy: Spatial resolution of biochemical processes in the cell. Trends in Cell Biology. 9, 48-52 (1999).
- Yasuda, R. Imaging spatiotemporal dynamics of neuronal signaling using fluorescence resonance energy transfer and fluorescence lifetime imaging microscopy. Current Opinion in Neurobiology. 16, 551-561 (2006).
- Tramier, M., Zahid, M., Mevel, J. -. C., Masse, M. -. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry Pairs to Donor Photobleaching on FRET Determination by Fluorescence Lifetime Imaging Microscopy in Living Cells. Microscopy Research and Technique. 71, 146-157 (2008).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A guide to fluorescent protein FRET pairs. Sensors (Switzerland). 16, 1-24 (2016).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends in Biochemical Sciences. 32, 407-414 (2007).
- Leray, A., et al. Optimized protocol of a frequency domain fluorescence lifetime imaging microscope for fret measurements. Microscopy Research and Technique. 72, 371-379 (2009).
- Elson, D. S., et al. Real-time time-domain fluorescence lifetime imaging including single-shot acquisition with a segmented optical image intensifier. New Journal of Physics. 6, 1-13 (2004).
- Rajoria, S., Zhao, L., Intes, X., Barroso, M. FLIM-FRET for Cancer Applications. Current Molecular Imaging. 3, 144-161 (2014).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nature Methods. 8, 393-399 (2011).
- Visca, P., Ciervo, A., Orsi, N. Cloning and nucleotide sequence of the pvdA gene encoding the pyoverdin biosynthetic enzyme L-ornithine N5-oxygenase in Pseudomonas aeruginosa. Journal of Bacteriology. 176, 1128-1140 (1994).
- Imperi, F., Visca, P. Subcellular localization of the pyoverdine biogenesis machinery of Pseudomonas aeruginosa: A membrane-associated 'siderosome'. FEBS Letters. 587, 3387-3391 (2013).
- Gasser, V., et al. In cellulo FRET-FLIM and single molecule tracking reveal the supra-molecular organization of the pyoverdine bio-synthetic enzymes in Pseudomonas aeruginosa. Quarterly Reviews of Biophysics. , 1-11 (2019).
- Rietsch, A., Mekalanos, J. J. Metabolic regulation of type III secretion gene expression in Pseudomonas aeruginosa. Molecular Microbiology. 59, 807-820 (2006).
- Herrero, M., De Lorenzo, V., Timmis, K. N. Transposon vectors containing non-antibiotic resistance selection markers for cloning and stable chromosomal insertion of foreign genes in gram-negative bacteria. Journal of Bacteriology. 172, 6557-6567 (1990).
- Godet, J., Mély, Y. Exploring protein-protein interactions with large differences in protein expression levels using FLIM-FRET. Methods and Applications in Fluorescence. 8, 014007 (2019).
- El Meshri, S. E., et al. Role of the nucleocapsid domain in HIV-1 gag oligomerization and trafficking to the plasma membrane: A fluorescence lifetime imaging microscopy investigation. Journal of Molecular Biology. 427, 1480-1494 (2015).
- Becker, W. The bh TCSPC Handbook. Scanning. , 1 (2010).
- Richert, L., Didier, P., de Rocquigny, H., Mély, Y. Monitoring HIV-1 protein oligomerization by FLIM FRET microscopy. Springer Series in Chemical Physics. , 111 (2015).
- Fereidouni, F., Blab, G. A., Gerritsen, H. C. Phasor based analysis of FRET images recorded using spectrally resolved lifetime imaging. Methods and Applications in Fluorescence. 2, (2014).
- Fereidouni, F., Gorpas, D., Ma, D., Fatakdawala, H., Marcu, L. Rapid fluorescence lifetime estimation with modified phasor approach and Laguerre deconvolution: a comparative study. Methods and Applications in Fluorescence. 5, 035003 (2017).
- Margineanu, A., et al. Screening for protein-protein interactions using Förster resonance energy transfer (FRET) and fluorescence lifetime imaging microscopy (FLIM). Scientific Reports. 6, (2016).
- Guzmán, C., Oetken-Lindholm, C., Abankwa, D. Automated High-Throughput Fluorescence Lifetime Imaging Microscopy to Detect Protein-Protein Interactions. Journal of Laboratory Automation. 21, 238-245 (2016).
- Liu, W., Cui, Y., Ren, W., Irudayaraj, J. Epigenetic biomarker screening by FLIM-FRET for combination therapy in ER+ breast cancer. Clinical Epigenetics. 11, 1-9 (2019).
- Liu, X., et al. Fast fluorescence lifetime imaging techniques: A review on challenge and development. Journal of Innovative Optical Health Sciences. 12, 1-27 (2019).
- Padilla-Parra, S., Auduge, N., Coppey-Moisan, M., Tramier, M. Non fitting based FRET-FLIM analysis approaches applied to quantify protein-protein interactions in live cells. Biophysical Reviews. 3, 63-70 (2011).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95, 2976-2988 (2008).
- Stringari, C., et al. Phasor approach to fluorescence lifetime microscopy distinguishes different metabolic states of germ cells in a live tissue. Proceedings of the National Academy of Sciences of the United States of America. 108, 13582-13587 (2011).
- Digman, M. A., Caiolfa, V. R., Zamai, M., Gratton, E. The phasor approach to fluorescence lifetime imaging analysis. Biophysical Journal. 94, 14-16 (2008).
- Liang, Z., Lou, J., Scipioni, L., Gratton, E., Hinde, E. Quantifying nuclear wide chromatin compaction by phasor analysis of histone Förster resonance energy transfer (FRET) in frequency domain fluorescence lifetime imaging microscopy (FLIM) data. Data in Brief. 30, 105401 (2020).
- Grimm, J. B., Heckman, L. M., Lavis, L. D. The chemistry of small-molecule fluorogenic probes. Progress in Molecular Biology and Translational Science. 113, (2013).
- Li, L., Sun, H. Next Generation of Small-Molecule Fluorogenic Probes for Bioimaging. Biochemistry. 59, 216-217 (2020).
- Yao, R., Ochoa, M., Yan, P., Intes, X. Net-FLICS: fast quantitative wide-field fluorescence lifetime imaging with compressed sensing - deep learning approach. Light: Science and Applications. 8, 1-7 (2019).
- Smith, J. T., et al. Fast fit-free analysis of fluorescence lifetime imaging via deep learning. Proceedings of the National Academy of Sciences of the United States of America. 116, 24019-24030 (2019).
- Yao, R., Ochoa, M., Intes, X., Yan, P. Deep compressive macroscopic fluorescence lifetime imaging. Proceedings - International Symposium on Biomedical Imaging. 2018, 908-911 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır