Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
FLIM-FRET Измерения белково-белковых взаимодействий в живых бактериях.
В этой статье
Резюме
Мы описываем здесь протокол для характеристики белково-белковых взаимодействий между двумя сильно по-разному выраженными белками в живых Pseudomonas aeruginosa с использованием измерений FLIM-FRET. Протокол включает в себя бактерии штамма конструкций, бактерий иммобилизации, изображений и пост-изображения данных анализа процедур.
Аннотация
Белково-белковые взаимодействия (ИЦП) контролируют различные ключевые процессы в клетках. Микроскопия флуоресценции в течение всей жизни (FLIM) в сочетании с переносом резонансной энергии Фюрстера (FRET) обеспечивает точную информацию о ИЦП в живых клетках. FLIM-FRET опирается на измерение распада флуоресценции донора FRET на каждом пикселе изображения FLIM, предоставляя количественную и точную информацию о ИЦП и их пространственных клеточных организациях. Мы предлагаем здесь подробный протокол для измерений FLIM-FRET, который мы применили для мониторинга ИЦП в живых Pseudomonas aeruginosa в конкретном случае двух взаимодействующих белков, выраженных с очень разными номерами копий, чтобы продемонстрировать качество и надежность метода при выявлении критических особенностей ИЦП. В этом протоколе подробно описаны все необходимые шаги для характеристики ИЦП - от бактериальных мутантных конструкций до окончательного анализа с использованием недавно разработанных инструментов, обеспечивающих расширенные возможности визуализации для простого толкования сложных данных FLIM-FRET.
Введение
Белково-белковые взаимодействия (ИЦП) контролируют различные ключевые процессы вклетках 1. Роли ИЦП различаются в зависимости от состава белка, сродства функций и мест в клетках2. ИЦП могут быть исследованы с помощью различныхметодов 3. Например, ко-иммунопреципиентация является относительно простым, надежным и недорогим методом, широко используемым инструментом для выявления или подтверждения ИЦП. Тем не менее, изучение ИЦП может быть сложной задачей, когда взаимодействующие белки имеют низкий уровень экспрессии или когда взаимодействия являются переходными или актуальными только в конкретных средах. Изучение ИЦП, происходящих между различными ферментами пиовердина пути в P. aeruginosa требует, чтобы репрессии общего железа совместно фактором репрессора меха освобождается, чтобы выражение всех белков пиовердина путь, которые будут выражены вклетке 4,5,6. Эта общая регулировка для всех протеинов путя приводит к в своевременных выражениях в клетке, как ожидается, для содействия их взаимодействию. Разнообразие с зрения размера, природы, уровней экспрессии и количества белков этого метаболического пути затрудняет изучение в восстановленных системах6. Поэтому изучение ИЦП в их клеточной среде имеет решающее значение для дальнейшего понимания биологических функций белков в их родном контексте.
Лишь немногие методы, включая флуоресценцию позволяют исследовать ИЦП в живыхклетках 7. Среди различных параметров флуоресценции, которые могут быть измерены, срок службы флуоресценции (т.е. среднее время флюорофор остается в возбужденном состоянии, прежде чем излучать фотон), вероятно, является одним из самых интересных параметров для изучения в живых клетках. Срок службы флуоресценции флюорофора очень чувствителен к окружающей среде, и поэтому FLIM может предоставить химическую или физическую информацию о флюорофорнойсреде 8. Это включает в себя наличие Фюрстер резонансной передачи энергии (FRET), которые могут возникнуть в присутствии "приемщика" флуоресценции, расположенной на небольшом расстоянии от флуоресценции "донор". Передача энергии приводит к значительному сокращению срока службы донорской флуоресценции(рисунок 1A),что делает флуоресценцию пожизненной микроскопии (FLIM) мощным подходом к изучению белково-белковых взаимодействий непосредственно в живых клетках. FLIM может дополнительно предоставить пространственную информацию о том, где происходит взаимодействие вячейках 7,8. Такой подход чрезвычайно силен для изучения ИЦП в ситуациях, когда возможна маркировка флюорофорами двух взаимодействующих партнеров.
Для возникновения ФРЕТ - критические условия на расстоянии между двумя флюорофорамитребуются 8,9. Два фторфора не должны быть удалены друг от друга более чем на 10 нм. Поэтому при разработке экспериментов FLIM-FRET необходимо принимать предостережения, чтобы донор и приемник флуоресценции имели возможность находиться близко друг к другу в взаимодействующих комплексах. Хотя это может показаться сдерживающим, это на самом деле истинное преимущество, как расстояние зависимости FRET гарантирует, что два помеченных белков, проходящих FRET должны физически взаимодействовать (Рисунок 1A). Таким образом, трудности с получением четких ответов на вопросы о ИЦП в экспериментах по колокализации (два колокализованных белка не обязательно взаимодействуют) не являются проблемой с использованием FLIM-FRET.
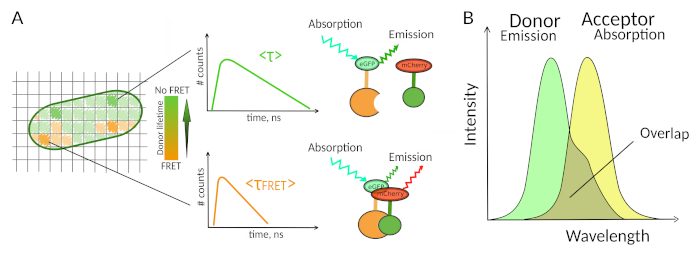
Рисунок 1: Принцип анализа FLIM-FRET. Каждый пиксель многомерного изображения FLIM-FRET содержит информацию о распаде флуоресценции, зарегистрированном в данном конкретном месте (#counts - количество обнаруженных фотонов в канале t). (A) Классическое изображение FLIM, как правило, ложного цвета жизни закодированы 2D изображение (слева). Снижение среднего срока службы флуоресценции донора - как видно из изменения цветовой шкалы - можно наблюдать в присутствии ФРЕТ и является информативным о наличии ИЦП в этой пространственной области. (B) Перекрытие между спектром выбросов донора и спектром поглощения приемоктора необходимо для возникновения ФРЕТ. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Второе требование ДЛЯ ФРЕТ заключается в том, что спектр выбросов донора и спектр поглощения приемора должны перекрываться8 (рисунок 1B). Флуоресценция возбуждения донора должна быть на длинах волн, которые вносят очень мало в прямое возбуждение флуоресценции приемора. Не все комбинации флюорофоров возможны, и мы дополнительно рекомендуем преимущественно использовать доноров с моноэкспонентным распадом флуоресценции для облегчения интерпретаций FLIM-FRET10. Несколько пар белков флуоресценции отвечают этим требованиям, в том числе популярная пара eGFP-mCherry11 (для обзора палитры доступных флуоресцентных белковых пар FRETсм. 12,13).
FLIM-FRET позволяет измерять упадок флуоресценции донора FRET на каждом пикселе изображения FLIM(рисунок 1A). Существуют два основных метода определения срока службы флуоресценции, которые отличаются по приобретению и анализу: частотный домен (FD)14 и домен времени (TD). TD FLIM является более распространенным и осуществляется с использованием импульсного освещения в сочетании с различными возможными конфигурациями обнаружения, включая gatingметоды 15, полосакамеры 16 или времени коррелированных одного фотона подсчета (TCSPC)методы 8. Как для методов FD, так и для TD срок службы флуоресценции непосредственно не измеряется, а требует анализа измеренных данных для оценки продолжительности жизни (ы) или наличия взаимодействий. Для методов TCSPC наиболее широко используемый анализ основывается на установке распада с помощью одной или нескольких экспоненциальных функций с использованием наименее квадратных итеративных революций, которые минимизируют взвешенную сумму остатков.
Наконец, FLIM-FRET может быть выполнен как с помощью одного фотона или мультифотонных возбуждений. Последние имеют ряд преимуществ, таких как уменьшение аутофторесценции и фотодемаж из фокусной плоскости. Мультифотонные возбуждения позволяют также более длинную глубину возбуждения при работе в толстых 3D образцах8. Напротив, одно фотон возбуждение, как правило, более эффективным, как два фотона поглощения поперечных сечений флуоресцентных белковограничены 17.
Здесь мы предлагаем протокол для измерений ИЦП FLIM-FRET в живых P. aeruginosa в конкретном случае двух взаимодействующих белков (PvdA и PvdL), выраженных с очень разным количеством копий, чтобы продемонстрировать качество и надежность метода при выявлении критических особенностей ИЦП. Белки PvdA и PvdL участвуют в биосинтезе пиовердина. PvdA является L-орнитин N5-оксигеназа и синтезирует L-N5-формил-N5-гидроксиорнитин из L-орнитин по гидроксилации (PvdA) и формилирования (PvdF)18. PvdL является не рибосомным пептидным синтезом (NRPS) ферментом, состоящим из четырех модулей. Первый модуль катализает ациляцию миристической кислоты. Второй модуль катализает активацию L-Glu и его конденсации в миристический коА. Затем третий модуль конденсирует аминокислоту L-Tyr, которая затем изомерируется в D-Tyr. Наконец, четвертый модуль связывает L-Dab (Diaminobutyric кислоты) аминокислоты для формирования ацилатного трипептида L-Glu/D-Tyr/L-Dab6. PvdL, таким образом, отвечает за синтез трех первых аминокислот прекурсора пиовердина. Взаимодействие белка PvdA с PvdL удивительно, так как PvdL, в отличие от PvdI и PvdJ, не несет модуль, специфичный для L-N5-formyl-N5-гидроксиорнитин. Это взаимодействие предполагает, что все ферменты, ответственные за биосинтез прекурсора пиовердина, расположены в больших переходных и динамическихмногоэнзиматических комплексах 19,20.
В этом докладе мы подробно объяснить, как построить бактериальных штаммов, выражаюющих родной двух взаимодействующих eGFP и mCherry помечены белками. Мы также описываем подготовку образцов и условия для эффективной визуализации клеток FLIM-FRET. Наконец, мы предлагаем пошаговую учебную программу для анализа изображений, включая недавно разработанный инструмент, предоставляющий расширенные возможности визуализации для простого толкования сложных данных FLIM-FRET. С помощью этого доклада мы хотели бы убедить не только предприимчивых, но и большинство биологов в том, что FRET-FLIM является доступным и мощным методом, способным решать свои вопросы о ИЦП непосредственно в родной клеточной среде.
протокол
1. Плазмидная конструкция
- Усиление двумя ПЦР (ПЦР1 и 3) последовательностей ДНК (использование геномной ДНК P. aeruginosa PAO1) из 700 базовых пар вверх и вниз по течению регионов, соответствующих месту вставки в геноме P. aeruginosa с полимеразой ДНК высокой точности. Добавьте сайты ограничения к грунтовки в синем и зеленом цветах и добавьте перекрывающуюся последовательность с mCherry к грунтовким красным цветом(рисунок 2).
- Для PvdA помечены на C-терминуса с eGFP, усилить 700 bp региона вверх по течению по отношению к остановке кодон грунтовки в синем, и усилить 700 bp вниз по течению региона, содержащего стоп-кодон с грунтовки в зеленом цвете.
- Для PvdL помечены на N-терминуса с mCherry, усилить 700 bp области вверх по течению к pvdL гена, в том числе начала кодон, праймеры в синем, и усилить 700 bp вниз по течению области с грунтовки в зеленом цвете.
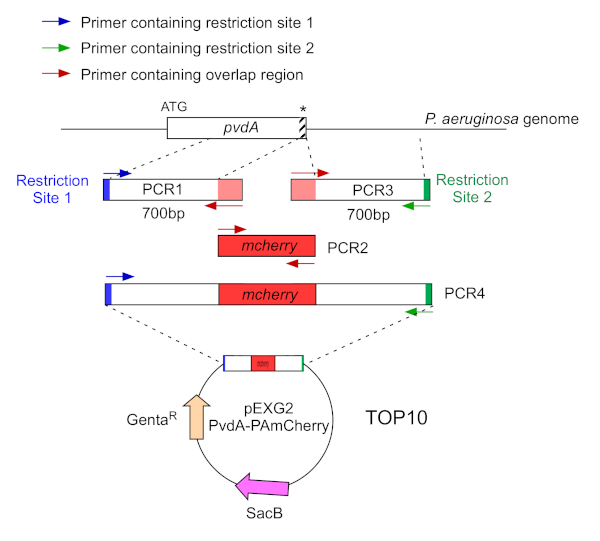
Рисунок 2: Обзор стратегии ПЦР и строительства плазмидов, используемых для строительства PvdA-mCherry. Смотрите текст для получения подробной информации - pvdA кодирует фермент, участвующий в биосинтезе siderophore pyoverdine, вторичного метаболита, участвуют в приобретении железа. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Усиление eGFP кодирования ДНК (без начала и остановки кодонов) с грунтовки в красном с высокой точностью ДНК полимеразы.
- Очистите продукты ПЦР на колонке очистки ПЦР(Таблица материалов).
- Смешайте перекрывающиеся продукты ПЦР в равнозначном соотношении и выполните второй ПЦР с использованием грунтовок с сайтом ограничения, используемым для ПЦР 1 и 3 (зеленый и синий на рисунке 2).
- Перенести продукт ПЦР в агарозу-1x TAE (Tris-Base Acetate EDTA pH 8.0) гель, вырезать соответствующую полосу и извлечь ампликон с pcR очистки комплекта(Таблица материалов).
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь. - Дайджест ПЦР ампликсон и pEXG2 плазмид с использованием соответствующих ферментовограничения 21.
- Лигат плазмида и вставьте с T4 ДНК лигазы с использованием 90 нг плазмидного и молекулярного соотношения 1:1 (плазмида: вставка).
- Преобразование плазмиды строительства в химически компетентных клеток E. coli TOP10 клеток путем смешивания перевязки продукта и 100 йл TOP10. Инкубировать компетентные бактерии / плазмидной смеси на льду в течение 30 минут, прежде чем приступить к 42 градусов теплового шока на 60 с. Затем поставь трубку на лед на 10 минут.
- Добавьте 1 мл лисогенного бульона (LB) к бактериям и инкубировать при 37 градусов по Цельсию в течение 1 ч.
- Бактерии плиты 100 йл на Агаре LB, содержащие 15 мкг/мл гентамицина.
- Инкубировать на ночь при 37 градусов по Цельсию.
- Экран наличие вставки колонии ПЦР: из одной изолированной колонии трансформатор, забрать минуту количество бактерий, которые будут добавлены в смесь ПЦР, содержащие грунтовки гибридизации на плазмиде таким образом, что наличие ампликона может быть обнаружено путем запуска продукта на агарозный гель (ДНК-полимераза). Из той же колонии, используемой для ПЦР, передать небольшое количество бактерий на свежей пластине, содержащей 15 мкг / мл гентамицина, которые будут изолированы и использованы для плазмидной экстракции. Наконец, изолировать и очистить плазмид (Таблицаматериалов) и проверитьвставку путем последовательности.
- Храните бактерии TOP10, содержащие плазмиду в LB с 20% глицеролом в микротрубке 1,5 мл при -80 градусов по Цельсию и очищенную плазмиду при -20 градусов по Цельсию в трубке 1,5 мл.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь
2. Вставка флуоресцентных тегов в хромосомный геном P. aeruginosa(рисунок 3)
- Расти P. aeruginosa, TOP10 и E. coli помощник бактерий, каждый из 5 мл LB без антибиотиков при 30 градусов по Цельсию под орбитальнойтряски ночь 22. Создать флуоресцентные метки вставки в геном P. aeruginosa путем передачи плазмиды из E. coli TOP10 в штамм PAO1 и интеграции плазмиды в геном гомологичной рекомбинации. Второе событие пересечения вектора генерирует соответствующего мутанта.
- Измерьте оптическую плотность на уровне 600 нм (OD600 нм)бактериальной культуры и смешайте равное количество P. aeruginosa (500 МКЛ, ОД600 нм и 1,0) с E. coli TOP10 pEXG2 (500 йл, ОД600 нм и 1,0) и E. coli HB101 pRK600 помощник (500 йл, OD600 нм и 1,0) в 1,5 мл microtube.
- Центрифуга 5 мин при 9300 х г гранулировать бактерии.
ПРИМЕЧАНИЕ: Онлайн-инструменты могут быть использованы для преобразования центробежной g-силы в вращение в минуту (об/мин) для регулировки скорости центрифуги. - Держите бактериальные гранулы и отбросить супернатант.
- Переусердуйте гранулы, содержащие бактерии в 50 МКЛ LB.
- Плита пятно (50 л) смеси на середине Агара LB (разогреть при 37 градусов по Цельсию) и инкубировать 5 ч при 37 градусов по Цельсию.
- Ломать пятно с стерильной циклом прививки и повторного перерасхода в 1 мл LB.
- Плита 100 Л этой бактериальной суспензии на Агаре LB, содержащей 10 мкг/мл хлорамфеникол для устранения Е. палочка палочки (E. coli TOP10 pEXG2 и E. coli HB101 pRK600 помощник чувствительны к хлорамфениколу, но P. aeruginosa естественно устойчива) и 30 мкг/мл гентамицина и инкубировать 2 дня при 37 градусов по Цельсию.
- Resuspend одной колонии в 1 мл LB и инкубировать при 37 градусов по Цельсию под орбитальной тряски 4h.
- Центрифуга 3 мин при 9300 х г и отбросить 950 МКЛ супернатанта. Resuspend гранулы в 50 л LB и изолировать смесь на LB агар, содержащий сахарозу и без NaCl.
- Инкубировать на ночь при 30 градусов по Цельсию.
- Обнаружить изолированные колонии на LB агар и LB агар, содержащий 15 мг / мл гентамицина для того, чтобы проверить чувствительность гентамицина.
- Проверить eGFP или mCherry вставки ПЦР колоний (ДНК полимеразы) и секвенирования с использованием конкретных грунтовки.
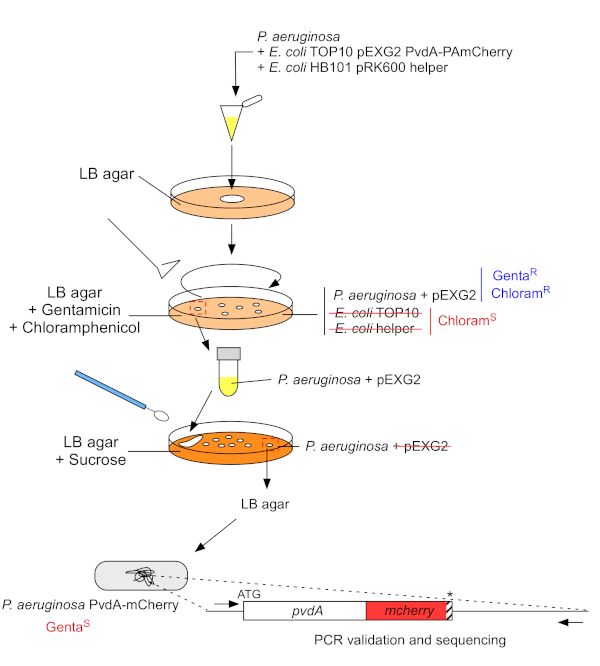
Рисунок 3: Протокол строительства штаммов P. aeruginosa путем вставки флуоресцентных тегов. Для получения подробной информации можно посмотреть текст. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
3. Измерение пиовердина
- Выращиваем бактерии в 5 мл ЛБ при 30 градусах цельсия под орбитальной тряской на ночь.
- Пеллетные бактерии путем центрифугации, мыть и выращивать их в 5 мл SM (Succinate Medium, состав: 6 гзЛNo1 К2ЛПО4, 3 гЗЛNo1 КХ 2ПО 4, 1 гЗЛNo1 (NH4)2 SO4, 0,2 г LNo 1 MgSO4, 7 H2O и 4 г'ЛNo 1 натрия сукчината с рН регулируется до 7,0, добавив NaOH) при 30 градусов по Цельсию под орбитальной тряски в одночасье. СМ является железом лишенной среды - отсутствие железа активирует экспрессию белков пиовердного пути, обычно подавляемого в присутствии железа.
- Измерьте OD600 nm и разбавьте бактерии снова в свежей среде SM на OD600 nm й 0.1 и вырастите их на 30 C под орбитальной тряской всю ночь.
- Измерьте OD 600 nm для того чтобы обусловить количество бактерий в каждом образце.
- Подготовь кварцевый кюветт, содержащий 100 МКЛ культуры P. aeruginosa и полный до 1 мл SM (900 МКЛ). Приготовьте кварцевый кювет, содержащий 1 мл среды SM (пустой).
- Используя УФ-видимый спектрофотометр, измеряйте абсорбцию на максимуме пика поглощения. При рН 7.0 максимальное поглощение пиовердина будет происходить на уровне 400 нм. Определите концентрацию пиовердина (формы апо) в образце с использованием закона Пиво-Ламберта с использованием коэффициента вымирания молара на уровне 400 нм e и 19 000М -1см -1.
ПРИМЕЧАНИЕ: Пиовердин можно количественно оценить в диапазоне абсорбанса от 0,1 до 1 евро (в зависимости от УФ-видимого спектрофотометра), в котором поглощение линейно увеличивается с концентрацией.
4. Культура бактерий и условия для клеток, чтобы выразить PvdA, PvdL и PvdJ
- На 1-й день прививите трубку с 5 мл ЛБ из соответствующего глицеролового запаса бактерий и выращиваем бактерии в ночное время при 30 градусах Цельсия при 200 об/мин в орбитальном инкубаторе шейкера.
- На второй день гранулы клетки центрифугации на 3000 х г в течение 3 мин и отказаться от супернатанта.
- Повторное перерасход клеток в 10 мл SM.
- Повторите шаги 4.2-4.3 один раз и вырастить бактерии в SM ночь на 30 градусов по Цельсию 200 об /мин.
- На 3-й день разбавляют 1/10 культурой бактерий в свежем СМ.
- Расти разбавленных бактерий снова на ночь в тех же условиях.
ПРИМЕЧАНИЕ: Наличие пиовердина можно обнаружить визуально, так как он окрашивается в желто-зеленые растущие средства массовой информации. Это показывает, что экспрессия белков пути пиовердина были активированы и что ферменты, представляющие интерес, выражаются в клетках.
5. Подготовка агарозной площадки(рисунок 4)
- Поместите микроскопное стекло-слайд на плоскую горизонтальную поверхность. Упорядочить два стеклянных слайдов увенчанный двумя слоями клейкой лентой с каждой стороны первоначального слайда.
ПРИМЕЧАНИЕ: Держите 1-2 мм пространство между тремя выровненными слайдами, чтобы предотвратить меленую агарозу, чтобы в конечном итоге распространиться на слайдах с клейкой лентой. - Пипетту и залить каплей 70 МКЛ 1% расплавленной агарозы на стекло-слайд. Добавить четвертый слайд на вершине, чтобы сгладить капли агарозы и нажмите вниз осторожно. Подожди минутку.
- Смей верхнюю горку и падение с пипеткой около 3 йл бактерий в 3 до 4 пятен в разных местах на агарозы площадку.
- Обложка с микроскопией стеклянные крышки (например, 22x22 мм #1,5 толщины).
ПРИМЕЧАНИЕ: Плоскость и толщина coverslips имеют важное значение для работы с двух-фотон возбуждения. Точность coverslips с контролируемой равномерной плоскости и низкой аутофторесценции, как правило, хороший выбор. - Исправить крышку с расплавленным парафином, чтобы запечатать крышку на стеклянную горку. Начните с фиксации четырех углов крышки.
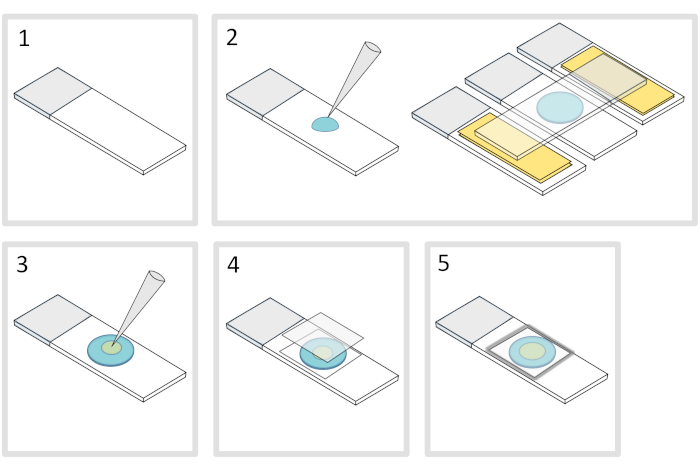
Рисунок 4: Агароза колодки подготовки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
6. Изображение с двухкориновой микроскопией установки
ПРИМЕЧАНИЕ: Мы используем самодельные двух фотон возбуждения сканирования перевернутый микроскоп с 60x 1.2NA воды погружения цели, работающие в режиме десканированных флуоресценции сбора. Двухкориновая длина волны возбуждения установлена на уровне 930 нм. Он обеспечивается лазером Ti:Sapphire (скорость повторения 80 МГц, ≈ 70 fs шириной импульса), работающим на 10-20 мВт. Фотоны флуоресценции были собраны с помощью фильтра короткого прохода 680 нм и фильтра диапазона 525/50 нм, прежде чем быть направленным на волоконно-соединенный лавинный фото-диод, подключенный к одному модулю подсчета фотографий (TCSPC). Микроскоп также оснащен трансмиссионой лампой флуоресценции. Несколько микроскопов FLIM-FRET в настоящее время коммерчески доступны, и многие средства визуализации оснащены установками, способными выполнять измерения FLIM-FRET.
- Используйте лампу флуоресценции, чтобы сосредоточить цель на монослой бактерий в образце и выбрать области, представляющие интерес.
- Убедитесь, что возбуждающей лазерной затвор закрыт и что инфракрасный свет, поступающий от лазера блокируется и не попадают в микроскоп.
Внимание: Тщательное внимание и постоянная бдительность должны быть предоставлены работы с ИК импульсных лазеров, как лазерный свет не может рассматриваться глазами, но любой и даже переходный прямой экспозиции или лазерного отражения может быть чрезвычайно вредным и создать необратимые повреждения глаз. Пожалуйста, обратитесь к местным процедурам лазерной безопасности и обучения перед использованием микроскопии установок. - Поместите слайд микроскопии на сцену с крышками, стоящими перед целью.
- Убедитесь, что лампа флуоресценции ON.
- Поверните башню кубика фильтра, чтобы выбрать кубик eGFP и откройте затвор лампы флуоресценции.
- Отправьте свет флуоресценции к окуляру микроскопа.
Внимание: Убедитесь, что соответствующие фильтры удаляются в светлом пути, чтобы отбросить прямой свет возбуждения, поступающий от лампы флуоресценции, которая может повредить глаза. - Сосредоточьте цель на бактериях с помощью ручки микроскопа.
- Выберите область интереса к образцу, перевестив его с помощью джойстика, контролирующего моторизованную сцену
ПРИМЕЧАНИЕ: Фокусировка легче с высоко флуоресцентным образцом позволяет флуоресценции, чтобы увидеть непосредственно глазами. - Переключите возбуждение на лазер 2PE для измерений FLIM-FRET.
- Отправьте путь выбросов флуоресценции обратно к детектору.
- Поверните назад башню кубика фильтра, чтобы выбрать для дихроического куба для лазера 930 нм.
- Установите мощность лазера до 20 мВт.
- Установите размер области интереса до 30 мкм. Эта операция регулирует напряжение, работающее на гальво-зеркалах, и определяет диапазон их движений(рисунок 5).
- Включите детектор и начните сканировать образец - кнопки запуска и остановки, контролирующие сканирование, также контролируют открытие и закрытие лазерного затвора как по соображениям безопасности, так и для ограничения фотооткрывателя образца(рисунок 5).
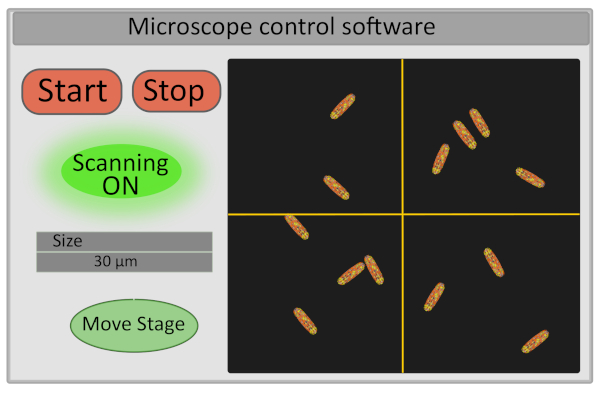
Рисунок 5: Схематическое представление интерфейса программного обеспечения для управления микроскопом. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- При необходимости отрегулируйте фокус, слегка перемещая микроскоп тонкой ручкой фокусировки.
- Выберите поле зрения для визуализации, тонко перемещая сцену из компьютерного интерфейса. Это может быть сделано на установку, перемещая крест на изображении в микроскоп управления программным обеспечением(рисунок 5), который будет определять новый центр изображения и нажав Move Stage. Хорошее поле зрения для приобретения соответствует изображению с 10-30 неподвижными бактериями, все правильно сфокусированы (все бактерии находятся на одной плоскости). Если вы заинтересованы в извлечении данных FLIM-FRET для отдельных клеток, убедитесь, что бактерии хорошо индивидуализированы (сегментация изображений будет намного проще).
- Откройте программное обеспечение SPCM (коммерческое программное обеспечение для сбора данных) и убедитесь, что скорость подсчета фотонов не слишком высока, чтобы избежать эффекта нагромоения, который может повлиять на измерения продолжительности жизни. При необходимости, снизить интенсивность лазера, чтобы сохранить скорость подсчета фотона низким (около 1% от скорости повторения лазера).
ПРИМЕЧАНИЕ: Эффект Pile-Up описывает эффект фотонов, потерянных при высоких скоростях подсчета фотонов из-за мертвого времени устройств соотнесенного по времени единого фотона (TCSPC). Если Pile-Up происходит, измеренный средний срок службы становится искусственно короче с возможно дополнительным более коротким компонентом, который может появиться в распаде из-за перенапись быстро излучающих фотонов. - Отрегулируйте параметры приобретения, включая время сбора денег (обычно для сбора достаточного количества фотонов требуется от 60 до 180 с).
- Нажмите кнопку «Пуск» и дождись завершения приобретения.
- Сохраните данные.
- Прекратите сканирование образца и выключите детектор.
- Выберите другое поле зрения в образце и повторите шаги 6.14-6.22 или изображение нового слайда микроскопии, повторив шаги 6.1-6.22.
ПРИМЕЧАНИЕ: P. aeruginosa может жить и делить до 6-8 часов при комнатной температуре на агарозной площадке (соответствующей, наконец, 4 удвоения времени при температуре 20 градусов по Цельсию). В идеале, не ждите слишком долго, чтобы выполнить FLIM-FRET измерения, чтобы избежать наблюдения площадку полностью покрыта бактериями.
7. Анализ данных
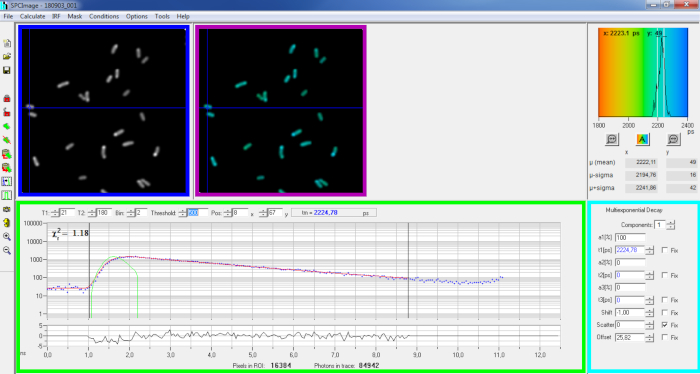
Рисунок 6: Основная панель окна анализа данных программного обеспечения SPCImage. Интенсивность изображения (синий ящик), пожизненное изображение (фиолетовый ящик), пожизненная гистограмма (в правом верхнем направлении), кривая распада в выбранном положении (зеленая коробка) и параметры распада в выбранном положении (голубой ящик) репрезентативного распада PvdA-eGFP, записанного в живой P. aeruginosa с помощью карты приобретения bh SPC830 на самодельных двух-фотон-Excitation-FLIM-FRET. Экспериментальная кривая распада пикселя, указанная на рисунке выше, ее моно-экспоненциальная подгонка (красная кривая), деконволутная распад от ее рассчитанной инструментальной функции реакции (зеленая кривая), можно увидеть в зеленой панели. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Базовый анализ
- Запустите программное обеспечение SPCImage.
- Импорт сохраненный файл SPCM. Интенсивность изображения отображается на левой верхней панели программного обеспечения(рисунок 6 синий ящик).
- Изучите окно кривой распада(рисунок 6 зеленой коробки), которое отображает данные о распаде, соответствующие пикселю, выбранному на изображении интенсивности(рисунок 6 синего ящика). Фотон номера каждого канала времени отображаются как синие точки и припадок распада обращается как красная линия. Обратите внимание, что после загрузки данных программное обеспечение отображает самый яркий пиксель изображения. Переместите синий крест через изображение, чтобы исследовать пиксели с меньшей интенсивностью. Окно распада автоматически обновляется в каждом новом положении пикселей.
ПРИМЕЧАНИЕ: Измерение инструментальной функции реагирования (IRF) системы лазерного сканирования очень трудно. IRF, рассчитанный на основе восходящего края кривых распада флуоресценции в данных FLIM, может быть использован для деконволюции распада. Это вариант, выполненный по умолчанию в SPCimage(рисунок 6 зеленая кривая). - Отрегулируйте диапазон установки, перемещая стартовые и окончание каналов фитинговой коробки (T1 и T2 в зеленой коробке). T1 следует начинать с первых нескольких каналов роста распада и T2 определить последний канал в конце распада и может быть выбран в качестве одного из последних каналов распада с рядом фотонов выше фотоны рассчитывать смещения (т.е. уровни фотонов рассчитывается до распада поднимается).
- Выберите биннинг, изменив значение Bin. Распад кривой интегрирует фотонирование выбранного пикселя вместе с областью i пикселей вокруг положения курсора, определяемого параметром ячеек (увеличение binning увеличит количество фотонов в распаде и может быть полезно для достижения количества фотонов, необходимых для многореациаляциаций моделей).
- Отрегулируйте значение порога. Пиксели, не имеют по крайней мере одного канала с количеством фотонов выше порогового значения, не будут включены в процедуру установки. Конечно, чем больше количество пикселей, чтобы соответствовать, тем дольше анализ.
ПРИМЕЧАНИЕ: Данные FLIM могут содержать огромное количество пикселей и каналов времени. Последние версии программного обеспечения позволяют использовать графический процессор (Graphics Processor Unit) для параллельной обработки большого количества пикселей, что значительно сокращает время обработки. Может быть интересно настроить параметры binning и порога используя изображения соответствующие к конструкциям бактерий exhibiting самая низкая интенсивность флуоресценции (например, с бактериальными напряжениями с самыми низкими уровнями выражения). Это позволит обеспечить, чтобы соответствующие распада, наблюдаемые в этих образцах, соответствовали критериям фильтрации и были включены в анализ. Эти параметры могут быть использованы для всех изображений. - Отрегулируйте, при необходимости, параметры распада (циановая коробка). Пусть сдвиг меняется, большую часть времени рассеяния и смещения могут быть установлены до нуля, если взглянуть на функции распада показывают, что их вклад является незначительным. Смещение можно оценить, глядя на первые каналы распада - обратите внимание, что визуализация в течение длительного времени из-за низкой флуоресценции в образце обычно приводит к ненулевой смещения. Рассеяние происходит в основном в толстых образцах и в противном случае может считаться незначительным.
- Перед запуском пригонки выберите подходящий алгоритм. Откройте окно настроек алгоритма в вариантах модели Show/Hide. Выберите алгоритм максимальной оценки вероятности (MLE)(рисунок 7A).
- Вы запустите установку изображения, нажав на | Decay. После завершения срока службы закодированное изображение FLIM отображается в панели изображений продолжительности жизни(рисунок 6 фиолетовый ящик).
ПРИМЕЧАНИЕ: На окне кривой распада(рисунок 6 зеленый ящик) можно увидеть значение продолжительности жизни, которое соответствует каждому пикселю изображения, перемещая синий крест.
ПРИМЕЧАНИЕ: для автоматической обработки большого количества аналогичных файлов данных FLIM можно использовать режим пакетной обработки. - Проверьте качество подходят глядя на остатки (в идеале распределены случайным образом около 0) и Чи квадратное значение близко к 1.
- Установленные данные могут экспортироваться в различных форматах. Чтобы экспортировать файлы в файлах txt, перейдите на файл | Экспорт. В окне экспортных опционов(рисунок 7B), выберите Выберите все, а затем нажмите Экспорт.
- Наконец сохранить файл анализа. Аналитические файлы сохраняются в качестве файлов и могут быть вновь открыты непосредственно в SPCImage.
ПРИМЕЧАНИЕ: В частности, в случаях несбалансированных количеств доноров/приемов FLIM-FRET может выявить субнаселения в смеси взаимодействующих белковых комплексов- в частности, когда концентрации двух партнеров очень различны, что приводит к смесям сложных и свободных видов. Не взаимодействующие виды (характеризующиеся распадом, очень похожим на только распад донора) могут подвергаться дискриминации со стороны взаимодействующих видов при условии пространственной неразумности компонентов донорской жизни в наборе данных. Аналогичным образом, могут образовываться нестоихометрические взаимодействующие комплексы либо с большим числом доноров, либо с более приемом флуоресценции. Флуоресценции распада таких комплексов, как правило, трудно интерпретировать. Участок диаграммы FLIM может быть использован для предоставления важной информации о стоитиометрии и режимесвязывания ИЦП 20,23. Участок диаграммы FLIM является графическим представлением самого короткого компонента продолжительности жизни в качестве функции его амплитуды. Он может быть использован для визуализации пикселей с аналогичными подписями распада. Чтобы сделать такие представления, экспериментальные распада флуоресценции должны быть оснащены двумя экспоненциальными модели. Следующие шаги могут быть руководством через этот процесс. - Начните с анализа данных донора только строительство. Это позволит определить стоимость жизни донора. В идеале, измерить это значение в течение нескольких изображений, записанных в тех же условиях, как донор / принимает конструкций для получения надежного значения жизни для донора.
- После того, как определяется, подходят флуоресценции распада доноров / приемов конструкций с двух-экспоненциальной модели. В поле параметра цианового распада(рисунок 6),установите количество компонентов до 2. Зафиксировать параметр t2(ps) к надежному значению срока службы донора, определяемому в шаге 1, и проверить коробку, чтобы зафиксировать этот параметр.
ПРИМЕЧАНИЕ: Важно исправить долгоижизненную жизнь No 2 для того, чтобы ограничить чрезмерное приспособление, чтобы улучшить установку конвергенции, и получить более надежные два экспоненциальныхподходят параметры 24,25,26. - Сохранить файл и экспортные данные, как файлы й.asc, как в шаге 7.1.11.
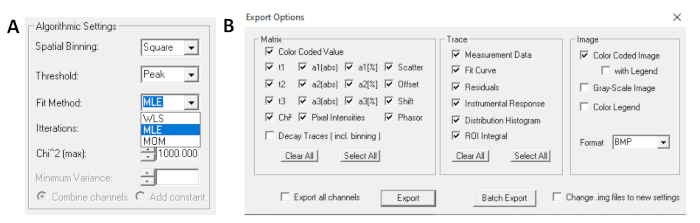
Рисунок 7: (A) Настройки алгоритма для установки распада с экспоненциальными моделями. Выбор MLE (алгоритм максимальной вероятности или оценка максимальной вероятности, MLE) в качестве подходящих моделей и (B) окна экспортных опционов. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
- Расширенный анализ изображений FLIM в R
- Установите R (https://cran.r-project.org) и RStudio (https://rstudio.com) при необходимости.
- Откройте RStudio и создайте новый проект.
- Перемести весь анализ файла в папку под названием "данные" в основной папке проекта.
- Откройте новый файл скрипта (или откройте дополнительный скрипт FLIM_analysis. Р).
- Установите специальный пакет flimDiagRam для анализа данных flim https://github.com/jgodet/flimDiagRam. Позвоните в пакет в рабочем пространстве. (См. уведомление HowTo_FlimDiagRam)
ПРИМЕЧАНИЕ: Установка пакетов должна быть сделана только один раз. После установки пакеты могут быть вызваны из любого нового сеанса R. Загрузка R-пакетов от github требует установки пакета 'devtools'. Установка «девтулов» может занять несколько минут. Пакет flimDiagRam может быть использован для представления параметров и распределения данных FLIM, для извлечения данных FLIM на уровне отдельных индивидуализированных ячеек, для сравнения результатов FLIM в условиях или штаммах и для изучения данных FLIM с использованием передовых инструментов визуализации, таких как график диаграммы FLIM. - Используйте пошаговую прокомментировал код и данные доступны для самостоятельного воспроизведения всех подсемейок, представленных в разделе Результаты представителя ниже. Этот учебник можно найти в уведомлении, HowTo_FlimDiagRam на https://github.com/jgodet/flimDiagRam/blob/master/HowTo.pdf. Код можно легко перенести для анализа данных.
Результаты
Эмпирические кумулятивные функции распределения (ecdf) жизней флуоресценции, измеренные для различных бактериальных штаммов, показаны на рисунке 8. Если ПРОИСХОДИТ ФРЕТ, экдфы смещаются в сторону более короткой продолжительности жизни(рисунок 8A.8B).
Обсуждение
FLIM-FRET предлагает некоторые ключевые преимущества по сравнению с интенсивностью на основе изображений FRET. Срок службы флуоресценции является неотъемлемым параметром флюорофора. Как следствие, он не зависит ни от локальных концентраций фторфоров, ни от интенсивности возбуждения света....
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы признательны д-ру Людовику Ричерту за его ценную помощь в сборе данных FLIM, а также в техническом обслуживании и разработке установки FLIM. Эта работа финансировалась за счет грантов фонда pour la Recherche en Chimie (https://icfrc.fr/). VN финансируется Фондом за Recherche M'dicale (FRM-SPF201809006906). YM признателен Институту Франции (IUF) за поддержку и предоставление дополнительного времени для исследований. IJS и JG признают Институт по доставке наркотиков в Страсбурге за его финансовую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| 525/50 nm band-pass filter | F37-516, AHF, Germany | ||
| 680 nm short pass filter | F75-680, AHF, Germany | ||
| Agarose | Sigma-Aldrich | A9539 | |
| Ammonium Sulfate (NH4)2SO4 | Sigma-Aldrich | A4418 | |
| DreamTaq DNA polymerase 5U/μL | ThermoFisher Scientific | EP0714 | |
| E. coli TOP10 | Invitrogen | C404010 | |
| Fiber-coupled avalanche photo-diode | SPCM-AQR-14- FC, Perkin Elmer | ||
| Glass coverslips (Thickness No. 1.5, 20×20mm | Knitel glass | MS0011 | |
| High-Fidelity DNA polymerase Phusion 2U/μL | ThermoFisher Scientific | F530S | |
| Lysogeny broth (LB) | Millipore | 1.10285 | |
| Magnesium Sulfate Heptahydrate (MgSO4 . 7H2O) | Sigma-Aldrich | 10034-99-8 | |
| Microscope slides (25×75mm) | Knitel glass | MS0057 | |
| NucleoSpin Gel and PCR Clean-up | Macherey-Nagel | 740609.50 | |
| NucleoSpin Plasmid | Macherey-Nagel | 740588.10 | |
| Potassium Phosphate Dibasic (K2HPO4) | Sigma-Aldrich | RES20765 | |
| Potassium Phosphate Monobasic (KH2PO4) | Sigma-Aldrich | P5655 | |
| Sodium Succinate (Disodium) | Sigma-Aldrich | 14160 | |
| SPCImage, SPCM software | Becker & Hickl | ||
| Sterile inoculating loop | Nunc | 7648-1PAK | |
| T4 DNA ligase 1U/μL | ThermoFisher Scientific | 15224017 | |
| TCSPC module | SPC830, Becker & Hickl, Germany | ||
| Ti:Sapphire laser | Insight DeepSee, Spectra Physics | ||
| Tubes 50mL | Falcon | 352070 |
Ссылки
- Braun, P., Gingras, A. C. History of protein-protein interactions: From egg-white to complex networks. Proteomics. 12, 1478-1498 (2012).
- Nooren, I. M. A., Thornton, J. M. Structural characterisation and functional significance of transient protein-protein interactions. Journal of Molecular Biology. 325, 991-1018 (2003).
- Hayes, S., Malacrida, B., Kiely, M., Kiely, P. A. Studying protein-protein interactions: Progress, pitfalls and solutions. Biochemical Society Transactions. 44, 994-1004 (2016).
- Guillon, L., Altenburger, S., Graumann, P. L., Schalk, I. J. Deciphering protein dynamics of the siderophore pyoverdine pathway in Pseudomonas aeruginosa. PLoS ONE. 8, 1-9 (2013).
- Ringel, M. T., Brüser, T. The biosynthesis of pyoverdines. Microbial Cell. 5, 424-437 (2018).
- Schalk, I. J., Rigouin, C., Godet, J. An overview of siderophore biosynthesis among fluorescent Pseudomonads and new insights into their complex cellular organization. Environmental Microbiology. 22, 1447-1466 (2020).
- Cui, Y., et al. Techniques for detecting protein-protein interactions in living cells: principles, limitations, and recent progress. Science China Life Sciences. , (2019).
- Day, R. N., Mazumder, N., Sun, Y., Christopher, K. G. FRET microscopy: Basics, issues and advantages of FLIM-FRET imaging. Springer Series in Chemical Physics. 111, 249-276 (2015).
- Bastiaens, P. I. H., Squire, A. Fluorescence lifetime imaging microscopy: Spatial resolution of biochemical processes in the cell. Trends in Cell Biology. 9, 48-52 (1999).
- Yasuda, R. Imaging spatiotemporal dynamics of neuronal signaling using fluorescence resonance energy transfer and fluorescence lifetime imaging microscopy. Current Opinion in Neurobiology. 16, 551-561 (2006).
- Tramier, M., Zahid, M., Mevel, J. -. C., Masse, M. -. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry Pairs to Donor Photobleaching on FRET Determination by Fluorescence Lifetime Imaging Microscopy in Living Cells. Microscopy Research and Technique. 71, 146-157 (2008).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A guide to fluorescent protein FRET pairs. Sensors (Switzerland). 16, 1-24 (2016).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends in Biochemical Sciences. 32, 407-414 (2007).
- Leray, A., et al. Optimized protocol of a frequency domain fluorescence lifetime imaging microscope for fret measurements. Microscopy Research and Technique. 72, 371-379 (2009).
- Elson, D. S., et al. Real-time time-domain fluorescence lifetime imaging including single-shot acquisition with a segmented optical image intensifier. New Journal of Physics. 6, 1-13 (2004).
- Rajoria, S., Zhao, L., Intes, X., Barroso, M. FLIM-FRET for Cancer Applications. Current Molecular Imaging. 3, 144-161 (2014).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nature Methods. 8, 393-399 (2011).
- Visca, P., Ciervo, A., Orsi, N. Cloning and nucleotide sequence of the pvdA gene encoding the pyoverdin biosynthetic enzyme L-ornithine N5-oxygenase in Pseudomonas aeruginosa. Journal of Bacteriology. 176, 1128-1140 (1994).
- Imperi, F., Visca, P. Subcellular localization of the pyoverdine biogenesis machinery of Pseudomonas aeruginosa: A membrane-associated 'siderosome'. FEBS Letters. 587, 3387-3391 (2013).
- Gasser, V., et al. In cellulo FRET-FLIM and single molecule tracking reveal the supra-molecular organization of the pyoverdine bio-synthetic enzymes in Pseudomonas aeruginosa. Quarterly Reviews of Biophysics. , 1-11 (2019).
- Rietsch, A., Mekalanos, J. J. Metabolic regulation of type III secretion gene expression in Pseudomonas aeruginosa. Molecular Microbiology. 59, 807-820 (2006).
- Herrero, M., De Lorenzo, V., Timmis, K. N. Transposon vectors containing non-antibiotic resistance selection markers for cloning and stable chromosomal insertion of foreign genes in gram-negative bacteria. Journal of Bacteriology. 172, 6557-6567 (1990).
- Godet, J., Mély, Y. Exploring protein-protein interactions with large differences in protein expression levels using FLIM-FRET. Methods and Applications in Fluorescence. 8, 014007 (2019).
- El Meshri, S. E., et al. Role of the nucleocapsid domain in HIV-1 gag oligomerization and trafficking to the plasma membrane: A fluorescence lifetime imaging microscopy investigation. Journal of Molecular Biology. 427, 1480-1494 (2015).
- Becker, W. The bh TCSPC Handbook. Scanning. , 1 (2010).
- Richert, L., Didier, P., de Rocquigny, H., Mély, Y. Monitoring HIV-1 protein oligomerization by FLIM FRET microscopy. Springer Series in Chemical Physics. , 111 (2015).
- Fereidouni, F., Blab, G. A., Gerritsen, H. C. Phasor based analysis of FRET images recorded using spectrally resolved lifetime imaging. Methods and Applications in Fluorescence. 2, (2014).
- Fereidouni, F., Gorpas, D., Ma, D., Fatakdawala, H., Marcu, L. Rapid fluorescence lifetime estimation with modified phasor approach and Laguerre deconvolution: a comparative study. Methods and Applications in Fluorescence. 5, 035003 (2017).
- Margineanu, A., et al. Screening for protein-protein interactions using Förster resonance energy transfer (FRET) and fluorescence lifetime imaging microscopy (FLIM). Scientific Reports. 6, (2016).
- Guzmán, C., Oetken-Lindholm, C., Abankwa, D. Automated High-Throughput Fluorescence Lifetime Imaging Microscopy to Detect Protein-Protein Interactions. Journal of Laboratory Automation. 21, 238-245 (2016).
- Liu, W., Cui, Y., Ren, W., Irudayaraj, J. Epigenetic biomarker screening by FLIM-FRET for combination therapy in ER+ breast cancer. Clinical Epigenetics. 11, 1-9 (2019).
- Liu, X., et al. Fast fluorescence lifetime imaging techniques: A review on challenge and development. Journal of Innovative Optical Health Sciences. 12, 1-27 (2019).
- Padilla-Parra, S., Auduge, N., Coppey-Moisan, M., Tramier, M. Non fitting based FRET-FLIM analysis approaches applied to quantify protein-protein interactions in live cells. Biophysical Reviews. 3, 63-70 (2011).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95, 2976-2988 (2008).
- Stringari, C., et al. Phasor approach to fluorescence lifetime microscopy distinguishes different metabolic states of germ cells in a live tissue. Proceedings of the National Academy of Sciences of the United States of America. 108, 13582-13587 (2011).
- Digman, M. A., Caiolfa, V. R., Zamai, M., Gratton, E. The phasor approach to fluorescence lifetime imaging analysis. Biophysical Journal. 94, 14-16 (2008).
- Liang, Z., Lou, J., Scipioni, L., Gratton, E., Hinde, E. Quantifying nuclear wide chromatin compaction by phasor analysis of histone Förster resonance energy transfer (FRET) in frequency domain fluorescence lifetime imaging microscopy (FLIM) data. Data in Brief. 30, 105401 (2020).
- Grimm, J. B., Heckman, L. M., Lavis, L. D. The chemistry of small-molecule fluorogenic probes. Progress in Molecular Biology and Translational Science. 113, (2013).
- Li, L., Sun, H. Next Generation of Small-Molecule Fluorogenic Probes for Bioimaging. Biochemistry. 59, 216-217 (2020).
- Yao, R., Ochoa, M., Yan, P., Intes, X. Net-FLICS: fast quantitative wide-field fluorescence lifetime imaging with compressed sensing - deep learning approach. Light: Science and Applications. 8, 1-7 (2019).
- Smith, J. T., et al. Fast fit-free analysis of fluorescence lifetime imaging via deep learning. Proceedings of the National Academy of Sciences of the United States of America. 116, 24019-24030 (2019).
- Yao, R., Ochoa, M., Intes, X., Yan, P. Deep compressive macroscopic fluorescence lifetime imaging. Proceedings - International Symposium on Biomedical Imaging. 2018, 908-911 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены