需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
活细菌中蛋白质-蛋白质相互作用的FLIM-FRET测量。
摘要
我们在此描述一个协议,使用FLIM-FRET测量来描述活 伪多 西诺萨中两种高度不同的表达蛋白之间的蛋白质-蛋白质相互作用。该协议包括细菌菌株结构、细菌固定、成像和成像后数据分析程序。
摘要
蛋白质-蛋白质相互作用(PPI)控制细胞中的各种关键过程。荧光寿命成像显微镜 (FLIM) 与 Fürster 共振能量转移 (FRET) 相结合,提供有关活细胞中 PPI 的准确信息。FLIM-FRET 依靠测量 FLIM 图像每个像素的 FRET 捐赠者的荧光寿命衰减,提供有关 PPI 及其空间细胞组织的定量和准确信息。我们在此为 FLIM-FRET 测量提出了详细的协议,我们用于监测活的伪多 多 尼亚亚鲁吉诺萨的 PPI,在两种相互作用的蛋白质用非常不同的拷贝数表示的特定情况下,以演示该技术在揭示PPI关键特征方面的质量和鲁棒性。该协议详细描述了 PPI 表征的所有必要步骤 - 从细菌突变结构到最终分析,使用最近开发的工具,为直接解释复杂的 FLIM-FRET 数据提供高级可视化可能性。
引言
蛋白质-蛋白质相互作用(PPI)控制细胞1中的各种关键过程。PPI的作用因蛋白质组成、亲缘功能和细胞2中的位置而不同。PPI可以通过不同的技术3进行调查。例如,共免疫沉淀是一种相对简单、可靠且廉价的技术,常用工具来识别或确认 PPI。然而,当相互作用的蛋白质表达水平较低,或者相互作用是瞬态的或仅在特定环境中相关时,研究PPI可能具有挑战性。研究在P.aeruginosa中皮奥弗丁通路的不同酶之间发生的PPI要求释放一般铁共因子抑制剂毛皮的抑制,使皮奥弗丁通路的所有蛋白质的表达在细胞4、5、6中表达。这种对通路所有蛋白质的共同调节导致细胞中的及时表达,预期促进其相互作用。这种代谢途径的大小、性质、表达水平和蛋白质数量的多样性使得在重组系统6中难以研究。因此,在细胞环境中探索PPI对于进一步了解蛋白质在本土环境中的生物功能至关重要。
只有少数方法,包括荧光,允许探索PPI在活细胞7。在可以测量的不同荧光参数中,荧光寿命(即荧光团在发射光子之前保持兴奋状态的平均时间)可能是活细胞中最有趣的参数之一。荧光团的荧光寿命对氟化物的环境高度敏感,因此,FLIM可以提供有关荧光团周围环境的化学或物理信息。这包括在荧光"捐赠者"的短距离存在荧光的"接受器"时可能发生的Fürster共振能量转移(FRET)。能量转移显著缩短了供体荧光寿命(图1A),使荧光寿命成像显微镜(FLIM)成为直接在活细胞中探索蛋白质-蛋白质相互作用的有力方法。FLIM还可以提供有关在细胞7、8中相互作用发生位置的空间信息。这种方法对于在两个相互作用的伙伴的荧光标记可能的情况下调查PPI非常强大。
对于F FRET发生 - 两个荧光团之间的距离的关键条件需要8,9。两个荧光团之间不应相距超过 10 nm。因此,在设计FLIM-FRET实验时,必须谨慎行事,以确保荧光的供体和接受方有机会在相互作用的复合体中彼此靠近。虽然这似乎有限制,但事实上,它是真正的优势,因为F FRET的远距离依赖性确保了两个标签的蛋白质进行F FRET必须物理相互作用(图1A)。因此,在结肠化实验中获得关于PPI的清晰答案(两种结肠化蛋白质不一定相互作用)的困难不是使用FLIM-FRET的问题。
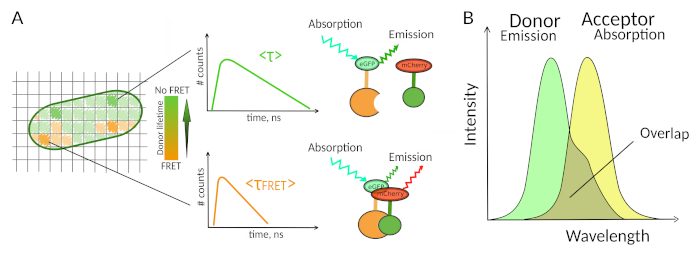
图1:FLIM-FRET分析原理。FLIM-FRET 多维图像的每个像素都包含有关在此特定位置记录的荧光衰减的信息(#counts = 通道 t 中检测到的光子数量)。(A) FLIM 图像的经典表示形式通常是一个假彩色寿命编码的 2D 图像(左)。在F FRET存在的情况下,可以观察到捐赠者平均荧光寿命的降低,这可以从颜色刻度的变化中观察到,并且对该空间区域中PPI的存在有信息性。(B) 供体发射谱与接受方吸收光谱之间的重叠是F FRET发生所必需的。 请单击此处查看此图的较大版本。
FRET 的第二个要求是供体的排放光谱和接受方的吸收光谱应重叠8(图 1B)。供体荧光激发的波长对接受器的直接荧光激发贡献很小。不是所有的荧光团组合都是可能的,我们还建议优先使用单一过期荧光衰变的捐赠者,以方便FLIM-FRET解释10。几对荧光蛋白夫妇满足这些要求,包括流行的eGFP-mCherry夫妇11(如审查可用荧光蛋白F FRET对的调色板见12,13)。
FLIM-FRET 允许测量 FRET 捐赠者在 FLIM 图像的每个像素的荧光寿命衰减(图 1A)。在采集和分析方面,有两种确定荧光寿命的主要技术:频域 (FD)14 和时域 (TD)。TD FLIM 是更广泛的,并使用脉冲照明结合不同的可能的检测配置,包括浇注方法15,条纹相机16 或时间相关的单光子计数 (TCSPC) 技术8。对于 FD 和 TD 技术,荧光寿命不是直接测量的,而是需要对测量数据进行分析,以估计寿命或相互作用的存在。对于 TCSPC 技术,使用最广泛的分析依赖于使用单指数函数或多指数函数对衰减进行拟合,使用最少的方形迭代重卷积,从而最大限度地减少残差的加权和。
最后,FLIM-FRET 可以通过使用单光子或多光子激动来执行。最新的有几个优点,如减少自荧光和光伤害的焦点平面。多光子激发也允许更长的激发深度,如果工作在厚3D样本8。相反,单光子激发通常效率更高,因为荧光蛋白的两光子吸收横截面是有限的17。
在这里,我们提出了一个协议,在两种相互作用的蛋白质(PvdA和PvdL)的特例中,FLIM-FRET测量PPI,用非常不同数量的拷贝表达,以证明该技术在揭示PPI关键特征方面的质量和鲁棒性。PvdA 和 PvdL 蛋白质参与皮奥弗丁生物合成。PvdA 是一种 L-ornithine N5-氧酶,通过羟基化 (PvdA) 和相化 (PvdF)18从 L-ornithine 合成 L-N5-formyl-N5-羟基磷酸烷。PvdL 是一种非核糖体肽合成 (NRPS) 酶,由四个模块组成。第一个模块催化甲酸的催化。第二个模块催化L-Glu的激活及其凝结到三元共体。然后,第三个模块凝结L-Tyr氨基酸,然后在D-Tyr中异构。最后,第四个模块结合L-Dab(硅丁酸)氨基酸,形成丙烯酸三肽L-Glu/D-Tyr/L-Dab6。因此,PvdL 负责合成皮多非丁前体的三个第一个氨基酸。PvdA蛋白与PvdL的相互作用令人惊讶,因为与PvdI和PvdJ相反,PvdL没有携带一个特定于L-N5-formyl-N5-羟基诺尼辛的模块。这种相互作用表明,所有负责皮奥弗丁前体生物合成的酶都排列在大型瞬态和动态多酶复合物19、20中。
在这份报告中,我们详细解释了如何构建本地表达两种相互作用的eGFP和mCherry标记蛋白的细菌菌株。我们还描述了有效 FLIM-FRET 细胞成像的样品制备和条件。最后,我们提出了图像分析的分步教程,包括最近开发的工具,为直接解释复杂的 FLIM-FRET 数据提供了高级可视化可能性。通过这份报告,我们不仅想说服冒险,而且让大多数生物学家相信,FRET-FLIM是一种易于访问和强大的技术,能够直接在本地细胞环境中解决他们关于PPI的问题。
研究方案
1. 质粒结构
- 通过两个PCR(PCR1和3)放大的700个碱基对的DNA序列( 使用P.aeruginosa PAO1的基因组DNA),这些碱基对与 P.aeruginosa 基因组中具有高保真DNA聚合酶的插入位点相对应的区域的上下游。将限制位点添加到蓝色和绿色的底像,并将 mCherry 的重叠序列添加到红色底像(图 2)。
- 对于在 C 术语上标有 eGFP 的 PvdA,放大上游 700 bp 区域相对于蓝色底流,并放大包含带底头的 700 bp 下游区域,并用绿色底法放大停止 codon。
- 对于在 N-术语用 mCherry 标记的 PvdL,将上游 700 bp 区域放大到 PvdL 基因(包括启动 codon)时,由蓝色底数放大 700 bp 下游区域,用绿色底板放大 700 bp 下游区域。
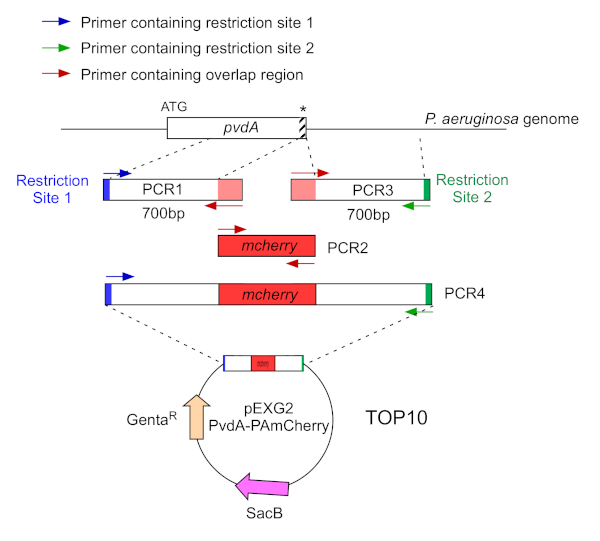
图2:用于PvdA-mCherry的PCR策略和质粒结构概述。 有关详细信息,请参阅文本 - pvdA 编码一种酶,其中涉及铁习得的二次代谢物)的侧罗福罗韦丁的生物合成。 请单击此处查看此图的较大版本。
- 用红色底塑素与高保真DNA聚合酶放大eGFP编码DNA(无启动和停止编码子)。
- 在 PCR 清理列(材料表)上净化 PCR产品。
- 以等价比混合重叠的 PCR 产品,并使用用于 PCR 1 和 3 的限制站点的底像执行第二个 PCR(图 2 中的绿色和蓝色)。
- 将PCR产品迁移至阿加罗斯-1x TAE(三联基醋酸EDTA pH 8.0)凝胶中,切割相应的带子,用PCR清理套件(材料表)提取安培。
注意:可以在这里暂停协议。 - 使用相应的限制性酶21消化PCR安培和pEXG2质粒。
- 使用 90 ng 质粒和分子比 1:1(质粒:插入)将质粒与 T4 DNA 结扎酶一起镀金和插入。
- 通过混合结扎产品和100μL的TOP10,在化学上称职的细胞中转化质粒结构,大肠杆菌 TOP10 细胞。在冰上孵育合格的细菌/质粒混合物30分钟,然后进行42°C的热冲击60秒。然后,将管子放在冰上10分钟。
- 将1 mL的菌质汤(LB)加入细菌中,在37°C下孵育1小时。
- 含有 15 μg/mL 根霉素的 LB 汞上的板 100 μL 细菌。
- 在37°C下孵育过夜。
- 筛选由菌落PCR的插入物的存在:从一个孤立的转化菌群,拿起一分钟细菌添加到PCR混合物中,含有质剂杂交质粒的方式,这样,通过运行在阿加罗斯凝胶(DNA聚合酶)上的产品,可以检测到安培糖的存在。从用于PCR的同一菌落中,将少量含有15μg/mL根霉素的新鲜板上转移,进行分离,用于质粒提取。最后,分离和纯化质粒(材料表),通过测序验证刀片。
- 在-80°C的1.5 mL微管中储存含有LB质粒的 TOP10 细菌,在-20°C 中将纯化质粒储存在 -20°C 中。
注意:可以在这里暂停协议
2. 荧光标签插入到P.aeruginosa的染色体基因组中(图3)
- 生长P.aeruginosa,TOP10和大肠杆菌帮助细菌,每一个在5mL的LB没有抗生素在30°C下轨道震动过夜22。通过将质粒从大肠杆菌 TOP10 转移到 PAO1 菌株中,通过同源重组将质粒整合到基因组中,在P. aeruginosa的基因组中生成荧光标记插入。第二个交叉事件消除向量生成相应的突变体。
- 测量细菌培养的 600 nm (OD600 nm)的光学密度,并混合 同等数量的 P. aeruginosa (500 μL, OD600 nm = 1.0), 带 大肠杆菌 TOP10 pEXG2(500 μL,OD600 nm = 1.0) 和大肠杆菌 HB101 pRK600 帮助器(500 μL,OD600 nm = 1.0),在 1.5 mL 微管中。
- 在 9,300 x g 下离心 5 分钟 ,以对细菌进行颗粒。
注:在线工具可用于将离心 g 力转换为每分钟旋转 (rpm)以调整离心机速度。 - 保留细菌颗粒并丢弃上一液。
- 在50μL的LB中重新暂停含有细菌的颗粒。
- 将混合物的一个点(±50μL)在LB agar中间(37°C预热)上,并在37°C下孵育5小时。
- 用无菌接种回路刮掉该点,并在 1 mL 的 LB 中重新暂停。
- 板 100 μL 这种细菌悬浮液在含有 10 μg/mL 氯霉素的 LB 汞上消除E. 大肠杆菌(大肠杆菌TOP10 pEXG2和大肠杆菌HB101 pRK600 帮助剂对氯霉素敏感,但 P. aeruginosa具有天然耐药性)和 30 μg/mL 根霉素,并在 37 °C 下孵育 2 天。
- 在1 mL LB中重新暂停一个菌落,并在轨道震动4h下在37°C下孵育。
- 在 9,300 x g 下离心 3 分钟 ,丢弃 950 μL 的上一液。将颗粒重新放入 50 μL 中,将含有蔗糖的 LB 汞上的混合物分离,且不含 NaCl。
- 在30°C孵育过夜。
- 在含有 15 mg/mL 根霉素的 LB agar 和 LB 阿加上发现分离菌落,以检查根霉素的敏感性。
- 验证 PCR 菌落(DNA 聚合酶)的 eGFP 或 mCherry 插入,并使用特定的底转进行测序。
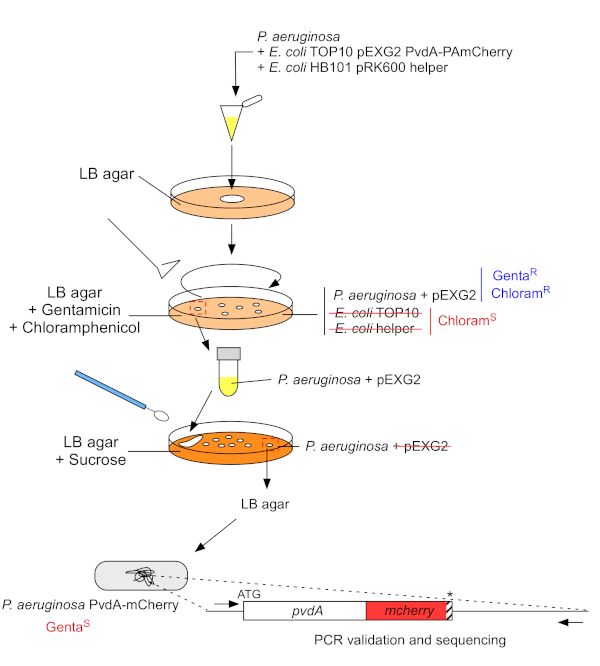
图3:通过荧光 标签插入构建P.aeruginosa 菌株的协议。 有关详细信息,请参阅文本。 请单击此处查看此图的较大版本。
3. 皮罗弗丁测量
- 在轨道震动下,在30°C下在5mL中生长细菌。
- 通过离心,洗涤和生长在5 mL的SM(吸乳中等, 成分: 6 g+L+1 K2HPO4, 3 g +L+1 KH2PO4, 1 g+L+1 (NH4)2 SO4, 0.2 g=L+1 MgSO4,7H2O 和 4 g+L+1 钠,pH 调整为 7.0,在 30°C 下在轨道震动过夜时加入 NaOH)。SM是一种缺铁的介质 - 铁的缺乏会激活在铁存在的情况下通常压抑的皮过丁通路蛋白质的表达。
- 测量OD600 nm, 在OD600 nm = 0.1的新鲜SM介质 中再次稀释细菌,并在轨道震动过夜下以30°C生长。
- 测量 OD600 nm 以确定每个样品中的细菌数量。
- 制备含有 100 μL 的 P. aeruginosa 培养的石英库,并完整至 1 mL 的 SM (900 μL)。准备含有 1 mL SM 介质(空白)的石英盒。
- 使用紫外可见分光光度计,在吸收峰值的最大值测量吸收度。在 pH 7.0 时,皮多丁的最大吸收量将发生在 ±400 nm。使用啤酒-兰伯特定律,使用 400 nm e = 19 000M-1=cm-1的摩尔灭绝系数确定样品中的皮多丁(阿波形式)浓度。
注:在吸光量范围从 ±0.1 到 ±1(取决于 UV 可见分光光度计)范围内,可对皮罗弗丁进行量化,其中吸收度随浓度线性增加。
4. 细菌培养和细胞表达PvdA、PvdL和PvdJ的条件
- 在第1天,从适当的甘油储存细菌中接种5 mL的管,并在轨道摇床培养箱中以30°C的速度在夜间以30°C的速度生长细菌。
- 在第2天,颗粒细胞以3,000 x g 的离心3分钟,丢弃上经剂。
- 在 SM 的 10 mL 中重新发送细胞。
- 重复步骤 4.2-4.3 一次,在 30 °C 200 rpm 下在 SM 中隔夜生长细菌。
- 在第3天,稀释1/10的细菌培养在新鲜的SM。
- 在相同条件下,在一夜之间再次生长稀释的细菌。
注:在生长中的介质中,可以直观地检测出皮乌弗丁的存在。结果表明,皮多弗丁通路蛋白的表达已被激活,感兴趣的酶正在细胞中表达。
5. 制备加糖垫 (图4)
- 将显微镜玻璃滑梯放在平坦的水平表面上。在初始幻灯片的每一侧排列两层玻璃滑梯,上面贴着两层胶带。
注:在三个对齐的幻灯片之间保持 1-2 mm 的空间,以防止带电的气糖最终用胶带在幻灯片上扩散。 - 在玻璃滑梯上滴液,将70μL的1%熔化的气糖滴。在顶部添加第四张幻灯片,将阿加罗斯液滴压平,然后轻轻按下。等一下
- 脱下上部滑梯,用移液器将大约 3 μL 的细菌放入不同位置的 3 到 4 个点,放入 agarose 垫上。
- 盖有显微镜玻璃盖玻片(例如 22x22 mm #1.5 厚度)。
注:盖玻片的平整度和厚度对于处理双光子激动非常重要。具有可控均匀平坦度和低自荧光的精密盖玻片通常是不错的选择。 - 用融化的石蜡固定盖玻片,将盖玻片密封在玻璃滑梯上。首先固定盖玻片的四个角。
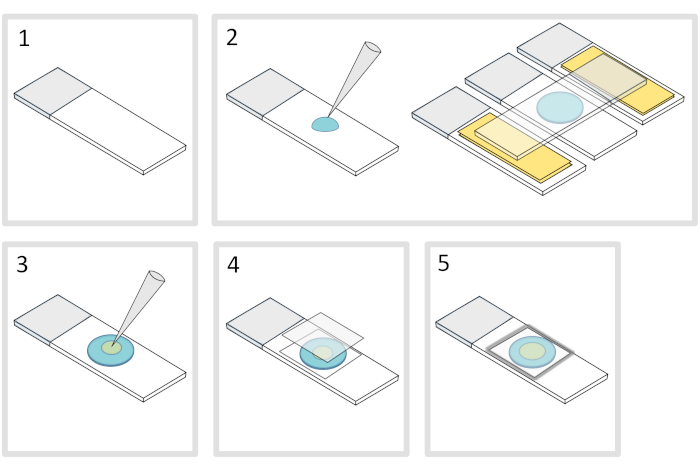
图4:阿加罗斯垫准备。请单击此处查看此图的较大版本。
6. 双光子显微镜设置成像
注:我们使用的是一种由60x1.2NA水浸目标在去扫描荧光收集模式下操作的家用双光子激发扫描倒置显微镜。双光子激发波长设置为 930 nm。它由 Ti:Sapphire 激光器(80 MHz 重复速率,≈ 70 fs 脉冲宽度)提供,工作功率为 10-20 mW。荧光光子通过 680 nm 短通滤波器和 525/50 nm 带通滤波器收集,然后被引导到连接到时间相关的单光子计数 (TCSPC) 模块的光纤耦合雪崩光电二极管。显微镜还配备了透光灯。几台 FLIM-FRET 显微镜现已投入商业使用,许多成像设备都配备了能够执行 FLIM-FRET 测量的装置。
- 使用荧光灯将目标对焦于样品中的细菌单层,并选择感兴趣的区域。
- 检查激发激光快门是否关闭,来自激光的红外光是否被阻挡,并且是否进入显微镜。
注意:应小心注意和保持持续警惕,使用红外脉冲激光器,因为眼睛无法看到激光,但任何甚至瞬态的直接反射或激光反射可能极其有害,并造成不可逆的眼损伤。在使用显微镜设置之前,请参阅当地的激光安全程序和培训。 - 将显微镜幻灯片放在舞台上,盖玻片朝向目标。
- 检查荧光灯是否打开。
- 转动滤芯转塔以选择 eGFP 立方体并打开荧光灯快门。
- 将荧光灯向显微镜的目镜发送。
注意:确保将适当的滤光器在光路中释放来自荧光灯的直接激发光,这些荧光灯可能会损坏眼睛。 - 使用显微镜旋钮将目标聚焦在细菌上。
- 使用控制电动阶段的操纵手柄进行平移,选择样品中感兴趣的区域
注:使用高荧光样品,可以直接用眼睛看到荧光,从而更容易对焦。 - 切换 2PE 激光器的激发,进行 FLIM-FRET 测量。
- 将荧光发射路径送回探测器。
- 将滤波立方体炮塔转回 930 nm 激光器的二色立方体。
- 将激光功率设置为 20 mW。
- 将感兴趣区域的大小设置为 30 μm。此操作可调整高光镜的电压,并定义其运动范围(图 5)。
- 打开探测器并开始扫描样品 - 控制扫描的启动和停止按钮还控制激光快门的打开和关闭,以出于安全考虑并限制样品的光漂白(图5)。
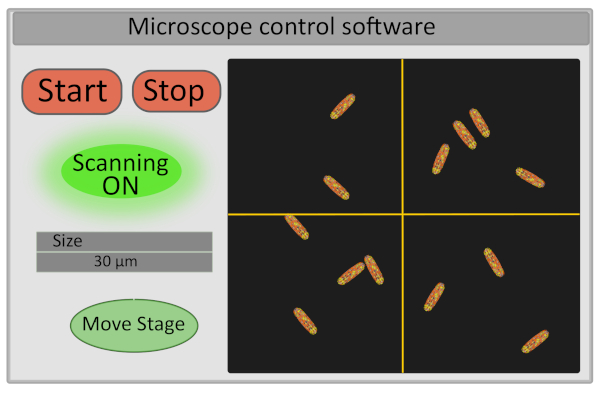
图5:显微镜控制软件界面的示意图。请单击此处查看此图的较大版本。
- 如有必要,通过稍微移动显微镜精细对焦旋钮来调整对焦。
- 通过从计算机界面微调舞台,选择图像的视场。这可以通过在设置上移动图像上的十字在显微镜控制软件(图5),将定义图像的新中心,并按下移动 阶段。一个好的采集视野对应于一个图像与10-30不动的细菌,所有正确聚焦(所有细菌都在同一平面上)。如果有兴趣提取单细胞FLIM-FRET数据,确保细菌的个性化良好(图像分割将更容易)。
- 打开 SPCM 软件(用于数据采集的商业软件),检查光子计数率是否过高,以避免可能影响寿命测量的堆积效应。如有必要,降低激光强度以保持光子计数率低(约为激光重复率的 1%)。
注:桩上效应描述由于时间相关单光子计数 (TCSPC) 器件的死时,光子在高光子计数速率下丢失的影响。如果发生 Pile-Up,测量的平均寿命将人工缩短,并可能因快速发光光子过采样而在衰变中出现额外的更短分量。 - 调整采集参数,包括采集收集时间(通常需要 60s 到 180 s 才能收集足够的光子)。
- 按 "开始 "按钮,等待采集完成。
- 保存数据。
- 停止扫描样品并关闭探测器。
- 在样本中选择另一个视场,重复步骤 6.14-6.22,或者通过重复步骤 6.1-6.22 来成像新的显微镜幻灯片。
注: 在加罗斯垫的室温下,P. aeruginosa 可以生活和分割长达 6-8 小时(在 20°C 下,最后为 +4 倍时间)。理想情况下,不要等待太久,以执行FLIM-FRET测量,以避免观察完全覆盖细菌的垫。
7. 数据分析
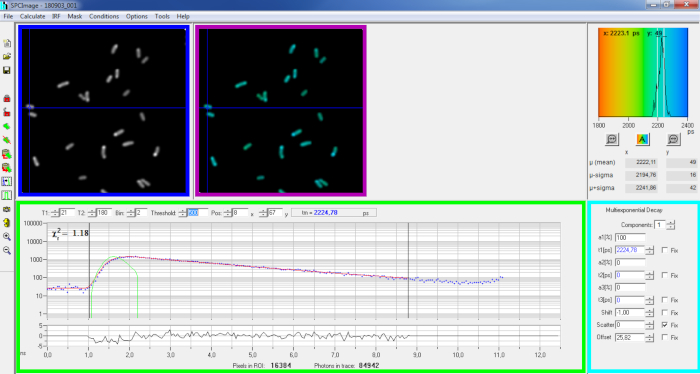
图6:SPCImage软件数据分析窗口的主面板。强度图像(蓝色框)、终身图像(紫色框)、寿命直方图(右上)、选定位置的衰减曲线(绿色框)和选定位置(青色盒)的衰减参数,使用在自用的二光激励-FLIM-FRET 设置上使用 bh SPC830 采集卡在实时 P. aeruginosa 中记录的具有代表性的 PvdA-eGFP 衰减值。上图中指向的像素的实验衰减曲线,其单指数拟合(红色曲线)从计算的仪器响应函数(绿色曲线)中去旋转,可以在绿色面板中看到。 请单击此处查看此图的较大版本。
- 基本分析
- 运行 SPCImage 软件。
- 导入保存的 SPCM 文件。强度图像显示在软件的左上面板上(图6 蓝色 框)。
- 检查衰减曲线窗口(图 6 绿色框),该窗口显示与强度图像中所选像素对应的衰减数据(图 6 蓝色框)。每个时间通道的光子编号显示为蓝点,衰减的拟合绘制为红线。请注意,加载数据后,软件将显示图像最亮的像素。在图像上移动蓝色十字以检查强度较低的像素。衰减窗口将自动刷新每个新像素位置。
注:测量激光扫描系统的仪器响应功能 (IRF) 非常困难。从 FLIM 数据中荧光衰减曲线的上升沿计算的 IRF 可用于衰减减卷。这是默认情况下在 SPCimage 中完成的选项(图 6 绿色曲线)。 - 通过移动管接头的起动和结束通道(绿色箱中的 T1 和 T2)来调整管接头范围。T1 应从上升衰减的左几个通道开始,T2 定义衰减结束时的最后一个通道,并可以选择作为衰变的最后通道之一,光子计数偏移量以上的光子数量(即衰减上升前计数的光子水平)。
- 通过更改 Bin 值选择 装箱 。曲线衰减将所选像素的光子计数与 bin 参数定义的光标位置周围的 i 像素区域集成在一起(增加装箱将增加衰减中的光子数量,并且可能有助于达到多指数模型所需的光子计数)。
- 调整阈 值 。安装过程中将不包括至少一个信道的像素,其光子数高于阈值。当然,要拟合的像素数越高,分析时间越长。
注:FLIM 数据可以包含大量像素和时间通道。该软件的最后版本允许使用 GPU(图形处理器单元)并行处理大量像素,从而大大减少了处理时间。使用与荧光强度最低的细菌结构对应的图像(例如,表达水平最低的细菌菌株)调整装箱和阈值参数可能很有趣。这将确保这些样品中观察到的相关衰变符合过滤标准,并将包含在分析中。然后,这些参数可用于所有图像。 - 如有必要,调整衰减参数(青色盒)。让移位变化,大多数时间散射和偏移可以固定为零,如果看看衰减函数显示,它们的贡献可以忽略不计。偏移量可以估计看衰减的第一个通道 - 请注意,由于样品中荧光度低,成像时间很长一段时间通常会导致非零偏移。散射主要发生在厚样品中,否则可以忽略不计。
- 在运行拟合之前,选择拟合算法。在"显示/隐藏模型 选项"中打开算法设置窗口。选择最大可能性估计 (MLE) 算法(图 7A)。
- 通过单击"计算"和"衰减"矩阵|拟合。完成后,终身编码的 FLIM 图像将显示在生存期图像面板(图6紫色框)。
注:在衰减曲线窗口(图 6 绿色框)上,通过移动蓝色十字可以查看对应于图像每个像素的生存期值。
注:要自动处理大量类似的FLIM数据文件,可以使用批处理模式。 - 检查看残差(理想随机分布于 0 左右)和接近 1 的 Chi 平方值的拟合质量。
- 拟合数据可以以不同格式导出。若要导出 txt 文件中的文件,请转到文件|导出。在"导出选项"窗口中(图 7B),选择"全部",然后单击"导出"。
- 最后保存分析文件。分析文件保存为 *.img 文件,可以直接在 SPCImage 中重新打开。
注:在捐赠者/接受者数量不平衡的情况下,FLIM-FRET可以揭示相互作用的蛋白质复合物的混合物中的亚种群,特别是在两个伙伴的浓度非常不同时,从而产生复杂和自由物种的混合物。非相互作用物种(其特征与仅捐赠者的衰变非常相似)可以区分为相互作用物种,假设整个数据集中供体寿命成分的空间不变。同样,可能与更多的捐赠者或更多的荧光接受器形成非计量相互作用复合物。这种复合物的荧光衰变通常难以解释。FLIM 图图图可用于提供有关PPI 20、23的计量和绑定模式的批判性信息。FLIM 图图图是最短寿命分量的图形表示,作为其振幅的函数。它可用于可视化具有类似衰减特征的像素。要得出这样的表示,实验荧光衰减必须装有两个指数模型。以下步骤可以指导完成此过程。 - 首先分析仅供体结构的数据。这将允许确定捐赠者的终身价值。理想情况下,在与捐赠者/接受方结构相同的条件下记录的多个图像上测量此值,以检索捐赠者的稳健终身值。
- 一旦确定,与双指数模型配合供体/接受器结构的荧光衰减。在青色衰减参数框中(图6),将组件数设置为2。将 t2(ps) 参数固定到步骤 1 中确定的捐赠者的健壮生存期值,并选中此框以修复此参数。
注:为了限制过位,改善拟合收敛,并获得更可靠的双指数拟合参数24、25、26,修复寿命+2非常重要。 - 保存 *img 文件 并导出数据为 *.asc 文件 ,如步骤 7.1.11 中。
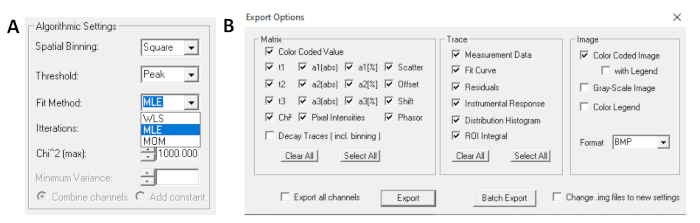
图7:(A)算法设置,用于使用指数模型拟合衰减。选择 MLE(最大可能性算法或最大可能性估计,MLE)作为拟合模型,和 (B) 导出选项窗口。 请单击此处查看此图的较大版本。
- R 中 FLIM 图像的高级分析
- 如有必要,安装 R(https://cran.r-project.org)和 RStudio(https://rstudio.com) 。
- 打开 RStudio 并创建新项目。
- 在项目主 文件夹中的名为" 数据"的文件夹中移动所有分析 *.asc 文件。
- 打开新的脚本文件(或打开补充脚本FLIM_analysis。R)。
- 安装专用的 flimDiagRam 封装,用于进行https://github.com/jgodet/flimDiagRam。在工作区中调用包。(见通知HowTo_FlimDiagRam)
注意:安装包只需完成一次。安装后,可以从任何新的 R 会话调用包。从 github 下载 R 包需要安装"devtools"包。安装"开发工具"可能需要几分钟时间。 flimDiagRam 封装可用于表示 FLIM 数据的参数和分布,在单个个性化单元级别提取 FLIM 数据,比较跨条件或菌株的 FLIM 结果,并使用 FLIM 图等高级可视化工具探索 FLIM 数据。 - 使用分步注释的代码,并提供数据以独立复制下面"代表结果"部分中显示的所有子数字。本教程可以在通知中找到HowTo_FlimDiagRam https://github.com/jgodet/flimDiagRam/blob/master/HowTo.pdf。 代码可以很容易地转置来分析数据。
结果
图8显示了为不同细菌菌株测量的荧光寿命的累积分布函数(ecdf)。如果出现F FRET,ecdfs 将转向寿命较短的寿命(图8A,8B)。请注意,当两种蛋白质的相互作用导致两个荧光团之间的长距离时,不会发生 FRET(图 8C)。这种情况不能与在《国际气候》中两个伙伴之间缺乏互动区分开来。因此,当无法从分子模型或复合...
讨论
与基于强度的 FRET 成像相比,FLIM-FRET 具有一些关键优势。荧光寿命是荧光的固有参数。因此,它既不依赖于局部浓度的荧光团,也不依赖于光激发的强度。此外,荧光寿命也受到光漂白的影响。特别有趣的是,在细胞中,局部蛋白质的浓度在整个亚细胞隔间或区域中具有高度异质性。FLIM-FRET 也很有趣,在所有复杂浓度低的情况下,因为蛋白质或其中一种蛋白质的表达水平都很低。
披露声明
作者没有什么可透露的。
致谢
我们感谢卢多维奇·里赫特博士在 FLIM 数据采集以及 FLIM 设置的技术维护和开发方面提供的宝贵帮助。这项工作的资金来自奇米基金会(https://icfrc.fr/)。VN由墨西哥教育基金会(FRM+SPF201809006906)资助。基督教青年会感谢法国大学研究所(IUF)的支持和提供更多时间专门从事研究。IJS和JG感谢斯特拉斯堡药物供应研究所的财政支持。
材料
| Name | Company | Catalog Number | Comments |
| 525/50 nm band-pass filter | F37-516, AHF, Germany | ||
| 680 nm short pass filter | F75-680, AHF, Germany | ||
| Agarose | Sigma-Aldrich | A9539 | |
| Ammonium Sulfate (NH4)2SO4 | Sigma-Aldrich | A4418 | |
| DreamTaq DNA polymerase 5U/μL | ThermoFisher Scientific | EP0714 | |
| E. coli TOP10 | Invitrogen | C404010 | |
| Fiber-coupled avalanche photo-diode | SPCM-AQR-14- FC, Perkin Elmer | ||
| Glass coverslips (Thickness No. 1.5, 20×20mm | Knitel glass | MS0011 | |
| High-Fidelity DNA polymerase Phusion 2U/μL | ThermoFisher Scientific | F530S | |
| Lysogeny broth (LB) | Millipore | 1.10285 | |
| Magnesium Sulfate Heptahydrate (MgSO4 . 7H2O) | Sigma-Aldrich | 10034-99-8 | |
| Microscope slides (25×75mm) | Knitel glass | MS0057 | |
| NucleoSpin Gel and PCR Clean-up | Macherey-Nagel | 740609.50 | |
| NucleoSpin Plasmid | Macherey-Nagel | 740588.10 | |
| Potassium Phosphate Dibasic (K2HPO4) | Sigma-Aldrich | RES20765 | |
| Potassium Phosphate Monobasic (KH2PO4) | Sigma-Aldrich | P5655 | |
| Sodium Succinate (Disodium) | Sigma-Aldrich | 14160 | |
| SPCImage, SPCM software | Becker & Hickl | ||
| Sterile inoculating loop | Nunc | 7648-1PAK | |
| T4 DNA ligase 1U/μL | ThermoFisher Scientific | 15224017 | |
| TCSPC module | SPC830, Becker & Hickl, Germany | ||
| Ti:Sapphire laser | Insight DeepSee, Spectra Physics | ||
| Tubes 50mL | Falcon | 352070 |
参考文献
- Braun, P., Gingras, A. C. History of protein-protein interactions: From egg-white to complex networks. Proteomics. 12, 1478-1498 (2012).
- Nooren, I. M. A., Thornton, J. M. Structural characterisation and functional significance of transient protein-protein interactions. Journal of Molecular Biology. 325, 991-1018 (2003).
- Hayes, S., Malacrida, B., Kiely, M., Kiely, P. A. Studying protein-protein interactions: Progress, pitfalls and solutions. Biochemical Society Transactions. 44, 994-1004 (2016).
- Guillon, L., Altenburger, S., Graumann, P. L., Schalk, I. J. Deciphering protein dynamics of the siderophore pyoverdine pathway in Pseudomonas aeruginosa. PLoS ONE. 8, 1-9 (2013).
- Ringel, M. T., Brüser, T. The biosynthesis of pyoverdines. Microbial Cell. 5, 424-437 (2018).
- Schalk, I. J., Rigouin, C., Godet, J. An overview of siderophore biosynthesis among fluorescent Pseudomonads and new insights into their complex cellular organization. Environmental Microbiology. 22, 1447-1466 (2020).
- Cui, Y., et al. Techniques for detecting protein-protein interactions in living cells: principles, limitations, and recent progress. Science China Life Sciences. , (2019).
- Day, R. N., Mazumder, N., Sun, Y., Christopher, K. G. FRET microscopy: Basics, issues and advantages of FLIM-FRET imaging. Springer Series in Chemical Physics. 111, 249-276 (2015).
- Bastiaens, P. I. H., Squire, A. Fluorescence lifetime imaging microscopy: Spatial resolution of biochemical processes in the cell. Trends in Cell Biology. 9, 48-52 (1999).
- Yasuda, R. Imaging spatiotemporal dynamics of neuronal signaling using fluorescence resonance energy transfer and fluorescence lifetime imaging microscopy. Current Opinion in Neurobiology. 16, 551-561 (2006).
- Tramier, M., Zahid, M., Mevel, J. -. C., Masse, M. -. J., Coppey-Moisan, M. Sensitivity of CFP/YFP and GFP/mCherry Pairs to Donor Photobleaching on FRET Determination by Fluorescence Lifetime Imaging Microscopy in Living Cells. Microscopy Research and Technique. 71, 146-157 (2008).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A guide to fluorescent protein FRET pairs. Sensors (Switzerland). 16, 1-24 (2016).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends in Biochemical Sciences. 32, 407-414 (2007).
- Leray, A., et al. Optimized protocol of a frequency domain fluorescence lifetime imaging microscope for fret measurements. Microscopy Research and Technique. 72, 371-379 (2009).
- Elson, D. S., et al. Real-time time-domain fluorescence lifetime imaging including single-shot acquisition with a segmented optical image intensifier. New Journal of Physics. 6, 1-13 (2004).
- Rajoria, S., Zhao, L., Intes, X., Barroso, M. FLIM-FRET for Cancer Applications. Current Molecular Imaging. 3, 144-161 (2014).
- Drobizhev, M., Makarov, N. S., Tillo, S. E., Hughes, T. E., Rebane, A. Two-photon absorption properties of fluorescent proteins. Nature Methods. 8, 393-399 (2011).
- Visca, P., Ciervo, A., Orsi, N. Cloning and nucleotide sequence of the pvdA gene encoding the pyoverdin biosynthetic enzyme L-ornithine N5-oxygenase in Pseudomonas aeruginosa. Journal of Bacteriology. 176, 1128-1140 (1994).
- Imperi, F., Visca, P. Subcellular localization of the pyoverdine biogenesis machinery of Pseudomonas aeruginosa: A membrane-associated 'siderosome'. FEBS Letters. 587, 3387-3391 (2013).
- Gasser, V., et al. In cellulo FRET-FLIM and single molecule tracking reveal the supra-molecular organization of the pyoverdine bio-synthetic enzymes in Pseudomonas aeruginosa. Quarterly Reviews of Biophysics. , 1-11 (2019).
- Rietsch, A., Mekalanos, J. J. Metabolic regulation of type III secretion gene expression in Pseudomonas aeruginosa. Molecular Microbiology. 59, 807-820 (2006).
- Herrero, M., De Lorenzo, V., Timmis, K. N. Transposon vectors containing non-antibiotic resistance selection markers for cloning and stable chromosomal insertion of foreign genes in gram-negative bacteria. Journal of Bacteriology. 172, 6557-6567 (1990).
- Godet, J., Mély, Y. Exploring protein-protein interactions with large differences in protein expression levels using FLIM-FRET. Methods and Applications in Fluorescence. 8, 014007 (2019).
- El Meshri, S. E., et al. Role of the nucleocapsid domain in HIV-1 gag oligomerization and trafficking to the plasma membrane: A fluorescence lifetime imaging microscopy investigation. Journal of Molecular Biology. 427, 1480-1494 (2015).
- Becker, W. The bh TCSPC Handbook. Scanning. , 1 (2010).
- Richert, L., Didier, P., de Rocquigny, H., Mély, Y. Monitoring HIV-1 protein oligomerization by FLIM FRET microscopy. Springer Series in Chemical Physics. , 111 (2015).
- Fereidouni, F., Blab, G. A., Gerritsen, H. C. Phasor based analysis of FRET images recorded using spectrally resolved lifetime imaging. Methods and Applications in Fluorescence. 2, (2014).
- Fereidouni, F., Gorpas, D., Ma, D., Fatakdawala, H., Marcu, L. Rapid fluorescence lifetime estimation with modified phasor approach and Laguerre deconvolution: a comparative study. Methods and Applications in Fluorescence. 5, 035003 (2017).
- Margineanu, A., et al. Screening for protein-protein interactions using Förster resonance energy transfer (FRET) and fluorescence lifetime imaging microscopy (FLIM). Scientific Reports. 6, (2016).
- Guzmán, C., Oetken-Lindholm, C., Abankwa, D. Automated High-Throughput Fluorescence Lifetime Imaging Microscopy to Detect Protein-Protein Interactions. Journal of Laboratory Automation. 21, 238-245 (2016).
- Liu, W., Cui, Y., Ren, W., Irudayaraj, J. Epigenetic biomarker screening by FLIM-FRET for combination therapy in ER+ breast cancer. Clinical Epigenetics. 11, 1-9 (2019).
- Liu, X., et al. Fast fluorescence lifetime imaging techniques: A review on challenge and development. Journal of Innovative Optical Health Sciences. 12, 1-27 (2019).
- Padilla-Parra, S., Auduge, N., Coppey-Moisan, M., Tramier, M. Non fitting based FRET-FLIM analysis approaches applied to quantify protein-protein interactions in live cells. Biophysical Reviews. 3, 63-70 (2011).
- Padilla-Parra, S., Audugé, N., Coppey-Moisan, M., Tramier, M. Quantitative FRET analysis by fast acquisition time domain FLIM at high spatial resolution in living cells. Biophysical Journal. 95, 2976-2988 (2008).
- Stringari, C., et al. Phasor approach to fluorescence lifetime microscopy distinguishes different metabolic states of germ cells in a live tissue. Proceedings of the National Academy of Sciences of the United States of America. 108, 13582-13587 (2011).
- Digman, M. A., Caiolfa, V. R., Zamai, M., Gratton, E. The phasor approach to fluorescence lifetime imaging analysis. Biophysical Journal. 94, 14-16 (2008).
- Liang, Z., Lou, J., Scipioni, L., Gratton, E., Hinde, E. Quantifying nuclear wide chromatin compaction by phasor analysis of histone Förster resonance energy transfer (FRET) in frequency domain fluorescence lifetime imaging microscopy (FLIM) data. Data in Brief. 30, 105401 (2020).
- Grimm, J. B., Heckman, L. M., Lavis, L. D. The chemistry of small-molecule fluorogenic probes. Progress in Molecular Biology and Translational Science. 113, (2013).
- Li, L., Sun, H. Next Generation of Small-Molecule Fluorogenic Probes for Bioimaging. Biochemistry. 59, 216-217 (2020).
- Yao, R., Ochoa, M., Yan, P., Intes, X. Net-FLICS: fast quantitative wide-field fluorescence lifetime imaging with compressed sensing - deep learning approach. Light: Science and Applications. 8, 1-7 (2019).
- Smith, J. T., et al. Fast fit-free analysis of fluorescence lifetime imaging via deep learning. Proceedings of the National Academy of Sciences of the United States of America. 116, 24019-24030 (2019).
- Yao, R., Ochoa, M., Intes, X., Yan, P. Deep compressive macroscopic fluorescence lifetime imaging. Proceedings - International Symposium on Biomedical Imaging. 2018, 908-911 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。