A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الأبقار المبيض القشرة الأنسجة الثقافة
In This Article
Summary
في المختبر ثقافة قشرة المبيض البقري وتأثير الغذائية درج خطوة النظام الغذائي على البيئة الدقيقة المبيض هو تقديم. تم استزراع قطع قشرة المبيض لمدة سبعة أيام وتم تقييم المنشطات والسيتوكينات ومراحل الجريب. وكان العلاج النظام الغذائي درج الخطوة زيادة تولد الستيرويد مما أدى إلى تطور الجريب في الثقافة.
Abstract
تطور الجريبات من المرحلة البدائية إلى المرحلة الأنترالية هو عملية ديناميكية داخل قشرة المبيض ، والتي تشمل عوامل الغدد الصماء والباراكرين من الخلايا الجسدية والتواصل بين الخلايا الركامية. لا يعرف الكثير عن البيئة المجهرية المبيض وكيف تؤثر السيتوكينات والمنشطات المنتجة في الوسط المحيط على تطور الجريب أو الاعتقال. في المختبر ثقافة قشرة المبيض تمكن بصيلات لتطوير في بيئة طبيعية التي لا تزال مدعومة من قبل ستروما المجاورة. كان هدفنا هو تحديد تأثير النظام الغذائي الدرج الخطوة الغذائية على البيئة الدقيقة المبيض (تطوير المسام, الستيرويد, وإنتاج السيتوكين) من خلال الثقافة المختبرية من قشرة المبيض البقري. ولتحقيق ذلك، أزيلت قطع قشرية المبيض من الهيفرات التي تخضع لنظامين مختلفين تم تطويرهما غذائيا قبل البلوغ: التحكم (تطوير التغذية التقليدية) ودرج الخطوة (التغذية وتقييد أثناء التنمية) التي تم قطعها إلى ما يقرب من 0.5-1 ملم3 قطع. تم تمرير هذه القطع في وقت لاحق من خلال سلسلة من يغسل ووضعها على إدراج ثقافة الأنسجة التي يتم تعيينها في بئر تحتوي على وسيلة ثقافة وايموث. تم استزراع قشرة المبيض لمدة 7 أيام مع تغييرات وسائل الإعلام الثقافية اليومية. تم إجراء قسم النسيج لتحديد التغيرات مرحلة الجريب قبل وبعد الثقافة لتحديد آثار التغذية وتأثير الثقافة دون علاج إضافي. تم تجميع القشرة الثقافة المتوسطة على مدى أيام لقياس المنشطات, نواتج الأيض الستيرويد, والسيتوكينات. كانت هناك ميول لزيادة هرمونات الستيرويد في البيئة الدقيقة المبيض التي سمحت لتطور الجريب في الثقافات درج الخطوة مقابل التحكم قشرة المبيض. تسمح تقنية ثقافة قشرة المبيض بفهم أفضل للبيئة الدقيقة المبيضية ، وكيف يمكن أن تؤثر التعديلات في إفراز الغدد الصماء على تطور الجريب ونموه من كل من العلاجات الحية وفي المختبر. قد تكون طريقة الثقافة هذه مفيدة أيضا لاختبار العلاجات المحتملة التي قد تحسن تطور الجريب لدى النساء لتعزيز الخصوبة.
Introduction
تمثل قشرة المبيض الطبقة الخارجية للمبيض حيث يحدث تطور الجريبات1. سيتم تنشيط بصيلات البدائية ، التي تم القبض عليها في البداية في التنمية ، لتصبح بصيلات أولية أو ثانوية أو ثلاثية بناء على مدخلات الباراكرين والغدد الصماء1و2و3و4. لفهم العمليات الفسيولوجية داخل المبيض بشكل أفضل ، يمكن استخدام زراعة الأنسجة كنموذج في المختبر ، مما يسمح لبيئة خاضعة للرقابة بإجراء التجارب. وقد استخدمت العديد من الدراسات زراعة أنسجة المبيض للبحوث في التكنولوجيا الإنجابية بمساعدة, الحفاظ على الخصوبة, وسرطان المبيض5,6,7. وقد عملت أيضا زراعة أنسجة المبيض كنموذج للتحقيق في السموم الإنجابية التي تضر بصحة المبيض ومسببات الاضطرابات التناسلية مثل متلازمة المبيض المتعدد الكيسات (PCOS)8و9و10و11. وبالتالي، ينطبق هذا النظام الثقافي على مجموعة واسعة من التخصصات.
في القوارض ، تم استخدام النجن الجنيني أو ما حول الولادة في تجارب البيولوجيا الإنجابية12،13،14،15. ومع ذلك، لا يمكن استزراع النجانات من الماشية المحلية الكبيرة كأعضاء كاملة بسبب حجمها الكبير وانحطاطها المحتمل. لذلك ، يتم قطع قشرة المبيض الرئيسيات غير البشرية إلى قطع أصغر16،17،18. وقد استزراع العديد من الدراسات قطع قشرة المبيض الصغيرة لدراسة عوامل النمو المختلفة (ق) في بدء الجريب البدائي في الماشية المنزلية والرئيسيات غير البشرية1،17،18،19. وقد أظهر استخدام ثقافة قشرة المبيض أيضا بدء الجريبات البدائية في غياب المصل للقطع القشرية البقرية والرئيسيات المستزرعة لمدة 7 أيام20. يانغ وفورتشن في عام 2006 تعامل الجنين قشرة المبيض ثقافة المتوسطة مع مجموعة من جرعات التستوستيرون على مدى 10 أيام، ولاحظ أن تركيز10-7 M من هرمون تستوستيرون زيادة تجنيد الجريب، والبقاء على قيد الحياة، وزيادة تطور بصيلات المرحلة المبكرة19. في عام 2007 ، وذلك باستخدام ثقافات قشرة المبيض من الأجنة البقرية (5-8 أشهر من الحمل) ، يانغ وفورتشن ذكرت دورا في عامل النمو البطانية الوعائية ألف (VEGFA) في المرحلة الانتقالية الأولية إلى الثانوية بصيلات21. وعلاوة على ذلك، استخدم مختبرنا ثقافات قشرة المبيض لإظهار كيف يمكن لأشكال VEGFA (الأوعية، ومضادات الأوعية، والجمع) تنظيم مسارات نقل الإشارات المختلفة من خلال مستقبلات مجال كيناز (KDR)، وهو مستقبل نقل الإشارات الرئيسي الذي يربط VEGFA16. سمحت هذه المعلومات بفهم أفضل لكيفية تأثير أشكال VEGFA المختلفة على مسارات الإشارات للحصول على تطور الجريب أو الاعتقال. معا, زراعة قطع قشرة المبيض في المختبر مع المنشطات المختلفة أو عوامل النمو يمكن أن يكون المقايسة قيمة لتحديد الآثار على الآليات التي تنظم تولد الجريبية. وبالمثل، قد تكون الحيوانات التي يتم تطويرها على أنظمة غذائية مختلفة قد غيرت البيئات الدقيقة المبيضية، والتي قد تعزز أو تمنع تكوين الجريبات التي تؤثر على النضج الإنجابي للإناث. وهكذا، هدفنا في المخطوطة الحالية هو الإبلاغ عن تقنية ثقافة قشرة البقر وتحديد ما إذا كانت هناك اختلافات في البيئات الدقيقة المبيض بعد الثقافة المختبرية من قشرة البقر من heifers تغذية إما التحكم أو درج الخطوة الوجبات الغذائية التي تم جمعها في 13 شهرا من العمر كما هو موضح سابقا16.
لذلك ، كانت خطوتنا التالية هي تحديد البيئة الدقيقة المبيض في هذه الهيفر التي تم تطويرها مع الوجبات الغذائية المختلفة. قمنا بتقييم قشرة المبيض من heifers تتغذى إما مع درج الخطوة أو السيطرة على النظام الغذائي. وعرضت الضوابط heifers حمية صيانة 97.9 غرام / كغ0.75 لمدة 84 يوما. بدأ النظام الغذائي درج الخطوة في 8 أشهر تحتوي على نظام غذائي تغذية مقيدة من 67.4 غرام / كجم0.75 لمدة 84 يوما. بعد الأيام ال 84 الأولى ، في حين واصلت السيطرة heifers لتلقي 97.9 غرام / كغ0.75، وعرضت على درج خطوة لحوم البقر heifers 118.9 غرام / كجم0.75 لمدة 68 يوما أخرى ، وبعد ذلك تم استئصال المبيضين في 13 شهرا من سن16 لدراسة التغيرات في المراحل الجريبية ومورفولوجيا قبل وبعد الثقافة. نحن أيضا المقايسة للاختلافات في المنشطات, نواتج الأيض الستيرويد, chemokines, والسيتوكينات تفرز في وسائل الإعلام القشرة. تم قياس المنشطات وغيرها من الأيض لتحديد ما إذا كان هناك أي آثار مباشرة من العلاجات التي أجريت في الجسم الحي و / أو في المختبر على صلاحية الأنسجة والإنتاجية. قدمت التغيرات في البيئة الدقيقة المبيض قبل وبعد الثقافة لمحة عن بيئة الغدد الصماء وتولد الجريبات قبل الثقافة وكيف تؤثر الثقافة أو العلاج أثناء الثقافة على تطور الجريب أو الاعتقال.
تم جمع المبيضين بعد إجراء استئصال المبيضين في الولايات المتحدة. مركز أبحاث اللحوم الحيوانية (USMARC) وفقا لإجراءات IACUC من التحكم ودرج الخطوة heifers في 13 شهرا من العمر16، وتنظيفها مع المحلول الملحي العازلة الفوسفات العقيمة (PBS) يغسل مع 0.1 ٪ من المضادات الحيوية لإزالة الدم والملوثات الأخرى ، قلصت الأنسجة الزائدة ، ونقلها إلى جامعة نبراسكا لينكولن (UNL) مختبر علم وظائف الأعضاء التناسلية UNL في 37°C23 . في UNL، قطعت قطع قشرة المبيض إلى قطع مربعة صغيرة (~ 0.5-1 مم3؛ الشكل 1) ومثقف لمدة 7 أيام (الشكل 2). وقد أجريت الأنسجة على الشرائح ثقافة القشرة قبل وبعد الثقافة لتحديد مراحل بصيلات16،24 (الشكل 3 والشكل 4) ، والبروتينات مصفوفة خارج الخلية التي قد تشير إلى التليف (بيكو سيروس الأحمر ، PSR ؛ الشكل 5). سمح هذا بتحديد تأثير الأنظمة الغذائية في الجسم الحي على مراحل الجريب وسمح بالمقارنة بين 7 أيام من قشرة المبيض على مراحل الجريب وتطور الجريب. في جميع أنحاء الثقافة ، تم جمع الوسط وتغييره يوميا (تم جمع حوالي 70٪ من الوسائط كل يوم ؛ 250 ميكرولتر / بئر) بحيث يمكن تقييم الهرمونات اليومية / السيتوكينات / chemokines أو تجميعها على مدى أيام للحصول على متوسط التركيزات. المنشطات مثل أندروستينديون (A4) والاستروجين (E2) يمكن تجميعها على مدى 3 أيام وتقييمها من خلال التصوير الإشعاعي (ريا; الشكل 6) وتجمع على مدى 4 أيام لكل و المقايسة عن طريق قياس الطيف السائل كروماتوغرافيا الكتلة عالية الأداء (HPLC-MS)24،25 ( الجدول1). واستخدمت صفائف السيتوكين لتقييم تركيزات السيتوكين والكيموكين في زراعة قشرة المبيضالمتوسطة 26 (الجدول 2). في الوقت الحقيقي البوليميراز سلسلة من ردود الفعل (RT-PCR) وأجريت لوحات المقايسة لتحديد التعبير الجيني لمسارات نقل إشارة محددة كما هو موضح سابقا16. كل من الستيرويد, السيتوكين, مرحلة الجريب وعلامات النسيجية توفير لقطة من البيئة المجهرية المبيض والقرائن على قدرة تلك البيئة الدقيقة لتعزيز "طبيعية" أو "غير طبيعية" تولد الجريبية.
Protocol
تم الحصول على المبيضين من مركز أبحاث اللحوم الأمريكي16. كما ذكر سابقا16، تمت الموافقة على جميع الإجراءات من قبل لجنة رعاية الحيوان واستخدامها التابعة للمركز الأمريكي لبحوث الحيوانات اللحوم (USMARC) وفقا لدليل رعاية واستخدام الحيوانات الزراعية في البحوث الزراعية والتدريس. تم إحضار المبيضين إلى مختبر الإنجاب في جامعة نبراسكا لينكولن حيث تم تجهيزهما واستزراعهما.
1. إعداد وسائل الإعلام المطلوبة
-
وايموث ميغابايت 752/1 المتوسطة
- ملء زجاجة 1 لتر زراعة الأنسجة مع 900 مل من الماء العقيم. في حين أن الماء هو اثارة بلطف على لوحة اثارة، إضافة تدريجيا المتوسطة مسحوق. بمجرد إذابة الوسط المجفف، أضف 2.24 غرام من بيكربونات الصوديوم تليها 1.25 غرام من ألبوم مصل البقر (BSA). استخدم مقياس درجة الحموضة وضبط درجة الحموضة إلى 7.25-7.35. أضف ماء معقم إضافي لرفع الحجم النهائي إلى 1 لتر.
- الانتقال إلى خزانة السلامة البيولوجية وإضافة كبريتات البنسلين-ستريبتومايسين بتركيز 0.1٪ v/v من الوسط. تصفية المتوسطة مع 0.22 ميكرومتر المسام 33.2 سم2 500 مل زجاجة أعلى مرشح.
- صب قبالة المتوسطة المصفاة في عدة أنابيب مخروطية 50 مل. إضافة 0.5 مل من الأنسولين-نقل-السيلينيوم لكل 50 مل من المتوسطة المقتبسة.
- التفاف أنابيب مخروطية وزجاجة الأسهم من المتوسط في رقائق الألومنيوم وتخزينها في 4 °C. هذه الوسيلة حساسة للضوء.
ملاحظة: يمكن تخزين وسيطة Waymouth لمدة تصل إلى شهر واحد.
-
ليبوفيتز L-15 (LB-15) المتوسطة
ملاحظة: يستخدم LB-15 المتوسطة لتنظيف الأنسجة استعدادا للثقافة.- ملء زجاجة 1 لتر زراعة الأنسجة مع 900 مل من الماء العقيم. في حين أن الماء العقيم هو اثارة بلطف على لوحة اثارة، إضافة تدريجيا المتوسطة مسحوق المعدة. استخدم مقياس درجة الحموضة وضبط درجة الحموضة إلى 7.25-7.35. أضف ماء معقم إضافي لرفع الحجم النهائي إلى 1 لتر.
- الانتقال إلى خزانة السلامة البيولوجية. جعل 1 لتر من LB-15 مع 0.1٪ المضادات الحيوية(انظر جدول المواد ). تصفية المتوسطة إلى اثنين من زجاجات زراعة الأنسجة 500 مل باستخدام 0.22 ميكرومتر المسام 33.2 سم2 500 مل زجاجة أعلى مرشح. التفاف زجاجات في رقائق الألومنيوم كما LB-15 المتوسطة حساسة للضوء وتخزينها في 4 °C.
ملاحظة: يمكن تخزين وسيط LB-15 لمدة تصل إلى شهر واحد.
-
ملحي الفوسفات المخزنة مؤقتا (PBS)
- جعل برنامج تلفزيوني في المختبر أو شراء برنامج تلفزيوني عقيمة دون الكالسيوم أو المغنيسيوم (جدول المواد). لجعل برنامج تلفزيوني في المختبر، تبدأ مع 800 مل من الماء المقطر وإضافة 8 غرام من كلوريد الصوديوم (NaCl) لذلك. ثم أضف 0.2 غرام من كلوريد البوتاسيوم (KCl)، و 1.44 غرام من فوسفات الصوديوم ديباسيك (Na2HPO4)،و 0.24 غرام من فوسفات البوتاسيوم ديباسيك (KH2PO4). ضبط درجة الحموضة إلى ~ 7.4 وضبط إجمالي حجم إلى 1 L. تعقيم الحل عن طريق الالاستعباد التلقائي.
- جعل 1 L PBS مع 0.1٪ المضادات الحيوية(انظر جدول المواد ) بينما في خزانة السلامة البيولوجية.
2. بروتوكول ثقافة القشرية المبيض
ملاحظة: تم الحصول على المبيضين من الربيع ولدت USMARC heifers في 13 شهرا من العمر. تم شطف المبيضين جيدا، وأزيلت جميع الدم والسوائل الأخرى مع برنامج تلفزيوني يحتوي على المضادات الحيوية (0.1٪) ونقلها في 37 درجةمئوية23 إلى جامعة نبراسكا لينكولن مختبر الاستنساخ UNL (1.5 ساعة بعيدا). (للحصول على تعليقات حول درجة حرارة المبيضين أثناء النقل يرجى الاطلاع على المناقشة)
- إعداد أنسجة المبيض على مقاعد البدلاء نظيفة (الشكل 1).
- تطهير مقاعد البدلاء نظيفة مع الإيثانول 70٪. ضع وسادة ماصة جديدة على سطح المقعد. تأكد من تشغيل منفاخ مقاعد البدلاء النظيف قبل نصف ساعة من تشريحه إلى جانب ضوء الأشعة فوق البنفسجية لتعقيم أي شيء في المقعد النظيف ، بما في ذلك وسادة ماصة والتأكد من استخدام معدات الوقاية الشخصية المناسبة.
- ترتيب أطباق بيتري (60 × 15 ملم) لغسل الأنسجة. هناك حاجة إلى ثلاثة أطباق بيتري لغسل برنامج تلفزيوني، وثلاثة لبرنامج تلفزيوني مع المضادات الحيوية، وثلاثة لغسل LB-15. سيتم استخدام طبق بيتري إضافي يحتوي على LB-15 مع غطاء مصاحب لوضع القطع النهائي بعد الغسل.
- ملء كل طبق بيتري مع ما يقرب من 10 مل من السوائل المناسبة، إما PBS أو LB-15.
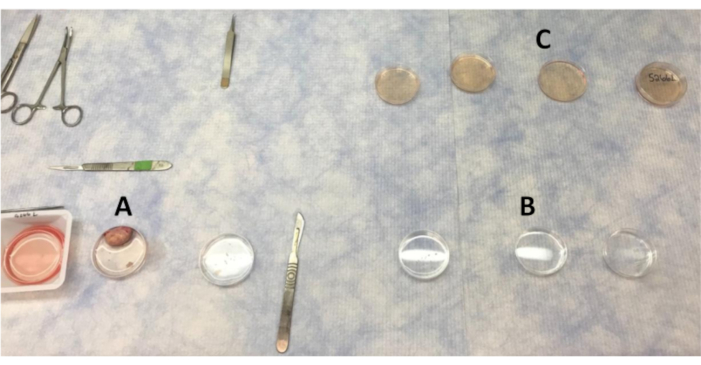
الشكل 1:تخطيط لوحات لغسل المبيض وقطع القشرة في مقاعد البدلاء نظيفة. (أ) برنامج تلفزيوني يستخدم لغسل المبيض كما تتم إزالة أجزاء من القشرة. (ب) برنامج تلفزيوني مع يغسل المضادات الحيوية التي يتم نقل قطع القشرة من خلال. (ج)يتم غسل قطع قشرة المبيض أربع مرات في LB-15 قبل الانتقال إلى خزانة السلامة الحيوية لغسل النهائي في LB-15. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
- إزالة إعداد Waymouth وLB-15 المتوسطة من الثلاجة ودافئة لدرجة حرارة الغرفة.
- أوتوكلاف جميع الأدوات لضمان التعقيم قبل الاستخدام.
- الحفاظ على المبيضين عند 37 درجة مئويةحتى تصبح قشرة المبيض جاهزة للجمع.
- باستخدام ملقط مع الفكين مسننة، والتقاط المبيض وغسل تماما في أول طبق بيتري مليئة PBS. نقل المبيض إلى غسل PBS الثاني وتطهير تماما مرة أخرى.
ملاحظة: سيبقى المبيض في مغسلة PBS الثانية أثناء إزالة الشرائط القشرية المبيضية. - باستخدام ملقط الفك مسننة، وتأمين المبيض وشريحة في النصف. في هذا الوقت، سوف قشرة المبيض قطع بعيدا عن النخاع. باستخدام مسطرة، تأكد من إزالة ما لا يزيد عن 1-2 مم من عمق سطح المبيض بعيدا عن النخاع16. إزالة المقاطع العرضية من قشرة المبيض من النخاع، وقطع 3-4 شرائح رقيقة من قشرة المبيض(الشكل 2)مع مشرط (# 11 مشرط شفرة؛ # 3 مقبض)، ووضع الشرائط في طبق بيتري الثالثة مليئة PBS.
ملاحظة: في هذا الوقت، يمكن جمع أنسجة قشرية المبيض إضافية لاستخراج الحمض النووي الريبي أو ثابتة وجمعها لعلم الأنسجة من القطع القشرة غير المستزرعة الأولية. عند إزالة شرائط من قشرة المبيض، تجنب المناطق ذات بصيلات أنترال مرئية أو لوبيا كوربورا. بالإضافة إلى ذلك، تجنب جمع الأنسجة النخاعية. الأنسجة من النخاع يختلف كثيرا كما هو مبين سابقا16. إذا لم يتم قطع قشرة المبيض إلى أكثر من عمق 1-2 مم ، فلا ينبغي الحصول على النخاع. الأنسجة المتميزة تسمح بالمعالم بين القشرة والندولة. - قطع شرائح قشرة المبيض في برنامج تلفزيوني الثالث يغسل إلى قطع صغيرة مربعة (~ 0.5-1 مم3) مع شفرة مشرط # 21. استخدام مسطرة تحت أطباق بيتري لضمان القطع هي من حجم مماثل وسمك لجعل قطع قشرة المبيض متسقة. استخدام ملقط لتأمين شرائط في حين قطع القطع مع مشرط.
ملاحظة: يعتمد عدد قطع الأنسجة المقطوعة على التجربة. أربع قطع من قشرة المبيض هو الحد الأدنى من الأنسجة اللازمة للثقافة. طرق أخرى لضمان طول وعمق المناسبة تشمل استخدام شرائح خاصة26 أو قطع بلاستيكية precut كنماذج27. - غسل قطع المبيض القشرية من خلال كل ثلاثة برنامج تلفزيوني مع أطباق بيتري مليئة بالمضادات الحيوية. استخدام ملقط تلميح منحني لنقل القطع بين يغسل.
- نقل قطع القشرة من خلال سلسلة من يغسل LB-15 ومكان في النهائي LB-15 مملوءة طبق بيتري. تسمية الغطاء مع معرف الحيوان والجانب المبيض (اليسار أو اليمين).
ملاحظة: غمر قطع قشرة المبيض بالكامل في كل غسلة لتنظيفها جيدا. - جمع أربع قطع قشرة المبيض لكل المبيض وإصلاح للأنسجة اليوم صفر. ويمكن أيضا قطع إضافية تكون فلاش المجمدة للجيش الملكي النيبالي. سيتم استخدام قطع الأنسجة المتبقية للثقافة. مسح أسفل أدوات تشريح مع الإيثانول 70٪ بعد كل جمع الأنسجة.
- إعداد خزانة السلامة البيولوجية لغسل الأنسجة النهائي وإعداد الثقافة. تعقيم الإمدادات مع الإيثانول 70٪ قبل وضعها في خزانة السلامة البيولوجية. استخدام تقنية العقيم عند العمل في خزانة السلامة البيولوجية.
- نقل جميع قشرة المبيض المخصصة للثقافة إلى خزانة السلامة البيولوجية وغسل مرة أخرى في طبق بيتري LB-15 مليئة.
- في لوحة زراعة الأنسجة 24 جيدا، ماصة 350 ميكرولتر من وايموث المتوسطة لكل بئر.
- وضع الثقافة غير المصقولة إدراج جيدا في كل بئر باستخدام ملقط. تأكد من عدم تشكل فقاعات تحت قاعدة الإدراج لأن هذا سيؤدي إلى جفاف الأنسجة. يجب أن يكون المتوسط لمس إدراج للسماح للوسط ليتم امتصاصها وتحيط قطع قشرة المبيض.
- وضع بعناية أربع قطع قشرة المبيض على شبكة كل إدراج (الشكل 2). يمكن أن ثقب ملقط شبكة إذا لم يتم وضع قطع الأنسجة بدقة. قطع الأنسجة لا ينبغي أن تلمس بعضها البعض أو الجانب من إدراج.
- احتضان الأنسجة في 37 درجة مئويةمع 5٪ CO216.
ملاحظة: استخدمت آخرين 38.8 درجة مئوية28. ومع ذلك، لم يلاحظ أي فرق في سلامة الأنسجة ولا في قدرة بصيلات للتقدم في 37 °C الأنسجة ولا غيرها39،30. وبالتالي، في هذه المرحلة أي من هذه درجات الحرارة ينبغي أن تكون مواتية لنجاح التجربة. وقد استخدمت آخرون 400 ميكرولتر من المتوسط. أي من المبلغين على ما يرام طالما أن واحدا هو ثابت، والأنسجة مغمورة جزئيا مما يسمح للتوتر السطحي كافية للسماح لترطيب الأنسجة (وسائل الإعلام المحيطة قطع قشرة المبيض). املأ الآبار الفارغة ب 500 ميكرولتر من المياه المعقمة للمساعدة في تقليل التبخر من الآبار الأخرى.

الشكل 2: قطع قشرة المبيض ولوحة الثقافة. (أ) شريط المبيض يجري قطع من قشرة المبيض. (ب)المسطرة وقطعة القشرة هو مبين جنبا إلى جنب. (ج) أربع قطع القشرة (~ 0.5-1 مم3) يستريح على إدراج في وسط الثقافة في لوحة. (د) رفع إدراج لجمع الثقافة المتوسطة من البئر. جمع واستبدال كل ثقافة المتوسطة يوميا (250 ميكرولتر) للحفاظ على pH.About 250 μL السليم يتم الحصول عليها من كل بئر كل يوم (حوالي 70٪ من المتوسط الثقافة الأولية). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. جمع وسائل الإعلام
- تغيير ثقافة قشرة المبيض المتوسطة يوميا لمدة 7 أيام. يجب أن تكون التغييرات المتوسطة أقرب إلى 24 ساعة بعيدا قدر الإمكان لمنع درجة الحموضة الكبيرة وتغيرات اللون في المتوسط. دافئة وايموث المتوسطة إلى 37 درجة مئوية قبل تغيير متوسط. يتم الحصول على حوالي 250 ميكرولتر من كل بئر كل يوم (حوالي 70٪ من متوسط الثقافة الأولي).
- خلال التغييرات المتوسطة، استخدم ملقط لرفع إدراج بلطف من البئر. جمع المتوسطة وايموث المستزرعة في أنابيب 0.5 مل (حوالي 250 ميكرولتر / يوم). تعيين إدراج مرة أخرى في جيدا وإضافة 350 ميكرولتر من الثقافة الطازجة المتوسطة عن طريق الاستغناء عن المتوسط بين جانب إدراج وجيدا.
ملاحظة: تغيير معظم وسائل الإعلام يوميا للحصول على وسائل الإعلام كافية لقياس جميع المنشطات, السيتوكينات, وchemkines اللازمة لتحديد البيئة الدقيقة المبيض. أيضا، التغيرات اليومية المتوسطة مهمة لمنع تغييرات درجة الحموضة الكبيرة (المشار إليها بتغيير اللون) في الوسط. تم الاحتفاظ قطرات من المتوسطة المحيطة قطع قشرة المبيض لضمان القطع لا تزال رطبة. لم تلاحظ أي مشاكل مع الأنسجة المستزرعة بسبب تغيير 70٪ من وسائل الإعلام. - تخزين المتوسطة التي تم جمعها من زراعة الأنسجة في -20 درجة مئوية.
4. التصوير والمعالجة المصب
- بعد 7 أيام من الثقافة في 37 درجة مئويةمع 5٪ CO2،صورة قطع قشرة المبيض باستخدام مجهر تشريح مع كاميرا المرفقة وبرنامج تصوير الكمبيوتر.
ملاحظة: عادة ما تكون الغرفة المظلمة هي الأفضل لتحقيق أفضل جودة للصور للتصوير. - بعد التصوير، إصلاح قطعتين قشرة المبيض لكل بئر في بوينز لعلم الأنسجة وفلاش تجميد قطعتين قشرة المبيض في النيتروجين السائل للحصول على الحمض النووي الريبي لcDNA. كرر هذه الخطوة لجميع الآبار مع الأنسجة. جمع المتوسطة من اليوم 7 وتخزينها في -20 درجة مئوية.
- دع قطع قشرة المبيض تبقى مغمورة في بوينز (حمض بيريك 750 مل، وحمض الخليك الجليدي 50 مل، و37٪-40٪ من الفورمالين 250 مل) لمدة 1.5 ساعة تقريبا قبل غسلها بالإيثانول بنسبة 70٪ ثلاث مرات. ستبقى الأنسجة في الإيثانول بنسبة 70٪ ويتم تطهيرها يوميا حتى لا يعود المحلول أصفر.
ملاحظة: يمكن استخدام المثبتات الأخرى غير بوين وكذلك بارافورمالديهايد. في هذا experiement يستخدم بوينز كما هو المثبت لتحقيق مورفولوجيا الأمثل. إذا كان هناك حاجة إلى مزيد من الأنسجة لتحليل آخر، يمكن الحصول على آبار إضافية من وسائل الإعلام وقطع من قشرة المبيض من كل.
النتائج
يمكن استخدام هذا الإجراء ثقافة القشرة البقرية لتحديد مجموعة واسعة من هرمون, السيتوكين, وبيانات الأنسجة من قطع صغيرة من المبيض. تلطيخ، مثل هيماتوكسيلين ويوسين (H &؛ E)، يمكن استخدامها لتحديد مورفولوجيا المبيض من خلال الجريبالتدريج 16،23،31 (...
Discussion
فائدة ثقافة قشرة المبيض في المختبر ، كما هو موضح في هذه المخطوطة ، هي أن الجريبات تتطور في بيئة طبيعية مع ستروما مجاورة تحيط بصيلات. تبقى الخلايا الجسدية والبويضات سليمة، وهناك اتصال مناسب من خلية إلى خلية كنموذج في الجسم الحي. وقد وجد مختبرنا أن نظام الثقافة لمدة 7 أيام يوفر بيانات تكوين ا?...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد دعم هذا البحث المعهد الوطني للأغذية والزراعة 2013-67015-20965 إلى ASC، جامعة نبراسكا للمنح التنافسية الغذائية للصحة إلى ASC. وزارة الزراعة الأمريكية هاتش منح NEB26-202/W3112 الانضمام #1011127 إلى ASC, هاتش-NEB ANHL الانضمام #1002234 إلى ASC. مبادرة علوم الحياة الكمية دعم الباحثين الصيفيين بعد الدكتوراه – جائزة COVID-19 للتمويل الصيفي ل CMS.
ويود المؤلفون أن يقدموا تقديرهم للدكتور روبرت كوشمان، المركز الأميركي لأبحاث اللحوم، مركز كلاي، NE لشكره على توفير المبيضين في منشور سابق، والتي استخدمت بعد ذلك في الورقة الحالية كدليل على المفهوم في التحقق من صحة هذه التقنية.
Materials
| Name | Company | Catalog Number | Comments |
| #11 Scapel Blade | Swann-Morton | 303 | Scaple Blade |
| #21 Scapel Blade | Swann-Morton | 307 | Scaple Blade |
| 500mL Bottle Top Filter | Corning | 430514 | Bottle Top Filter 0.22 µm pore for filtering medium |
| AbsoluteIDQ Sterol17 Assay | Biocrates | Sterol17 Kit | Samples are sent off to Biocrates and steroid panels are run and results are returned |
| Androstenedione Double Antibody RIA Kit | MPBio | 7109202 | RIA to determine androstenedione from culture medium |
| Belgium A4 Assay Kit | DIA Source | KIP0451 | RIA to determine androstenedione from culture medium |
| Bovine Cytokine Array Q3 | RayBiotech | QAB-CYT-3-1 | Cytokine kit to determine cytokines from culture medium |
| cellSens Software Standard 1.3 | Olympus | 7790 | Imaging Software |
| Insulin-Transferrin-Selenium-X | Gibco ThermoFisher Scientific | 5150056 | Addative to the culture medium |
| Leibovitz's L-15 Medium | Gibco ThermoFisher Scientific | 4130039 | Used for tissue washing on clean bench, and in the biosafety cabniet |
| Microscope | Olympus | SZX16 | Disection microscope used for imaging tissue culture pieces |
| Microscope Camera | Olympus | DP71 | Microscope cameraused for imaging tissue culture pieces |
| Millicell Cell Culture Inserts 0.4µm, 12,mm Diameter | Millipore Sigma | PICM01250 | Inserts that allow the tissue to rest against the medium without being submerged in it |
| Multiwell 24 well plate | Falcon | 353047 | Plate used to hold meduim, inserts, and tissues |
| Petri dish 60 x 15 mm | Falcon | 351007 | Petri dish used for washing steps prior to culture |
| Phosphate-Buffered Saline (PBS 1X) | Corning | 21-040-CV | Used for tissue washing |
| SAS Version 9.3 | SAS Institute | 9.3 TS1M2 | Statistical analysis software |
| Thomas Stadie-Riggs Tissue Slicer | Thomas Scientific | 6727C10 | Tissue slicer for preperation of thin uniform sections of fresh tissue |
| Waymouth MB 752/1 Medium | Sigma-Aldrich | W1625 | Medium used for tissue cultures |
References
- Braw-Tal, R., Yossefi, S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. Journal of Reproduction and Fertility. 109, 165-171 (1997).
- Nilsson anEdson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Fortune, J. E., Cushman, R. A., Wahl, C. M., Kito, S. The primordial to primary follicle transition. Molecular and Cellular Endocrinology. 163, 53-60 (2000).
- Ireland, J. J. Control of follicular growth and development. Journal of Reproduction and Fertility. 34, 39-54 (1987).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Ramezani, M., Salehnia, M., Jafarabadi, M. Short term culture of vitrified human ovarian cortical tissue to assess the cryopreservation outcome: molecular and morphological analysis. Journal of Reproduction & Infertility. 18 (1), 162-171 (2017).
- McLaughlin, M., Telfer, E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Stefansdottir, A., Fowler, P. A., Powles-Glover, N., Anderson, R. A., Spears, N. Use of ovary culture techniques in reproductive toxicology. Reproductive Toxicology. 49, 117-135 (2014).
- Bromfield, J. J., Sheldon, I. M. Lipopolysaccharide reduces the primordial follicle pool in the bovine ovarian cortex ex vivo and in the murine ovary in vivo. Biology of Reproduction. 88 (4), 1-9 (2013).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Humane Reproduction Update. 14 (4), 367-378 (2008).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicological Sciences. 90 (2), 500-509 (2006).
- Bott, R. C., McFee, R. M., Clopton, D. T., Toombs, C., Cupp, A. S. Vascular endothelial growth factor and kinase domain region receptor are involved in both seminiferous cord formation and vascular development during testis morphogenesis in the rat. Biology of Reproduction. 75, 56-67 (2006).
- Baltes-Breitwisch, M. M., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms or administration of proangiogenic isoforms stimulates vascular development in the rat testis. Reproduction. 140 (2), 319-329 (2010).
- McFee, R. M., et al. Inhibition of vascular endothelial growth factor receptor signal transduction blocks follicle progression but does not necessarily disrupt vascular development in perinatal rat ovaries. Biology of Reproduction. 81, 966-977 (2009).
- Artac, R. A., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms is more effective than treatment with proangiogenic isoforms in stimulating vascular development and follicle progression in the perinatal rat ovary. Biology of Reproduction. 81, 978-988 (2009).
- Abedal-Majed, M. A., et al. Vascular endothelial growth factor A isoforms modulate follicle development in peripbertal heifers independent of diet through diverse signal transduction pathways. Biology of Reproduction. 102 (3), 680-692 (2020).
- Wandji, S. A., Srsen, V., Voss, A. K., Eppig, J. J., Fortune, J. E. Initiation in vitro of bovine primordial follicles. Biology of Reproduction. 55, 942-948 (1996).
- Wandji, S. A., Srsen, V., Nathanielsz, P. W., Eppig, J. J., Fortune, J. E. Initiation of growth of baboon primordial follicles in vitro. Human Reproduction. 12 (9), 1993-2001 (1993).
- Yang, M. Y., Fortune, J. E. Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75, 924-932 (2006).
- Fortune, J. E., Kito, S., Wandji, S. A., Srsen, V. Activation of bovine and baboon primordial follicles in vitro. Theriogenology. 49, 441-449 (1998).
- Yang, M. Y., Fortune, J. E. Vascular endothelial growth factor stimulates the primary to secondary follicle transition in bovine follicles in vitro. Molecular Reproduction and Development. 74, 1095-1104 (2007).
- Barberino, R. S., Silva, J. R. V., Figueiredo, J. R., Matos, M. H. T. Transport of domestic and wild animal ovaries: a review of the effects of medium, temperature, and periods of storage on follicular viability. Biopreservation and Biobanking. 17 (1), 84-90 (2019).
- Summers, A. F., et al. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess. PLoS One. 9 (10), e110683 (2014).
- Koal, T., Schmiederer, D., Pham-Tuan, H., Rohring, C., Rauh, M. Standardized LC-MS/MS based steroid hormone profile analysis. The Journal of Steroid Biochemistry and Molecular Biology. 129, 129-138 (2012).
- Poole, R. K., Brown, A. R., Pore, M. H., Pickworth, C. L., Poole, D. H. Effects of endophyte-infected tall fescue seed and protein supplementation on stocker steers: II. Adaptive and innate immune function. Journal of Animal Science. 97 (10), 4160-4170 (2019).
- Laronda, M., et al. Alginate encapsulation supports the growth and differentiation of human primordial follicles within ovarian cortical tissue. Journal of Assisted Reproduction and Genetics. 31 (8), 1013-1028 (2014).
- Silber, S. J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23 (7), 1531-1537 (2008).
- Wiedemann, C., Zahmel, J., Jewgenow, K. Short-term culture of ovarian cortex pieces to assess the cryopreservation outcome in wild fields for genome conservation. BMC Veterinary Research. 9 (37), (2013).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354 (3), 869-880 (2013).
- Shimizu, T., Miyamoto, A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk-1, its receptor, in bovine granulosa cells. Animal Reproduction Science. 102 (3-4), 228-237 (2007).
- Tepekoy, F., Akkoyunlu, G. The effect of FSH and activin A on Akt and MAPK1/3 phosphorylation in cultured bovine ovarian cortical strips. Journal of Ovarian Research. 9 (13), 1-9 (2016).
- Beck, K., Singh, J., Arshud Dar, M., Anzar, M. Short-term culture of adult bovine ovarian tissues: chorioallantoic membrane (CAM) vs. traditional in vitro culture systems. Reproductive Biology and Endocrinology. 16 (1), 21 (2018).
- Eppig, J. J. Oocyte control of ovarian follicular development and function in mammals. Reproduction. 122 (6), 829-838 (2001).
- Paczkowski, M., Silva, E., Schoolcraft, W. B., Krisher, R. L. Comparative importance of fatty acid beta-oxidation to nuclear maturation, gene expression, and glucose metabolism in mouse, bovine, and porcine cumulus oocyte complexes. Biology of Reproduction. 88 (5), 1-11 (2013).
- Raffel, N., et al. Is ovarian tissue transport at supra-zero temperatures compared to body temperature optimal for follicle survival?. In Vivo. 34 (2), 533-541 (2020).
- Duncan, F., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction (Cambridge, England). 152 (6), R201-R210 (2016).
- Liebenthron, J., et al. Overnight ovarian tissue transportation for centralized cryobanking: a feasible option. Reproductive BioMedicine Online. 38 (5), 740-749 (2019).
- Mohammed, B. T., Donadeu, F. X. Bovine granulosa cell culture. Epithelial Cell Culture: Methods and Protocols. , 79-87 (2018).
- Langbeen, A., et al. Effects of neutral red assisted viability assessment on the cryotolerance of isolated bovine preantral follicles. Journal of Assisted Reproduction Genetics. 31, 1727-1736 (2014).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Yang, M. Y., Fortune, J. E. Changes in the transcriptome of bovine ovarian cortex during follicle activation in vitro. Physiological Genomics. 47, 600-611 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved