Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cultivo de tejido de corteza ovárica bovina
En este artículo
Resumen
Se presenta el cultivo in vitro de la corteza ovárica bovina y el efecto de la dieta nutricional Stair-step sobre el microambiente ovárico. Las piezas de la corteza ovárica se cultivaron durante siete días y se evaluaron los esteroides, las citoquinas y las etapas del folículo. El tratamiento de la dieta Stair-Step había aumentado la esteroidogénesis, lo que resultó en la progresión del folículo en cultivo.
Resumen
El desarrollo del folículo desde la etapa primordial hasta la antral es un proceso dinámico dentro de la corteza ovárica, que incluye factores endocrinos y paracrinos de las células somáticas y la comunicación cúmulo célula-ovocito. Poco se sabe sobre el microambiente ovárico y cómo las citoquinas y esteroides producidos en el entorno circundante afectan la progresión o detención del folículo. El cultivo in vitro de la corteza ovárica permite que los folículos se desarrollen en un entorno normalizado que permanece soportado por el estroma adyacente. Nuestro objetivo fue determinar el efecto de la dieta nutricional Stair-Step sobre el microambiente ovárico (desarrollo del folículo, producción de esteroides y citoquinas) a través del cultivo in vitro de la corteza ovárica bovina. Para lograr esto, se retiraron piezas corticales ováricas de novillas sometidas a dos esquemas nutricionalmente desarrollados diferentes antes de la pubertad: Control (desarrollo de la nutrición tradicional) y Stair-Step (alimentación y restricción durante el desarrollo) que se cortaron en aproximadamente 0.5-1 mm3 pedazos. Estas piezas se pasaron posteriormente a través de una serie de lavados y se colocaron en un inserto de cultivo de tejidos que se coloca en un pozo que contiene el medio de cultivo de Waymouth. La corteza ovárica se cultivó durante 7 días con cambios diarios en los medios de cultivo. Se realizó un seccionamiento histológico para determinar los cambios en el estadio del folículo antes y después del cultivo para determinar los efectos de la nutrición y el impacto del cultivo sin tratamiento adicional. El medio de cultivo Cortex se agrupó durante días para medir esteroides, metabolitos esteroides y citoquinas. Hubo tendencias para el aumento de las hormonas esteroides en el microambiente ovárico que permitieron la progresión del folículo en los cultivos de corteza ovárica Stair-Step versus Control. La técnica de cultivo de la corteza ovárica permite una mejor comprensión del microambiente ovárico y cómo las alteraciones en la secreción endocrina pueden afectar la progresión y el crecimiento del folículo tanto a partir de tratamientos in vivo como in vitro. Este método de cultivo también puede resultar beneficioso para probar posibles terapias que pueden mejorar la progresión del folículo en las mujeres para promover la fertilidad.
Introducción
La corteza ovárica representa la capa externa del ovario donde se produce el desarrollo del folículo1. Los folículos primordiales, inicialmente detenidos en desarrollo, se activarán para convertirse en folículos primarios, secundarios y luego antrales o terciarios basados en entradas paracrinas y gonadotropinas1,2,3,4. Para comprender mejor los procesos fisiológicos dentro del ovario, el cultivo de tejidos se puede utilizar como un modelo in vitro, lo que permite un entorno controlado para realizar experimentos. Muchos estudios han utilizado el cultivo de tejido ovárico para la investigación en tecnología de reproducción asistida, preservación de la fertilidad y cáncer de ovario5,6,7. El cultivo de tejido ovárico también ha servido como modelo para investigar las toxinas reproductivas que dañan la salud ovárica y la etiología de trastornos reproductivos como el Síndrome de Ovario Poliquístico (SOP)8,9,10,11. Por lo tanto, este sistema de cultivo es aplicable a una amplia gama de especialidades.
En roedores, se han utilizado gónadas fetales o perinatales enteras en experimentos de biología reproductiva12,13,14,15. Sin embargo, las gónadas del ganado doméstico más grande no se pueden cultivar como órganos completos debido a su gran tamaño y posible degeneración. Por lo tanto, la corteza ovárica bovina y primate no humana se corta en trozos más pequeños16,17,18. Muchos estudios han cultivado pequeñas piezas de corteza ovárica para estudiar varios factores de crecimiento en la iniciación del folículo primordial en ganado doméstico y primates no humanos1,17,18,19. El uso del cultivo de corteza ovárica también ha demostrado la iniciación del folículo primordial en ausencia de suero para piezas corticales bovinas y primates cultivadas durante 7 días20. Yang y Fortune en 2006 trataron el medio de cultivo de corteza ovárica fetal con un rango de dosis de testosterona durante 10 días y observaron que la concentración de testosterona de 10-7 M aumentó el reclutamiento del folículo, la supervivencia y el aumento de la progresión de los folículos en etapa temprana19. En 2007, utilizando cultivos de corteza ovárica de fetos bovinos (5-8 meses de gestación), Yang y Fortune informaron un papel para el Factor de Crecimiento Endotelial Vascular A (VEGFA) en la transición del folículo primario a secundario21. Además, nuestro laboratorio ha utilizado cultivos de corteza ovárica para demostrar cómo las isoformas VEGFA (angiogénicas, antiangiogénicas y una combinación) pueden regular diferentes vías de transducción de señales a través del receptor del dominio quinasa (KDR), que es el principal receptor de transducción de señales al que se une VEGFA16. Esta información permitió una mejor comprensión de cómo las diferentes isoformas de VEGFA afectan las vías de señalización para provocar la progresión o detención del folículo. En conjunto, el cultivo de piezas de corteza ovárica in vitro con diferentes esteroides o factores de crecimiento puede ser un ensayo valioso para determinar los efectos sobre los mecanismos que regulan la foliculogénesis. Del mismo modo, los animales que se desarrollan en diferentes regímenes nutricionales pueden tener microambientes ováricos alterados, lo que puede promover o inhibir la foliculogénesis que afecta la madurez reproductiva femenina. Por lo tanto, nuestro objetivo en el manuscrito actual es informar sobre la técnica de cultivo de corteza bovina y determinar si existen diferencias en los microambientes ováricos después del cultivo in vitro de la corteza bovina a partir de novillas alimentadas con dietas Control o Stair-Step recolectadas a los 13 meses de edad como se describió anteriormente16.
Por lo tanto, nuestro siguiente paso fue determinar el microambiente ovárico en estas novillas que se desarrollaron con diferentes dietas nutricionales. Evaluamos la corteza ovárica de novillas alimentadas con una dieta Stair-Step o Control. A las novillas de control se les ofreció una dieta de mantenimiento de 97,9 g/kg0,75 durante 84 días. La dieta Stair-Step se inició a los 8 meses conteniendo una dieta restringida de 67,4 g/kg0,75 durante 84 días. Después de los primeros 84 días, mientras que las novillas control continuaron recibiendo 97,9 g/kg0,75,a las novillas de carne de res Stair-Step se les ofreció 118,9 g/kg0,75 durante otros 68 días, después de lo cual fueron ovariectomizadas a los 13 meses de edad de16 años para estudiar los cambios en las etapas foliculares y la morfología antes y después del cultivo. También se analizaron las diferencias en los esteroides, metabolitos esteroides, quimiocinas y citoquinas secretadas en los medios de la corteza. Se midieron los esteroides y otros metabolitos para determinar si hubo algún efecto directo de los tratamientos realizados in vivo y/o in vitro sobre la viabilidad y productividad de los tejidos. Los cambios en el microambiente ovárico antes y después del cultivo proporcionaron una instantánea del medio endocrino y la foliculogénesis antes del cultivo y cómo el cultivo o el tratamiento durante el cultivo afecta la progresión o detención del folículo.
Los ovarios se recolectaron después de que se realizaron ovariectomías en el Centro de Investigación de Animales de Carne de los Estados Unidos (USMARC) de acuerdo con sus procedimientos IACUC de novillas de control y escalonadas a los 13 meses de edad de16años, limpiadas con lavados estériles de solución salina tampón de fosfato (PBS) con 0.1% de antibiótico para eliminar sangre y otros contaminantes, recortaron el exceso de tejido y se transportaron al laboratorio de Fisiología Reproductiva de la Universidad de Nebraska-Lincoln (UNL) UNL a 37 ° C23 . En la UNL, las piezas de la corteza ovárica se cortaron en pequeños trozos cuadrados (~ 0.5-1 mm3; Figura 1) y cultivado durante 7 días (Figura 2). La histología se realizó en las diapositivas de cultivo de la corteza antes y después del cultivo para determinar los folículos en las etapas16,24 (Figura 3 y Figura 4),y las proteínas de la matriz extracelular que pueden indicar fibrosis (Picro-Sirus Red, PSR; Figura 5). Esto permitió la determinación del efecto de los regímenes nutricionales in vivo en las etapas del folículo y permitió la comparación de 7 días de corteza ovárica en las etapas del folículo y la progresión del folículo. A lo largo del cultivo, el medio se recolectó y cambió diariamente (aproximadamente el 70% de los medios se recolectaron cada día; 250 μL / pozo) para que las hormonas / citoquinas / quimiocinas diarias puedan evaluarse o agruparse durante días para obtener concentraciones promedio. Los esteroides como la androstenediona (A4) y el estrógeno (E2) se pueden agrupar durante 3 días y evaluarse a través de radioinmunoensayo (RIA; Figura 6) y agrupados durante 4 días por animal y ensayados mediante Cromatografía Líquida de Alto Rendimiento-Espectrometría de Masas (HPLC-MS)24,25 ( Tabla1). Se utilizaron matrices de citoquinas para evaluar las concentraciones de citoquinas y quimiocinas en el medio de cultivo de la corteza ovárica26 (Tabla 2). Se realizaron placas de ensayo de reacción en cadena de la polimerasa (RT-PCR) en tiempo real para determinar la expresión génica de vías de transducción de señales específicas, como se demostró anteriormente16. Todos los marcadores de esteroides, citoquinas, etapas foliculares e histológicos proporcionan una instantánea del microambiente ovárico y pistas sobre la capacidad de ese microambiente para promover la foliculogénesis "normal" o "anormal".
Protocolo
Los ovarios se obtuvieron del U. S. Meat Animal Research Center16. Como se indicó anteriormente16,todos los procedimientos fueron aprobados por el Comité de Cuidado y Uso de Animales del Centro de Investigación de Animales de Carne de los Estados Unidos (USMARC) de acuerdo con la guía para el Cuidado y Uso de Animales Agrícolas en la Investigación y Enseñanza Agrícola. Los ovarios fueron llevados al Laboratorio Reproductivo de la Universidad de Nebraska-Lincoln, donde fueron procesados y cultivados.
1. Preparación de los medios requeridos
-
Waymouth MB 752/1 medio
- Llene una botella de cultivo de tejidos de 1 L con 900 ml de agua estéril. Mientras el agua se agita suavemente en una placa de agitación, agregue gradualmente el medio en polvo. Una vez disuelto el medio en polvo, añadir 2,24 g de bicarbonato de sodio seguido de 1,25 g de albúmina sérica bovina (BSA). Use un medidor de pH y ajuste el pH a 7.25-7.35. Agregue agua estéril adicional para llevar el volumen final a 1 L.
- Pase a un gabinete de seguridad biológica y agregue sulfato de penicilina-estreptomicina a una concentración de 0.1% v / v del medio. Filtre el medio con un filtro superior de botella de 0,22 μm de porode 33,2 cm 2 500 ml.
- Vierta el medio filtrado en varios tubos cónicos de 50 ml. Añadir 0,5 ml de insulina-transferrina-selenio por cada 50 ml de medio alicitado.
- Envuelva los tubos cónicos y la botella de caldo del medio en papel de aluminio y guárdelo a 4 °C. Este medio es sensible a la luz.
NOTA: El medio Waymouth se puede almacenar hasta por 1 mes.
-
Medio L-15 (LB-15) de Leibovitz
NOTA: El medio LB-15 se utiliza para limpiar el tejido en preparación para el cultivo.- Llene una botella de cultivo de tejidos de 1 L con 900 ml de agua estéril. Mientras el agua estéril se agita suavemente en una placa de agitación, agregue gradualmente el medio en polvo preparado. Use un medidor de pH y ajuste el pH a 7.25-7.35. Agregue agua estéril adicional para llevar el volumen final a 1 L.
- Pasar al gabinete de seguridad biológica. Hacer 1 L de LB-15 con 0.1% de antibiótico (ver Tabla de Materiales). Filtre el medio en dos botellas de cultivo de tejidos de 500 ml utilizando un filtro superior de botella de poro de 0,22 μm33,2 cm 2 500 ml. Envuelva las botellas en papel de aluminio ya que el medio LB-15 es sensible a la luz y guárdelo a 4 °C.
NOTA: El medio LB-15 se puede almacenar hasta por 1 mes.
-
Solución salina tamponada con fosfato (PBS)
- Haga PBS en el laboratorio o compre PBS estéril sin calcio ni magnesio(Tabla de materiales). Para hacer PBS en el laboratorio, comience con 800 ml de agua destilada y agréguele 8 g de cloruro de sodio (NaCl). Luego, agregue 0.2 g de cloruro de potasio (KCl), 1.44 g de fosfato de sodio dibásico (Na2HPO4)y 0.24 g de fosfato de potasio dibásico (KH2PO4). Ajuste el pH a ~ 7.4 y ajuste el volumen total a 1 L. Esterilice la solución en autoclave.
- Haga 1 L PBS con 0.1% de antibiótico (ver Tabla de Materiales)mientras está en un gabinete de seguridad biológica.
2. Protocolo de cultivo cortical ovárico
NOTA: Los ovarios se obtuvieron de novillas USMARC nacidas en primavera a los 13 meses de edad. Los ovarios se enjuagaron a fondo, y toda la sangre y otros líquidos se extrajeron con PBS que contenía antibiótico (0,1%) y se transportaron a 37 °C23 al Laboratorio de Reproducción UNL de la Universidad de Nebraska-Lincoln (a 1,5 h de distancia). (Para comentarios sobre la temperatura de los ovarios durante el transporte, consulte discusión)
- Preparar el tejido ovárico en un banco limpio (Figura 1).
- Desinfecte el banco limpio con etanol al 70%. Coloque una almohadilla absorbente fresca en la mesa de trabajo. Asegúrese de que el soplador de banco limpio se encienda media hora antes de la disección junto con la luz UV para esterilizar cualquier cosa en el banco limpio, incluida la almohadilla absorbente y asegúrese de que se use el EPP adecuado.
- Coloque las placas de Petri (60 x 15 mm) para lavados de pañuelos. Se requieren tres placas de Petri para el lavado de PBS, tres para PBS con antibióticos y tres para lavados de LB-15. Se utilizará una placa de Petri adicional que contiene LB-15 con tapa acompañante para la colocación final de las piezas después del lavado.
- Llene cada placa de Petri con aproximadamente 10 ml de fluidos apropiados, ya sea PBS o LB-15.
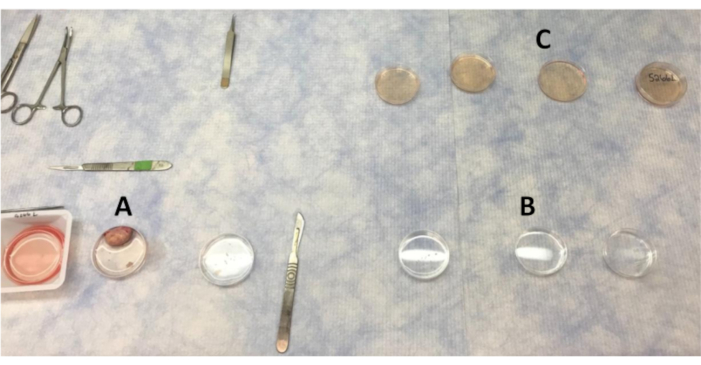
Figura 1: Disposición de las placas para lavar las piezas de ovario y corteza en el banco limpio. (A) PBS utilizado para lavar el ovario a medida que se eliminan las secciones de la corteza. (B) PBS con lavados antibióticos por los que se mueven las piezas de la corteza. (C) Las piezas de corteza ovárica se lavan cuatro veces en LB-15 antes de pasar al gabinete de bioseguridad para el lavado final en LB-15. Haga clic aquí para ver una versión más grande de esta figura.
- Retire el medio Waymouth y LB-15 preparado del refrigerador y caliente a temperatura ambiente.
- Autoclave todas las herramientas para asegurar la esterilización antes de su uso.
- Mantenga los ovarios a 37 °C hasta que la corteza ovárica esté lista para ser recolectada.
- Usando fórceps con mandíbulas dentadas, recoja el ovario y lávese bien en la primera placa de Petri llena de PBS. Transfiera el ovario al segundo lavado de PBS y limpie a fondo una vez más.
NOTA: El ovario permanecerá en el segundo lavado de PBS mientras se retiran las tiras corticales ováricas. - Usando pinzas de mandíbula dentadas, asegure el ovario y corte por la mitad. En este momento, la corteza ovárica se separará de la médula. Usando una regla, asegúrese de que no se extraiga más de 1-2 mm de profundidad de la superficie del ovario lejos de la médula16. Retire las secciones transversales de la corteza ovárica de la médula, corte de 3 a 4 tiras delgadas de corteza ovárica(Figura 2)con un bisturí (hoja de bisturí # 11; mango # 3) y coloque las tiras en la tercera placa de Petri llena de PBS.
NOTA: En este momento, se puede recolectar tejido cortical ovárico adicional para la extracción de ARN o fijarlo y recolectarlo para la histología de piezas iniciales de corteza no cultivadas. Al eliminar tiras de corteza ovárica, evite las áreas con folículos antrales visibles o cuerpos lúteos. Además, evite la recolección de tejido medular. La histología de la médula es muy diferente como se mostró anteriormente16. Si la corteza ovárica no se corta a más de 1-2 mm de profundidad, entonces no se debe obtener la médula. La histología distinta permite puntos de referencia entre la corteza y la médula. - Corte las tiras de la corteza ovárica en el tercer lavado de PBS en trozos pequeños y cuadrados (~ 0.5–1 mm3) con una cuchilla de bisturí # 21. Use una regla debajo de las placas de Petri para asegurarse de que las piezas sean de tamaño y grosor similares para hacer piezas consistentes de corteza ovárica. Use fórceps para asegurar las tiras mientras corta las piezas con un bisturí.
NOTA: El número de piezas de tejido cortadas depende del experimento. Cuatro piezas de corteza ovárica es la cantidad mínima de tejido necesaria para el cultivo. Otros métodos para garantizar una longitud y profundidad adecuadas incluyen el uso de cortadoras especiales26 o piezas de plástico precortadas como plantillas27. - Lave las piezas corticales ováricas a través de los tres PBS con placas de Petri llenas de antibióticos. Use pinzas de punta curva para mover piezas entre lavados.
- Mueva las piezas de la corteza a través de la serie de lavados LB-15 y colóquelas en la placa de Petri final llena de LB-15. Etiquete la tapa con identificación del animal y el lado del ovario (izquierda o derecha).
NOTA: Sumerja completamente las piezas de la corteza ovárica en cada lavado para una limpieza a fondo. - Recolecte cuatro piezas de corteza ovárica por ovario y arregle para la histología del día cero. Las piezas adicionales también se pueden congelar por flash para el ARN. Las piezas de tejido restantes se utilizarán para el cultivo. Limpie las herramientas de disección con etanol al 70% después de cada recolección de tejido.
- Prepare un gabinete de seguridad biológica para el lavado final de tejidos y la preparación de cultivos. Desinfecte los suministros con etanol al 70% antes de colocarlos en el gabinete de seguridad biológica. Utilice la técnica aséptica cuando trabaje en el gabinete de seguridad biológica.
- Mueva toda la corteza ovárica destinada al cultivo al gabinete de seguridad biológica y lávela una vez más en una placa de Petri llena de LB-15.
- En una placa de cultivo de tejido de 24 pocillos, pipetee 350 μL de medio Waymouth por pozo.
- Coloque las inserciones de cultivo sin recubrimiento en cada pozo usando fórceps. Asegúrese de que no se formen burbujas debajo de la base del inserto, ya que esto provocaría que el tejido se seque. El medio debe tocar las inserciones para permitir que el medio sea absorbido y rodee las piezas de la corteza ovárica.
- Coloque cuidadosamente cuatro piezas de corteza ovárica en la malla de cada inserto (Figura 2). Los fórceps pueden perforar la malla si las piezas de tejido no están delicadamente colocadas. Las piezas de tejido no deben tocarse entre sí ni con el lado del inserto.
- Incubar el tejido a 37ºCcon un 5% de CO216.
NOTA: Otros han utilizado 38.8 °C28. Sin embargo, no se ha observado ninguna diferencia en la integridad del tejido ni en la capacidad de los folículos para progresar en el tejido a 37ºCni tampoco lo han hecho otros39,30. Por lo tanto, en este punto, cualquiera de estas temperaturas debería ser propicia para el éxito del experimento. Otros han utilizado 400 μL de medio. Cualquiera de las cantidades está bien siempre que una sea consistente, y el tejido está parcialmente sumergido, lo que permite una tensión superficial adecuada para permitir la hidratación del tejido (medios que rodean las piezas de la corteza ovárica). Llene los pozos vacíos con 500 μL de agua estéril para ayudar a reducir la evaporación de otros pozos.

Figura 2: Piezas de corteza ovárica y placa de cultivo. (A) Una tira ovárica que se corta de la corteza del ovario. (B) Regla y pieza de corteza que se muestran una al lado de la otra. (C) Cuatro piezas de corteza (~0.5-1 mm3) que descansan sobre el inserto en el medio de cultivo en la placa. (D) Levantar el inserto para recoger el medio de cultivo del pozo. Recolectar y reemplazar todo el medio de cultivo diariamente (250 μL) para mantener un pH adecuado.Aproximadamente 250 μL se obtienen de cada pozo cada día (aproximadamente el 70% del medio de cultivo inicial). Haga clic aquí para ver una versión más grande de esta figura.
3. Colección de medios
- Cambie el medio de cultivo de la corteza ovárica diariamente durante 7 días. Los cambios de medio deben estar lo más cerca posible de 24 h de distancia para evitar grandes cambios de pH y color en el medio. Waymouth caliente medio a 37 °C antes del cambio medio. Se obtienen aproximadamente 250 μL de cada pozo cada día (aproximadamente el 70% del medio de cultivo inicial).
- Durante los cambios medios, use fórceps para levantar suavemente el inserto del pozo. Recoger el medio Waymouth cultivado en tubos de 0,5 ml (aproximadamente 250 μL/día). Vuelva a colocar el inserto en el pozo y agregue 350 μL de medio de cultivo fresco dispensando el medio entre el lado del inserto y el pozo.
NOTA: Cambie la mayoría de los medios diariamente para obtener suficientes medios para medir todos los esteroides, citoquinas y quimiocinas necesarias para determinar el microambiente ovárico. Además, los cambios diarios en el medio son importantes para prevenir grandes cambios de pH (indicados por el cambio de color) en el medio. Se retuvieron gotas de medio que rodeaban las piezas de la corteza ovárica para garantizar que las piezas permanecieran húmedas. No se observaron problemas con el tejido cultivado debido a la variación del 70% de los medios. - Almacene el medio recolectado del cultivo de tejidos a -20 °C.
4. Procesamiento de imágenes y posterior
- Después de 7 días de cultivo a 37 °C con 5% de CO2,obtenga imágenes de las piezas de la corteza ovárica utilizando un microscopio de disección con una cámara adjunta y un programa de software de imágenes por computadora.
NOTA: Una habitación oscura suele ser la mejor para lograr la mejor calidad de imagen para la obtención de imágenes. - Después de la obtención de imágenes, fije dos piezas de corteza ovárica por pozo en Bouins para histología y congele dos piezas de corteza ovárica en nitrógeno líquido para obtener ARN para el ADNc. Repita este paso para todos los pozos con tejido. Recoger el medio a partir del día 7 y almacenar a -20ºC.
- Deje que las piezas de la corteza ovárica permanezcan sumergidas en Bouins (ácido picrico 750 ml, ácido acético glacial 50 ml y 37%-40% formalina 250 ml) durante aproximadamente 1,5 h antes de lavarse con etanol al 70% tres veces. El tejido permanecerá en etanol al 70% y se eliminará diariamente hasta que la solución ya no sea amarilla.
NOTA: Se pueden usar fijadores que no sean Bouins, así como paraformaldehído. En esta experiencia se utiliza Bouins ya que es el fijador para lograr una morfología óptima. Si se requiere más tejido para otros análisis, se pueden obtener pocillos adicionales de medios y piezas de corteza ovárica de cada animal.
Resultados
Este procedimiento de cultivo de corteza bovina se puede utilizar para determinar una amplia variedad de datos hormonales, citoquinas e histológicos de pequeñas piezas del ovario. La tinción, como la hematoxilina y la eosina (H&E), se puede utilizar para determinar la morfología ovárica a través de la estadificación del folículo16,23,31 ( Figura3). Brevemente, los folículos se clasificaron ...
Discusión
El beneficio del cultivo in vitro de corteza ovárica, como se describe en este manuscrito, es que los folículos se desarrollan en un ambiente normalizado con estroma adyacente que rodea los folículos. Las células somáticas y los ovocitos permanecen intactos, y existe una comunicación apropiada de célula a célula como modelo in vivo. Nuestro laboratorio ha encontrado que un sistema de cultivo de 7 días proporciona datos representativos de foliculogénesis y esteroidogénesis para el tratamiento de la corteza ová...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue apoyada por el Instituto Nacional de Alimentos y Agricultura 2013-67015-20965 a ASC, University of Nebraska Food for Health Competitive Grants to ASC. Subvención neb26-202/W3112 adhesión del Departamento de Agricultura de los Estados Unidos #1011127 a ASC, Hatch–NEB ANHL Adhesión #1002234 a ASC. Quantitative Life Sciences Initiative Summer Postdoctoral Scholar Support – Premio COVID-19 para la financiación de verano para CMS.
Los autores desean extender su agradecimiento al Dr. Robert Cushman, U.S. Meat Animal Research Center, Clay Center, NE para agradecerle por proporcionar los ovarios en una publicación anterior, que luego se utilizaron en el artículo actual como prueba de concepto para validar esta técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| #11 Scapel Blade | Swann-Morton | 303 | Scaple Blade |
| #21 Scapel Blade | Swann-Morton | 307 | Scaple Blade |
| 500mL Bottle Top Filter | Corning | 430514 | Bottle Top Filter 0.22 µm pore for filtering medium |
| AbsoluteIDQ Sterol17 Assay | Biocrates | Sterol17 Kit | Samples are sent off to Biocrates and steroid panels are run and results are returned |
| Androstenedione Double Antibody RIA Kit | MPBio | 7109202 | RIA to determine androstenedione from culture medium |
| Belgium A4 Assay Kit | DIA Source | KIP0451 | RIA to determine androstenedione from culture medium |
| Bovine Cytokine Array Q3 | RayBiotech | QAB-CYT-3-1 | Cytokine kit to determine cytokines from culture medium |
| cellSens Software Standard 1.3 | Olympus | 7790 | Imaging Software |
| Insulin-Transferrin-Selenium-X | Gibco ThermoFisher Scientific | 5150056 | Addative to the culture medium |
| Leibovitz's L-15 Medium | Gibco ThermoFisher Scientific | 4130039 | Used for tissue washing on clean bench, and in the biosafety cabniet |
| Microscope | Olympus | SZX16 | Disection microscope used for imaging tissue culture pieces |
| Microscope Camera | Olympus | DP71 | Microscope cameraused for imaging tissue culture pieces |
| Millicell Cell Culture Inserts 0.4µm, 12,mm Diameter | Millipore Sigma | PICM01250 | Inserts that allow the tissue to rest against the medium without being submerged in it |
| Multiwell 24 well plate | Falcon | 353047 | Plate used to hold meduim, inserts, and tissues |
| Petri dish 60 x 15 mm | Falcon | 351007 | Petri dish used for washing steps prior to culture |
| Phosphate-Buffered Saline (PBS 1X) | Corning | 21-040-CV | Used for tissue washing |
| SAS Version 9.3 | SAS Institute | 9.3 TS1M2 | Statistical analysis software |
| Thomas Stadie-Riggs Tissue Slicer | Thomas Scientific | 6727C10 | Tissue slicer for preperation of thin uniform sections of fresh tissue |
| Waymouth MB 752/1 Medium | Sigma-Aldrich | W1625 | Medium used for tissue cultures |
Referencias
- Braw-Tal, R., Yossefi, S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. Journal of Reproduction and Fertility. 109, 165-171 (1997).
- Nilsson anEdson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Fortune, J. E., Cushman, R. A., Wahl, C. M., Kito, S. The primordial to primary follicle transition. Molecular and Cellular Endocrinology. 163, 53-60 (2000).
- Ireland, J. J. Control of follicular growth and development. Journal of Reproduction and Fertility. 34, 39-54 (1987).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Ramezani, M., Salehnia, M., Jafarabadi, M. Short term culture of vitrified human ovarian cortical tissue to assess the cryopreservation outcome: molecular and morphological analysis. Journal of Reproduction & Infertility. 18 (1), 162-171 (2017).
- McLaughlin, M., Telfer, E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Stefansdottir, A., Fowler, P. A., Powles-Glover, N., Anderson, R. A., Spears, N. Use of ovary culture techniques in reproductive toxicology. Reproductive Toxicology. 49, 117-135 (2014).
- Bromfield, J. J., Sheldon, I. M. Lipopolysaccharide reduces the primordial follicle pool in the bovine ovarian cortex ex vivo and in the murine ovary in vivo. Biology of Reproduction. 88 (4), 1-9 (2013).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Humane Reproduction Update. 14 (4), 367-378 (2008).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicological Sciences. 90 (2), 500-509 (2006).
- Bott, R. C., McFee, R. M., Clopton, D. T., Toombs, C., Cupp, A. S. Vascular endothelial growth factor and kinase domain region receptor are involved in both seminiferous cord formation and vascular development during testis morphogenesis in the rat. Biology of Reproduction. 75, 56-67 (2006).
- Baltes-Breitwisch, M. M., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms or administration of proangiogenic isoforms stimulates vascular development in the rat testis. Reproduction. 140 (2), 319-329 (2010).
- McFee, R. M., et al. Inhibition of vascular endothelial growth factor receptor signal transduction blocks follicle progression but does not necessarily disrupt vascular development in perinatal rat ovaries. Biology of Reproduction. 81, 966-977 (2009).
- Artac, R. A., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms is more effective than treatment with proangiogenic isoforms in stimulating vascular development and follicle progression in the perinatal rat ovary. Biology of Reproduction. 81, 978-988 (2009).
- Abedal-Majed, M. A., et al. Vascular endothelial growth factor A isoforms modulate follicle development in peripbertal heifers independent of diet through diverse signal transduction pathways. Biology of Reproduction. 102 (3), 680-692 (2020).
- Wandji, S. A., Srsen, V., Voss, A. K., Eppig, J. J., Fortune, J. E. Initiation in vitro of bovine primordial follicles. Biology of Reproduction. 55, 942-948 (1996).
- Wandji, S. A., Srsen, V., Nathanielsz, P. W., Eppig, J. J., Fortune, J. E. Initiation of growth of baboon primordial follicles in vitro. Human Reproduction. 12 (9), 1993-2001 (1993).
- Yang, M. Y., Fortune, J. E. Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75, 924-932 (2006).
- Fortune, J. E., Kito, S., Wandji, S. A., Srsen, V. Activation of bovine and baboon primordial follicles in vitro. Theriogenology. 49, 441-449 (1998).
- Yang, M. Y., Fortune, J. E. Vascular endothelial growth factor stimulates the primary to secondary follicle transition in bovine follicles in vitro. Molecular Reproduction and Development. 74, 1095-1104 (2007).
- Barberino, R. S., Silva, J. R. V., Figueiredo, J. R., Matos, M. H. T. Transport of domestic and wild animal ovaries: a review of the effects of medium, temperature, and periods of storage on follicular viability. Biopreservation and Biobanking. 17 (1), 84-90 (2019).
- Summers, A. F., et al. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess. PLoS One. 9 (10), e110683 (2014).
- Koal, T., Schmiederer, D., Pham-Tuan, H., Rohring, C., Rauh, M. Standardized LC-MS/MS based steroid hormone profile analysis. The Journal of Steroid Biochemistry and Molecular Biology. 129, 129-138 (2012).
- Poole, R. K., Brown, A. R., Pore, M. H., Pickworth, C. L., Poole, D. H. Effects of endophyte-infected tall fescue seed and protein supplementation on stocker steers: II. Adaptive and innate immune function. Journal of Animal Science. 97 (10), 4160-4170 (2019).
- Laronda, M., et al. Alginate encapsulation supports the growth and differentiation of human primordial follicles within ovarian cortical tissue. Journal of Assisted Reproduction and Genetics. 31 (8), 1013-1028 (2014).
- Silber, S. J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23 (7), 1531-1537 (2008).
- Wiedemann, C., Zahmel, J., Jewgenow, K. Short-term culture of ovarian cortex pieces to assess the cryopreservation outcome in wild fields for genome conservation. BMC Veterinary Research. 9 (37), (2013).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354 (3), 869-880 (2013).
- Shimizu, T., Miyamoto, A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk-1, its receptor, in bovine granulosa cells. Animal Reproduction Science. 102 (3-4), 228-237 (2007).
- Tepekoy, F., Akkoyunlu, G. The effect of FSH and activin A on Akt and MAPK1/3 phosphorylation in cultured bovine ovarian cortical strips. Journal of Ovarian Research. 9 (13), 1-9 (2016).
- Beck, K., Singh, J., Arshud Dar, M., Anzar, M. Short-term culture of adult bovine ovarian tissues: chorioallantoic membrane (CAM) vs. traditional in vitro culture systems. Reproductive Biology and Endocrinology. 16 (1), 21 (2018).
- Eppig, J. J. Oocyte control of ovarian follicular development and function in mammals. Reproduction. 122 (6), 829-838 (2001).
- Paczkowski, M., Silva, E., Schoolcraft, W. B., Krisher, R. L. Comparative importance of fatty acid beta-oxidation to nuclear maturation, gene expression, and glucose metabolism in mouse, bovine, and porcine cumulus oocyte complexes. Biology of Reproduction. 88 (5), 1-11 (2013).
- Raffel, N., et al. Is ovarian tissue transport at supra-zero temperatures compared to body temperature optimal for follicle survival?. In Vivo. 34 (2), 533-541 (2020).
- Duncan, F., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction (Cambridge, England). 152 (6), R201-R210 (2016).
- Liebenthron, J., et al. Overnight ovarian tissue transportation for centralized cryobanking: a feasible option. Reproductive BioMedicine Online. 38 (5), 740-749 (2019).
- Mohammed, B. T., Donadeu, F. X. Bovine granulosa cell culture. Epithelial Cell Culture: Methods and Protocols. , 79-87 (2018).
- Langbeen, A., et al. Effects of neutral red assisted viability assessment on the cryotolerance of isolated bovine preantral follicles. Journal of Assisted Reproduction Genetics. 31, 1727-1736 (2014).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Yang, M. Y., Fortune, J. E. Changes in the transcriptome of bovine ovarian cortex during follicle activation in vitro. Physiological Genomics. 47, 600-611 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados