JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
소 난소 피질 조직 배양
요약
소 난소 피질의 체외 문화와 난소 미세 환경에 대한 영양 계단 단계 식단의 효과가 제시됩니다. 난소 피질 조각7 일 동안 배양 하 고 스테로이드, 사이토 카인, 그리고 여포 단계 평가 되었다. 계단 단계 다이어트 치료는 문화에서 여포 진행의 결과로 증가 스테로이드 발생했다.
초록
초보에서 antral 단계로의 여포 발달은 체세포 및 적혈구 세포-oocyte 통신에서 내분비 및 파라크리인을 포함하는 난소 피질 내의 동적 과정입니다. 난소 미세 환경과 주변 밀리에서 생산 된 사이토카인과 스테로이드가 여포 진행 또는 체포에 미치는 영향에 대해서는 거의 알려져 있습니다. 난소 피질의 체외 배양은 여포가 인접한 스트로마에 의해 지원되는 정규화된 환경에서 발전할 수 있게 합니다. 우리의 목표는 소난소 피질의 체외 문화를 통해 난소 미세 환경 (여포 발달, 스테로이드 및 사이토카인 생산)에 영양 계단 단계 식단의 효과를 결정하는 것이었습니다. 이를 위해 난소 피질 조각은 사춘기 이전에 두 가지 영양학적으로 개발된 두 가지 영양학적 개발 체계를 겪고 있는 하이퍼에서 제거되었습니다: 제어(전통적인 영양 발달) 및 Stair-Step(개발 중 의 먹이 주기 및 제한) 약 0.5-1mm3개로 절단되었습니다. 이 조각들은 이후 일련의 세차를 통과하고 웨이머스의 배양 배지를 잘 포함하는 조직 배양 삽입에 배치되었다. 난소 피질은 매일 문화 매체의 변화와 함께 7 일 동안 배양되었다. 조직학적 단면은 추가 치료 없이 영양의 영향과 문화의 영향을 결정하기 위해 문화 전후의 여포 단계 변화를 결정하기 위해 수행되었다. 피질 배양 배지 스테로이드를 측정 하기 위해 일 동안 풀링 되었다, 스테로이드 대사 산물, 그리고 사이토 카인. 난소 미세 환경에서 증가 된 스테로이드 호르몬에 대 한 경향이 있었다 제어 난소 피 질 배양 대 계단 에서 여포 진행을 허용. 난소 피질 배양 기술은 난소 미세 환경의 더 나은 이해를 허용하고, 내분비 분비의 변경이 생체 및 체외 치료 모두에서 여포 진행과 성장에 영향을 미칠 수있는 방법. 이 문화 방법은 또한 비옥을 승진시키기 위하여 여자에 있는 여포 진행을 향상할 수 있는 잠재적인 치료시험을 위한 유익한 증명할 수 있습니다.
서문
난소 피질은 여포 발달이 발생하는 난소의 외부 층을 나타냅니다1. 처음에 개발에서 체포 된 원시 여포는 파라크리네 및 생식샘 호르몬 입력1,2,3,4에기초한 원차, 보조 및 다음 항제 또는 삼차 여포로 활성화됩니다. 난소 내의 생리적 과정을 더 잘 이해하기 위해 조직 배양은 체외 모델로 사용될 수 있으므로 조절된 환경이 실험을 수행할 수 있습니다. 많은 연구가 보조 생식 기술, 불임 보존 및 난소암5,6,7의연구를 위해 난소 조직 문화를이용했습니다. 난소 조직 배양은 또한 난소 건강을 손상시키는 생식 독소를 조사하는 모델로 사용되었으며 다낭성 난소 증후군 (PCOS)8,9,10,11과같은 생식 장애의 병인. 따라서 이 문화 시스템은 다양한 특산품에 적용할 수 있습니다.
설치류에서, 전체 태아 또는 주산기 생식기 생식 실험에 사용 되었습니다12,13,14,15. 그러나, 큰 국내 가축에서 gonads그들의 큰 크기와 잠재적인 변성 때문에 전체 기관으로 배양 될 수 없습니다. 따라서, 소, 및 비인간 영장류 난소 피질은 작은조각으로 절단된다 16,17,18. 많은 연구는 국내 가축및 비인간 영장류에서 원시 여포 개시에서 다양한 성장 인자를 연구하기 위해 작은 난소 피질 조각을배양1,17,18,19. 난소 피질 문화의 사용은 또한 7 일20동안 배양 된 소와 영장류 피질 조각에 대한 혈청이 없는 상태에서 원시 여포 개시를 입증했다. 양과 포춘은 2006년 10일 이상 다양한 테스토스테론 투여량으로 태아 난소 피질 배양 배지를 치료하고,10-7M 의 테스토스테론 농도가 여포 모집, 생존, 초기 단계 여포의 진행 증가등을 관찰하였다 19. 2007년, 소 태아(임신 5-8개월)로부터 난소 피질 배양을 사용하여 양과 포춘은 1차에서 이차 여포전환(21)에혈관 내피 성장 인자 A(VEGFA)의 역할을 보고했다. 더욱이, 당사의 실험실은 VEGFA가16을결합하는 주요 신호 전달 수용체인 키나제 도메인 수용체(KDR)를 통해 VEGFA 이소형성(혈관형성, 항혈관형성 및 조합)이 어떻게 다른 신호 전달 경로를 조절할 수 있는지 를 보여주기 위해 난소 피질 배양을 활용하였다. 이 정보는 다른 VEGFA 동소 형태가 여포 진행 또는 체포를 유도하는 신호 경로에 미치는 영향을 더 잘 이해할 수 있었습니다. 함께 촬영, 다른 스테로이드 또는 성장 인자와 체외에서 난소 피질 조각의 배양 여 포 여 추 신을 조절 하는 메커니즘에 미치는 영향을 결정 하는 귀중 한 분석 될 수 있습니다. 유사하게, 다른 영양 정권에 개발되는 동물은 여성 생식 성숙에 영향을 미치는 여포 발생을 촉진하거나 억제 할 수있는 난소 미세 환경을 변경했을 수 있습니다. 따라서, 현재 원고에서 우리의 목표는 소 피질 배양 기술을 보고하고이전에설명된 바와 같이 13개월에 수집된 암소 피질로부터 소 피질의 체외 배양 후 난소 미세환경에 차이가 있는지 여부를 결정하는 것입니다.
따라서, 우리의 다음 단계는 다른 영양 식단으로 개발 된 이 암소에서 난소 미세 환경을 결정하는 것이었습니다. 우리는 계단 단계 또는 제어 규정식으로 공급된 암낭에서 난소 피질을 평가했습니다. 제어 용 heifers는 84 일 동안 97.9 g / kg0.75의 유지 보수 식단을 제공받았다. Stair-Step 규정식은 84 일 동안 67.4 g/kg0.75의 제한된 규정식을 포함하는 8 달에 시작되었습니다. 처음 84일 후, 컨트롤 하이퍼는 97.9 g/kg0.75를계속 받았지만, 계단-스텝 쇠고기 하이퍼는 68일 동안 118.9g/kg0.75를 제공받았으며, 그 후16세의 13개월 동안 모낭 단계와 모폴로지의 변화를 연구하기 위해 16세에 소독화되었다. 우리는 또한 스테로이드에 차이 대 한 분석, 스테로이드 대사 산물, chemokines, 그리고 시토 카인 피 질 매체로 분 비. 스테로이드와 다른 대사 산물 생체 내에서 실시 하는 치료에서 어떤 직접적인 효과 있는지 확인 하기 위해 측정 되었다 및/또는 조직 생존 및 생산성에 시험관 내. 문화 이전과 후 난소 미세 환경의 변화는 문화 전에 내분비 밀리우와 여포 발생의 스냅 샷을 제공하고 문화 동안 문화 또는 치료가 여포 진행 또는 체포에 미치는 영향.
난소는 미국에서 혈관 절제술이 수행 된 후 수집되었다. 육류 동물 연구 센터 (USMARC)는16세의 13 개월에 제어 및 계단 - 스텝 암종의 IACUC 절차에 따라, 혈액 및 기타 오염 물질을 제거하기 위해 0.1 %의 항생제로 세척, 초과 조직을 손질하고 네브래스카 - (UNL 생식 의학) 3°C로 수송 . UNL에서 난소 피질 조각은 작은 사각형 조각으로 절단되었습니다 (~ 0.5-1 mm3; 그림 1) 7 일 동안 배양(그림 2). 조직학은 모낭 단계16,24 (도 3 및 도 4)및 섬유증을 나타낼 수 있는 세포외 매트릭스 단백질(Picro-Sirus Red, PSR; 그림 5). 이것은 여포 단계에 생체 내 영양 정권의 효력의 결정을 허용하고 여포 단계 및 여포 진행에 난소 피질의 7 일 비교를 허용했습니다. 배양 전반에 걸쳐, 배지는 매일 수집 및 변경되었습니다 (약 70%의 미디어가 매일 수집되었다; 250 μL/well) 그래서 매일 호르몬/사이토카인/케모킨을 평가하거나 평균 농도를 얻기 위하여 며칠 동안 풀로 울 수 있습니다. 안드로스텐디온(A4) 및 에스트로겐(E2)과 같은 스테로이드는 3일 이상 풀려나 방사선 면역분석술(RIA;; 그림 6) 및 동물 당 4 일 이상 풀및 고성능 액체 크로마토그래피 질량 분광법 (HPLC-MS)24,25 (표 1)를통해 분석. 사이토카인 어레이는 난소 피질 배양배지(26)에서 사이토카인 및 체모킨 농도를 평가하기 위해 활용되었다(표 2). 실시간 중합효소 연쇄 반응(RT-PCR) 분석 플레이트는 이전에16회입증된 바와 같이 특정 신호 트랜스듀션 경로에 대한 유전자 발현을 결정하기 위해 수행되었다. 모든 스테로이드, 사이토카인, 여포 단계 및 조직학적 마커는 난소 미세 환경의 스냅샷과 "정상" 또는 "비정상적인" 여포 발생을 촉진하는 마이크로 환경의 능력에 대한 단서를 제공합니다.
프로토콜
난소는 미국 육류 동물 연구 센터16에서수득하였다. 앞서 언급한 바와같이,농업 연구 및 교육에서 농업 동물의 관리 및 사용에 대한 지침에 따라 미국 육류 동물 연구 센터 (USMARC) 동물 관리 및 사용위원회에 의해 모든 절차가 승인되었습니다. 난소는 네브래스카 링컨 생식 연구소로 옮겨졌으며, 그곳에서 가공되고 배양되었습니다.
1. 필수 미디어 준비
-
웨이머스 MB 752/1 매체
- 멸균 수의 900mL로 1 L 티슈 배양 병을 채웁니다. 물이 교반 판에 부드럽게 저어주면서 가루 를 점차적으로 넣습니다. 분말 매체가 용해되면 중탄산나트륨 2.24g을 넣고 소세럼 알부민(BSA)을 1.25g씩 첨가한다. pH 미터를 사용하고 pH를 7.25-7.35로 조정합니다. 멸균 물을 추가하여 최종 부피를 1L로 가져옵니다.
- 생물학적 안전 캐비닛으로 이동하고 배지의 0.1 % v / v의 농도에 페니실린 연쇄 상균 황산염을 추가합니다. 0.22 μm 모공 33.2cm2 500 mL 병 상단 필터로 매체를 필터링합니다.
- 여과된 배지를 여러 50mL 원문 튜브에 붓습니다. 알리인용 배지의 50mL 당 인슐린-트랜스퍼린 셀레늄0.5mL를 추가합니다.
- 알루미늄 호일에 매체의 원물 튜브 및 스톡 병을 감싸고 4 °C에 보관하십시오. 이 매체는 빛에 민감합니다.
참고: 웨이머스 배지는 최대 1개월 동안 보관할 수 있습니다.
-
라이보비츠의 L-15 (LB-15) 매체
참고 : LB-15 배지는 문화에 대비하여 조직을 청소하는 데 사용됩니다.- 멸균 수의 900mL로 1 L 티슈 배양 병을 채웁니다. 멸균물이 교반판에 부드럽게 저어주면서, 준비된 가루 매체를 점진적으로 추가합니다. pH 미터를 사용하고 pH를 7.25-7.35로 조정합니다. 멸균 물을 추가하여 최종 부피를 1L로 가져옵니다.
- 생물학적 안전 캐비닛으로 이동합니다. 0.1%의 항생제로 LB-15 1L을만드십시오(재료표 참조). 0.22 μm 모공 33.2 cm2 500 mL 병 상단 필터를 사용하여 배지를 2 개의 500 mL 조직 배양 병으로 필터링하십시오. LB-15 배지가 빛에 민감하고 4 °C에서 저장으로 알루미늄 호일에 병을 감쌉니다.
참고: LB-15 배지는 최대 1개월 동안 보관할 수 있습니다.
-
인산염 완충식식염수(PBS)
- 실험실에서 PBS를 만들거나 칼슘이나 마그네슘(재료의 표)없이멸균 PBS를 구입합니다. 실험실에서 PBS를 만들려면 증류수 800mL로 시작하여 8 g의 염화 나트륨(NaCl)을 추가하십시오. 그런 다음 염화칼륨(KCl), 인산나트륨 디베이직 1.44g(Na2HPO4),칼륨 인산염 디베이직 0.24g(KH2PO4)을추가합니다. pH를 ~7.4로 조정하고 총 부피를 1L로 조정하여 용액을 소독합니다.
- 생물학적 안전 캐비닛에있는 동안 0.1 %의 항생제 (재료의 표참조)와 1 L PBS를 확인합니다.
2. 난소 피질 배양 프로토콜
참고: 난소는 13개월에 태어난 USMARC 휴퍼로부터 수득되었습니다. 난소는 철저히 헹구었고, 모든 혈액 및 기타 액체는 항생제(0.1%)를 함유하는 PBS로 제거되었고, 37°C23에서 네브래스카-링컨 생식연구소 UNL(1.5h 거리)으로 이송하였다. (운송 중 난소 의 온도에 대한 의견은 토론을참조하십시오)
- 깨끗한 벤치에 난소 조직을 준비(그림 1).
- 70%의 에탄올로 깨끗한 벤치를 소독합니다. 벤치탑에 신선한 흡수 패드를 놓습니다. 깨끗한 벤치 송풍기는 흡수 패드를 포함하여 깨끗한 벤치에서 아무것도 살균하고 적절한 PPE가 사용되는지 확인하기 위해 UV 빛과 함께 해부 반 시간 전에 켜져 있는지 확인합니다.
- 페트리 접시(60 x 15mm)를 조직 세정에 준비합니다. PBS 세척에는 3개의 페트리 요리, 항생제를 가진 PBS의 경우 3개, LB-15 세척용 3개가 필요합니다. 뚜껑이 포함된 추가 LB-15 페트리 접시는 세척 후 조각의 최종 배치에 사용됩니다.
- 각 페트리 접시를 PBS 또는 LB-15 중 약 10mL의 적절한 유체로 채웁니다.
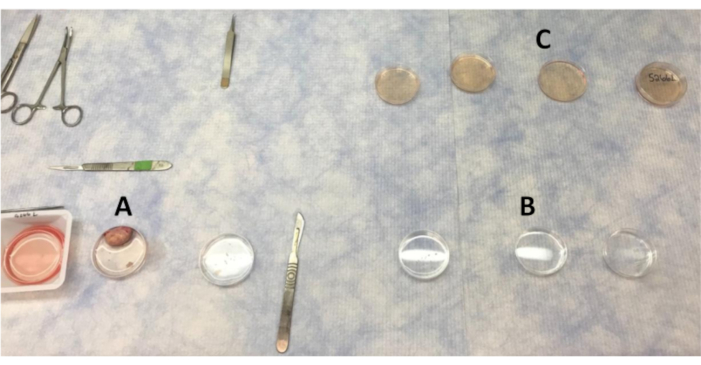
그림 1:깨끗한 벤치에서난소와 피질 조각을 세척하기위한 플레이트의 레이아웃. (A)피질의 섹션이 제거됨에 따라 난소를 세척하는 데 사용되는 PBS. (B)피질 조각이 통과하는 항생제 세동을 가진 PBS. (C)난소 피질 조각은 LB-15에서 최종 세척을 위해 생물 안전 캐비닛으로 이동하기 전에 LB-15에서 4번 세척된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 냉장고에서 준비된 웨이머스 와 LB-15 매체를 제거하고 따뜻한 온도에서 실온으로 제거합니다.
- 사용하기 전에 멸균을 보장하기 위해 모든 도구를 자동 복제합니다.
- 난소 피질이 수집 될 준비가 될 때까지 37 °C에서 난소를 유지합니다.
- 톱니 모양의 턱이 있는 집게를 사용하여 난소를 집어 들고 PBS가 가득한 페트리 접시를 철저히 씻으십시오. 난소를 두 번째 PBS 세척으로 옮기고 다시 한 번 철저히 정화합니다.
참고: 난소 피질 스트립이 제거되는 동안 난소는 두 번째 PBS 세척에 유지됩니다. - 톱니 모양의 턱 집게를 사용하여 난소를 고정하고 반으로 자릅니다. 이 때 난소 피질은 수질에서 절단됩니다. 눈금자를 사용하여 난소 의 표면 깊이의 1-2mm 이상이수질(16)에서제거되지 않도록 하십시오. 수질에서 난소 피질의 횡단 섹션을 제거하고 메스 (#11 메스 블레이드;#3 핸들)로 난소 피질의 3-4 얇은 스트립을 자르고 세 번째 PBS가 채워진 페트리 접시에 스트립을 놓습니다.
참고: 이 때, RNA 추출을 위해 추가 난소 피질 조직을 수집하거나 초기 비배양피질 조각의 조직학을 위해 고정 및 수집될 수 있다. 난소 피질의 스트립을 제거할 때, 눈에 보이는 개미 여포 또는 코포라 루테아가 있는 부위를 피하십시오. 또한 수질 조직을 수집하지 마십시오. 수질의 히스토로지(16)는 이전에표시된 것과 매우 다릅니다. 난소 피질이 1-2mm 깊이 이상으로 절단되지 않으면 수질을 얻을 수 없습니다. 뚜렷한 히스토로지에서는 피질과 수질 사이의 랜드마크가 있습니다. - 세 번째 PBS 워시의 난소 피질 스트립을 #21 메스 블레이드로 작고 사각 조각(~0.5-1mm3)으로자른다. 페트리 접시 아래에 있는 통치자를 사용하여 조각이 비슷한 크기와 두께를 보장하여 일관된 난소 피질 조각을 만듭니다. 메스로 조각을 자르면서 스트립을 고정하려면 집게를 사용합니다.
참고: 절단된 조직 조각의 수는 실험에 따라 달라집니다. 난소 피질의 4 개는 문화에 필요한 조직의 최소 금액입니다. 적절한 길이와 깊이를 보장하기위한 다른 방법은 템플릿(27)으로특수 슬라이서(26) 또는 미리 절단 플라스틱 조각을 사용하는 것을 포함한다. - 항생제로 채워진 페트리 요리로 세 PBS를 통해 난소 피질 조각을 씻으시다. 곡선 팁 집게를 사용하여 세차 사이에 조각을 이동합니다.
- LB-15 세차재 시리즈를 통해 피질 조각을 이동하고 최종 LB-15 채워진 페트리 접시에 배치합니다. 뚜껑에 동물 ID와 난소 면(왼쪽 또는 오른쪽)으로 라벨을 붙입니다.
참고: 철저한 세척을 위해 각 세척에 난소 피질 조각을 완전히 담급하십시오. - 난소 당 4 개의 난소 피질 조각을 수집하고 하루 제로 히스토로지 수정합니다. 추가 조각은 또한 RNA를 위해 동결플래시될 수 있습니다. 나머지 조직 조각은 문화에 사용됩니다. 각 조직 수집 후 70%의 에탄올로 해부 도구를 닦아냅니다.
- 최종 조직 세척 및 문화 준비를 위한 생물학적 안전 캐비닛을 준비하십시오. 생물학적 안전 캐비닛에 넣기 전에 70%의 에탄올로 소모품을 소독합니다. 생물학적 안전 캐비닛에서 작업할 때 무균 기술을 사용합니다.
- 문화를 위한 모든 난소 피질을 생물학적 안전 캐비닛으로 옮기고 LB-15가 채워진 페트리 접시에 다시 한 번 씻으실 수 있습니다.
- 24웰 조직 배양 플레이트에서 웨이머스 배지의 파이펫 350 μL은 웰당.
- 코팅되지 않은 배양체를 각 웰에 잘 삽입하여 집게를 사용합니다. 이 조직이 건조 될 것 같은 삽입의 밑에 형성되지 않는 것을 확인합니다. 매체는 매체가 흡수되고 난소 피질 조각을 둘러싸고 있을 수 있도록 인서트를 만져야 합니다.
- 각 인서드의 메쉬에 4개의 난소 피질 조각을 조심스럽게 배치합니다(그림2). 집게는 조직 조각이 섬세하게 배치되지 않으면 메쉬를 펑크 할 수 있습니다. 조직 조각은 서로 또는 삽입의 측면을 만지지 않아야합니다.
- 조직을 37 °C에서5 % CO216으로배양하십시오.
참고 : 다른 사람들은 38.8 °C28을사용했다. 그러나, 조직의 무결성이나 37°C 조직에서 진행되는 여포의 능력에서 차이가 관찰되지 않았으며 다른39,30이있다. 따라서, 이 시점에서 이러한 온도 중 어느 것이 성공 실험에 도움이 되어야 한다. 다른 사람들은 매체의 400 μL을 사용했습니다. 어느 양중 하나는 일관된 한, 조직이 부분적으로 침수되어 조직의 수분을 허용합니다 (난소 피질 조각을 둘러싼 미디어). 다른 우물의 증발을 줄이기 위해 멸균 물의 500 μL로 빈 우물을 채웁니다.

도 2: 난소 피질 조각 및 배양 판. (A)난소 스트립은 난소의 피질에서 절단되는. (B)눈금자와 피질 조각이 나란히 표시됩니다. (C)4개의 피질 조각(~0.5-1 mm3)이플레이트 내의 배양 배지에 삽입에 놓여 있다. (D)우물에서 배양 배지를 수집하는 인서트를 들어 올린다. 적절한 pH를 유지하기 위해 매일 모든 배양 배지(250 μL)를 수집하고 교체합니다.매일 매일 약 250 μL(초기 배양 배지의 약 70%)에서 얻어진다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 미디어 컬렉션
- 난소 피질 배양 배지를 매일 7일 동안 변경합니다. 중간 변화는 매체의 큰 pH 및 색상 변화를 방지하기 위해 가능한 한 24h 에 가까워야합니다. 중간 변화 전에 37 °C에 따뜻한 웨이머스 중간. 매일 약 250 μL이 매일 우물에서 얻습니다 (초기 배양 매체의 약 70 %).
- 중간 변경 시 집게를 사용하여 삽입을 웰에서 부드럽게 들어 올립니다. 배양 된 웨이머스 배지를 0.5 mL 튜브 (약 250 μL /일)로 수집합니다. 인서트를 다시 잘 설정하고 삽입의 측면 사이에 배지를 분배하여 신선한 배양 배지의 350 μL을 추가합니다.
참고: 모든 스테로이드를 측정 하기 위해 충분 한 미디어를 얻기 위해 매일 미디어의 대부분을 변경, 사이토 카인, 그리고 난소 미세 환경을 결정 하는 데 필요한 chemokines. 또한, 매일 매체의 변화는 매체에서 큰 pH 변화(색상 변화에 의해 표시)를 방지하는 것이 중요하다. 나타리안 피질 조각을 둘러싸고 배지 방울을 유지하여 조각이 젖은 상태로 유지되도록 했습니다. 미디어의 70%를 변경하기 때문에 배양 된 조직에 아무런 문제가 관찰되지 않았습니다. - 조직 배양으로부터 수집된 배지를 -20°C로 저장합니다.
4. 이미징 및 다운스트림 처리
- 37°C에서5%CO2로7일간의 배양 후, 부착된 카메라와 컴퓨터 이미징 소프트웨어 프로그램을 갖춘 해부 현미경을 이용한 난소 피질 조각을 이미지화한다.
참고: 어두운 방은 일반적으로 이미징을위한 최고의 화질을 달성하는 데 가장 좋습니다. - 이미징 후, 부인에서 잘 2개의 난소 피질 조각을 고치고, cDNA에 대한 RNA를 얻기 위해 액체 질소에 두 개의 난소 피질 조각을 동결한다. 조직으로 모든 우물에 대한이 단계를 반복합니다. 7일째부터 배지를 수집하고 -20 °C에보관하십시오.
- 난소 피질 조각이 부인(picric acid 750mL, 빙하 아세트산 50mL, 37%-40% 포르말린 250mL)에 잠그고 약 1.5시간 동안 에탄올을 3회 세척합니다. 조직은 70% 에탄올에 남아 용액이 더 이상 노랗지 않을 때까지 매일 지워질 것입니다.
참고: 부인 이외의 고정물뿐만 아니라 파라포름알데히드를 사용할 수 있습니다. 이 체험부에서 부인은 최적의 형태를 달성하기 위한 고정성으로서 사용된다. 다른 분석에 더 많은 조직이 필요한 경우, 각 동물에서 미디어 와 난소 피질의 조각의 추가 우물을 얻을 수 있습니다.
결과
이 소 피질 배양 절차는 난소의 작은 조각에서 호르몬, 사이토카인 및 작사학 데이터의 다양한 을 결정하기 위하여 이용될 수 있습니다. 헤마톡시린 및 에오신(H&E)과 같은 염색은 여포 스테이징16,23,31(도 3)을통해 난소 형태를 결정하는 데 사용될 수 있다. 간략하게, 여포는 원형으로 분류되었다, 이는 편?...
토론
이 원고에 설명된 바와 같이 체외 난소 피질 문화의 장점은 여포를 둘러싼 인접한 기질이 있는 정상화된 환경에서 여포가 발전한다는 것입니다. 체세포 및 난소세포는 그대로 유지되며 생체 내 모델으로서 적절한 세포 간 통신이 있다. 우리의 실험실은 7 일 문화 시스템이 난소 피질의 처리를 위한 대표적인 여포 신생 및 스테로이드 발생 데이터를 제공한다는 것을 것을을 발견했습니다. 다른 난?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 ASC에 국립 식품 농업 연구소에 의해 지원 되었다 2013-67015-20965 ASC에, 건강 경쟁 보조금에 대 한 네브래스카 식품 대학. 미국 농무부 보조금 NEB26-202/W3112 가입 #1011127 ASC, 해치-NEB ANHL 가입 #1002234 ASC에. 양적 생명 과학 이니셔티브 여름 박사 후 학자 지원 – CMS에 대한 여름 자금에 대한 COVID-19 상.
저자는 로버트 쿠시먼 박사, 미국 육류 동물 연구 센터, 클레이 센터, NE박사에게 감사를 표하고 싶습니다 이전 출판물에서 난소를 제공 한 그에게 감사, 이는 다음이 기술을 검증하는 개념의 증거로 현재 논문에 사용된.
자료
| Name | Company | Catalog Number | Comments |
| #11 Scapel Blade | Swann-Morton | 303 | Scaple Blade |
| #21 Scapel Blade | Swann-Morton | 307 | Scaple Blade |
| 500mL Bottle Top Filter | Corning | 430514 | Bottle Top Filter 0.22 µm pore for filtering medium |
| AbsoluteIDQ Sterol17 Assay | Biocrates | Sterol17 Kit | Samples are sent off to Biocrates and steroid panels are run and results are returned |
| Androstenedione Double Antibody RIA Kit | MPBio | 7109202 | RIA to determine androstenedione from culture medium |
| Belgium A4 Assay Kit | DIA Source | KIP0451 | RIA to determine androstenedione from culture medium |
| Bovine Cytokine Array Q3 | RayBiotech | QAB-CYT-3-1 | Cytokine kit to determine cytokines from culture medium |
| cellSens Software Standard 1.3 | Olympus | 7790 | Imaging Software |
| Insulin-Transferrin-Selenium-X | Gibco ThermoFisher Scientific | 5150056 | Addative to the culture medium |
| Leibovitz's L-15 Medium | Gibco ThermoFisher Scientific | 4130039 | Used for tissue washing on clean bench, and in the biosafety cabniet |
| Microscope | Olympus | SZX16 | Disection microscope used for imaging tissue culture pieces |
| Microscope Camera | Olympus | DP71 | Microscope cameraused for imaging tissue culture pieces |
| Millicell Cell Culture Inserts 0.4µm, 12,mm Diameter | Millipore Sigma | PICM01250 | Inserts that allow the tissue to rest against the medium without being submerged in it |
| Multiwell 24 well plate | Falcon | 353047 | Plate used to hold meduim, inserts, and tissues |
| Petri dish 60 x 15 mm | Falcon | 351007 | Petri dish used for washing steps prior to culture |
| Phosphate-Buffered Saline (PBS 1X) | Corning | 21-040-CV | Used for tissue washing |
| SAS Version 9.3 | SAS Institute | 9.3 TS1M2 | Statistical analysis software |
| Thomas Stadie-Riggs Tissue Slicer | Thomas Scientific | 6727C10 | Tissue slicer for preperation of thin uniform sections of fresh tissue |
| Waymouth MB 752/1 Medium | Sigma-Aldrich | W1625 | Medium used for tissue cultures |
참고문헌
- Braw-Tal, R., Yossefi, S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. Journal of Reproduction and Fertility. 109, 165-171 (1997).
- Nilsson anEdson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Fortune, J. E., Cushman, R. A., Wahl, C. M., Kito, S. The primordial to primary follicle transition. Molecular and Cellular Endocrinology. 163, 53-60 (2000).
- Ireland, J. J. Control of follicular growth and development. Journal of Reproduction and Fertility. 34, 39-54 (1987).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Ramezani, M., Salehnia, M., Jafarabadi, M. Short term culture of vitrified human ovarian cortical tissue to assess the cryopreservation outcome: molecular and morphological analysis. Journal of Reproduction & Infertility. 18 (1), 162-171 (2017).
- McLaughlin, M., Telfer, E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Stefansdottir, A., Fowler, P. A., Powles-Glover, N., Anderson, R. A., Spears, N. Use of ovary culture techniques in reproductive toxicology. Reproductive Toxicology. 49, 117-135 (2014).
- Bromfield, J. J., Sheldon, I. M. Lipopolysaccharide reduces the primordial follicle pool in the bovine ovarian cortex ex vivo and in the murine ovary in vivo. Biology of Reproduction. 88 (4), 1-9 (2013).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Humane Reproduction Update. 14 (4), 367-378 (2008).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicological Sciences. 90 (2), 500-509 (2006).
- Bott, R. C., McFee, R. M., Clopton, D. T., Toombs, C., Cupp, A. S. Vascular endothelial growth factor and kinase domain region receptor are involved in both seminiferous cord formation and vascular development during testis morphogenesis in the rat. Biology of Reproduction. 75, 56-67 (2006).
- Baltes-Breitwisch, M. M., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms or administration of proangiogenic isoforms stimulates vascular development in the rat testis. Reproduction. 140 (2), 319-329 (2010).
- McFee, R. M., et al. Inhibition of vascular endothelial growth factor receptor signal transduction blocks follicle progression but does not necessarily disrupt vascular development in perinatal rat ovaries. Biology of Reproduction. 81, 966-977 (2009).
- Artac, R. A., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms is more effective than treatment with proangiogenic isoforms in stimulating vascular development and follicle progression in the perinatal rat ovary. Biology of Reproduction. 81, 978-988 (2009).
- Abedal-Majed, M. A., et al. Vascular endothelial growth factor A isoforms modulate follicle development in peripbertal heifers independent of diet through diverse signal transduction pathways. Biology of Reproduction. 102 (3), 680-692 (2020).
- Wandji, S. A., Srsen, V., Voss, A. K., Eppig, J. J., Fortune, J. E. Initiation in vitro of bovine primordial follicles. Biology of Reproduction. 55, 942-948 (1996).
- Wandji, S. A., Srsen, V., Nathanielsz, P. W., Eppig, J. J., Fortune, J. E. Initiation of growth of baboon primordial follicles in vitro. Human Reproduction. 12 (9), 1993-2001 (1993).
- Yang, M. Y., Fortune, J. E. Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75, 924-932 (2006).
- Fortune, J. E., Kito, S., Wandji, S. A., Srsen, V. Activation of bovine and baboon primordial follicles in vitro. Theriogenology. 49, 441-449 (1998).
- Yang, M. Y., Fortune, J. E. Vascular endothelial growth factor stimulates the primary to secondary follicle transition in bovine follicles in vitro. Molecular Reproduction and Development. 74, 1095-1104 (2007).
- Barberino, R. S., Silva, J. R. V., Figueiredo, J. R., Matos, M. H. T. Transport of domestic and wild animal ovaries: a review of the effects of medium, temperature, and periods of storage on follicular viability. Biopreservation and Biobanking. 17 (1), 84-90 (2019).
- Summers, A. F., et al. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess. PLoS One. 9 (10), e110683 (2014).
- Koal, T., Schmiederer, D., Pham-Tuan, H., Rohring, C., Rauh, M. Standardized LC-MS/MS based steroid hormone profile analysis. The Journal of Steroid Biochemistry and Molecular Biology. 129, 129-138 (2012).
- Poole, R. K., Brown, A. R., Pore, M. H., Pickworth, C. L., Poole, D. H. Effects of endophyte-infected tall fescue seed and protein supplementation on stocker steers: II. Adaptive and innate immune function. Journal of Animal Science. 97 (10), 4160-4170 (2019).
- Laronda, M., et al. Alginate encapsulation supports the growth and differentiation of human primordial follicles within ovarian cortical tissue. Journal of Assisted Reproduction and Genetics. 31 (8), 1013-1028 (2014).
- Silber, S. J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23 (7), 1531-1537 (2008).
- Wiedemann, C., Zahmel, J., Jewgenow, K. Short-term culture of ovarian cortex pieces to assess the cryopreservation outcome in wild fields for genome conservation. BMC Veterinary Research. 9 (37), (2013).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354 (3), 869-880 (2013).
- Shimizu, T., Miyamoto, A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk-1, its receptor, in bovine granulosa cells. Animal Reproduction Science. 102 (3-4), 228-237 (2007).
- Tepekoy, F., Akkoyunlu, G. The effect of FSH and activin A on Akt and MAPK1/3 phosphorylation in cultured bovine ovarian cortical strips. Journal of Ovarian Research. 9 (13), 1-9 (2016).
- Beck, K., Singh, J., Arshud Dar, M., Anzar, M. Short-term culture of adult bovine ovarian tissues: chorioallantoic membrane (CAM) vs. traditional in vitro culture systems. Reproductive Biology and Endocrinology. 16 (1), 21 (2018).
- Eppig, J. J. Oocyte control of ovarian follicular development and function in mammals. Reproduction. 122 (6), 829-838 (2001).
- Paczkowski, M., Silva, E., Schoolcraft, W. B., Krisher, R. L. Comparative importance of fatty acid beta-oxidation to nuclear maturation, gene expression, and glucose metabolism in mouse, bovine, and porcine cumulus oocyte complexes. Biology of Reproduction. 88 (5), 1-11 (2013).
- Raffel, N., et al. Is ovarian tissue transport at supra-zero temperatures compared to body temperature optimal for follicle survival?. In Vivo. 34 (2), 533-541 (2020).
- Duncan, F., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction (Cambridge, England). 152 (6), R201-R210 (2016).
- Liebenthron, J., et al. Overnight ovarian tissue transportation for centralized cryobanking: a feasible option. Reproductive BioMedicine Online. 38 (5), 740-749 (2019).
- Mohammed, B. T., Donadeu, F. X. Bovine granulosa cell culture. Epithelial Cell Culture: Methods and Protocols. , 79-87 (2018).
- Langbeen, A., et al. Effects of neutral red assisted viability assessment on the cryotolerance of isolated bovine preantral follicles. Journal of Assisted Reproduction Genetics. 31, 1727-1736 (2014).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Yang, M. Y., Fortune, J. E. Changes in the transcriptome of bovine ovarian cortex during follicle activation in vitro. Physiological Genomics. 47, 600-611 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유