È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Coltura tissutale della corteccia ovarica bovina
In questo articolo
Riepilogo
Viene presentata la coltura in vitro della corteccia ovarica bovina e l'effetto della dieta nutrizionale a gradini sul microambiente ovarico. I pezzi di corteccia ovarica sono stati coltivati per sette giorni e sono stati valutati steroidi, citochine e stadi follicolari. Il trattamento dietetico Stair-Step aveva aumentato la steroidogenesi con conseguente progressione del follicolo in coltura.
Abstract
Lo sviluppo del follicolo dallo stadio primordiale a quello antrale è un processo dinamico all'interno della corteccia ovarica, che include fattori endocrini e paracrini da cellule somatiche e comunicazione cellula-ovocita cumulo. Poco si sa sul microambiente ovarico e su come le citochine e gli steroidi prodotti nell'ambiente circostante influenzino la progressione o l'arresto del follicolo. La coltura in vitro della corteccia ovarica consente ai follicoli di svilupparsi in un ambiente normalizzato che rimane supportato da stroma adiacente. Il nostro obiettivo era determinare l'effetto della dieta nutrizionale Stair-Step sul microambiente ovarico (sviluppo follicolare, produzione di steroidi e citochine) attraverso la coltura in vitro della corteccia ovarica bovina. Per raggiungere questo obiettivo, i pezzi corticali ovarici sono stati rimossi dalle giovenche sottoposte a due diversi schemi nutrizionalmente sviluppati prima della pubertà: Control (sviluppo nutrizionale tradizionale) e Stair-Step (alimentazione e restrizione durante lo sviluppo) che sono stati tagliati in circa 0,5-1 mm3 pezzi. Questi pezzi sono stati successivamente passati attraverso una serie di lavaggi e posizionati su un inserto di coltura tissutale che è incastonato in un pozzo contenente il terreno di coltura di Waymouth. La corteccia ovarica è stata coltivata per 7 giorni con cambiamenti quotidiani dei terreni di coltura. Il sezionamento istologico è stato eseguito per determinare i cambiamenti dello stadio follicolare prima e dopo la coltura per determinare gli effetti della nutrizione e l'impatto della coltura senza ulteriori trattamenti. Il terreno di coltura della corteccia è stato raggruppato per giorni per misurare steroidi, metaboliti steroidei e citochine. C'erano tendenze per l'aumento degli ormoni steroidei nel microambiente ovarico che ha permesso la progressione del follicolo nelle colture di corteccia ovarica Stair-Step versus Control. La tecnica di coltura della corteccia ovarica consente una migliore comprensione del microambiente ovarico e di come le alterazioni della secrezione endocrina possono influenzare la progressione e la crescita del follicolo da trattamenti sia in vivo che in vitro. Questo metodo di coltura può anche rivelarsi utile per testare potenziali terapie che possono migliorare la progressione del follicolo nelle donne per promuovere la fertilità.
Introduzione
La corteccia ovarica rappresenta lo strato esterno dell'ovaio in cui si verifica lo sviluppo del follicolo1. I follicoli primordiali, inizialmente arrestati nello sviluppo, saranno attivati per diventare follicoli primari, secondari e quindi antrali o terziari basati su input paracrini e gonadotropine1,2,3,4. Per comprendere meglio i processi fisiologici all'interno dell'ovaio, la coltura tissutale può essere utilizzata come modello in vitro, consentendo così un ambiente controllato per condurre esperimenti. Molti studi hanno utilizzato la coltura del tessuto ovarico per la ricerca nella tecnologia di riproduzione assistita, nella conservazione della fertilità e nel cancro ovarico5,6,7. La coltura del tessuto ovarico è servita anche come modello per studiare le tossine riproduttive che danneggiano la salute ovarica e l'eziologia di disturbi riproduttivi come la sindrome dell'ovaio policistico (PCOS)8,9,10,11. Pertanto, questo sistema di cultura è applicabile a una vasta gamma di specialità.
Nei roditori, gonadi fetali o perinatali intere sono state utilizzate negli esperimenti di biologia riproduttiva12,13,14,15. Tuttavia, le gonadi di bestiame domestico più grande non possono essere coltivate come organi interi a causa delle loro grandi dimensioni e della potenziale degenerazione. Pertanto, la corteccia ovarica dei primati bovini e non umani viene tagliata in pezzi più piccoli16,17,18. Molti studi hanno coltivato piccoli pezzi di corteccia ovarica per studiare vari fattori di crescita nell'iniziazione del follicolo primordiale nel bestiame domestico e nei primati non umani1,17,18,19. L'uso della coltura della corteccia ovarica ha anche dimostrato l'inizio del follicolo primordiale in assenza di siero per pezzi corticali bovini e primati coltivati per 7 giorni20. Yang e Fortune nel 2006 hanno trattato il terreno di coltura della corteccia ovarica fetale con una gamma di dosi di testosterone nell'arco di 10 giorni e hanno osservato che la concentrazione di10-7 M di testosterone aumentava il reclutamento del follicolo, la sopravvivenza e l'aumento della progressione dei follicoli in fase iniziale19. Nel 2007, utilizzando colture di corteccia ovarica da feti bovini (5-8 mesi di gestazione), Yang e Fortune hanno riportato un ruolo per il fattore di crescita endoteliale vascolare A (VEGFA) nella transizione del follicolo primario-secondario21. Inoltre, il nostro laboratorio ha utilizzato colture di corteccia ovarica per dimostrare come le isoforme VEGFA (angiogeniche, antiangiogeniche e una combinazione) possono regolare diverse vie di trasduzione del segnale attraverso il recettore del dominio chinasico (KDR), che è il principale recettore di trasduzione del segnale che VEGFA lega16. Queste informazioni hanno permesso una migliore comprensione di come le diverse isoforme di VEGFA influenzano le vie di segnalazione per provocare la progressione o l'arresto del follicolo. Nel loro insieme, la coltura di pezzi di corteccia ovarica in vitro con diversi steroidi o fattori di crescita può essere un saggio prezioso per determinare gli effetti sui meccanismi che regolano la follicologenesi. Allo stesso modo, gli animali che si sviluppano su diversi regimi nutrizionali possono avere microambienti ovarici alterati, che possono promuovere o inibire la follicologenesi che influenza la maturità riproduttiva femminile. Pertanto, il nostro obiettivo nel manoscritto attuale è quello di riportare la tecnica di coltura della corteccia bovina e determinare se ci sono differenze nei microambienti ovarici dopo la coltura in vitro della corteccia bovina da giovenche alimentate con diete di controllo o Stair-Step raccolte a 13 mesi di età come descritto in precedenza16.
Pertanto, il nostro passo successivo è stato quello di determinare il microambiente ovarico in queste giovenche che sono state sviluppate con diverse diete nutrizionali. Abbiamo valutato la corteccia ovarica da giovenche alimentate con una dieta Stair-Step o Control. Alle giovenche di controllo è stata offerta una dieta di mantenimento di 97,9 g / kg0,75 per 84 giorni. La dieta Stair-Step è stata iniziata a 8 mesi contenente una dieta ristretta di 67,4 g / kg0,75 per 84 giorni. Dopo i primi 84 giorni, mentre le giovenche di controllo hanno continuato a ricevere 97,9 g/kg0,75,alle giovenche di manzo Stair-Step sono stati offerti 118,9 g/kg0,75 per altri 68 giorni, dopo di che sono state ovariectomizzate a 13 mesi di età16 anni per studiare i cambiamenti negli stadi follicolari e nella morfologia prima e dopo la coltura. Abbiamo anche analizzato le differenze in steroidi, metaboliti steroidei, chemochine e citochine secrete nei mezzi della corteccia. Gli steroidi e altri metaboliti sono stati misurati per determinare se ci fossero effetti diretti dai trattamenti condotti in vivo e/o in vitro sulla vitalità e la produttività dei tessuti. I cambiamenti nel microambiente ovarico prima e dopo la coltura hanno fornito un'istantanea dell'ambiente endocrino e della follicologenesi prima della coltura e di come la coltura o il trattamento durante la coltura influisce sulla progressione o sull'arresto del follicolo.
Le ovaie sono state raccolte dopo che le ovariectomie sono state eseguite presso il Meat Animal Research Center (USMARC) degli Stati Uniti secondo le loro procedure IACUC dalle giovenche control e stair-step a 13 mesi di età16anni, pulite con lavaggi sterili di soluzione salina tampone fosfato (PBS) con antibiotico allo 0,1% per rimuovere sangue e altri contaminanti, tagliato il tessuto in eccesso e trasportato al laboratorio di fisiologia riproduttiva UNL dell'Università del Nebraska-Lincoln (UNL) a 37 ° C23 . All'UNL, i pezzi della corteccia ovarica sono stati tagliati in piccoli pezzi quadrati (~ 0,5-1 mm3; Figura 1) e coltivato per 7 giorni (Figura 2). L'istologia è stata condotta sui vetrini di coltura della corteccia prima e dopo la coltura per determinare gli stadi follicoli16,24 (Figura 3 e Figura 4)e le proteine della matrice extracellulare che possono indicare la fibrosi (Picro-Sirus Red, PSR; Figura 5). Ciò ha permesso la determinazione dell'effetto dei regimi nutrizionali in vivo sugli stadi follicolari e ha permesso il confronto di 7 giorni di corteccia ovarica sugli stadi follicolari e sulla progressione del follicolo. Durante tutta la coltura, il mezzo è stato raccolto e cambiato ogni giorno (circa il 70% dei media è stato raccolto ogni giorno; 250 μL / bene) in modo che gli ormoni giornalieri / citochine / chemochine possano essere valutati o raggruppati su giorni per ottenere concentrazioni medie. Gli steroidi come l'androstenedione (A4) e l'estrogeno (E2) possono essere raggruppati nell'arco di 3 giorni e valutati attraverso il test radioimmunologico (RIA; Figura 6) e raggruppati nell'arco di 4 giorni per animale e analizzati tramite cromatografia liquida ad alte prestazioni-spettrometria di massa (HPLC-MS)24,25 (Tabella 1). Gli array di citochine sono stati utilizzati per valutare le concentrazioni di citochine e chemochine nel terreno di coltura della corteccia ovarica26 (Tabella 2). Le piastre di analisi della reazione a catena della polimerasi in tempo reale (RT-PCR) sono state condotte per determinare l'espressione genica per specifiche vie di trasduzione del segnale, come dimostrato in precedenza16. Tutti gli steroidi, le citochine, lo stadio follicolare e i marcatori istologici forniscono un'istantanea del microambiente ovarico e indizi sulla capacità di quel microambiente di promuovere la follicologenesi "normale" o "anormale".
Protocollo
Le ovaie sono state ottenute dal Centro di ricerca sugli animali da carne degli Stati Uniti16. Come affermato in precedenza16,tutte le procedure sono state approvate dal Comitato per la cura e l'uso degli animali del Centro di ricerca sugli animali da carne degli Stati Uniti (USMARC) in conformità con la guida per la cura e l'uso degli animali agricoli nella ricerca e nell'insegnamento agricolo. Le ovaie sono state portate al laboratorio riproduttivo dell'Università del Nebraska-Lincoln dove sono state lavorate e coltivate.
1. Preparazione dei supporti richiesti
-
Waymouth MB 752/1 medio
- Riempire un flacone di coltura tissutale da 1 L con 900 ml di acqua sterile. Mentre l'acqua si mescola delicatamente su una piastra di agitazione, aggiungere gradualmente il mezzo in polvere. Una volta sciolto il mezzo in polvere, aggiungere 2,24 g di bicarbonato di sodio seguito da 1,25 g di albumina sierica bovina (BSA). Utilizzare un pHmetro e regolare il pH a 7,25-7,35. Aggiungere ulteriore acqua sterile per portare il volume finale a 1 L.
- Passare a un armadietto di sicurezza biologica e aggiungere penicillina-streptomicina solfato ad una concentrazione dello 0,1% v / v del mezzo. Filtrare il mezzo con un filtro a fascio tubiero da 0,22 μm33,2 cm 2 da 500 mL.
- Versare il mezzo filtrato in diversi tubi conici da 50 ml. Aggiungere 0,5 mL di insulina-transferrina-selenio per 50 mL di terreno aliquotato.
- Avvolgere i tubi conici e il flacone del mezzo in un foglio di alluminio e conservare a 4 °C. Questo mezzo è sensibile alla luce.
NOTA: Waymouth medium può essere conservato per un massimo di 1 mese.
-
L-15 (LB-15) medio di Leibovitz
NOTA: il mezzo LB-15 viene utilizzato per pulire i tessuti in preparazione alla coltura.- Riempire un flacone di coltura tissutale da 1 L con 900 ml di acqua sterile. Mentre l'acqua sterile si mescola delicatamente su un piatto di agitazione, aggiungere gradualmente il mezzo in polvere preparato. Utilizzare un pHmetro e regolare il pH a 7,25-7,35. Aggiungere ulteriore acqua sterile per portare il volume finale a 1 L.
- Passare all'armadio di sicurezza biologica. Fare 1 L di LB-15 con lo 0,1% di antibiotico (vedi Tabella dei materiali). Filtrare il mezzo in due flaconi di coltura tissutale da 500 mL utilizzando un filtro per flaconi da 0,22 μm a poro33,2 cm 2 500 mL. Avvolgere le bottiglie in un foglio di alluminio poiché il mezzo LB-15 è sensibile alla luce e conservare a 4 °C.
NOTA: LB-15 medium può essere conservato per un massimo di 1 mese.
-
Soluzione salina tamponata con fosfato (PBS)
- Fare PBS in laboratorio o acquistare PBS sterile senza calcio o magnesio(Tabella dei materiali). Per produrre PBS in laboratorio, iniziare con 800 ml di acqua distillata e aggiungere 8 g di cloruro di sodio (NaCl) ad esso. Quindi, aggiungere 0,2 g di cloruro di potassio (KCl), 1,44 g di sodio fosfato bibasico (Na2HPO4) e 0,24 g di fosfato di potassio bibasico (KH2PO4). Regolare il pH a ~7,4 e regolare il volume totale a 1 L. Sterilizzare la soluzione mediante autoclave.
- Produrre 1 L PBS con lo 0,1% di antibiotici (vedere Tabella dei materiali)mentre si è in un armadio di sicurezza biologica.
2. Protocollo di coltura corticale ovarica
NOTA: Le ovaie sono state ottenute da giovenche USMARC nate in primavera a 13 mesi di età. Le ovaie sono state risciacquate accuratamente e tutto il sangue e altri liquidi sono stati rimossi con PBS contenente antibiotico (0,1%) e trasportati a 37 °C23 al Laboratorio di riproduzione UNL dell'Università del Nebraska-Lincoln (1,5 ore di distanza). (Per commenti sulla temperatura delle ovaie durante il trasporto si veda discussione)
- Preparare il tessuto ovarico su un banco pulito (Figura 1).
- Disinfettare il banco pulito con il 70% di etanolo. Posizionare un cuscinetto assorbente fresco sul piano di lavoro. Assicurarsi che il soffiatore da banco pulito sia acceso mezz'ora prima della dissezione insieme alla luce UV per sterilizzare qualsiasi cosa nel banco pulito, incluso il tampone assorbente e assicurarsi che vengano utilizzati DPI appropriati.
- Disporre le piastre di Petri (60 x 15 mm) per i lavaggi dei tessuti. Tre piastre di Petri sono necessarie per il lavaggio PBS, tre per PBS con antibiotico e tre per lavaggi LB-15. Un'ulteriore capsula di Petri contenente LB-15 con coperchio di accompagnamento verrà utilizzata per il posizionamento finale dei pezzi dopo i lavaggi.
- Riempire ogni capsula di Petri con circa 10 ml di liquidi appropriati, PBS o LB-15.
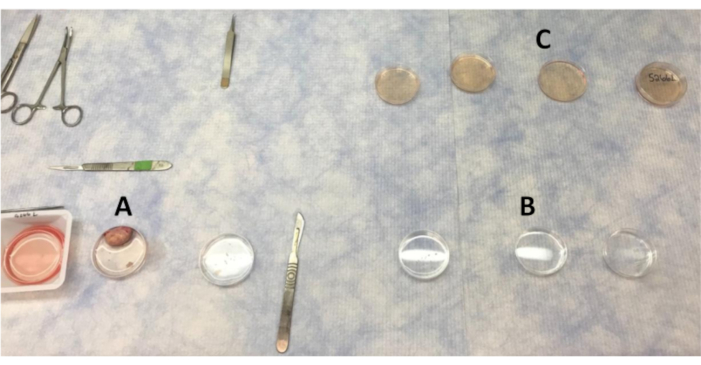
Figura 1: Disposizione delle piastre per il lavaggio dei pezzi di ovaio e corteccia nel banco pulito. (A) PBS utilizzato per lavare l'ovaio quando vengono rimosse sezioni della corteccia. (B) PBS con lava antibiotici che i pezzi di corteccia vengono spostati attraverso. (C)I pezzi della corteccia ovarica vengono lavati quattro volte in LB-15 prima di passare all'armadio di biosicurezza per il lavaggio finale in LB-15. Fare clic qui per visualizzare una versione più grande di questa figura.
- Rimuovere il waymouth preparato e il mezzo LB-15 dal frigorifero e riscaldare a temperatura ambiente.
- Autoclave tutti gli strumenti per garantire la sterilizzazione prima dell'uso.
- Mantenere le ovaie a 37 °C fino a quando la corteccia ovarica è pronta per essere raccolta.
- Usando una pinza con mascelle seghettate, raccogliere l'ovaia e lavare accuratamente nella prima capsula di Petri piena di PBS. Trasferire l'ovaio al secondo lavaggio PBS e pulire accuratamente ancora una volta.
NOTA: L'ovaio rimarrà nel secondo lavaggio PBS mentre le strisce corticali ovariche vengono rimosse. - Usando una pinza mascellare seghettata, fissare l'ovaio e tagliare a metà. In questo momento, la corteccia ovarica taglierà via dal midollo. Usando un righello, assicurati che non più di 1-2 mm di profondità della superficie dell'ovaio venga rimosso dal midollo16. Rimuovere le sezioni trasversali della corteccia ovarica dal midollo, tagliare 3-4 strisce sottili di corteccia ovarica (Figura 2) con un bisturi (lama di bisturi # 11; maniglia # 3) e posizionare le strisce nella terza capsula di Petri piena di PBS.
NOTA: In questo momento, è possibile raccogliere ulteriore tessuto corticale ovarico per l'estrazione dell'RNA o fisso e raccolto per l'istologia di pezzi iniziali di corteccia non coltivati. Quando si rimuovono strisce di corteccia ovarica, evitare aree con follicoli antrali visibili o corpi lutei. Inoltre, evitare di raccogliere tessuto midollare. L'istologia del midollo è molto diversa come mostrato in precedenza16. Se la corteccia ovarica non viene tagliata a più di una profondità di 1-2 mm, il midollo non deve essere ottenuto. L'istologia distinta consente punti di riferimento tra la corteccia e il midollo. - Tagliare le strisce della corteccia ovarica nel terzo lavaggio PBS in piccoli pezzi quadrati (~ 0,5-1 mm3) con una lama di bisturi # 21. Utilizzare un righello sotto le piastre di Petri per assicurarsi che i pezzi siano di dimensioni e spessore simili per creare pezzi di corteccia ovarica coerenti. Utilizzare una pinza per fissare le strisce mentre si tagliano i pezzi con un bisturi.
NOTA: il numero di pezzi di tessuto tagliati dipende dall'esperimento. Quattro pezzi di corteccia ovarica è la quantità minima di tessuto necessaria per la coltura. Altri metodi per garantire la lunghezza e la profondità appropriate includono l'uso di affettatrici speciali26 o pezzi di plastica pretagliati come modelli27. - Lavare i pezzi corticali ovarici attraverso tutti e tre i PBS con piastre di Petri piene di antibiotici. Usa una pinza a punta curva per spostare i pezzi tra i lavaggi.
- Sposta i pezzi della corteccia attraverso la serie di lavaggi LB-15 e posizionali nella piastra di Petri finale riempita di LB-15. Etichettare il coperchio con ID animale e lato ovarico (sinistro o destro).
NOTA: Immergere completamente i pezzi di corteccia ovarica in ogni lavaggio per una pulizia accurata. - Raccogliere quattro pezzi di corteccia ovarica per ovaio e fissare per l'istologia del giorno zero. Pezzi aggiuntivi possono anche essere congelati per l'RNA. I restanti pezzi di tessuto saranno utilizzati per la coltura. Pulire gli strumenti di dissezione con il 70% di etanolo dopo ogni raccolta di tessuto.
- Preparare un armadio di sicurezza biologica per il lavaggio finale dei tessuti e la preparazione della coltura. Disinfettare le forniture con il 70% di etanolo prima di inserirle nell'armadio di sicurezza biologica. Utilizzare la tecnica asettica quando si lavora nell'armadio di sicurezza biologica.
- Spostare tutta la corteccia ovarica destinata alla coltura nell'armadio di sicurezza biologica e lavare ancora una volta in una capsula di Petri piena di LB-15.
- In una piastra di coltura tissutale a 24 pozzetti, pipetta 350 μL di waymouth medio per pozzetto.
- Posizionare ben inserti di coltura non rivestiti in ogni pozzo usando una pinza. Assicurarsi che non si formino bolle sotto la base dell'inserto in quanto ciò comporterebbe l'essiccazione del tessuto. Il mezzo deve toccare gli inserti per consentire al mezzo di essere assorbito e circondare i pezzi della corteccia ovarica.
- Posizionare con attenzione quattro pezzi di corteccia ovarica sulla rete di ciascun inserto (Figura 2). La pinza può forare la rete se i pezzi di tessuto non sono posizionati delicatamente. I pezzi di tessuto non devono toccarsi l'un l'altro o il lato dell'inserto.
- Incubare il tessuto a 37 °C con il 5% di CO216.
NOTA: Altri hanno usato 38,8 °C28. Tuttavia, nessuna differenza è stata osservata nell'integrità del tessuto né nella capacità dei follicoli di progredire nel tessuto a 37 °C né ne hanno altri39,30. Pertanto, a questo punto una qualsiasi di queste temperature dovrebbe favorire il successo dell'esperimento. Altri hanno usato 400 μL di mezzo. Entrambe le quantità vanno bene finché una è consistente e il tessuto è parzialmente sommerso consentendo un'adeguata tensione superficiale per consentire l'idratazione del tessuto (mezzi che circondano i pezzi della corteccia ovarica). Riempire i pozzi vuoti con 500 μL di acqua sterile per ridurre l'evaporazione da altri pozzi.

Figura 2: Pezzi di corteccia ovarica e piastra di coltura. (A) Una striscia ovarica tagliata dalla corteccia dell'ovaio. (B) Righello e pezzo di corteccia mostrati fianco a fianco. (C) Quattro pezzi di corteccia (~0,5-1 mm3) appoggiati sull'inserto nel terreno di coltura nella piastra. (D) Sollevare l'inserto per raccogliere il terreno di coltura dal pozzo. Raccogliere e sostituire tutto il terreno di coltura ogni giorno (250 μL) per mantenere un pH corretto.Ogni giorno si ottengono circa 250 μL da ciascun pozzo (circa il 70% del terreno di coltura iniziale). Fare clic qui per visualizzare una versione più grande di questa figura.
3. Raccolta multimediale
- Cambiare la coltura della corteccia ovarica media ogni giorno per 7 giorni. I cambiamenti del mezzo dovrebbero essere il più vicino possibile a 24 ore di distanza per evitare grandi cambiamenti di pH e colore nel mezzo. Warm Waymouth medio a 37 °C prima del cambio del mezzo. Circa 250 μL si ottengono da ciascun pozzo ogni giorno (circa il 70% del terreno di coltura iniziale).
- Durante i cambi medi, utilizzare una pinza per sollevare delicatamente l'inserto dal pozzo. Raccogliere il terreno di coltura Waymouth in tubi da 0,5 mL (circa 250 μL/giorno). Rimettere bene l'inserto e aggiungere 350 μL di terreno di coltura fresco erogando il mezzo tra il lato dell'inserto e il pozzetto.
NOTA: Cambiare la maggior parte dei media ogni giorno per ottenere abbastanza media per misurare tutti gli steroidi, citochine e chemochine necessarie per determinare il microambiente ovarico. Inoltre, i cambiamenti giornalieri del mezzo sono importanti per prevenire grandi cambiamenti di pH (indicati dal cambiamento di colore) nel mezzo. Gocce di mezzo sono state trattenute intorno ai pezzi della corteccia ovarica per garantire che i pezzi rimanessero bagnati. Non sono stati osservati problemi con il tessuto in coltura a causa del cambiamento del 70% dei mezzi. - Conservare il mezzo raccolto dalla coltura tissutale a -20 °C.
4. Imaging ed elaborazione a valle
- Dopo 7 giorni di coltura a 37 °C con il 5% di CO2, immagine i pezzi della corteccia ovarica utilizzando un microscopio di dissezione con una fotocamera collegata e un programma software di imaging per computer.
NOTA: una camera oscura è in genere la soluzione migliore per ottenere la migliore qualità dell'immagine per l'imaging. - Dopo l'imaging, fissare due pezzi di corteccia ovarica per pozzetto in Bouins per l'istologia e congelare due pezzi di corteccia ovarica in azoto liquido per ottenere RNA per cDNA. Ripeti questo passaggio per tutti i pozzetti con tessuto. Raccogliere il mezzo dal giorno 7 e conservare a -20 °C.
- Lasciare che i pezzi della corteccia ovarica rimangano immersi in Bouins (acido picrico 750 ml, acido acetico glaciale 50 ml e 37%-40% formalina 250 ml) per circa 1,5 ore prima di essere lavati con etanolo al 70% tre volte. Il tessuto rimarrà in etanolo al 70% e sarà eliminato quotidianamente fino a quando la soluzione non sarà più gialla.
NOTA: Possono essere utilizzati fissativi diversi da Bouins e paraformaldeide. In questa esperienza Bouins è usato in quanto è il fissativo per ottenere una morfologia ottimale. Se è necessario più tessuto per altre analisi, è possibile ottenere ulteriori pozzetti di media e pezzi di corteccia ovarica da ciascun animale.
Risultati
Questa procedura di coltura della corteccia bovina può essere utilizzata per determinare un'ampia varietà di dati ormonali, citochine e istologici da piccoli pezzi dell'ovaio. La colorazione, come l'ematossilina e l'eosina (H & E), può essere utilizzata per determinare la morfologia ovarica attraverso la stadiazione del follicolo16,23,31 ( Figura3). In breve, i follicoli sono stati classificati c...
Discussione
Il vantaggio della coltura in vitro della corteccia ovarica, come descritto in questo manoscritto, è che i follicoli si sviluppano in un ambiente normalizzato con stroma adiacente che circonda i follicoli. Le cellule somatiche e gli ovociti rimangono intatti e vi è un'appropriata comunicazione cellula-cellula come modello in vivo. Il nostro laboratorio ha scoperto che un sistema di coltura a 7 giorni fornisce dati rappresentativi di follicologenesi e steroidogenesi per il trattamento della corteccia ovarica. Altri prot...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata supportata dal National Institute of Food and Agriculture 2013-67015-20965 ad ASC, University of Nebraska Food for Health Competitive Grants to ASC. United States Department of Agriculture Hatch grant NEB26-202/W3112 Accession #1011127 to ASC, Hatch–NEB ANHL Accession #1002234 to ASC. Quantitative Life Sciences Initiative Summer Postdoctoral Scholar Support - Premio COVID-19 per i finanziamenti estivi per CMS.
Gli autori vorrebbero estendere il loro apprezzamento al Dr. Robert Cushman, U.S. Meat Animal Research Center, Clay Center, NE per ringraziarlo per aver fornito le ovaie in una precedente pubblicazione, che sono state poi utilizzate nell'attuale articolo come prova di concetto nella convalida di questa tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| #11 Scapel Blade | Swann-Morton | 303 | Scaple Blade |
| #21 Scapel Blade | Swann-Morton | 307 | Scaple Blade |
| 500mL Bottle Top Filter | Corning | 430514 | Bottle Top Filter 0.22 µm pore for filtering medium |
| AbsoluteIDQ Sterol17 Assay | Biocrates | Sterol17 Kit | Samples are sent off to Biocrates and steroid panels are run and results are returned |
| Androstenedione Double Antibody RIA Kit | MPBio | 7109202 | RIA to determine androstenedione from culture medium |
| Belgium A4 Assay Kit | DIA Source | KIP0451 | RIA to determine androstenedione from culture medium |
| Bovine Cytokine Array Q3 | RayBiotech | QAB-CYT-3-1 | Cytokine kit to determine cytokines from culture medium |
| cellSens Software Standard 1.3 | Olympus | 7790 | Imaging Software |
| Insulin-Transferrin-Selenium-X | Gibco ThermoFisher Scientific | 5150056 | Addative to the culture medium |
| Leibovitz's L-15 Medium | Gibco ThermoFisher Scientific | 4130039 | Used for tissue washing on clean bench, and in the biosafety cabniet |
| Microscope | Olympus | SZX16 | Disection microscope used for imaging tissue culture pieces |
| Microscope Camera | Olympus | DP71 | Microscope cameraused for imaging tissue culture pieces |
| Millicell Cell Culture Inserts 0.4µm, 12,mm Diameter | Millipore Sigma | PICM01250 | Inserts that allow the tissue to rest against the medium without being submerged in it |
| Multiwell 24 well plate | Falcon | 353047 | Plate used to hold meduim, inserts, and tissues |
| Petri dish 60 x 15 mm | Falcon | 351007 | Petri dish used for washing steps prior to culture |
| Phosphate-Buffered Saline (PBS 1X) | Corning | 21-040-CV | Used for tissue washing |
| SAS Version 9.3 | SAS Institute | 9.3 TS1M2 | Statistical analysis software |
| Thomas Stadie-Riggs Tissue Slicer | Thomas Scientific | 6727C10 | Tissue slicer for preperation of thin uniform sections of fresh tissue |
| Waymouth MB 752/1 Medium | Sigma-Aldrich | W1625 | Medium used for tissue cultures |
Riferimenti
- Braw-Tal, R., Yossefi, S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. Journal of Reproduction and Fertility. 109, 165-171 (1997).
- Nilsson anEdson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Fortune, J. E., Cushman, R. A., Wahl, C. M., Kito, S. The primordial to primary follicle transition. Molecular and Cellular Endocrinology. 163, 53-60 (2000).
- Ireland, J. J. Control of follicular growth and development. Journal of Reproduction and Fertility. 34, 39-54 (1987).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Ramezani, M., Salehnia, M., Jafarabadi, M. Short term culture of vitrified human ovarian cortical tissue to assess the cryopreservation outcome: molecular and morphological analysis. Journal of Reproduction & Infertility. 18 (1), 162-171 (2017).
- McLaughlin, M., Telfer, E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Stefansdottir, A., Fowler, P. A., Powles-Glover, N., Anderson, R. A., Spears, N. Use of ovary culture techniques in reproductive toxicology. Reproductive Toxicology. 49, 117-135 (2014).
- Bromfield, J. J., Sheldon, I. M. Lipopolysaccharide reduces the primordial follicle pool in the bovine ovarian cortex ex vivo and in the murine ovary in vivo. Biology of Reproduction. 88 (4), 1-9 (2013).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Humane Reproduction Update. 14 (4), 367-378 (2008).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicological Sciences. 90 (2), 500-509 (2006).
- Bott, R. C., McFee, R. M., Clopton, D. T., Toombs, C., Cupp, A. S. Vascular endothelial growth factor and kinase domain region receptor are involved in both seminiferous cord formation and vascular development during testis morphogenesis in the rat. Biology of Reproduction. 75, 56-67 (2006).
- Baltes-Breitwisch, M. M., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms or administration of proangiogenic isoforms stimulates vascular development in the rat testis. Reproduction. 140 (2), 319-329 (2010).
- McFee, R. M., et al. Inhibition of vascular endothelial growth factor receptor signal transduction blocks follicle progression but does not necessarily disrupt vascular development in perinatal rat ovaries. Biology of Reproduction. 81, 966-977 (2009).
- Artac, R. A., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms is more effective than treatment with proangiogenic isoforms in stimulating vascular development and follicle progression in the perinatal rat ovary. Biology of Reproduction. 81, 978-988 (2009).
- Abedal-Majed, M. A., et al. Vascular endothelial growth factor A isoforms modulate follicle development in peripbertal heifers independent of diet through diverse signal transduction pathways. Biology of Reproduction. 102 (3), 680-692 (2020).
- Wandji, S. A., Srsen, V., Voss, A. K., Eppig, J. J., Fortune, J. E. Initiation in vitro of bovine primordial follicles. Biology of Reproduction. 55, 942-948 (1996).
- Wandji, S. A., Srsen, V., Nathanielsz, P. W., Eppig, J. J., Fortune, J. E. Initiation of growth of baboon primordial follicles in vitro. Human Reproduction. 12 (9), 1993-2001 (1993).
- Yang, M. Y., Fortune, J. E. Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75, 924-932 (2006).
- Fortune, J. E., Kito, S., Wandji, S. A., Srsen, V. Activation of bovine and baboon primordial follicles in vitro. Theriogenology. 49, 441-449 (1998).
- Yang, M. Y., Fortune, J. E. Vascular endothelial growth factor stimulates the primary to secondary follicle transition in bovine follicles in vitro. Molecular Reproduction and Development. 74, 1095-1104 (2007).
- Barberino, R. S., Silva, J. R. V., Figueiredo, J. R., Matos, M. H. T. Transport of domestic and wild animal ovaries: a review of the effects of medium, temperature, and periods of storage on follicular viability. Biopreservation and Biobanking. 17 (1), 84-90 (2019).
- Summers, A. F., et al. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess. PLoS One. 9 (10), e110683 (2014).
- Koal, T., Schmiederer, D., Pham-Tuan, H., Rohring, C., Rauh, M. Standardized LC-MS/MS based steroid hormone profile analysis. The Journal of Steroid Biochemistry and Molecular Biology. 129, 129-138 (2012).
- Poole, R. K., Brown, A. R., Pore, M. H., Pickworth, C. L., Poole, D. H. Effects of endophyte-infected tall fescue seed and protein supplementation on stocker steers: II. Adaptive and innate immune function. Journal of Animal Science. 97 (10), 4160-4170 (2019).
- Laronda, M., et al. Alginate encapsulation supports the growth and differentiation of human primordial follicles within ovarian cortical tissue. Journal of Assisted Reproduction and Genetics. 31 (8), 1013-1028 (2014).
- Silber, S. J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23 (7), 1531-1537 (2008).
- Wiedemann, C., Zahmel, J., Jewgenow, K. Short-term culture of ovarian cortex pieces to assess the cryopreservation outcome in wild fields for genome conservation. BMC Veterinary Research. 9 (37), (2013).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354 (3), 869-880 (2013).
- Shimizu, T., Miyamoto, A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk-1, its receptor, in bovine granulosa cells. Animal Reproduction Science. 102 (3-4), 228-237 (2007).
- Tepekoy, F., Akkoyunlu, G. The effect of FSH and activin A on Akt and MAPK1/3 phosphorylation in cultured bovine ovarian cortical strips. Journal of Ovarian Research. 9 (13), 1-9 (2016).
- Beck, K., Singh, J., Arshud Dar, M., Anzar, M. Short-term culture of adult bovine ovarian tissues: chorioallantoic membrane (CAM) vs. traditional in vitro culture systems. Reproductive Biology and Endocrinology. 16 (1), 21 (2018).
- Eppig, J. J. Oocyte control of ovarian follicular development and function in mammals. Reproduction. 122 (6), 829-838 (2001).
- Paczkowski, M., Silva, E., Schoolcraft, W. B., Krisher, R. L. Comparative importance of fatty acid beta-oxidation to nuclear maturation, gene expression, and glucose metabolism in mouse, bovine, and porcine cumulus oocyte complexes. Biology of Reproduction. 88 (5), 1-11 (2013).
- Raffel, N., et al. Is ovarian tissue transport at supra-zero temperatures compared to body temperature optimal for follicle survival?. In Vivo. 34 (2), 533-541 (2020).
- Duncan, F., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction (Cambridge, England). 152 (6), R201-R210 (2016).
- Liebenthron, J., et al. Overnight ovarian tissue transportation for centralized cryobanking: a feasible option. Reproductive BioMedicine Online. 38 (5), 740-749 (2019).
- Mohammed, B. T., Donadeu, F. X. Bovine granulosa cell culture. Epithelial Cell Culture: Methods and Protocols. , 79-87 (2018).
- Langbeen, A., et al. Effects of neutral red assisted viability assessment on the cryotolerance of isolated bovine preantral follicles. Journal of Assisted Reproduction Genetics. 31, 1727-1736 (2014).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Yang, M. Y., Fortune, J. E. Changes in the transcriptome of bovine ovarian cortex during follicle activation in vitro. Physiological Genomics. 47, 600-611 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon