Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Culture de tissu du cortex ovarien bovin
Dans cet article
Résumé
La culture in vitro du cortex ovarien bovin et l’effet du régime nutritionnel Stair-step sur le microenvironnement ovarien sont présentés. Des morceaux de cortex ovarien ont été cultivés pendant sept jours et les stéroïdes, les cytokines et les stades folliculaires ont été évalués. Le traitement diététique Stair-Step avait une augmentation de la stéroïdogenèse entraînant une progression des follicules en culture.
Résumé
Le développement du follicule du stade primordial au stade antral est un processus dynamique dans le cortex ovarien, qui comprend des facteurs endocriniens et paracrines des cellules somatiques et de la communication cellule-ovocyte cumulus. On sait peu de choses sur le microenvironnement ovarien et sur la façon dont les cytokines et les stéroïdes produits dans le milieu environnant affectent la progression ou l’arrêt des follicules. La culture in vitro du cortex ovarien permet aux follicules de se développer dans un environnement normalisé qui reste soutenu par le stroma adjacent. Notre objectif était de déterminer l’effet du régime nutritionnel Stair-Step sur le microenvironnement ovarien (développement de follicules, production de stéroïdes et de cytokines) par culture in vitro du cortex ovarien bovin. Pour ce faire, des morceaux corticaux ovariens ont été retirés des génisses subissant deux schémas nutritionnels différents développés avant la puberté: Control (développement nutritionnel traditionnel) et Stair-Step (alimentation et restriction pendant le développement) qui ont été coupés en environ 0,5-1 mm3 morceaux. Ces morceaux ont ensuite été passés à travers une série de lavages et positionnés sur un insert de culture tissulaire qui est placé dans un puits contenant le milieu de culture de Waymouth. Le cortex ovarien a été cultivé pendant 7 jours avec des changements quotidiens des milieux de culture. Une section histologique a été effectuée pour déterminer les changements de stade folliculaire avant et après la culture afin de déterminer les effets de la nutrition et l’impact de la culture sans traitement supplémentaire. Le milieu de culture du cortex a été mis en commun au fil des jours pour mesurer les stéroïdes, les métabolites stéroïdiens et les cytokines. Il y avait des tendances à l’augmentation des hormones stéroïdes dans le microenvironnement ovarien qui ont permis la progression du follicule dans les cultures Stair-Step versus Control ovarian cortex. La technique de culture du cortex ovarien permet de mieux comprendre le microenvironnement ovarien et comment les altérations de la sécrétion endocrinienne peuvent affecter la progression et la croissance des follicules à partir de traitements in vivo et in vitro. Cette méthode de culture peut également s’avérer bénéfique pour tester des thérapies potentielles susceptibles d’améliorer la progression des follicules chez les femmes afin de favoriser la fertilité.
Introduction
Le cortex ovarien représente la couche externe de l’ovaire où se produit le développement du follicule1. Les follicules primordiaux, initialement arrêtés en développement, seront activés pour devenir des follicules primaires, secondaires, puis antraux ou tertiaires à partir des apports de paracrine et de gonadotrophine1,2,3,4. Pour mieux comprendre les processus physiologiques au sein de l’ovaire, la culture tissulaire peut être utilisée comme modèle in vitro, permettant ainsi à un environnement contrôlé de mener des expériences. De nombreuses études ont utilisé la culture de tissu ovarien pour la recherche sur la technologie de procréation assistée, la préservation de la fertilité et le cancer de l’ovaire5,6,7. La culture de tissu ovarien a également servi de modèle pour étudier les toxines reproductrices qui nuisent à la santé ovarienne et à l’étiologie des troubles de la reproduction tels que le syndrome des ovaires polykystiques (SOPK)8,9,10,11. Ainsi, ce système de culture est applicable à un large éventail de spécialités.
Chez les rongeurs, des gonades fœtales ou périnatales entières ont été utilisées dans des expériences de biologie de la reproduction12,13,14,15. Cependant, les gonades provenant d’un gros bétail domestique ne peuvent pas être cultivées en tant qu’organes entiers en raison de leur grande taille et de leur dégénérescence potentielle. Par conséquent, le cortex ovarien des primates bovins et non humains est coupé en plus petits morceaux16,17,18. De nombreuses études ont cultivé de petits morceaux de cortex ovarien pour étudier divers facteurs de croissance dans l’initiation du follicule primordial chez le bétail domestique et les primates non humains1,17,18,19. L’utilisation de la culture du cortex ovarien a également démontré l’initiation du follicule primordial en l’absence de sérum pour les morceaux corticaux bovins et primates cultivés pendant 7 jours20. Yang et Fortune en 2006 ont traité le milieu de culture du cortex ovarien fœtal avec une gamme de doses de testostérone sur 10 jours et ont observé que la concentration de 10à 7 M de testostérone augmentait le recrutement des follicules, la survie et augmentait la progression des follicules à un stade précoce19. En 2007, en utilisant des cultures de cortex ovarien de fœtus bovins (5-8 mois de gestation), Yang et Fortune ont rapporté un rôle pour le facteur de croissance de l’endothélium vasculaire A (VEGFA) dans la transition du follicule primaire au secondaire21. En outre, notre laboratoire a utilisé des cultures de cortex ovarien pour démontrer comment les isoformes VEGFA (angiogéniques, antiangiogéniques et une combinaison) peuvent réguler différentes voies de transduction du signal à travers le récepteur du domaine kinase (KDR), qui est le principal récepteur de transduction du signal que VEGFA lie16. Cette information a permis de mieux comprendre comment différentes isoformes de VEGFA affectent les voies de signalisation pour provoquer la progression ou l’arrêt des follicules. Pris ensemble, la culture de morceaux de cortex ovarien in vitro avec différents stéroïdes ou facteurs de croissance peut être un test précieux pour déterminer les effets sur les mécanismes régulant la folliculogenèse. De même, les animaux qui sont développés sur différents régimes nutritionnels peuvent avoir modifié les microenvironnements ovariens, ce qui peut favoriser ou inhiber la folliculogenèse affectant la maturité reproductive féminine. Ainsi, notre objectif dans le présent manuscrit est de rapporter la technique de culture du cortex bovin et de déterminer s’il existe des différences dans les microenvironnements ovariens après la culture in vitro du cortex bovin à partir de génisses nourries avec des régimes Control ou Stair-Step collectés à l’âge de 13 mois comme décrit précédemment16.
Par conséquent, notre prochaine étape a été de déterminer le microenvironnement ovarien chez ces génisses qui ont été développées avec différents régimes nutritionnels. Nous avons évalué le cortex ovarien de génisses nourries avec un régime Stair-Step ou Control. Les génisses témoins se sont vu offrir un régime d’entretien de 97,9 g/kg0,75 pendant 84 jours. Le régime Stair-Step a été initié à 8 mois contenant un régime alimentaire restreint de 67,4 g / kg0,75 pendant 84 jours. Après les 84 premiers jours, alors que les génisses témoins continuaient de recevoir 97,9 g/kg0,75, les génisses de bœuf Stair-Step se sont vu offrir 118,9 g/kg0,75 pendant 68 autres jours, après quoi elles ont été ovariectomisées à l’âge de 13 mois16 ans pour étudier les changements dans les stades folliculaires et la morphologie avant et après la culture. Nous avons également testé les différences dans les stéroïdes, les métabolites stéroïdiens, les chimiokines et les cytokines sécrétées dans le cortex. Les stéroïdes et autres métabolites ont été mesurés pour déterminer s’il y avait des effets directs des traitements menés in vivo et / ou in vitro sur la viabilité et la productivité des tissus. Les changements dans le microenvironnement ovarien avant et après la culture ont fourni un aperçu du milieu endocrinien et de la folliculogenèse avant la culture et de la façon dont la culture ou le traitement pendant la culture affecte la progression ou l’arrêt du follicule.
Les ovaires ont été prélevés après que des ovariectomies ont été effectuées au U.S. Meat Animal Research Center (USMARC) selon leurs procédures IACUC auprès de génisses Control et Stair-Step à l’âge de13 mois 16ans, nettoyées avec des lavages de solution saline tampon phosphate stérile (PBS) avec 0,1% d’antibiotique pour éliminer le sang et d’autres contaminants, coupé l’excès de tissu et transporté au laboratoire de physiologie de la reproduction DE l’Université du Nebraska-Lincoln (UNL) UNL à 37 ° C23 . À l’UNL, les morceaux de cortex ovarien ont été coupés en petits morceaux carrés (~0,5-1 mm3; Figure 1) et cultivé pendant 7 jours (Figure 2). L’histologie a été réalisée sur les lames de culture du cortex avant et après la culture afin de déterminer les stades16et24 des follicules(figure 3 et figure 4)et les protéines de la matrice extracellulaire pouvant indiquer une fibrose (Picro-Sirus Red, PSR; Figure 5). Cela a permis de déterminer l’effet des régimes nutritionnels in vivo sur les stades folliculaires et de comparer 7 jours de cortex ovarien sur les stades folliculaires et la progression des follicules. Tout au long de la culture, le milieu a été recueilli et modifié quotidiennement (environ 70 % des milieux ont été recueillis chaque jour; 250 μL/puits) afin que les hormones/cytokines/chimiokines quotidiennes puissent être évaluées ou regroupées sur des jours pour obtenir des concentrations moyennes. Les stéroïdes tels que l’androstènedione (A4) et l’œstrogène (E2) peuvent être regroupés sur 3 jours et évalués par dosage radioimmunologique (RIA; Graphique 6) et regroupés sur 4 jours par animal et analysés par chromatographie liquide à haute performance-spectrométrie de masse (HPLC-MS)24,25 ( tableau1). Des réseaux de cytokines ont été utilisés pour évaluer les concentrations de cytokines et de chimiokines dans le milieu de culture du cortex ovarien26 (tableau 2). Des plaques de dosage de la réaction en chaîne par polymérase en temps réel (RT-PCR) ont été menées pour déterminer l’expression des gènes pour des voies de transduction de signal spécifiques, comme démontré précédemment16. Tous les marqueurs stéroïdes, cytokines, follicules et histologiques fournissent un instantané du microenvironnement ovarien et des indices quant à la capacité de ce microenvironnement à favoriser la folliculogenèse « normale » ou « anormale ».
Protocole
Les ovaires ont été obtenus du U. S. Meat Animal Research Center16. Comme indiqué précédemment16, toutes les procédures ont été approuvées par le comité de soins et d’utilisation des animaux du U.S. Meat Animal Research Center (USMARC) conformément au guide pour les soins et l’utilisation des animaux d’élevage dans la recherche et l’enseignement agricoles. Les ovaires ont été amenés au laboratoire de reproduction de l’Université du Nebraska-Lincoln où ils ont été traités et cultivés.
1. Préparation des supports requis
-
Waymouth MB 752/1 moyen
- Remplissez une bouteille de culture tissulaire de 1 L avec 900 mL d’eau stérile. Pendant que l’eau agite doucement sur une plaque à remuer, ajoutez progressivement le milieu en poudre. Une fois le milieu en poudre dissous, ajouter 2,24 g de bicarbonate de sodium suivi de 1,25 g d’albumine sérique bovine (BSA). Utilisez un pH-mètre et ajustez le pH à 7,25-7,35. Ajouter de l’eau stérile supplémentaire pour porter le volume final à 1 L.
- Passer à une armoire de sécurité biologique et ajouter le sulfate de pénicilline-streptomycine à une concentration de 0,1 % v/v du milieu. Filtrer le milieu avec un pore de 0,22 μm 33,2 cm2 500 mL filtre de dessus de bouteille.
- Verser le milieu filtré dans plusieurs tubes coniques de 50 mL. Ajouter 0,5 mL d’insuline-transferrine-sélénium par 50 mL de milieu aliquote.
- Envelopper les tubes coniques et la bouteille de stock du milieu dans du papier d’aluminium et conserver à 4 °C. Ce médium est sensible à la lumière.
REMARQUE: Le milieu Waymouth peut être conservé jusqu’à 1 mois.
-
Milieu L-15 (LB-15) de Leibovitz
REMARQUE: Le milieu LB-15 est utilisé pour nettoyer les tissus en vue de la culture.- Remplissez une bouteille de culture tissulaire de 1 L avec 900 mL d’eau stérile. Pendant que l’eau stérile agite doucement sur une plaque à remuer, ajoutez progressivement le milieu en poudre préparé. Utilisez un pH-mètre et ajustez le pH à 7,25-7,35. Ajouter de l’eau stérile supplémentaire pour porter le volume final à 1 L.
- Passez à l’armoire de sécurité biologique. Faire 1 L de LB-15 avec 0,1% d’antibiotique (voir tableau des matériaux). Filtrer le milieu dans deux flacons de culture tissulaire de 500 mL à l’aide d’un filtre à pores de 0,22 μm de 33,2 cm et de2 500 mL. Enveloppez les bouteilles dans du papier d’aluminium car le support LB-15 est sensible à la lumière et conservez à 4 ° C.
REMARQUE: Le support LB-15 peut être conservé jusqu’à 1 mois.
-
Solution saline tamponnée au phosphate (PBS)
- Fabriquez du PBS en laboratoire ou achetez du PBS stérile sans calcium ni magnésium (Table des matériaux). Pour fabriquer du PBS en laboratoire, commencez avec 800 mL d’eau distillée et ajoutez-y 8 g de chlorure de sodium (NaCl). Ensuite, ajoutez 0,2 g de chlorure de potassium (KCl), 1,44 g de phosphate de sodium dibasique (Na2HPO4),et 0,24 g de phosphate de potassium dibasique (KH2PO4). Réglez le pH à ~7,4 et réglez le volume total à 1 L. Stérilisez la solution par autoclavage.
- Fabriquer 1 L de PBS avec 0,1 % d’antibiotique (voir tableau des matériaux)dans une armoire de sécurité biologique.
2. Protocole de culture corticale ovarienne
REMARQUE: Les ovaires ont été obtenus à partir de génisses USMARC nées au printemps à l’âge de 13 mois. Les ovaires ont été rincés abondamment, et tout le sang et les autres liquides ont été retirés avec du PBS contenant un antibiotique (0,1%) et transportés à 37 °C23 au laboratoire de reproduction DE l’Université du Nebraska-Lincoln UNL (1,5 h de distance). (Pour les commentaires sur la température des ovaires pendant le transport, veuillez consulter discussion)
- Préparer le tissu ovarien sur un banc propre (Figure 1).
- Désinfectez le banc propre avec 70% d’éthanol. Placez un tampon absorbant frais sur la paillasse. Assurez-vous que le ventilateur de banc propre est allumé une demi-heure avant la dissection avec la lumière UV pour stériliser tout ce qui se trouve dans le banc propre, y compris le tampon absorbant et assurez-vous que l’EPI approprié est utilisé.
- Disposer les boîtes de Petri (60 x 15 mm) pour les lavages de tissus. Trois boîtes de Petri sont nécessaires pour le lavage PBS, trois pour le PBS avec antibiotique et trois pour les lavages LB-15. Une boîte de Petri supplémentaire contenant du LB-15 avec couvercle d’accompagnement sera utilisée pour le placement final des pièces après le lavage.
- Remplissez chaque boîte de Pétri avec environ 10 mL de fluides appropriés, SOIT PBS ou LB-15.
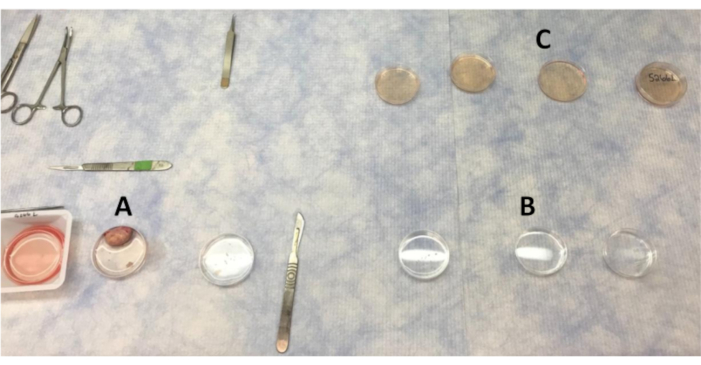
Figure 1:Dispositiondes plaques pour laver les morceaux de l’ovaire et du cortex dans le banc propre. (A) PBS utilisé pour laver l’ovaire lorsque des sections du cortex sont enlevées. (B) PBS avec des lavages antibiotiques que les morceaux de cortex sont déplacés. (C) Les morceaux de cortex ovarien sont lavés quatre fois dans LB-15 avant de passer à l’armoire de biosécurité pour un lavage final dans LB-15. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Retirer le waymouth préparé et le milieu LB-15 du réfrigérateur et réchauffer à la température ambiante.
- Autoclavez tous les outils pour assurer la stérilisation avant utilisation.
- Maintenir les ovaires à 37 °C jusqu’à ce que le cortex ovarien soit prêt à être collecté.
- À l’aide de pinces à mâchoires dentelées, ramassez l’ovaire et lavez-vous soigneusement dans la première boîte de Petri remplie de PBS. Transférer l’ovaire au deuxième lavage PBS et nettoyer à fond une fois de plus.
REMARQUE: L’ovaire restera dans le deuxième lavage PBS pendant que les bandelettes corticales ovariennes sont enlevées. - À l’aide de pinces à mâchoires dentelées, fixez l’ovaire et coupez-le en deux. À ce stade, le cortex ovarien va couper de la moelle. À l’aide d’une règle, assurez-vous que pas plus de 1 à 2 mm de profondeur de surface de l’ovaire est retiré de la moelle16. Retirez les sections transversales du cortex ovarien de la moelle épinière, coupez 3 à 4 fines bandes de cortex ovarien(Figure 2)avec un scalpel (lame de scalpel n ° 11; poignée n ° 3) et placez les bandes dans la troisième boîte de Petri remplie de PBS.
REMARQUE: À l’heure actuelle, du tissu cortical ovarien supplémentaire peut être collecté pour l’extraction de l’ARN ou fixé et collecté pour l’histologie des morceaux initiaux de cortex non cultivés. Lorsque vous enlevez des bandelettes du cortex ovarien, évitez les zones avec des follicules antraux visibles ou des corps jaunes. De plus, évitez de prélever du tissu médullaire. L’histologie de la médullaire est très différente comme indiqué précédemment16. Si le cortex ovarien n’est pas coupé à plus de 1–2 mm de profondeur, la moelle ne doit pas être obtenue. Une histologie distincte permet d’établir des points de repère entre le cortex et la moelle épinière. - Coupez les bandes du cortex ovarien dans le troisième lavage PBS en petits morceaux carrés (~ 0,5–1 mm3)avec une lame de scalpel #21. Utilisez une règle sous les boîtes de Petri pour vous assurer que les pièces sont de taille et d’épaisseur similaires afin de créer des pièces de cortex ovarien cohérentes. Utilisez des pinces pour fixer les bandes tout en coupant les morceaux avec un scalpel.
REMARQUE: Le nombre de morceaux de tissu coupés dépend de l’expérience. Quatre morceaux de cortex ovarien est la quantité minimale de tissu nécessaire à la culture. D’autres méthodes pour assurer une longueur et une profondeur appropriées comprennent l’utilisation de trancheuses spéciales26 ou de pièces en plastique prédécoupées commegabarits 27. - Lavez les morceaux corticaux ovariens à travers les trois PBS avec des boîtes de Petri remplies d’antibiotiques. Utilisez une pince à pointe incurvée pour déplacer les pièces entre les lavages.
- Déplacez les morceaux de cortex à travers la série de lavages LB-15 et placez-les dans la boîte de Petri finale remplie de LB-15. Étiquetez le couvercle avec l’identification de l’animal et le côté de l’ovaire (gauche ou droite).
REMARQUE: Immergez complètement les morceaux de cortex ovarien dans chaque lavage pour un nettoyage en profondeur. - Collectez quatre morceaux de cortex ovarien par ovaire et fixez-les pour l’histologie du jour zéro. Des pièces supplémentaires peuvent également être congelées pour l’ARN. Les morceaux de tissu restants seront utilisés pour la culture. Essuyez les outils de dissection avec 70% d’éthanol après chaque prélèvement de tissus.
- Préparez une armoire de sécurité biologique pour le lavage final des tissus et la préparation de la culture. Désinfectez les fournitures avec de l’éthanol à 70 % avant de les placer dans l’armoire de sécurité biologique. Utilisez la technique aseptique lorsque vous travaillez dans l’armoire de sécurité biologique.
- Déplacez tout le cortex ovarien destiné à la culture dans l’armoire de sécurité biologique et lavez-le une fois de plus dans une boîte de Petri remplie de LB-15.
- Dans une plaque de culture tissulaire de 24 puits, pipette 350 μL de milieu Waymouth par puits.
- Placez des inserts de puits de culture non revêtus dans chaque puits à l’aide de pinces. Assurez-vous qu’aucune bulle ne se forme sous la base de l’insert, car cela entraînerait le dessèchement du tissu. Le milieu doit toucher les inserts pour permettre au milieu d’être absorbé et d’entourer les morceaux du cortex ovarien.
- Positionnez soigneusement quatre morceaux de cortex ovarien sur le maillage de chaque insert (Figure 2). Les pinces peuvent percer le maillage si les morceaux de tissu ne sont pas délicatement placés. Les morceaux de tissu ne doivent pas se toucher ou se toucher sur le côté de l’insert.
- Incuber le tissu à 37°Cavec 5% de CO216.
NOTE: D’autres ont utilisé 38,8 °C28. Cependant, aucune différence n’a été observée dans l’intégrité du tissu ni dans la capacité des follicules à progresser dans les tissus à 37°Cni dans les autres39,30. Ainsi, à ce stade, l’une de ces températures devrait être propice au succès de l’expérience. D’autres ont utilisé 400 μL de milieu. L’une ou l’autre quantité est bonne tant que l’une est constante et que le tissu est partiellement submergé, ce qui permet une tension superficielle adéquate pour permettre l’hydratation des tissus (milieux entourant les morceaux du cortex ovarien). Remplissez les puits vides avec 500 μL d’eau stérile pour aider à réduire l’évaporation des autres puits.

Figure 2: Morceaux de cortex ovarien et plaque de culture. (A) Une bande ovarienne coupée du cortex de l’ovaire. (B) Règle et pièce de cortex montrées côte à côte. (C) Quatre morceaux de cortex (~0,5-1 mm3) reposant sur l’insert dans le milieu de culture dans la plaque. (D) Soulever l’insert pour recueillir le milieu de culture du puits. Recueillir et remplacer tout le milieu de culture quotidiennement (250 μL) pour maintenir un pH correct.Environ 250 μL sont obtenus de chaque puits chaque jour (environ 70% du milieu de culture initial). Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Collection de médias
- Changer le milieu de culture du cortex ovarien quotidiennement pendant 7 jours. Les changements moyens doivent être aussi proches que possible de 24 heures d’intervalle pour éviter les grands changements de pH et de couleur dans le milieu. Chaud Waymouth moyen à 37 °C avant le changement moyen. Environ 250 μL sont obtenus de chaque puits chaque jour (environ 70 % du milieu de culture initial).
- Lors de changements moyens, utilisez des pinces pour soulever doucement l’insert hors du puits. Recueillir le milieu waymouth cultivé dans des tubes de 0,5 mL (environ 250 μL /jour). Replacez bien l’insert et ajoutez 350 μL de milieu de culture frais en distribuant le milieu entre le côté de l’insert et le puits.
REMARQUE: Changez la plupart des médias quotidiennement pour obtenir suffisamment de médias pour mesurer tous les stéroïdes, cytokines et chimiokines nécessaires pour déterminer le microenvironnement ovarien. En outre, les changements quotidiens de milieu sont importants pour éviter de grands changements de pH (indiqués par un changement de couleur) dans le milieu. Des gouttes de milieu ont été retenues autour des morceaux du cortex ovarien pour s’assurer que les morceaux restaient humides. Aucun problème n’a été observé avec les tissus cultivés en raison de la modification de 70% des milieux. - Conserver le milieu prélevé à partir de la culture tissulaire à -20 °C.
4. Imagerie et traitement en aval
- Après 7 jours de culture à 37°Cavec 5% deCO2,imagez les morceaux du cortex ovarien à l’aide d’un microscope à dissection avec une caméra attachée et un logiciel d’imagerie informatique.
REMARQUE: Une pièce sombre est généralement la meilleure pour obtenir la meilleure qualité d’image pour l’imagerie. - Après l’imagerie, fixez deux morceaux de cortex ovarien par puits dans Bouins pour l’histologie et gèlez rapidement deux morceaux de cortex ovarien dans de l’azote liquide pour obtenir de l’ARN pour l’ADNc. Répétez cette étape pour tous les puits avec du tissu. Collecter le milieu à partir du jour 7 et conserver à -20 °C.
- Laissez les morceaux de cortex ovarien rester immergés dans Bouins (acide picrique 750 mL, acide acétique glacial 50 mL et 37% à 40% de formol 250 mL) pendant environ 1,5 h avant d’être lavés trois fois avec de l’éthanol à 70%. Le tissu restera dans de l’éthanol à 70% et sera nettoyé quotidiennement jusqu’à ce que la solution ne soit plus jaune.
REMARQUE: Des fixateurs autres que bouins ainsi que du paraformaldéhyde peuvent être utilisés. Dans cette expérience, Bouins est utilisé car c’est le fixateur pour obtenir une morphologie optimale. Si plus de tissu est nécessaire pour d’autres analyses, des puits supplémentaires de milieux et des morceaux de cortex ovarien peuvent être obtenus de chaque animal.
Résultats
Cette procédure de culture du cortex bovin peut être utilisée pour déterminer une grande variété de données hormonales, cytokines et histologiques à partir de petits morceaux de l’ovaire. La coloration, telle que l’hématoxyline et l’éosine (H & E), peut être utilisée pour déterminer la morphologie ovarienne par la stadification des follicules16,23,31 ( Figure3). En bref, les folli...
Discussion
L’avantage de la culture in vitro du cortex ovarien, tel que décrit dans ce manuscrit, est que les follicules se développent dans un environnement normalisé avec un stroma adjacent entourant les follicules. Les cellules somatiques et les ovocytes restent intacts, et il existe une communication appropriée de cellule à cellule en tant que modèle in vivo. Notre laboratoire a découvert qu’un système de culture de 7 jours fournit des données représentatives de la folliculogenèse et de la stéroïdogenèse pour ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été soutenue par l’Institut national de l’alimentation et de l’agriculture 2013-67015-20965 à ASC, University of Nebraska Food for Health Competitive Grants à ASC. Subvention Hatch du département de l’Agriculture des États-Unis NEB26-202/W3112 Accession #1011127 à ASC, Hatch–NEB ANHL Accession #1002234 à ASC. Quantitative Life Sciences Initiative Summer Postdoctoral Scholar Support – Prix COVID-19 pour le financement d’été de CMS.
Les auteurs aimeraient exprimer leur gratitude au Dr Robert Cushman, U.S. Meat Animal Research Center, Clay Center, NE pour le remercier d’avoir fourni les ovaires dans une publication précédente, qui ont ensuite été utilisés dans le présent article comme preuve de concept pour valider cette technique.
matériels
| Name | Company | Catalog Number | Comments |
| #11 Scapel Blade | Swann-Morton | 303 | Scaple Blade |
| #21 Scapel Blade | Swann-Morton | 307 | Scaple Blade |
| 500mL Bottle Top Filter | Corning | 430514 | Bottle Top Filter 0.22 µm pore for filtering medium |
| AbsoluteIDQ Sterol17 Assay | Biocrates | Sterol17 Kit | Samples are sent off to Biocrates and steroid panels are run and results are returned |
| Androstenedione Double Antibody RIA Kit | MPBio | 7109202 | RIA to determine androstenedione from culture medium |
| Belgium A4 Assay Kit | DIA Source | KIP0451 | RIA to determine androstenedione from culture medium |
| Bovine Cytokine Array Q3 | RayBiotech | QAB-CYT-3-1 | Cytokine kit to determine cytokines from culture medium |
| cellSens Software Standard 1.3 | Olympus | 7790 | Imaging Software |
| Insulin-Transferrin-Selenium-X | Gibco ThermoFisher Scientific | 5150056 | Addative to the culture medium |
| Leibovitz's L-15 Medium | Gibco ThermoFisher Scientific | 4130039 | Used for tissue washing on clean bench, and in the biosafety cabniet |
| Microscope | Olympus | SZX16 | Disection microscope used for imaging tissue culture pieces |
| Microscope Camera | Olympus | DP71 | Microscope cameraused for imaging tissue culture pieces |
| Millicell Cell Culture Inserts 0.4µm, 12,mm Diameter | Millipore Sigma | PICM01250 | Inserts that allow the tissue to rest against the medium without being submerged in it |
| Multiwell 24 well plate | Falcon | 353047 | Plate used to hold meduim, inserts, and tissues |
| Petri dish 60 x 15 mm | Falcon | 351007 | Petri dish used for washing steps prior to culture |
| Phosphate-Buffered Saline (PBS 1X) | Corning | 21-040-CV | Used for tissue washing |
| SAS Version 9.3 | SAS Institute | 9.3 TS1M2 | Statistical analysis software |
| Thomas Stadie-Riggs Tissue Slicer | Thomas Scientific | 6727C10 | Tissue slicer for preperation of thin uniform sections of fresh tissue |
| Waymouth MB 752/1 Medium | Sigma-Aldrich | W1625 | Medium used for tissue cultures |
Références
- Braw-Tal, R., Yossefi, S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. Journal of Reproduction and Fertility. 109, 165-171 (1997).
- Nilsson anEdson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Fortune, J. E., Cushman, R. A., Wahl, C. M., Kito, S. The primordial to primary follicle transition. Molecular and Cellular Endocrinology. 163, 53-60 (2000).
- Ireland, J. J. Control of follicular growth and development. Journal of Reproduction and Fertility. 34, 39-54 (1987).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Ramezani, M., Salehnia, M., Jafarabadi, M. Short term culture of vitrified human ovarian cortical tissue to assess the cryopreservation outcome: molecular and morphological analysis. Journal of Reproduction & Infertility. 18 (1), 162-171 (2017).
- McLaughlin, M., Telfer, E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Stefansdottir, A., Fowler, P. A., Powles-Glover, N., Anderson, R. A., Spears, N. Use of ovary culture techniques in reproductive toxicology. Reproductive Toxicology. 49, 117-135 (2014).
- Bromfield, J. J., Sheldon, I. M. Lipopolysaccharide reduces the primordial follicle pool in the bovine ovarian cortex ex vivo and in the murine ovary in vivo. Biology of Reproduction. 88 (4), 1-9 (2013).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Humane Reproduction Update. 14 (4), 367-378 (2008).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicological Sciences. 90 (2), 500-509 (2006).
- Bott, R. C., McFee, R. M., Clopton, D. T., Toombs, C., Cupp, A. S. Vascular endothelial growth factor and kinase domain region receptor are involved in both seminiferous cord formation and vascular development during testis morphogenesis in the rat. Biology of Reproduction. 75, 56-67 (2006).
- Baltes-Breitwisch, M. M., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms or administration of proangiogenic isoforms stimulates vascular development in the rat testis. Reproduction. 140 (2), 319-329 (2010).
- McFee, R. M., et al. Inhibition of vascular endothelial growth factor receptor signal transduction blocks follicle progression but does not necessarily disrupt vascular development in perinatal rat ovaries. Biology of Reproduction. 81, 966-977 (2009).
- Artac, R. A., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms is more effective than treatment with proangiogenic isoforms in stimulating vascular development and follicle progression in the perinatal rat ovary. Biology of Reproduction. 81, 978-988 (2009).
- Abedal-Majed, M. A., et al. Vascular endothelial growth factor A isoforms modulate follicle development in peripbertal heifers independent of diet through diverse signal transduction pathways. Biology of Reproduction. 102 (3), 680-692 (2020).
- Wandji, S. A., Srsen, V., Voss, A. K., Eppig, J. J., Fortune, J. E. Initiation in vitro of bovine primordial follicles. Biology of Reproduction. 55, 942-948 (1996).
- Wandji, S. A., Srsen, V., Nathanielsz, P. W., Eppig, J. J., Fortune, J. E. Initiation of growth of baboon primordial follicles in vitro. Human Reproduction. 12 (9), 1993-2001 (1993).
- Yang, M. Y., Fortune, J. E. Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75, 924-932 (2006).
- Fortune, J. E., Kito, S., Wandji, S. A., Srsen, V. Activation of bovine and baboon primordial follicles in vitro. Theriogenology. 49, 441-449 (1998).
- Yang, M. Y., Fortune, J. E. Vascular endothelial growth factor stimulates the primary to secondary follicle transition in bovine follicles in vitro. Molecular Reproduction and Development. 74, 1095-1104 (2007).
- Barberino, R. S., Silva, J. R. V., Figueiredo, J. R., Matos, M. H. T. Transport of domestic and wild animal ovaries: a review of the effects of medium, temperature, and periods of storage on follicular viability. Biopreservation and Biobanking. 17 (1), 84-90 (2019).
- Summers, A. F., et al. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess. PLoS One. 9 (10), e110683 (2014).
- Koal, T., Schmiederer, D., Pham-Tuan, H., Rohring, C., Rauh, M. Standardized LC-MS/MS based steroid hormone profile analysis. The Journal of Steroid Biochemistry and Molecular Biology. 129, 129-138 (2012).
- Poole, R. K., Brown, A. R., Pore, M. H., Pickworth, C. L., Poole, D. H. Effects of endophyte-infected tall fescue seed and protein supplementation on stocker steers: II. Adaptive and innate immune function. Journal of Animal Science. 97 (10), 4160-4170 (2019).
- Laronda, M., et al. Alginate encapsulation supports the growth and differentiation of human primordial follicles within ovarian cortical tissue. Journal of Assisted Reproduction and Genetics. 31 (8), 1013-1028 (2014).
- Silber, S. J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23 (7), 1531-1537 (2008).
- Wiedemann, C., Zahmel, J., Jewgenow, K. Short-term culture of ovarian cortex pieces to assess the cryopreservation outcome in wild fields for genome conservation. BMC Veterinary Research. 9 (37), (2013).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354 (3), 869-880 (2013).
- Shimizu, T., Miyamoto, A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk-1, its receptor, in bovine granulosa cells. Animal Reproduction Science. 102 (3-4), 228-237 (2007).
- Tepekoy, F., Akkoyunlu, G. The effect of FSH and activin A on Akt and MAPK1/3 phosphorylation in cultured bovine ovarian cortical strips. Journal of Ovarian Research. 9 (13), 1-9 (2016).
- Beck, K., Singh, J., Arshud Dar, M., Anzar, M. Short-term culture of adult bovine ovarian tissues: chorioallantoic membrane (CAM) vs. traditional in vitro culture systems. Reproductive Biology and Endocrinology. 16 (1), 21 (2018).
- Eppig, J. J. Oocyte control of ovarian follicular development and function in mammals. Reproduction. 122 (6), 829-838 (2001).
- Paczkowski, M., Silva, E., Schoolcraft, W. B., Krisher, R. L. Comparative importance of fatty acid beta-oxidation to nuclear maturation, gene expression, and glucose metabolism in mouse, bovine, and porcine cumulus oocyte complexes. Biology of Reproduction. 88 (5), 1-11 (2013).
- Raffel, N., et al. Is ovarian tissue transport at supra-zero temperatures compared to body temperature optimal for follicle survival?. In Vivo. 34 (2), 533-541 (2020).
- Duncan, F., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction (Cambridge, England). 152 (6), R201-R210 (2016).
- Liebenthron, J., et al. Overnight ovarian tissue transportation for centralized cryobanking: a feasible option. Reproductive BioMedicine Online. 38 (5), 740-749 (2019).
- Mohammed, B. T., Donadeu, F. X. Bovine granulosa cell culture. Epithelial Cell Culture: Methods and Protocols. , 79-87 (2018).
- Langbeen, A., et al. Effects of neutral red assisted viability assessment on the cryotolerance of isolated bovine preantral follicles. Journal of Assisted Reproduction Genetics. 31, 1727-1736 (2014).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Yang, M. Y., Fortune, J. E. Changes in the transcriptome of bovine ovarian cortex during follicle activation in vitro. Physiological Genomics. 47, 600-611 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon