Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Gewebekultur der Rinderovariarinde
In diesem Artikel
Zusammenfassung
In-vitro-Kultur der rindereigenen Ovarialrinde und die Wirkung der ernährungsphysiologischen Stair-Step-Diät auf die ovarielle Mikroumgebung wird vorgestellt. Eierstockkortexstücke wurden sieben Tage lang kultiviert und Steroide, Zytokine und Follikelstadien wurden bewertet. Die Stair-Step-Diätbehandlung hatte eine erhöhte Steroidogenese, was zu einer Follikelprogression in Kultur führte.
Zusammenfassung
Die Follikelentwicklung vom primordialen zum antralen Stadium ist ein dynamischer Prozess innerhalb des Ovarialkortex, der endokrine und parakrine Faktoren aus somatischen Zellen und kumululuszell-eizelliger Kommunikation umfasst. Über die Mikroumgebung der Eierstöcke ist wenig bekannt und wie die im umgebenden Milieu produzierten Zytokine und Steroide die Progression oder den Stillstand der Follikel beeinflussen. Die In-vitro-Kultur des Ovarialkortex ermöglicht es follikeln, sich in einer normalisierten Umgebung zu entwickeln, die vom benachbarten Stroma unterstützt wird. Unser Ziel war es, die Wirkung der ernährungsphysiologischen Stair-Step-Diät auf die ovarielle Mikroumgebung (Follikelentwicklung, Steroid- und Zytokinproduktion) durch In-vitro-Kultur der Rinderovariarinde zu bestimmen. Um dies zu erreichen, wurden kortikale Ovarialstücke von Färsen entfernt, die vor der Pubertät zwei verschiedenen ernährungsphysiologisch entwickelten Schemata unterzogen wurden: Kontrolle (traditionelle Ernährungsentwicklung) und Stair-Step (Fütterung und Einschränkung während der Entwicklung), die in etwa 0,5-1 mm3 Stücke geschnitten wurden. Diese Stücke wurden anschließend einer Reihe von Waschungen unterzogen und auf einem Gewebekultureinsatz positioniert, der in einen Brunnen mit Waymouths Kulturmedium eingesetzt wird. Der Ovarialkortex wurde 7 Tage lang mit täglichen Veränderungen der Kulturmedien kultiviert. Histologische Schnitte wurden durchgeführt, um Follikelstadiumsveränderungen vor und nach der Kultur zu bestimmen, um die Auswirkungen der Ernährung und die Auswirkungen der Kultur ohne zusätzliche Behandlung zu bestimmen. Cortex-Kulturmedium wurde über Tage gepoolt, um Steroide, Steroidmetaboliten und Zytokine zu messen. Es gab Tendenzen für erhöhte Steroidhormone in der ovariellen Mikroumgebung, die eine Follikelprogression in den Stair-Step versus Control-Ovarialkortexkulturen ermöglichten. Die Kulturtechnik des ovariellen Kortex ermöglicht ein besseres Verständnis der ovariellen Mikroumgebung und wie Veränderungen in der endokrinen Sekretion die Progression und das Wachstum der Follikel sowohl durch In-vivo- als auch durch In-vitro-Behandlungen beeinflussen können. Diese Kulturmethode kann sich auch als vorteilhaft erweisen, um potenzielle Therapeutika zu testen, die die Follikelprogression bei Frauen verbessern können, um die Fruchtbarkeit zu fördern.
Einleitung
Der Ovarialkortex stellt die äußere Schicht des Eierstocks dar, in der die Follikelentwicklung stattfindet1. Primordiale Follikel, die zunächst in der Entwicklung gestoppt wurden, werden aktiviert, um primäre, sekundäre und dann antrale oder tertiäre Follikel zu werden, basierend auf parakrinen und Gonadotropin-Inputs1,2,3,4. Um physiologische Prozesse im Eierstock besser zu verstehen, kann die Gewebekultur als In-vitro-Modell verwendet werden, wodurch eine kontrollierte Umgebung für die Durchführung von Experimenten ermöglicht wird. Viele Studien haben die Ovarialgewebekultur für die Forschung in der assistierten Reproduktionstechnologie, der Erhaltung der Fruchtbarkeit und des Eierstockkrebses verwendet5,6,7. Die ovarielle Gewebekultur diente auch als Modell für die Untersuchung von Fortpflanzungstoxinen, die die Gesundheit der Eierstöcke und die Ätiologie von Fortpflanzungsstörungen wie dem polyzystischen Ovarialsyndrom (PCOS)schädigen 8,9,10,11. Somit ist dieses Kultursystem auf eine Vielzahl von Spezialitäten anwendbar.
Bei Nagetieren wurden ganze fetale oder perinatale Gonaden in reproduktionsbiologischen Experimentenverwendet 12,13,14,15. Gonaden von größeren Haustieren können jedoch aufgrund ihrer Größe und potenziellen Degeneration nicht als ganze Organe kultiviert werden. Daher wird der ovarielle Kortex von Rindern und nichtmenschlichen Primaten in kleinere Stücke geschnitten16,17,18. Viele Studien haben kleine Ovarialrindenstücke kultiviert, um verschiedene Wachstumsfaktoren bei der Initiation von Primordialfollikeln bei Haustieren und nichtmenschlichen Primaten zu untersuchen1,17,18,19. Die Verwendung der ovariellen Kortexkultur hat auch die Primordialfollikelinitiation in Abwesenheit von Serum für rinder- und primatenkortikale Stücke gezeigt, die für 7 Tagekultiviert wurden 20. Yang und Fortune behandelten 2006 das kulturmedium des fetalen Ovarialkortex mit einer Reihe von Testosterondosen über 10 Tage und beobachteten, dass die Testosteronkonzentration von10 -7 M die Follikelrekrutierung, das Überleben und das erhöhte Fortschreiten der Follikel im Frühstadium erhöhte19. Im Jahr 2007 berichteten Yang und Fortune unter Verwendung von Ovarialkortexkulturen von Rinderföten (5-8 Monate schwangerschaft) über eine Rolle für den vaskulären endothelialen Wachstumsfaktor A (VEGFA) beim übergang von primären zu sekundären Follikeln21. Darüber hinaus hat unser Labor Eierstockkortexkulturen verwendet, um zu zeigen, wie VEGFA-Isoformen (angiogen, antiangiogen und eine Kombination) verschiedene Signaltransduktionswege durch den Kinase-Domänenrezeptor (KDR) regulieren können, der der Hauptsignaltransduktionsrezeptor ist, den VEGFA bindet16. Diese Informationen ermöglichten ein besseres Verständnis dafür, wie verschiedene VEGFA-Isoformen Signalwege beeinflussen, um follikelprogression oder -stillstand hervorzurufen. Zusammengenommen kann die Kultivierung von Ovarialrindenstücken in vitro mit verschiedenen Steroiden oder Wachstumsfaktoren ein wertvoller Assay sein, um Die Auswirkungen auf Mechanismen zu bestimmen, die die Follikulogese regulieren. In ähnlicher Weise können Tiere, die auf verschiedenen Ernährungsregimen entwickelt wurden, eine veränderte ovarielle Mikroumgebung aufweisen, die die Follikulogese fördern oder hemmen kann, die die weibliche Fortpflanzungsreife beeinträchtigt. Daher ist es unser Ziel im aktuellen Manuskript, die Kulturtechnik des Rinderkortex zu berichten und festzustellen, ob es Unterschiede in der ovariellen Mikroumgebung nach in vitro Kultur der Rinderrinde von Färsen gibt, die entweder mit Kontroll- oder Stair-Step-Diäten gefüttert wurden, die im Alter von 13 Monaten gesammelt wurden, wie zuvor beschrieben16.
Daher bestand unser nächster Schritt darin, die Mikroumgebung der Eierstöcke in diesen Färsen zu bestimmen, die mit verschiedenen Ernährungsdiäten entwickelt wurden. Wir bewerteten den Ovarialkortex von Färsen, die entweder mit einer Stair-Step- oder Control-Diät gefüttert wurden. Kontrollfärsen wurde eine Erhaltungsdiät von 97,9 g/kg0,75 für 84 Tage angeboten. Die Stair-Step-Diät wurde nach 8 Monaten mit einer eingeschränkt gefütterten Diät von 67,4 g/kg0,75 für 84 Tage begonnen. Nach den ersten 84 Tagen, während Kontrollfärsen weiterhin 97,9 g/kg0,75erhielten, wurden den Stair-Step-Rinderfärsen 118,9 g/kg0,75 für weitere 68 Tage angeboten, danach wurden sie im Alter von 13 Monaten im Alter von16 Jahren ovariektomiert, um Veränderungen der follikulären Stadien und der Morphologie vor und nach der Kultur zu untersuchen. Wir untersuchten auch Unterschiede in Steroiden, Steroidmetaboliten, Chemokinen und Zytokinen, die in Kortexmedien sezerniert wurden. Steroide und andere Metaboliten wurden gemessen, um festzustellen, ob es direkte Auswirkungen von Behandlungen gab, die in vivo und / oder in vitro auf die Lebensfähigkeit und Produktivität des Gewebes durchgeführt wurden. Veränderungen in der Mikroumgebung der Eierstöcke vor und nach der Kultur lieferten eine Momentaufnahme des endokrinen Milieus und der Follikulogese vor der Kultur und wie die Kultur oder Behandlung während der Kultur die Progression oder den Stillstand der Follikel beeinflusst.
Eierstöcke wurden entnommen, nachdem Ovariektomien am U.S. Meat Animal Research Center (USMARC) gemäß ihren IACUC-Verfahren von Kontroll- und Treppenstufenfärsen im Alter von 13 Monaten im Alter von16Jahren durchgeführt wurden, gereinigt mit sterilen Phosphatpuffer-Kochsalzlösungen (PBS) mit 0,1% Antibiotikum, um Blut und andere Verunreinigungen zu entfernen, überschüssiges Gewebe zu trimmen und in das Labor für Reproduktionsphysiologie der Universität von Nebraska-Lincoln (UNL) UNL bei 37 ° C transportiert zu werden23 . An der UNL wurden ovarielle Kortexstücke in kleine quadratische Stücke geschnitten (~0,5-1 mm3; Abbildung 1) und 7 Tage lang kultiviert (Abbildung 2). Die Histologie wurde an den Kortexkulturobjektträgern vor und nach der Kulturdurchgeführt,um die Follikelstadien16,24 (Abbildung 3 und Abbildung 4) und extrazelluläre Matrixproteine, die auf Fibrose hinweisen können (Picro-Sirus Red, PSR; Abbildung 5). Dies ermöglichte die Bestimmung der Wirkung von In-vivo-Ernährungsregimen auf Follikelstadien und ermöglichte den Vergleich von 7 Tagen Eierstockrinde auf Follikelstadien und Follikelprogression. Während der gesamten Kultur wurde das Medium täglich gesammelt und gewechselt (etwa 70% der Medien wurden jeden Tag gesammelt; 250 μL / well), so dass entweder tägliche Hormone / Zytokine / Chemokine bewertet oder über Tage gepoolt werden können, um durchschnittliche Konzentrationen zu erhalten. Steroide wie Androstendion (A4) und Östrogen (E2) können über 3 Tage gepoolt und durch Radioimmunoassay (RIA; Abbildung 6) und über 4 Tage pro Tier gepoolt und mittels Hochleistungsflüssigkeitschromatographie-Massenspektrometrie (HPLC-MS)24,25 ( Tabelle1) untersucht. Zytokin-Arrays wurden verwendet, um Zytokin- und Chemokinkonzentrationen im Ovarialkortex-Kulturmedium26 zu bewerten (Tabelle 2). Echtzeit-Polymerase-Kettenreaktions-Assay-Platten (RT-PCR) wurden durchgeführt, um die Genexpression für spezifische Signaltransduktionswege zu bestimmen, wie zuvor gezeigt16. Alle Steroid-, Zytokin-, Follikelstufen- und histologischen Marker liefern eine Momentaufnahme der Mikroumgebung der Eierstöcke und Hinweise auf die Fähigkeit dieser Mikroumgebung, eine "normale" oder "abnormale" Follikulogenese zu fördern.
Protokoll
Die Eierstöcke wurden vom U. S. Meat Animal Research Center16 bezogen. Wie bereitserwähnt 16, wurden alle Verfahren vom U.S. Meat Animal Research Center (USMARC) Animal Care and Use Committee in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von landwirtschaftlichen Tieren in der landwirtschaftlichen Forschung und Lehre genehmigt. Die Eierstöcke wurden in das Reproduktionslabor der University of Nebraska-Lincoln gebracht, wo sie verarbeitet und kultiviert wurden.
1. Vorbereitung der benötigten Medien
-
Waymouth MB 752/1 mittel
- Füllen Sie eine 1 L Gewebekulturflasche mit 900 ml sterilem Wasser. Während das Wasser sanft auf einer Rührplatte gerührt wird, fügen Sie nach und nach das pulverisierte Medium hinzu. Sobald das pulverförmige Medium gelöst ist, fügen Sie 2,24 g Natriumbicarbonat hinzu, gefolgt von 1,25 g Rinderserumalbumin (BSA). Verwenden Sie ein pH-Messgerät und stellen Sie den pH-Wert auf 7,25-7,35 ein. Fügen Sie zusätzliches steriles Wasser hinzu, um das Endvolumen auf 1 L zu bringen.
- Gehen Sie zu einer biologischen Sicherheitswerkbank und fügen Sie Penicillin-Streptomycinsulfat in einer Konzentration von 0,1% v / v des Mediums hinzu. Filtern Sie das Medium mit einer 0,22 μm Pore 33,2 cm2 500 ml Flaschenverschlussfilter.
- Gießen Sie das gefilterte Medium in mehrere 50 ml konische Rohre. Fügen Sie 0,5 ml Insulin-Transferrin-Selen pro 50 ml aliquotem Medium hinzu.
- Konische Röhrchen und Lagerflasche des Mediums in Alufolie wickeln und bei 4 °C lagern. Dieses Medium ist lichtempfindlich.
HINWEIS: Waymouth Medium kann bis zu 1 Monat gelagert werden.
-
Leibovitz' L-15 (LB-15) medium
HINWEIS: LB-15 Medium wird verwendet, um Gewebe in Vorbereitung auf die Kultur zu reinigen.- Füllen Sie eine 1 L Gewebekulturflasche mit 900 ml sterilem Wasser. Während das sterile Wasser auf einer Rührplatte vorsichtig gerührt wird, fügen Sie nach und nach das vorbereitete pulverförmige Medium hinzu. Verwenden Sie ein pH-Messgerät und stellen Sie den pH-Wert auf 7,25-7,35 ein. Fügen Sie zusätzliches steriles Wasser hinzu, um das Endvolumen auf 1 L zu bringen.
- Wechseln Sie zur biologischen Sicherheitswerkbank. Machen Sie 1 l LB-15 mit 0,1% Antibiotikum (siehe Materialtabelle). Filtern Sie das Medium in zwei 500 ml Gewebekulturflaschen mit einem 0,22 μm Porenfilter 33,2 cm2 500 ml Flaschenverschlussfilter. Flaschen in Aluminiumfolie einwickeln, da LB-15 medium lichtempfindlich ist und bei 4 °C lagern.
HINWEIS: LB-15 Medium kann bis zu 1 Monat gelagert werden.
-
Phosphatgepufferte Kochsalzlösung (PBS)
- Stellen Sie PBS im Labor her oder kaufen Sie steriles PBS ohne Kalzium oder Magnesium (Table of Materials). Um PBS im Labor herzustellen, beginnen Sie mit 800 ml destilliertem Wasser und fügen Sie 8 g Natriumchlorid (NaCl) hinzu. Dann werden 0,2 g Kaliumchlorid (KCl), 1,44 g natriumphosphatdibasisch(Na2HPO4)und 0,24 g Kaliumphosphatdibasis(KH2PO4)zugegeben. Stellen Sie den pH-Wert auf ~ 7,4 und das Gesamtvolumen auf 1 L ein.
- Machen Sie 1 L PBS mit 0,1% Antibiotikum (siehe Materialtabelle),während Sie sich in einer biologischen Sicherheitswerkbank befinden.
2. Protokoll der kortikalen Kultur der Eierstöcke
HINWEIS: Eierstöcke wurden von im Frühjahr geborenen USMARC-Färsen im Alter von 13 Monaten gewonnen. Eierstöcke wurden gründlich gespült, und alle Blut- und andere Flüssigkeiten wurden mit PBS-haltigem Antibiotikum (0,1%) entfernt und bei 37 °C23 zum University of Nebraska-Lincoln Reproduction Laboratory UNL (1,5 h entfernt) transportiert. (Für Kommentare zur Temperatur der Eierstöcke während des Transports siehe Diskussion)
- Bereiten Sie das Eierstockgewebe auf einer sauberen Bank vor (Abbildung 1).
- Desinfizieren Sie die saubere Bank mit 70% Ethanol. Legen Sie ein frisches saugfähiges Pad auf die Tischplatte. Stellen Sie sicher, dass das saubere Bankgebläse eine halbe Stunde vor der Dissektion zusammen mit UV-Licht eingeschaltet wird, um alles in der sauberen Bank zu sterilisieren, einschließlich des absorbierenden Pads, und stellen Sie sicher, dass geeignete PSA verwendet wird.
- Die Petrischalen (60 x 15 mm) für Tissue-Wäschen anrichten. Drei Petrischalen werden für PBS-Wäsche, drei für PBS mit Antibiotikum und drei für LB-15-Wäschen benötigt. Eine zusätzliche LB-15-haltige Petrischale mit begleitendem Deckel wird für die endgültige Platzierung der Stücke nach dem Waschen verwendet.
- Füllen Sie jede Petrischale mit ca. 10 ml geeigneter Flüssigkeiten, entweder PBS oder LB-15.
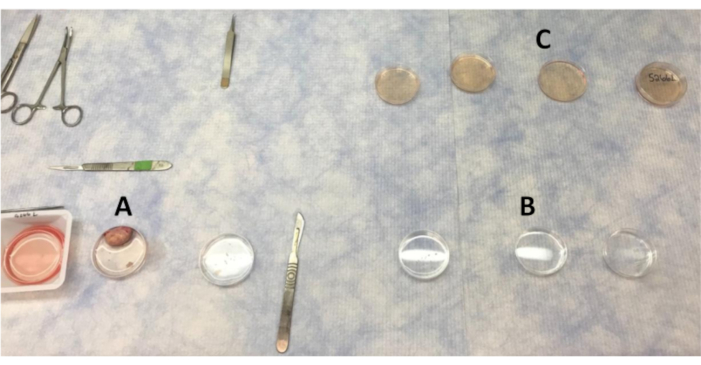
Abbildung 1:Anordnung der Platten zum Waschender Eierstock- und Kortexstücke in der sauberen Bank. (A) PBS, die zum Waschen des Eierstocks verwendet werden, wenn Abschnitte des Kortex entfernt werden. (B) PBS mit antibiotischen Waschungen, durch die Kortexstücke bewegt werden. (C) Ovarialkortexstücke werden viermal in LB-15 gewaschen, bevor sie zur endgültigen Wäsche in LB-15 in die Biosicherheitswerkbank gebracht werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
- Entfernen Sie das vorbereitete Waymouth und LB-15 Medium aus dem Kühlschrank und erwärmen Sie es auf Raumtemperatur.
- Autoklavieren Sie alle Werkzeuge, um die Sterilisation vor dem Gebrauch zu gewährleisten.
- Halten Sie die Eierstöcke bei 37 °C, bis der Eierstockkortex bereit ist, gesammelt zu werden.
- Nehmen Sie mit einer Pinzette mit gezackten Kiefern den Eierstock auf und waschen Sie ihn gründlich in der ersten PBS-gefüllten Petrischale. Übertragen Sie den Eierstock auf die zweite PBS-Wäsche und reinigen Sie ihn erneut gründlich.
HINWEIS: Der Eierstock bleibt in der zweiten PBS-Wäsche, während kortikale Streifen der Eierstöcke entfernt werden. - Mit einer gezackten Kieferzange den Eierstock sichern und in zwei Hälften schneiden. Zu diesem Zeitpunkt wird der Ovarialkortex von der Medulla wegschneiden. Stellen Sie mit einem Lineal sicher, dass nicht mehr als 1-2 mm Tiefe der Oberfläche des Eierstocks von der Medulla entfernt wird16. Entfernen Sie transversale Abschnitte des Ovarialkortex aus der Medulla, schneiden Sie 3-4 dünne Streifen des Ovarialkortex (Abbildung 2) mit einem Skalpell (# 11 Skalpellklinge; # 3 Griff) und legen Sie die Streifen in die dritte PBS-gefüllte Petrischale.
HINWEIS: Zu diesem Zeitpunkt kann zusätzliches kortikales Ovarialgewebe für die RNA-Extraktion gesammelt oder für die Histologie von anfänglichen nicht kultivierten Kortexstücken fixiert und gesammelt werden. Wenn Sie Streifen des Ovarialkortex entfernen, vermeiden Sie Bereiche mit sichtbaren Antralfollikeln oder Corpora lutea. Vermeiden Sie außerdem das Sammeln von Medulläremgewebe. Die Histologie der Medulla ist sehr unterschiedlich, wie zuvor gezeigt16. Wenn der Ovarialkortex nicht auf mehr als eine Tiefe von 1-2 mm geschnitten wird, sollte das Medulla nicht erhalten werden. Eine ausgeprägte Histologie ermöglicht Landmarken zwischen dem Kortex und der Medulla. - Schneiden Sie die Ovarialkortexstreifen in der dritten PBS-Wäsche in kleine, quadratische Stücke (~ 0,5-1 mm3)mit einer Skalpellklinge Nr. 21. Verwenden Sie ein Lineal unter den Petrischalen, um sicherzustellen, dass die Stücke von ähnlicher Größe und Dicke sind, um konsistente ovarielle Kortexstücke herzustellen. Verwenden Sie eine Pinzette, um die Streifen zu sichern, während Sie die Stücke mit einem Skalpell schneiden.
HINWEIS: Die Anzahl der geschnittenen Gewebestücke hängt vom Experiment ab. Vier Teile des Ovarialkortex sind die minimale Menge an Gewebe, die für die Kultur notwendig ist. Andere Methoden, um eine angemessene Länge und Tiefe zu gewährleisten, umfassen die Verwendung spezieller Schneidemaschinen26 oder vorgeschnittener Kunststoffteile alsSchablonen 27. - Waschen Sie ovarielle kortikale Stücke durch alle drei PBS mit antibiotikagefüllten Petrischalen. Verwenden Sie eine gebogene Zehenzange, um Teile zwischen den Waschungen zu bewegen.
- Bewegen Sie Kortexstücke durch die Reihe von LB-15-Waschungen und legen Sie sie in die endgültige LB-15-gefüllte Petrischale. Beschriften Sie den Deckel mit Tierausweis und Eierstockseite (links oder rechts).
HINWEIS: Tauchen Sie die Eierstockkortexstücke vollständig in jede Wäsche ein, um sie gründlich zu reinigen. - Sammle vier Eierstockkortexstücke pro Eierstock und fixiere sie für die Histologie am Tag Null. Zusätzliche Stücke können auch für RNA schockgefroren werden. Die verbleibenden Gewebestücke werden für die Kultur verwendet. Wischen Sie die Sezierwerkzeuge nach jeder Gewebeentnahme mit 70% Ethanol ab.
- Bereiten Sie eine biologische Sicherheitswerkbank für die abschließende Gewebewäsche und Kulturvorbereitung vor. Desinfizieren Sie die Vorräte mit 70% Ethanol, bevor Sie sie in die biologische Sicherheitswerkbank legen. Verwenden Sie die aseptische Technik, wenn Sie in der biologischen Sicherheitswerkbank arbeiten.
- Bewegen Sie den gesamten Ovarialkortex, der für die Kultur bestimmt ist, in die biologische Sicherheitswerkbank und waschen Sie ihn erneut in einer mit LB-15 gefüllten Petrischale.
- In einer 24-Well-Gewebekulturplatte werden 350 μL Waymouth-Medium pro Vertiefung pipettiert.
- Legen Sie unbeschichtete Kulturbrunneneinsätze mit einer Pinzette in jede Vertiefung. Stellen Sie sicher, dass sich unter der Basis des Einsatzes keine Blasen bilden, da dies zum Austrocknen des Gewebes führen würde. Das Medium muss die Einsätze berühren, damit das Medium absorbiert werden kann und die Teile des Ovarialkortex umgibt.
- Positionieren Sie vorsichtig vier Teile des Ovarialkortex auf dem Netz jedes Einsatzes (Abbildung 2). Die Pinzette kann das Netz durchstechen, wenn die Gewebestücke nicht vorsichtig platziert sind. Die Gewebestücke sollten sich nicht gegenseitig oder die Seite des Einsatzes berühren.
- Inkubieren sie das Gewebe bei 37°Cmit 5%CO216.
HINWEIS: Andere haben 38,8 °C28verwendet. Es wurde jedoch kein Unterschied in der Integrität des Gewebes oder in der Fähigkeit der Follikel beobachtet, in 37 °C-Gewebe fortzuschreiten, noch haben andere39,30. Daher sollte an dieser Stelle jede dieser Temperaturen für den Experimenterfolg förderlich sein. Andere haben 400 μL Medium verwendet. Beide Mengen sind in Ordnung, solange sie konsistent sind, und das Gewebe ist teilweise untergetaucht, was eine ausreichende Oberflächenspannung ermöglicht, um die Hydratation von Gewebe (Medien, die Ovarialrindenstücke umgeben) zu ermöglichen. Füllen Sie leere Brunnen mit 500 μL sterilem Wasser, um die Verdunstung aus anderen Brunnen zu reduzieren.

Abbildung 2: Ovarielle Kortexstücke und Kulturplatte. (A) Ein Eierstockstreifen, der aus dem Kortex des Eierstocks geschnitten wird. (B) Lineal und Kortexstück nebeneinander dargestellt. (C) Vier Kortexstücke (~0,5-1 mm3),die auf dem Einsatz im Kulturmedium in der Platte ruhen. (D) Anheben des Einsatzes, um das Kulturmedium aus dem Brunnen zu sammeln. Sammeln und ersetzen Sie das gesamte Kulturmedium täglich (250 μL), um den richtigen pH-Wert aufrechtzuerhalten.Ungefähr 250 μL werden jeden Tag aus jeder Vertiefung gewonnen (etwa 70% des ursprünglichen Kulturmediums). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Mediensammlung
- Wechseln Sie das Kulturmedium des Ovarialkortex täglich für 7 Tage. Mittlere Änderungen sollten so nah wie möglich an 24 h voneinander entfernt sein, um große pH- und Farbänderungen im Medium zu verhindern. Warmes Waymouth-Medium auf 37 °C vor dem Mittelwechsel. Aus jeder Vertiefung werden täglich etwa 250 μL gewonnen (etwa 70% des Ausgangskulturmediums).
- Verwenden Sie bei Mediumwechseln eine Pinzette, um den Einsatz vorsichtig aus dem Brunnen zu heben. Sammeln Sie das kultivierte Waymouth-Medium in 0,5 ml Röhrchen (ca. 250 μL / Tag). Setzen Sie den Einsatz gut ein und fügen Sie 350 μL Frischekulturmedium hinzu, indem Sie das Medium zwischen der Seite des Einsatzes und der Vertiefung verteilen.
HINWEIS: Wechseln Sie die meisten Medien täglich, um genügend Medien zu erhalten, um alle Steroide, Zytokine und Chemokine zu messen, die zur Bestimmung der Mikroumgebung der Eierstöcke erforderlich sind. Außerdem sind tägliche Mediumswechsel wichtig, um große pH-Veränderungen (angezeigt durch Farbveränderungen) im Medium zu verhindern. Mediumstropfen wurden um die Eierstockkortexstücke herum zurückgehalten, um sicherzustellen, dass die Stücke nass blieben. Es wurden keine Probleme mit kultiviertem Gewebe beobachtet, da 70% der Medien verändert wurden. - Lagern Sie das gesammelte Medium aus der Gewebekultur bei -20 °C.
4. Bildgebung und Weiterverarbeitung
- Nach 7 Tagen Kultur bei 37 °C mit 5%CO2bilden Sie die Stücke des Ovarialkortex mit einem Dissektionsmikroskop mit angeschlossener Kamera und einem Computer-Imaging-Softwareprogramm ab.
HINWEIS: Ein dunkler Raum ist in der Regel am besten geeignet, um die beste Bildqualität für die Bildgebung zu erzielen. - Nach der Bildgebung fixieren Sie zwei Ovarialkortexstücke pro Vertiefung in Bouins für die Histologie und frieren zwei Eierstockkortexstücke in flüssigem Stickstoff ein, um RNA für cDNA zu erhalten. Wiederholen Sie diesen Schritt für alle Vertiefungen mit Gewebe. Sammeln Sie das Medium von Tag 7 und lagern Sie es bei -20 °C.
- Lassen Sie die Eierstockkortexstücke etwa 1,5 h in Bouins (Pikrinsäure 750 ml, Eisessig 50 ml und 37%-40% Formalin 250 ml) eintauchen, bevor sie dreimal mit 70% Ethanol gewaschen werden. Das Gewebe verbleibt in 70% Ethanol und wird täglich gereinigt, bis die Lösung nicht mehr gelb ist.
HINWEIS: Andere Fixiermittel als Bouins sowie Paraformaldehyd können verwendet werden. In dieser Erfahrung wird Bouins verwendet, da es das Fixiermittel ist, um eine optimale Morphologie zu erreichen. Wenn mehr Gewebe für andere Analysen benötigt wird, können von jedem Tier zusätzliche Medientöpfe und Teile des Ovarialkortex gewonnen werden.
Ergebnisse
Dieses Rinderkortex-Kulturverfahren kann verwendet werden, um eine Vielzahl von Hormon-, Zytokin- und Histologiedaten aus kleinen Teilen des Eierstocks zu bestimmen. Färbungen, wie Hämatoxylin und Eosin (H & E), können verwendet werden, um die Morphologie der Eierstöcke durch Follikelinszenierung16,23,31 ( Abbildung3) zu bestimmen. Kurz gesagt, Follikel wurden als primordial klassifiziert, eine ...
Diskussion
Der Vorteil der in vitro ovariellen Kortexkultur, wie in diesem Manuskript beschrieben, besteht darin, dass sich die Follikel in einer normalisierten Umgebung mit angrenzendem Stroma entwickeln, das die Follikel umgibt. Die somatischen Zellen und die Eizelle bleiben intakt, und es gibt eine geeignete Zell-zu-Zell-Kommunikation als in vivo-Modell. Unser Labor hat herausgefunden, dass ein 7-Tage-Kultursystem repräsentative Follikulogese- und Steroidogenesedaten für die Behandlung des Ovarialkortex liefert. Andere ovariel...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Forschung wurde vom National Institute of Food and Agriculture 2013-67015-20965 an ASC, University of Nebraska Food for Health Competitive Grants an ASC, unterstützt. United States Department of Agriculture Hatch grant NEB26-202/W3112 Accession #1011127 to ASC, Hatch–NEB ANHL Accession #1002234 to ASC. Quantitative Life Sciences Initiative Summer Postdoctoral Scholar Support – COVID-19 Award für Sommerförderung für CMS.
Die Autoren möchten Dr. Robert Cushman, U.S. Meat Animal Research Center, Clay Center, NE, ihre Anerkennung aussprechen, um ihm für die Bereitstellung der Eierstöcke in einer früheren Publikation zu danken, die dann in der aktuellen Arbeit als Proof of Concept zur Validierung dieser Technik verwendet wurden.
Materialien
| Name | Company | Catalog Number | Comments |
| #11 Scapel Blade | Swann-Morton | 303 | Scaple Blade |
| #21 Scapel Blade | Swann-Morton | 307 | Scaple Blade |
| 500mL Bottle Top Filter | Corning | 430514 | Bottle Top Filter 0.22 µm pore for filtering medium |
| AbsoluteIDQ Sterol17 Assay | Biocrates | Sterol17 Kit | Samples are sent off to Biocrates and steroid panels are run and results are returned |
| Androstenedione Double Antibody RIA Kit | MPBio | 7109202 | RIA to determine androstenedione from culture medium |
| Belgium A4 Assay Kit | DIA Source | KIP0451 | RIA to determine androstenedione from culture medium |
| Bovine Cytokine Array Q3 | RayBiotech | QAB-CYT-3-1 | Cytokine kit to determine cytokines from culture medium |
| cellSens Software Standard 1.3 | Olympus | 7790 | Imaging Software |
| Insulin-Transferrin-Selenium-X | Gibco ThermoFisher Scientific | 5150056 | Addative to the culture medium |
| Leibovitz's L-15 Medium | Gibco ThermoFisher Scientific | 4130039 | Used for tissue washing on clean bench, and in the biosafety cabniet |
| Microscope | Olympus | SZX16 | Disection microscope used for imaging tissue culture pieces |
| Microscope Camera | Olympus | DP71 | Microscope cameraused for imaging tissue culture pieces |
| Millicell Cell Culture Inserts 0.4µm, 12,mm Diameter | Millipore Sigma | PICM01250 | Inserts that allow the tissue to rest against the medium without being submerged in it |
| Multiwell 24 well plate | Falcon | 353047 | Plate used to hold meduim, inserts, and tissues |
| Petri dish 60 x 15 mm | Falcon | 351007 | Petri dish used for washing steps prior to culture |
| Phosphate-Buffered Saline (PBS 1X) | Corning | 21-040-CV | Used for tissue washing |
| SAS Version 9.3 | SAS Institute | 9.3 TS1M2 | Statistical analysis software |
| Thomas Stadie-Riggs Tissue Slicer | Thomas Scientific | 6727C10 | Tissue slicer for preperation of thin uniform sections of fresh tissue |
| Waymouth MB 752/1 Medium | Sigma-Aldrich | W1625 | Medium used for tissue cultures |
Referenzen
- Braw-Tal, R., Yossefi, S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. Journal of Reproduction and Fertility. 109, 165-171 (1997).
- Nilsson anEdson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Fortune, J. E., Cushman, R. A., Wahl, C. M., Kito, S. The primordial to primary follicle transition. Molecular and Cellular Endocrinology. 163, 53-60 (2000).
- Ireland, J. J. Control of follicular growth and development. Journal of Reproduction and Fertility. 34, 39-54 (1987).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Ramezani, M., Salehnia, M., Jafarabadi, M. Short term culture of vitrified human ovarian cortical tissue to assess the cryopreservation outcome: molecular and morphological analysis. Journal of Reproduction & Infertility. 18 (1), 162-171 (2017).
- McLaughlin, M., Telfer, E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Stefansdottir, A., Fowler, P. A., Powles-Glover, N., Anderson, R. A., Spears, N. Use of ovary culture techniques in reproductive toxicology. Reproductive Toxicology. 49, 117-135 (2014).
- Bromfield, J. J., Sheldon, I. M. Lipopolysaccharide reduces the primordial follicle pool in the bovine ovarian cortex ex vivo and in the murine ovary in vivo. Biology of Reproduction. 88 (4), 1-9 (2013).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Humane Reproduction Update. 14 (4), 367-378 (2008).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicological Sciences. 90 (2), 500-509 (2006).
- Bott, R. C., McFee, R. M., Clopton, D. T., Toombs, C., Cupp, A. S. Vascular endothelial growth factor and kinase domain region receptor are involved in both seminiferous cord formation and vascular development during testis morphogenesis in the rat. Biology of Reproduction. 75, 56-67 (2006).
- Baltes-Breitwisch, M. M., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms or administration of proangiogenic isoforms stimulates vascular development in the rat testis. Reproduction. 140 (2), 319-329 (2010).
- McFee, R. M., et al. Inhibition of vascular endothelial growth factor receptor signal transduction blocks follicle progression but does not necessarily disrupt vascular development in perinatal rat ovaries. Biology of Reproduction. 81, 966-977 (2009).
- Artac, R. A., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms is more effective than treatment with proangiogenic isoforms in stimulating vascular development and follicle progression in the perinatal rat ovary. Biology of Reproduction. 81, 978-988 (2009).
- Abedal-Majed, M. A., et al. Vascular endothelial growth factor A isoforms modulate follicle development in peripbertal heifers independent of diet through diverse signal transduction pathways. Biology of Reproduction. 102 (3), 680-692 (2020).
- Wandji, S. A., Srsen, V., Voss, A. K., Eppig, J. J., Fortune, J. E. Initiation in vitro of bovine primordial follicles. Biology of Reproduction. 55, 942-948 (1996).
- Wandji, S. A., Srsen, V., Nathanielsz, P. W., Eppig, J. J., Fortune, J. E. Initiation of growth of baboon primordial follicles in vitro. Human Reproduction. 12 (9), 1993-2001 (1993).
- Yang, M. Y., Fortune, J. E. Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75, 924-932 (2006).
- Fortune, J. E., Kito, S., Wandji, S. A., Srsen, V. Activation of bovine and baboon primordial follicles in vitro. Theriogenology. 49, 441-449 (1998).
- Yang, M. Y., Fortune, J. E. Vascular endothelial growth factor stimulates the primary to secondary follicle transition in bovine follicles in vitro. Molecular Reproduction and Development. 74, 1095-1104 (2007).
- Barberino, R. S., Silva, J. R. V., Figueiredo, J. R., Matos, M. H. T. Transport of domestic and wild animal ovaries: a review of the effects of medium, temperature, and periods of storage on follicular viability. Biopreservation and Biobanking. 17 (1), 84-90 (2019).
- Summers, A. F., et al. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess. PLoS One. 9 (10), e110683 (2014).
- Koal, T., Schmiederer, D., Pham-Tuan, H., Rohring, C., Rauh, M. Standardized LC-MS/MS based steroid hormone profile analysis. The Journal of Steroid Biochemistry and Molecular Biology. 129, 129-138 (2012).
- Poole, R. K., Brown, A. R., Pore, M. H., Pickworth, C. L., Poole, D. H. Effects of endophyte-infected tall fescue seed and protein supplementation on stocker steers: II. Adaptive and innate immune function. Journal of Animal Science. 97 (10), 4160-4170 (2019).
- Laronda, M., et al. Alginate encapsulation supports the growth and differentiation of human primordial follicles within ovarian cortical tissue. Journal of Assisted Reproduction and Genetics. 31 (8), 1013-1028 (2014).
- Silber, S. J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23 (7), 1531-1537 (2008).
- Wiedemann, C., Zahmel, J., Jewgenow, K. Short-term culture of ovarian cortex pieces to assess the cryopreservation outcome in wild fields for genome conservation. BMC Veterinary Research. 9 (37), (2013).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354 (3), 869-880 (2013).
- Shimizu, T., Miyamoto, A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk-1, its receptor, in bovine granulosa cells. Animal Reproduction Science. 102 (3-4), 228-237 (2007).
- Tepekoy, F., Akkoyunlu, G. The effect of FSH and activin A on Akt and MAPK1/3 phosphorylation in cultured bovine ovarian cortical strips. Journal of Ovarian Research. 9 (13), 1-9 (2016).
- Beck, K., Singh, J., Arshud Dar, M., Anzar, M. Short-term culture of adult bovine ovarian tissues: chorioallantoic membrane (CAM) vs. traditional in vitro culture systems. Reproductive Biology and Endocrinology. 16 (1), 21 (2018).
- Eppig, J. J. Oocyte control of ovarian follicular development and function in mammals. Reproduction. 122 (6), 829-838 (2001).
- Paczkowski, M., Silva, E., Schoolcraft, W. B., Krisher, R. L. Comparative importance of fatty acid beta-oxidation to nuclear maturation, gene expression, and glucose metabolism in mouse, bovine, and porcine cumulus oocyte complexes. Biology of Reproduction. 88 (5), 1-11 (2013).
- Raffel, N., et al. Is ovarian tissue transport at supra-zero temperatures compared to body temperature optimal for follicle survival?. In Vivo. 34 (2), 533-541 (2020).
- Duncan, F., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction (Cambridge, England). 152 (6), R201-R210 (2016).
- Liebenthron, J., et al. Overnight ovarian tissue transportation for centralized cryobanking: a feasible option. Reproductive BioMedicine Online. 38 (5), 740-749 (2019).
- Mohammed, B. T., Donadeu, F. X. Bovine granulosa cell culture. Epithelial Cell Culture: Methods and Protocols. , 79-87 (2018).
- Langbeen, A., et al. Effects of neutral red assisted viability assessment on the cryotolerance of isolated bovine preantral follicles. Journal of Assisted Reproduction Genetics. 31, 1727-1736 (2014).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Yang, M. Y., Fortune, J. E. Changes in the transcriptome of bovine ovarian cortex during follicle activation in vitro. Physiological Genomics. 47, 600-611 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten