Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Культура ткани коры яичников крупного рогатого скота
В этой статье
Резюме
Представлена культура in vitro коры яичников крупного рогатого скота и влияние питательной лестничной диеты на микроокружение яичников. Кусочки коры яичников культивировали в течение семи дней, оценивали стероиды, цитокины и стадии фолликулов. Диетическое лечение Stair-Step увеличило стероидогенез, что привело к прогрессированию фолликулов в культуре.
Аннотация
Развитие фолликула от первичной до антральной стадии – это динамический процесс внутри коры яичников, который включает эндокринные и паракринные факторы из соматических клеток и кучевые клеточно-ооцитарные коммуникации. Мало что известно о микроокружении яичников и о том, как цитокины и стероиды, вырабатываемые в окружающей среде, влияют на прогрессирование или остановку фолликулов. Культура in vitro коры яичников позволяет фолликулам развиваться в нормализованной среде, которая остается поддерживаемой соседней стромой. Наша цель состояла в том, чтобы определить влияние питательной диеты Stair-Step на микроокружение яичников (развитие фолликулов, выработку стероидов и цитокинов) с помощью культуры in vitro коры яичников крупного рогатого скота. Чтобы достичь этого, корковые части яичников были удалены у телок, проходящих две различные схемы питания до полового созревания: Контроль (традиционное развитие питания) и Ступенька (кормление и ограничение во время развития), которые были разрезаны примерно на 0,5-1 мм3 кусочка. Эти кусочки впоследствии были пропущены через серию промывок и размещены на тканевой культуральной вставке, которая устанавливается в колодец, содержащий культуральную среду Уэймута. Кора яичников культивировалась в течение 7 дней с ежедневными изменениями питательных сред. Гистологическое сечение проводили для определения изменений стадии фолликула до и после посева для определения эффектов питания и воздействия культуры без дополнительного лечения. Культуральная среда cortex была объединена в течение нескольких дней для измерения стероидов, стероидных метаболитов и цитокинов. Наблюдались тенденции к увеличению стероидных гормонов в микроокружении яичников, что позволило прогрессировать фолликулы в культурах Stair-Step по сравнению с культурами коры яичников. Метод культивирования коры яичников позволяет лучше понять микроокружение яичников и то, как изменения в эндокринной секреции могут влиять на прогрессирование и рост фолликулов как при лечении in vivo, так и in vitro. Этот метод культивирования может также оказаться полезным для тестирования потенциальных терапевтических средств, которые могут улучшить прогрессирование фолликулов у женщин для повышения фертильности.
Введение
Кора яичников представляет собой внешний слой яичника, где происходит развитие фолликула1. Примордиальные фолликулы, первоначально остановленные в развитии, будут активированы, чтобы стать первичными, вторичными, а затем антральными или третичными фолликулами на основе паракринных и гонадотропиновых входов1,2,3,4. Чтобы лучше понять физиологические процессы в яичнике, культура тканей может быть использована в качестве модели in vitro, что позволяет контролируемой среде проводить эксперименты. Многие исследования использовали культуру ткани яичников для исследований в области вспомогательных репродуктивных технологий, сохранения фертильности и рака яичников5,6,7. Культура ткани яичников также послужила моделью для исследования репродуктивных токсинов, которые повреждают здоровье яичников и этиологию репродуктивных расстройств, таких как синдром поликистозных яичников (СПКЯ)8,9,10,11. Таким образом, эта система культур применима к широкому спектру специальностей.
У грызунов цельные фетальные или перинатальные гонады использовались в экспериментах по репродуктивной биологии12,13,14,15. Однако гонады более крупного домашнего скота не могут культивироваться как целые органы из-за их большого размера и потенциальной дегенерации. Поэтому кору яичников крупного рогатого скота и нечеловеческого примата разрезают на более мелкие кусочки16,17,18. Во многих исследованиях культивировались небольшие кусочки коры яичников для изучения различных факторов роста в инициации первичного фолликула у домашнего скота и нечеловеческих приматов1,17,18,19. Использование культуры коры яичников также продемонстрировало инициацию первичного фолликула при отсутствии сыворотки для кортикальных кусочков крупного рогатого скота и приматов, культивируемых в течение 7дней 20. Янг и Фортуна в 2006 году лечили культуральную среду коры яичников плода диапазоном доз тестостерона в течение 10 дней и наблюдали, что концентрация тестостерона10 -7 М увеличивает набор фолликулов, выживаемость и увеличивает прогрессирование фолликулов на ранней стадии19. В 2007 году, используя культуры коры яичников крупного рогатого скота (5-8 месяцев беременности), Ян и Фортуна сообщили о роли фактора роста эндотелия сосудов А (VEGFA) в первичном переходе фолликула на вторичный21. Кроме того, наша лаборатория использовала культуры коры яичников, чтобы продемонстрировать, как изоформы VEGFA (ангиогенные, антиангиогенные и комбинированные) могут регулировать различные пути сигнальной трансдукции через рецептор киназного домена (KDR), который является основным сигнальным рецептором трансдукции, который VEGFA связывает16. Эта информация позволила лучше понять, как различные изоформы VEGFA влияют на сигнальные пути, вызывая прогрессирование или остановку фолликулов. В совокупности культивирование кусочков коры яичников in vitro с различными стероидами или факторами роста может быть ценным анализом для определения влияния на механизмы, регулирующие фолликулогенез. Аналогичным образом, животные, которые развиваются на разных режимах питания, могут иметь измененное микроокружение яичников, что может способствовать или ингибировать фолликулогенез, влияющий на репродуктивную зрелость самок. Таким образом, наша цель в текущей рукописи состоит в том, чтобы сообщить о методе культивирования коры крупного рогатого скота и определить, есть ли различия в микросредах яичников после культуры in vitro коры крупного рогатого скота от телок, которых кормили либо контрольной, либо степенной диетой, собранной в возрасте 13 месяцев, как описаноранее 16.
Поэтому нашим следующим шагом было определение микроокружения яичников у этих телок, которые были разработаны с различными питательными диетами. Мы оценили кору яичников у телок, которых кормили либо лестничной, либо контрольной диетой. Контрольным телкам предлагалась поддерживающая диета 97,9 г/кг0,75 в течение 84 дней. Диета Stair-Step была начата через 8 месяцев, содержащая ограниченную диету 67,4 г / кг0,75 в течение 84 дней. После первых 84 дней, в то время как контрольные телки продолжали получать 97,9 г/кг0,75,говяжьим телкам Stair-Step предлагали 118,9 г/кг0,75 в течение еще 68 дней, после чего их овариэктомировали в возрасте 13 месяцев16 лет для изучения изменений в фолликулярных стадиях и морфологии до и после культивирования. Мы также проанализировали различия в стероидах, стероидных метаболитах, хемокинах и цитокинах, секретируемых в среды коры головного мозга. Стероиды и другие метаболиты измеряли, чтобы определить, были ли какие-либо прямые эффекты от лечения, проводимого in vivo и / или in vitro, на жизнеспособность и продуктивность тканей. Изменения в микроокружении яичников до и после культивирования обеспечили снимок эндокринной среды и фолликулогенеза до посева и того, как культура или лечение во время культуры влияет на прогрессирование или остановку фолликулов.
Яичники были собраны после того, как овариэктомия была выполнена в Исследовательском центре мясных животных США (USMARC) в соответствии с их процедурами IACUC от контрольных и лестничных телок в возрасте 13 месяцев16лет, очищенных стерильным фосфатным буферным физиологическим раствором (PBS), промытых 0,1% антибиотиком для удаления крови и других загрязняющих веществ, обрезанных излишков ткани и транспортированных в лабораторию репродуктивной физиологии Университета Небраски-Линкольна (UNL) UNL при 37 ° C23 . В UNL кусочки коры яичников разрезали на мелкие квадратные кусочки (~0,5-1мм3; Рисунок 1) и культивируется в течение 7 дней(рисунок 2). Гистология проводилась на слайдах культуры коры головного мозга до и после посева для определения фолликуловстадий 16,24 (Фиг.3 и Фиг.4),а также белков внеклеточного матрикса, которые могут указывать на фиброз (Picro-Sirus Red, PSR; Рисунок 5). Это позволило определить влияние режимов питания in vivo на стадии фолликула и позволило сравнить 7 дней коры яичников на стадиях фолликула и прогрессирование фолликулов. На протяжении всей культуры среду собирали и изменяли ежедневно (примерно 70% сред собирали каждый день; 250 мкл / хорошо), так что либо суточные гормоны / цитокины / хемокины могли быть оценены, либо объединены в течение нескольких дней для получения средних концентраций. Стероиды, такие как андростендион (A4) и эстроген (E2), могут быть объединены в течение 3 дней и оценены с помощью радиоиммуноанализа (RIA; Рисунок 6) и объединенные в течение 4 дней на каждое животное и проанализированные с помощью высокоэффективной жидкостной хроматографии-масс-спектрометрии (ВЭЖХ-МС)24,25 (таблица 1). Цитокиновые массивы использовали для оценки концентраций цитокинов и хемокинов в культуральной среде коры яичников26 (таблица 2). Были проведены тестовые пластины полимеразной цепной реакции (ОТ-ПЦР) в режиме реального времени для определения экспрессии генов для специфических путей трансдукции сигнала, как было продемонстрированоранее 16. Все стероидные, цитокиновые, фолликулярные стадии и гистологические маркеры обеспечивают снимок микроокружения яичников и подсказки о способности этого микроокружения способствовать «нормальному» или «аномальному» фолликулогенезу.
протокол
Яичники были получены из Исследовательского центра мясных животных США16. Как указывалосьранее 16,все процедуры были одобрены Комитетом по уходу и использованию животных Центра исследований мясных животных США (USMARC) в соответствии с руководством по уходу и использованию сельскохозяйственных животных в сельскохозяйственных исследованиях и обучении. Яичники были доставлены в Репродуктивную лабораторию Университета Небраски-Линкольна, где они были обработаны и культивированы.
1. Подготовка необходимых носителей
-
Уэймут MB 752/1 средний
- Наполните бутылку с культурой тканей объемом 1 л 900 мл стерильной воды. Пока вода осторожно помешивается на перемешиваемой пластине, постепенно добавляйте порошкообразную среду. После того, как порошкообразная среда растворится, добавьте 2,24 г бикарбоната натрия, а затем 1,25 г бычьего сывороточного альбумина (BSA). Используйте рН-метр и отрегулируйте рН до 7,25-7,35. Добавьте дополнительную стерильную воду, чтобы довести конечный объем до 1 л.
- Переместите в шкаф биологической безопасности и добавьте пенициллин-стрептомицин сульфат в концентрации 0,1% v/v среды. Отфильтруйте среду с помощью 0,22 мкм поры 33,2 см2 500 мл бутылочного верхнего фильтра.
- Вылейте отфильтрованную среду в несколько конических трубок по 50 мл. Добавьте 0,5 мл инсулина-трансферрина-селена на 50 мл аликвотированной среды.
- Заверните конические трубки и бутылочку со средой в алюминиевую фольгу и храните при 4 °C. Эта среда светочувствительна.
ПРИМЕЧАНИЕ: Среда Waymouth может храниться до 1 месяца.
-
Средний L-15 (LB-15) компании Leibovitz
ПРИМЕЧАНИЕ: Среда LB-15 используется для очистки тканей при подготовке к культуре.- Наполните бутылку с культурой тканей объемом 1 л 900 мл стерильной воды. Пока стерильная вода осторожно помешивается на перемешиваемой пластине, постепенно добавляйте приготовленную порошкообразную среду. Используйте рН-метр и отрегулируйте рН до 7,25-7,35. Добавьте дополнительную стерильную воду, чтобы довести конечный объем до 1 л.
- Перейдите в кабинет биологической безопасности. Внесите 1 л LB-15 с 0,1% антибиотиком (см. Таблицу материалов). Отфильтруйте среду в два флакона для посева тканей по 500 мл, используя верхний фильтр для бутылок с порой 0,22 мкм33,2 см 2 500 мл. Обернуть бутылки в алюминиевую фольгу как среду LB-15 светочувствительна и хранить при 4 °C.
ПРИМЕЧАНИЕ: Носитель LB-15 может храниться до 1 месяца.
-
Фосфатный буферизованный физиологический раствор (PBS)
- Сделайте PBS в лаборатории или приобретите стерильный PBS без кальция или магния(Таблица материалов). Чтобы сделать PBS в лаборатории, начните с 800 мл дистиллированной воды и добавьте к ней 8 г хлорида натрия (NaCl). Затем добавляют 0,2 г калия хлорида (KCl), 1,44 г двухосновного фосфата натрия (Na2HPO4)и 0,24 г двухосновного фосфата калия (KH2PO4). Отрегулируйте pH до ~7,4 и отрегулируйте общий объем до 1 л. Стерилизуйте раствор путем автоклавирования.
- Внесите 1 л PBS с 0,1% антибиотиком (см. Таблицу материалов),находясь в шкафу биологической безопасности.
2. Протокол культивирования коры яичников
ПРИМЕЧАНИЕ: Яичники были получены от весенних телок USMARC в возрасте 13 месяцев. Яичники тщательно промывали, а всю кровь и другую жидкость удаляли С помощью PBS, содержащего антибиотик (0,1%), и транспортировали при 37 °C23 в Лабораторию репродукции Университета Небраски-Линкольна UNL (1,5 часа). (Для комментариев о температуре яичников во время транспортировки см. Обсуждение)
- Подготовьте ткань яичника на чистой скамье(рисунок 1).
- Продезинфицируйте чистую скамейку 70% этанолом. Поместите свежую абсорбирующую прокладку на столешницу. Убедитесь, что чистый настольный воздуходувка включена за полчаса до вскрытия вместе с ультрафиолетовым светом, чтобы стерилизовать что-либо в чистой скамье, включая абсорбирующую прокладку, и убедитесь, что используются соответствующие СИЗ.
- Разложите посуду Петри (60 x 15 мм) для промывания тканей. Три чашки Петри требуются для мытья PBS, три для PBS с антибиотиком и три для мытья LB-15. Дополнительная чашка Петри, содержащая LB-15, с сопутствующей крышкой будет использоваться для окончательного размещения кусочков после мытья.
- Наполните каждую чашку Петри примерно 10 мл соответствующих жидкостей, либо PBS, либо LB-15.
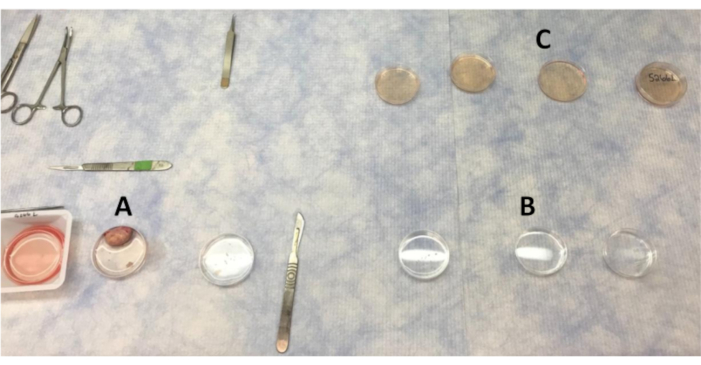
Рисунок 1:Расположение пластин для промывания яичников и коры в чистой скамье. (А)PBS используется для промывания яичника по мере удаления участков коры. (B) PBS с антибиотиками, через которые перемещаются части коры. (C)Кусочки коры яичников промывают четыре раза в LB-15 перед перемещением в шкаф биобезопасности для окончательной промывки в LB-15. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Выньте подготовленную среду Waymouth и LB-15 из холодильника и разогрейте до комнатной температуры.
- Автоклав все инструменты для обеспечения стерилизации перед использованием.
- Поддерживайте яичники при 37°Сдо тех пор, пока кора яичников не будет готова к сбору.
- Используя щипцы с зазубренными челюстями, поднимите завязь и тщательно вымойте в первой чашке Петри, наполненной PBS. Переведите яичник на вторую промывку PBS и тщательно очистите еще раз.
ПРИМЕЧАНИЕ: Яичник останется во второй промывке PBS, в то время как кортикальные полоски яичника будут удалены. - Используя зазубренные челюстные щипцы, закрепите яичник и разрезайте пополам. В это время кора яичников будет отрезана от продолговатого мозга. Используя линейку, убедитесь, что от продолговатого мозга удалено не более 1–2 мм глубины поверхности завязи16. Удалите поперечные участки коры яичников из продолговатого мозга, вырежьте 3–4 тонкие полоски коры яичников(рисунок 2)скальпелем (лезвие скальпеля No 11; ручка No3) и поместите полоски в третью чашку Петри, заполненную PBS.
ПРИМЕЧАНИЕ: В это время дополнительная кортикальная ткань яичника может быть собрана для извлечения РНК или зафиксирована и собрана для гистологии исходных некультивированных участков коры. При удалении полосок коры яичников избегайте участков с видимыми антральными фолликулами или желтыми телами. Кроме того, избегайте сбора медуллярной ткани. Гистология продолговатого мозга сильно отличается, как показаноранее 16. Если кору яичников не разрезать на глубину более 1–2 мм, то продолговатый мозг получать не следует. Отчетливая гистология позволяет определить ориентиры между корой и продолговатым мозгом. - Разрежьте полоски коры яичников в третьем PBS на мелкие квадратные кусочки (~ 0,5-1 мм3)лезвием скальпеля No21. Используйте линейку под чашками Петри, чтобы убедиться, что кусочки имеют одинаковый размер и толщину, чтобы сделать последовательные кусочки коры яичников. Используйте щипцы, чтобы закрепить полоски, разрезая куски скальпелем.
ПРИМЕЧАНИЕ: Количество вырезанных кусочков ткани зависит от эксперимента. Четыре куска коры яичников – это минимальное количество ткани, необходимое для культивирования. Другие способы обеспечения соответствующей длины и глубины включают использование специальных слайсеров26 или предварительно вырезанных пластиковых кусков в качестве шаблонов27. - Промыть кортикальные кусочки яичников через все три PBS с помощью наполненных антибиотиками чашек Петри. Используйте изогнутые наконечники щипцов для перемещения кусочков между стирками.
- Переместите кусочки коры через серию промывок LB-15 и поместите в конечную чашку Петри, наполненную LB-15. Пометьте крышку идентификатором животного и стороной яичника (слева или справа).
ПРИМЕЧАНИЕ: Полностью погружайте кусочки коры яичников в каждую промывку для тщательной очистки. - Соберите четыре кусочка коры яичников на яичник и зафиксируйте гистологию нулевого дня. Дополнительные кусочки также могут быть заморожены для РНК. Остальные кусочки ткани будут использованы для культивирования. Протирайте рассекающие инструменты 70% этанолом после каждого сбора ткани.
- Подготовьте шкаф биологической безопасности для окончательного промывания тканей и подготовки культуры. Продезинфицируйте расходные материалы с 70% этанолом перед помещением в шкаф биологической безопасности. Используйте асептическую технику при работе в шкафу биологической безопасности.
- Переместите всю кору яичников, предназначенную для культивирования, в шкаф биологической безопасности и снова вымойте в чашке Петри, наполненной LB-15.
- В 24-луночной тканевой культуральной пластине пипетка 350 мкл среды Waymouth на лунку.
- Поместите в каждую лунку колодцы без покрытия с помощью щипцов. Убедитесь, что под основанием вставки не образуются пузырьки, так как это приведет к высыханию ткани. Среда должна касаться вставок, чтобы позволить среде поглощаться и окружать кусочки коры яичников.
- Аккуратно расположите четыре части коры яичников на сетке каждой вставки(рисунок 2). Щипцы могут проколоть сетку, если кусочки ткани не расположены деликатно. Кусочки ткани не должны касаться друг друга или боковой стороны вставки.
- Инкубируют ткани при 37°Сс 5%СО216.
ПРИМЕЧАНИЕ: Другие использовали 38,8 °C28. Однако не наблюдалось различий ни в целостности ткани, ни в способности фолликулов прогрессировать в 37°Сткани, ни в других39,30. Таким образом, в этот момент любая из этих температур должна способствовать успеху эксперимента. Другие использовали 400 мкл среды. Любое количество хорошо, если оно является последовательным, и ткань частично погружена, что обеспечивает адекватное поверхностное натяжение, чтобы обеспечить гидратацию ткани (среды, окружающие части коры яичников). Заполняйте пустые колодцы 500 мкл стерильной воды, чтобы уменьшить испарение из других скважин.

Рисунок 2:Кусочки коры яичников и культуральная пластина. (A) Полоса яичника, вырезанная из коры яичника. (B) Линейка и часть коры показаны бок о бок. (C) Четыре части коры (~0,5-1 мм3),опирающиеся на вставку в культуральную среду в пластине. (D) Подъем вкладыша для сбора питательной среды из колодца. Собирайте и заменяйте всю культуральную среду ежедневно (250 мкл) для поддержания надлежащего рН.Приблизительно 250 мкл получают из каждой лунки каждый день (около 70% исходной питательной среды). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Медиа коллекция
- Меняют культуру коры яичников средняя ежедневно в течение 7 дней. Изменения среды должны быть как можно ближе к 24 часам друг от друга, чтобы предотвратить большие изменения рН и цвета в среде. Теплый Waymouth средний до 37 °C до изменения среды. Приблизительно 250 мкл получают из каждой скважины каждый день (около 70% исходной питательной среды).
- Во время смены среды используйте щипцы, чтобы осторожно поднять вставку из колодца. Собирают культивируемую уэймутовую среду в пробирках по 0,5 мл (примерно 250 мкл/сут). Установите вставку обратно в колодец и добавьте 350 мкл свежей питательной среды, распределив среду между боковой стороной вкладыша и колодцем.
ПРИМЕЧАНИЕ: Ежедневно меняйте большую часть среды, чтобы получить достаточное количество сред для измерения всех стероидов, цитокинов и хемокинов, необходимых для определения микроокружения яичников. Кроме того, ежедневные изменения среды важны для предотвращения больших изменений рН (обозначенных изменением цвета) в среде. Капли среды были сохранены вокруг кусочков коры яичников, чтобы гарантировать, что кусочки остаются влажными. Никаких проблем с культивируемой тканью не наблюдалось из-за изменения 70% среды. - Хранят собранную среду из культуры тканей при -20°С.
4. Визуализация и последующая обработка
- После 7 дней культивирования при 37 °C с 5% CO2,визуализируйте кусочки коры яичников с помощью рассеченного микроскопа с прикрепленной камерой и компьютерной программой для визуализации.
ПРИМЕЧАНИЕ: Темная комната обычно лучше всего подходит для достижения наилучшего качества изображения для изображения. - После визуализации зафиксируйте два кусочка коры яичников на лунку в Буинах для гистологии и мгновенно заморозьте два кусочка коры яичников в жидком азоте для получения РНК для кДНК. Повторите этот шаг для всех лунок с тканью. Собирают среду с 7 дня и хранят при -20°С.
- Пусть кусочки коры яичников остаются погруженными в буины (пикриновая кислота 750 мл, ледниковая уксусная кислота 50 мл и 37%-40% формалин 250 мл) в течение примерно 1,5 ч, прежде чем быть промытым 70% этанолом три раза. Ткань останется в 70% этаноле и будет очищаться ежедневно, пока раствор не перестанет желтеть.
ПРИМЕЧАНИЕ: Могут использоваться фиксаторы, отличные от буинов, а также параформальдегид. В этом опыте буэн используется, так как он является фиксатором для достижения оптимальной морфологии. Если для другого анализа требуется больше ткани, у каждого животного могут быть получены дополнительные колодцы сред и кусочки коры яичников.
Результаты
Эта процедура культивирования коры крупного рогатого скота может быть использована для определения широкого спектра гормональных, цитокинных и гистологических данных из небольших кусочков яичника. Окрашивание, такое как гематоксилин и эозин (H & E), может быть использовано для определ?...
Обсуждение
Преимущество культуры коры яичников in vitro, как описано в этой рукописи, заключается в том, что фолликулы развиваются в нормализованной среде с прилегающей стромой, окружающей фолликулы. Соматические клетки и ооцит остаются нетронутыми, и существует соответствующая межклеточная связь ?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было поддержано Национальным институтом продовольствия и сельского хозяйства 2013-67015-20965 ASC, University of Nebraska Food for Health Competitive Grants to ASC. Грант Министерства сельского хозяйства США NEB26-202/W3112 Присоединение No 1011127 к ASC, присоединение Hatch-NEB ANHL #1002234 к ASC. Количественная инициатива в области наук о жизни Летняя постдокторская поддержка стипендиатов – награда COVID-19 за летнее финансирование CMS.
Авторы хотели бы выразить свою признательность доктору Роберту Кушману, Исследовательскому центру мясных животных США, Clay Center, NE, чтобы поблагодарить его за предоставление яичников в предыдущей публикации, которые затем были использованы в текущей статье в качестве доказательства концепции при проверке этого метода.
Материалы
| Name | Company | Catalog Number | Comments |
| #11 Scapel Blade | Swann-Morton | 303 | Scaple Blade |
| #21 Scapel Blade | Swann-Morton | 307 | Scaple Blade |
| 500mL Bottle Top Filter | Corning | 430514 | Bottle Top Filter 0.22 µm pore for filtering medium |
| AbsoluteIDQ Sterol17 Assay | Biocrates | Sterol17 Kit | Samples are sent off to Biocrates and steroid panels are run and results are returned |
| Androstenedione Double Antibody RIA Kit | MPBio | 7109202 | RIA to determine androstenedione from culture medium |
| Belgium A4 Assay Kit | DIA Source | KIP0451 | RIA to determine androstenedione from culture medium |
| Bovine Cytokine Array Q3 | RayBiotech | QAB-CYT-3-1 | Cytokine kit to determine cytokines from culture medium |
| cellSens Software Standard 1.3 | Olympus | 7790 | Imaging Software |
| Insulin-Transferrin-Selenium-X | Gibco ThermoFisher Scientific | 5150056 | Addative to the culture medium |
| Leibovitz's L-15 Medium | Gibco ThermoFisher Scientific | 4130039 | Used for tissue washing on clean bench, and in the biosafety cabniet |
| Microscope | Olympus | SZX16 | Disection microscope used for imaging tissue culture pieces |
| Microscope Camera | Olympus | DP71 | Microscope cameraused for imaging tissue culture pieces |
| Millicell Cell Culture Inserts 0.4µm, 12,mm Diameter | Millipore Sigma | PICM01250 | Inserts that allow the tissue to rest against the medium without being submerged in it |
| Multiwell 24 well plate | Falcon | 353047 | Plate used to hold meduim, inserts, and tissues |
| Petri dish 60 x 15 mm | Falcon | 351007 | Petri dish used for washing steps prior to culture |
| Phosphate-Buffered Saline (PBS 1X) | Corning | 21-040-CV | Used for tissue washing |
| SAS Version 9.3 | SAS Institute | 9.3 TS1M2 | Statistical analysis software |
| Thomas Stadie-Riggs Tissue Slicer | Thomas Scientific | 6727C10 | Tissue slicer for preperation of thin uniform sections of fresh tissue |
| Waymouth MB 752/1 Medium | Sigma-Aldrich | W1625 | Medium used for tissue cultures |
Ссылки
- Braw-Tal, R., Yossefi, S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. Journal of Reproduction and Fertility. 109, 165-171 (1997).
- Nilsson anEdson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Fortune, J. E., Cushman, R. A., Wahl, C. M., Kito, S. The primordial to primary follicle transition. Molecular and Cellular Endocrinology. 163, 53-60 (2000).
- Ireland, J. J. Control of follicular growth and development. Journal of Reproduction and Fertility. 34, 39-54 (1987).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Ramezani, M., Salehnia, M., Jafarabadi, M. Short term culture of vitrified human ovarian cortical tissue to assess the cryopreservation outcome: molecular and morphological analysis. Journal of Reproduction & Infertility. 18 (1), 162-171 (2017).
- McLaughlin, M., Telfer, E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Stefansdottir, A., Fowler, P. A., Powles-Glover, N., Anderson, R. A., Spears, N. Use of ovary culture techniques in reproductive toxicology. Reproductive Toxicology. 49, 117-135 (2014).
- Bromfield, J. J., Sheldon, I. M. Lipopolysaccharide reduces the primordial follicle pool in the bovine ovarian cortex ex vivo and in the murine ovary in vivo. Biology of Reproduction. 88 (4), 1-9 (2013).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Humane Reproduction Update. 14 (4), 367-378 (2008).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicological Sciences. 90 (2), 500-509 (2006).
- Bott, R. C., McFee, R. M., Clopton, D. T., Toombs, C., Cupp, A. S. Vascular endothelial growth factor and kinase domain region receptor are involved in both seminiferous cord formation and vascular development during testis morphogenesis in the rat. Biology of Reproduction. 75, 56-67 (2006).
- Baltes-Breitwisch, M. M., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms or administration of proangiogenic isoforms stimulates vascular development in the rat testis. Reproduction. 140 (2), 319-329 (2010).
- McFee, R. M., et al. Inhibition of vascular endothelial growth factor receptor signal transduction blocks follicle progression but does not necessarily disrupt vascular development in perinatal rat ovaries. Biology of Reproduction. 81, 966-977 (2009).
- Artac, R. A., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms is more effective than treatment with proangiogenic isoforms in stimulating vascular development and follicle progression in the perinatal rat ovary. Biology of Reproduction. 81, 978-988 (2009).
- Abedal-Majed, M. A., et al. Vascular endothelial growth factor A isoforms modulate follicle development in peripbertal heifers independent of diet through diverse signal transduction pathways. Biology of Reproduction. 102 (3), 680-692 (2020).
- Wandji, S. A., Srsen, V., Voss, A. K., Eppig, J. J., Fortune, J. E. Initiation in vitro of bovine primordial follicles. Biology of Reproduction. 55, 942-948 (1996).
- Wandji, S. A., Srsen, V., Nathanielsz, P. W., Eppig, J. J., Fortune, J. E. Initiation of growth of baboon primordial follicles in vitro. Human Reproduction. 12 (9), 1993-2001 (1993).
- Yang, M. Y., Fortune, J. E. Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75, 924-932 (2006).
- Fortune, J. E., Kito, S., Wandji, S. A., Srsen, V. Activation of bovine and baboon primordial follicles in vitro. Theriogenology. 49, 441-449 (1998).
- Yang, M. Y., Fortune, J. E. Vascular endothelial growth factor stimulates the primary to secondary follicle transition in bovine follicles in vitro. Molecular Reproduction and Development. 74, 1095-1104 (2007).
- Barberino, R. S., Silva, J. R. V., Figueiredo, J. R., Matos, M. H. T. Transport of domestic and wild animal ovaries: a review of the effects of medium, temperature, and periods of storage on follicular viability. Biopreservation and Biobanking. 17 (1), 84-90 (2019).
- Summers, A. F., et al. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess. PLoS One. 9 (10), e110683 (2014).
- Koal, T., Schmiederer, D., Pham-Tuan, H., Rohring, C., Rauh, M. Standardized LC-MS/MS based steroid hormone profile analysis. The Journal of Steroid Biochemistry and Molecular Biology. 129, 129-138 (2012).
- Poole, R. K., Brown, A. R., Pore, M. H., Pickworth, C. L., Poole, D. H. Effects of endophyte-infected tall fescue seed and protein supplementation on stocker steers: II. Adaptive and innate immune function. Journal of Animal Science. 97 (10), 4160-4170 (2019).
- Laronda, M., et al. Alginate encapsulation supports the growth and differentiation of human primordial follicles within ovarian cortical tissue. Journal of Assisted Reproduction and Genetics. 31 (8), 1013-1028 (2014).
- Silber, S. J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23 (7), 1531-1537 (2008).
- Wiedemann, C., Zahmel, J., Jewgenow, K. Short-term culture of ovarian cortex pieces to assess the cryopreservation outcome in wild fields for genome conservation. BMC Veterinary Research. 9 (37), (2013).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354 (3), 869-880 (2013).
- Shimizu, T., Miyamoto, A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk-1, its receptor, in bovine granulosa cells. Animal Reproduction Science. 102 (3-4), 228-237 (2007).
- Tepekoy, F., Akkoyunlu, G. The effect of FSH and activin A on Akt and MAPK1/3 phosphorylation in cultured bovine ovarian cortical strips. Journal of Ovarian Research. 9 (13), 1-9 (2016).
- Beck, K., Singh, J., Arshud Dar, M., Anzar, M. Short-term culture of adult bovine ovarian tissues: chorioallantoic membrane (CAM) vs. traditional in vitro culture systems. Reproductive Biology and Endocrinology. 16 (1), 21 (2018).
- Eppig, J. J. Oocyte control of ovarian follicular development and function in mammals. Reproduction. 122 (6), 829-838 (2001).
- Paczkowski, M., Silva, E., Schoolcraft, W. B., Krisher, R. L. Comparative importance of fatty acid beta-oxidation to nuclear maturation, gene expression, and glucose metabolism in mouse, bovine, and porcine cumulus oocyte complexes. Biology of Reproduction. 88 (5), 1-11 (2013).
- Raffel, N., et al. Is ovarian tissue transport at supra-zero temperatures compared to body temperature optimal for follicle survival?. In Vivo. 34 (2), 533-541 (2020).
- Duncan, F., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction (Cambridge, England). 152 (6), R201-R210 (2016).
- Liebenthron, J., et al. Overnight ovarian tissue transportation for centralized cryobanking: a feasible option. Reproductive BioMedicine Online. 38 (5), 740-749 (2019).
- Mohammed, B. T., Donadeu, F. X. Bovine granulosa cell culture. Epithelial Cell Culture: Methods and Protocols. , 79-87 (2018).
- Langbeen, A., et al. Effects of neutral red assisted viability assessment on the cryotolerance of isolated bovine preantral follicles. Journal of Assisted Reproduction Genetics. 31, 1727-1736 (2014).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Yang, M. Y., Fortune, J. E. Changes in the transcriptome of bovine ovarian cortex during follicle activation in vitro. Physiological Genomics. 47, 600-611 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены