A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تحديد الحجم والتحليل الظاهري للحويصلات البولية خارج الخلية باستخدام قياس التدفق الخلوي
In This Article
Summary
يصف هذا البروتوكول طريقة لعزل الحويصلات البولية خارج الخلية ، uEVs ، عن المتبرعين البشريين الأصحاء وتوصيفها الظاهري من خلال التعبير عن الحجم وعلامة السطح باستخدام قياس التدفق الخلوي.
Abstract
الحويصلات خارج الخلية ، EVs ، هي مركب غير متجانس من الأغشية الدهنية ، يفرزها أي نوع من الخلايا ، في أي سائل مثل البول. يمكن أن تكون المركبات الكهربائية بأحجام مختلفة تتراوح من 40-100 نانومتر في القطر كما هو الحال في الإكسوسومات إلى 100-1000 نانومتر في الحويصلات الدقيقة. يمكن أن تحتوي أيضا على جزيئات مختلفة يمكن استخدامها كمؤشرات حيوية لتشخيص وتشخيص العديد من الأمراض. تم تطوير العديد من التقنيات لتوصيف هذه الحويصلات. واحد من هؤلاء هو قياس التدفق الخلوي. ومع ذلك ، لا توجد تقارير حالية لإظهار كيفية تحديد تركيز المركبات الكهربائية وتمييزها حسب الحجم ، جنبا إلى جنب مع اكتشاف المؤشرات الحيوية. يهدف هذا العمل إلى وصف إجراء لعزل الحويصلات البولية خارج الخلية ، uEVs ، وتقديرها الكمي والتنميط الظاهري ، باستخدام مقياس خلوي تقليدي للتحليل دون أي تعديل على تكوينه. تشمل قيود الطريقة تلطيخ أربعة مؤشرات حيوية مختلفة كحد أقصى لكل عينة. الطريقة محدودة أيضا بكمية المركبات الكهربائية المتوفرة في العينة. على الرغم من هذه القيود ، من خلال هذا البروتوكول وتحليله اللاحق ، يمكننا الحصول على مزيد من المعلومات حول إثراء علامات المركبات الكهربائية ووفرة هذه الحويصلات الموجودة في عينات البول ، في الأمراض التي تنطوي على تلف الكلى والدماغ.
Introduction
في الثدييات ، يتم ترشيح الدم عن طريق المرور عبر الكلى 250-300 مرة ؛ خلال هذا الوقت ، يتشكل البول. إنتاج هذا السائل الحيوي هو نتيجة لسلسلة من العمليات ، بما في ذلك الترشيح الكبيبي ، وإعادة الامتصاص الأنبوبي ، والإفراز. تعتبر النفايات الأيضية والإلكتروليتات هي المكونات الرئيسية للبول. أيضا ، يتم إفراز المنتجات الثانوية الأخرى مثل الببتيدات والبروتينات الوظيفية والحويصلات خارج الخلية (EVs)1،2،3،4،5،6. في البداية ، تم تحديد حويصلات بولية خارج الخلية (uEVs) في عينات البول من المرضى الذين يعانون من اضطرابات توازن الماء. أظهر هؤلاء المرضى وجود جزيئات مثل أكوابورين -2 (AQP2) ، والتي تم استخدامها بعد ذلك كمؤشر حيوي لهذاالمرض 7. ركزت العديد من الدراسات اللاحقة على تحديد الأصل الخلوي ل uEVs ، واصفة أن هذه الهياكل يمكن إفرازها بواسطة خلايا الكلى (الكبيبات ، الخلايا البودوية ، إلخ) وأنواع الخلايا الأخرى من السلالات البطانية أو الكريات البيض. علاوة على ذلك ، يمكن أن يرتبط عدد وتخصيب الجزيئات في uEVs بحالة العديد من الأمراض والاضطرابات8،9،10،11،12،13،14.
إجمالا ، تشكل المركبات الكهربائية عائلة غير متجانسة للغاية من الجسيمات المحاطة بطبقات ثنائية الدهون وتطلقها الخلايا من خلال آليات سلبية أو نشطة في سوائل مختلفة. اعتمادا على أصلها ، يمكن تصنيف المركبات الكهربائية على أنها إكسوسومات داخلية أو حويصلات دقيقة / جزيئات دقيقة مشتقة من غشاء البلازما. ومع ذلك ، لا يمكن تطبيق معيار التصنيف هذا إلا عند ملاحظة التكوين الحيوي للجسيمات مباشرة. لذلك ، تم اعتماد معايير أخرى غير تافهة ، بما في ذلك الأصل الفيزيائي والكيميائي الحيوي والخلوي ، من قبل العديد من الباحثين في هذا المجال15،16،17. اعتمادا على طبيعة العزلة التي تم تحليلها ، تم اقتراح تقنيات تحليلية مختلفة لتوصيف المركبات الكهربائية. على سبيل المثال ، بناء على تخصيب المركبات الكهربائية الكبيرة (≥100 نانومتر) أو الصغيرة (≤100 نانومتر) ، يقترح القياس الكمي عن طريق قياس التدفق الخلوي أو تتبع الجسيمات النانوية ، على التوالي18.
في الوقت الحاضر ، أصبح استخدام المركبات الكهربائية كمؤشرات حيوية للعديد من الأمراض ذا صلة ، لذلك تم التحقيق في البحث عن مصادر مختلفة. يعد البول من أكثر المصادر الواعدة حيث يمكن الحصول عليه بطريقة سهلة وغير جراحية. لذلك ، يصف هذا البروتوكول إجراء لعزل uEVs عن طريق الطرد المركزي التفاضلي ، والمعالجة بالأجسام المضادة المترافقة بالفلوروكروم ، والتحليل النهائي باستخدام مقياس خلوي تقليدي ثنائي الليزر / 4 ألوان.
Access restricted. Please log in or start a trial to view this content.
Protocol
تم الحصول على عينات البول البشرية من متطوعين أصحاء وقعوا على موافقة المتبرع المستنير. تمت الموافقة على هذه الإجراءات أيضا من قبل المعهد الوطني للعلوم الطبية والتغذية في سلفادور زوبيران لجنة أخلاقيات البحث.
1. عزل الحويصلات البولية خارج الخلية
ملاحظة: تم تعديل بروتوكول العزل الخاص ب uEVs من المرجع 19. يوضح الشكل 1 تمثيل البروتوكول لعزل uEVs.
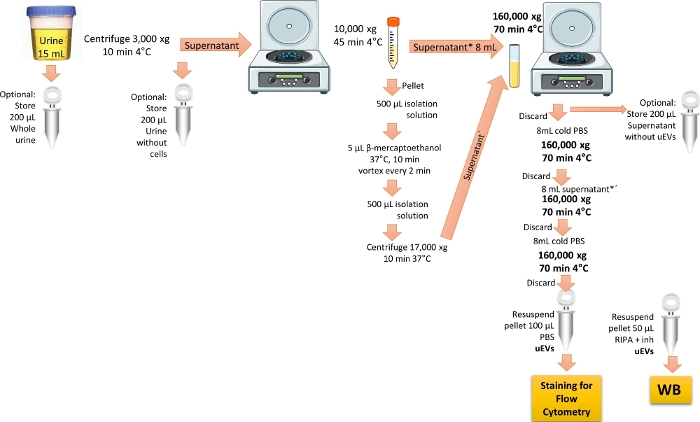
الشكل 1: نظرة عامة على عزل uEVs لتحليل قياس التدفق الخلوي. في هذا البروتوكول ، قم أولا بالطرد المركزي أول بول في اليوم لإزالة الخلايا والحطام. ثم جهاز الطرد المركزي لإزالة الحويصلات الكبيرة مع المعالجة لإزالة بروتين THP وأخيرا إجراء الطرد المركزي الفائق لإثراء والحصول على uEVs بغسل واحد. يتم وضع علامة على خطوات الحفاظ على كسور البول للتحقق من صحة WB. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- استخدم بول الصباح الأول (15 مل) من المتطوعين الأصحاء. قم بالطرد المركزي للبول عند 3,000 × جم لمدة 10 دقائق عند 4 درجات مئوية ، لإزالة جميع الخلايا والحطام.
ملاحظة: تفضيل استخدام البول الطازج. إذا لم يكن متاحا ، استخدم البول المخزن لمدة أقصاها 3 أشهر عند -20 درجة مئوية ، أو مخزن لمدة أقصاها 6 أشهر عند -70 درجة مئوية. قم بإذابة عينة البول على الجليد وقم بدوامها بقوة. قم بتنفيذ جميع الإجراءات على الجليد أو عند 4 درجات مئوية. تتمثل الخطوة الاختيارية لتحليل اللطخة الغربية في عمل أنبوب مكرر وكمية 200 ميكرولتر من بول الصباح الأول في أنبوب منفصل. قم بتخزين العينة عند -20 درجة مئوية حتى الاستخدام ، مع تصنيفها على أنها "بول كامل" ، للتحقق من علامات الحويصلة خارج الخلية. - انقل المادة الطافية التي تم الحصول عليها في الخطوة 1.1 إلى أنبوب طرد مركزي مخروطي جديد سعة 15 مل ، ثم جهاز طرد مركزي عند 10,000 × جم لمدة 45 دقيقة عند 4 درجات مئوية. انقل المادة الطافية إلى أنبوب طرد مركزي فائق سعة 8 مل من البولي كربونات واحتفظ به على الجليد.
ملاحظة: اختياريا ، تناول 200 ميكرولتر من المادة الطافية التي تم الحصول عليها في الخطوة 1.1 في أنبوب منفصل يسمى "بول بدون خلايا" لتحليل اللطخة الغربية.- إزالة بروتين Tamm-Horsfall ، THP
ملاحظة: THP موجود في البول ويتم إثرائه عندما يكون الفرد مصابا بمرض كلى. تم الإبلاغ عن أن THP يقلل من عائد uEVs لأنه يمكن أن يرتبط ب uEVs. لإزالة هذا البروتين ، يعد استخدام عامل اختزال ضروريا3،6.- تحضير محلول العزل عن طريق خلط 250 ملي من السكروز مع 10 ملي مولار ثلاثي إيثانولامين. اضبط الرقم الهيدروجيني على 7.6.
- امزج الحبيبات التي تم الحصول عليها في الخطوة 1.2 مع 500 ميكرولتر من محلول العزل ، ثم أضف 5 ميكرولتر من β-mercaptoethanol.
- احتضان مزيج الحبيبات عند 37 درجة مئوية لمدة 10 دقائق ، مع الدوران كل دقيقتين. أضف 500 ميكرولتر من محلول العزل ثم جهاز الطرد المركزي عند 17,000 × جم لمدة 10 دقائق عند 37 درجة مئوية. اجمع المادة الطافية التي تم الحصول عليها (التي تحتوي على THP غير المجمعة بالإضافة إلى uEVs).
- إزالة بروتين Tamm-Horsfall ، THP
- امزج كل من المواد الطافية المحجوزة (من الخطوتين 1.2 و 1.2.1.3) في نفس أنبوب الطرد المركزي الفائق من البولي كربونات سعة 8 مل ، ثم جهاز الطرد المركزي عند 160،000 × جم لمدة 70 دقيقة عند 4 درجات مئوية ، باستخدام دوار فائق الطرد المركزي بزاوية ثابتة.
ملاحظة: اختياريا ، لتحليل اللطخة الغربية ، قم بتخزين 200 ميكرولتر من المادة الطافية التي تم الحصول عليها أعلاه مع تصنيفها على أنها "طافية بدون مركبات كهربائية". ستكون هذه العينة بمثابة عنصر تحكم سلبي عند البحث عن علامات الحويصلة خارج الخلية. - تخلص من المادة الطافية. أضف 1x PBS المثلج إلى أنبوب البولي كربونات سعة 8 مل وجهاز الطرد المركزي عند 160,000 × جم لمدة 70 دقيقة عند 4 درجات مئوية.
ملاحظة: احرص على عدم التخلص من الحبيبات ، لأنها تحتوي على uEVs. يحتاج 1x PBS إلى التعقيم والتصفية باستخدام مرشح حقنة مسام 0.22 ميكرومتر على الأقل. - تخلص من المادة الطافية. أضف باقي المادة الطافية إلى أنبوب البولي كربونات سعة 8 مل وجهاز الطرد المركزي عند 160,000 × جم لمدة 70 دقيقة عند 4 درجات مئوية.
- تخلص من المادة الطافية وأضف 8 مل من PBS المثلج إلى الحبيبات لغسل uEVs.
- تخلص من المادة الطافية. اترك الحبيبات تجف ثم أعد تعليقها ب 1 مل من PBS المثلج. يحفظ في درجة حرارة -70 درجة مئوية حتى الاستخدام.
ملاحظة: في حالة إجراء تحليل اللطخة الغربية ، قم بتعليق حبيبات الأنبوب المكرر باستخدام 50 ميكرولتر من المخزن المؤقت RIPA بالإضافة إلى مثبطات البروتياز. يحفظ في درجة حرارة -20 درجة مئوية حتى الاستخدام.
2. تلطيخ uEVs
ملاحظة: قبل تلطيخ وتحليل uEVs ، من الضروري تنفيذ منهجية واحدة على الأقل أوصت بها MISEV201818 للتحقق من العزل المناسب للمركبات المركبة السريعة ؛ هنا ، يتم تصوير تحليل اللطخة الغربية. يوضح الشكل 2 بروتوكولا تمثيليا لصبغة uEVs.
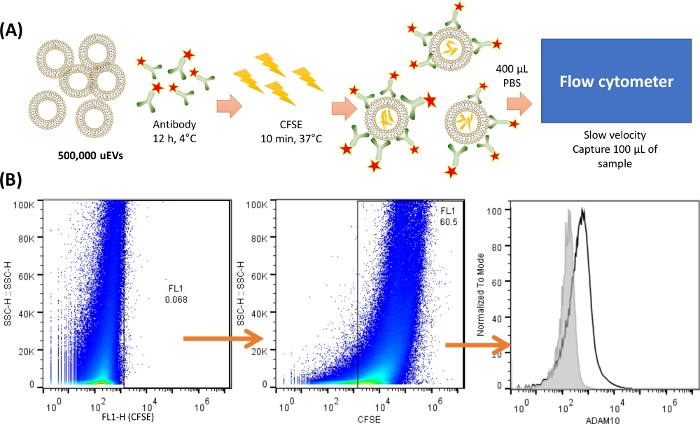
الشكل 2: نظرة عامة على تلطيخ uEVs والتقاطها في مقياس الخلويات. (أ) تمثيل تلطيخ uEV. بالنسبة ل 500,000 uEVs ، تم خلط الجسم المضاد واحتضانه عند 4 درجات مئوية لمدة 12 ساعة. ثم تمت إضافة CFSE واحتضانها عند 37 درجة مئوية لمدة 10 دقائق. كان لدى uEVs CFSE بالداخل ، وسوف يرتبط الجسم المضاد بسطح المستضد. تم استخدام 400 ميكرولتر من PBS البارد لإعادة تعليق والتقاط 100 ميكرولتر من العينة في مقياس التدفق الخلوي بسرعة بطيئة. (ب) استراتيجية التحليل. يصور المخطط النقطي الأول (SSC-H VS FL-X) التحكم السلبي ل uEVs ، متبوعا بالمخطط النقطي الذي يظهر تلطيخ uEVs ب CFSE ، وأخيرا ، رسم بياني مع تلطيخ الأجسام المضادة ل uEVs (الخط الأسود) ، يظهر التحكم السلبي في الخط الرمادي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- احسب العدد النسبي ل uEVs عن طريق تحديد محتوى البروتين باستخدام أي مقايسة بروتين لونية تقليدية ، كما هو مذكور في جدول المواد. قم بإجراء تخفيف بنسبة 1: 5 من uEVs واتبع تعليمات ورقة البيانات المتوفرة في مجموعة بروتين الفحص.
- استنادا إلى الصيغة20 التي تم الإبلاغ عنها سابقا ، ضع في اعتبارك أن 1 ميكروغرام / مل من بروتين uEVs يساوي 800,000 uEVs / ميكرولتر. تأكد من وجود 500,000 uEVs في 20 ميكرولتر من PBS المثلج.
- قم بتسمية الأنابيب ، كما هو موضح في الجدول 1.
ملاحظة: يعتمد عدد الأنابيب المستخدمة على عدد الأجسام المضادة المستخدمة ، والحد الأقصى لمقياس الخلايا 2-ليزر / 4 ألوان هو 4 أجسام مضادة كحد أقصى لكل أنبوب يمكن استخدامه. لذلك ، يمكن قراءة FL1 و FL2 و FL3 و FL4 فقط في مقياس الخلوي ، على الرغم من الحاجة إلى التعويض. في هذه الإجراءات ، استخدم أنابيب الطرد المركزي الدقيقة سعة 1.5 مل أو أنابيب مستديرة القاع سعة 5 مل لقياس التدفق الخلوي. يتم تصوير الأنابيب المطلوبة في الجدول 1. يتكون الأنبوبان 4 و 5 من مزيج من جميع الأجسام المضادة التي سيتم استخدامها في هذا البروتوكول. يتم إعطاء أنبوبين مشكلة (8 و 9) كمثال. لذلك ، يجب أن تحتوي هذه المجموعة من عناصر التحكم على المجموعة المراد استخدامها في كل أنبوب.
| أنبوب 1. | حبات Megamix FSC | |
| أنبوب 2. | برنامج تلفزيوني | |
| أنبوب 3. | برنامج تلفزيوني مع CFSE | |
| أنبوب 4. | PBS مع جميع الأجسام المضادة للمشكلة 1 | |
| أنبوب 5. | PBS مع جميع الأجسام المضادة للمشكلة 2 | |
| أنبوب 6. | التحكم في التألق الذاتي | uEVs بدون أي كاشف ، فقط في PBS. |
| أنبوب 7. | #uEVs | uEVs مع CFSE |
| أنبوب 8. | المشكلة 1 | وحدات uEV مع CD37 FITC و CD53 PE و ADAM10 APC |
| أنبوب 9. | المشكلة 2 | uEVs مع CD9 FITC ، TSPAN33 APC |
الجدول 1: وضع العلامات على الأنابيب. مثال يوضح كيفية تسمية الأنابيب. الأنابيب الأولى هي جميع عناصر التحكم المطلوبة. تعتمد الأنابيب التي تحتوي على الأجسام المضادة - الفلوروكروم على تلطيخها.
- أضف 20 ميكرولتر من PBS تحتوي على 500,000 uEVs إلى الأنابيب المسماة.
- أضف الأجسام المضادة كما هو موضح في الجدول 1 ، والتي تم معايرتها مسبقا. احتضان طوال الليل عند 4 درجات مئوية.
ملاحظة: قبل التلوين ، يوصى بالطرد المركزي للأجسام المضادة عند 4 درجات مئوية بأقصى سرعة لمدة 5 دقائق على الأقل ، لمنع الركام. الأجسام المضادة المستخدمة هنا هي مثال على البروتينات الموجودة في uEVs وتنتمي إلى مخطوطة مستقلة قيد الإعداد حاليا. - أضف 0.4 ميكرولتر من إستر الكربوكسي فلوريسين السكسينيميديل (CFSE) [5 نانومتر] إلى الأنبوب رقم 3. احتضن لمدة 10 دقائق عند 37 درجة مئوية.
ملاحظة: CFSE هي صبغة تستخدم لتلطيخ جميع المركبات الكهربائية الموجودة في العينة والتمييز بين ضوضاء الخلفية عند إجراء تحليل مقياس التدفق الخلوي. لمزيد من المعلومات، راجع قسم المناقشة . - أضف 400 ميكرولتر من 1x PBS المثلج إلى جميع الأنابيب.
- احتفظ بجميع الأنابيب عند 4 درجات مئوية.
3. الحصول على uEVs باستخدام مقياس الخلوي التقليدي
ملاحظة: تعليمات استخدام مقياس التدفق الخلوي (انظر جدول المواد) موصوفة هنا.
- قم بإجراء معايرة جودة مقياس الخلوي باستخدام حبات 6 و 8 ذروة.
ملاحظة: يجب أن تكون قيمة النسبة المئوية للذروة الأخيرة أقل من 6 ؛ سيهتم فني مقياس الخلوي بهذا. - افتح برنامج مقياس التدفق الخلوي.
ملاحظة: بمجرد فتح البرنامج ، سيتم فتح تجربة جديدة ، تعرض عرضا يحتوي على قالب ل 96 عينة ، ومعلمات التشغيل ، وقسم "فارغ" لإنشاء مخططات نقطية أو مخططات بيانية. - اضبط المعلمات على شاشة البرنامج قيد التشغيل: 100 ميكرولتر من العينة لالتقاطها ، والتشغيل البطيء ، وتعيين العتبة عند 10,000 على FSC-H ، و 2,000 على SSC-H.
ملاحظة: العتبة الموصى بها هنا هي مثال؛ مطلوب تعيين الحد بناء على العينات التي تم تحليلها. - أنبوب التحميل رقم 1 (أنبوب Megamix) ، كما هو موضح في الجدول 1. التقط الخرز. قم بإنشاء مخططين نقطيين في الجزء "الفارغ" من شاشة البرنامج بالنقر فوق خيار Dot Plot . قم بالإنشاء كلوحة A و B من الشكل 3.
ملاحظة: يمكن تحليل حبات الفلورسنت Megamix (الخرز المستخدم لتحديد أحجام 0.1 و 0.3 و 0.5 و 0.9 ميكرومتر وإنشاء قالب للأحجام) ، باستخدام كاشف FL1 (FITC). يجب عرض جميع المخططات النقطية والرسوم البيانية في قيم الارتفاع. سجل أكبر عدد ممكن من الأحداث ؛ أي تعديل في ورقة العمل لا يغير البيانات.
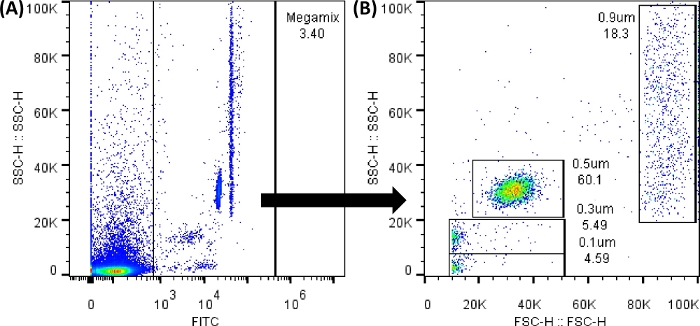
الشكل 3: مخططات نقطية من حبات Megamix FSC. تم إنشاء المخططات النقطية المعروضة باستخدام برنامج مقياس التدفق الخلوي. في مقياس التدفق الخلوي ، ستكون الصورة متشابهة جدا. (أ) مخطط النقطة الأول الذي تم إنشاؤه لتحديد الخرز لتجنب ضوضاء الخلفية. (SSC-H مقابل FL1-H). (ب) المخطط النقطي الذي تم إنشاؤه عن طريق اختيار البوابة السابقة ، والذي يوضح الأحجام المختلفة للخرز. (SSC-H مقابل FSC-H). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- في القسم "الفارغ" من شاشة البرنامج ، قم بإنشاء مخطط نقطي ورسم بياني لكل فلوروكروم مستخدم ؛ استخدم الخوارزمية في الشكل التكميلي 1 كمثال. للقيام بذلك ، انقر فوق خيار Dot Plot أو Histogram لكل فلوروكروم.
ملاحظة: ستكون ضوضاء الخلفية موجودة دائما، كما هو موضح في الشكل 3 أ. جميع النقاط بين 0 إلى 1,000 من FL1 (المحور السيني) خارج البوابة التي تم إنشاؤها. لذلك ، من الضروري استخدام جميع أنابيب التحكم للحصول على نتائج مناسبة. بين كل تحميل أنبوب ، قم بتنظيف سائل الغمد وقم بإجراء دورة فك انسداد. رج كل أنبوب برفق قبل التحميل. بعد تحميل خمسة أنابيب متتالية ، قم بتشغيل 100 ميكرولتر من PBS 1x. - قم بتحميل الأنابيب رقم 2 و 5 ، لضبط قيم القطع (سالبة). للقيام بذلك ، حدد أيقونة بوابة المستطيلة (الموجودة أسفل مخطط النقطة التي تم إنشاؤها) ، أو رمز بوابة الخط (الموجود أسفل الرسم البياني الذي تم إنشاؤه) ؛ ووضعه في مكان عدم وجود إشارة ، من أجل الحصول على مخططات نقطية ورسوم بيانية مثل تلك الموضحة في الشكل التكميلي 1.
ملاحظة: تتطلب كل هذه الأنابيب وضع المنطقة الموجبة بما لا يزيد عن 0.70٪ لأنه لن يكون هناك "تألق" أكثر من 103 (1,500). إذا كان هناك أي مضان أبعد من هذه المنطقة ، فقم بتخفيف الكواشف المستخدمة. لذلك ، من المهم معايرة الكواشف قبل القياسات النهائية. - قم بتحميل الأنبوب رقم 6 (أنبوب التألق الذاتي) ، لضبط المناطق السالبة للعينة. للقيام بذلك ، حدد أيقونة بوابة المستطيلة (الموجودة أسفل مخطط النقطة التي تم إنشاؤها) ، أو رمز بوابة الخط (الموجود أسفل الرسم البياني الذي تم إنشاؤه) ؛ ضعه في مكان عدم وجود إشارة.
- قم بتحميل الأنابيب التالية (الأنابيب من 7 إلى 9 ، الموضحة في الجدول 1).
- احفظ التجربة.
ملاحظة: بالنسبة لبرنامج مقياس الخلايا المستخدم هنا، يشير الأمر Save Experiment إلى حفظ البيانات التي تم إنشاؤها. بمعنى آخر ، يجب حفظ جميع الأنابيب التي يتم الحصول عليها بواسطة مقياس التدفق الخلوي ، والبيانات التي تم إنشاؤها لكل أنبوب. للقيام بذلك ، من الضروري النقر فوق الزر "حفظ التجربة ". - تصدير البيانات كملفات FSC.
4. تحليل البيانات باستخدام برنامج مقياس التدفق الخلوي.
ملاحظة: تعليمات استخدام برنامج مقياس التدفق الخلوي الموضحة في جدول المواد موصوفة في هذا القسم. يوضح الشكل 4 مساحة العمل مع خطوات إنشاء بوابات الحجم.
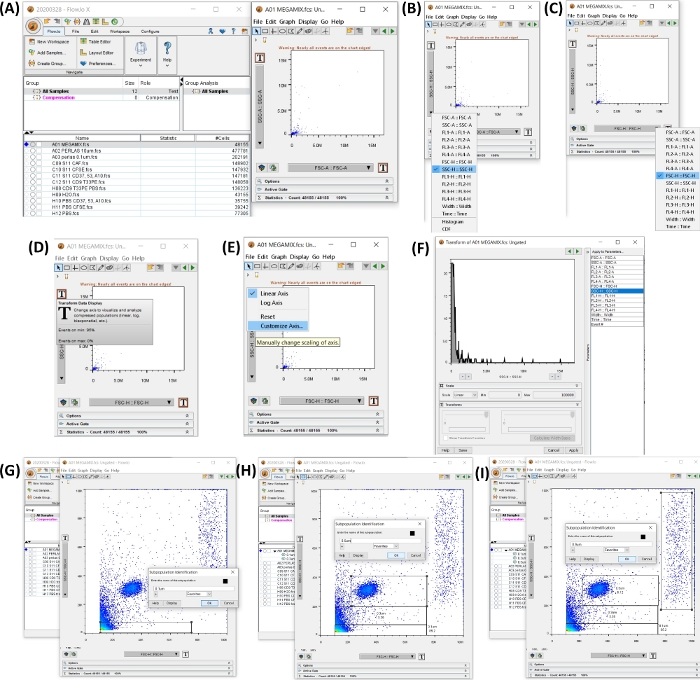
الشكل 4: مساحة العمل مع جميع الخطوات لبدء تحليل البيانات. تم إنشاء جميع الصور عن طريق طباعة الشاشة لمساحة العمل. (أ) مساحة العمل التي تم إنشاؤها مع إضافة بيانات العينة (على اليسار) ، مخطط النقطة الذي تم إنشاؤه عن طريق اختيار الأنبوب 1 ، حبات FSC ، (يمين). (B ، C) يظهر تعديل المحور ، ليكون SSC-H و FSC-H. (D-F) إظهار التخصيص خطوة بخطوة لكلا المحورين. (G-I) تظهر اختيار وتوليد أحجام الخرز المختلفة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- افتح برنامج مقياس التدفق الخلوي. أضف العينات ، بالنقر فوق الزر "إضافة عينات " ، وحدد ملفات FCS التي تم تصديرها.
- انقر فوق أنبوب Megamix لفتح مخطط نقطي SSC-H (المحور y) مقابل FSC-H (المحور x). اضبط كلا المحورين لعرض 0 إلى 100,000 بالنقر فوق الزر T (تحويل عرض البيانات) ، وانقر فوق تخصيص المحور ، وانقر فوق SSC-H أو FSSC-H وقم بتغيير قيمة المقياس إلى الحد الأدنى 0 والحد الأقصى 100,000 (انظر الشكل 4A-F).
- اضبط البوابات على 0.1 و 0.3 و 0.5 و 0.9 ميكرومتر ، في المخطط النقطي الذي تم إنشاؤه في الخطوة 4.2. حدد الزر Rectangle Gate لإنشاء بوابة كما هو موضح في الشكل 4G-I.
ملاحظة: يوضح الشكل 5 مساحة العمل مع خطوات إنشاء المناطق الموجبة ، والحصول على متوسط الشدة للفلوروكروم.

الشكل 5: مساحة عمل لتحليل البيانات التي تم الحصول عليها. تم إنشاء جميع الصور عن طريق طباعة الشاشة لمساحة العمل. (أ) مساحة العمل التي تم إنشاؤها باستخدام بوابة الحجم المطبقة على جميع العينات. (ب) تم تحديد أنبوب التألق الذاتي ، ومخطط نقطي يوضح بوابة الحجم ، والرسم البياني لحجم واحد محدد (0.1 ميكرومتر) ، استخدم هذا الرسم البياني للحصول على البوابة الموجبة لكل فلوروكروم وحجم. (ج) مساحة العمل التي تم إنشاؤها باستخدام البوابات الموجبة لكل فلوروكروم وحجمه. (د) مساحة العمل (يسار) ومحرر التخطيط (يمين) اللذين تم إنشاؤهما للنماذج. في محرر التخطيط ، يظهر الرسم البياني لأنبوب التألق الذاتي والأنبوب الموجب ل FL1-H ، وكيفية الحصول على لوحة الخصائص لتعديلها. (ه) توضح الصورة كيفية الحصول على متوسط قيمة مضان الشدة. (و) الرسوم البيانية التي تم إنشاؤها لثلاثة فلوروكروم مختلفة، تبين جميع التغييرات التي يسمح البرنامج بالقيام بها مع المعلومات الإحصائية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- قم بتطبيق البوابات التي تم إنشاؤها (0.1 و 0.3 و 0.5 و 0.9 ميكرومتر) على جميع العينات. حدد البوابات، اسحب وأفلت في خيار جميع العينات ، كما هو موضح في الشكل 5 أ.
- انقر فوق أنبوب التألق الذاتي. قم بتعيين المناطق الموجبة لكل فلوروكروم لكل حجم. افتح المخطط النقطي SSC-H VS FSC-H باستخدام بوابات الحجم ، وانقر فوق حجم البوابة الواحدة. في النافذة الجديدة ، انقر فوق المحور y لتحديد خيار الرسم البياني. في المحور x، حدد FL1-H، ثم حدد أيقونة النطاق لإنشاء المنطقة الموجبة. كرر العملية ل FL2-H و FL4-H (انظر الشكل 5 ب).
- قم بتطبيق البوابات على جميع العينات. حدد البوابات ، واسحب وأفلت في خيار جميع العينات ، كما هو موضح في الشكل 5C.
- افتح محرر التخطيط.
- قم بسحب وإفلات كل عينة في المحرر. حدد حجم أنبوب "التألق الذاتي" ، واسحب وأفلت ، ثم حدد نفس حجم الأنبوب الملون ، واسحب ، وإسقط.
- انقر فوق الجزء السفلي الأيمن من الرسم البياني. افتح قائمة خصائص . انقر فوق وسيلة الإيضاح. أضف متوسط شدة الفلوروكروم.
ملاحظة: في الخصائص ، هناك أدوات أخرى متوفرة لتعديل مظهر الرسم البياني. - كرر نفس الإجراء مع الفلوروكروم والأحجام المتبقية.
5. التحليل للحصول على عدد uEVs لكل عينة.
ملاحظة: يوضح الشكل 6 مساحة العمل مع خطوات الحصول على عدد uEVs لكل عينة.
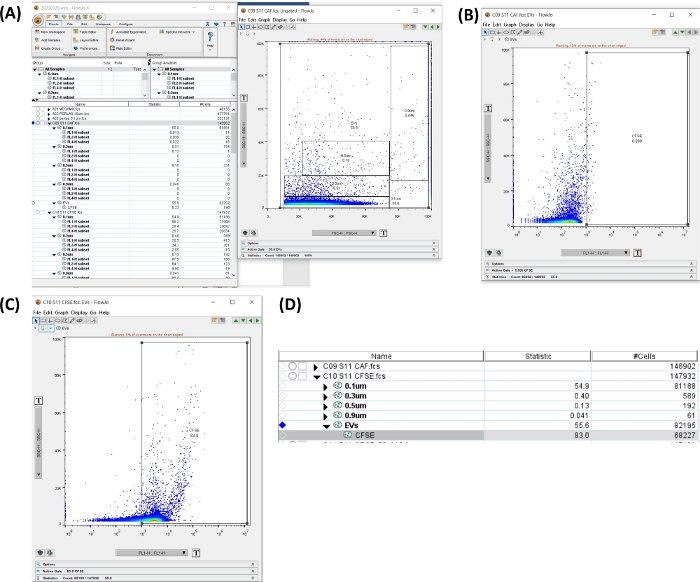
الشكل 6: مساحة عمل لتحليل أنبوب CFSE. تم إنشاء جميع الصور عن طريق طباعة الشاشة لمساحة العمل. (أ) مساحة العمل التي تم إنشاؤها عن طريق تحديد منطقة جميع الأحجام ، إجمالي uEVs (يسار) ، مخطط نقطة يوضح البوابة المحددة (يمين). (ب) مخطط نقطي SSC-H مقابل FL1-H للمنطقة السلبية CFSE في أنبوب التألق الذاتي. (ج) مؤامرة نقطة SSC-H مقابل FL1-H ل CFSE في أنبوب التلوين. (د) صورة للجدول تم الحصول عليها مع إحصائيات تلطيخ CFSE ، توضح عدد uEVs في العينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
- انقر فوق أنبوب التألق الذاتي. في المخطط النقطي SSC-H VS FSC-H مع بوابات الحجم ، قم بإنشاء منطقة تتضمن جميع الأحجام. انقر فوق منطقة جديدة. اضبط المنطقة الموجبة (انظر الشكل 6أ ، ب).
- قم بتطبيق البوابات على جميع العينات. حدد البوابات واسحب وأفلت في خيار جميع العينات .
- انقر فوق أنبوب CFSE + uEVs. افتح المنطقة الجديدة وتحقق من المنطقة الموجبة ل CFSE (FL1-H) ، كما هو موضح في الشكل 6C.
- في مساحة العمل في الشكل 6 د، انسخ بيانات الخلايا # للأنبوب. هذا الرقم هو #uEVs التي يتم الحصول عليها عن طريق قياس التدفق الخلوي (#uEVs FC).
- قم بتطبيق الصيغة التالية لحساب عدد uEVs لكل ميكرولتر:
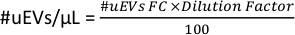
- للحصول على #uEVs لكل ميكرولتر لكل فلوروكروم (#uEVs/ميكرولتر FLX) ، في مساحة العمل ، انسخ إحصائيات المجموعة الفرعية FLX-H ، هذا الرقم هو النسبة المئوية (٪ مجموعة فرعية FLX).
- قم بتطبيق الصيغة التالية لحساب عدد uEVs لكل ميكرولتر لكل فلوروكروم.
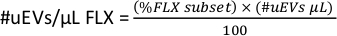
ملاحظة: بناء على ما إذا كانت البوابة المحددة ستكون لحجم واحد أو لجميع uEVs، تحقق من البيانات المحددة.
Access restricted. Please log in or start a trial to view this content.
النتائج
هناك العديد من نقاط التفتيش من خلال البروتوكول ، وقبل تلطيخ uEVs. لذلك ، من الضروري أولا التحقق من كمية البروتين الموجودة في مستخلص uEVs. تقوم جميع مجموعات البحث التي تعمل مع الحويصلات خارج الخلية بتحديد كمية البروتين ، كما هو موضح في الخطوة 2.1. يوضح الشكل التكميلي 2 ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
في الوقت الحاضر ، زاد استخدام الحويصلات خارج الخلية كمؤشرات حيوية للعديد من الأمراض ، خاصة بالنسبة لتلك التي يمكن عزلها من مصادر غير جراحية مثل البول5،21،22،23،24. لقد ثبت أن عزل uEVs هو ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
ويعلن المؤلفون أن البحث أجري في غياب أي علاقة مالية أو تجارية يمكن تفسيرها على أنها تضارب محتمل في المصالح.
Acknowledgements
ودعم هذا العمل بمنح من المجلس الوطني للاتصالات وتكنولوجيا المعلومات (A3-S-36875) وبرنامج إدارة الشؤون الاجتماعية والمساعدة في شؤون اللاجئين (IN213020 و IA202318). تم دعم NH-I من قبل الزمالة 587790 من CONACyT.
يريد المؤلفون أن يشكروا ليوبولدو فلوريس رومو † وفياني أورتيز نافاريت وأنتوني بوكارد جونيور وديانا غوميز مارتن على نصائحهم القيمة لتحقيق هذا البروتوكول ، ولجميع الأفراد الأصحاء لعينات البول الخاصة بهم.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| APC anti human CD156c (ADAM10) antibody | BioLegend | 352706 | Add 5 µL to the 20 µL of uEVs in PBS |
| APC anti human TSPAN33 (BAAM) antibody | BioLegend | 395406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Avanti centrifuge with JA-25.5O fixed angle rotor | Beckamn Coulter | J-26S XPI | |
| BD Accuri C6 Flow Cytometer | BD Biosciences | ||
| β-mercaptoethanol | SIGMA-Aldrich | M3148 | |
| Benchtop centrifuge with A-4-44 rotor | Eppendorf | 5804 | |
| BLUEstain 2 protein ladder | GOLDBIO | P008 | |
| CD9 (C-4) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-13118 | |
| CD63 (MX-49.129.5) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-5275 | |
| Cell Trace CFSE cell proliferation kit for flow cytometry | Thermo Scientific | C34554 | |
| Chemidoc XRS+ system | BIORAD | 5837 | |
| FITC anti human CD9 antibody | BioLegend | 312104 | Add 5 µL to the 20 µL of uEVs in PBS |
| FITC anti human CD37 antibody | BioLegend | 356304 | Add 5 µL to the 20 µL of uEVs in PBS |
| Fluorescent yellow particles | Spherotech | FP-0252-2 | |
| Fluorescent yellow particles | Spherotech | FP-0552-2 | |
| Fluorescent yellow particles | Spherotech | FP-1552-2 | |
| FlowJo Software | Becton, Dickinson and Company | ||
| Goat anti-mouse immunoglobulins/HRP | Dako | P0447 | |
| Halt protease inhibitor cocktail | Thermo Scientific | 78429 | |
| Immun-Blot PVDF membrane 0.22µm | BIORAD | 1620177 | |
| Megamix-Plus FSC beads | COSMO BIO CO.LTD | 7802 | |
| NuPAGE LDS sample buffer 4X | Thermo Scientific | NP0007 | |
| Optima ultracentrifuge with rotor 90Ti fixed angle 355530 | Beckamn Coulter | XPN100 | |
| Page Blue protein staining solution | Thermo Scientific | 24620 | |
| PE anti human CD53 antibody | BioLegend | 325406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Pierce BCA Protein assay kit | Thermo Scientific | 23227 | |
| Pierce RIPA buffer | Thermo Scientific | 89900 | |
| Polycarbonate thick wall centrifuge tubes | Beckamn Coulter | 355630 | |
| Spherotech 8-Peak validation beads (FL1-FL3) | BD Accuri | 653144 | |
| Spherotech 6-Peak validation beads (FL4) | BD Accuri | 653145 | |
| Sucrose | SIGMA-Aldrich | 59378 | |
| Triethanolamine | SIGMA-Aldrich | 90279 |
References
- Decramer, S., et al. Urine in clinical proteomics. Molecular & Cellular Proteomics. 7 (10), 1850-1862 (2008).
- Nawaz, M., et al. The emerging role of extracellular vesicles as biomarkers for urogenital cancers. Nature Reviews Urology. 11 (12), 688-701 (2014).
- Pisitkun, T., Johnstone, R., Knepper, M. A. Discovery of urinary biomarkers. Molecular & Cellular Proteomics. 5 (10), 1760-1771 (2006).
- Urinology Think Tank Writing Group. Urine: Waste product or biologically active tissue. Neurourology and Urodynamics. 37 (3), 1162-1168 (2018).
- Wang, S., Kojima, K., Mobley, J. A., West, A. B. Proteomic analysis of urinary extracellular vesicles reveal biomarkers for neurologic disease. EBioMedicine. 45, 351-361 (2019).
- Merchant, M. L., Rood, I. M., Deegens, J. K. J., Klein, J. B. Isolation and characterization of urinary extracellular vesicles: implications for biomarker discovery. International Urology and Nephrology. 13 (12), 731-749 (2017).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Jing, H., et al. The role of extracellular vesicles in renal fibrosis. Cell Death and Disease. 10 (5), 367(2019).
- Liu, X., et al. Tubule-derived exosomes play a central role in fibroblast activation and kidney fibrosis. Kidney International. 97 (6), 1181-1195 (2020).
- Quaglia, M., et al. Extracellular Vesicles as Mediators of Cellular Crosstalk Between Immune System and Kidney Graft. Frontiers in Immunology. 11, 74(2020).
- Simpson, R. J., Lim, J. W., Moritz, R. L., Mathivanan, S. Exosomes: proteomic insights and diagnostic potential. Expert Review of Proteomics. 6 (3), 267-283 (2009).
- Street, J. M., Koritzinsky, E. H., Glispie, D. M., Star, R. A., Yuen, P. S. Urine Exosomes: An Emerging Trove of Biomarkers. Advances in Clinical Chemistry. 78, 103-122 (2017).
- Thongboonkerd, V. Roles for Exosome in Various Kidney Diseases and Disorders. Frontiers in Pharmacology. 10, 1655(2019).
- Watanabe, Y., et al. Molecular Network Analysis of the Urinary Proteome of Alzheimer's Disease Patients. Dementia and Geriatric Cognitive Disorders Extra. 9 (1), 53-65 (2019).
- Jadli, A. S., Ballasy, N., Edalat, P., Patel, V. B. Inside(sight) of tiny communicator: exosome biogenesis, secretion, and uptake. Molecular and Cellular Biochemistry. 467 (1-2), 77-94 (2020).
- Svenningsen, P., Sabaratnam, R., Jensen, B. L. Urinary extracellular vesicles: Origin, role as intercellular messengers and biomarkers; efficient sorting and potential treatment options. Acta Physiologica. 228 (1), 13346(2020).
- Witwer, K. W., Thery, C. Extracellular vesicles or exosomes? On primacy, precision, and popularity influencing a choice of nomenclature. Journal of Extracellular Vesicles. 8 (1), 1648167(2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Perez-Hernandez, J., et al. Increased Urinary Exosomal MicroRNAs in Patients with Systemic Lupus Erythematosus. PLoS One. 10 (9), 0138618(2015).
- Freyssinet, J. M., Toti, F. Membrane microparticle determination: at least seeing what's being sized. Journal of Thrombosis and Haemostasis. 8 (2), 311-314 (2010).
- D'Anca, M., et al. Exosome Determinants of Physiological Aging and Age-Related Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 11, 232(2019).
- Lawson, C., Vicencio, J. M., Yellon, D. M., Davidson, S. M. Microvesicles and exosomes: new players in metabolic and cardiovascular disease. Journal of Endocrinology. 228 (2), 57-71 (2016).
- Lee, S., Mankhong, S., Kang, J. H. Extracellular Vesicle as a Source of Alzheimer's Biomarkers: Opportunities and Challenges. International Journal of Molecular Sciences. 20 (7), (2019).
- Mori, M. A., Ludwig, R. G., Garcia-Martin, R., Brandao, B. B., Kahn, C. R. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. Cell Metabolism. 30 (4), 656-673 (2019).
- Hoorn, E. J., et al. Prospects for urinary proteomics: exosomes as a source of urinary biomarkers. Nephrology (Carlton). 10 (3), 283-290 (2005).
- Ranghino, A., Dimuccio, V., Papadimitriou, E., Bussolati, B. Extracellular vesicles in the urine: markers and mediators of tissue damage and regeneration. Clinical Kidney Journal. 8 (1), 23-30 (2015).
- Zhang, W., et al. Extracellular vesicles in diagnosis and therapy of kidney diseases. American Journal of Physiology-Renal Physiology. 311 (5), 844-851 (2016).
- Fernandez-Llama, P., et al. Tamm-Horsfall protein and urinary exosome isolation. Kidney International. 77 (8), 736-742 (2010).
- Royo, F., et al. Different EV enrichment methods suitable for clinical settings yield different subpopulations of urinary extracellular vesicles from human samples. Journal of Extracellular Vesicles. 5, 29497(2016).
- Rider, M. A., Hurwitz, S. N., Meckes, D. G. ExtraPEG: A Polyethylene Glycol-Based Method for Enrichment of Extracellular Vesicles. Scientific Reports. 6, 23978(2016).
- Lv, C. Y., et al. A PEG-based method for the isolation of urinary exosomes and its application in renal fibrosis diagnostics using cargo miR-29c and miR-21 analysis. International Urology and Nephrology. 50 (5), 973-982 (2018).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Wang, D., Sun, W. Urinary extracellular microvesicles: isolation methods and prospects for urinary proteome. Proteomics. 14 (16), 1922-1932 (2014).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. Journal of Extracellular Vesicles. 4, 25530(2015).
- van der Pol, E., et al. Standardization of extracellular vesicle measurements by flow cytometry through vesicle diameter approximation. Journal of Thrombosis and Haemostasis. 16 (6), 1236-1245 (2018).
- Huyan, T., Du, Y., Huang, Q., Huang, Q., Li, Q. Uptake Characterization of Tumor Cell-derived Exosomes by Natural Killer Cells. Iranian Journal of Public Health. 47 (6), 803-813 (2018).
- Puzar Dominkus, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (6), 1350-1361 (2018).
- Morales-Kastresana, A., et al. Labeling Extracellular Vesicles for Nanoscale Flow Cytometry. Scientific Reports. 7 (1), 1878(2017).
- de Rond, L., et al. Comparison of Generic Fluorescent Markers for Detection of Extracellular Vesicles by Flow Cytometry. Clinical Chemistry. 64 (4), 680-689 (2018).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved