A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
קביעת גודל וניתוח פנוטיפי של שלפוחיות שתן חוץ-תאיות באמצעות ציטומטריית זרימה
In This Article
Summary
פרוטוקול זה מתאר שיטה לבידוד שלפוחיות שתן חוץ-תאיות, uEVs, מתורמים אנושיים בריאים ואפיונם הפנוטיפי על ידי גודל וביטוי סמני פני השטח באמצעות ציטומטריית זרימה.
Abstract
שלפוחיות חוץ-תאיות, EVs, הן קומפלקס הטרוגני של ממברנות שומניות, המופרשות על ידי כל סוג תא, בכל נוזל כגון שתן. רכבים חשמליים יכולים להיות בגדלים שונים הנעים בין 40-100 ננומטר בקוטר כמו באקסוזומים ועד 100-1000 ננומטר במיקרו-שלפוחית. הם יכולים גם להכיל מולקולות שונות שיכולות לשמש כסמנים ביולוגיים לפרוגנוזה ואבחון של מחלות רבות. טכניקות רבות פותחו כדי לאפיין את השלפוחיות הללו. אחד מהם הוא ציטומטריית זרימה. עם זאת, אין דוחות קיימים המראים כיצד לכמת את ריכוז הרכבים החשמליים ולהבדיל ביניהם לפי גודל, יחד עם זיהוי סמנים ביולוגיים. עבודה זו נועדה לתאר הליך לבידוד, כימות ופנוטיפ של שלפוחיות שתן חוץ-תאיות, uEVs, באמצעות ציטומטר קונבנציונאלי לניתוח ללא כל שינוי בתצורתו. מגבלות השיטה כוללות צביעה של ארבעה סמנים ביולוגיים שונים לכל דגימה. השיטה מוגבלת גם על ידי כמות הרכבים החשמליים הזמינים במדגם. למרות מגבלות אלה, בעזרת פרוטוקול זה והניתוח שלאחר מכן, אנו יכולים לקבל מידע נוסף על העשרת סמני EVs ושפע השלפוחיות הללו הקיימות בדגימות שתן, במחלות הכוללות נזק לכליות ולמוח.
Introduction
אצל יונקים, הדם מסונן על ידי מעבר דרך הכליות 250 - 300 פעמים; במהלך תקופה זו נוצר שתן. ייצור הנוזל הביולוגי הזה הוא תוצאה של סדרה של תהליכים, כולל סינון גלומרולרי, ספיגה חוזרת של צינורות והפרשה. תוצרי פסולת מטבוליים ואלקטרוליטים הם המרכיבים העיקריים של השתן. כמו כן, תוצרי לוואי אחרים כגון פפטידים, חלבונים פונקציונליים ושלפוחיות חוץ-תאיות (EVs) מופרשים 1,2,3,4,5,6. בתחילה, שלפוחיות שתן חוץ-תאיות (uEVs) זוהו בדגימות שתן של חולים הסובלים מהפרעות במאזן המים. חולים אלה הראו נוכחות של מולקולות כמו אקוופורין-2 (AQP2), ששימשו אז כסמן ביולוגי למחלה זו7. מספר מחקרים עוקבים התמקדו בזיהוי המקור התאי של uEVs, ותיארו כי מבנים אלה יכולים להיות מופרשים על ידי תאי כליה (גלומרולוס, פודוציטים וכו') וסוגי תאים אחרים של שושלות אנדותל או לויקוציטים. יתר על כן, המספר והעשרת המולקולות ב-uEVs יכולים להיות בקורלציה עם המצב של מחלות והפרעות רבות 8,9,10,11,12,13,14.
בסך הכל, EVs מהווים משפחה הטרוגנית מאוד של חלקיקים הסגורים על ידי שכבות דו-שכבתיות של שומנים ומשתחררים על ידי תאים באמצעות מנגנונים פסיביים או אקטיביים לנוזלים שונים. בהתאם למקורם, ניתן לסווג EVs כאקסוזומים שמקורם באנדוזום או מיקרו-שלפוחיות/מיקרו-חלקיקים שמקורם בקרום פלזמה. עם זאת, ניתן ליישם קריטריון סיווג זה רק כאשר נצפית ישירות הביוגנזה של החלקיקים. לכן, קריטריונים אחרים שאינם טריוויאליים, כולל מקור פיזיקלי, ביוכימי ותאי, אושרו על ידי מספר חוקרים בתחום 15,16,17. בהתאם לאופי הבידוד שנותח, הוצעו טכניקות אנליטיות שונות לאפיון EVs. לדוגמה, בהתבסס על העשרה של EVs גדולים (≥100 ננומטר) או קטנים (≤100 ננומטר), מוצע כימות באמצעות ציטומטריית זרימה או מעקב אחר ננו-חלקיקים, בהתאמה.
כיום, השימוש ברכבים חשמליים כסמנים ביולוגיים למחלות רבות הפך לרלוונטי, ולכן החיפוש אחר מקורות שונים נחקר. אחד המקורות המבטיחים ביותר הוא השתן שכן ניתן להשיג אותו בצורה קלה ולא פולשנית. לכן, פרוטוקול זה מתאר הליך לבידוד uEVs על ידי צנטריפוגה דיפרנציאלית, עיבוד עם נוגדנים מצומדים פלואורוכרום, וניתוח במורד הזרם באמצעות ציטומטר קונבנציונאלי של 2 לייזרים/4 צבעים.
Protocol
דגימות השתן האנושיות נלקחו ממתנדבים בריאים שחתמו על הסכמה מדעת של התורם. נהלים אלה אושרו גם על ידי ועדת האתיקה למחקר של המכון הלאומי למדעי הרפואה והנוטריסיון סלבדור זוביראן.
1. בידוד שלפוחיות שתן חוץ-תאיות
הערה: פרוטוקול הבידוד של uEVs שונה מ-ref.19. איור 1 מתאר את הייצוג של הפרוטוקול לבידוד uEVs.
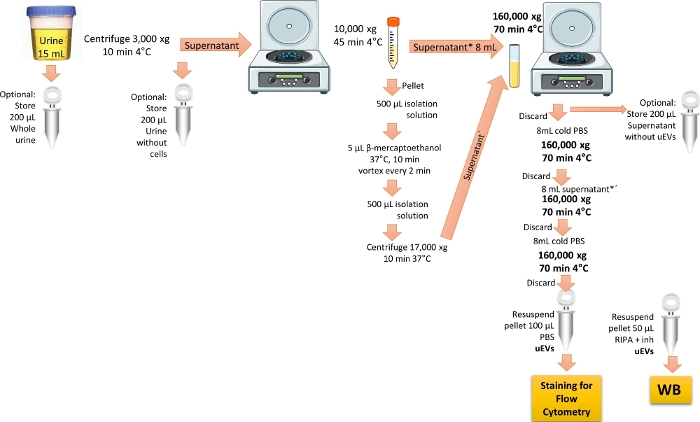
איור 1: סקירה כללית של בידוד ה-uEVs עבור ניתוח ציטומטריית זרימה. בפרוטוקול זה, צנטריפוגה ראשונה את השתן הראשון ביום כדי להסיר את התאים והפסולת. לאחר מכן צנטריפוגה להסרת השלפוחיות הגדולות עם טיפול להסרת חלבון ה-THP ולבסוף לבצע אולטרה-צנטריפוגה כדי להעשיר ולהשיג את ה-uEVs בשטיפה אחת. הצעדים לשמירת שברי שתן לאימות WB מסומנים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- השתמשו בשתן הראשון בבוקר (15 מ"ל) ממתנדבים בריאים. צנטריפוגה של השתן ב-3,000 x גרם למשך 10 דקות ב-4 מעלות צלזיוס, כדי להסיר את כל התאים והפסולת.
הערה: עדיף להשתמש בשתן טרי; אם אינו זמין, יש להשתמש בשתן המאוחסן לתקופה מקסימלית של 3 חודשים בטמפרטורה של -20 מעלות צלזיוס, או מאוחסן לתקופה מקסימלית של 6 חודשים בטמפרטורה של -70 מעלות צלזיוס. להפשיר את דגימת השתן על קרח ולמערבל אותה במרץ. בצע את כל ההליכים על קרח או בטמפרטורה של 4 מעלות צלזיוס. צעד אופציונלי לניתוח כתמים מערביים הוא ליצור צינור משוכפל ולאסוף 200 מיקרוליטר של השתן הראשון בבוקר בצינור נפרד. אחסן את הדגימה בטמפרטורה של -20 מעלות צלזיוס עד לשימוש, ותייג אותה כ"שתן מלא", כדי לבדוק אם יש סמני שלפוחית חוץ-תאיים. - העבירו את הסופרנטנט שהתקבל בשלב 1.1 לצינור צנטריפוגה חרוטי חדש של 15 מ"ל, ולאחר מכן צנטריפוגה ב-10,000 x גרם למשך 45 דקות ב-4 מעלות צלזיוס. העבירו את הסופרנטנט לצינור אולטרה-צנטריפוגה פוליקרבונט בנפח 8 מ"ל ושמרו אותו על קרח.
הערה: לחלופין, יש לצרוך 200 מיקרוליטר של הסופרנטנט שהושג בשלב 1.1 בשפופרת נפרדת המסומנת כ"שתן ללא תאים" לניתוח כתמים מערביים.- הסרת חלבון Tamm-Horsfall, THP
הערה: THP קיים בשתן ומועשר כאשר לאדם יש מחלת כליות. דווח כי THP מפחית את התפוקה של uEVs מכיוון שהוא יכול להיקשר ל-uEVs. כדי להסיר חלבון זה, יש צורך בשימוש בחומר מפחית 3,6.- הכן את תמיסת הבידוד על ידי ערבוב של 250 מ"מ סוכרוז עם 10 מ"מ טריאתנולמין. התאם את ה-pH ל-7.6.
- מערבבים את הגלולה שהתקבלה בשלב 1.2 עם 500 מיקרוליטר של תמיסת בידוד, ולאחר מכן מוסיפים 5 מיקרוליטר של β-מרקפטואתנול.
- דגרו את תערובת הגלולות בטמפרטורה של 37 מעלות צלזיוס למשך 10 דקות, מערבולת כל 2 דקות. הוסף 500 מיקרוליטר של תמיסת בידוד ולאחר מכן צנטריפוגה ב-17,000 x גרם למשך 10 דקות ב-37 מעלות צלזיוס. אסוף את הסופרנטנט שהתקבל (מכיל THP מופחת לא מצטבר בתוספת uEVs).
- הסרת חלבון Tamm-Horsfall, THP
- מערבבים את שני הסופרנטנטים השמורים (משלבים 1.2 ו-1.2.1.3) באותו צינור אולטרה-צנטריפוגה פוליקרבונט בנפח 8 מ"ל, ולאחר מכן צנטריפוגה ב-160,000 x גרם למשך 70 דקות ב-4 מעלות צלזיוס, באמצעות רוטור אולטרה-צנטריפוגה בזווית קבועה.
הערה: לחלופין, לניתוח כתמים מערביים, אחסן 200 מיקרוליטר של הסופרנטנט שהושג לעיל ותייג אותו כ"סופרנטנט ללא EVs". דגימה זו תשמש כבקרה שלילית בעת חיפוש סמני שלפוחית חוץ-תאיים. - השליכו את הסופרנטנט. הוסף 1x PBS קר כקרח לצינור הפוליקרבונט של 8 מ"ל וצנטריפוגה ב-160,000 x גרם למשך 70 דקות ב-4 מעלות צלזיוס.
הערה: היזהר לא להשליך את הגלולה, מכיוון שהיא מכילה את ה-uEVs. יש לעקר ולסנן את ה-1x PBS עם מסנן מזרק נקבוביות של 0.22 מיקרומטר לפחות. - השליכו את הסופרנטנט. הוסף את שאר הסופרנטנט לצינור הפוליקרבונט של 8 מ"ל ולצנטריפוגה ב-160,000 x גרם למשך 70 דקות ב-4 מעלות צלזיוס.
- השליכו את הסופרנטנט והוסיפו 8 מ"ל PBS קר כקרח לגלולה כדי לשטוף את ה-uEVs.
- השליכו את הסופרנטנט. הניחו לגלולה להתייבש ולאחר מכן השעו אותה מחדש עם 1 מ"ל PBS קר כקרח. יש לאחסן בטמפרטורה של -70 מעלות צלזיוס עד לשימוש.
הערה: אם מבצעים ניתוח כתמים מערביים, השעו מחדש את הגלולה של הצינור המשוכפל עם 50 מיקרוליטר של מאגר RIPA בתוספת מעכבי פרוטאז. יש לאחסן בטמפרטורה של -20 מעלות צלזיוס עד לשימוש.
2. מכתים של uEVs
הערה: לפני צביעה וניתוח של uEVs, חיוני לבצע לפחות מתודולוגיה אחת המומלצת על ידי MISEV201818 כדי לוודא בידוד נכון של uEVs; כאן מתואר ניתוח כתמים מערביים. איור 2 מציג פרוטוקול מייצג להכתמת uEVs.
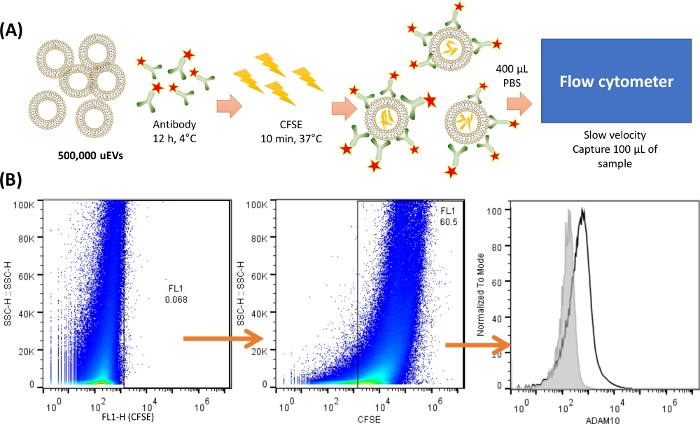
איור 2: סקירה כללית של הצביעה והלכידה של ה-uEVs בציטומטר. (א) ייצוג של צביעת ה-uEV. עבור 500,000 uEVs, הנוגדן עורבב והודגר ב-4 מעלות צלזיוס למשך 12 שעות. לאחר מכן CFSE נוסף והודגר בטמפרטורה של 37 מעלות צלזיוס למשך 10 דקות. ה-uEVs הכיל את ה-CFSE בפנים, והנוגדן ייקשר לפני השטח של האנטיגן. 400 מיקרוליטר של PBS קר שימשו להשעיה וללכידת 100 מיקרוליטר מהדגימה בציטומטר הזרימה במהירות איטית. (ב) אסטרטגיית ניתוח. תרשים הנקודות הראשון (SSC-H VS FL-X) מתאר את הבקרה השלילית עבור uEVs, ואחריו תרשים הנקודות המציג uEVs מכתימים ב-CFSE, ולבסוף, היסטוגרמה עם צביעת הנוגדנים של uEVs (קו שחור), הבקרה השלילית מוצגת בקו האפור. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- חשב את המספר היחסי של uEVs על ידי כימות תכולת החלבון באמצעות כל בדיקת חלבון קולורימטרית קונבנציונלית, כפי שהוזכר בטבלת החומרים. בצע דילול של 1:5 של ה-uEVs ופעל לפי ההוראות של גיליון הנתונים המסופק בערכת חלבון הבדיקה.
- בהתבסס על נוסחה20 שדווחה בעבר, קחו בחשבון ש-1 מיקרוגרם/מ"ל של חלבון uEVs שווה ל-800,000 uEVs/μL. ודא ש-500,000 uEVs נמצאים ב-20 מיקרוליטר של PBS קר כקרח.
- סמן את הצינורות, כפי שמצוין בטבלה 1.
הערה: מספר הצינורות המשמשים יהיה תלוי במספר הנוגדנים המופעלים, המגבלה עבור ציטומטר 2 לייזרים/4 צבעים היא מקסימום 4 נוגדנים לכל צינור שניתן להשתמש בו; לכן, ניתן היה לקרוא רק FL1, FL2, FL3 ו-FL4 בציטומטר, אם כי יש צורך בפיצוי. עבור הליכים אלה, השתמש בצינורות מיקרו-צנטריפוגה של 1.5 מ"ל או בצינורות תחתונים עגולים של 5 מ"ל לציטומטריית זרימה. צינורות נחוצים מתוארים בטבלה 1. צינורות 4 ו-5 מורכבים מקוקטייל של כל הנוגדנים שישמשו בפרוטוקול זה. שני צינורות בעייתיים (8 ו-9) ניתנים כדוגמה; לכן, מערכת פקדים זו חייבת לכלול את השילוב שישמש בכל צינור.
| צינור 1. | חרוזי FSC של מגה-מיקס | |
| צינור 2. | PBS | |
| צינור 3. | PBS עם CFSE | |
| צינור 4. | PBS עם כל הנוגדנים של בעיה 1 | |
| צינור 5. | PBS עם כל הנוגדנים של בעיה 2 | |
| צינור 6. | בקרת אוטופלואורסצנטיות | uEVs ללא כל ריאגנט, רק ב-PBS. |
| צינור 7. | #uEVs | uEVs עם CFSE |
| צינור 8. | בעיה 1 | uEVs עם CD37 FITC, CD53 PE, ADAM10 APC |
| צינור 9. | בעיה 2 | uEVs עם CD9, FITC, TSPAN33 APC |
טבלה 1: תיוג צינורות. דוגמה המראה כיצד לתייג את הצינורות. הצינורות הראשונים הם כל הפקדים הדרושים. הצינורות עם הנוגדנים-פלואורוכרומים יהיו תלויים בצביעה.
- הוסף 20 מיקרוליטר של PBS המכילים 500,000 uEVs לצינורות המסומנים בתווית.
- הוסף את הנוגדנים כפי שמצוין בטבלה 1, שצוינה קודם לכן. יש לדגור למשך הלילה בטמפרטורה של 4 מעלות צלזיוס.
הערה: לפני הצביעה, מומלץ לצנטריפוגה של הנוגדנים ב-4 מעלות צלזיוס במהירות מלאה למשך 5 דקות לפחות, כדי למנוע את האגרגטים. הנוגדנים המשמשים כאן הם דוגמה לחלבונים הקיימים ב-uEVs ושייכים לכתב יד עצמאי שנמצא כעת בהכנה. - הוסף 0.4 מיקרוליטר של קרבוקסיפלואורסצאין סוקסינימידיל אסטר (CFSE) [5 ננומטר] לשפופרת מספר 3. יש לדגור למשך 10 דקות בחום של 37 מעלות צלזיוס.
הערה: CFSE הוא צבע המשמש להכתמת כל ה-EVs הקיימים בדגימה ולהבחין בין רעשי הרקע בעת ביצוע ניתוח ציטומטר זרימה. למידע נוסף, עיין בסעיף דיון . - הוסף 400 מיקרוליטר של PBS 1x קר כקרח לכל הצינורות.
- שמור את כל הצינורות בטמפרטורה של 4 מעלות צלזיוס.
3. רכישת uEVs באמצעות ציטומטר קונבנציונאלי
הערה: הוראות לשימוש בציטומטר הזרימה (ראה טבלת חומרים) מתוארות כאן.
- בצע את הכיול האיכותי של הציטומטר, באמצעות חרוזי 6 ו-8 פסגות.
הערה: %CV של השיא האחרון חייב להיות ערך מתחת ל- 6; טכנאי הציטומטר ידאג לכך. - פתח את תוכנת ציטומטר הזרימה.
הערה: לאחר פתיחת התוכנה, ייפתח ניסוי חדש, המציג הקרנה עם תבנית ל-96 דגימות, הפרמטרים להפעלה וקטע "ריק" ליצירת תרשימי נקודות או היסטוגרמות. - התאם את הפרמטרים על המסך של התוכנה הפועלת: 100 מיקרוליטר של דגימה ללכידה, ריצה איטית, הגדר את הסף ל-10,000 ב-FSC-H ו-2,000 ב-SSC-H.
הערה: הסף המומלץ כאן הוא דוגמה; נדרש לקבוע את הסף על סמך הדגימות שנותחו. - צינור עומס מספר 1 (צינור Megamix), כפי שמצוין בטבלה 1. לכוד את החרוזים. צור שתי עלילות נקודות בחלק ה"ריק" של מסך התוכנה על ידי לחיצה על אפשרות תרשים נקודות . צור כפאנל A ו-B באיור 3.
הערה: ניתן לנתח את חרוזי הפלואורסצנט של Megamix (חרוזים המשמשים לתיחום הגדלים של 0.1, 0.3, 0.5 ו-0.9 מיקרומטר ויצירת התבנית לגדלים), באמצעות גלאי FL1 (FITC). כל תרשימי הנקודות וההיסטוגרמות צריכים להיות מוצגים בערכי גובה. הקלט כמה שיותר אירועים; כל שינוי בגליון העבודה אינו משנה את הנתונים.
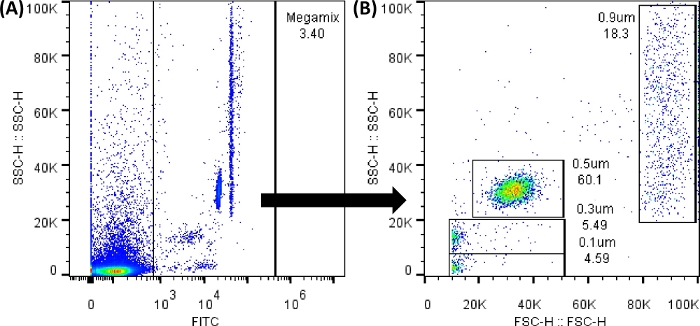
איור 3: תרשימי נקודות של חרוזי FSC של Megamix. עלילות הנקודות שהוצגו נוצרו באמצעות תוכנת ציטומטר הזרימה; בציטומטר הזרימה, התמונה תהיה דומה מאוד. (A) תרשים הנקודות הראשון שנוצר כדי לבחור את החרוזים תוך הימנעות מרעשי הרקע. (SSC-H לעומת FL1-H). (B) תרשים הנקודות שנוצר על-ידי בחירת השער הקודם, שמראה את הגדלים השונים של החרוזים. (SSC-H לעומת FSC-H). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- בחלק ה"ריק" של מסך התוכנה צור תרשים נקודות והיסטוגרמה עבור כל פלואורוכרום בשימוש; השתמש באלגוריתם באיור משלים 1 כדוגמה. לשם כך, לחץ על אפשרות עלילת נקודות או היסטוגרמה עבור כל פלואורוכרום.
הערה: רעשי רקע תמיד יהיו קיימים, כפי שמוצג באיור 3A. כל הנקודות בין 0 ל-1,000 של FL1 (ציר x) נמצאות מחוץ לשער שנוצר. לכן, חיוני להשתמש בכל צינורות הבקרה כדי להשיג תוצאות נאותות. בין כל העמסת צינור, שטוף לאחור את נוזל הנדן ובצע מחזור פתיחת סתימה. יש לנער בעדינות כל שפופרת לפני ההעמסה. לאחר טעינת חמישה צינורות רצופים, הפעל 100 מיקרוליטר של PBS 1x. - טען צינורות מספר 2 ו -5, כדי להגדיר את ערכי החיתוך (שליליים). לשם כך, בחר בסמל שער מלבן (הממוקם מתחת לתרשים הנקודות שנוצר), או בסמל שער קו (הממוקם מתחת להיסטוגרמה שנוצרה); ולמקם אותו במקום שאין אות, על מנת לקבל תרשימי נקודות והיסטוגרמות כמו אלה המוצגים באיור משלים 1.
הערה: כל הצינורות הללו דורשים מיקום של האזור החיובי לא יותר מ-0.70% מכיוון שלא תהיה "פלואורסצנטית" יותר מ-103 (1,500). אם יש פלואורסצנטיות רחוקה יותר מאזור זה, יש לדלל את הריאגנטים המשמשים. לכן, חשוב לטיטר את הריאגנטים לפני המדידות הסופיות. - צינור עומס מספר 6 (צינור אוטופלואורסצנטי), כדי להגדיר את האזורים השליליים לדגימה. לשם כך, בחר בסמל שער מלבן (הממוקם מתחת לתרשים הנקודות שנוצר), או בסמל שער קו (הממוקם מתחת להיסטוגרמה שנוצרה); מקם אותו במקום שאין אות.
- טען את הצינורות הבאים (צינורות 7 עד 9, המתוארים בטבלה 1).
- שמור את הניסוי.
הערה: עבור תוכנת הציטומטר המשמשת כאן, הפקודה שמור ניסוי, מתייחסת לשמירת הנתונים שנוצרו. במילים אחרות, יש לשמור את כל הצינורות הנרכשים על ידי ציטומטר הזרימה, ואת הנתונים הנוצרים עבור כל צינור. לשם כך, יש צורך ללחוץ על כפתור שמור ניסוי . - ייצא נתונים כקבצי FSC.
4. ניתוח הנתונים באמצעות תוכנת ציטומטר זרימה.
הערה: הוראות לשימוש בתוכנת ציטומטר הזרימה המתוארת בטבלת החומרים, מתוארות בסעיף זה. איור 4 מציג את סביבת העבודה עם השלבים ליצירת שערי הגודל.
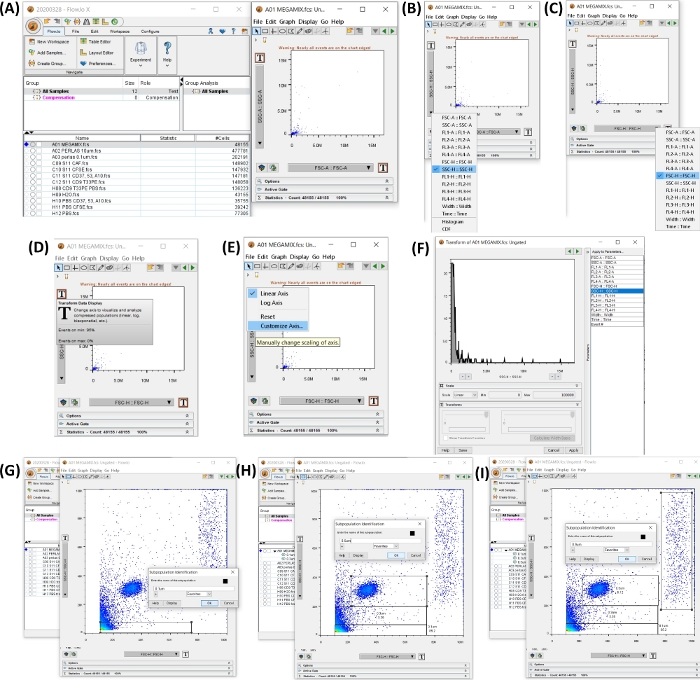
איור 4: סביבת עבודה עם כל השלבים להתחלת ניתוח הנתונים. כל התמונות נוצרו על ידי הדפסת רשת של סביבת העבודה. (A) סביבת עבודה שנוצרה עם נתוני הדגימה שנוספו (משמאל), תרשים נקודות שנוצר על ידי בחירת הצינור 1, חרוזי FSC, (מימין). (B,C) מראים את השינוי של הציר, כך שיהיה SSC-H ו-FSC-H. (D-F) הצג התאמה אישית שלב אחר שלב של שני הצירים. (G-I) מראה את הבחירה והיצירה של גדלי החרוזים השונים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- פתח את תוכנת ציטומטר הזרימה. הוסף את הדוגמאות, על ידי לחיצה על כפתור הוסף דוגמאות , ובחר את קבצי ה-FCS המיוצאים.
- לחץ על צינור המגה-מיקס כדי לפתוח תרשים נקודות SSC-H (ציר y) לעומת FSC-H (ציר x). כוונן את שני הצירים כדי view 0 עד 100,000 על ידי לחיצה על כפתור T (תצוגת נתוני המרה), לחץ על התאמה אישית של ציר, לחץ על SSC-H או FSSC-H ושנה את ערך קנה המידה למינימום 0 ומקסימום 100,000 (ראה איור 4A-F).
- הגדר את השערים עבור 0.1, 0.3, 0.5 ו- 0.9 מיקרומטר, בתרשים הנקודות שנוצר בשלב 4.2. בחר בלחצן שער מלבן כדי ליצור שער כפי שמתואר באיור 4G-I.
הערה: איור 5 מציג את סביבת העבודה עם השלבים ליצירת האזורים החיוביים, ולהשגת העוצמה הממוצעת עבור הפלואורוכרום.

איור 5: סביבת עבודה לניתוח הנתונים שהתקבלו. כל התמונות נוצרו על ידי הדפסת המסך של סביבת העבודה. (א) סביבת עבודה שנוצרה עם שער הגודל שהוחל על כל הדגימות. (B) צינור אוטופלואורסצנטי שנבחר, תרשים נקודות שמראה את שער הגודל, והיסטוגרמה עבור גודל נבחר אחד (0.1 מיקרומטר), השתמשו בהיסטוגרמה הזו כדי להשיג את השער החיובי עבור כל פלואורוכרום וגודל. (C) סביבת עבודה שנוצרה עם השערים החיוביים עבור כל פלואורוכרום וגודל. (D) Workspace (משמאל) ו-Layout Editor (מימין) שנוצרו עבור הדוגמאות. בעורך הפריסה מוצגת ההיסטוגרמה עבור צינור אוטופלואורסצנטי וצינור חיובי עבור FL1-H, וכיצד להשיג את לוח המאפיינים כדי לשנות אותם. (E) התמונה מראה כיצד להשיג את ערך הקרינה בעוצמה הממוצעת. (F) היסטוגרמות שנוצרו עבור שלושה פלואורוכרומים שונים, שמציגות את כל השינויים שהתוכנה מאפשרת לעשות עם המידע הסטטיסטי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- החל את השערים שנוצרו (0.1, 0.3, 0.5 ו-0.9 מיקרומטר) על כל הדגימות. בחר את השערים, גרור ושחרר באפשרות כל הדגימות , כפי שמתואר באיור 5A.
- לחץ על צינור האוטו-פלואורסצנטי. הגדר את האזורים החיוביים עבור כל פלואורוכרום, עבור כל גודל. פתח את עלילת הנקודות SSC-H VS FSC-H עם שערי הגודל, לחץ על גודל שער יחיד. בחלון החדש, לחץ על ציר ה-y כדי לבחור באפשרות ההיסטוגרמה. בציר x, בחר FL1-H ולאחר מכן בחר בסמל Range ליצירת האזור החיובי. חזור על הפעולה עבור FL2-H ו-FL4-H (ראה איור 5B).
- החל את השערים על כל הדגימות. בחר Gates, גרור ושחרר באפשרות All Samples , כפי שמתואר באיור 5C.
- פתח את עורך הפריסה.
- גרור ושחרר כל דוגמה בעורך. בחר את גודל הצינור "האוטו-פלואורסצנטי", גרור ושחרר, ולאחר מכן בחר את אותו גודל של הצינור המוכתם, גרור ושחרר.
- לחץ על החלק התחתון הימני של ההיסטוגרמה. פתח את תפריט מאפיינים . לחץ על מקרא. הוסף את העוצמה הממוצעת עבור הפלואורוכרום.
הערה: במאפיינים, קיימים כלים זמינים אחרים לשינוי מראה ההיסטוגרמה. - חזור על אותו הליך עבור שאר הפלואורוכרומים והגדלים.
5. ניתוח להשגת מספר ה-uEVs לכל דגימה.
הערה: איור 6 מציג את סביבת העבודה עם השלבים להשגת מספר ה-uEVs לכל דגימה.
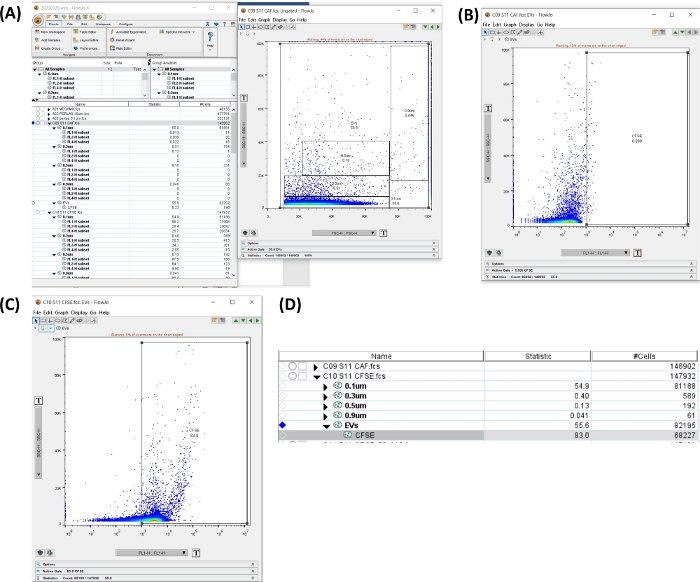
איור 6: סביבת עבודה לניתוח שפופרת CFSE. כל התמונות נוצרו על ידי הדפסת רשת של סביבת העבודה. (A) סביבת עבודה שנוצרת על-ידי בחירה של אזור כל הגדלים, סה"כ uEVs (משמאל), תרשים נקודות המציג את השער שנבחר (מימין). (B) תרשים נקודות SSC-H לעומת FL1-H עבור אזור שלילי CFSE בצינור האוטופלואורסצנטי. (C) תרשים נקודה SSC-H לעומת FL1-H עבור CFSE בצינור הצביעה. (D) תמונה של הטבלה שהתקבלה עם הסטטיסטיקה של צביעת CFSE, המציגה את מספר ה-uEVs במדגם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- לחץ על שפופרת אוטופלואורסצנטית. בתרשים הנקודות SSC-H VS FSC-H עם שערי הגודל, צור אזור הכולל את כל הגדלים. לחץ על אזור חדש. הגדר את האזור החיובי (ראה איור 6A,B).
- החל את השערים על כל הדגימות. בחר את השערים, גרור ושחרר באפשרות All Sample .
- לחץ על צינור CFSE + uEVs. פתחו את האזור החדש וודאו את האזור החיובי עבור CFSE (FL1-H), כפי שמתואר באיור 6C.
- בסביבת העבודה באיור 6D, העתק את נתוני תאי # עבור הצינור. מספר זה הוא #uEVs המתקבל על ידי ציטומטריית זרימה (#uEVs FC).
- החל את הנוסחה הבאה כדי לחשב את מספר ה-uEVs למיקרוליטר:
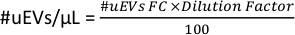
- כדי לקבל את #uEVs למיקרוליטר עבור כל פלואורוכרום (#uEVs/μL FLX), בסביבת העבודה, העתק את הנתונים הסטטיסטיים עבור תת-קבוצת FLX-H, מספר זה הוא האחוז (תת-קבוצה %FLX).
- החל את הנוסחה הבאה כדי לחשב את מספר ה-uEVs למיקרוליטר עבור כל פלואורוכרום.
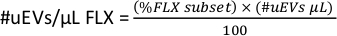
הערה: תלוי אם השער שנבחר יהיה עבור גודל אחד או עבור כל הרכבים החשמליים, אמת את הנתונים שנבחרו.
תוצאות
ישנם מספר מחסומים דרך הפרוטוקול, ולפני צביעת ה-uEVs. לכן, חיוני לאמת תחילה את כמות החלבון הקיימת בתמצית ה-uEVs. כל קבוצות המחקר שעובדות עם שלפוחיות חוץ-תאיות מכמתות את החלבון, כפי שמצוין בשלב 2.1. איור משלים 2 מציג לוח מייצג של 96 בארות המכיל חלק uEVs בבארות 4E, 5E ו-6E. בארות 1A, ...
Discussion
כיום, השימוש בשלפוחיות חוץ-תאיות כסמנים ביולוגיים למספר מחלות גדל, במיוחד עבור אלה שניתן לבודד ממקורות לא פולשניים כמו שתן 5,21,22,23,24. הוכח כי בידוד של uEVs הוא משאב חיוני לדעת את מצבו של...
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר כל קשר פיננסי או מסחרי שיכול להתפרש כניגוד אינטרסים פוטנציאלי.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מ-CONACyT (A3-S-36875) ותוכנית UNAM-DGAPA-PAPIIT (IN213020 ו-IA202318). NH-I נתמך על ידי מלגה 587790 מ-CONACyT.
המחברים רוצים להודות לליאופולדו פלורס-רומו†, ויאני אורטיז-נברטה, אנטוני בוקארד ג'וניור ודיאנה גומז-מרטין על עצותיהם החשובות למימוש פרוטוקול זה, ולכל האנשים הבריאים על דגימות השתן שלהם.
Materials
| Name | Company | Catalog Number | Comments |
| APC anti human CD156c (ADAM10) antibody | BioLegend | 352706 | Add 5 µL to the 20 µL of uEVs in PBS |
| APC anti human TSPAN33 (BAAM) antibody | BioLegend | 395406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Avanti centrifuge with JA-25.5O fixed angle rotor | Beckamn Coulter | J-26S XPI | |
| BD Accuri C6 Flow Cytometer | BD Biosciences | ||
| β-mercaptoethanol | SIGMA-Aldrich | M3148 | |
| Benchtop centrifuge with A-4-44 rotor | Eppendorf | 5804 | |
| BLUEstain 2 protein ladder | GOLDBIO | P008 | |
| CD9 (C-4) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-13118 | |
| CD63 (MX-49.129.5) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-5275 | |
| Cell Trace CFSE cell proliferation kit for flow cytometry | Thermo Scientific | C34554 | |
| Chemidoc XRS+ system | BIORAD | 5837 | |
| FITC anti human CD9 antibody | BioLegend | 312104 | Add 5 µL to the 20 µL of uEVs in PBS |
| FITC anti human CD37 antibody | BioLegend | 356304 | Add 5 µL to the 20 µL of uEVs in PBS |
| Fluorescent yellow particles | Spherotech | FP-0252-2 | |
| Fluorescent yellow particles | Spherotech | FP-0552-2 | |
| Fluorescent yellow particles | Spherotech | FP-1552-2 | |
| FlowJo Software | Becton, Dickinson and Company | ||
| Goat anti-mouse immunoglobulins/HRP | Dako | P0447 | |
| Halt protease inhibitor cocktail | Thermo Scientific | 78429 | |
| Immun-Blot PVDF membrane 0.22µm | BIORAD | 1620177 | |
| Megamix-Plus FSC beads | COSMO BIO CO.LTD | 7802 | |
| NuPAGE LDS sample buffer 4X | Thermo Scientific | NP0007 | |
| Optima ultracentrifuge with rotor 90Ti fixed angle 355530 | Beckamn Coulter | XPN100 | |
| Page Blue protein staining solution | Thermo Scientific | 24620 | |
| PE anti human CD53 antibody | BioLegend | 325406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Pierce BCA Protein assay kit | Thermo Scientific | 23227 | |
| Pierce RIPA buffer | Thermo Scientific | 89900 | |
| Polycarbonate thick wall centrifuge tubes | Beckamn Coulter | 355630 | |
| Spherotech 8-Peak validation beads (FL1-FL3) | BD Accuri | 653144 | |
| Spherotech 6-Peak validation beads (FL4) | BD Accuri | 653145 | |
| Sucrose | SIGMA-Aldrich | 59378 | |
| Triethanolamine | SIGMA-Aldrich | 90279 |
References
- Decramer, S., et al. Urine in clinical proteomics. Molecular & Cellular Proteomics. 7 (10), 1850-1862 (2008).
- Nawaz, M., et al. The emerging role of extracellular vesicles as biomarkers for urogenital cancers. Nature Reviews Urology. 11 (12), 688-701 (2014).
- Pisitkun, T., Johnstone, R., Knepper, M. A. Discovery of urinary biomarkers. Molecular & Cellular Proteomics. 5 (10), 1760-1771 (2006).
- Urinology Think Tank Writing Group. Urine: Waste product or biologically active tissue. Neurourology and Urodynamics. 37 (3), 1162-1168 (2018).
- Wang, S., Kojima, K., Mobley, J. A., West, A. B. Proteomic analysis of urinary extracellular vesicles reveal biomarkers for neurologic disease. EBioMedicine. 45, 351-361 (2019).
- Merchant, M. L., Rood, I. M., Deegens, J. K. J., Klein, J. B. Isolation and characterization of urinary extracellular vesicles: implications for biomarker discovery. International Urology and Nephrology. 13 (12), 731-749 (2017).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Jing, H., et al. The role of extracellular vesicles in renal fibrosis. Cell Death and Disease. 10 (5), 367 (2019).
- Liu, X., et al. Tubule-derived exosomes play a central role in fibroblast activation and kidney fibrosis. Kidney International. 97 (6), 1181-1195 (2020).
- Quaglia, M., et al. Extracellular Vesicles as Mediators of Cellular Crosstalk Between Immune System and Kidney Graft. Frontiers in Immunology. 11, 74 (2020).
- Simpson, R. J., Lim, J. W., Moritz, R. L., Mathivanan, S. Exosomes: proteomic insights and diagnostic potential. Expert Review of Proteomics. 6 (3), 267-283 (2009).
- Street, J. M., Koritzinsky, E. H., Glispie, D. M., Star, R. A., Yuen, P. S. Urine Exosomes: An Emerging Trove of Biomarkers. Advances in Clinical Chemistry. 78, 103-122 (2017).
- Thongboonkerd, V. Roles for Exosome in Various Kidney Diseases and Disorders. Frontiers in Pharmacology. 10, 1655 (2019).
- Watanabe, Y., et al. Molecular Network Analysis of the Urinary Proteome of Alzheimer's Disease Patients. Dementia and Geriatric Cognitive Disorders Extra. 9 (1), 53-65 (2019).
- Jadli, A. S., Ballasy, N., Edalat, P., Patel, V. B. Inside(sight) of tiny communicator: exosome biogenesis, secretion, and uptake. Molecular and Cellular Biochemistry. 467 (1-2), 77-94 (2020).
- Svenningsen, P., Sabaratnam, R., Jensen, B. L. Urinary extracellular vesicles: Origin, role as intercellular messengers and biomarkers; efficient sorting and potential treatment options. Acta Physiologica. 228 (1), 13346 (2020).
- Witwer, K. W., Thery, C. Extracellular vesicles or exosomes? On primacy, precision, and popularity influencing a choice of nomenclature. Journal of Extracellular Vesicles. 8 (1), 1648167 (2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Perez-Hernandez, J., et al. Increased Urinary Exosomal MicroRNAs in Patients with Systemic Lupus Erythematosus. PLoS One. 10 (9), 0138618 (2015).
- Freyssinet, J. M., Toti, F. Membrane microparticle determination: at least seeing what's being sized. Journal of Thrombosis and Haemostasis. 8 (2), 311-314 (2010).
- D'Anca, M., et al. Exosome Determinants of Physiological Aging and Age-Related Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 11, 232 (2019).
- Lawson, C., Vicencio, J. M., Yellon, D. M., Davidson, S. M. Microvesicles and exosomes: new players in metabolic and cardiovascular disease. Journal of Endocrinology. 228 (2), 57-71 (2016).
- Lee, S., Mankhong, S., Kang, J. H. Extracellular Vesicle as a Source of Alzheimer's Biomarkers: Opportunities and Challenges. International Journal of Molecular Sciences. 20 (7), (2019).
- Mori, M. A., Ludwig, R. G., Garcia-Martin, R., Brandao, B. B., Kahn, C. R. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. Cell Metabolism. 30 (4), 656-673 (2019).
- Hoorn, E. J., et al. Prospects for urinary proteomics: exosomes as a source of urinary biomarkers. Nephrology (Carlton). 10 (3), 283-290 (2005).
- Ranghino, A., Dimuccio, V., Papadimitriou, E., Bussolati, B. Extracellular vesicles in the urine: markers and mediators of tissue damage and regeneration. Clinical Kidney Journal. 8 (1), 23-30 (2015).
- Zhang, W., et al. Extracellular vesicles in diagnosis and therapy of kidney diseases. American Journal of Physiology-Renal Physiology. 311 (5), 844-851 (2016).
- Fernandez-Llama, P., et al. Tamm-Horsfall protein and urinary exosome isolation. Kidney International. 77 (8), 736-742 (2010).
- Royo, F., et al. Different EV enrichment methods suitable for clinical settings yield different subpopulations of urinary extracellular vesicles from human samples. Journal of Extracellular Vesicles. 5, 29497 (2016).
- Rider, M. A., Hurwitz, S. N., Meckes, D. G. ExtraPEG: A Polyethylene Glycol-Based Method for Enrichment of Extracellular Vesicles. Scientific Reports. 6, 23978 (2016).
- Lv, C. Y., et al. A PEG-based method for the isolation of urinary exosomes and its application in renal fibrosis diagnostics using cargo miR-29c and miR-21 analysis. International Urology and Nephrology. 50 (5), 973-982 (2018).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Wang, D., Sun, W. Urinary extracellular microvesicles: isolation methods and prospects for urinary proteome. Proteomics. 14 (16), 1922-1932 (2014).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. Journal of Extracellular Vesicles. 4, 25530 (2015).
- van der Pol, E., et al. Standardization of extracellular vesicle measurements by flow cytometry through vesicle diameter approximation. Journal of Thrombosis and Haemostasis. 16 (6), 1236-1245 (2018).
- Huyan, T., Du, Y., Huang, Q., Huang, Q., Li, Q. Uptake Characterization of Tumor Cell-derived Exosomes by Natural Killer Cells. Iranian Journal of Public Health. 47 (6), 803-813 (2018).
- Puzar Dominkus, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (6), 1350-1361 (2018).
- Morales-Kastresana, A., et al. Labeling Extracellular Vesicles for Nanoscale Flow Cytometry. Scientific Reports. 7 (1), 1878 (2017).
- de Rond, L., et al. Comparison of Generic Fluorescent Markers for Detection of Extracellular Vesicles by Flow Cytometry. Clinical Chemistry. 64 (4), 680-689 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved