JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
유세포 분석을 사용한 Urinary Extracellular Vesicles의 크기 측정 및 표현형 분석
요약
이 프로토콜은 유세포 분석을 사용하여 크기 및 표면 마커 발현에 의한 건강한 인간 기증자로부터 요로 세포외 소포체(uEV)를 분리하고 표현형 특성을 분석하는 방법을 설명합니다.
초록
세포외 소포체(EV)는 소변과 같은 체액에서 모든 세포 유형에 의해 분비되는 지질막의 이질적인 복합체입니다. EV는 엑소좀과 같이 직경이 40-100nm에서 미세 소포의 100-1000nm에 이르기까지 다양한 크기일 수 있습니다. 그들은 또한 많은 질병의 예후 및 진단을 위한 바이오마커로 사용할 수 있는 다양한 분자를 포함할 수 있습니다. 이러한 소포를 특성화하기 위해 많은 기술이 개발되었습니다. 그 중 하나가 유세포 분석입니다. 그러나 바이오마커 검출과 함께 EV의 농도를 정량화하고 크기별로 구별하는 방법을 보여주는 기존 보고서는 없습니다. 이 작업은 구성을 수정하지 않고 분석을 위해 기존 세포분석기를 사용하여 요세포외 소포체(uEV)의 분리, 정량화 및 표현형화 절차를 설명하는 것을 목표로 합니다. 이 방법의 한계는 샘플당 최대 4개의 서로 다른 바이오마커를 염색하는 것입니다. 이 방법은 또한 샘플에서 사용할 수 있는 EV의 양에 의해 제한됩니다. 이러한 한계에도 불구하고 이 프로토콜과 후속 분석을 통해 신장 및 뇌 손상과 관련된 질병에서 EV 마커의 농축과 소변 샘플에 존재하는 이러한 소포의 풍부함에 대한 더 많은 정보를 얻을 수 있습니다.
서문
포유류에서 혈액은 신장을 250-300 번 통과하여 여과됩니다. 이 기간 동안 소변이 형성됩니다. 이 생체 유체의 생산은 사구체 여과, 세뇨관 재흡수 및 분비를 포함한 일련의 과정의 결과입니다. 대사 노폐물과 전해질은 소변의 주요 구성 요소입니다. 또한 펩타이드, 기능성 단백질 및 세포외 소포체(EV)와 같은 다른 부산물은 1,2,3,4,5,6으로 배설됩니다. 초기에는 수분 균형 장애를 앓고 있는 환자의 소변 샘플에서 요로 세포외 소포체(uEV)가 확인되었습니다. 이 환자들은 아쿠아포린-2(AQP2)와 같은 분자의 존재를 보였으며, 이 분자는 이 질병의 바이오마커로 사용되었습니다7. 몇 가지 후속 연구는 uEV의 세포 기원을 확인하는 데 초점을 맞추었으며, 이러한 구조가 신장 세포(사구체, 포도사이트 등) 및 기타 세포 유형의 내피 또는 백혈구 계통에 의해 분비될 수 있다고 설명했습니다. 더욱이, uEV의 수와 분자 농축은 많은 질병 및 장애의 상태와 상관 관계가 있을 수 있습니다 8,9,10,11,12,13,14.
전체적으로 EV는 지질 이중층으로 둘러싸여 있고 수동 또는 능동 메커니즘을 통해 세포에 의해 다른 유체로 방출되는 매우 이질적인 입자 제품군을 구성합니다. EV는 기원에 따라 엔도솜 유래 엑소좀 또는 원형질막 유래 미세소포/미세입자로 분류할 수 있습니다. 그러나 이 분류 기준은 입자의 생물 발생이 직접 관찰되는 경우에만 적용될 수 있습니다. 따라서 물리적, 생화학적, 세포 기원을 포함한 다른 사소하지 않은 기준은 이 분야의 여러 연구자들에 의해 승인되었습니다 15,16,17. 분석된 분리물의 특성에 따라 EV 특성화를 위해 다양한 분석 기술이 제안되었습니다. 예를 들어, 대형(≥100nm) 또는 소형(≤100nm) EV의 농축을 기반으로 유세포 분석 또는 나노 입자 추적을 통한 정량화가 각각제안됩니다 18.
요즘에는 많은 질병에 대한 바이오마커로 EV를 사용하는 것이 중요해짐에 따라 다양한 출처에 대한 검색이 조사되고 있습니다. 가장 유망한 공급원 중 하나는 쉽고 비침습적인 방식으로 얻을 수 있는 소변입니다. 따라서 이 프로토콜은 차등 원심분리, 형광 색소 접합 항체를 사용한 처리 및 기존의 2-레이저/4-색 세포분석기를 사용한 다운스트림 분석을 통한 uEV의 분리 절차를 설명합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
인간의 소변 샘플은 기증자 동의서에 서명한 건강한 지원자로부터 채취했습니다. 이러한 절차는 Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán Research Ethics Committee의 승인도 받았습니다.
1. 소변 세포외 소포체의 분리
참고: uEV의 절연 프로토콜은 ref.19에서 수정되었습니다. 그림 1 은 uEV를 격리하기 위한 프로토콜의 표현을 보여줍니다.
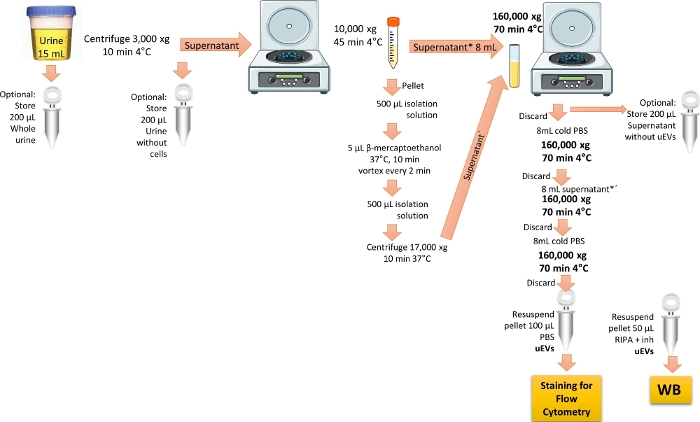
그림 1: 유세포 분석을 위한 uEVs 분리 개요. 이 프로토콜에서는 먼저 하루의 첫 번째 소변을 원심 분리하여 세포와 파편을 제거합니다. 그런 다음 THP 단백질을 제거하는 처리로 큰 소포를 제거하기 위해 원심분리기를 제거하고 마지막으로 초원심분리를 수행하여 한 번의 세척으로 uEV를 농축하고 얻습니다. WB 검증을 위해 소변 분율을 유지하는 단계가 표시되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 건강한 지원자의 첫 아침 소변(15mL)을 사용하십시오. 소변을 3,000 x g 에서 4°C에서 10분 동안 원심분리하여 모든 세포와 찌꺼기를 제거합니다.
참고: 가급적으로 신선한 소변을 사용하십시오. 사용할 수 없는 경우 -20°C에서 최대 3개월 동안 보관하거나 -70°C에서 최대 6개월 동안 보관된 소변을 사용하십시오. 소변 샘플을 얼음 위에서 해동하고 격렬하게 소용돌이칩니다. 얼음 위 또는 4°C에서 모든 절차를 수행합니다. 웨스턴 블롯 분석을 위한 선택적 단계는 중복 튜브를 만들고 첫 번째 아침 소변의 200μL를 별도의 튜브에 분취하는 것입니다. 샘플을 사용할 때까지 -20°C에서 보관하고 "전체 소변"이라고 표시하여 세포 외 소포 마커를 확인합니다. - 1.1단계에서 얻은 상등액을 새로운 15mL 코니컬 원심분리 튜브로 옮긴 다음 4°C에서 45분 동안 10,000 x g 로 원심분리합니다. 상층액을 8mL 폴리카보네이트 초원심분리 튜브에 옮기고 얼음 위에 보존합니다.
참고: 선택적으로, 웨스턴 블롯 분석을 위해 1.1단계에서 얻은 상층액의 200μL를 "세포 없는 소변"으로 표시된 별도의 튜브에 분취합니다.- Tamm-Horsfall 단백질, THP 제거
참고: THP는 소변에 존재하며 개인이 신장 질환이 있을 때 풍부합니다. THP는 uEV에 결합할 수 있기 때문에 uEV의 수율을 감소시키는 것으로 보고되었습니다. 이 단백질을 제거하려면 환원제를 사용해야 합니다 3,6.- 250mM 자당과 10mM 트리에탄올아민을 혼합하여 분리 용액을 준비합니다. pH를 7.6으로 조정합니다.
- 단계 1.2에서 얻은 펠릿을 500μL의 분리 용액과 혼합한 다음 5μL의 β-메르캅토에탄올을 첨가합니다.
- 펠릿 혼합물을 37°C에서 10분 동안 배양하고 2분마다 와류로 배양합니다. 500μL의 분리 용액을 첨가한 다음 17,000 x g 에서 37°C에서 10분 동안 원심분리합니다. 얻어진 상등액(감소된 비응집된 THP 및 uEV 포함)을 수집합니다.
- Tamm-Horsfall 단백질, THP 제거
- 동일한 8mL 폴리카보네이트 초원심분리 튜브에 예약된 상층액(단계 1.2 및 1.2.1.3)을 모두 혼합한 다음 초원심분리기 고정각 로터를 사용하여 160,000 x g 에서 4°C에서 70분 동안 원심분리합니다.
참고: 선택적으로, 웨스턴 블롯 분석을 위해 위에서 얻은 상등액 200μL를 "EV가 없는 상등액"으로 표시하여 보관하십시오. 이 샘플은 세포외 소포 마커를 검색할 때 음성 대조군 역할을 합니다. - 상등액을 버리십시오. 8mL 폴리카보네이트 튜브에 얼음처럼 차가운 1x PBS를 첨가하고 160,000 x g 의 속도로 4°C에서 70분 동안 원심분리합니다.
알림: 펠릿에는 uEV가 포함되어 있으므로 펠릿을 버리지 않도록 주의하십시오. 1x PBS는 최소 0.22μm 공극 주사기 필터로 멸균 및 여과해야 합니다. - 상등액을 버리십시오. 나머지 상층액을 8mL 폴리카보네이트 튜브에 넣고 160,000 x g 에서 4°C에서 70분 동안 원심분리합니다.
- 상등액을 버리고 펠릿에 얼음처럼 차가운 PBS 8mL를 첨가하여 uEV를 세척합니다.
- 상등액을 버리십시오. 펠릿을 건조시킨 다음 얼음처럼 차가운 PBS 1mL로 다시 현탁시킵니다. 사용할 때까지 -70 °C에서 보관하십시오.
참고: 웨스턴 블롯 분석을 수행하는 경우 중복 튜브의 펠릿을 50μL의 RIPA 완충액과 프로테아제 억제제로 재현탁합니다. 사용할 때까지 -20 °C에서 보관하십시오.
2. uEV의 염색
참고: uEV의 염색 및 분석하기 전에 uEV의 적절한 분리를 확인하기 위해MISEV2018 18 에서 권장하는 방법론을 하나 이상 수행하는 것이 중요합니다. 여기에서는 웨스턴 블롯 분석이 설명되어 있습니다. 그림 2 는 uEV 염색에 대한 대표적인 프로토콜을 보여줍니다.
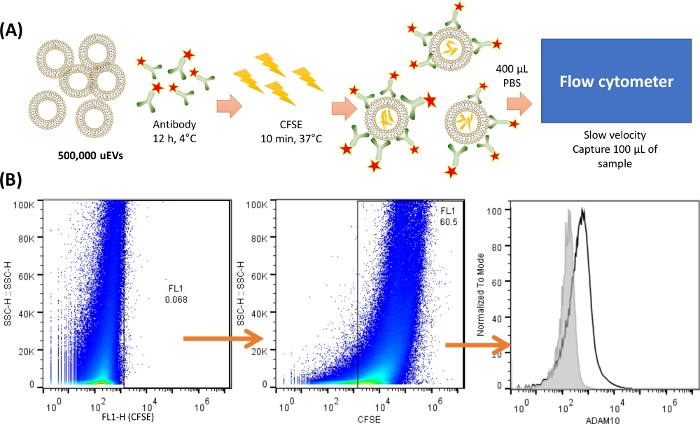
그림 2: 세포분석기에서 uEVs 염색 및 캡처에 대한 개요. (A) uEV 염색의 표현. 500,000 uEVs의 경우, 항체를 혼합하여 4°C에서 12시간 동안 배양하였다. 그런 다음 CFSE를 첨가하고 37°C에서 10분 동안 배양했습니다. uEV는 내부에 CFSE를 가지고 있었고 항체는 항원 표면에 결합합니다. 400 μL의 차가운 PBS를 사용하여 유세포 분석기에서 100 μL의 시료를 느린 속도로 재현탁하고 캡처했습니다. (B) 분석 전략. 첫 번째 도트 플롯(SSC-H VS FL-X)은 uEV에 대한 음성 대조군을 나타내고, 그 다음은 CFSE로 염색된 uEV를 보여주는 점도표이며, 마지막으로 uEV의 항체 염색을 보여주는 히스토그램(검은색 선)은 음성 대조군이 회색선으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- Table of Materials에 언급된 바와 같이 기존의 비색 단백질 분석을 사용하여 단백질 함량을 정량화하여 uEV의 상대적 수를 계산합니다. uEV를 1:5로 희석하고 단백질 분석 키트에 제공된 데이터시트의 지침을 따릅니다.
- 이전에 보고된 공식20에 따라 1μg/mL의 uEVs 단백질이 800,000uEV/μL와 같다고 간주합니다. 20μL의 얼음처럼 차가운 PBS에 500,000uEV가 존재하는지 확인합니다.
- 표 1에 표시된 대로 튜브에 레이블을 지정합니다.
참고: 사용되는 튜브의 수는 사용된 항체의 수에 따라 다르며, 2-레이저/4색 세포분석기의 제한은 사용할 수 있는 튜브당 최대 4개의 항체입니다. 따라서 보상이 필요하지만 세포 분석기에서 FL1, FL2, FL3 및 FL4 만 읽을 수 있습니다. 이러한 절차에서는 유세포 분석을 위해 1.5mL 마이크로 원심분리 튜브 또는 5mL 원형 튜브 튜브를 사용합니다. 필요한 튜브는 표 1에 나와 있습니다. 튜브 4 및 5는 이 프로토콜에 사용되는 모든 항체의 칵테일로 구성됩니다. 두 개의 문제 튜브(8 및 9)가 예로 제공됩니다. 따라서 이 컨트롤 세트에는 각 튜브에 사용할 조합이 있어야 합니다.
| 튜브 1. | 메가믹스 FSC 비즈 | |
| 튜브 2. | PBS (PBS) | |
| 튜브 3. | CFSE를 사용한 PBS | |
| 튜브 4. | 문제 1의 모든 항체를 가진 PBS | |
| 튜브 5. | 문제 2의 모든 항체를 가진 PBS | |
| 튜브 6. | 자가형광 제어 | 시약이 없는 uEV는 PBS에서만 가능합니다. |
| 튜브 7. | #uEVs | CFSE를 사용하는 uEV |
| 튜브 8. | 문제 1 | CD37 FITC, CD53 PE, ADAM10 APC를 갖춘 uEV |
| 튜브 9. | 문제 2 | CD9 FITC, TSPAN33 APC를 갖춘 uEV |
표 1: 튜브 라벨링. 튜브에 레이블을 지정하는 방법을 보여주는 예제. 첫 번째 튜브는 필요한 모든 컨트롤입니다. 항체-형광 색소가 있는 튜브는 염색에 따라 달라집니다.
- 500,000uEV를 함유한 PBS 20μL를 라벨링된 튜브에 추가합니다.
- 이전에 적정한 표 1에 표시된 대로 항체를 추가합니다. 4 °C에서 밤새 배양하십시오.
참고: 염색하기 전에 응집체를 방지하기 위해 4°C에서 최대 속도로 최소 5분 동안 항체를 원심분리하는 것이 좋습니다. 여기에 사용된 항체는 uEV에 존재하는 단백질의 한 예이며 현재 준비 중인 독립적인 원고에 속합니다. - 0.4μL의 카르복시플루오레세인 숙시니미딜 에스테르(CFSE)[5nM]를 튜브 번호 3에 추가합니다. 37 °C에서 10분 동안 배양합니다.
참고: CFSE는 유세포 분석기 분석을 수행할 때 샘플에 존재하는 모든 EV를 염색하고 배경 잡음을 구별하는 데 사용되는 염료입니다. 자세한 내용은 토론 섹션을 참조하십시오. - 모든 튜브에 400μL의 얼음처럼 차가운 1x PBS를 추가합니다.
- 모든 튜브를 4 °C로 유지하십시오.
3. 기존 cytometer를 사용한 uEV 획득
참고: 유세포 분석기 사용 지침( 재료 표 참조)이 여기에 설명되어 있습니다.
- 6 및 8 피크 비드를 사용하여 세포분석기의 품질 보정을 수행합니다.
참고: 마지막 피크의 %CV는 6 미만의 값이어야 합니다. 세포분석기 기술자가 이 작업을 처리합니다. - 유세포 분석기 소프트웨어를 엽니다.
참고: 소프트웨어가 열리면 새 실험이 열리고 96개 샘플에 대한 템플릿, 실행을 위한 매개변수, 점도표 또는 히스토그램을 생성하기 위한 "빈" 섹션이 있는 스크리닝이 표시됩니다. - 실행 중인 소프트웨어의 화면에서 매개변수를 조정합니다: 캡처할 시료 100μL, 느린 실행, 임계값을 FSC-H에서 10,000, SSC-H에서 2,000으로 설정합니다.
참고: 여기에서 권장하는 임계값은 예입니다. 분석된 샘플을 기반으로 임계값을 설정해야 합니다. - 로드 튜브 번호 1(Megamix 튜브), 표 1에 표시된 대로. 구슬을 캡처합니다. Dot Plot 옵션을 클릭하여 소프트웨어 화면의 "빈" 부분에 두 개의 점도표를 만듭니다. 그림 3의 패널 A와 B로 만듭니다.
참고: Megamix 형광 비드(0.1, 0.3, 0.5 및 0.9 μm의 크기를 구분하고 크기에 대한 템플릿을 만드는 데 사용되는 비드)는 FL1(FITC) 검출기를 사용하여 분석할 수 있습니다. 모든 점도표와 히스토그램은 높이 값에 표시되어야 합니다. 가능한 한 많은 이벤트를 기록하십시오. 워크시트를 수정해도 데이터는 변경되지 않습니다.
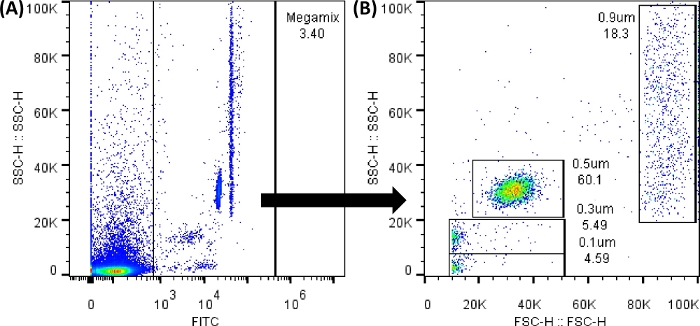
그림 3: Megamix FSC 비드 점도표. 표시된 점도표는 유세포 분석기 소프트웨어를 사용하여 생성되었습니다. 유세포 분석기에서 이미지는 매우 유사합니다. (A) 배경 소음을 피하는 비드를 선택하기 위해 생성된 첫 번째 점도표. (SSC-H 대 FL1-H). (B) 이전 게이트의 선택에 의해 생성된 도트 플롯으로, 비드의 다양한 크기를 보여줍니다. (SSC-H 대 FSC-H). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 소프트웨어 화면의 "빈" 섹션에서 사용된 각 형광 색소에 대한 점도표와 히스토그램을 만듭니다. 보충 그림 1 의 알고리즘을 예로 들어 보겠습니다. 이렇게 하려면 각 형광 색소에 대한 Dot Plot 또는 Histogram 옵션을 클릭합니다.
알림: 그림 3A와 같이 배경 소음은 항상 존재합니다. FL1(x축)의 0에서 1,000 사이의 모든 점은 생성된 게이트 외부에 있습니다. 따라서 적절한 결과를 얻으려면 모든 제어 튜브를 사용하는 것이 중요합니다. 모든 튜브 로딩 사이에 피복 유체를 역세척하고 막힘 제거 사이클을 수행합니다. 적재하기 전에 모든 튜브를 부드럽게 흔듭니다. 5개의 튜브를 연속으로 로드한 후 100μL의 PBS 1x를 실행합니다. - 튜브 번호 2와 5를 로드하여 컷오프 값(음수)을 설정합니다. 이렇게 하려면 Rectangle Gate 아이콘(생성된 도트 플롯 아래에 있음) 또는 Line Gate 아이콘(생성된 히스토그램 아래에 있음)을 선택합니다. 그리고 신호가 없는 곳에 배치하여 보충 그림 1에 표시된 것과 같은 점도표와 히스토그램을 얻습니다.
참고: 이 모든 튜브는 103 (1,500) 이상의 "형광"이 없기 때문에 0.70% 이하의 양극 영역을 배치해야 합니다. 이 영역보다 더 먼 곳에 형광이 있으면 사용된 시약을 희석하십시오. 따라서 최종 측정 전에 시약을 역가시키는 것이 중요합니다. - 로드 튜브 번호 6(자가형광 튜브)을 사용하여 샘플의 음극 영역을 설정합니다. 이렇게 하려면 Rectangle Gate 아이콘(생성된 도트 플롯 아래에 있음) 또는 Line Gate 아이콘(생성된 히스토그램 아래에 있음)을 선택합니다. 신호가 없는 곳에 놓으십시오.
- 다음 튜브(튜브 7-9, 표 1 참조)를 로드합니다.
- 실험을 저장합니다.
참고: 여기에 사용된 세포 분석기 소프트웨어의 경우 실험 저장 명령은 생성된 데이터를 저장하는 것을 의미합니다. 즉, 유세포 분석기에 의해 수집된 모든 튜브와 각 튜브에 대해 생성된 데이터를 저장해야 합니다. 이렇게 하려면 실험 저장 버튼을 클릭해야 합니다. - 데이터를 FSC 파일로 내보냅니다.
4. 유세포 분석기 소프트웨어를 사용한 데이터 분석.
참고: 재료 표에 표시된 유세포 분석기 소프트웨어 사용 지침은 이 섹션에 설명되어 있습니다. 그림 4 는 크기 게이트를 만드는 단계가 있는 작업 공간을 보여줍니다.
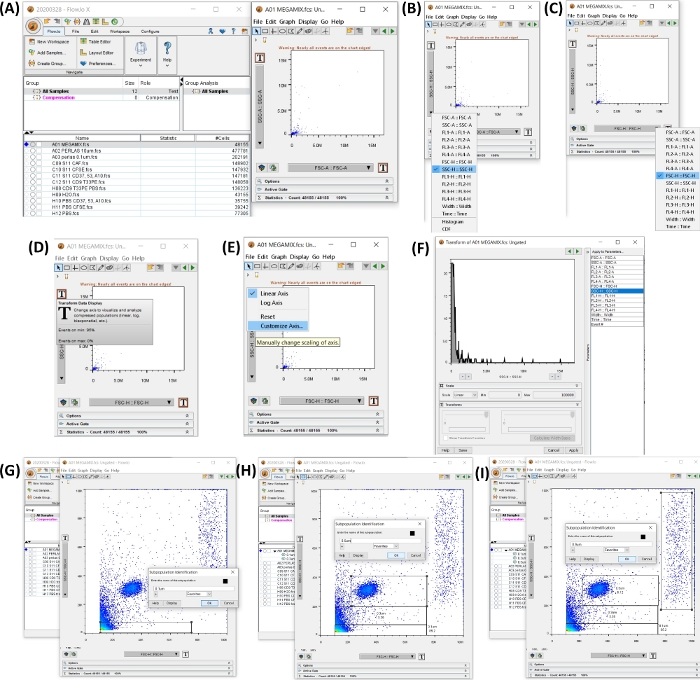
그림 4: 데이터 분석을 시작하기 위한 모든 단계가 있는 작업 공간. 모든 이미지는 작업 공간의 스크린 인쇄로 생성되었습니다. (A) 추가된 샘플 데이터로 생성된 작업 공간(왼쪽), 튜브 1, FSC 비드 선택으로 생성된 도트 플롯(오른쪽). (B,C)는 SSC-H 및 FSC-H를 갖도록 축의 변형을 보여줍니다. (D-F) 두 축의 단계별 사용자 정의를 보여줍니다. (G-I)는 다양한 비드 크기의 선택 및 생성을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 유세포 분석기 소프트웨어를 엽니다. Add Samples 버튼을 클릭하여 샘플을 추가하고 내보낸 FCS 파일을 선택합니다.
- Megamix 튜브를 클릭하여 도트 플롯 SSC-H(y축) VS FSC-H(x축)를 엽니다. T 버튼(Transform Data Display)을 클릭하고, Customize Axis(축 사용자 지정)를 클릭하고, SSC-H 또는 FSSC-H를 클릭하고 스케일 값을 최소 0 및 최대 100,000으로 변경하여 두 축을 모두 0에서 100,000까지 표시합니다(그림 4AF 참조).
- 4.2단계에서 생성된 도트 플롯에서 0.1, 0.3, 0.5 및 0.9μm에 대한 게이트를 설정합니다. Rectangle Gate 버튼을 선택하여 그림 4G-I와 같이 게이트를 생성합니다.
참고: 그림 5 는 양의 영역을 만들고 형광 색소에 대한 Mean Intensity를 얻는 단계가 있는 작업 공간을 보여줍니다.

그림 5: 얻은 데이터를 분석하기 위한 작업 공간. 모든 이미지는 작업 공간의 스크린 인쇄로 생성되었습니다. (A) 모든 샘플에 적용된 크기 게이트로 생성된 작업 공간. (B) 선택한 자가형광관, 크기 게이트를 보여주는 도트 플롯 및 선택한 크기(0.1μm)에 대한 히스토그램을 사용하여 각 형광 색소 및 크기에 대한 포지티브 게이트를 얻습니다. (C) 각 형광 색소 및 크기에 대한 포지티브 게이트로 생성된 작업 공간. 샘플에 대해 생성된 (D) 작업 공간(왼쪽)과 레이아웃 편집기(오른쪽). 레이아웃 편집기에는 FL1-H에 대한 자가형광관 및 포지티브 튜브에 대한 히스토그램과 이를 수정하기 위해 속성 패널을 가져오는 방법이 표시됩니다. (E) 이미지는 평균 강도 형광 값을 얻는 방법을 보여줍니다. (F) 세 가지 다른 형광 색소에 대해 생성된 히스토그램으로, 소프트웨어가 통계 정보로 수행할 수 있는 모든 변경 사항을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 생성된 게이트(0.1, 0.3, 0.5 및 0.9μm)를 모든 샘플에 적용합니다. Gates(게이트)를 선택하고 그림 5A와 같이 All Samples(모든 샘플) 옵션으로 끌어다 놓습니다.
- 자가형광관을 클릭합니다. 각 크기에 대해 각 형광 색소에 대한 양의 영역을 설정합니다. 게이트 크기가 있는 도트 플롯 SSC-H VS FSC-H를 열고 단일 게이트 크기를 클릭합니다. 새 창에서 y축을 클릭하여 히스토그램 옵션을 선택합니다. x축에서 FL1-H를 선택한 다음, 범위 아이콘을 선택하여 양수 영역을 만듭니다. FL2-H 및 FL4-H에 대해 작업을 반복합니다(그림 5B 참조).
- 모든 샘플에 게이트를 적용합니다. Gates를 선택하고 그림 5C와 같이 All Samples 옵션으로 끌어다 놓습니다.
- Layout Editor를 엽니다.
- 편집기에서 각 샘플을 끌어다 놓습니다. "자가형광" 튜브의 크기를 선택하고 드래그 앤 드롭한 다음 동일한 크기의 염색된 튜브를 선택하고 드래그 앤 드롭합니다.
- 히스토그램에서 오른쪽 하단을 클릭합니다. 속성 메뉴를 엽니다. 범례를 클릭합니다. 형광 색소의 평균 강도를 추가합니다.
참고: 속성에는 히스토그램의 모양을 수정하는 데 사용할 수 있는 다른 도구가 있습니다. - 나머지 형광 색소와 크기에 대해 동일한 절차를 반복합니다.
5. 샘플당 uEV 수를 얻기 위한 분석.
참고: 그림 6 은 샘플당 uEV 수를 구하는 단계가 있는 작업 공간을 보여줍니다.
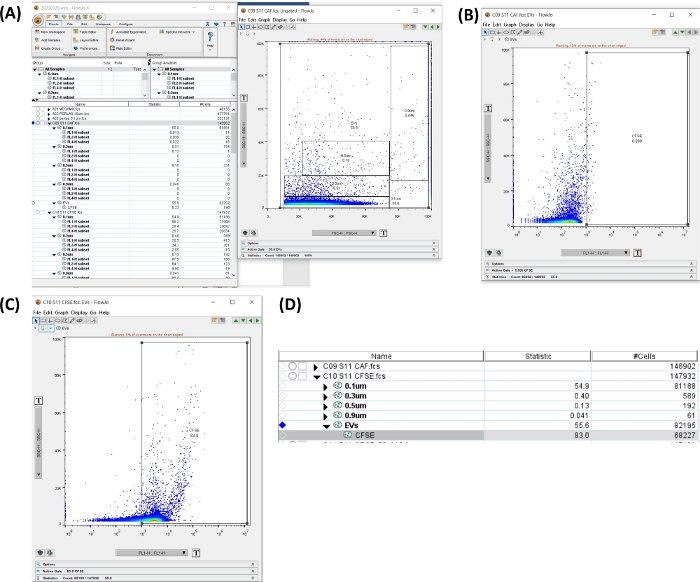
그림 6: CFSE 튜브를 분석하기 위한 작업 공간. 모든 이미지는 작업 공간의 스크린 인쇄로 생성되었습니다. (A) 모든 크기, 영역, uEVs 총계(왼쪽), 선택한 게이트를 보여주는 도트 플롯(오른쪽)을 선택하여 생성된 작업 공간. (B) 자가형광관의 CFSE 음성 영역에 대한 도트 플롯 SSC-H 대 FL1-H. (C) 염색 튜브의 CFSE에 대한 도트 플롯 SSC-H 대 FL1-H. (D) CFSE 염색 통계와 함께 얻은 표의 이미지로, 샘플 내 uEV의 수를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 자가형광관을 클릭합니다. 크기 게이트가 있는 SSC-H 대 FSC-H의 점도표에서 모든 크기를 포함하는 영역을 만듭니다. 새 지역을 클릭합니다. 양의 영역을 설정합니다(그림 6A,B 참조).
- 모든 샘플에 게이트를 적용합니다. 게이트를 선택하고 All Samples 옵션에서 끌어다 놓습니다.
- CFSE + uEVs 튜브를 클릭합니다. 새 영역을 열고 그림 6C와 같이 CFSE(FL1-H)에 대한 양성 영역을 확인합니다.
- 그림 6D의 작업 공간에서 튜브에 대한 # cells 데이터를 복사합니다. 이 숫자는 유세포 분석법(#uEVs FC)으로 얻은 #uEVs입니다.
- 다음 공식을 적용하여 마이크로리터당 uEV의 수를 계산합니다.
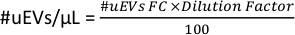
- 각 형광 색소(#uEVs/μL FLX)에 대해 마이크로리터당 #uEVs 지정하려면 작업 공간에서 FLX-H 부분 집합에 대한 통계량을 복사하고, 이 숫자는 백분율(%FLX 부분 집합)입니다.
- 다음 공식을 적용하여 각 형광 색소에 대한 마이크로리터당 uEV 수를 계산합니다.
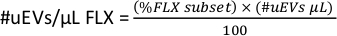
알림: 선택한 게이트가 한 가지 크기인지 아니면 모든 uEV에 대한 게이트인지에 따라 선택한 데이터를 확인합니다.
Access restricted. Please log in or start a trial to view this content.
결과
프로토콜을 통해, 그리고 uEV를 염색하기 전에 여러 체크포인트가 있습니다. 따라서 먼저 uEV 추출물에 존재하는 단백질의 양을 확인하는 것이 중요합니다. 세포외 소포체를 다루는 모든 연구 그룹은 2.1단계에서 설명한 것처럼 단백질을 정량화합니다. 보충 그림 2 는 웰 4E, 5E 및 6E에서 uEV 분획을 포함하는 대표적인 96 웰 플레이트를 보여줍니다. 웰 1A, 2A 및 3A는...
Access restricted. Please log in or start a trial to view this content.
토론
요즘에는 여러 질병에 대한 바이오마커로 세포 외 소포체의 사용이 증가했으며, 특히 소변과 같은 비침습적 소스에서 분리할 수 있는 질병의 경우 5,21,22,23,24. uEV의 격리는 건강한 개인의 상태와 여러 질병을 앓고 있는 환자의 진단/예후를 아는 데 ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 잠재적인 이해 상충으로 해석될 수 있는 재정적 또는 상업적 관계가 없는 상태에서 연구가 수행되었다고 선언합니다.
감사의 말
이 작업은 CONACyT(A3-S-36875) 및 UNAM-DGAPA-PAPIIT 프로그램(IN213020 및 IA202318)의 보조금으로 지원되었습니다. NH-I는 CONACyT의 펠로우십 587790의 지원을 받았습니다.
저자는 이 프로토콜의 실현을 위해 귀중한 조언을 해준 Leopoldo Flores-Romo†, Vianney Ortiz-Navarrete, Antony Boucard Jr 및 Diana Gómez-Martin과 소변 샘플에 대해 모든 건강한 개인에게 감사를 표합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| APC anti human CD156c (ADAM10) antibody | BioLegend | 352706 | Add 5 µL to the 20 µL of uEVs in PBS |
| APC anti human TSPAN33 (BAAM) antibody | BioLegend | 395406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Avanti centrifuge with JA-25.5O fixed angle rotor | Beckamn Coulter | J-26S XPI | |
| BD Accuri C6 Flow Cytometer | BD Biosciences | ||
| β-mercaptoethanol | SIGMA-Aldrich | M3148 | |
| Benchtop centrifuge with A-4-44 rotor | Eppendorf | 5804 | |
| BLUEstain 2 protein ladder | GOLDBIO | P008 | |
| CD9 (C-4) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-13118 | |
| CD63 (MX-49.129.5) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-5275 | |
| Cell Trace CFSE cell proliferation kit for flow cytometry | Thermo Scientific | C34554 | |
| Chemidoc XRS+ system | BIORAD | 5837 | |
| FITC anti human CD9 antibody | BioLegend | 312104 | Add 5 µL to the 20 µL of uEVs in PBS |
| FITC anti human CD37 antibody | BioLegend | 356304 | Add 5 µL to the 20 µL of uEVs in PBS |
| Fluorescent yellow particles | Spherotech | FP-0252-2 | |
| Fluorescent yellow particles | Spherotech | FP-0552-2 | |
| Fluorescent yellow particles | Spherotech | FP-1552-2 | |
| FlowJo Software | Becton, Dickinson and Company | ||
| Goat anti-mouse immunoglobulins/HRP | Dako | P0447 | |
| Halt protease inhibitor cocktail | Thermo Scientific | 78429 | |
| Immun-Blot PVDF membrane 0.22µm | BIORAD | 1620177 | |
| Megamix-Plus FSC beads | COSMO BIO CO.LTD | 7802 | |
| NuPAGE LDS sample buffer 4X | Thermo Scientific | NP0007 | |
| Optima ultracentrifuge with rotor 90Ti fixed angle 355530 | Beckamn Coulter | XPN100 | |
| Page Blue protein staining solution | Thermo Scientific | 24620 | |
| PE anti human CD53 antibody | BioLegend | 325406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Pierce BCA Protein assay kit | Thermo Scientific | 23227 | |
| Pierce RIPA buffer | Thermo Scientific | 89900 | |
| Polycarbonate thick wall centrifuge tubes | Beckamn Coulter | 355630 | |
| Spherotech 8-Peak validation beads (FL1-FL3) | BD Accuri | 653144 | |
| Spherotech 6-Peak validation beads (FL4) | BD Accuri | 653145 | |
| Sucrose | SIGMA-Aldrich | 59378 | |
| Triethanolamine | SIGMA-Aldrich | 90279 |
참고문헌
- Decramer, S., et al. Urine in clinical proteomics. Molecular & Cellular Proteomics. 7 (10), 1850-1862 (2008).
- Nawaz, M., et al. The emerging role of extracellular vesicles as biomarkers for urogenital cancers. Nature Reviews Urology. 11 (12), 688-701 (2014).
- Pisitkun, T., Johnstone, R., Knepper, M. A. Discovery of urinary biomarkers. Molecular & Cellular Proteomics. 5 (10), 1760-1771 (2006).
- Urinology Think Tank Writing Group. Urine: Waste product or biologically active tissue. Neurourology and Urodynamics. 37 (3), 1162-1168 (2018).
- Wang, S., Kojima, K., Mobley, J. A., West, A. B. Proteomic analysis of urinary extracellular vesicles reveal biomarkers for neurologic disease. EBioMedicine. 45, 351-361 (2019).
- Merchant, M. L., Rood, I. M., Deegens, J. K. J., Klein, J. B. Isolation and characterization of urinary extracellular vesicles: implications for biomarker discovery. International Urology and Nephrology. 13 (12), 731-749 (2017).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Jing, H., et al. The role of extracellular vesicles in renal fibrosis. Cell Death and Disease. 10 (5), 367(2019).
- Liu, X., et al. Tubule-derived exosomes play a central role in fibroblast activation and kidney fibrosis. Kidney International. 97 (6), 1181-1195 (2020).
- Quaglia, M., et al. Extracellular Vesicles as Mediators of Cellular Crosstalk Between Immune System and Kidney Graft. Frontiers in Immunology. 11, 74(2020).
- Simpson, R. J., Lim, J. W., Moritz, R. L., Mathivanan, S. Exosomes: proteomic insights and diagnostic potential. Expert Review of Proteomics. 6 (3), 267-283 (2009).
- Street, J. M., Koritzinsky, E. H., Glispie, D. M., Star, R. A., Yuen, P. S. Urine Exosomes: An Emerging Trove of Biomarkers. Advances in Clinical Chemistry. 78, 103-122 (2017).
- Thongboonkerd, V. Roles for Exosome in Various Kidney Diseases and Disorders. Frontiers in Pharmacology. 10, 1655(2019).
- Watanabe, Y., et al. Molecular Network Analysis of the Urinary Proteome of Alzheimer's Disease Patients. Dementia and Geriatric Cognitive Disorders Extra. 9 (1), 53-65 (2019).
- Jadli, A. S., Ballasy, N., Edalat, P., Patel, V. B. Inside(sight) of tiny communicator: exosome biogenesis, secretion, and uptake. Molecular and Cellular Biochemistry. 467 (1-2), 77-94 (2020).
- Svenningsen, P., Sabaratnam, R., Jensen, B. L. Urinary extracellular vesicles: Origin, role as intercellular messengers and biomarkers; efficient sorting and potential treatment options. Acta Physiologica. 228 (1), 13346(2020).
- Witwer, K. W., Thery, C. Extracellular vesicles or exosomes? On primacy, precision, and popularity influencing a choice of nomenclature. Journal of Extracellular Vesicles. 8 (1), 1648167(2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Perez-Hernandez, J., et al. Increased Urinary Exosomal MicroRNAs in Patients with Systemic Lupus Erythematosus. PLoS One. 10 (9), 0138618(2015).
- Freyssinet, J. M., Toti, F. Membrane microparticle determination: at least seeing what's being sized. Journal of Thrombosis and Haemostasis. 8 (2), 311-314 (2010).
- D'Anca, M., et al. Exosome Determinants of Physiological Aging and Age-Related Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 11, 232(2019).
- Lawson, C., Vicencio, J. M., Yellon, D. M., Davidson, S. M. Microvesicles and exosomes: new players in metabolic and cardiovascular disease. Journal of Endocrinology. 228 (2), 57-71 (2016).
- Lee, S., Mankhong, S., Kang, J. H. Extracellular Vesicle as a Source of Alzheimer's Biomarkers: Opportunities and Challenges. International Journal of Molecular Sciences. 20 (7), (2019).
- Mori, M. A., Ludwig, R. G., Garcia-Martin, R., Brandao, B. B., Kahn, C. R. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. Cell Metabolism. 30 (4), 656-673 (2019).
- Hoorn, E. J., et al. Prospects for urinary proteomics: exosomes as a source of urinary biomarkers. Nephrology (Carlton). 10 (3), 283-290 (2005).
- Ranghino, A., Dimuccio, V., Papadimitriou, E., Bussolati, B. Extracellular vesicles in the urine: markers and mediators of tissue damage and regeneration. Clinical Kidney Journal. 8 (1), 23-30 (2015).
- Zhang, W., et al. Extracellular vesicles in diagnosis and therapy of kidney diseases. American Journal of Physiology-Renal Physiology. 311 (5), 844-851 (2016).
- Fernandez-Llama, P., et al. Tamm-Horsfall protein and urinary exosome isolation. Kidney International. 77 (8), 736-742 (2010).
- Royo, F., et al. Different EV enrichment methods suitable for clinical settings yield different subpopulations of urinary extracellular vesicles from human samples. Journal of Extracellular Vesicles. 5, 29497(2016).
- Rider, M. A., Hurwitz, S. N., Meckes, D. G. ExtraPEG: A Polyethylene Glycol-Based Method for Enrichment of Extracellular Vesicles. Scientific Reports. 6, 23978(2016).
- Lv, C. Y., et al. A PEG-based method for the isolation of urinary exosomes and its application in renal fibrosis diagnostics using cargo miR-29c and miR-21 analysis. International Urology and Nephrology. 50 (5), 973-982 (2018).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Wang, D., Sun, W. Urinary extracellular microvesicles: isolation methods and prospects for urinary proteome. Proteomics. 14 (16), 1922-1932 (2014).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. Journal of Extracellular Vesicles. 4, 25530(2015).
- van der Pol, E., et al. Standardization of extracellular vesicle measurements by flow cytometry through vesicle diameter approximation. Journal of Thrombosis and Haemostasis. 16 (6), 1236-1245 (2018).
- Huyan, T., Du, Y., Huang, Q., Huang, Q., Li, Q. Uptake Characterization of Tumor Cell-derived Exosomes by Natural Killer Cells. Iranian Journal of Public Health. 47 (6), 803-813 (2018).
- Puzar Dominkus, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (6), 1350-1361 (2018).
- Morales-Kastresana, A., et al. Labeling Extracellular Vesicles for Nanoscale Flow Cytometry. Scientific Reports. 7 (1), 1878(2017).
- de Rond, L., et al. Comparison of Generic Fluorescent Markers for Detection of Extracellular Vesicles by Flow Cytometry. Clinical Chemistry. 64 (4), 680-689 (2018).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유