需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
使用流式细胞术测定尿细胞外囊泡的大小和表型分析
摘要
该方案描述了一种从健康人类供体中分离尿细胞外囊泡 uEV 的方法,以及使用流式细胞术通过大小和表面标志物表达来表征其表型特征。
摘要
细胞外囊泡 (EV) 是一种异质的脂质膜复合物,由任何细胞类型在任何液体(如尿液)中分泌。EV 可以具有不同的大小,直径从 40-100 nm(例如外泌体)到微泡中的 100-1000 nm。它们还可以包含不同的分子,这些分子可用作许多疾病预后和诊断的生物标志物。已经开发了许多技术来表征这些囊泡。其中之一是流式细胞术。然而,目前还没有报告显示如何量化 EV 的浓度并按大小区分它们,以及生物标志物检测。这项工作旨在描述一种分离、定量和表型化尿细胞外囊泡 uEV 的程序,使用常规细胞仪进行分析,而无需对其配置进行任何修改。该方法的局限性包括每个样品最多对四种不同的生物标志物进行染色。该方法还受到样本中可用 EV 数量的限制。尽管存在这些限制,但通过该方案及其后续分析,我们可以获得有关涉及肾脏和脑损伤的疾病中 EV 标志物的富集以及尿液样本中存在的这些囊泡丰度的更多信息。
引言
在哺乳动物中,血液通过肾脏过滤 250 - 300 次;在此期间,会形成尿液。这种生物流体的产生是一系列过程的结果,包括肾小球过滤、肾小管重吸收和分泌。代谢废物和电解质是尿液的主要成分。此外,肽、功能性蛋白和细胞外囊泡 (EV) 等其他副产物也会被排泄 1,2,3,4,5,6。最初,在水平衡障碍患者的尿液样本中鉴定出尿细胞外囊泡 (uEV)。这些患者显示存在水通道蛋白 2 (AQP2) 等分子,然后用作该疾病的生物标志物7。随后的几项研究侧重于确定 uEV 的细胞起源,描述了这些结构可以由肾细胞(肾小球、足细胞等)和其他细胞类型的内皮或白细胞系分泌。此外,uEV 的数量和分子富集可能与许多疾病和病症的状态相关 8,9,10,11,12,13,14。
总而言之,EV 构成了一个高度异质的颗粒家族,这些颗粒由脂质双层封闭,并由细胞通过被动或主动机制释放到不同的液体中。根据它们的来源,EV 可分为内体起源的外泌体或质膜衍生的微囊泡/微粒。然而,只有当直接观察到颗粒的生物发生时,才能应用此分类标准。因此,其他重要的标准,包括物理、生化和细胞起源,已经得到了该领域几位研究人员的认可 15,16,17。根据所分析的分离物的性质,建议采用不同的分析技术进行 EV 表征。例如,基于大 (≥100 nm) 或小 (≤100 nm) EV 的富集,建议通过流式细胞术或纳米颗粒示踪分别进行定量18。
如今,使用 EV 作为许多疾病的生物标志物已变得相关,因此研究了不同来源的搜索。最有前途的来源之一是尿液,因为它可以通过简单且无创的方式获得。因此,该方案描述了通过差异离心、使用荧光染料偶联抗体处理以及使用常规 2 激光/4 色细胞仪进行下游分析来分离 uEV 的程序。
Access restricted. Please log in or start a trial to view this content.
研究方案
人类尿液样本来自签署捐赠者知情同意书的健康志愿者。这些程序也得到了萨尔瓦多-祖比兰国家科学和营养研究所研究伦理委员会的批准。
1. 分离尿细胞外囊泡
注意:uEV 的隔离协议是从参考文献 19 修改而来的。 图 1 描述了隔离 uEV 的协议的表示。
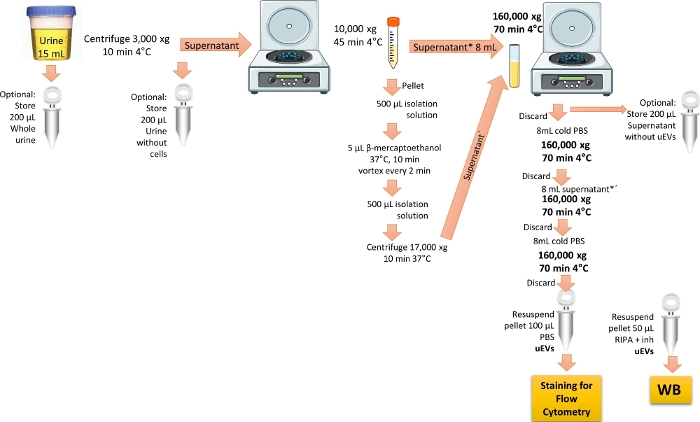
图 1:用于流式细胞术分析的 uEV 分离概述。 在该方案中,首先离心当天的第一次尿液以去除细胞和碎片。然后离心以去除大囊泡,处理以去除 THP 蛋白,最后进行超速离心以富集并通过单次洗涤获得 uEV。标记了为 WB 验证保留尿液分数的步骤。 请单击此处查看此图的较大版本。
- 使用健康志愿者的第一次早晨尿液 (15 mL)。将尿液在 4 °C 下以 3,000 x g 离心 10 分钟,以去除所有细胞和碎片。
注意:优先使用新鲜尿液;如果没有,请使用在 -20 °C 下最多储存 3 个月的尿液,或在 -70 °C 下最多储存 6 个月。 在冰上解冻尿液样本并剧烈涡旋。在冰上或 4 °C 下执行所有程序。 蛋白质印迹分析的一个可选步骤是制作一个重复的试管,并将 200 μL 的第一天早上尿液分装在单独的试管中。将样品储存在 -20 °C 直至使用,将其标记为“全尿”,以检查细胞外囊泡标志物。 - 将步骤 1.1 中获得的上清液转移到新的 15 mL 锥形离心管中,然后在 4 °C 下以 10,000 x g 离心 45 分钟。 将上清液转移到 8 mL 聚碳酸酯超速离心管中,并将其保存在冰上。
注:或者,将步骤 1.1 中获得的 200 μL 上清液分装在标记为“无细胞尿液”的单独试管中,用于 Western 印迹分析。- 去除 Tamm-Horsfall 蛋白 THP
注意:THP 存在于尿液中,当个体患有肾脏疾病时会富集。据报道,THP 会降低 uEV 的产量,因为它可以与 uEV 结合。要去除这种蛋白质,必须使用还原剂 3,6。- 通过将 250 mM 蔗糖与 10 mM 三乙醇胺混合来制备分离溶液。将 pH 值调节至 7.6。
- 将步骤 1.2 中获得的沉淀与 500 μL 分离溶液混合,然后加入 5 μL β-巯基乙醇。
- 将沉淀混合物在 37 °C 下孵育 10 分钟,每 2 分钟涡旋一次。加入 500 μL 分离溶液,然后在 37 °C 下以 17,000 x g 离心 10 分钟。 收集获得的上清液(包含减少的非聚集 THP 和 uEV)。
- 去除 Tamm-Horsfall 蛋白 THP
- 将保留的上清液(来自步骤 1.2 和 1.2.1.3)混合在同一个 8 mL 聚碳酸酯超速离心管中,然后在 4 °C 下以 160,000 x g 离心 70 分钟,使用超速离心机固定角转子。
注意:或者,对于蛋白质印迹分析,储存 200 μL 上面获得的上清液,将其标记为“不含 EV 的上清液”。该样品将用作搜索细胞外囊泡标志物时的阴性对照。 - 丢弃上清液。将冰冷的 1x PBS 添加到 8 mL 聚碳酸酯管中,并在 4 °C 下以 160,000 x g 离心 70 分钟。
注意: 小心不要丢弃颗粒,因为它包含 uEV。1x PBS 需要用至少 0.22 μm 孔径的注射器过滤器进行消毒和过滤。 - 丢弃上清液。将剩余的上清液加入 8 mL 聚碳酸酯管中,并在 4 °C 下以 160,000 x g 离心 70 分钟。
- 弃去上清液,向沉淀中加入 8 mL 冰冷的 PBS 以洗涤 uEV。
- 丢弃上清液。让沉淀干燥,然后用 1 mL 冰冷的 PBS 重悬。在 -70 °C 下储存直至使用。
注:如果进行蛋白质印迹分析,请用 50 μL RIPA 缓冲液和蛋白酶抑制剂重悬重复管的沉淀。在 -20 °C 下储存直至使用。
2. uEV 的染色
注意:在对 uEV 进行染色和分析之前,必须至少执行 MISEV201818 推荐的一种方法,以验证 uEV 的正确分离;这里描述了 Western blot 分析。 图 2 显示了 uEV 染色的代表性方案。
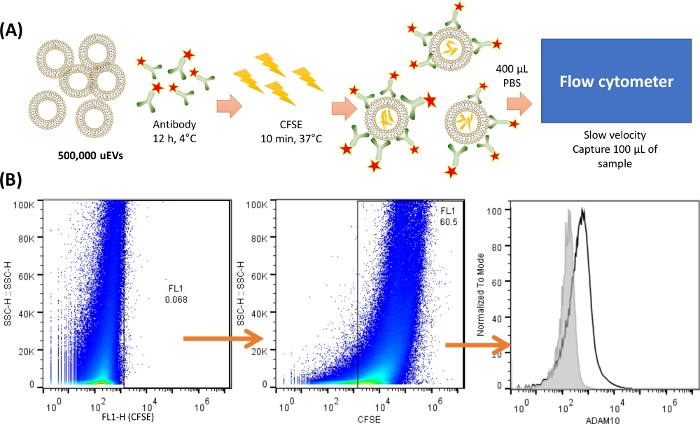
图 2:细胞仪中 uEV 染色和捕获的概述。 (A) uEV 染色的表示。对于 500,000 个 uEV,将抗体混合并在 4 °C 下孵育 12 小时。然后加入 CFSE 并在 37 °C 下孵育 10 分钟。uEV 内部有 CFSE,抗体会结合到抗原表面。使用 400 μL 冷 PBS 重悬并在流式细胞仪中以慢速捕获 100 μL 样品。(B) 分析策略。第一个点图(SSC-H VS FL-X)描述了 uEV 的阴性对照,然后是显示 uEV 用 CFSE 染色的点图,最后是带有 uEV 抗体染色的直方图(黑线),阴性对照显示在灰线中。 请单击此处查看此图的较大版本。
- 通过使用任何常规比色蛋白质测定法定量蛋白质含量来计算 uEV 的相对数量,如 材料表中所述。对 uEV 进行 1:5 稀释,并按照检测蛋白试剂盒中提供的数据表的说明进行作。
- 根据先前报道的公式20,假设 1 μg/mL 的 uEVs 蛋白等于 800,000 uEV/μL。确保 500,000 个 uEV 存在于 20 μL 冰冷的 PBS 中。
- 标记试管,如 表 1 所示。
注:使用的试管数量取决于所采用的抗体数量,2 激光器/4 色细胞仪的限制是每管最多可使用 4 个抗体;因此,尽管需要补偿,但只能读取细胞仪中的 FL1、FL2、FL3 和 FL4。对于这些程序,使用 1.5 mL 微量离心管或 5 mL 圆底管进行流式细胞分析。 表 1 中描述了所需的管子。试管 4 和 5 由本实验步骤中使用的所有抗体的混合物组成。以两个问题管(8 和 9)为例;因此,这组对照必须具有要在每根管中使用的组合。
| 管 1. | Megamix FSC 微珠 | |
| 管 2. | PBS 系列 | |
| 管 3. | 含 CFSE 的 PBS | |
| 管 4. | 含问题 1 的所有抗体的 PBS | |
| 管 5. | 含问题 2 的所有抗体的 PBS | |
| 管 6. | 自发荧光控制 | 不含任何试剂的 uEV,仅在 PBS 中。 |
| 管 7. | #uEVs | 带 CFSE 的 uEV |
| 管 8. | 问题 1 | 具有 CD37 FITC、CD53 PE、ADAM10 APC 的 uEV |
| 管 9. | 问题 2 | 具有 CD9 FITC 的 uEV,TSPAN33 APC |
表 1:试管标记。 显示如何标记管的示例。第一根管子是所需的所有控件。带有抗体荧光染料的试管将取决于染色。
- 将 20 μL 含有 500,000 个 uEV 的 PBS 添加到标记的试管中。
- 如 表 1 所示添加抗体,之前滴定。在 4 °C 下孵育过夜。
注:染色前,建议将抗体在 4 °C 下全速离心至少 5 分钟,以防止聚集。此处使用的抗体是 uEV 中存在的蛋白质的一个例子,属于目前正在准备的独立手稿。 - 将 0.4 μL 羧基荧光素琥珀酰亚胺酯 (CFSE) [5 nM] 添加到 3 号试管中。在 37 °C 下孵育 10 分钟。
注:CFSE 是一种染料,用于对样品中存在的所有 EV 进行染色,并在进行流式细胞仪分析时区分背景噪声。有关更多信息,请参阅 讨论 部分。 - 向所有试管中加入 400 μL 冰冷的 1x PBS。
- 将所有试管保持在 4 °C。
3. 使用传统细胞仪采集 uEV
注:此处描述了流式细胞仪的使用说明(参见 材料表)。
- 使用 6 峰和 8 峰珠子对细胞仪进行质量校准。
注:最后一个峰的 %CV 值必须小于 6;细胞仪技术人员将负责此作。 - 打开流式细胞仪软件。
注:软件打开后,将打开一个新的实验,显示带有 96 个样品模板的筛选、运行参数以及用于创建点图或直方图的“空”部分。 - 调整正在运行的软件屏幕上的参数:100 μL 样品捕获,慢速运行,在 FSC-H 上将阈值设置为 10,000,在 SSC-H 上设置为 2,000。
注意:此处建议的阈值是一个示例;需要根据分析的样本设置阈值。 - 加载 1 号管(Megamix 管),如 表 1 所示。捕获磁珠。通过单击 点 图 选项,在软件屏幕的 “空 ”部分创建两个点图。创建图 3 的面板 A 和 B。
注:Megamix 荧光微珠(用于界定 0.1、0.3、0.5 和 0.9 μm 大小的微珠,并创建大小模板)可以使用 FL1 (FITC) 检测器进行分析。所有点图和直方图都需要以高度值显示。记录尽可能多的事件;工作表中的任何修改都不会更改数据。
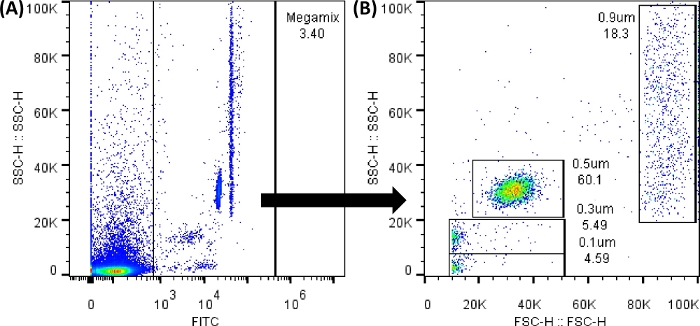
图 3:Megamix FSC 微珠点图。 显示的点图是使用流式细胞仪软件生成的;在流式细胞仪中,图像将非常相似。(A) 为选择磁珠而生成的第一个点图,避免了背景噪声。(SSC-H 与 FL1-H)。(B) 选择前一个浇口生成的点图,显示了微珠的不同大小。(SSC-H 与 FSC-H)。 请单击此处查看此图的较大版本。
- 在软件屏幕的“空”部分中,为使用的每种荧光染料创建点图和直方图;以 补充图 1 中的算法为例。为此,请单击每个荧光染料的 Dot Plot 或 Histogram 选项。
注意:背景噪声将始终存在,如图 3A 所示。FL1 的 0 到 1,000 之间的所有点(x 轴)都在创建的门之外。因此,必须使用所有对照管以获得足够的结果。在每次试管加载之间,反冲洗护套液并执行疏通循环。上样前轻轻摇晃每根试管。连续加载 5 个试管后,运行 100 μL PBS 1x。 - 加载 2 号和 5 号试管,以设置截止值(负值)。为此,请选择 Rectangle Gate 图标(位于创建的点图下方)或 Line Gate 图标(位于创建的直方图下方);并将其放置在没有信号的地方,以获得点图和直方图,如 补充图 1 所示。
注意:所有这些试管都要求阳性区域的放置不超过 0.70%,因为“荧光”不会超过 103 (1,500)。如果有任何荧光超过该区域,请稀释使用的试剂。因此,在最终测量之前对试剂进行滴定非常重要。 - 加载 6 号管(自发荧光管),以设置样品的负区域。为此,请选择 Rectangle Gate 图标(位于创建的点图下方)或 Line Gate 图标(位于创建的直方图下方);将其放置在没有信号的地方。
- 加载下一根管子(管 7 到 9,如 表 1 所示)。
- 保存实验。
注:对于此处使用的细胞仪软件,命令 Save Experiment 是指保存生成的数据。换句话说,需要保存流式细胞仪采集的所有试管以及为每根试管生成的数据。为此,必须单击 保存实验 按钮。 - 将数据导出为 FSC 文件。
4. 使用流式细胞仪软件分析数据。
注:本节介绍了材料表中描述的流式细胞仪软件的使用说明。 图 4 显示了工作区,其中包含创建尺寸门的步骤。
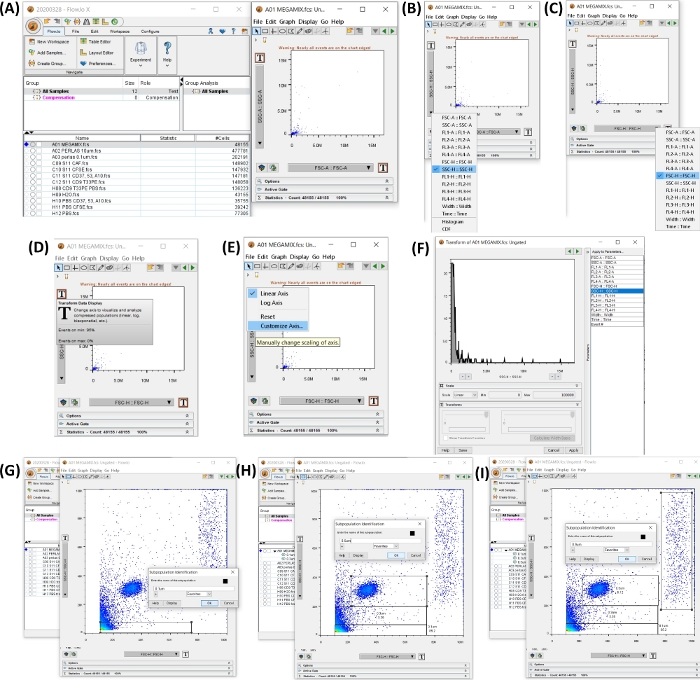
图 4:包含开始数据分析的所有步骤的工作区。 所有图像都是通过工作区的丝网印刷生成的。(A) 添加样品数据后生成的工作区(左),选择试管 1 生成的点图,FSC 微珠(右)。(B,C) 显示轴的修改,具有 SSC-H 和 FSC-H。(D-F) 显示两个轴的逐步自定义。(G-I) 显示不同微珠大小的选择和生成。 请单击此处查看此图的较大版本。
- 打开流式细胞仪软件。通过单击 Add Samples 按钮添加样本,然后选择导出的 FCS 文件。
- 单击 Megamix 管 以打开点图 SSC-H(y 轴)VS FSC-H(x 轴)。通过单击 T 按钮 (变换数据显示),单击 自定义轴,单击 SSC-H 或 FSSC-H 并将刻度值更改为最小值 0 和最大值 100,000,将两个轴调整为 0 到 100,000(参见 图 4AF)。
- 在步骤 4.2 中生成的点图中,将门设置为 0.1、0.3、0.5 和 0.9 μm。选择 Rectangle Gate 按钮以创建如图 4G-I 所示的门。
注: 图 5 显示了工作区,其中包含创建阳性区域和获得荧光染料平均强度的步骤。

图 5:用于分析所获数据的工作区。 所有图像都是由工作区的丝网印刷生成的。(A) 将尺寸门应用于所有样品时生成的工作区。(B) 选择自发荧光管,点图显示大小门,以及一个选定尺寸 (0.1 μm) 的直方图,使用此直方图获得每个荧光染料和大小的阳性门。(C) 使用每种荧光染料和大小的阳性门生成的工作区。(D) 为样本生成的 Workspace(左)和 Layout Editor(右)。在布局编辑器中,显示了 FL1-H 的自发荧光管和阳性管的直方图,以及如何获取属性面板来修改它们。(E) 该图像显示了如何获得平均强度荧光值。(F) 为三种不同荧光染料生成的直方图,显示软件允许对统计信息进行的所有更改。 请单击此处查看此图的较大版本。
- 将生成的门(0.1、0.3、0.5 和 0.9 μm)应用于所有样品。选择 Gates,在 All Samples 选项中拖放,如图 5A 所示。
- 点击 Autofluorescence 管。为每种荧光染料设置每种大小的阳性区域。打开带有尺寸门的点图 SSC-H VS FSC-H,单击 单门尺寸。在新窗口中,单击 y 轴 以选择直方图选项。在 x 轴中,选择 FL1-H,然后选择 Range 图标以创建正区域。对 FL2-H 和 FL4-H 重复此作(参见 图 5B)。
- 将门应用于所有样品。选择 Gates,在 All Samples 选项中拖放,如图 5C 所示。
- 打开 Layout Editor。
- 在编辑器中拖放每个样本。选择“自发荧光”试管的大小,拖放,然后选择相同大小的染色试管,拖放。
- 单击直方图的右下角。打开 Properties 菜单。单击 Legend(图例)。添加荧光染料的平均强度。
注意:在 Properties (属性) 中,还有其他可用的工具可以修改直方图的外观。 - 对剩余的荧光染料和大小重复相同的步骤。
5. 分析以获得每个样本的 uEV 数量。
注意: 图 6 显示了工作区以及获取每个样品的 uEV 数量的步骤。
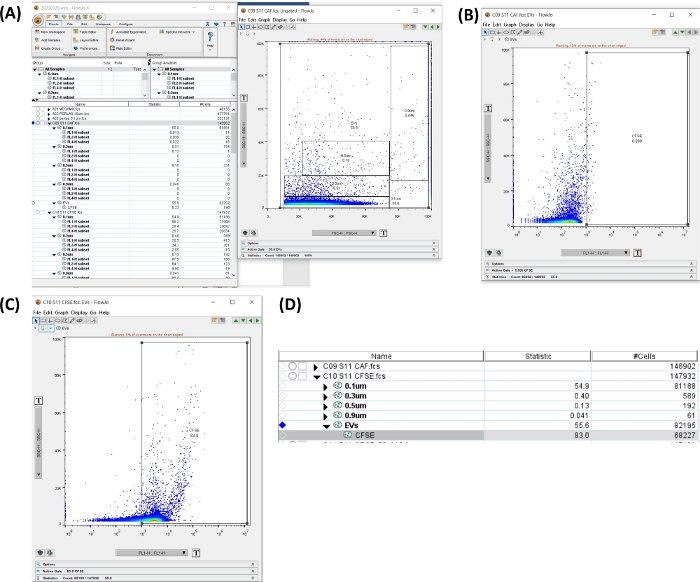
图 6:分析 CFSE 管的工作区。 所有图像都是通过工作区的丝网印刷生成的。(A) 通过选择所有尺寸区域生成的工作区,uEV 总数(左),显示所选门的点图(右)。(B) 自发荧光管中 CFSE 负区的点图 SSC-H 与 FL1-H。(C) 染色管中 CFSE 的点图 SSC-H 与 FL1-H。(D) 使用 CFSE 染色统计数据获得的表格图像,显示样品中 uEV 的数量。 请单击此处查看此图的较大版本。
- 点击 Autofluorescence tube。在带有尺寸门的 SSC-H VS FSC-H 点图中,创建一个包含所有尺寸的区域。单击 New Region(新建区域)。设置正区域(参见 图 6A、B)。
- 将门应用于所有样品。选择门,在 All Samples 选项中拖放。
- 点击 CFSE + uEVs 管。打开新区域并验证 CFSE 的正区域 (FL1-H),如图 6C 所示。
- 在 图 6D 的工作区中,复制管的 # cells 数据。该数字是通过流式细胞术 (#uEVs FC) 获得的 #uEVs。
- 应用以下公式计算每微升的 uEV 数量:
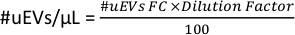
- 要获得每种荧光染料 (#uEVs/μL FLX) 的每微升 #uEVs,请在工作空间中复制 FLX-H 子集的统计数据,此数字是百分比(%FLX 子集)。
- 应用以下公式计算每种荧光染料每微升的 uEV 数量。
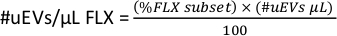
注意:根据所选门是针对一种尺寸还是针对所有 uEV,验证所选数据。
Access restricted. Please log in or start a trial to view this content.
结果
该协议有几个检查点,并且在 uEV 染色之前。因此,必须首先验证 uEV 提取物中存在的蛋白质量。所有使用细胞外囊泡的研究小组都定量蛋白质,如步骤 2.1 所示。 补充图 2 显示了一个代表性的 96 孔板,其中 4E、5E 和 6E 中含有 uEV 组分。1A、2A 和 3A 井由空白孔组成,但如果没有纯化的 uEV,孔将呈现相似的颜色。
在此步骤之后,需要验证 u...
Access restricted. Please log in or start a trial to view this content.
讨论
如今,细胞外囊泡作为多种疾病的生物标志物的使用已经增加,特别是那些可以从非侵入性来源(如尿液)中分离的疾病 5,21,22,23,24。事实证明,uEV 的分离是了解健康个体状况以及患有多种疾病的患者的诊断/预后的重要资源
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的财务或商业关系的情况下进行的。
致谢
这项工作得到了 CONACyT (A3-S-36875) 和 UNAM-DGAPA-PAPIIT 计划 (IN213020 和 IA202318) 的资助。NH-I 得到了 CONACyT 的奖学金 587790 的支持。
作者要感谢 Leopoldo Flores-Romo†、Vianney Ortiz-Navarrete、Antony Boucard Jr 和 Diana Gómez-Martin 为实现该协议提供的宝贵建议,并感谢所有健康个体的尿液样本。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| APC anti human CD156c (ADAM10) antibody | BioLegend | 352706 | Add 5 µL to the 20 µL of uEVs in PBS |
| APC anti human TSPAN33 (BAAM) antibody | BioLegend | 395406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Avanti centrifuge with JA-25.5O fixed angle rotor | Beckamn Coulter | J-26S XPI | |
| BD Accuri C6 Flow Cytometer | BD Biosciences | ||
| β-mercaptoethanol | SIGMA-Aldrich | M3148 | |
| Benchtop centrifuge with A-4-44 rotor | Eppendorf | 5804 | |
| BLUEstain 2 protein ladder | GOLDBIO | P008 | |
| CD9 (C-4) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-13118 | |
| CD63 (MX-49.129.5) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-5275 | |
| Cell Trace CFSE cell proliferation kit for flow cytometry | Thermo Scientific | C34554 | |
| Chemidoc XRS+ system | BIORAD | 5837 | |
| FITC anti human CD9 antibody | BioLegend | 312104 | Add 5 µL to the 20 µL of uEVs in PBS |
| FITC anti human CD37 antibody | BioLegend | 356304 | Add 5 µL to the 20 µL of uEVs in PBS |
| Fluorescent yellow particles | Spherotech | FP-0252-2 | |
| Fluorescent yellow particles | Spherotech | FP-0552-2 | |
| Fluorescent yellow particles | Spherotech | FP-1552-2 | |
| FlowJo Software | Becton, Dickinson and Company | ||
| Goat anti-mouse immunoglobulins/HRP | Dako | P0447 | |
| Halt protease inhibitor cocktail | Thermo Scientific | 78429 | |
| Immun-Blot PVDF membrane 0.22µm | BIORAD | 1620177 | |
| Megamix-Plus FSC beads | COSMO BIO CO.LTD | 7802 | |
| NuPAGE LDS sample buffer 4X | Thermo Scientific | NP0007 | |
| Optima ultracentrifuge with rotor 90Ti fixed angle 355530 | Beckamn Coulter | XPN100 | |
| Page Blue protein staining solution | Thermo Scientific | 24620 | |
| PE anti human CD53 antibody | BioLegend | 325406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Pierce BCA Protein assay kit | Thermo Scientific | 23227 | |
| Pierce RIPA buffer | Thermo Scientific | 89900 | |
| Polycarbonate thick wall centrifuge tubes | Beckamn Coulter | 355630 | |
| Spherotech 8-Peak validation beads (FL1-FL3) | BD Accuri | 653144 | |
| Spherotech 6-Peak validation beads (FL4) | BD Accuri | 653145 | |
| Sucrose | SIGMA-Aldrich | 59378 | |
| Triethanolamine | SIGMA-Aldrich | 90279 |
参考文献
- Decramer, S., et al. Urine in clinical proteomics. Molecular & Cellular Proteomics. 7 (10), 1850-1862 (2008).
- Nawaz, M., et al. The emerging role of extracellular vesicles as biomarkers for urogenital cancers. Nature Reviews Urology. 11 (12), 688-701 (2014).
- Pisitkun, T., Johnstone, R., Knepper, M. A. Discovery of urinary biomarkers. Molecular & Cellular Proteomics. 5 (10), 1760-1771 (2006).
- Urinology Think Tank Writing Group. Urine: Waste product or biologically active tissue. Neurourology and Urodynamics. 37 (3), 1162-1168 (2018).
- Wang, S., Kojima, K., Mobley, J. A., West, A. B. Proteomic analysis of urinary extracellular vesicles reveal biomarkers for neurologic disease. EBioMedicine. 45, 351-361 (2019).
- Merchant, M. L., Rood, I. M., Deegens, J. K. J., Klein, J. B. Isolation and characterization of urinary extracellular vesicles: implications for biomarker discovery. International Urology and Nephrology. 13 (12), 731-749 (2017).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Jing, H., et al. The role of extracellular vesicles in renal fibrosis. Cell Death and Disease. 10 (5), 367(2019).
- Liu, X., et al. Tubule-derived exosomes play a central role in fibroblast activation and kidney fibrosis. Kidney International. 97 (6), 1181-1195 (2020).
- Quaglia, M., et al. Extracellular Vesicles as Mediators of Cellular Crosstalk Between Immune System and Kidney Graft. Frontiers in Immunology. 11, 74(2020).
- Simpson, R. J., Lim, J. W., Moritz, R. L., Mathivanan, S. Exosomes: proteomic insights and diagnostic potential. Expert Review of Proteomics. 6 (3), 267-283 (2009).
- Street, J. M., Koritzinsky, E. H., Glispie, D. M., Star, R. A., Yuen, P. S. Urine Exosomes: An Emerging Trove of Biomarkers. Advances in Clinical Chemistry. 78, 103-122 (2017).
- Thongboonkerd, V. Roles for Exosome in Various Kidney Diseases and Disorders. Frontiers in Pharmacology. 10, 1655(2019).
- Watanabe, Y., et al. Molecular Network Analysis of the Urinary Proteome of Alzheimer's Disease Patients. Dementia and Geriatric Cognitive Disorders Extra. 9 (1), 53-65 (2019).
- Jadli, A. S., Ballasy, N., Edalat, P., Patel, V. B. Inside(sight) of tiny communicator: exosome biogenesis, secretion, and uptake. Molecular and Cellular Biochemistry. 467 (1-2), 77-94 (2020).
- Svenningsen, P., Sabaratnam, R., Jensen, B. L. Urinary extracellular vesicles: Origin, role as intercellular messengers and biomarkers; efficient sorting and potential treatment options. Acta Physiologica. 228 (1), 13346(2020).
- Witwer, K. W., Thery, C. Extracellular vesicles or exosomes? On primacy, precision, and popularity influencing a choice of nomenclature. Journal of Extracellular Vesicles. 8 (1), 1648167(2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Perez-Hernandez, J., et al. Increased Urinary Exosomal MicroRNAs in Patients with Systemic Lupus Erythematosus. PLoS One. 10 (9), 0138618(2015).
- Freyssinet, J. M., Toti, F. Membrane microparticle determination: at least seeing what's being sized. Journal of Thrombosis and Haemostasis. 8 (2), 311-314 (2010).
- D'Anca, M., et al. Exosome Determinants of Physiological Aging and Age-Related Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 11, 232(2019).
- Lawson, C., Vicencio, J. M., Yellon, D. M., Davidson, S. M. Microvesicles and exosomes: new players in metabolic and cardiovascular disease. Journal of Endocrinology. 228 (2), 57-71 (2016).
- Lee, S., Mankhong, S., Kang, J. H. Extracellular Vesicle as a Source of Alzheimer's Biomarkers: Opportunities and Challenges. International Journal of Molecular Sciences. 20 (7), (2019).
- Mori, M. A., Ludwig, R. G., Garcia-Martin, R., Brandao, B. B., Kahn, C. R. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. Cell Metabolism. 30 (4), 656-673 (2019).
- Hoorn, E. J., et al. Prospects for urinary proteomics: exosomes as a source of urinary biomarkers. Nephrology (Carlton). 10 (3), 283-290 (2005).
- Ranghino, A., Dimuccio, V., Papadimitriou, E., Bussolati, B. Extracellular vesicles in the urine: markers and mediators of tissue damage and regeneration. Clinical Kidney Journal. 8 (1), 23-30 (2015).
- Zhang, W., et al. Extracellular vesicles in diagnosis and therapy of kidney diseases. American Journal of Physiology-Renal Physiology. 311 (5), 844-851 (2016).
- Fernandez-Llama, P., et al. Tamm-Horsfall protein and urinary exosome isolation. Kidney International. 77 (8), 736-742 (2010).
- Royo, F., et al. Different EV enrichment methods suitable for clinical settings yield different subpopulations of urinary extracellular vesicles from human samples. Journal of Extracellular Vesicles. 5, 29497(2016).
- Rider, M. A., Hurwitz, S. N., Meckes, D. G. ExtraPEG: A Polyethylene Glycol-Based Method for Enrichment of Extracellular Vesicles. Scientific Reports. 6, 23978(2016).
- Lv, C. Y., et al. A PEG-based method for the isolation of urinary exosomes and its application in renal fibrosis diagnostics using cargo miR-29c and miR-21 analysis. International Urology and Nephrology. 50 (5), 973-982 (2018).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Wang, D., Sun, W. Urinary extracellular microvesicles: isolation methods and prospects for urinary proteome. Proteomics. 14 (16), 1922-1932 (2014).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. Journal of Extracellular Vesicles. 4, 25530(2015).
- van der Pol, E., et al. Standardization of extracellular vesicle measurements by flow cytometry through vesicle diameter approximation. Journal of Thrombosis and Haemostasis. 16 (6), 1236-1245 (2018).
- Huyan, T., Du, Y., Huang, Q., Huang, Q., Li, Q. Uptake Characterization of Tumor Cell-derived Exosomes by Natural Killer Cells. Iranian Journal of Public Health. 47 (6), 803-813 (2018).
- Puzar Dominkus, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (6), 1350-1361 (2018).
- Morales-Kastresana, A., et al. Labeling Extracellular Vesicles for Nanoscale Flow Cytometry. Scientific Reports. 7 (1), 1878(2017).
- de Rond, L., et al. Comparison of Generic Fluorescent Markers for Detection of Extracellular Vesicles by Flow Cytometry. Clinical Chemistry. 64 (4), 680-689 (2018).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。