このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
フローサイトメトリーを用いた尿中細胞外小胞のサイズ決定と表現型解析
要約
このプロトコルは、健康なヒトドナーからの尿中細胞外小胞、uEVの単離方法と、フローサイトメトリーを使用したサイズと表面マーカー発現によるそれらの表現型の特徴付けについて説明しています。
要約
細胞外小胞(EV)は、脂質膜の不均一な複合体であり、尿などのあらゆる液体中のあらゆる細胞タイプによって分泌されます。EVは、エキソソームのような直径40〜100nmから、微小胞内の100〜1000nmまで、さまざまなサイズにすることができます。また、多くの疾患の予後や診断のためのバイオマーカーとして使用できるさまざまな分子を含んでいることもあります。これらの小胞を特徴付けるために、多くの技術が開発されてきました。その一つがフローサイトメトリーです。しかし、バイオマーカーの検出とともに、EVの濃度を定量化し、サイズで区別する方法を示す既存のレポートはありません。この研究は、尿中細胞外小胞(uEV)の単離、定量化、および表現型化の手順を説明することを目的としています。これは、従来のサイトメーターを使用して、その構成を変更せずに分析します。この分析法の限界には、サンプルあたり最大4つの異なるバイオマーカーを染色できることが含まれます。また、この方法は、サンプルに含まれるEVの量によっても制限されます。これらの制限にもかかわらず、このプロトコルとその後の分析により、腎臓や脳の損傷を伴う疾患において、尿サンプル中に存在するEVマーカーの濃縮とこれらの小胞の存在量について、より多くの情報を得ることができます。
概要
哺乳動物では、血液は腎臓を250〜300回通過することによってろ過されます。この間に尿が形成されます。この生体液の生成は、糸球体濾過、尿細管再吸収、分泌などの一連のプロセスの結果です。代謝老廃物と電解質は尿の主成分です。また、ペプチド、機能性タンパク質、細胞外小胞(EV)などの他の副産物も排泄されます1,2,3,4,5,6。最初に、尿中の細胞外小胞(uEV)は、水分バランス障害に苦しむ患者の尿サンプルで特定されました。これらの患者は、アクアポリン-2(AQP2)などの分子の存在を示し、これはその後、この疾患のバイオマーカーとして使用されました7。その後のいくつかの研究は、uEVの細胞起源を特定することに焦点を当て、これらの構造が腎臓細胞(糸球体、足細胞など)や他の細胞タイプの内皮または白血球系統によって分泌される可能性があることを説明しています。さらに、uEVの数と分子濃縮度は、多くの疾患や障害の状況と相関する可能性があります8,9,10,11,12,13,14。
全体として、EVは、脂質二重層で囲まれ、細胞が受動的または能動的なメカニズムを通じてさまざまな流体に放出する粒子の非常に不均一なファミリーを構成しています。その起源に応じて、EVはエンドソーム起源のエクソソームまたは原形質膜由来のマイクロベシクル/マイクロ粒子に分類できます。ただし、この分類基準は、粒子の生合成が直接観察される場合にのみ適用できます。したがって、物理的、生化学的、および細胞起源を含む他の重要な基準は、この分野のいくつかの研究者によって承認されています15,16,17。分析した分離物の性質に応じて、EVの特性評価にはさまざまな分析手法が提案されました。例えば、大型(≥100 nm)または小型(≤100 nm)のEVの濃縮に基づいて、フローサイトメトリーまたはナノ粒子追跡による定量がそれぞれ提案されています18。
今日、多くの疾患のバイオマーカーとしてのEVの使用が重要になっているため、さまざまな原因の検索が調査されています。最も有望な供給源の1つは、簡単かつ非侵襲的な方法で入手できる尿です。したがって、このプロトコルでは、示差遠心分離、蛍光色素標識抗体による処理、および従来の2レーザー/ 4色サイトメーターを使用したダウンストリーム分析によるuEVの分離手順について説明します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
ヒトの尿サンプルは、ドナーインフォームドコンセントに署名した健康なボランティアから採取されました。これらの手続きは、Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán研究倫理委員会によっても承認されました。
1. 尿中細胞外小胞の分離
注:uEVのアイソレーションプロトコルは、ref.19から変更されています。 図1 は、uEVを分離するためのプロトコルの表現を示しています。
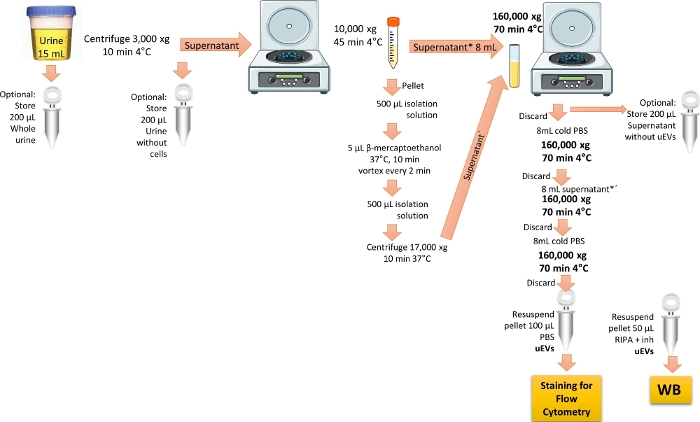
図1:フローサイトメトリー解析のためのuEV単離の概要。 このプロトコルでは、まずその日の最初の尿を遠心分離して、細胞と破片を取り除きます。次に、THPタンパク質を除去するための処理で大きな小胞を除去するために遠心分離を行い、最後に超遠心分離を実行して、1回の洗浄でuEVを濃縮して取得します。WB検証のために尿分画を保持する手順がマークされています。 この図の拡大版を表示するには、ここをクリックしてください。
- 健康なボランティアからの初朝の尿(15 mL)を使用してください。.尿を3,000 x g で4°Cで10分間遠心分離し、すべての細胞と破片を取り除きます。
注:新鮮な尿を優先的に使用してください。利用できない場合は、-20°Cで最大3か月間保存された尿を使用するか、-70°Cで最大6か月間保存された尿を使用してください。. 尿サンプルを氷の上で解凍し、激しく渦巻きます。すべての手順を氷上または4°Cで実行します。 ウェスタンブロット分析のオプションのステップは、複製チューブを作成し、別のチューブで初回の朝尿200μLを分注することです。サンプルは「全尿」とラベル付けして使用するまで-20°Cで保存し、細胞外小胞マーカーを確認します。 - ステップ 1.1 で得られた上清を新しい 15 mL 円錐形遠心チューブに移し、10,000 x g で 45 分間 4°C で遠心分離します。 上清を8mLのポリカーボネート超遠心チューブに移し、これを氷上に保存します。
注:オプションで、ステップ1.1で得られた上清200μLを、ウェスタンブロット分析用に「細胞なし尿」とラベル付けされた別のチューブにアリコートします。- Tamm-Horsfallタンパク質、THPの除去
注:THPは尿中に存在し、個人が腎疾患を患っているときに濃縮されます。THPはuEVに結合するため、uEVの収量を減少させることが報告されています。このタンパク質を除去するためには、還元剤の使用が必要である3,6。- 250 mMのスクロースと10 mMのトリエタノールアミンを混合して、単離溶液を調製します。pHを7.6に調整します。
- ステップ1.2で得られたペレットを500μLの分離溶液と混合し、次に5μLのβ-メルカプトエタノールを加えます。
- ペレットミックスを37°Cで10分間インキュベートし、2分ごとにボルテックスします。500 μLのアイソレーション溶液を加え、17,000 x g で37°Cで10分間遠心分離します。 得られた上清(還元非凝集THPとuEVを含む)を収集します。
- Tamm-Horsfallタンパク質、THPの除去
- 同じ8 mLポリカーボネート超遠心チューブで、予約した上清(ステップ1.2および1.2.1.3)を混合し、超遠心固定角ローターを使用して、160,000 x g 、4°C、70分間遠心分離します。
注:オプションで、ウェスタンブロット分析のために、上記で得られた上清を200 μL保存し、「EVを含まない上清」とラベル付けします。このサンプルは、細胞外小胞マーカーを検索する際のネガティブコントロールとして機能します。 - 上清を捨てます。氷冷した1x PBSを8 mLポリカーボネートチューブに加え、160,000 x g で4°Cで70分間遠心分離します。
注意: ペレットにはuEVが含まれているため、ペレットを捨てないように注意してください。1x PBSは、少なくとも0.22μmの細孔シリンジフィルターで滅菌およびろ過する必要があります。 - 上清を捨てます。残りの上清を8 mLのポリカーボネートチューブに加え、160,000 x g で4°Cで70分間遠心分離します。
- 上清を捨て、ペレットに氷冷したPBSを8mL加えてuEVを洗浄します。
- 上清を捨てます。ペレットを乾かしてから、氷冷したPBS1mLで再懸濁します。使用するまで-70°Cで保管してください。
注:ウェスタンブロット分析を行う場合は、複製したチューブのペレットを50 μLのRIPAバッファーとプロテアーゼ阻害剤で再懸濁してください。使用するまで-20°Cで保管してください。
2. uEVの染色
注:uEVの染色および分析を行う前に、uEVの適切な分離を検証するために、MISEV201818 で推奨されている少なくとも1つの方法を実行することが不可欠です。ここでは、ウェスタンブロット分析を示しています。 図2 は、uEVs染色の代表的なプロトコルを示しています。
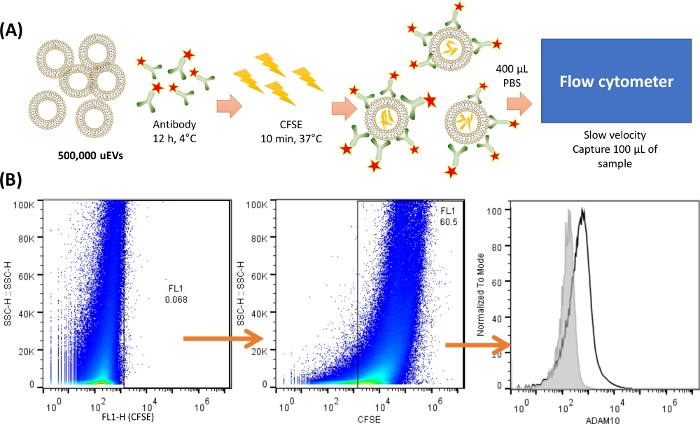
図2:サイトメーターでのuEVの染色と捕捉の概要。 (A)uEV染色の表現。500,000 uEVについて、抗体を混合し、4°Cで12時間インキュベートしました。次に、CFSEを添加し、37°Cで10分間インキュベートしました。uEVは内部にCFSEを持っており、抗体は抗原の表面に結合します。400 μL の冷 PBS を使用して再懸濁し、フローサイトメーターで 100 μL のサンプルを低速で捕捉しました。(B)分析戦略。最初のドットプロット(SSC-H VS FL-X)はuEVのネガティブコントロールを示し、次にCFSEで染色したuEVを示すドットプロット、最後にuEVの抗体染色を示すヒストグラム(黒線)、ネガティブコントロールを灰色の線で示しています。 この図の拡大版を表示するには、ここをクリックしてください。
- 材料の表に記載されているように、従来の比色タンパク質アッセイを使用してタンパク質含有量を定量化することにより、uEVの相対数を計算します。uEVを1:5に希釈し、アッセイタンパク質キットに記載されているデータシートの指示に従ってください。
- 以前に報告された式20 に基づいて、1 μg/mL の uEV タンパク質を 800,000 uEVs/μL に等しいと考え、20 μL の氷冷 PBS に 500,000 uEV が存在することを確認します。
- 表1に示すように、チューブにラベルを付けます。
注:使用されるチューブの数は、使用する抗体の数によって異なりますが、2レーザー/ 4色サイトメーターの制限は、使用できるチューブあたり最大4つの抗体です。したがって、サイトメーターではFL1、FL2、FL3、およびFL4のみを読み取ることができましたが、補正が必要です。これらの手順では、1.5 mLの微量遠心チューブまたはフローサイトメトリー用の5 mLの丸底チューブを使用します。必要なチューブを 表1に示します。チューブ4および5は、このプロトコルで使用されるすべての抗体のカクテルで構成されています。例として、2 つの問題チューブ (8 と 9) を示します。したがって、このコントロールのセットには、各チューブで使用する組み合わせが必要です。
| チューブ1。 | Megamix FSCビーズ | |
| チューブ2。 | PBSの | |
| チューブ3。 | PBSとCFSE | |
| チューブ4。 | 問題1のすべての抗体を持つPBS | |
| チューブ5。 | 問題2のすべての抗体を持つPBS | |
| チューブ6。 | 自家蛍光制御 | 試薬なし、PBSのみのuEV。 |
| チューブ7。 | #uEVs | CFSE搭載のuEV |
| チューブ8。 | 問題点1 | CD37 FITC、CD53 PE、ADAM10 APCを搭載したuEV |
| チューブ 9. | 問題点2 | CD9 FITC、TSPAN33 APCを搭載したuEV |
表1:チューブのラベリング。 チューブにラベルを付ける方法を示す例。最初のチューブは、必要なすべてのコントロールです。抗体-蛍光色素の入ったチューブは、染色に依存します。
- 500,000 uEVを含む20 μLのPBSをラベル付きチューブに加えます。
- 表1に示すように抗体を添加し、予め滴定しておいた。4°Cで一晩インキュベートします。
注:染色する前に、凝集体を防ぐために、抗体を4°Cで全速力で少なくとも5分間遠心分離することをお勧めします。ここで使用した抗体は、uEVに存在するタンパク質の一例であり、現在準備中の独立した原稿に属しています。 - 0.4 μL のカルボキシフルオレセイン・スクシンイミジル・エステル (CFSE) [5 nM] をチューブ番号 3 に添加します。37°Cで10分間インキュベートします。
注:CFSEは、サンプル中に存在するすべてのEVを染色し、フローサイトメーター分析を実行するときにバックグラウンドノイズを区別するために使用される色素です。詳細については、「 ディスカッション」 セクションを参照してください。 - 氷冷した1x PBSを400μLをすべてのチューブに加えます。
- すべてのチューブを4°Cに保ちます。
3. 従来のサイトメーターによるuEVの取得
注:フローサイトメーターの使用方法( 資料の表を参照)については、こちらで説明しています。
- サイトメーターの品質キャリブレーションを、6ピークおよび8ピークビーズを使用して行います。
注:最後のピークの%CVは6未満の値である必要があります。サイトメーターの技術者がこれを処理します。 - フローサイトメーターソフトウェアを開きます。
注:ソフトウェアを開くと、新しい実験が開き、96サンプルのテンプレートを使用したスクリーニング、実行のパラメータ、およびドットプロットまたはヒストグラムを作成するための「空」セクションが表示されます。 - 実行中のソフトウェアの画面でパラメータを調整します:100μLのサンプルをキャプチャする、低速実行、FSC-Hで10,000、SSC-Hで2,000にしきい値を設定します。
注: ここで推奨されるしきい値は一例です。分析したサンプルに基づいてしきい値を設定する必要があります。 - ロードチューブ番号1(Megamixチューブ)、 表1に示すように。ビーズを捕らえます。ソフトウェア画面の「空」の部分に2つのドットプロットを作成するには、[ ドットプロット ]オプションをクリックします。 図3のパネルAとBとして作成します。
注:Megamix蛍光ビーズ(0.1、0.3、0.5、および0.9 μmのサイズを区切り、サイズのテンプレートを作成するために使用されるビーズ)は、FL1(FITC)検出器を使用して分析できます。すべてのドットプロットとヒストグラムは、高さの値で表示する必要があります。できるだけ多くのイベントを記録します。ワークシートを変更しても、データは変更されません。
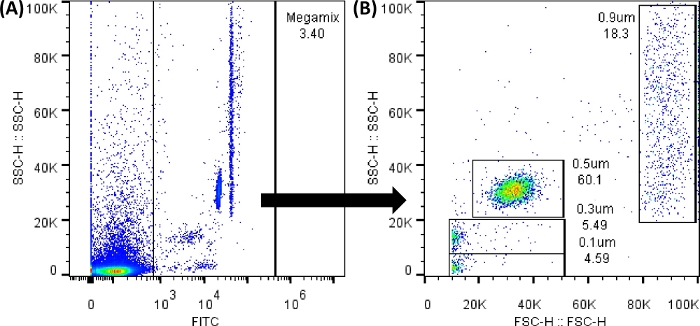
図3:Megamix FSCビーズのドットプロット。 示されているドットプロットは、フローサイトメーターソフトウェアを使用して生成されました。フローサイトメーターでは、画像は非常によく似ています。(A)バックグラウンドノイズを避けてビーズを選択するために生成された最初のドットプロット。(SSC-HとFL1-H)。(B)前のゲートの選択によって生成されたドットプロットで、ビーズのさまざまなサイズを示しています。(SSC-HとFSC-Hの比較)。 この図の拡大版を表示するには、ここをクリックしてください。
- ソフトウェア画面の「空」セクションで、使用する各蛍光色素のドットプロットとヒストグラムを作成します。 例として、補足図1 のアルゴリズムを使用します。これを行うには、各蛍光色素の ドットプロット または ヒストグラム オプションをクリックします。
メモ: 図 3A に示すように、バックグラウンド ノイズは常に存在します。FL1(x軸)の0から1,000までのすべてのドットは、作成されたゲートの外側にあります。したがって、適切な結果を得るには、すべてのコントロールチューブを使用することが不可欠です。チューブをローディングするたびに、シース液をバックフラッシュし、詰まり解消サイクルを実行します。ロードする前に、すべてのチューブを静かに振ってください。5本連続でチューブをロードした後、PBS 1xを100μL泳流します。 - ロードチューブ番号2と5は、カットオフ値(負)を設定します。これを行うには、 長方形ゲート アイコン(作成したドットプロットの下にあります)または ラインゲート アイコン(作成したヒストグラムの下にあります)を選択します。そして、 補足図1に示すようなドットプロットとヒストグラムを得るために、信号がない場所に配置します。
注:これらすべてのチューブは、103 (1,500)を超える「蛍光」がないため、0.70%以下の正の領域の配置を必要とします。この領域よりもさらに蛍光がある場合は、使用する試薬を希釈してください。したがって、最終測定の前に試薬の力価を測定することが重要です。 - ロードチューブ番号6(自家蛍光チューブ)は、サンプルの負の領域を設定します。これを行うには、 長方形ゲート アイコン(作成したドットプロットの下にあります)または ラインゲート アイコン(作成したヒストグラムの下にあります)を選択します。信号のない場所に置いてください。
- 次のチューブ( 表1に示すチューブ7〜9)をロードします。
- 実験を保存します。
注:ここで使用するサイトメーターソフトウェアの場合、 コマンドSave Experimentは、生成されたデータを保存することを指します。つまり、フローサイトメーターで取得したすべてのチューブと、各チューブで生成されたデータを保存する必要があります。これを行うには、[ 実験の保存 ]ボタンをクリックする必要があります。 - データをFSCファイルとしてエクスポートします。
4. フローサイトメーターソフトウェアによるデータの解析
注:資料の表に示されているフローサイトメーターソフトウェアの使用方法は、このセクションで説明されています。 図 4 は、サイズ ゲートを作成する手順を含むワークスペースを示しています。
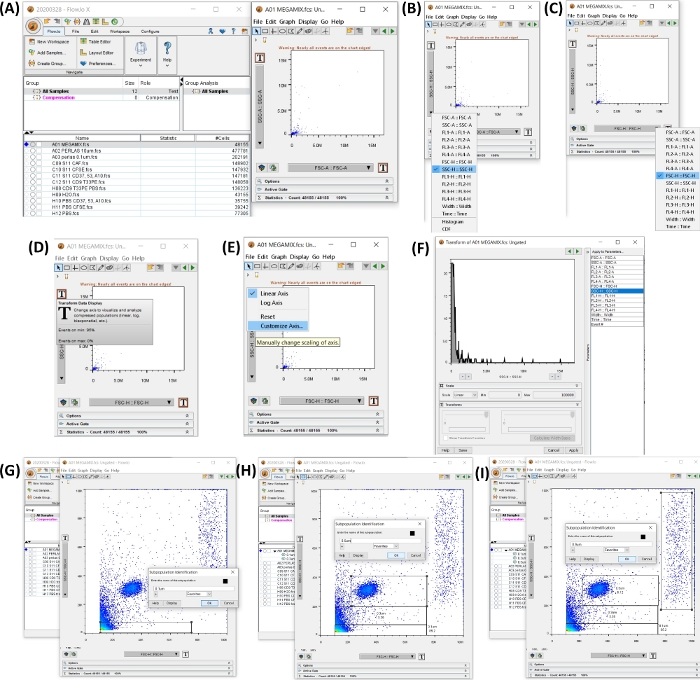
図 4: データの分析を開始するためのすべての手順を含むワークスペース。 すべての画像は、ワークスペースのスクリーン印刷によって生成されました。(A)サンプルデータを追加して生成したワークスペース(左)、チューブ1、FSCビーズを選択して生成したドットプロット(右)。(B,C)は、SSC-HとFSC-Hを持つように軸の変更を示しています。(D-F)は、両方の軸の段階的なカスタマイズを示しています。(G-I)は、さまざまなビーズサイズの選択と生成を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
- フローサイトメーターソフトウェアを開きます。 [Add Samples ] ボタンをクリックしてサンプルを追加し、エクスポートした FCS ファイルを選択します。
- Megamixチューブをクリックして、ドットプロットSSC-H(y軸)VSCF-H(x軸)を開きます。Tボタン(Transform Data Display)をクリックし、Customize Axisをクリックし、SSC-HまたはFSSC-Hをクリックして、両方の軸を0から100,000まで表示するように調整し、スケール値を最小0、最大100,000に変更します(図4AFを参照)。
- ステップ4.2で生成したドットプロットで、ゲートを0.1、0.3、0.5、0.9μmに設定します。 [Rectangle Gate ] ボタンを選択して、 図 4G-I に示すようにゲートを作成します。
注意: 図5 は、正の領域を作成し、蛍光色素の平均強度を取得する手順を含むワークスペースを示しています。

図5:取得したデータを分析するためのワークスペース。 すべての画像は、ワークスペースのスクリーン印刷によって生成されました。(A)すべてのサンプルにサイズゲートを適用して生成されたワークスペース。(B)選択した自家蛍光チューブ、サイズゲートを示すドットプロット、および選択した1つのサイズ(0.1μm)のヒストグラム、このヒストグラムを使用して、各蛍光色素とサイズの正のゲートを取得します。(C)各蛍光色素とサイズの正のゲートで生成されたワークスペース。(D)サンプル用に生成されたワークスペース(左)とレイアウトエディター(右)。Layout Editorには、FL1-Hの自家蛍光チューブとポジティブチューブのヒストグラムと、それらを修正するためのプロパティパネルの取得方法が示されています。(E)画像は、平均強度蛍光値の取得方法を示しています。(F)3つの異なる蛍光色素に対して生成されたヒストグラムで、ソフトウェアが統計情報に対して行うことができるすべての変更を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
5. サンプルあたりのuEVの数を求めるための分析。
注: 図6 は、サンプルあたりのuEVの数を取得する手順を含むワークスペースを示しています。
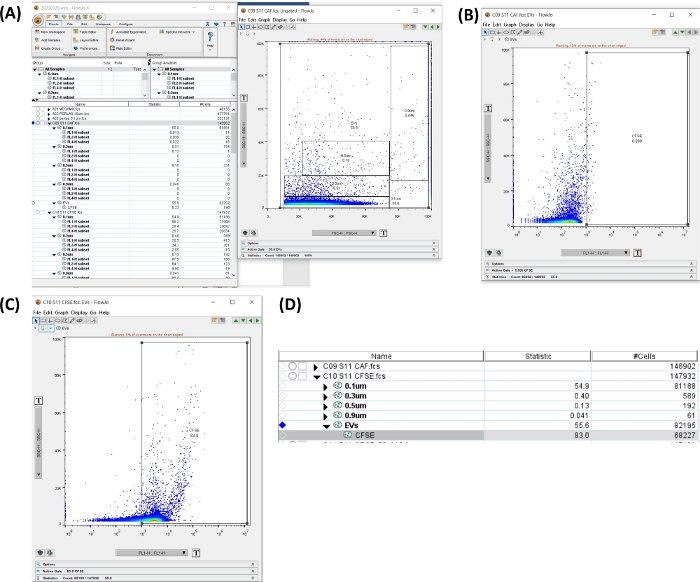
図6:CFSEチューブを分析するためのワークスペース。 すべての画像は、ワークスペースのスクリーン印刷によって生成されました。(a)全サイズ領域の選択によって生成されたワークスペース、uEV合計(左)、選択したゲートを示すドットプロット(右)。(B)自家蛍光チューブ内のCFSE陰性領域のSSC-HとFL1-Hのドットプロット。(C)染色チューブ内のCFSEのSSC-HとFL1-Hのドットプロット。(D)CFSE染色の統計で得られた表の画像で、サンプル中のuEVの数を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
- 自家蛍光チューブをクリックします。サイズゲートを使用したドットプロットSSC-H VS FSC-Hで、すべてのサイズを含む領域を作成します。[新しい地域] をクリックします。正の領域を設定します (図 6A、B を参照)。
- ゲートをすべてのサンプルに適用します。ゲートを選択し、[ All Samples ] オプションをドラッグ アンド ドロップします。
- CFSE + uEVsチューブをクリックします。新しい領域を開き、図 6C に示すように、CFSE (FL1-H) の正の領域を確認します。
- 図 6D のワークスペースで、チューブの # cells データをコピーします。この数値は、フローサイトメトリー(#uEVs FC)によって得られた #uEVs です。
- 次の式を適用して、マイクロリットルあたりのuEVの数を計算します。
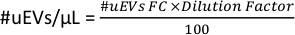
- 各蛍光色素のマイクロリットルあたりの #uEVs(#uEVs/μL FLX)を取得するには、ワークスペースでFLX-Hサブセットの統計をコピーします。この数値はパーセンテージ(%FLXサブセット)です。
- 次の式を適用して、各蛍光色素のマイクロリットルあたりのuEVの数を計算します。
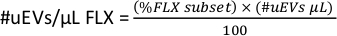
注:選択したゲートが1つのサイズ用か、すべてのuEV用かに応じて、選択したデータを確認します。
Access restricted. Please log in or start a trial to view this content.
結果
プロトコルを通じて、そしてuEVの染色前にいくつかのチェックポイントがあります。そのため、まずuEVの抽出物に含まれるタンパク質の量を確認することが不可欠です。細胞外小胞を扱うすべての研究グループは、ステップ2.1に示すように、タンパク質を定量します。 補足図2 は、ウェル4E、5E、および6EにuEVsフラクションを含む代表的な96ウェルプレー?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
今日では、いくつかの疾患のバイオマーカーとしての細胞外小胞の使用が増加しています、特に尿5,21,22,23,24などの非侵襲的な供給源から分離できる疾患について。uEVの分離は、健康な個人の状態、およびいくつかの疾患に苦しむ患者の診断/予?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者らは、この研究が、潜在的な利益相反と解釈される可能性のある金銭的または商業的な関係がない状態で実施されたことを宣言します。
謝辞
この研究は、CONACyT(A3-S-36875)およびUNAM-DGAPA-PAPIITプログラム(IN213020およびIA202318)からの助成金によって支援されました。NH-I は、CONACyT のフェローシップ 587790 によって支援されました。
著者は、このプロトコルの実現に向けた貴重なアドバイスを提供してくれたレオポルド・フローレス・ロモ†、ヴィアニー・オルティス・ナバレテ、アントニー・ブカール・ジュニア、ダイアナ・ゴメス・マーティン、および尿サンプルを提供してくれたすべての健康な個人に感謝したいと思います。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| APC anti human CD156c (ADAM10) antibody | BioLegend | 352706 | Add 5 µL to the 20 µL of uEVs in PBS |
| APC anti human TSPAN33 (BAAM) antibody | BioLegend | 395406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Avanti centrifuge with JA-25.5O fixed angle rotor | Beckamn Coulter | J-26S XPI | |
| BD Accuri C6 Flow Cytometer | BD Biosciences | ||
| β-mercaptoethanol | SIGMA-Aldrich | M3148 | |
| Benchtop centrifuge with A-4-44 rotor | Eppendorf | 5804 | |
| BLUEstain 2 protein ladder | GOLDBIO | P008 | |
| CD9 (C-4) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-13118 | |
| CD63 (MX-49.129.5) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-5275 | |
| Cell Trace CFSE cell proliferation kit for flow cytometry | Thermo Scientific | C34554 | |
| Chemidoc XRS+ system | BIORAD | 5837 | |
| FITC anti human CD9 antibody | BioLegend | 312104 | Add 5 µL to the 20 µL of uEVs in PBS |
| FITC anti human CD37 antibody | BioLegend | 356304 | Add 5 µL to the 20 µL of uEVs in PBS |
| Fluorescent yellow particles | Spherotech | FP-0252-2 | |
| Fluorescent yellow particles | Spherotech | FP-0552-2 | |
| Fluorescent yellow particles | Spherotech | FP-1552-2 | |
| FlowJo Software | Becton, Dickinson and Company | ||
| Goat anti-mouse immunoglobulins/HRP | Dako | P0447 | |
| Halt protease inhibitor cocktail | Thermo Scientific | 78429 | |
| Immun-Blot PVDF membrane 0.22µm | BIORAD | 1620177 | |
| Megamix-Plus FSC beads | COSMO BIO CO.LTD | 7802 | |
| NuPAGE LDS sample buffer 4X | Thermo Scientific | NP0007 | |
| Optima ultracentrifuge with rotor 90Ti fixed angle 355530 | Beckamn Coulter | XPN100 | |
| Page Blue protein staining solution | Thermo Scientific | 24620 | |
| PE anti human CD53 antibody | BioLegend | 325406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Pierce BCA Protein assay kit | Thermo Scientific | 23227 | |
| Pierce RIPA buffer | Thermo Scientific | 89900 | |
| Polycarbonate thick wall centrifuge tubes | Beckamn Coulter | 355630 | |
| Spherotech 8-Peak validation beads (FL1-FL3) | BD Accuri | 653144 | |
| Spherotech 6-Peak validation beads (FL4) | BD Accuri | 653145 | |
| Sucrose | SIGMA-Aldrich | 59378 | |
| Triethanolamine | SIGMA-Aldrich | 90279 |
参考文献
- Decramer, S., et al. Urine in clinical proteomics. Molecular & Cellular Proteomics. 7 (10), 1850-1862 (2008).
- Nawaz, M., et al. The emerging role of extracellular vesicles as biomarkers for urogenital cancers. Nature Reviews Urology. 11 (12), 688-701 (2014).
- Pisitkun, T., Johnstone, R., Knepper, M. A. Discovery of urinary biomarkers. Molecular & Cellular Proteomics. 5 (10), 1760-1771 (2006).
- Urinology Think Tank Writing Group. Urine: Waste product or biologically active tissue. Neurourology and Urodynamics. 37 (3), 1162-1168 (2018).
- Wang, S., Kojima, K., Mobley, J. A., West, A. B. Proteomic analysis of urinary extracellular vesicles reveal biomarkers for neurologic disease. EBioMedicine. 45, 351-361 (2019).
- Merchant, M. L., Rood, I. M., Deegens, J. K. J., Klein, J. B. Isolation and characterization of urinary extracellular vesicles: implications for biomarker discovery. International Urology and Nephrology. 13 (12), 731-749 (2017).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Jing, H., et al. The role of extracellular vesicles in renal fibrosis. Cell Death and Disease. 10 (5), 367(2019).
- Liu, X., et al. Tubule-derived exosomes play a central role in fibroblast activation and kidney fibrosis. Kidney International. 97 (6), 1181-1195 (2020).
- Quaglia, M., et al. Extracellular Vesicles as Mediators of Cellular Crosstalk Between Immune System and Kidney Graft. Frontiers in Immunology. 11, 74(2020).
- Simpson, R. J., Lim, J. W., Moritz, R. L., Mathivanan, S. Exosomes: proteomic insights and diagnostic potential. Expert Review of Proteomics. 6 (3), 267-283 (2009).
- Street, J. M., Koritzinsky, E. H., Glispie, D. M., Star, R. A., Yuen, P. S. Urine Exosomes: An Emerging Trove of Biomarkers. Advances in Clinical Chemistry. 78, 103-122 (2017).
- Thongboonkerd, V. Roles for Exosome in Various Kidney Diseases and Disorders. Frontiers in Pharmacology. 10, 1655(2019).
- Watanabe, Y., et al. Molecular Network Analysis of the Urinary Proteome of Alzheimer's Disease Patients. Dementia and Geriatric Cognitive Disorders Extra. 9 (1), 53-65 (2019).
- Jadli, A. S., Ballasy, N., Edalat, P., Patel, V. B. Inside(sight) of tiny communicator: exosome biogenesis, secretion, and uptake. Molecular and Cellular Biochemistry. 467 (1-2), 77-94 (2020).
- Svenningsen, P., Sabaratnam, R., Jensen, B. L. Urinary extracellular vesicles: Origin, role as intercellular messengers and biomarkers; efficient sorting and potential treatment options. Acta Physiologica. 228 (1), 13346(2020).
- Witwer, K. W., Thery, C. Extracellular vesicles or exosomes? On primacy, precision, and popularity influencing a choice of nomenclature. Journal of Extracellular Vesicles. 8 (1), 1648167(2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Perez-Hernandez, J., et al. Increased Urinary Exosomal MicroRNAs in Patients with Systemic Lupus Erythematosus. PLoS One. 10 (9), 0138618(2015).
- Freyssinet, J. M., Toti, F. Membrane microparticle determination: at least seeing what's being sized. Journal of Thrombosis and Haemostasis. 8 (2), 311-314 (2010).
- D'Anca, M., et al. Exosome Determinants of Physiological Aging and Age-Related Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 11, 232(2019).
- Lawson, C., Vicencio, J. M., Yellon, D. M., Davidson, S. M. Microvesicles and exosomes: new players in metabolic and cardiovascular disease. Journal of Endocrinology. 228 (2), 57-71 (2016).
- Lee, S., Mankhong, S., Kang, J. H. Extracellular Vesicle as a Source of Alzheimer's Biomarkers: Opportunities and Challenges. International Journal of Molecular Sciences. 20 (7), (2019).
- Mori, M. A., Ludwig, R. G., Garcia-Martin, R., Brandao, B. B., Kahn, C. R. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. Cell Metabolism. 30 (4), 656-673 (2019).
- Hoorn, E. J., et al. Prospects for urinary proteomics: exosomes as a source of urinary biomarkers. Nephrology (Carlton). 10 (3), 283-290 (2005).
- Ranghino, A., Dimuccio, V., Papadimitriou, E., Bussolati, B. Extracellular vesicles in the urine: markers and mediators of tissue damage and regeneration. Clinical Kidney Journal. 8 (1), 23-30 (2015).
- Zhang, W., et al. Extracellular vesicles in diagnosis and therapy of kidney diseases. American Journal of Physiology-Renal Physiology. 311 (5), 844-851 (2016).
- Fernandez-Llama, P., et al. Tamm-Horsfall protein and urinary exosome isolation. Kidney International. 77 (8), 736-742 (2010).
- Royo, F., et al. Different EV enrichment methods suitable for clinical settings yield different subpopulations of urinary extracellular vesicles from human samples. Journal of Extracellular Vesicles. 5, 29497(2016).
- Rider, M. A., Hurwitz, S. N., Meckes, D. G. ExtraPEG: A Polyethylene Glycol-Based Method for Enrichment of Extracellular Vesicles. Scientific Reports. 6, 23978(2016).
- Lv, C. Y., et al. A PEG-based method for the isolation of urinary exosomes and its application in renal fibrosis diagnostics using cargo miR-29c and miR-21 analysis. International Urology and Nephrology. 50 (5), 973-982 (2018).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Wang, D., Sun, W. Urinary extracellular microvesicles: isolation methods and prospects for urinary proteome. Proteomics. 14 (16), 1922-1932 (2014).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. Journal of Extracellular Vesicles. 4, 25530(2015).
- van der Pol, E., et al. Standardization of extracellular vesicle measurements by flow cytometry through vesicle diameter approximation. Journal of Thrombosis and Haemostasis. 16 (6), 1236-1245 (2018).
- Huyan, T., Du, Y., Huang, Q., Huang, Q., Li, Q. Uptake Characterization of Tumor Cell-derived Exosomes by Natural Killer Cells. Iranian Journal of Public Health. 47 (6), 803-813 (2018).
- Puzar Dominkus, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (6), 1350-1361 (2018).
- Morales-Kastresana, A., et al. Labeling Extracellular Vesicles for Nanoscale Flow Cytometry. Scientific Reports. 7 (1), 1878(2017).
- de Rond, L., et al. Comparison of Generic Fluorescent Markers for Detection of Extracellular Vesicles by Flow Cytometry. Clinical Chemistry. 64 (4), 680-689 (2018).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved