Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение размера и фенотипический анализ внеклеточных пузырьков мочевого пузыря с помощью проточной цитометрии
В этой статье
Резюме
В данном протоколе описан метод выделения мочевых внеклеточных везикул (uEVs) от здоровых доноров человека и их фенотипическая характеристика по размеру и экспрессии поверхностных маркеров с помощью проточной цитометрии.
Аннотация
Внеклеточные везикулы представляют собой гетерогенный комплекс липидных мембран, секретируемых любым типом клеток в любой жидкости, такой как моча. Электромобили могут иметь различные размеры: от 40-100 нм в диаметре, например, в экзосомах, до 100-1000 нм в микровезикулах. Они также могут содержать различные молекулы, которые могут быть использованы в качестве биомаркеров для прогноза и диагностики многих заболеваний. Для характеристики этих везикул было разработано множество методов. Одним из таких является проточная цитометрия. Тем не менее, не существует отчетов, показывающих, как количественно оценить концентрацию электромобилей и дифференцировать их по размеру, а также обнаружить биомаркеры. Целью данной работы является описание процедуры выделения, количественного определения и фенотипификации мочевых внеклеточных везикул, uEVs, с использованием обычного цитометра для анализа без каких-либо изменений его конфигурации. Ограничения метода включают окрашивание максимум четырьмя различными биомаркерами на образец. Метод также ограничен количеством электромобилей, доступных в образце. Несмотря на эти ограничения, с помощью данного протокола и его последующего анализа мы можем получить больше информации об обогащении маркеров ВВ и распространенности этих везикул, присутствующих в образцах мочи, при заболеваниях, связанных с повреждением почек и головного мозга.
Введение
У млекопитающих кровь фильтруется, проходя через почки 250 - 300 раз; За это время образуется моча. Производство этой биожидкости является результатом ряда процессов, включая клубочковую фильтрацию, канальцевую реабсорбцию и секрецию. Продукты метаболизма и электролиты являются основными компонентами мочи. Кроме того, выводятся другие побочные продукты, такие как пептиды, функциональные белки и внеклеточные везикулы (ВВ) 1,2,3,4,5,6. Первоначально внеклеточные везикулы мочи (ВВВ) были идентифицированы в образцах мочи пациентов, страдающих нарушениями водного баланса. У этих пациентов наблюдалось присутствие таких молекул, как аквапорин-2 (AQP2), который затем был использован в качестве биомаркераэтого заболевания. Несколько последующих исследований были сосредоточены на выявлении клеточного происхождения uEVs, описывая, что эти структуры могут секретироваться клетками почек (клубочками, подоцитами и т. д.) и другими типами клеток эндотелиальных или лейкоцитарных линий. Более того, количество и обогащение молекулами в uEVs может коррелировать со статусом многих заболеваний и расстройств 8,9,10,11,12,13,14.
В целом, ВВ составляют весьма гетерогенное семейство частиц, окруженных липидными бислоями и высвобождаемых клетками с помощью пассивных или активных механизмов в различные жидкости. В зависимости от их происхождения ВВ могут быть классифицированы как экзосомы, происходящие из эндосом, или микровезикулы/микрочастицы, полученные из плазматических мембран. Однако этот критерий классификации может быть применен только в том случае, если биогенез частиц непосредственно наблюдается. Таким образом, другие нетривиальные критерии, включая физическое, биохимическое и клеточное происхождение, были одобрены несколькими исследователямив этой области. В зависимости от характера анализируемого изолята были предложены различные аналитические методы для определения характеристик ВВ. Например, на основе обогащения больших (≥100 нм) или малых (≤100 нм) EV предлагается количественное определение с помощью проточной цитометрии или отслеживания наночастиц, соответственно18.
В настоящее время использование ВВ в качестве биомаркеров для многих заболеваний стало актуальным, поэтому исследуется поиск различных источников. Одним из наиболее перспективных источников является моча, так как ее можно получить простым и неинвазивным способом. Таким образом, данный протокол описывает процедуру выделения uEV путем дифференциального центрифугирования, обработки фторохром-конъюгированными антителами и последующего анализа с использованием обычного 2-лазерного/4-цветного цитометра.
Access restricted. Please log in or start a trial to view this content.
протокол
Образцы человеческой мочи были получены от здоровых добровольцев, подписавших информированное согласие донора. Эти процедуры также были одобрены Комитетом по этике научных исследований Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
1. Выделение мочевых внеклеточных пузырьков
ПРИМЕЧАНИЕ: Протокол изоляции uEV изменен по ссылке 19. На рисунке 1 изображено представление протокола для выделения uEV.
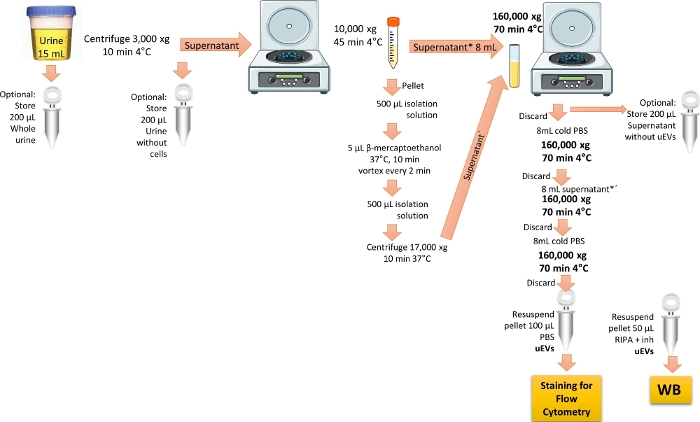
Рисунок 1: Обзор выделения uEVs для анализа проточной цитометрии. В этом протоколе сначала центрифугируют первую мочу за день, чтобы удалить клетки и мусор. Затем центрифугируйте для удаления крупных везикул с обработкой для удаления белка THP и, наконец, выполните ультрацентрифугирование для обогащения и получения uEV за одну промывку. Отмечены шаги по сохранению фракций мочи для валидации WB. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Используйте первую утреннюю мочу (15 мл) здоровых добровольцев. Центрифугируйте мочу при давлении 3 000 х г в течение 10 минут при 4 °C, чтобы удалить все клетки и мусор.
ПРИМЕЧАНИЕ: Предпочтительно использовать свежую мочу; если это невозможно, используйте мочу, хранящую не более 3 месяцев при -20 °C или не более 6 месяцев при -70 °C. Разморозьте образец мочи на льду и энергично перебейте его. Выполняйте все процедуры на льду или при температуре 4 °C. Необязательным этапом анализа вестерн-блоттинга является изготовление дубликата пробирки и аликвота 200 мкл мочи за первое утро в отдельную пробирку. Храните образец при температуре -20 °C до использования, пометив его как «цельная моча», чтобы проверить маркеры внеклеточных везикул. - Переносим надосадочную жидкость, полученную на стадии 1.1, в новую коническую центрифужную пробирку объемом 15 мл, затем центрифугируем при 10 000 x g в течение 45 мин при 4 °C. Перенесите надосадочную жидкость в поликарбонатную ультрацентрифужную пробирку объемом 8 мл и сохраните ее на льду.
ПРИМЕЧАНИЕ: По желанию аликвоту 200 мкл надосадочной жидкости, полученной на этапе 1.1, в отдельной пробирке, помеченной как «моча без клеток», для вестерн-блоттинга.- Удаление белка Тамма-Хорсфолла, ТГФ
ПРИМЕЧАНИЕ: ТГФ присутствует в моче и обогащается, когда у человека есть заболевание почек. Сообщалось, что THP снижает выход uEV, потому что он может связываться с uEV. Для удаления этого белка необходимо использовать восстановитель 3,6.- Приготовьте изоляционный раствор, смешав 250 мМ сахарозы с 10 мМ триэтаноламина. Отрегулируйте pH до 7,6.
- Полученную на этапе 1.2 гранулу смешать с 500 мкл изоляционного раствора, а затем добавить 5 мкл β-меркаптоэтанола.
- Инкубируйте пеллетную смесь при 37 °C в течение 10 минут, переворачивая каждые 2 минуты. Добавьте 500 μL изоляционного раствора и затем центрифугируйте при 17 000 x g в течение 10 минут при 37 °C. Соберите полученную надосадочную жидкость (содержащую восстановленный/неагрегированный ТГФ плюс uEVs).
- Удаление белка Тамма-Хорсфолла, ТГФ
- Смешайте оба зарезервированных надосадочной жидкости (из этапов 1.2 и 1.2.1.3) в одной и той же ультрацентрифужной пробирке из поликарбоната объемом 8 мл, а затем центрифугируйте при давлении 160 000 x g в течение 70 мин при 4 °C с помощью ультрацентрифугового ротора с фиксированным углом наклона.
ПРИМЕЧАНИЕ: При необходимости, для вестерн-блоттинга храните 200 мкл полученной выше надосадочной жидкости, помечая ее как «надосадочная жидкость без ВВ». Этот образец послужит негативным контролем при поиске маркеров внеклеточных везикул. - Выбросьте надосадочную жидкость. Добавьте ледяной 1x PBS в поликарбонатную пробирку объемом 8 мл и центрифугируйте при 160 000 x g в течение 70 минут при 4 °C.
ПРИМЕЧАНИЕ: Будьте осторожны и не выбрасывайте гранулы, так как они содержат uEV. 1x PBS необходимо стерилизовать и отфильтровать с помощью шприца-фильтра с порами не менее 0,22 мкм. - Выбросьте надосадочную жидкость. Добавьте оставшуюся надосадочную жидкость в поликарбонатную пробирку объемом 8 мл и центрифугируйте при 160 000 x g в течение 70 минут при 4 °C.
- Выбросьте надосадочную жидкость и добавьте 8 мл ледяного PBS в гранулу для мытья uEVs.
- Выбросьте надосадочную жидкость. Дайте грануле высохнуть, а затем снова суспендируйте ее 1 мл ледяного PBS. Хранить при температуре -70 °C до использования.
ПРИМЕЧАНИЕ: При проведении вестерн-блоттинга ресуспендируйте гранулу дубликата пробирки 50 мкл буфера RIPA плюс ингибиторы протеазы. Хранить при температуре -20 °C до использования.
2. Окрашивание uEV
ПРИМЕЧАНИЕ: Перед окрашиванием и анализом uEV важно выполнить по крайней мере одну методологию, рекомендованную MISEV201818 , для проверки надлежащей изоляции uEV; здесь изображен анализ вестерн-блоттинга. На рисунке 2 показан репрезентативный протокол для окрашивания uEVs.
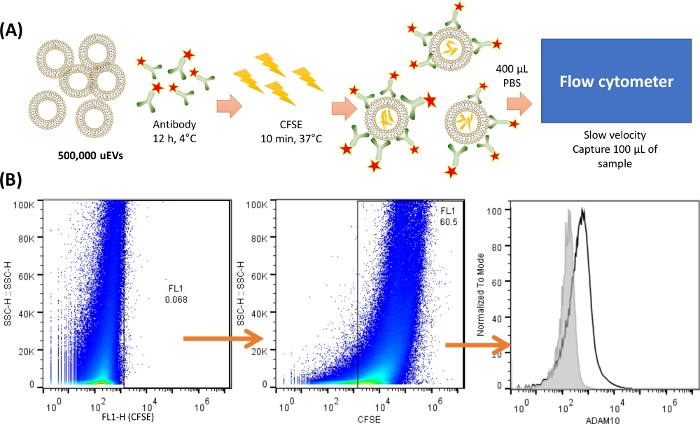
Рисунок 2: Обзор окрашивания и захвата uEVs в цитометре. (A) Изображение окрашивания uEV. Для 500 000 uEVs антитела смешивали и инкубировали при 4 °C в течение 12 часов. Затем добавляли CFSE и инкубировали при 37 °C в течение 10 минут. Внутри uEV был CFSE, и антитело будет связываться с поверхностью антигена. 400 мкл холодной PBS использовали для ресуспендирования и захвата 100 мкл образца в проточном цитометре с низкой скоростью. (B) Стратегия анализа. Первая точечная диаграмма (SSC-H VS FL-X) показывает отрицательный контроль для uEVs, за ней следует точечная диаграмма, показывающая окрашивание uEVs CFSE, и, наконец, гистограмма с окрашиванием антителами uEVs (черная линия), отрицательный контроль показан серой линией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Рассчитайте относительное количество uEV путем количественного определения содержания белка с помощью любого обычного колориметрического анализа белка, как указано в Таблице материалов. Выполните разведение uEV в соотношении 1:5 и следуйте инструкциям в техническом описании, приведенном в наборе белков для анализа.
- Основываясь на ранее описанной формуле20, предположим, что 1 мкг/мл белка uEVs равен 800 000 мкВ/мкл. Убедитесь, что 500 000 мкЛ присутствует в 20 мкл ледяного PBS.
- Наклейте на пробирки маркировку, как указано в таблице 1.
ПРИМЕЧАНИЕ: Количество используемых пробирок будет зависеть от количества используемых антител, ограничение для цитометра с 2 лазерами/4 цветами составляет максимум 4 антитела на пробирку, которые могут быть использованы; таким образом, в цитометре можно считать только FL1, FL2, FL3 и FL4, хотя требуется компенсация. Для этих процедур используйте микроцентрифужные пробирки объемом 1,5 мл или пробирки с круглым дном объемом 5 мл для проточной цитометрии. Необходимые трубки изображены в таблице 1. Пробирки 4 и 5 состоят из коктейля из всех антител, которые должны использоваться в этом протоколе. В качестве примера приведены две проблемные трубки (8 и 9); Следовательно, этот набор элементов управления должен иметь комбинацию для использования в каждой трубке.
| Трубка 1. | Бусины Megamix FSC | |
| Трубка 2. | ПБС | |
| Трубка 3. | PBS с CFSE | |
| Трубка 4. | ПБС со всеми антителами проблемы 1 | |
| Трубка 5. | ПБС со всеми антителами проблемы 2 | |
| Трубка 6. | Контроль автофлуоресценции | uEVs без реагента, только в PBS. |
| Трубка 7. | #uEVs | uEV с CFSE |
| Трубка 8. | Проблема 1 | uEV с CD37 FITC, CD53 PE, ADAM10 APC |
| Трубка 9. | Проблема 2 | uEV с CD9 FITC, TSPAN33 APC |
Таблица 1: Маркировка пробирок. Пример, показывающий, как маркировать трубки. Первые трубки — это все необходимые элементы управления. Пробирки с антителами-флуорохромами будут зависеть от окрашивания.
- Добавьте 20 μL PBS, содержащего 500 000 uEVs, в помеченные пробирки.
- Добавьте антитела, как указано в таблице 1, предварительно титруемые. Выдерживать в течение ночи при температуре 4 °C.
ПРИМЕЧАНИЕ: Перед окрашиванием рекомендуется центрифугировать антитела при температуре 4 °C на полной скорости в течение не менее 5 минут, чтобы предотвратить образование агрегатов. Использованные здесь антитела являются примером белков, присутствующих в uEV, и относятся к отдельной рукописи, которая в настоящее время находится в стадии подготовки. - Добавьте 0,4 мкл карбоксифлуоресцеина сукцинимидилового эфира (CFSE) [5 нМ] в пробирку No 3. Инкубировать в течение 10 минут при 37 °C.
ПРИМЕЧАНИЕ: CFSE — это краситель, используемый для окрашивания всех EV, присутствующих в образце, и различения фонового шума при анализе проточного цитометра. Для получения дополнительной информации см. раздел Обсуждение . - Добавьте 400 μL ледяного 1x PBS во все пробирки.
- Держите все пробирки при температуре 4 °C.
3. Получение uEV с помощью обычного цитометра
ПРИМЕЧАНИЕ: Инструкция по применению проточного цитометра (см. Таблицу материалов) описана здесь.
- Выполните качественную калибровку цитометра, используя 6- и 8-пиковые шарики.
ПРИМЕЧАНИЕ: %CV последнего пика должен быть значением меньше 6; Об этом позаботится техник по цитометру. - Откройте программное обеспечение проточного цитометра.
ПРИМЕЧАНИЕ: Как только программное обеспечение будет открыто, откроется новый эксперимент, показывающий скрининг с шаблоном для 96 образцов, параметрами для выполнения и «пустым» разделом для создания точечных графиков или гистограмм. - Отрегулируйте параметры на экране запущенного программного обеспечения: 100 мкл образца для захвата, медленно работаю, установите порог на уровне 10 000 на FSC-H и 2 000 на SSC-H.
ПРИМЕЧАНИЕ: Рекомендуемый здесь порог является примером; Требуется установить пороговое значение на основе анализируемых образцов. - Загрузите трубку No1 (трубка Мегамикс), как указано в таблице 1. Захватите бусины. Создайте два точечных графика в «пустой» части экрана программного обеспечения, нажав на опцию «Точечный график ». Создайте как панели A и B на рисунке 3.
ПРИМЕЧАНИЕ: Флуоресцентные шарики Megamix (бусины, используемые для определения размеров 0,1, 0,3, 0,5 и 0,9 мкм и создания шаблона для размеров) могут быть проанализированы с помощью детектора FL1 (FITC). Все точечные графики и гистограммы должны отображаться в значениях высоты. Записывайте как можно больше событий; Любые изменения в листе не изменяют данные.
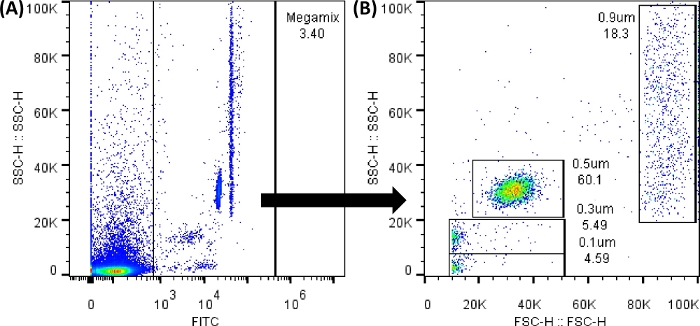
Рисунок 3: Точечные графики бусин Megamix FSC. Показанные точечные графики были сгенерированы с использованием программного обеспечения проточного цитометра; В проточном цитометре изображение будет очень похожим. (A) Первая точечная диаграмма сгенерирована для выбора бусин во избежание фонового шума. (SSC-H ПРОТИВ FL1-H). (B) Точечная диаграмма, полученная при выборе предыдущего вентиля, показывающая различные размеры бусин. (SSC-H ПРОТИВ FSC-H). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- В разделе «пустой» программного обеспечения создайте точечную диаграмму и гистограмму для каждого используемого флуорохрома; В качестве примера используйте алгоритм, показанный на дополнительном рисунке 1 . Для этого нажмите на опцию «Точечная диаграмма » или «Гистограмма » для каждого флуорохрома.
ПРИМЕЧАНИЕ: Фоновый шум будет присутствовать всегда, как показано на рисунке 3A. Все точки от 0 до 1 000 FL1 (ось x) находятся за пределами созданного затвора. Поэтому для получения адекватных результатов важно использовать все контрольные трубки. Между каждой загрузкой трубки промывайте жидкость оболочки и выполняйте цикл прочистки от засорения. Осторожно встряхните каждую трубку перед загрузкой. После загрузки пяти последовательных пробирок запустите 100 μL PBS 1x. - Загрузите трубки No 2 и 5, чтобы установить пороговые значения (отрицательные). Для этого выберите иконку Rectangle Gate (расположенную под созданной точечной диаграммой) или иконку Line Gate (расположенную под созданной гистограммой); и поместите его там, где нет сигнала, чтобы получить точечные графики и гистограммы, подобные показанным на дополнительном рисунке 1.
ПРИМЕЧАНИЕ: Все эти пробирки требуют размещения положительной области не далее 0,70%, потому что там не будет «флуоресценции» более 103 (1,500). Если есть флуоресценция дальше этой области, разбавьте используемые реагенты. Поэтому важно проводить титрование реагентов перед окончательными измерениями. - Загрузите пробирку No6 (автофлуоресцентную трубку), чтобы установить отрицательные области для образца. Для этого выберите иконку Rectangle Gate (расположенную под созданной точечной диаграммой) или иконку Line Gate (расположенную под созданной гистограммой); Разместите его там, где нет сигнала.
- Загрузите следующие трубки (трубки с 7 по 9, изображенные в таблице 1).
- Сохраните эксперимент.
ПРИМЕЧАНИЕ: Для используемого здесь программного обеспечения для цитометра команда Save Experiment относится к сохранению сгенерированных данных. Другими словами, все пробирки, которые регистрируются проточным цитометром, и данные, полученные для каждой пробирки, должны быть сохранены. Для этого необходимо нажать на кнопку «Сохранить эксперимент ». - Экспортируйте данные в виде файлов FSC.
4. Анализ данных с помощью программного обеспечения проточного цитометра.
ПРИМЕЧАНИЕ: Инструкция по использованию программного обеспечения проточного цитометра, представленная в таблице материалов, описана в этом разделе. На рисунке 4 показано рабочее пространство с инструкциями по созданию размеров ворот.
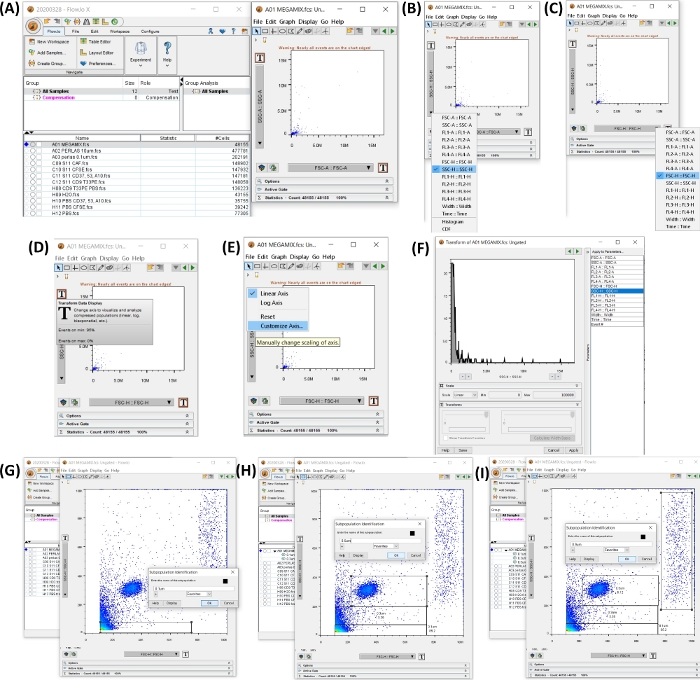
Рисунок 4: Рабочая область со всеми шагами для начала анализа данных. Все изображения были сгенерированы методом трафаретной печати рабочего пространства. (A) Рабочее пространство, созданное с добавлением данных образца (слева), точечная диаграмма, созданная выбором трубки 1, бусины FSC (справа). (B,C) показывают изменение оси, чтобы получить SSC-H и FSC-H. (D-F) показать пошаговую настройку обеих осей. (G-I) показывают выбор и генерацию валиков различных размеров. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Откройте программное обеспечение проточного цитометра. Добавьте сэмплы, нажав на кнопку «Добавить сэмплы », и выберите экспортированные файлы FCS.
- Нажмите на трубку Megamix, чтобы открыть точечную диаграмму SSC-H (ось y) и FSC-H (ось x). Настройте обе оси для просмотра от 0 до 100 000, нажав на кнопку T (Convert Data Display), нажмите на Customize Axis, нажмите на SSC-H или FSSC-H и измените значение масштаба на min 0 и max 100 000 (см. Рисунок 4A-F).
- Установите вентили для 0,1, 0,3, 0,5 и 0,9 мкм на точечной диаграмме, созданной на шаге 4.2. Нажмите кнопку «Прямоугольный ворот », чтобы создать ворота, как показано на рисунке 4G-I.
ПРИМЕЧАНИЕ: На рисунке 5 показано рабочее пространство с инструкциями по созданию положительных областей и получению средней интенсивности для флуорохрома.

Рисунок 5: Рабочее пространство для анализа полученных данных. Все изображения были сгенерированы методом трафаретной печати рабочего пространства. (A) Рабочее пространство, созданное с применением размерного затвора ко всем образцам. (B) Выбранная автофлуоресцентная трубка, точечная диаграмма, показывающая размерный вентиль, и гистограмма для одного выбранного размера (0,1 мкм), используйте эту гистограмму для получения положительного затвора для каждого флуорохрома и размера. (C) Рабочее пространство, созданное с положительными вентильными элементами для каждого флуорохрома и размера. (D) Рабочее пространство (слева) и редактор макетов (справа) созданы для образцов. В Редакторе раскладок показана гистограмма для автофлуоресцентной трубки и положительной трубки для FL1-H, а также способ получения свойств панели для их изменения. (E) На изображении показано, как получить среднее значение интенсивности флуоресценции. (F) Гистограммы, сгенерированные для трех различных флуорохромов, показывающие все изменения, которые программное обеспечение позволяет сделать со статистической информацией. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Примените сгенерированные вентили (0,1, 0,3, 0,5 и 0,9 мкм) ко всем образцам. Выберите элементы Gates, перетащите их в опцию All Samples , как показано на рисунке 5A.
- Нажмите на автофлуоресцентную трубку. Установите положительные области для каждого флуорохрома, для каждого размера. Откройте точечную диаграмму SSC-H VS FSC-H с размером вентилей, нажмите на Single Gate Size. В новом окне нажмите на ось y, чтобы выбрать вариант гистограммы. По оси X выберите FL1-H, затем щелкните значок «Диапазон », чтобы создать положительную область. Повторите эту операцию для FL2-H и FL4-H (см. рис. 5B).
- Примените затворы ко всем образцам. Выберите Gates, перетащите курсор в опцию All Samples , как показано на рисунке 5C.
- Откройте Редактор макетов.
- Перетащите каждый образец в редакторе. Выберите размер «автофлуоресцентной» трубки, перетащите, затем выберите такой же размер окрашенной трубки, перетащите и бросьте.
- Нажмите на правый низ гистограммы. Откройте меню «Свойства ». Нажмите на Легенда. Добавьте среднюю интенсивность для флуорохрома.
ПРИМЕЧАНИЕ: В разделе "Свойства" есть и другие доступные инструменты для изменения внешнего вида гистограммы. - Повторите ту же процедуру для остальных флуорохромов и размеров.
5. Анализ для получения количества uEV на образец.
ПРИМЕЧАНИЕ: На рисунке 6 показано рабочее пространство с инструкциями по получению количества uEV на образец.
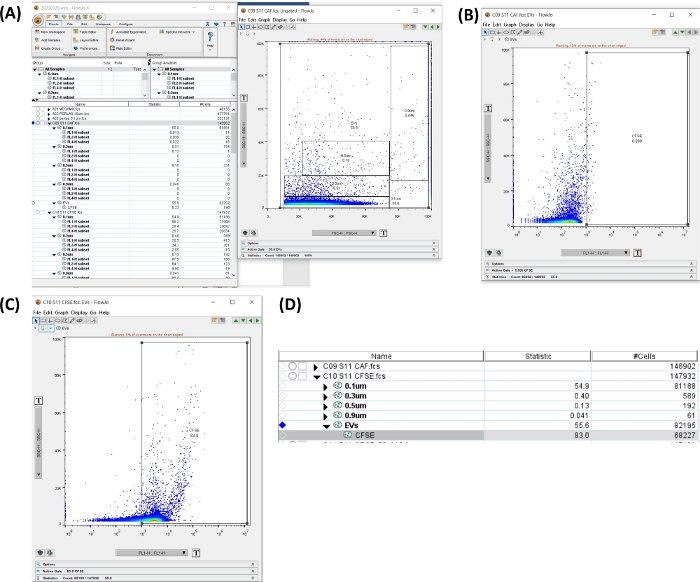
Рисунок 6: Рабочее пространство для анализа трубки CFSE. Все изображения были сгенерированы методом трафаретной печати рабочего пространства. (A) Рабочая область, созданная путем выбора всех размеров области, общего количества uEVs (слева), точечной диаграммы, показывающей выбранный вентиль (справа). (B) Точечная диаграмма SSC-H В ЗАВИСИМОСТИ ОТ FL1-H для отрицательной области CFSE в автофлуоресцентной трубке. (C) Точечная диаграмма SSC-H В СРАВНЕНИИ С FL1-H для CFSE в окрашивающей трубке. (D) Полученное изображение таблицы со статистикой окрашивания CFSE, показывающей количество uEV в образце. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Нажмите на Автофлуоресцентная трубка. На точечной диаграмме SSC-H VS FSC-H с размерами вентигл создайте область, включающую все размеры. Нажмите на «Новый регион». Установите положительную область (см. рис. 6A,B).
- Примените затворы ко всем образцам. Выберите ворота, перетащите их в опцию « Все сэмплы ».
- Нажмите на трубку CFSE + uEVs. Откройте новую область и проверьте положительную область для CFSE (FL1-H), как показано на рисунке 6C.
- В рабочей области на рисунке 6D скопируйте данные # ячеек для трубки. Это число является #uEVs, полученным с помощью проточной цитометрии (#uEVs ФК).
- Примените следующую формулу для расчета количества uEV на микролитр:
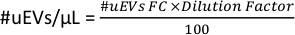
- Чтобы иметь #uEVs на микролитр для каждого флуорохрома (#uEVs/μL FLX), в рабочей области скопируйте статистику для подмножества FLX-H, это число является процентом (%FLX подмножество).
- Примените следующую формулу для расчета количества uEV на микролитр для каждого флуорохрома.
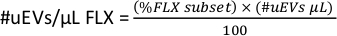
ПРИМЕЧАНИЕ: В зависимости от того, будут ли выбранные ворота для одного размера или для всех uEV, проверьте выбранные данные.
Access restricted. Please log in or start a trial to view this content.
Результаты
Есть несколько контрольных точек через протокол и до окрашивания uEV. Поэтому важно сначала проверить количество белка, присутствующего в экстракте uEVs. Все исследовательские группы, работающие с внеклеточными везикулами, количественно определяют содержание белка, ка...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В настоящее время использование внеклеточных везикул в качестве биомаркеров для некоторых заболеваний возросло, особенно для тех, которые могут быть выделены из неинвазивных источников, таких как моча 5,21,22,23,24....
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что исследование проводилось в отсутствие каких-либо финансовых или коммерческих отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана грантами CONACyT (A3-S-36875) и Программой UNAM-DGAPA-PAPIIT (IN213020 и IA202318). NH-I была поддержана стипендией 587790 от CONACyT.
Авторы хотят поблагодарить Леопольдо Флорес-Ромо†, Вианни Ортис-Наваррете, Энтони Букара-младшего и Диану Гомес-Мартин за их ценные советы по реализации этого протокола, а также всех здоровых людей за их образцы мочи.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| APC anti human CD156c (ADAM10) antibody | BioLegend | 352706 | Add 5 µL to the 20 µL of uEVs in PBS |
| APC anti human TSPAN33 (BAAM) antibody | BioLegend | 395406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Avanti centrifuge with JA-25.5O fixed angle rotor | Beckamn Coulter | J-26S XPI | |
| BD Accuri C6 Flow Cytometer | BD Biosciences | ||
| β-mercaptoethanol | SIGMA-Aldrich | M3148 | |
| Benchtop centrifuge with A-4-44 rotor | Eppendorf | 5804 | |
| BLUEstain 2 protein ladder | GOLDBIO | P008 | |
| CD9 (C-4) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-13118 | |
| CD63 (MX-49.129.5) mouse monoclonal antibody | Santa Cruz Biotechnology | sc-5275 | |
| Cell Trace CFSE cell proliferation kit for flow cytometry | Thermo Scientific | C34554 | |
| Chemidoc XRS+ system | BIORAD | 5837 | |
| FITC anti human CD9 antibody | BioLegend | 312104 | Add 5 µL to the 20 µL of uEVs in PBS |
| FITC anti human CD37 antibody | BioLegend | 356304 | Add 5 µL to the 20 µL of uEVs in PBS |
| Fluorescent yellow particles | Spherotech | FP-0252-2 | |
| Fluorescent yellow particles | Spherotech | FP-0552-2 | |
| Fluorescent yellow particles | Spherotech | FP-1552-2 | |
| FlowJo Software | Becton, Dickinson and Company | ||
| Goat anti-mouse immunoglobulins/HRP | Dako | P0447 | |
| Halt protease inhibitor cocktail | Thermo Scientific | 78429 | |
| Immun-Blot PVDF membrane 0.22µm | BIORAD | 1620177 | |
| Megamix-Plus FSC beads | COSMO BIO CO.LTD | 7802 | |
| NuPAGE LDS sample buffer 4X | Thermo Scientific | NP0007 | |
| Optima ultracentrifuge with rotor 90Ti fixed angle 355530 | Beckamn Coulter | XPN100 | |
| Page Blue protein staining solution | Thermo Scientific | 24620 | |
| PE anti human CD53 antibody | BioLegend | 325406 | Add 5 µL to the 20 µL of uEVs in PBS |
| Pierce BCA Protein assay kit | Thermo Scientific | 23227 | |
| Pierce RIPA buffer | Thermo Scientific | 89900 | |
| Polycarbonate thick wall centrifuge tubes | Beckamn Coulter | 355630 | |
| Spherotech 8-Peak validation beads (FL1-FL3) | BD Accuri | 653144 | |
| Spherotech 6-Peak validation beads (FL4) | BD Accuri | 653145 | |
| Sucrose | SIGMA-Aldrich | 59378 | |
| Triethanolamine | SIGMA-Aldrich | 90279 |
Ссылки
- Decramer, S., et al. Urine in clinical proteomics. Molecular & Cellular Proteomics. 7 (10), 1850-1862 (2008).
- Nawaz, M., et al. The emerging role of extracellular vesicles as biomarkers for urogenital cancers. Nature Reviews Urology. 11 (12), 688-701 (2014).
- Pisitkun, T., Johnstone, R., Knepper, M. A. Discovery of urinary biomarkers. Molecular & Cellular Proteomics. 5 (10), 1760-1771 (2006).
- Urinology Think Tank Writing Group. Urine: Waste product or biologically active tissue. Neurourology and Urodynamics. 37 (3), 1162-1168 (2018).
- Wang, S., Kojima, K., Mobley, J. A., West, A. B. Proteomic analysis of urinary extracellular vesicles reveal biomarkers for neurologic disease. EBioMedicine. 45, 351-361 (2019).
- Merchant, M. L., Rood, I. M., Deegens, J. K. J., Klein, J. B. Isolation and characterization of urinary extracellular vesicles: implications for biomarker discovery. International Urology and Nephrology. 13 (12), 731-749 (2017).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Jing, H., et al. The role of extracellular vesicles in renal fibrosis. Cell Death and Disease. 10 (5), 367(2019).
- Liu, X., et al. Tubule-derived exosomes play a central role in fibroblast activation and kidney fibrosis. Kidney International. 97 (6), 1181-1195 (2020).
- Quaglia, M., et al. Extracellular Vesicles as Mediators of Cellular Crosstalk Between Immune System and Kidney Graft. Frontiers in Immunology. 11, 74(2020).
- Simpson, R. J., Lim, J. W., Moritz, R. L., Mathivanan, S. Exosomes: proteomic insights and diagnostic potential. Expert Review of Proteomics. 6 (3), 267-283 (2009).
- Street, J. M., Koritzinsky, E. H., Glispie, D. M., Star, R. A., Yuen, P. S. Urine Exosomes: An Emerging Trove of Biomarkers. Advances in Clinical Chemistry. 78, 103-122 (2017).
- Thongboonkerd, V. Roles for Exosome in Various Kidney Diseases and Disorders. Frontiers in Pharmacology. 10, 1655(2019).
- Watanabe, Y., et al. Molecular Network Analysis of the Urinary Proteome of Alzheimer's Disease Patients. Dementia and Geriatric Cognitive Disorders Extra. 9 (1), 53-65 (2019).
- Jadli, A. S., Ballasy, N., Edalat, P., Patel, V. B. Inside(sight) of tiny communicator: exosome biogenesis, secretion, and uptake. Molecular and Cellular Biochemistry. 467 (1-2), 77-94 (2020).
- Svenningsen, P., Sabaratnam, R., Jensen, B. L. Urinary extracellular vesicles: Origin, role as intercellular messengers and biomarkers; efficient sorting and potential treatment options. Acta Physiologica. 228 (1), 13346(2020).
- Witwer, K. W., Thery, C. Extracellular vesicles or exosomes? On primacy, precision, and popularity influencing a choice of nomenclature. Journal of Extracellular Vesicles. 8 (1), 1648167(2019).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Perez-Hernandez, J., et al. Increased Urinary Exosomal MicroRNAs in Patients with Systemic Lupus Erythematosus. PLoS One. 10 (9), 0138618(2015).
- Freyssinet, J. M., Toti, F. Membrane microparticle determination: at least seeing what's being sized. Journal of Thrombosis and Haemostasis. 8 (2), 311-314 (2010).
- D'Anca, M., et al. Exosome Determinants of Physiological Aging and Age-Related Neurodegenerative Diseases. Frontiers in Aging Neuroscience. 11, 232(2019).
- Lawson, C., Vicencio, J. M., Yellon, D. M., Davidson, S. M. Microvesicles and exosomes: new players in metabolic and cardiovascular disease. Journal of Endocrinology. 228 (2), 57-71 (2016).
- Lee, S., Mankhong, S., Kang, J. H. Extracellular Vesicle as a Source of Alzheimer's Biomarkers: Opportunities and Challenges. International Journal of Molecular Sciences. 20 (7), (2019).
- Mori, M. A., Ludwig, R. G., Garcia-Martin, R., Brandao, B. B., Kahn, C. R. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. Cell Metabolism. 30 (4), 656-673 (2019).
- Hoorn, E. J., et al. Prospects for urinary proteomics: exosomes as a source of urinary biomarkers. Nephrology (Carlton). 10 (3), 283-290 (2005).
- Ranghino, A., Dimuccio, V., Papadimitriou, E., Bussolati, B. Extracellular vesicles in the urine: markers and mediators of tissue damage and regeneration. Clinical Kidney Journal. 8 (1), 23-30 (2015).
- Zhang, W., et al. Extracellular vesicles in diagnosis and therapy of kidney diseases. American Journal of Physiology-Renal Physiology. 311 (5), 844-851 (2016).
- Fernandez-Llama, P., et al. Tamm-Horsfall protein and urinary exosome isolation. Kidney International. 77 (8), 736-742 (2010).
- Royo, F., et al. Different EV enrichment methods suitable for clinical settings yield different subpopulations of urinary extracellular vesicles from human samples. Journal of Extracellular Vesicles. 5, 29497(2016).
- Rider, M. A., Hurwitz, S. N., Meckes, D. G. ExtraPEG: A Polyethylene Glycol-Based Method for Enrichment of Extracellular Vesicles. Scientific Reports. 6, 23978(2016).
- Lv, C. Y., et al. A PEG-based method for the isolation of urinary exosomes and its application in renal fibrosis diagnostics using cargo miR-29c and miR-21 analysis. International Urology and Nephrology. 50 (5), 973-982 (2018).
- Alvarez, M. L., Khosroheidari, M., Kanchi Ravi, R., DiStefano, J. K. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney International. 82 (9), 1024-1032 (2012).
- Wang, D., Sun, W. Urinary extracellular microvesicles: isolation methods and prospects for urinary proteome. Proteomics. 14 (16), 1922-1932 (2014).
- Pospichalova, V., et al. Simplified protocol for flow cytometry analysis of fluorescently labeled exosomes and microvesicles using dedicated flow cytometer. Journal of Extracellular Vesicles. 4, 25530(2015).
- van der Pol, E., et al. Standardization of extracellular vesicle measurements by flow cytometry through vesicle diameter approximation. Journal of Thrombosis and Haemostasis. 16 (6), 1236-1245 (2018).
- Huyan, T., Du, Y., Huang, Q., Huang, Q., Li, Q. Uptake Characterization of Tumor Cell-derived Exosomes by Natural Killer Cells. Iranian Journal of Public Health. 47 (6), 803-813 (2018).
- Puzar Dominkus, P., et al. PKH26 labeling of extracellular vesicles: Characterization and cellular internalization of contaminating PKH26 nanoparticles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1860 (6), 1350-1361 (2018).
- Morales-Kastresana, A., et al. Labeling Extracellular Vesicles for Nanoscale Flow Cytometry. Scientific Reports. 7 (1), 1878(2017).
- de Rond, L., et al. Comparison of Generic Fluorescent Markers for Detection of Extracellular Vesicles by Flow Cytometry. Clinical Chemistry. 64 (4), 680-689 (2018).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены