Method Article
تحضير جل الببتيد المحدد من قبل المستخدم لنماذج الثقافة ثلاثية الأبعاد الخاضعة للرقابة للسرطان والأمراض
In This Article
Summary
نقدم طريقة لإنشاء بيئة ثقافة خلية ثلاثية الأبعاد ، والتي يمكن استخدامها للتحقيق في أهمية تفاعلات الخلية / المصفوفة في تطور السرطان. باستخدام ثماني البتيد البسيط ذاتي التجميع ، يمكن التحكم في المصفوفة المحيطة بالخلايا المغلفة ، مع تنظيم مستقل للإشارات الميكانيكية والكيميائية الحيوية.
Abstract
هناك وعي متزايد بأن الخلايا المزروعة في 3D نموذج أفضل في السلوك في الجسم الحي من تلك التي نمت في 2D. في هذا البروتوكول ، نصف هيدروجيل ثلاثي الأبعاد بسيط وقابل للضبط ، ومناسب لزراعة الخلايا والأنسجة في بيئة تتناسب مع بيئتها الأصلية. هذا مهم بشكل خاص للباحثين الذين يبحثون في بدء السرطان ونموه وعلاجه حيث يكون التفاعل بين الخلايا ومصفوفتها المحلية خارج الخلية جزءا أساسيا من النموذج. قد يكون الانتقال إلى الثقافة ثلاثية الأبعاد أمرا صعبا وغالبا ما يرتبط بنقص قابلية التكرار بسبب التباين الكبير من دفعة إلى دفعة في مصفوفات الاستزراع ثلاثية الأبعاد المشتقة من. وبالمثل ، يمكن أن تحد مشكلات التعامل من فائدة الهلاميات المائية الاصطناعية. استجابة لهذه الحاجة ، قمنا بتحسين جل الببتيد البسيط ذاتي التجميع ، لتمكين زراعة نماذج خط الخلايا ذات الصلة بالسرطان والمرض ، بالإضافة إلى الأنسجة / الخلايا المشتقة من المريض. الجل نفسه خال من مكونات المصفوفة ، بصرف النظر عن تلك المضافة أثناء التغليف أو الترسيب في الجل بواسطة الخلايا المغلفة. يمكن أيضا تغيير الخواص الميكانيكية للهلاميات المائية بشكل مستقل عن إضافة المصفوفة. لذلك ، فهي تعمل بمثابة "لوحة فارغة" تسمح للباحثين ببناء بيئة ثقافة ثلاثية الأبعاد تعكس الأنسجة المستهدفة ذات الأهمية وتشريح تأثيرات القوى الميكانيكية و / أو التحكم الكيميائي الحيوي في سلوك الخلية بشكل مستقل.
Introduction
أصبحت الأدوار العديدة التي تلعبها البيئة خارج الخلية في تطور السرطان وتطوره أكثر وضوحا من أي وقت مضى1. في الآونة الأخيرة ، أضافت التحليلات التفصيلية القائمة على البروتين إلى قاعدة أدبية مقنعة بالفعل ، مما يدل على أن مكونات المصفوفة المشتقة من الخلايا اللحمية المرتبطة بالسرطان ، أو الخلايا السرطانية نفسها ، هي عوامل رئيسية في أحداث مثل تعزيز الانتقال اللحمي المتوسط الظهاري والانتشار النقيلي2،3،4. نظرا لهذه الأهمية المعترف بها للمصفوفة خارج الخلية (ECM) ، أصبح من الضروري التحرك نحو منصات زراعة الخلايا التي تسمح بالتحكم في البيئة ثلاثية الأبعاد المقدمة للخلايا. استجابة لهذه الحاجة ، يقدم هذا البروتوكول طريقة لتغليف الخلايا وثقافتها في هيدروجيل ثلاثي الأبعاد ، مع تكوين ECM محدد من قبل المستخدم وخصائص ميكانيكية5.
حاليا ، هناك علاقة ضعيفة بين الفعالية العلاجية للسرطان في 2D في الثقافة المختبرية ، وتأثير هذه العلاجات في نماذج حالية في الجسم الحي (xenograft مشتقة من المريض ، PDX) ونشاطها النهائي في التجارب السريرية6،7. وقد أدى ذلك إلى إخفاقات كبيرة في خط أنابيب اكتشاف الأدوية مع الحاجة الملحة إلى نماذج محسنة في المختبر تسمح للعلاجات المختبرة "بالفشل المبكر والفشل بثمن بخس". يستخدم العديد من الباحثين المنتج المشتق من ورم الخلايا البدينة للفأر ، على سبيل المثال ، Matrigel (أو منتجات مماثلة) لإنشاء بيئات غنية بالمصفوفة ثلاثية الأبعاد للنمو ومراقبة سلوك الخلية في المختبر ، بما في ذلك الخلايا المشتقة من PDX وغيرها من الخلايا القريبة من المريض8،9،10. ومع ذلك ، فإن نهج "الحجم الواحد يناسب الجميع" هذا يتجاهل الدور المعقد الذي تلعبه بروتينات المصفوفة / الجليكان في بدء السرطان وتطوره.
كما شجع التعرف على دور المصفوفة خارج الخلية (ECM) في التحكم في سلوك الخلية على استخدام ثقافة ثلاثية الأبعاد في أو على الهلاميات المائية المكونة من مكونات مصفوفة محددة11. في حين أن هذا مفيد للتحقيق في تفاعلات محددة ، إلا أن هذه الأنظمة تعاني من عدم القدرة على فصل التعليمات الميكانيكية والكيميائية الحيوية بين الخلايا والمصفوفة. قد يكون من الصعب أيضا التعامل معها ويمكن أن تعطي قراءات غير واضحة لسلوك الخلية. تعتبر المواد الهلامية الكولاجين مثالا رئيسيا على هذه المشكلة ، حيث أن تقلص الهلام بوساطة الخلية يمكن أن يقلل بشكل كبير من القدرة على تصور الخلايا داخل الجل5. هناك أيضا بعض أنظمة الهلام الأنيقة للغاية ومتعددة المكونات ، والتي استخدمها الخبراء لتأثير كبير12،13،14. يمكن أن تتضمن هذه الروابط الحساسة للإنزيم والزخارف النشطة بيولوجيا ولكنها أكثر تعقيدا بشكل ملحوظ في صياغتها وتطبيقها من النظام الموصوف هنا.
يصف هذا البروتوكول طريقة لإنشاء نماذج ثقافة ثلاثية الأبعاد محددة بالكامل ، مما يسمح بنمذجة أدوار ECM في التطور والمرض في المختبر. أساس النموذج ثلاثي الأبعاد هو هلام الببتيد ، والذي وصفناه سابقا بأنه تحسين هيدروجيل ثماني البتيد البسيط ذاتي التجميع5،15،16. من خلال الابتعاد عن المصفوفات المعقدة المشتقة من ، يوفر هذا النظام فائدة كبيرة لتحسين الاتساق من دفعة إلى دفعة وتحسين المناولة في حالته البسيطة ، لا يحتوي الببتيد على زخارف مشتقة من المصفوفة ويوفر بشكل فعال "لوحا فارغا" يمكن للمستخدم بناء الوظائف عليه.
نوضح كيف يمكن تنظيم الخواص الميكانيكية لهلام الببتيد بشكل مستقل ، جنبا إلى جنب مع دمج بروتينات المصفوفة / الجليكانات. النظام قابل للضبط بدرجة كبيرة ، مما يسمح بتغليف مجموعة من أنواع الخلايا بتنسيقات مختلفة. الأهم من ذلك لبناء نموذج السرطان ، يمكن أيضا دمج الخلايا اللحمة: إما في الزراعة المشتركة المباشرة أو فصلها للسماح بتحليل محدد للتفاعلات غير المباشرة بين الخلايا السرطانية والسدى. والأهم من ذلك ، أن البروتوكول الموصوف هنا لا يتطلب معرفة معقدة بالكيمياء ويمكن استنساخه في أي مختبر لزراعة الخلايا دون الحاجة إلى معرفة أو معدات كيميائية متخصصة.
لقد قمنا بتحسين الأساليب لدراسة سلوك الخلية في المواد الهلامية الببتيدية ، بما في ذلك التصوير والتحليل الريولوجي واستخراج المواد ل PCR5 والتضمين للتقييم النسيجي. من الفوائد الواضحة لنظام الهيدروجيل البسيط القدرة على تصور ودراسة المصفوفة المودعة بواسطة الخلايا المغلفة. تم تسليط الضوء مؤخرا على أهمية المصفوفات المشتقة من الخلايا وفوائد الفهم الأفضل لكيفية إعادة هندسة الخلايا لبيئتها المكروية المحلية17 وتعكس وعيا متزايدا بأهمية محاصرة مكونات المصفوفة التي تفرز الخلايا ، بطريقة مماثلة لتلك التي تحدث في الجسم الحي. قد يكون تسخير القدرة على نمذجة مثل هذه العمليات أحد الدوافع الأساسية لتحسين أهمية المريض لنماذج الأمراض القائمة على الهيدروجيل.
Protocol
1. انحلال الببتيد
- في شفاط زراعة الأنسجة، أضف 800 ميكرولتر من الماء المعقم إلى أنبوب سعة 15 مل باستخدام ماصة P1000.
- باستخدام ميزان دقيق ، قم بوزن مسحوق الببتيد في قارب وزن غير ثابت. استخدم كتلة (بالملغ) تبلغ 1.25 ضعف تركيز هلام الببتيد النهائي المطلوب (بالملغم / مل ، الجدول 1).
ملاحظة: ستنتج الطريقة الموضحة هنا حجما يبلغ حوالي 1.25 مل من هلام الببتيد لكل أنبوب عند نقطة التبلور النهائي. يمكن تحضير أنابيب متعددة في وقت واحد ، أو بدلا من ذلك يمكن زيادة الحجم لكل أنبوب عندما يكون المستخدم من ذوي الخبرة في الطريقة المقدمة.
| تركيز الببتيد (بعد التبلور النهائي) | كتلة الببتيد | إضافة هيدروكسيد الصوديوم الأولية |
| 6 ملغم/مل | 7.5 مجم | 30 ميكرولتر |
| 10 ملغم/مل | 12.5 مجم | 60 ميكرولتر |
| 15 ملغم/مل | 18.75 مجم | 100 ميكرولتر |
الجدول 1: كتلة الببتيد وإضافة هيدروكسيد الصوديوم الأولية المقترحة لتركيزات الهلام النهائية النموذجية. يمكن تمديد نطاقات تركيزات الببتيد المدرجة في أي من الاتجاهين ، ومع ذلك ، فمن المرجح ألا تشكل تركيزات الببتيد المنخفضة مواد هلامية مستقرة ، بينما عند التركيزات العالية قد يكون الجل الناتج كثيفا جدا للسماح بتبادل المغذيات الكافي وصلاحية الخلية. سيتطلب التركيز المناسب تحسينا لأنواع الخلايا المختلفة ودفعات الببتيد.
- أضف الببتيد الموزون في أنبوب 15 مل. قم بتحريك قارب الوزن لضمان عدم ترك أي مسحوق.
ملاحظة: يمكن أن يكون مسحوق الببتيد ثابتا جدا ، احرص على تقليل فقدان المسحوق. ليس من الضروري الحفاظ على ظروف معقمة خلال الخطوتين 1.2 و 1.3 (أو لأي قياسات للأس الهيدروجيني) حيث يحدث التعقيم أثناء الحضانة عند 80 درجة مئوية في وقت لاحق من العملية. - دوامة لمدة 3 دقائق ، ثم جهاز طرد مركزي عند 200 × جم لمدة 3 دقائق.
- احتضان محلول الببتيد في فرن على حرارة 80 درجة مئوية لمدة 2 ساعة على الأقل. في حالة وجود الببتيد غير المذاب بعد الحضانة ، كرر الخطوة 1.4.
ملاحظة: نظرا لأن التسخين المنتظم ضروري ، فإن الكتلة الحرارية ليست مناسبة لهذه الخطوة. ومع ذلك ، فقد وجدنا أن أفران التهجين تعمل بشكل جيد كما يعمل الحمام المائي طالما أن محلول الببتيد مغمور بالكامل.
2. تشكيل سلائف هلام
- قم بإعداد محلول هيدروكسيد الصوديوم المعقم 0.5 M (NaOH) باستخدام الماء المعقم.
ملاحظة: يوصى باستخدام محلول هيدروكسيد الصوديوم المخفف حديثا للحصول على معظم النتائج المتسقة. - في غطاء زراعة الأنسجة ، أضف 0.5 M هيدروكسيد الصوديوم إلى وسط الببتيد المذاب واخلطه عن طريق التقليب البطبط مع طرف الماصة (الجدول 1).
- قم بتدوير الأنبوب لمدة 10 ثوان وجهاز الطرد المركزي عند 200 × جم لمدة 10 ثوان لإزالة الفقاعات.
- إذا كانت سلائف الجل غائمة ، كرر الخطوتين 2.2 و 2.3 ، مع إضافة زيادات قدرها 5 ميكرولتر من هيدروكسيد الصوديوم .
ملاحظة: يمكن أن يساعد قياس الأس الهيدروجيني في تحديد ما إذا كان قد تمت إضافة ما يكفي من هيدروكسيد الصوديوم: يتراوح الرقم الهيدروجيني الأمثل بين 9-10.5 ويفضل عدم تجاوز ذلك لأن استخدام الأحماض لإعادة الأس الهيدروجيني إلى الأسفل يمكن أن يؤدي إلى عدم تجانس الهلام. قد يختلف الحجم الدقيق لهيدروكسيد الصوديوم المطلوب باختلاف مصدر الببتيد. - بمجرد أن تصبح سلائف الجل واضحة بصريا وذاتية الدعم (أو تتدفق فقط) عند انعكاس أنبوب 15 مل ، أضف 100 ميكرولتر من PBS المعقم 10x في غطاء زراعة الأنسجة. دوامة لمدة 10 ثوان وجهاز طرد مركزي عند 200 × جم لمدة 10 ثوان.
ملاحظة: إذا كانت سلائف الجل غائمة ، كرر الخطوة 2.4 حتى تصبح صافية وشبه صلبة. إذا كانت سلائف الجل سائلة (أعلى من درجة الحموضة ~ 10.5) ، فلن تشكل هلامية مستقرة ويجب التخلص منها. - احتضن طوال الليل في فرن على حرارة 80 درجة مئوية.
- تحقق بصريا من سلائف الجل للتأكد من أنها سائلة بالكامل عند 80 درجة مئوية.
- إذا لم تكن سلائف الجل سائلة بالكامل عند 80 درجة مئوية ، فلن يتم تحييدها بشكل كاف ، أضف هيدروكسيد الصوديوم باتباع الخطوة 2.4.
- إذا كانت سلائف الجل سائلة ولكن توجد فقاعات هواء أو رواسب صغيرة ، فقم بنفض الغبار عن الأنبوب بحدة لتفريقها. إذا استمرت فقاعات الهواء أو الرواسب بعد النقر على الأنبوب ، فقم بتدوير سلائف الجل وجهاز الطرد المركزي عند 200 × جم لمدة 10 ثوان لكل منهما.
- بعد اتباع أي من الخطوتين 2.7.1 أو 2.7.2 ، احتضان المواد الهلامية للسلائف لمدة ساعتين أخريين عند 80 درجة مئوية قبل الشروع في التبلور النهائي.
- احتفظ بسلائف الجل عند 80 درجة مئوية لحين الحاجة (48 ساعة كحد أقصى).
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا ، وتخزين سلائف الجل عند 4 درجات مئوية لمدة تصل إلى 4 أسابيع. في حالة إعادة التشغيل من نقطة الإيقاف المؤقت هذه ، احتضان سلائف الجل عند 80 درجة مئوية لمدة ساعتين على الأقل ، وأعد التشغيل من الخطوة 2.7. يوصى بشدة بإعداد سلائف الجل قبل الحاجة إليها في التبلور النهائي ، لضمان وجود وقت كاف للتعديلات المذكورة أعلاه إذا لزم الأمر.
3. تحضير مكونات المصفوفة للبذر
ملاحظة: يظهر مثال على حساب الخطوات من 3 إلى 5 في الشكل 1. قد يتم حذف الخطوة 3 والخطوة 4 لإنتاج هلام خال من المصفوفة و / أو خال من الخلايا على التوالي.
- احسب الحجم الإجمالي للخلايا والمصفوفة والوسائط المطلوبة للبذر ، مما يسمح بإضافة 250 ميكرولتر إلى كل هلام سليفة سعة 1 مل. اضرب هذا الحجم في 1.1 للسماح بحدوث خطأ في سحب العينات. هذا هو حجم البذر ، VS.
- لكل مكون مصفوفة ، احسب حجم محلول المخزون المراد إضافته إلى حجم البذر باستخدام المعادلة 1:
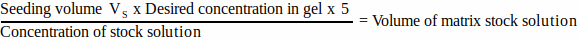 (1)
(1)
ملاحظة: يتوافق VS مع الحجم الإجمالي لوسط البذر المطلوب لبذر جميع المواد الهلامية (الخطوة 3.1). تأكد من أن مجموع جميع أحجام مكونات المصفوفة لا يتجاوز VS. - قم بإذابة جميع مكونات المصفوفة جيدا (راجع تعليمات الشركة المصنعة) واحفظها على الثلج لحين الحاجة.
ملاحظة: ستكون بعض مكونات المصفوفة عرضة جدا للهلام. راجع تعليمات الشركة المصنعة لتجنب حدوث ذلك. - إذا كان سيتم إضافة محلول مخزون الكولاجين الحمضي الذي يتطلب تحييدا (راجع تعليمات الشركة المصنعة) ، فقم بإعداد محلول التحييد على النحو التالي:
- احسب حجم محلول مخزون الكولاجين ، VC ، المطلوب باستخدام المعادلة 1.
- حدد حجما مناسبا لمحلول التحييد ، VN. يجب اختيار هذا بحيث لا يتجاوز الحجم المجمع لجميع إضافات المصفوفة حجم البذر ، VS.
ملاحظة: بشكل عام ، قيمة معقولة ل VN = 2 × Vc ، ولكن يمكن تعديلها وفقا لعدد وحجم مكونات المصفوفة الأخرى المراد إضافتها. - احسب حجم 1 M هيدروكسيد الصوديوم المطلوب للتحييد باستخدام المعادلة 2.
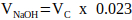 (2)
(2) - احسب حجم 10x PBS المطلوب في محلول التحييد باستخدام المعادلة 3.
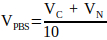 (3)
(3) - اجمع بين الأحجام المحسوبة البالغة 1 M هيدروكسيد الصوديوم و 10x PBS ، ثم اصنع ما يصل إلى VN بالماء المعقم. تخلط جيدا وتخزن على الثلج لحين الحاجة.
ملاحظة: لا تضيف الكولاجين الحمضي في هذه المرحلة. سيؤدي الخلط المبكر للكولاجين مع محلول التحييد إلى بدء تكوين ليفي الكولاجين ، والذي يمكن أن يسبب عدم تناسق في خصائص هلام الببتيد النهائي.
4. تحضير الخلايا للبذر
- إذا لم يكن قد اكتمل بالفعل ، فاحسب حجم البذر ، VS وفقا للخطوة 3.1.
- احسب كثافة الخلية المطلوبة في معلق الخلية هذا ، عن طريق أخذ كثافة الخلية المطلوبة في هلام الببتيد النهائي وضربها في 5.
ملاحظة: تعليق الخلية هو 5 أضعاف التركيز النهائي المطلوب لحساب التخفيف عند الخلط بسلائف الجل. يجب تحسين كثافة الخلايا لكل خط خلية جديد قيد الدراسة. اعتمادا على نوع الخلية ، قد تكون الكثافة بين 1 × 104 و 1 × 106 خلايا / مل في هلام الببتيد النهائي مناسبة. - احسب العدد الإجمالي للخلايا المطلوبة للبذر (اضرب كثافة الخلية في حجم البذر VS المحسوب في الخطوة 4.1.).
- باستخدام طرق الثقافة / المرور القياسية للخلايا المستخدمة ، قم بإعداد حبيبات خلية تحتوي على الكمية المطلوبة من الخلايا كما هو محسوب.
5. التبلور النهائي / تغليف الخلية
- عندما تكون جاهزا لبدء الهلام النهائي ، انقل سلائف الجل من فرن 80 درجة مئوية إلى حمام مائي 37 درجة مئوية.
ملاحظة: يجب أن تكون سلائف الجل ذاتية الدعم عند 37 درجة مئوية. إذا كانت سائلة ، فمن غير المحتمل أن يحدث هلام كامل ، ويجب التخلص من سلائف الجل. - قم بإعداد صفيحة 96 بئر ، أو بدلا من ذلك صفيحة 24 بئرا (أو ما شابه) مع إدخالات زراعة الخلايا.
ملاحظة: تأكد من وجود فجوة بين قاعدة الملحق ولوحة البئر عند طلاء المواد الهلامية الببتيد في 24 إدراج بئر. هذا يضمن ملامسة الجل للوسائط. - إذا أردنا إضافة المصفوفة ، فقم بدمج جميع مكونات المصفوفة وحلول التحييد (الخطوة 3). اصنع ما يصل إلى VS (الخطوة 3.1) باستخدام وسط زراعة الخلايا واخلطه جيدا. إذا كانت الخلايا ستتم إضافتها ، فأعد تعليق حبيبات الخلية المحضرة في الخطوة 4 باستخدام حجم البذر VS.
ملاحظة: إذا لم يتم تحضير مكونات مصفوفة في الخطوة 3 ، فاستخدم وسط زراعة الخلية لحجم البذر. هذا هو بشكل عام وسيط الثقافة القياسي لنوع الخلية المستخدم ، على الرغم من أن هذا قد يحتاج إلى التحقق من الصحة إذا تم استخدام خليط من أنواع الخلايا. - باستخدام ماصة P1000، أضف 250 ميكرولتر من خلية الخلية/المصفوفة بلطف فوق سلائف الجل.
ملاحظة: قد تبدأ مكونات المصفوفة ، وخاصة مستخلص الغشاء القاعدي ، في البلمرة بمجرد إضافتها إلى سلائف الجل. لذلك ، من المهم الانتقال إلى الخطوة التالية في أسرع وقت ممكن. - امزج برفق عن طريق العمل المشترك لسحب العينات والتقليب. الجل عبارة عن ترقق للقص ، لذا سيصبح من الأسهل خلطه مع سحب العينات / التقليب اللطيف. عند الخلط جيدا ، أضف 100 ميكرولتر إلى كل بئر من صفيحة 96 بئر ، أو 200 ميكرولتر إلى كل إدراج لزراعة الخلايا.
ملاحظة: عند الخلط، يمكن أن يكون سحب العينات العكسي باستخدام مجموعة P1000 عند 200 ميكرولتر مفيدا لتجنب إدخال فقاعات الهواء. قد يكون من الصعب خلط الجل في البداية ، ولكن عند الخلط المستمر يجب أن يصبح أسهل - وهذا يشير إلى أن الخلط فعال. - احتضان لمدة 10 دقائق عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 وأجواء رطبة.
ملاحظة: هذه الخطوة ليست ضرورية إذا كان هلام الببتيد لا يحتوي على إضافات مصفوفة. - أضف 200 ميكرولتر من الوسائط إلى كل بئر من لوحة البئر 96 ، أو 1 مل إلى الجزء الخارجي من إدراج ثقافة الخلية مع بضع قطرات في الجزء العلوي من الجل. احتضان عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 وجو رطب.
- قم بتغيير الوسائط مرتين خلال الساعة التالية، ومرة أخرى بعد عدة ساعات (أو في اليوم التالي).
ملاحظة: توخي الحذر هنا لأن المواد الهلامية ستكون غير مستقرة لعدة ساعات. - قم بتغيير الوسائط كل 2-3 أيام (أو باتباع بروتوكول الثقافة القياسي للخلايا المستخدمة).
6. الثقافة المشتركة غير المباشرة
ملاحظة: هذه الطريقة قابلة للتطبيق فقط عندما يتم زرع المواد الهلامية الببتيد في 24 إدراج لوحة بئر ، أو تنسيقات مماثلة يمكن من خلالها دعم الجل فوق طبقة أحادية الخلية. يمكن إدخال الزراعة المشتركة غير المباشرة في هذه الحالة عن طريق إعداد طبقة تغذية ثنائية الأبعاد من الخلايا في قاع لوحة البئر.
- تحضير طبق 24 بئر للبذر. يجب أن تكون هذه لوحة منفصلة عن المواد الهلامية الببتيد ولكن يجب أن تكون من نفس العلامة التجارية لضمان التوافق مع الإدخالات المستخدمة (انظر الخطوة 5.2).
- احسب كثافة الخلية اللازمة لبذر الزراعة المشتركة غير المباشرة ، وفقا لنوع الخلية قيد الدراسة.
ملاحظة: يجب تحسين كثافة بذر الخلية لكل خط خلية جديد قيد الدراسة. يجب طلاء الخلايا لإعطاء ما يقرب من 30-50٪ التقاء. على سبيل المثال ، عادة ما يتم طلاء خط الخلايا الليفية الثديية البشرية HMFU19 بكثافة 1-5 × 104 خلايا / بئر. - باستخدام طرق الاستزراع / المرور القياسية للخلايا المستخدمة ، قم بإعداد معلق خلوي مناسب للبذر عند 1 مل / بئر ، باستخدام وسط النمو النموذجي لهذه الخلايا.
- قم بزرع معلق الخلية في صفيحة البئر ، 1 مل لكل بئر.
- احتضان عند 37 درجة مئوية في 5٪ ثاني أكسيد الكربون2 وأجواء رطبة للالتصاق لعدة ساعات أو بين عشية وضحاها. ثم قم بإزالة الوسط من الآبار.
- باستخدام ملقط معقم ، انقل 24 إدخالات صفيحة بئر تحتوي على المواد الهلامية الببتيد إلى الآبار الجديدة التي تحتوي على الخلايا المصنفة مسبقا في 2D. أضف 1 مل من القطرة المتوسطة إلى الجزء الخارجي من الملحق وبضع قطرات على سطح الجل.
ملاحظة: عادة ما يكون الوسيط المستخدم في هذه المرحلة هو الوسيط المناسب للخلايا المغلفة في الجل ، ولكن قد تحتاج ملاءمة هذه الوسيطة للخلايا في 2D إلى التحقق أو التحسين للتجربة المعينة قيد الدراسة. - قم بإعداد طبقات التغذية الجديدة بانتظام لتجنب الإفراط في التقاء ، ونقل المواد الهلامية الببتيد إلى هذه الآبار الجديدة باتباع نفس الطريقة المذكورة أعلاه.
ملاحظة: عادة ، يتم تحضير خلايا الزراعة المشتركة غير المباشرة في نفس وقت بذر هلام الببتيد. يمكن بعد ذلك نقل المواد الهلامية الببتيدية إلى الزراعة المشتركة عند نقطة تغيير الوسائط بعد بضع ساعات أو حضانة بين عشية وضحاها ، انظر الخطوة 5.8.
7. الريولوجيا التذبذبية السائبة للمواد الهلامية الببتيد
ملاحظة: كمعيار ، يتم إجراء التوصيف الانسيابي بعد 24 ساعة من بذر الهلام ، والذي يجب أن يحدث في 24 إدراج لوحة بئر.
- قم بإعداد ومعايرة مقياس الريومتر وفقا لتعليمات الشركة المصنعة. استخدم هندسة لوحة متوازية بقطر اللوحة في أقرب وقت ممكن من قطر إدراج ثقافة الخلية.
ملاحظة: يمكن إجراء الاختبارات عند 37 درجة مئوية إذا رغبت في ذلك ، مما يؤدي إلى تكرار البيئة أثناء الاستزراع. - قم بإزالة عينة هلام الببتيد الأولى ليتم اختبارها من ملحق زراعة الخلية عن طريق قلب الملحق وقطع الغشاء البلاستيكي باستخدام مشرط.
ملاحظة: تأكد من أن اللوحة التي تحتوي على المواد الهلامية الببتيد خارج حاضنة زراعة الخلايا لأقصر وقت ممكن قبل الاختبار. تعتمد الوسائط المزودة بنظام تخزين مؤقت من البيكربونات على وجود ثاني أكسيد الكربون2 للحفاظ على درجة الحموضة. المواد الهلامية التي كانت خارج الحاضنة لفترة طويلة سوف تنجرف في درجة الحموضة ، مما قد يؤثر على التقييم الانسيابي. قد يكون من المفيد الحفاظ على المواد الهلامية مع إضافة 10 ملي مولار من HEPES إلى الوسائط لمنع هذا التأثير. - انقل الجل بعناية إلى لوحة مقياس الريومتر. بعد ذلك ، باستخدام مشرط ، قم بقص ارتفاع الجل إلى حوالي 1 مم لتقليل تشوه الهلام عند تحميله تحت لوحة مقياس الريومتر.
ملاحظة: احرص على عدم لمس أو تلف لوحة مقياس الريومتر عند استخدام المشرط. - اضبط تباعد اللوحة المتوازية على 1 مم. قم بقص أي هلام زائد لا تغطيه ألواح مقياس الريومتر.
- قم بتشغيل إعدادات الاختبار المطلوبة على مقياس الريومتر ، وفقا لتعليمات الشركة المصنعة.
ملاحظة: لكل حالة عينة جديدة ، ينصح بإجراء مسح سعة من 0.1-100٪ سلالة لضمان إجراء جميع الاختبارات على مستوى إجهاد داخل المنطقة اللزجة المرنة الخطية للعينة.
8. تلطيخ حي / ميت للخلايا المغلفة
- قم بإزالة الوسط من الآبار ، واغسل المواد الهلامية الببتيد مرتين باستخدام 1x PBS ، باستخدام نفس التقنية المستخدمة في تغيير الوسائط (الخطوة 5.7).
- قم بإزالة المواد الهلامية الببتيد التي تم زراعتها في 24 إدخالا للوحة البئر باتباع الخطوة 7.2. احتفظ بالمواد الهلامية في 1x PBS في لوحة البئر الأصلية حتى تصبح جاهزة للتلطيخ.
ملاحظة: توخي الحذر لأن المواد الهلامية يمكن أن تكون هشة في هذه المرحلة ، خاصة بعد الثقافة الممتدة. - قم بإعداد محلول تلطيخ حي / ميت ، مما يسمح بصبغة 500 ميكرولتر لكل 24 لوحة بئر ، أو 50 ميكرولتر لكل بئر من لوحة 96 بئر. البقعة النموذجية هي 4 ميكرومتر من homodimer الإيثيديوم و 2 ميكرومتر كالسيين AM في 1x PBS. حماية الحل الناتج من الضوء.
ملاحظة: قد تتطلب تركيزات الكواشف الحية / الميتة مزيدا من التحسين اعتمادا على نوع الخلية المستخدمة ومورد الكاشف. - قم بإزالة PBS بعناية من كل جل واستبدلها ببضع قطرات من محلول التلوين ، مع التأكد من تغطية كل جل جيدا.
- احتضن المواد الهلامية في محلول التلوين في الظلام لمدة 10-15 دقيقة ، ثم تصورها باستخدام مجهر كونفوكال / فلورسنت.
ملاحظة: للحصول على صور عالية الجودة ، قد يكون من المفيد نقل المواد الهلامية إلى أطباق ذات قاع زجاجي بسماكة الغطاء.
9. تحديد المواد الهلامية الببتيد للتصوير في النهاية
- اغسل المواد الهلامية الببتيد باتباع الخطوة 8.1.
- أضف 4٪ بارافورمالدهيد (PFA) في 1x PBS: 100 ميكرولتر لكل بئر من صفيحة 96 بئر و 1 مل لكل هلام في إدراج صفيحة 24 بئرا (يجب إضافة بضع قطرات فوق الجل داخل الإدراج).
تنبيه: بارافورمالدهيد (PFA) شديد السمية ويتم امتصاصه بسهولة من خلال الجلد. إنه مدمر للغاية للجلد والعينين والأغشية المخاطية والجهاز التنفسي العلوي. يجب التعامل مع PFA في غطاء الدخان ويجب على المستخدمين ارتداء ملابس وقفازات واقية. يمكن استخدام المثبتات الكيميائية البديلة بنفس الطريقة وفقا للتطبيق النهائي. - احتضان المواد الهلامية الببتيد في مثبت PFA لمدة 1 ساعة في درجة حرارة الغرفة.
- قم بإزالة مثبت PFA واغسل المواد الهلامية الببتيد مرتين باستخدام 1x PBS.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا ، وتخزين المواد الهلامية الببتيد الثابتة عند 4 درجات مئوية في 1x PBS لمدة تصل إلى 4 أسابيع ، مع التأكد من أن اللوحة محكمة الغلق بغشاء البارافين.
10. تضمين المواد الهلامية الببتيد للتقسيم
ملاحظة: يعد تضمين المواد الهلامية الببتيد في أجار 4٪ خطوة حاسمة قبل تضمين البارافين للكيمياء المناعية. بدلا من ذلك ، يمكن تضمين المواد الهلامية في أجار 2٪ وتقسيمها باستخدام اهتزاز (عادة ما تعطي أقسام 500 ميكرومتر نتائج جيدة). هذه خطوة اختيارية ، تنتج أقساما هلامية رطبة يمكن أن تكون مفيدة لتلوين توطين المصفوفة خارج الخلية في الجل ، باستخدام الطرق الواردة في القسم 11.
- تحضير محلول أجار منصهر بنسبة 2٪ أو 4٪ في 1x PBS (انظر الملاحظة أعلاه) ، عن طريق الغليان في الميكروويف. اتركيه ليبرد لبضع دقائق قبل الاستخدام.
ملاحظة: يمثل Molten agar خطرا على الحرارة - تعامل بحذر باستخدام حماية اليدين والوجه. بمجرد التحضير ، يمكن تخزين محلول أجار عند 4 درجات مئوية لحين الحاجة. - قم بإزالة هلام الببتيد من ملحق مزرعة الخلية باتباع الخطوة 7.2.
- باستخدام ماصة باستور بلاستيكية ، قم بتغطية قاعدة قالب التضمين النسيجي بطبقة رقيقة من محلول الأجار. اتركيه ليبرد عند 20 درجة مئوية لبضع ثوان.
- باستخدام ملعقة ، ضع جل الببتيد في وسط أجار. ثم قم بتغطية هلام الببتيد بالكامل في أجار.
ملاحظة: يجب ألا يغرق الجل في أجار. إذا حدث ذلك ، فقم بإزالة الجل وانتظر بضع ثوان أخرى حتى يتجمد الأجار أكثر وحاول مرة أخرى. حاول ألا تدع الكثير من التصلب يحدث وإلا سيكون هناك وصلة ضعيفة بين الطبقتين. - اترك الجل المدمج يبرد لمدة ساعة واحدة عند 4 درجات مئوية قبل إزالته من القالب النسيجي.
ملاحظة: يمكن إيقاف البروتوكول مؤقتا هنا ، وتخزين المواد الهلامية المدمجة عند 4 درجات مئوية في 1x PBS لمدة تصل إلى 4 أسابيع. - إذا كان سيتم إجراء الكيمياء النسيجية المناعية ، فضع المواد الهلامية المدمجة في معالج الأنسجة ، واستمر في استخدام طرق المختبر القياسية.
ملاحظة: بدلا من ذلك ، يمكن تقطيع المواد الهلامية المدمجة إلى أقسام رطبة باستخدام اهتزاز. يجب تخزين الأقسام الرطبة في أطباق محكمة الغلق عند 4 درجات مئوية في 1x PBS لمدة تصل إلى 4 أسابيع.
11. تلطيخ الخلايا في المواد الهلامية باستخدام الكيمياء المناعية
- قم بإزالة 1x PBS الذي يغطي أقسام المواد الهلامية / الهلامية الببتيدية. قم بإزالة أي مواد هلامية لا تزال في 24 إدخالا للوحة البئر باتباع الخطوة 7.2.
- قم بتغطية أقسام المواد الهلامية / الجل في مخزن مؤقت مانع واحتضانه لمدة 30 دقيقة عند 20 درجة مئوية.
ملاحظة: يتكون المخزن المؤقت النموذجي للحجب من 0.5٪ ألبومين مصل البقر (BSA) في 1x PBS مع 0.1٪ Triton X-100. Triton X-100 سام ويسبب تلفا خطيرا للعين وتهيج الجلد وهو شديد السمية للحياة المائية. يجب على المستخدمين ارتداء ملابس واقية وواقي للعين وقفازات. - تحضير الأجسام المضادة الأولية في حجب المخزن المؤقت بتركيزات عمل محسنة. اسمح ب 200 ميكرولتر لكل 24 بئر من هلام الألواح ، و 100 ميكرولتر لكل قسم هلام ، و 50 ميكرولتر لكل 96 لوحة بئر.
ملاحظة: عادة ، يجب أن تكون تركيزات الأجسام المضادة المستخدمة في تلطيخ ثلاثي الأبعاد في المواد الهلامية ضعف التركيز المستخدم في 2D. - قم بإزالة المخزن المؤقت المانع وأضف محلول الأجسام المضادة إلى المواد الهلامية بالتنقيط.
- ختم اللوحة بغشاء البارافين واحتضانها طوال الليل عند 4 درجات مئوية.
- قم بإزالة محلول الأجسام المضادة واغسله مرتين باستخدام محلول حاظر.
- أضف الجسم المضاد الثانوي باتباع نفس الإجراءات الموضحة في الخطوتين 11.3 و 11.4.
- احتضن في الظلام طوال الليل عند 4 درجات مئوية ، أو لمدة 3 ساعات عند 20 درجة مئوية.
- قم بإزالة محلول الأجسام المضادة واغسله مرتين باستخدام 1x PBS.
- قم بتغطية العينات في محلول 1: 1,000 DAPI واحتضانها عند 4 درجات مئوية في الظلام لمدة 1 ساعة.
- انقل الجل إلى غطاء زجاجي وقم بتصويره بواسطة الفحص المجهري الفلوري / متحد البؤر.
12. استخراج الحمض النووي الريبي
ملاحظة: الأحجام المستخدمة في هذه الطريقة قابلة للتطبيق حيث يتم زرع المواد الهلامية الببتيد في إدخالات صفيحة ذات 24 بئرا. يمكن استخدام تنسيقات هلام أخرى ، وتعديل الأحجام وفقا لذلك.
- قم بإزالة الوسط من الآبار ، واغسل المواد الهلامية الببتيد مرتين باستخدام 1x PBS ، باستخدام نفس التقنية المستخدمة في تغيير الوسائط (الخطوة 5.7).
- قم بإزالة المواد الهلامية الببتيد التي تم زراعتها في 24 إدخالا للوحة البئر باتباع الخطوة 7.2. ضع كل جل في أنبوب طرد مركزي منفصل سعة 15 مل.
ملاحظة: توخي الحذر لأن المواد الهلامية يمكن أن تكون هشة في هذه المرحلة ، خاصة بعد الثقافة الممتدة. - باستخدام P1000 ، أضف 500 ميكرولتر من Trypsin-EDTA (0.25٪) إلى كل أنبوب وماصة لأعلى ولأسفل للخلط وتعطيل الجل.
- احتضن المواد الهلامية في Trypsin-EDTA عند 37 درجة مئوية لمدة 3-5 دقائق.
ملاحظة: قد تتطلب أوقات الحضانة التحسين اعتمادا على نوع الخلية المستخدمة. - أضف 5 مل من 1x PBS لتخفيف Trypsin-EDTA.
- جهاز طرد مركزي عند 200 × جم لمدة 5 دقائق لخلايا الحبيبات.
- قم بإزالة المادة الطافية.
ملاحظة: توخ الحذر لأن طبقة هلام قد تكون قد تشكلت بين حبيبات الخلية والمادة الطافية. - أعد تعليق حبيبات الخلية في المخزن المؤقت للتحلل ، وفقا لتعليمات الشركة المصنعة ، واستمر في اتباع البروتوكولات القياسية لاستخراج الحمض النووي الريبي.
النتائج
تسمح طريقة تصنيع هلام الببتيد الموضحة هنا للمستخدم بتحديد وإنشاء بيئة ثقافة ثلاثية الأبعاد حسب الطلب. بينما يتم تحديد البيئة الميكانيكية بشكل أساسي من خلال تركيز الببتيد ، يمكن أيضا إضافة مكونات المصفوفة ذات الأهمية عند الكثافة الخاضعة للرقابة ، كما هو موضح في حساب المثال في الشكل 1. ومع ذلك ، في أبسط أشكاله ، يوفر بروتوكول هلام الببتيد طريقة لتغليف الخلايا في بيئة ثلاثية الأبعاد خالية من المصفوفة. يوضح الشكل 2 كيف يمكن دمج هذا النهج مع مجموعة واسعة من نماذج السرطان ، بما في ذلك خطوط الخلايا السرطانية المصنفة بالفلورسنت (الشكل 2 أ) ومادة الطعم الغريب المشتق من المريض (PDX) (الشكل 2ب ، ج). الأهم من ذلك ، يمكن استزراع خطوط الخلايا ومواد PDX داخل المواد الهلامية في ظروف خالية من المصل (الشكل 2C ، D) ، مما يوفر نظام ثقافة ثلاثي الأبعاد بتركيبة محددة بالكامل.
نظرا لأن الببتيد نفسه لا يحتوي على أي أشكال مرتبطة بالخلايا ، فإن الخلايا المغلفة تعرض عادة مورفولوجيا مستديرة في المواد الهلامية الببتيد غير المعدلة. يوضح الشكل 3 أ هذا بالنسبة للأرومات الليفية الثديية البشرية في هلام الببتيد 6 مجم / مل ، مقارنة بمورفولوجيتها المستطيلة الكلاسيكية التي تظهر في Matrigel النقي وهلام الكولاجين النقي. ومع ذلك ، فإن الأهم من ذلك ، أن بروتوكول هلام الببتيد يسمح بدمج مكونات المصفوفة ذات الأهمية. يوضح الشكل 3 أ كيف يمكن لإضافة 200 ميكروغرام / مل من الكولاجين I استعادة مورفولوجيا الخلايا الليفية المستطيلة في المواد الهلامية الببتيدية.
يمكن أن تدعم إضافات المصفوفة أيضا نمو وتنظيم أنواع الخلايا الأخرى ، على سبيل المثال MCF10A ، كما هو موضح في الشكل 3 ب. في هذه الحالة ، تسمح إضافة 100 ميكروغرام / مل من الكولاجين I إلى هلام الببتيد 6 مجم / مل بتكوين هياكل أسينار بحلول اليوم 7. يمكن أيضا إدخال مزيد من التعقيد عن طريق دمج طبقة خلية داعمة في الثقافة المشتركة غير المباشرة. يوضح الشكل 3C كيف يمكن للنهج المشترك لدمج المصفوفة والثقافة المشتركة غير المباشرة مع الخلايا الليفية الثديية البشرية أن يعزز نمو MCF10A وتنظيمه.
معلمة أخرى مهمة هي تركيز الببتيد المستخدم في تصنيع هلام الببتيد. يوضح الشكل 4 أ مثالا على كيفية التحكم في تركيز الببتيد ، في هذه الحالة بين 4 و 10 مجم / مل ، ينتج عنه صلابة تتراوح بين 100 إلى 1000 ثانية من باسكال. يمكن تصنيع هذه المواد الهلامية خالية من المصفوفة أو يمكن إنشاؤها مع إضافات المصفوفة للسماح بالتحكم المتزامن في كل من الصلابة والتكوين. يمكن تقسيم المواد الهلامية الببتيدية مع إضافات المصفوفة وتلطيخها للسماح بتصور توزيع هذه الإضافات. يوضح الشكل 4ب ، ج طريقتين للقيام بذلك: التضمين في أجار بنسبة 4٪ متبوعا بمعالجة الأنسجة القياسية وتضمين البارافين للكيمياء المناعية (الشكل 4 ب) أو التضمين في أجار بنسبة 2٪ متبوعا بتقسيم الاهتزاز وتلوين الفلورسنت (الشكل 4 ج).
عند تعديل تركيبة المواد الهلامية الببتيد ، من الأهمية بمكان التأكد من أن هذه التغييرات لا تؤثر على البيئة الميكانيكية المقدمة في البداية للخلايا. يوضح الشكل 4D كيف يمكن استخدام التعديلات على تركيز الببتيد لتعويض أي تغييرات في صلابة هلام الببتيد عند دمج المصفوفة. يمكن بعد ذلك لمقاييس الريولوجيا التذبذبية السائبة لصلابة الهلام (معامل التخزين ، G') التمييز بين تأثيرات تكوين الهلام والصلابة على مورفولوجيا الخلية. كما هو موضح في صور المجال الساطع ، تطور خلايا MDA MB 231 مورفولوجيا مستطيلة على إضافة الكولاجين إلى 10 مجم / مل أو 15 مجم / مل من المواد الهلامية الببتيدية. يوضح الشكل 4E أن هذه الخلايا الممدودة تلطخ إيجابية ل pFAK ، مما يشير إلى تفاعل مع المصفوفة المحيطة بها. كما أن البيئة الخالية من المصفوفة في البداية للمواد الهلامية الببتيد تجعلها منصة مثالية لدراسة التخليق الخلوي وترسب مكونات المصفوفة ذات الأهمية. يوضح الشكل 4F الترسب الموضعي للكولاجين I بواسطة خلايا MCF7 المغلفة في 10 مجم / مل من المواد الهلامية الببتيدية.
تتمثل إحدى المزايا الرئيسية للمواد الهلامية الببتيد في السهولة التي يمكن بها تطبيق الأساليب المختبرية القياسية على تحليلها. يمكن استخراج المواد ل qRT-PCR لتحديد ملامح التعبير الجيني (كما هو موضح في منشورنا الأخير5). يسمح التصوير بواسطة الفحص المجهري للمجال الساطع أيضا بالتصور في الوقت الفعلي لنمو الخلايا. يوضح الشكل 5 بعض مشكلات استكشاف الأخطاء وإصلاحها النموذجية التي قد تواجهها في المواد الهلامية الببتيد غير الناجحة: الخلط غير المكتمل لسلائف الجل (الشكل 5أ ، ب) ؛ تحسين غير صحيح لتركيز الببتيد (الشكل 5C ، D) أو كثافة البذر (الشكل 5E ، F) ؛ والتحييد غير الصحيح للكولاجين الحمضي قبل دمجها في المواد الهلامية الببتيد (الشكل 5G ، H). يجب تحسين تركيز الببتيد وكثافة البذر ، على وجه الخصوص ، لكل خط خلية ومصدر ببتيد ، لضمان تحديد بيئة الاستزراع بشكل مناسب ، وتمثيل التطبيق ذي الاهتمام.
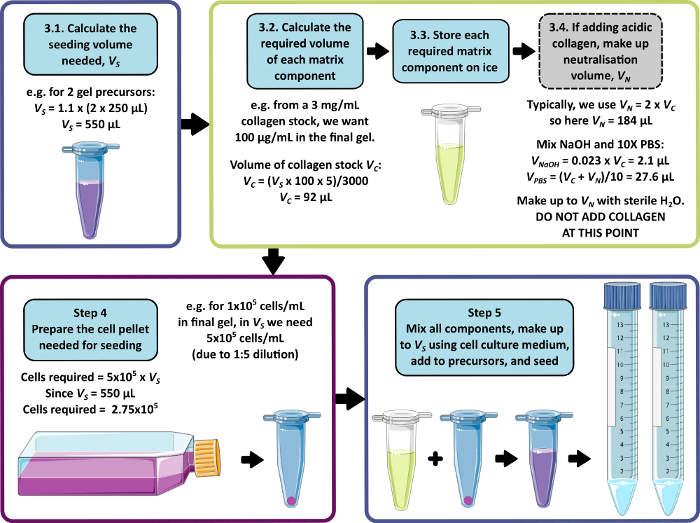
الشكل 1: مثال على حساب تكوين المصفوفة وكثافة البذر. يصف سير العمل هذا المثال الإجراء الذي سيتم اتباعه لبذر سلائف هلام الببتيد مع إضافات 100 ميكروغرام / مل من الكولاجين ، بكثافة خلية نهائية تبلغ 1 × 105 خلايا / مل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
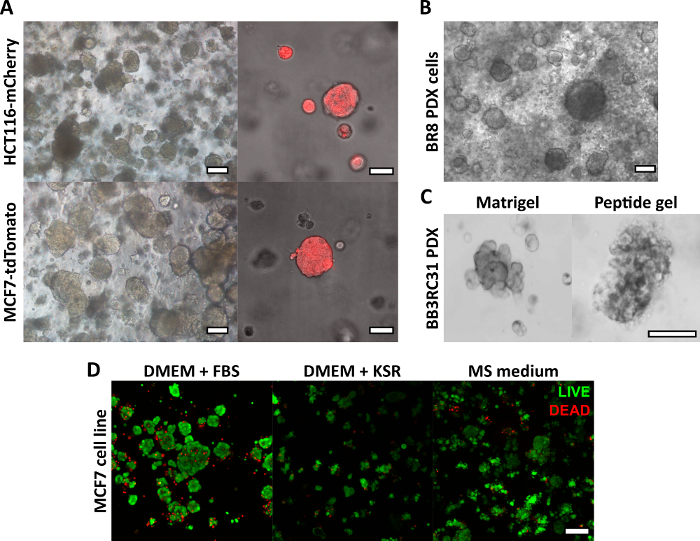
الشكل 2: توفر المواد الهلامية للببتيد الخالية من المصفوفة منصة ثقافة ثلاثية الأبعاد مناسبة لخط الخلايا ونماذج السرطان المشتقة من المريض. (أ) سرطان القولون والمستقيم HCT116 وخطوط خلايا سرطان الثدي MCF7 ، التي تعبر بشكل أساسي عن علامات الفلورسنت mCherry و tdTomato على التوالي ، تشكل مجموعات الخلايا في 6 مجم / مل من المواد الهلامية بحلول اليوم 9 (على اليسار) ، ويمكن تصويرها مباشرة باستخدام الفحص المجهري الفلوري (اليمين ، شريط المقياس 50 ميكرومتر) ؛ (ب) تشكل خلايا الطعم الخارجي المشتقة من المريض (PDX) من مريضة سرطان الثدي الثلاثي السلبي (BR8) مجموعات خلايا بحلول اليوم 7 في 10 مجم / مل من المواد الهلامية الببتيدية ؛ (ج) يمكن زراعة خلايا PDX من أورام الثدي الإيجابية لمستقبلات هرمون الاستروجين (BB3RC31) في ظروف خالية من المصل18 ، كما هو موضح مع مصفوفة الغشاء القاعدي (مثل Matrigel) التحكم في ممر متطابق للمقارنة. (د) خلايا سرطان الثدي MCF7 قابلة للحياة في 6 مجم / مل من المواد الهلامية الببتيد في ظروف خالية من المصفوفة وخالية من المصل ، كما تم تقييمها باستخدام اختبار الخلايا الحية / الميتة في اليوم 7. KSR = استبدال مصل الضربة القاضية ، متوسط MS = وسط الماموسفير19. شريط المقياس 100 ميكرومتر ما لم يتم تحديده. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
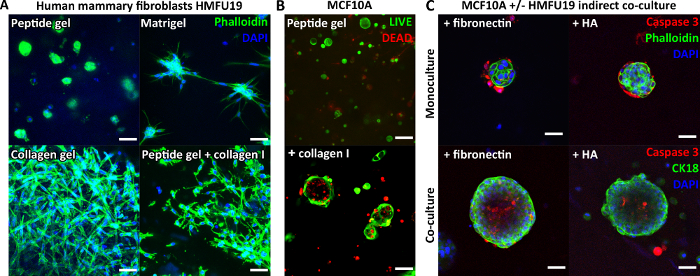
الشكل 3: يمكن زيادة تعقيد هلام الببتيد عن طريق إدخال إضافات المصفوفة والثقافة المشتركة. (أ) يتطلب خط الخلايا الليفية الثديية البشرية HMFU19 إضافات كولاجين لاستعادة التشكل المستطيل في هلام الببتيد 6 مجم / مل ، الموضح مع مصفوفة غشاء القاعدية النقية (مثل Matrigel) و 1.5 مجم / مل جل كولاجين ذيل الفئران I للمقارنة ، شريط المقياس 50 ميكرومتر ؛ (ب) تشكل خلايا الثدي الطبيعية MCF10A هياكل أسينار بحلول اليوم 7 في 6 مجم / مل من المواد الهلامية الببتيد عند إضافة 100 ميكروغرام / مل من الكولاجين البشري I ، شريط المقياس 100 ميكرومتر ؛ (ج) تؤدي الإضافة المجمعة لمكونات المصفوفة فيبرونكتين / HA (حمض الهيالورونيك ، الوزن الجزيئي 804 كيلو دالتون) و HMFU19 في الثقافة المشتركة غير المباشرة إلى زيادة حجم وتنظيم MCF10A acini في 10 مجم / مل من المواد الهلامية الببتيد كما تم تقييمها بواسطة تلطيخ الكاسباز 3 المشقوق ، شريط المقياس 50 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
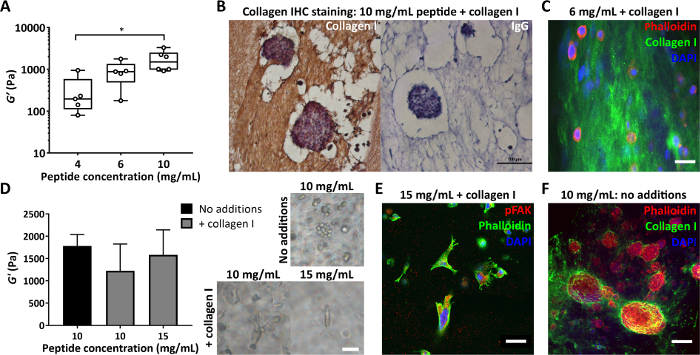
الشكل 4: تسمح المواد الهلامية الببتيدية بالتحكم المستقل في الصلابة والتكوين ، وتقييم المصفوفة المترسبة في الخلايا. (أ) قياسات الريولوجيا السائبة التي تبين مدى صلابة نموذجي (معامل التخزين، G') يمكن تحقيقه عن طريق التحكم في تركيز الببتيد، * تشير إلى p < 0.05؛ (ب) الكيمياء النسيجية المناعية التي تظهر تلطيخا 150 ميكروغرام/مل من الكولاجين I في هلام ببتيد 10 ملغم/مل مع MCF7 مغلف (اليوم 7، شريط المقياس 100 ميكرومتر)؛ (ج) التألق المناعي لتوزيع الكولاجين I في هلام الببتيد 6 مجم / مل مع 200 ميكروغرام / مل من الكولاجين البشري I ، عن طريق تضمين أجار وتقسيم الاهتزاز ، شريط المقياس 25 ميكرومتر ؛ (د) إضافة 200 ميكروغرام / مل من الكولاجين الأول يعطي انخفاضا متواضعا في معامل التخزين ، G '، من 10 مجم / مل من المواد الهلامية الببتيد (الريولوجيا التذبذبية السائبة) ، يقابلها زيادة تركيز الببتيد إلى 15 مجم / مل. تظهر خلايا سرطان الثدي الثلاثية السلبية MDA MB 231 في كل حالة (اليوم 7 ، شريط المقياس 50 ميكرومتر) ؛ (ه) MDA MB 231 في 15 مجم / مل من المواد الهلامية الببتيد مع 200 ميكروغرام / مل من الكولاجين البشري أظهر استطالة وتفاعلا مع المصفوفة عن طريق تلطيخ pFAK (اليوم 14 ، شريط المقياس 50 ميكرومتر) ؛ (F) تلطيخ في الموقع لترسب الكولاجين MCF7 I في هلام ببتيد خال من المصفوفة 10 مجم / مل (اليوم 10 ، شريط المقياس 100 ميكرومتر). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: يمكن حل مشكلات استكشاف أخطاء هلام الببتيد الشائعة وإصلاحها باستخدام الفحص المجهري للمجال الساطع. الخلايا المعروضة هي الخلايا الظهارية الطبيعية للثدي MCF10A ، في اليوم 7 ما لم يتم تحديدها. (أ) يجب أن تكون السلائف الهلامية الممزوجة بشكل صحيح واضحة بصريا مع عدم وجود تناقضات ، في حين أن (ب) يمكن أن يتسبب الاختلاط / التحييد غير الكافي في عدم تجانس / خطوط مرئية في هلام الببتيد (الأسهم البيضاء) ؛ (ج) تشكل MCF10A هياكل أسينار في مواد هلامية ببتيد 6 مجم / مل عند إضافة الزراعة المشتركة غير المباشرة HMFU19 ، ولكن (د) عند 15 مجم / مل يكون تركيز الببتيد مرتفعا جدا بحيث لا يسمح بتكوين أسينار ؛ (ه) MCF10A المصنف في 5 × 105 خلايا / مل تشكل هياكل أسينار في مواد هلامية 6 مجم / مل عند إضافة 100 ميكروغرام / مل من الكولاجين الأول ، ولكن (F) عند 2 × 105 خلايا / مل كثافة الخلية منخفضة جدا بحيث لا تسمح بتكوين أسينار ؛ (ز) يمكن أن تنتج إضافات الكولاجين مجموعات خلايا كبيرة بحلول اليوم الرابع عشر ، ولكن (H) الإضافة غير الصحيحة (تحييد الكولاجين في وقت مبكر جدا من العملية) يمكن أن تمنع نمو الكتلة. شريط المقياس 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
لقد وجدنا أن المواد الهلامية الببتيد الموصوفة هنا هي حل بسيط وفعال من حيث التكلفة ومرن لدعم الثقافة ثلاثية الأبعاد لأنواع الخلايا المتعددة. من خلال توفير التحكم الكامل في تركيز الببتيد المستخدم وإضافات البروتين أو الجليكان التي تم إجراؤها ، تسمح هذه الطريقة بتصميم المواد الهلامية الببتيد بعناية لتطبيقها.
الميزة الحاسمة للببتيد الهلامية على الطرق الحالية هي أنه يمكن التحكم في تكوين المصفوفة والخصائص الميكانيكية بشكل مستقل ، باستخدام طريقة بسيطة لا تتطلب أي إجراءات كيميائية معقدة. يتم تحديد الخواص الميكانيكية لهلام الببتيد بشكل أساسي من خلال تركيز الببتيد في سلائف الهلام الأولية. تسمح الإضافة اللاحقة للخلايا و / أو مكونات المصفوفة بإنشاء بيئة مختبرية محددة بالكامل من قبل المستخدم. على الرغم من أن إضافات المصفوفة قد تغير الخصائص الميكانيكية الأولية للهلام ، إلا أن هذا قد يقابله بسهولة التباين المستقل لتركيز الببتيد5. يوفر هذا ميزة ملموسة على الأنظمة الحالية ، على سبيل المثال المواد الهلامية للكولاجين ، حيث تؤدي المعلمات التي تتحكم في الصلابة عادة إلى تغيير في أشكال ربط الإنتجرين20،21.
لقد أظهرنا تطبيق هلام الببتيد للزراعة المختبرية لخطوط الخلايا السرطانية والمواد المشتقة من المريض5. نطاق الصلابة الذي يمكن الوصول إليه باستخدام هلام الببتيد (في حدود 100 ثانية إلى 1000 ثانية من باسكال) مناسب بشكل مثالي لتكرار بيئات مصفوفة الورم الطبيعية في الأنسجة الرخوة مثل الثدي. ومع ذلك ، فإننا ندرك أن التطبيقات الأخرى تتطلب بيئات أكثر صلابة ، على سبيل المثال في نطاق 10-20 كيلو باسكال لتجديد العظام. ستكون هناك حاجة إلى مزيد من التعديل للبروتوكول المقدم هنا لتوسيع الصلابة التي يمكن تحقيقها في هذا النطاق ، وهو أكثر شيوعا للأساليب البديلة مثل المواد الهلامية الجينات22. وبالمثل ، وصفنا هنا طريقة بسيطة للوظيفية عن طريق الاحتباس المادي لبروتينات المصفوفة / الجليكان داخل هلام الببتيد. بالنسبة للتطبيقات الموضحة هنا ، يعمل هذا النهج بشكل جيد ويمكن تكييفه بسهولة للاستخدام من قبل المجموعات غير المتخصصة التي ترغب في استخدام نماذج ثلاثية الأبعاد في المختبر للأمراض. مثل العديد من الهلاميات المائيةالأخرى 11 ، يمكن توسيع الببتيد المستخدم هنا ليشمل ربط الخلايا أو الزخارف البيولوجية الأخرى ، وقد يكون هذا النهج مفضلا بالنسبة لبعض التطبيقات.
وقد حددنا بعض النقاط الرئيسية التي تحتاج إلى اهتمام دقيق لضمان النجاح. يعد تكوين سلائف الجل خطوة وسيطة حاسمة تمكن المستخدم من التحقق من صحة الظروف المستخدمة قبل دمج الخلايا. يمكن تخزين هذه السلائف لعدة أسابيع (عند 4 درجات مئوية) ولكن يجب تحضينها عند 80 درجة مئوية وبعد ذلك عند 37 درجة مئوية قبل الاستخدام. ستكون السلائف المناسبة سائلة تماما عند 80 درجة مئوية ، وذاتية الدعم عند 37 درجة مئوية. هذه الفحوصات ضرورية للتأكد من حدوث التبلور بشكل صحيح. يمكن بعد ذلك دمج الخلايا و / أو المصفوفة في ظل الظروف الفسيولوجية.
ستكون المختبرات التي تستخدم بالفعل مصفوفات ثلاثية الأبعاد على دراية بالمعالجة الدقيقة اللازمة لتغليف الخلايا في المواد الهلامية الببتيدية. يجب توخي الحذر للحد من تحريك الخلايا قبل وأثناء خطوات التغليف. لقد وجدنا أن أنواعا معينة من الخلايا معرضة بشكل تفاضلي للتلف أثناء هذه العملية ويجب تقييم ذلك بعناية من قبل المستخدم. تسمح تركيزات هلام الببتيد الموصوف هنا بالاستمرار في الترحيل الهلامي في إطار زمني يسمح ، بالنسبة للخلايا المذكورة ، بتغليف الخلايا قبل أن تغرق في قاع بئر الصب ولكن ببطء كاف بحيث لا تتضرر من هذه العملية. ومع ذلك ، من الجدير بالذكر أن بعض أنواع الخلايا الحساسة قد تتطلب تحييدا أسرع لتجنب التعرض لفترات طويلة لدرجة الحموضة المرتفعة. في هذه الحالة ، يمكن أن تكون إضافة 10 ملي مولار HEPES إلى الوسط المحيط بهلام الببتيد مفيدة.
عند اعتماد الطريقة الموضحة في هذا البروتوكول ، من المهم جدا التفكير بعناية في جودة مصدر الببتيد. بدلا من استخدامه كفكرة أو طلاء وظيفي ، فإن الببتيد هنا هو كامل الجزء غير القابل للذوبان من الهيدروجيل. لذلك ، من المحتمل أن يكون لأي ملوثات أو اختلاف في بنية الببتيد تأثير كبير على سلامة أو القدرة على دعم بقاء الخلية في الهيدروجيل النهائي. عند الانتقال إلى دفعة جديدة من الببتيد ، يجب توخي الحذر للتأكد من وجود تناسق جيد من دفعة إلى دفعة من المورد بالإضافة إلى التحقق من سلوك الببتيد عند تشكيل سلائف الجل.
باختصار ، يصف هذا البروتوكول نظام ثقافة ثلاثي الأبعاد مع تركيز حاسم على التحكم المستقل في الخصائص الميكانيكية والبيولوجية. إن بساطة الطريقة وقدرتها على التكيف تجعلها مناسبة للتبني من قبل أي مختبر لزراعة الخلايا ، ولمجموعة واسعة من التطبيقات5. في المستقبل ، قد يتم تمديد هذا البروتوكول للسماح بالتعديل التساهمي لتسلسل الببتيد. يمكن دمج ذلك مع طرق الفحص المجهري المتقدمة للتحقيق في قوى الشد التي تمارسها الخلايا على المصفوفة المحيطة بها. ومع ذلك ، فإن الأهمية بمكان هي القدرة على التمييز بين المصفوفة المدمجة بشكل مصطنع ، والمصفوفة التي يتم تصنيعها بواسطة الخلايا المغلفة نفسها. ستسمح هذه القدرة على التحكم في تغيرات المصفوفة ومراقبتها بمرور الوقت برؤى غير مسبوقة حول أدوار تفاعلات المصفوفة الخلوية في تطور السرطان والأمراض الأخرى.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نود أن نعرب عن تقديرنا للتمويل المقدم من المركز الوطني لاستبدال في مجال البحوث وصقلها والحد منها NC / N0015831 / 1 إلى JCA و GF و CLRM و NC / T001267 / 1 إلى RBC و CLRM و JCA و KL-S و KS و NC / T001259 / 1 إلى JCA و KL-S و CLRM و NC / P002285 / 1 إلى AMG و SJ و CLRM. كما يمول من مجلس بحوث العلوم الهندسية والفيزيائية EP/R035563/1 إلى KL-S و CLRM و EP/N006615/1 إلى أبراج بحيرات جميرا و CLRM. تم إنشاء الشكل 1 باستخدام رسومات مقتبسة من Servier Medical Art. تم ترخيص Servier Medical Art by Servier بموجب ترخيص Creative Commons Attribution 3.0 Unported.
Materials
| Name | Company | Catalog Number | Comments |
| Gel fabrication - Reagents | |||
| FEFEFKFK | Pepceuticals | n/a | Polypeptide; available from various suppliers. Pepceuticals is our recommended supplier due to the quality of the product. |
| PBS 10X | Gibco | 70011-036 | |
| Sodium hydroxide (1 M) | Sigma-Aldrich | S2770 | NaOH; dilute to 0.5 M prior to use |
| Water | Sigma-Aldrich | W3500 | |
| Gel fabrication - Equipment and Consumables | |||
| 15 mL falcon tubes | Greiner | 188261 | If using different brand ensure the material withstands temperatures of up to 90°C |
| 24 well plate | Corning Costar | 3524 | Alternative brands/suppliers can be used as long as there is a gap between the insert base and the plate surface |
| Centrifuge | Any | 200 x g for 3 minutes | |
| Class II Microbiological Safety Cabinet | Any | ||
| Fine balance | Any | Readability 0.1 mg | |
| Hanging insert for 24 well plate | Millipore | MCRP24H48 | Alternative brands/suppliers can be used as long as there is a gap between the insert base and the plate surface |
| Incubator | Any | 37°C, 5% CO2, humidified environment | |
| Oven | Any | set to 80°C | |
| P1000/200/20/10 pipette | Any | It is essential the pipettes used for the procedure are calibrated | |
| P1000/200/20/10 tips | Any | ||
| pH meter with microprobe | Any | ||
| Spatula | Any | ||
| Vortex | Any | ||
| Matrix addition | |||
| Collagen I (human) | Stem Cell Technologies | 07005 | |
| Collagen I (rat tail) | Gibco | A10483 | |
| Fibronectin | Stem Cell Technologies | 07159 | |
| Hyaluronic Acid | Iduron | HA804 | |
| Matrigel | Corning | 354234 | |
| Cell encapsulation/culture | |||
| B27 Supplement (no retinoic acid) | Gibco | 12587010 | Media additions for serum free cultures (Figure 2D) |
| Cholera toxin | Sigma-Aldrich | C-8052 | Media additions for MCF10A cells (Figure 3, 5) |
| DMEM | Gibco | 21969-035 | |
| DMEM/F12 | Sigma-Aldrich | D8062 | Media additions for MCF10A cells (Figure 3, 5) |
| DMEM/F12 Phenol Red Free | Gibco | 21041-025 | Media additions for serum free cultures (Figure 2D) |
| DPBS | Gibco | 14190-094 | |
| EGF | SourceBiosciences | ABC016 | Media additions for MCF10A cells (Figure 3, 5) |
| Fetal Bovine Serum | Gibco | 10500-064 | |
| Horse serum | Gibco | 26050-070 | Media additions for MCF10A cells (Figure 3, 5) |
| Human cancer/epithelial cell lines | e.g. MCF7/tdTomato MCF7/MCF10a/HCT116-mCherry | ||
| Human mammary fibroblasts | e.g. HMFU19 | ||
| Hydrocortisone | Sigma-Aldrich | H-0888 | Media additions for MCF10A cells (Figure 3, 5) |
| Insulin | Sigma-Aldrich | I9278 | Media additions for MCF10A cells (Figure 3, 5) |
| Knockout serum replacement | Gibco | 10828-028 | Media additions for serum free cultures (Figure 2D) |
| L-glutamine | Gibco | 25030-024 | |
| RPMI | Gibco | 21875-034 | |
| RPMI Phenol Red Free | Sigma-Aldrich | R7509 | |
| Imaging and other assays | |||
| 4% paraformaldehyde | Polysciences | 18814 | |
| Agar | SLS | CHE1070 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | 5482 | |
| Confocal and/or fluorescent microscope | Any | e.g. Leica TCS SPE confocal laser scanning microscope (Figures 2-4) | |
| DAPI solution | Invitrogen | D3571 | 300 uM working solution |
| DPX mounting medium | ThermoFisher Scientific | ||
| Glass cover slips | Any | No1 coverslips 0.13 - 0.17 mm thickness | |
| Glass-bottom dishes | MatTek | ||
| Goat Anti-Rabbit IgG H&L (HRP polymer) | Abcam | ab214880 | |
| Haematoxylin and Eosin | Any | ||
| Histology molds (disposable, plastic) | Any | ||
| Image analysis software | ImageJ | ||
| Live/Dead assay kit | Invitrogen | L3224 | |
| Microtome | Any | ||
| Phalloidin | Life Technologies | F432/R415 | |
| Pierce Peroxidase IHC Detection Kit | ThermoFisher Scientific | 36000 | |
| Primary Ab Caspase 3 | Abcam | ab34710 | Shown in Figure 3C |
| Primary Ab Collagen I | Cell Signalling Technology | 9661 | Shown in Figure 4B, C, F |
| Primary Ab pFAK Tyr 397 | ThermoFisher Scientific | 44-624G | Shown in Figure 4E |
| Prolong gold/diamond anti-fade mountant with DAPI | Molecular Probes | S36939 | |
| Rheometer Physica MCR 301 | Anton Paar | ||
| Scalpel | Any | ||
| Secondary antibody Goat anti Rabbit AF488 | nvitrogen | a11034 | |
| Secondary antibody Goat anti Rabbit AF546 | Invitrogen | a11010 | |
| SuperFrost slides | ThermoFisher Scientific | Coating e.g. APES can help to retain microtome sections on slides. | |
| Triton X 100 | Sigma-Aldrich | X100 | |
| Trypsin-EDTA (0.25%) | Gibco | 25300054 | |
| Vibratome | Leica |
References
- Hynes, R. The extracellular matrix: not just pretty fibrils. Science. 326 (5957), 1216-1219 (2009).
- Tian, C., et al. Cancer-cell-derived matrisome proteins promote metastasis in pancreatic ductal adenocarcinoma. Cancer Research. 80 (7), 1461-1474 (2020).
- Hebert, J. D., et al. Proteomic profiling of the ECM of xenograft breast cancer metastases in different organs reveals distinct metastatic niches. Cancer Research. 80 (7), 1475-1485 (2020).
- Vennin, C., et al. CAF hierarchy driven by pancreatic cancer cell p53-status creates a pro-metastatic and chemoresistant environment via perlecan. Nature Communication. 10 (1), 3637 (2019).
- Ashworth, J. C., et al. Peptide gels of fully-defined composition and mechanics for probing cell-cell and cell-matrix interactions in vitro. Matrix Biology. 85, 15-33 (2020).
- Toniatti, C., Jones, P., Graham, H., Pagliara, B., Draetta, G. Oncology drug discovery: Planning a turnaround. Cancer Discovery. 4 (4), 397-404 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5, 539-551 (2020).
- Onion, D., et al. 3-Dimensional patient-derived lung cancer assays reveal resistance to standards-of-care promoted by stromal cells but sensitivity to histone deacetylase inhibitors. Molecular Cancer Therapy. 15 (4), 753-763 (2016).
- Saunders, J. H., et al. Individual patient oesophageal cancer 3D models for tailored treatment. Oncotarget. 8 (15), 24224-24236 (2017).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Kühn, S., et al. Cell-instructive multiphasic gel-in-gel materials. Advanced Functional Materials. 30, 1908857 (2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., Lutolf, M. P. Synthesis and characterization of well- defined hydrogel matrices and their application to intestinal stem cell and organoid culture. Nature Protocols. 12 (11), 2263-2274 (2017).
- Saiani, A., et al. Self assembly and gelation properties of α-helix versus β-sheet forming peptides. Soft Matter. 5 (1), 193-202 (2008).
- Wan, S., et al. Self-assembling peptide hydrogel for intervertebral disc tissue engineering. Acta Biomaterialia. 46, 29-40 (2016).
- Blache, U., Stevens, M. M., Gentleman, E. Harnessing the secreted extracellular matrix to engineer tissues. Nature Biomedical Engineering. 4 (4), 357-363 (2020).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Barcus, C. E., Keely, P. J., Eliceiri, K. W., Schule, L. A. Stiff collagen matrices increase tumorigenic prolactin signaling in breast cancer cells. Journal of Biological Chemistry. 288, 12722-12732 (2013).
- Bax, D. V., et al. Impact of UV- and carbodiimide-based crosslinking on the Integrin-binding properties of collagen-based materials. Acta Biomaterialia. 100, 280 (2019).
- Huang, B. P., et al. Multi-peptide presentation and hydrogel mechanics jointly enhance therapeutic duo-potential of entrapped stromal cells. Biomaterials. 245, 119973 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved