Method Article
用于癌症和疾病的受控 3D 培养模型的自定义肽凝胶的制备
摘要
我们提出了一种创建 3D 细胞培养环境的方法,可用于研究细胞/基质相互作用在癌症进展中的重要性。使用简单的自组装八肽,可以控制包封细胞周围的基质,并独立调节机械和生化线索。
摘要
人们越来越意识到,在 3D 中生长的细胞比在 2D 中生长的细胞更能模拟体内行为。在该协议中,我们描述了一种简单且可调的 3D 水凝胶,适用于在与其天然环境相匹配的环境中培养细胞和组织。这对于研究癌症发生、生长和治疗的研究人员尤为重要,因为细胞与其局部细胞外基质之间的相互作用是模型的基本组成部分。转向 3D 培养可能具有挑战性,并且由于动物源性 3D 培养基质的批次间差异很大,通常与缺乏可重复性有关。同样,处理问题会限制合成水凝胶的实用性。为了满足这一需求,我们优化了一种简单的自组装肽凝胶,以便能够培养癌症和疾病的相关细胞系模型,以及患者来源的组织/细胞。凝胶本身不含基质成分,除了在封装过程中添加的或由封装的细胞沉积到凝胶中的成分。水凝胶的机械性能也可以独立于基质添加而改变。因此,它就像一张“白纸”,允许研究人员构建反映目标组织的 3D 培养环境,并独立剖析机械力和/或细胞行为的生化控制的影响。
引言
细胞外环境在癌症发展和进展中发挥的许多作用越来越明显1。最近,基于蛋白质组学的详细分析增加了已经令人信服的文献基础,表明来自癌症相关基质细胞或癌细胞本身的基质成分是促进上皮间充质转化和转移扩散等事件的关键因素 2,3,4.鉴于细胞外基质 (ECM) 的这一公认重要性,转向能够控制呈现给细胞的 3D 环境的细胞培养平台变得至关重要。为了满足这一需求,该协议提出了一种在 3D 水凝胶中封装和培养细胞的方法,具有用户定义的 ECM 组成和机械特性5。
目前,2D 体外培养的癌症治疗效果、这些疗法在当前体内(患者来源的异种移植物,PDX)模型中的影响以及它们在临床试验中的最终活性之间存在较差的相关性 6,7。这导致了药物发现管道的重大失败,迫切需要改进的体外模型,使经过测试的疗法能够“尽早失败,廉价失败”。许多研究人员使用小鼠肥大细胞瘤衍生产品,例如 Matrigel(或类似产品)来创建富含 3D 基质的环境,以在体外生长和观察细胞行为,包括 PDX 衍生的细胞和其他靠近患者的细胞 8,9,10。然而,这种“一刀切”的方法忽视了基质蛋白/聚糖在癌症发生和进展中发挥的复杂作用。
认识到细胞外基质 (ECM) 在控制细胞行为中的作用也鼓励在由特定基质成分组成的水凝胶中或水凝胶上使用 3D 培养11。虽然这对于研究特定的相互作用很有用,但这些系统无法分离细胞和基质之间的机械和生化指令。它们也可能难以处理,并且可能会给出不清楚的细胞行为读数。胶原蛋白凝胶是这个问题的一个关键例子,因为细胞介导的凝胶收缩会大大降低观察凝胶内细胞的能力5.还有一些非常优雅的多组分凝胶系统,专家们已经使用它们,效果很好 12,13,14。这些可以结合酶敏感接头和生物活性基序,但其配方和应用比此处描述的系统要复杂得多。
该协议描述了一种创建完全定义的 3D 培养模型的方法,允许在体外模拟 ECM 在发育和疾病中的作用。3D 模型的基础是肽凝胶,我们之前将其描述为简单的自组装八肽水凝胶的优化 5,15,16。通过摒弃复杂的动物源性基质,该系统具有提高批次间一致性和改进处理的显著优势。在简单状态下,肽不包含基质衍生的基序,有效地提供了一个“空白板”,用户可以在其上构建功能。
我们展示了如何独立调节肽凝胶的机械性能,以及基质蛋白/聚糖的掺入。该系统具有高度可调性,允许以各种形式封装一系列细胞类型。对于构建癌症模型重要的是,基质细胞也可以掺入:直接共培养或分离以允许对间接癌细胞-基质相互作用进行特异性分析。最关键的是,此处描述的方案不需要复杂的化学知识,并且可以在任何细胞培养实验室中复制,而无需专门的化学知识或设备。
我们优化了研究肽凝胶中细胞行为的方法,包括成像、流变学分析、PCR5 材料提取和组织学评估包埋。简单水凝胶系统的一个明显优点是能够可视化和研究包埋细胞沉积的基质。细胞衍生基质的重要性以及更好地了解细胞如何重新设计其局部微环境的好处最近得到了强调17 ,这反映了人们越来越意识到捕获细胞分泌的基质成分的重要性,其方式与体内发生的方式类似。利用对此类过程进行建模的能力可能是提高基于水凝胶的疾病模型的患者相关性的基本驱动力之一。
研究方案
1. 肽的溶解
- 在组织培养通风橱中,使用 P1000 移液器向 15 mL 试管中加入 800 μL 无菌水。
- 使用精细天平称量肽粉末,将其放入非静态称量船中。使用所需最终肽凝胶浓度(以 mg/mL 为单位, 表 1)的 1.25 倍质量(以 mg/mL 为单位)。
注:在最终凝胶化点,此处描述的方法将在每管产生约 1.25 mL 体积的肽凝胶。可以一次制备多管,或者当用户对所介绍的方法有经验时,可以增加每管的体积。
| 肽浓度(最终凝胶化后) | 肽的质量 | 初始 NaOH 添加 |
| 6 毫克/毫升 | 7.5 毫克 | 30 微升 |
| 10 毫克/毫升 | 12.5 毫克 | 60 微升 |
| 15 毫克/毫升 | 18.75 毫克 | 100 微升 |
表 1:典型最终凝胶浓度的肽质量和建议的初始 NaOH 添加量。 列出的肽浓度范围可以向任一方向扩展,但是,较低的肽浓度很可能不会形成稳定的凝胶,而在高浓度下,所得的凝胶可能太密集,无法进行足够的营养交换和细胞活力。适当的浓度需要针对不同的细胞类型和肽批次进行优化。
- 将称取的肽加入 15 mL 试管中。轻弹称量船,确保没有粉末残留。
注意:肽粉可能非常静电,请注意尽量减少粉末的损失。在步骤 1.2 和 1.3(或任何 pH 测量)期间无需保持无菌条件,因为灭菌发生在过程后期在 80 °C 下孵育期间。 - 涡旋 3 分钟,然后以 200 x g 离心 3 分钟。
- 将肽溶液在设定为 80 °C 的烘箱中孵育至少 2 小时。如果孵育后存在未溶解的肽,请重复步骤 1.4。
注意:由于均匀加热是必不可少的,因此加热块不适合此步骤。然而,我们发现,只要肽溶液完全浸没,杂交柱温箱和水浴效果很好。
2. 凝胶前驱体的形成
- 使用无菌水制备无菌 0.5 M 氢氧化钠 (NaOH) 溶液。
注:建议使用新鲜稀释的 NaOH 溶液以获得最一致的结果。 - 在组织培养罩中,向溶解肽的中心添加 0.5 M NaOH,并用移液器吸头缓慢搅拌混合(表 1)。
- 涡旋试管 10 秒,并以 200 x g 离心 10 秒以去除气泡。
- 如果凝胶前体混浊,重复步骤 2.2 和 2.3,添加 5 μL 的 NaOH。
注意:pH 值测量有助于确定是否添加了足够的 NaOH:最佳 pH 值在 9–10.5 之间,最好不要超过这个值,因为使用酸来降低 pH 值会导致凝胶不均匀。所需的 NaOH 的精确体积可能因肽源而异。 - 一旦凝胶前体在 15 mL 试管倒置时光学透明且自支撑(或仅流动),在组织培养罩中加入 100 μL 无菌 10x PBS。涡旋 10 秒,并以 200 x g 离心 10 秒。
注:如果凝胶前体混浊,请重复步骤 2.4,直到它变成透明和半固体。如果凝胶前体是液体(pH 值高于 ~10.5),它不会形成稳定的凝胶,应丢弃。 - 在 80 °C 的烘箱中孵育过夜。
- 目视检查凝胶前驱体,确保其在 80 °C 时完全呈液体。
- 如果凝胶前体在 80 °C 时不完全液态,则尚未充分中和,请按照步骤 2.4 添加 NaOH。
- 如果凝胶前体是液体,但存在气泡或小沉淀物,请猛烈弹动试管以分散它们。如果轻弹试管后气泡或沉淀物仍然存在,请涡旋凝胶前体并以 200 x g 离心 10 秒。
- 遵循步骤 2.7.1 或 2.7.2 中的任何一个后,将前体凝胶在 80 °C 下再孵育 2 小时,然后再进行最终凝胶化。
- 将凝胶前体保持在 80 °C 直至需要(最长 48 小时)。
注意:该方案可以在此处暂停,将凝胶前体在 4 °C 下储存长达 4 周。如果从该暂停点重新开始,请将凝胶前体在 80 °C 下孵育至少 2 小时,然后从步骤 2.7 重新开始。强烈建议在最终凝胶化需要凝胶前体之前尽早制备凝胶前体,以确保在需要时有足够的时间进行上述修饰。
3. 制备用于晶种的基质组分
注意:步骤 3-5 的示例计算如图 1 所示。可以省略步骤 3 和步骤 4 以分别产生无基质和/或无细胞凝胶。
- 计算接种所需的细胞、基质和培养基的总组合体积,允许向每 1 mL 母离子凝胶中添加 250 μL。将此体积乘以 1.1 以允许移液误差。这是晶种体积 VS。
- 对于每个基质组分,使用 公式 1 计算要添加到接种体积中的储备溶液的体积:
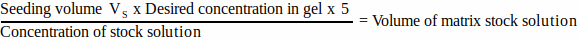 (1)
(1)
注: VS对应于接种 所有凝胶所需的接种培养基总体积(步骤 3.1)。确保所有基质组分体积的总和不超过 VS。 - 彻底解冻所有基质组分(请参阅制造商的说明)并储存在冰上,直到需要。
注意:某些基质组分很容易凝胶化。请参阅制造商的说明以避免这种情况发生。 - 如果要添加需要中和的酸性胶原原液(请参阅制造商的说明),请按以下步骤制备中和溶液:
- 使用公式 1 计算所需的胶原蛋白原液体积 VC。
- 确定中和溶液的合适体积 VN。应选择此参数,以便所有基质添加的总体积不超过接种体积 VS。
注意:通常, VN = 2 x Vc 的合理值,但可以根据要添加的其他基质组分的数量和体积进行调整。 - 使用 公式 2 计算中和所需的 1 M NaOH 体积。
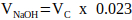 (2)
(2) - 使用公式 3 计算中和溶液中所需的 10x PBS 体积。
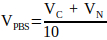 (3)
(3) - 将计算体积的 1 M NaOH 和 10x PBS 混合,然后用无菌水补足至 VN。混合均匀,并储存在冰上以备需要。
注意:此时不要添加酸性胶原蛋白。胶原蛋白与中和溶液的过早混合将导致胶原蛋白原纤维生成开始,这可能导致最终肽凝胶的性质不一致。
4. 制备用于接种的细胞
- 如果尚未完成,则根据步骤 3.1 计算播种体积 VS。
- 通过将最终肽凝胶中所需的细胞密度乘以 5 来计算该细胞悬液中所需的细胞密度。
注:细胞悬液是所需最终浓度的 5 倍,以考虑与凝胶前体混合时的稀释。应针对正在考虑的每种新细胞系优化细胞密度。根据细胞类型,最终肽凝胶中 1 x 104 和 1 x 106 个细胞/mL 的密度可能是合适的。 - 计算接种所需的细胞总数(将细胞密度乘以步骤 4.1 中计算的接种体积 VS。
- 对所用细胞使用标准培养/传代方法,制备含有步骤 4.3 中计算的所需细胞量的细胞沉淀。
5. 最终凝胶化/细胞封装
- 当准备开始最终凝胶化时,将凝胶前体从 80 °C 烘箱转移到 37 °C 水浴中。
注:凝胶前体应在 37 °C 下具有自支撑性。 如果它们是液体,则不太可能发生完全凝胶化,应丢弃凝胶前体。 - 准备 96 孔板,或者制备带有细胞培养小室的 24 孔板(或类似板)。
注: 在 24 孔小室中接种肽凝胶时,请确保小室底部和孔板之间有间隙。这可确保凝胶与介质接触。 - 如果要添加基质,请混合所有基质组分和中和溶液(步骤 3)。使用细胞培养基补足至 VS(步骤 3.1)并充分混合。如果要添加细胞,请使用接种体积 VS 重悬步骤 4 中制备的细胞沉淀。
注:如果在步骤 3 中未制备基质组分,请使用细胞培养基作为接种体积。这通常是所用细胞类型的标准培养基,但如果使用的是多种细胞类型的混合物,则可能需要验证。 - 使用 P1000 移液器,在凝胶前体顶部轻轻添加 250 μL 细胞/基质混合物。
注:基质组分,特别是基底膜提取物,一旦添加到凝胶前体中,可能会开始聚合。因此,尽快进行下一步非常重要。 - 通过移液和搅拌的联合作用轻轻混合。凝胶是剪切稀化的,因此通过轻柔的移液/搅拌会变得更容易混合。充分混合后,向 96 孔板的每个孔中加入 100 μL,或向每个细胞培养小室中加入 200 μL。
注:混匀时,使用设置为 200 μL 的 P1000 进行反向移液有助于避免引入气泡。凝胶最初可能难以混合,但持续混合后应该会变得更容易 - 这表明混合是有效的。 - 在 37 °C 的 5% CO2 和潮湿气氛中孵育 10 分钟。
注:如果肽凝胶中未添加基质,则无需此步骤。 - 向 96 孔板的每个孔中加入 200 μL 培养基,或向细胞培养小室外侧添加 1 mL,并在凝胶顶部滴几滴。在 37 °C 的 5% CO2 和潮湿气氛中孵育。
- 在接下来的一小时内更换介质两次,并在几小时后(或第二天)再次更换。
注意:此时要小心,因为凝胶会在几个小时内不稳定。 - 每 2-3 天更换一次培养基(或遵循所用细胞的标准培养方案)。
6. 间接共培养
注:该方法仅适用于将肽凝胶接种到 24 孔板插入物中的情况,或凝胶可以支撑在细胞单层上方的类似形式。在这种情况下,可以通过在孔板底部制备细胞的 2D 饲养层来引入间接共培养。
- 准备一个 24 孔板用于接种。这应该是与肽凝胶不同的板,但应为同一品牌,以确保与所用插入物兼容(参见步骤 5.2)。
- 根据所考虑的细胞类型,计算接种间接共培养所需的细胞密度。
注:应针对正在考虑的每种新细胞系优化细胞接种密度。应将细胞铺板至产生大约 30-50% 的汇合度。例如,人乳腺成纤维细胞系 HMFU19 通常以 1-5 x 104 个细胞/孔的密度接种。 - 使用所用细胞的标准培养/传代方法,使用这些细胞的典型生长培养基,以 1 mL/孔的浓度制备适合接种的细胞悬液。
- 将细胞悬液接种到孔板中,每孔 1 mL。
- 在 37 °C 的 5% CO2 和潮湿环境中孵育数小时或过夜。然后从孔中取出培养基。
- 使用无菌镊子,将含有肽凝胶的 24 孔板插入物转移到含有 2D 预接种细胞的新孔中。在小室外部滴加 1 mL 培养基,并在凝胶表面滴几滴。
注:通常,此时使用的培养基是适用于凝胶中封装的细胞的培养基,但该培养基对 2D 细胞的适用性可能需要针对所考虑的特定实验进行验证或优化。 - 定期制备新的饲养层以避免过度汇合,并按照与上述相同的方法将肽凝胶转移到这些新孔中。
注:通常,用于间接共培养的细胞与肽凝胶接种同时制备。然后,可以在数小时或孵育过夜后,在培养基更换点将肽凝胶转移到共培养物中,参见步骤 5.8。
7. 肽凝胶的体振荡流变学
注意:作为标准,流变学表征在凝胶接种后 24 小时进行,这应在 24 孔板插入物中进行。
- 根据制造商的说明设置和校准流变仪。使用平行的板几何形状,板直径尽可能接近细胞培养小室的直径。
注意:如果需要,可以在 37 °C 下进行测试,复制培养过程中的环境。 - 通过倒置插入物并使用手术刀切出塑料膜,从细胞培养小室中取出第一个待测肽凝胶样品。
注:测试前,确保含有肽凝胶的板在细胞培养箱外放置尽可能短的时间。带有碳酸氢盐缓冲系统的介质依靠 CO2 的存在来维持 pH 值。在培养箱外放置时间过长的凝胶会在 pH 值中漂移,这会影响流变学评估。在培养基中加入 10 mM HEPES 来维持凝胶以防止这种影响可能是有益的。 - 小心地将凝胶转移到流变仪板上。然后,使用手术刀将凝胶的高度修剪到大约 1 mm,以最大限度地减少加载流变仪板下时的凝胶变形。
注意:使用手术刀时,请小心不要触摸或损坏流变仪板。 - 将平行板间距设置为 1 mm。修剪流变仪板未覆盖的任何多余凝胶。
- 根据制造商的说明,在流变仪上运行所需的测试设置。
注:对于每种新的样品条件,建议运行 0.1-100% 应变的振幅扫描,以确保所有测试都在样品线性粘弹性区域内的应变水平下进行。
8. 包膜细胞的活/死染色
- 从孔中取出培养基,用 1x PBS 洗涤肽凝胶两次,使用与更换培养基相同的技术(步骤 5.7)。
- 按照步骤 7.2 去除已在 24 孔板插入物中培养的肽凝胶。将凝胶保存在原始孔板中的 1x PBS 中,直到准备好染色。
注意:请小心,因为此时凝胶可能很脆弱,尤其是在长时间培养后。 - 制备活/死染溶液,每 24 孔板插入物 500 μL 染色,或 96 孔板每孔 50 μL 染色。典型的染色剂是在 1x PBS 中的 4 μM 乙锭同型二聚体和 2 μM 钙黄绿素 AM。保护所得溶液避光。
注:活/死试剂的浓度可能需要进一步优化,具体取决于所使用的细胞类型和试剂供应商。 - 小心地从每块凝胶中取出 PBS,并用几滴染色液代替,确保每块凝胶都被充分覆盖。
- 将凝胶在染色溶液中避光孵育 10-15 分钟,然后使用共聚焦/荧光显微镜进行可视化。
注:为了获得更高质量的图像,将凝胶转移到盖玻片厚度的玻璃底培养皿中可能是有益的。
9. 固定肽凝胶以进行终点成像
- 按照步骤 8.1 洗涤肽凝胶。
- 在 1x PBS 中加入 4% 多聚甲醛 (PFA):96 孔板的每个孔 100 μL,24 孔板插件中的每个凝胶 1 mL(应在插件内的凝胶顶部添加几滴)。
注意:多聚甲醛 (PFA) 具有剧毒,很容易通过皮肤吸收。它对皮肤、眼睛、粘膜和上呼吸道具有极大的破坏性。PFA 应在通风橱中处理,用户应穿防护服和手套。根据最终应用,可以以相同的方式使用替代化学固定剂。 - 在室温下将肽凝胶在 PFA 固定剂中孵育 1 小时。
- 去除 PFA 固定剂并用 1x PBS 洗涤肽凝胶两次。
注意:该方案可以在此处暂停,将固定的肽凝胶在 4 °C 下在 1x PBS 中储存长达 4 周,确保板用石蜡膜密封良好。
10. 包埋肽凝胶进行切片
注:将肽凝胶包埋在 4% 琼脂中是免疫组织化学石蜡包埋之前的关键步骤。或者,可以将凝胶包埋在 2% 琼脂中,并使用振动切片机进行切片(通常 500 μm 切片可产生良好的结果)。这是一个可选步骤,使用第 11 节中的方法产生有利于凝胶中细胞外基质定位的水合凝胶切片。
- 通过在微波炉中煮沸,在 1x PBS 中制备熔融的 2% 或 4% 琼脂溶液(参见上面的注释)。使用前冷却几分钟。
注意:熔融琼脂存在热危险 - 使用手部和面部防护装置小心处理。制备后,琼脂溶液可储存在 4 °C 直至需要。 - 按照步骤 7.2 从细胞培养插入物中取出肽凝胶。
- 使用塑料巴斯德移液器,用一层薄薄的琼脂溶液覆盖组织学包埋模具的底部。在 20 °C 下冷却几秒钟。
- 使用刮刀将肽凝胶放入琼脂的中心。然后将肽凝胶完全覆盖在琼脂中。
注意:凝胶不应沉入琼脂中。如果是这样,请取出凝胶并再等待几秒钟,直到琼脂进一步凝固,然后重试。尽量不要让太多的凝固发生,否则两层之间会出现弱连接。 - 让包埋的凝胶在 4 °C 下冷却 1 小时,然后从组织学模具中取出。
注意:该方案可以在此处暂停,将包埋的凝胶在 4 °C 的 1x PBS 中储存长达 4 周。 - 如果要进行免疫组化,请将包埋的凝胶放入组织脱水机中,并使用标准实验室方法进行。
注:或者,可以使用振动切片机将包埋的凝胶切割成水合部分。水合切片应在 4 °C 的 1x PBS 中储存在密封板中长达 4 周。
11. 使用免疫细胞化学对凝胶中的细胞进行染色
- 去除覆盖肽凝胶/凝胶切片的 1x PBS。按照步骤 7.2 去除 24 孔板插入物中的任何凝胶。
- 将凝胶/凝胶切片覆盖在封闭缓冲液中,并在 20 °C 下孵育 30 分钟。
注:典型的封闭缓冲液由 0.5% 牛血清白蛋白 (BSA) 在 1x PBS 和 0.1% Triton X-100 中组成。Triton X-100 有毒,会引起严重的眼睛损伤、皮肤刺激,并且对水生生物有很强的毒性。使用者应穿戴防护服、佩戴护目镜和手套。 - 在封闭缓冲液中以最佳工作浓度制备一抗。每 24 孔板凝胶 200 μL,每个凝胶切片 100 μL,每 96 孔板孔 50 μL。
注:通常,用于凝胶 3D 染色的抗体浓度应为 2D 中所用浓度的两倍。 - 去除封闭缓冲液,向凝胶中滴加抗体溶液。
- 用石蜡膜密封板,并在 4 °C 下孵育过夜。
- 去除抗体溶液,用封闭缓冲液洗涤两次。
- 按照步骤 11.3 和 11.4 中描述的相同程序添加二抗。
- 在 4 °C 下避光孵育过夜,或在 20 °C 下孵育 3 小时。
- 去除抗体溶液并用 1x PBS 洗涤两次。
- 将样品覆盖在 1:1,000 DAPI 溶液中,并在 4 °C 下避光孵育 1 小时。
- 将凝胶转移到玻璃盖玻片上,并通过荧光/共聚焦显微镜成像。
12. RNA 提取
注:该方法中使用的体积适用于将肽凝胶接种到 24 孔板插入物中的情况。可以使用其他凝胶形式,并相应地调整体积。
- 从孔中取出培养基,用 1x PBS 洗涤肽凝胶两次,使用与更换培养基相同的技术(步骤 5.7)。
- 按照步骤 7.2 去除已在 24 孔板插入物中培养的肽凝胶。将每块凝胶放入单独的 15 mL 离心管中。
注意:请小心,因为此时凝胶可能很脆弱,尤其是在长时间培养后。 - 使用 P1000,向每个试管中加入 500 μL 胰蛋白酶-EDTA (0.25%),上下移液以混合,并破坏凝胶。
- 将凝胶在 37 °C 的胰蛋白酶-EDTA 中孵育 3-5 分钟。
注:孵育时间可能需要优化,具体取决于所使用的细胞类型。 - 加入 5 mL 的 1x PBS 以稀释胰蛋白酶-EDTA。
- 以 200 x g 离心 5 分钟以沉淀细胞。
- 去除上清液。
注意:请小心,因为细胞沉淀和上清液之间可能已经形成凝胶层。 - 根据制造商的说明,将细胞沉淀重悬于裂解缓冲液中,并按照 RNA 提取的标准方案进行。
结果
此处描述的肽凝胶制备方法允许用户定义和创建定制的 3D 培养环境。虽然机械环境主要由肽浓度决定,但也可以以受控密度添加目标基质组分,如图 1 中的示例计算所示。然而,在最简单的形式中,肽凝胶方案提供了一种在无基质的 3D 环境中封装细胞的方法。 图 2 显示了如何将这种方法与各种癌症模型相结合,包括荧光标记的癌细胞系(图 2A)和患者来源的异种移植物 (PDX) 材料(图 2B、C)。重要的是,细胞系和 PDX 材料都可以在无血清条件下在凝胶内培养(图 2C、D),从而提供具有完全成分的 3D 培养系统。
由于肽本身不包含任何细胞结合基序,因此包封的细胞通常在未修饰的肽凝胶中表现出圆形形态。 图 3A 证明,在 6 mg/mL 肽凝胶中,人乳腺成纤维细胞与纯基质胶和纯胶原凝胶中观察到的经典伸长形态相比。然而,重要的是,肽凝胶方案允许掺入感兴趣的基质组分。 图 3A 展示了添加 200 μg/mL 胶原蛋白 I 如何恢复肽凝胶中伸长的成纤维细胞形态。
基质添加还可以支持其他细胞类型的生长和组织,例如 MCF10A,如图 3B 所示。在这种情况下,向 6 mg/mL 肽凝胶中添加 100 μg/mL 胶原蛋白 I 可在第 7 天形成腺泡结构。在间接共培养中掺入支持细胞层也可能引入进一步的复杂性。 图 3C 展示了基质掺入和与人乳腺成纤维细胞间接共培养的联合方法如何增强 MCF10A 的生长和组织。
另一个重要参数是肽凝胶制造中使用的肽浓度。 图 4A 显示了一个示例,说明控制肽浓度(在本例中在 4 到 10 mg/mL 之间)如何导致 100 秒到 1000 秒 Pa 的刚度。这些凝胶可以是无基质制备的,也可以添加基质制成,以便同时控制刚度和成分。可以对添加基质的肽凝胶进行切片和染色,以便观察这些添加物的分布。 图 4B、C 显示了两种方法:包埋在 4% 琼脂中,然后进行标准组织处理和石蜡包埋以进行免疫组织化学(图 4B)或包埋在 2% 琼脂中,然后进行振动切片和荧光染色(图 4C)。
在修饰肽凝胶的组成时,确保这些变化不会影响最初呈现给细胞的机械环境至关重要。 图 4D 展示了如何使用对肽浓度的修改来抵消基质掺入时肽凝胶刚度的任何变化。然后,凝胶刚度(储能模量, G')的体振荡流变学测量可以区分凝胶组成和刚度对细胞形态的影响。如明场图像所示,MDA MB 231 细胞在加入 10 mg/mL 或 15 mg/mL 肽凝胶的胶原上形成拉长的形态。 图 4E 显示这些细长的细胞对 pFAK 呈阳性,表明与周围基质存在相互作用。肽凝胶最初无基质的环境也使其成为研究目标基质成分的细胞合成和沉积的理想平台。 图 4F 显示了封装在 10 mg/mL 肽凝胶中的 MCF7 细胞对胶原蛋白 I 的局部沉积。
肽凝胶的主要优势之一是可以轻松地将标准实验室方法应用于其分析。可以提取材料用于 qRT-PCR 以确定基因表达谱(如我们最近的出版物5 所示)。通过明场显微镜成像还可以实时观察细胞生长。 图 5 显示了在不成功的肽凝胶中可能遇到的一些典型故障排除问题:凝胶前体混合不完全(图 5A、B);肽浓度(图 5C、D)或接种密度(图 5E、F)优化不正确;以及在掺入肽凝胶之前酸性胶原蛋白的中和不正确(图 5G,H)。特别是,必须针对每种细胞系和肽源优化肽浓度和接种密度,以确保适当定义培养环境并代表目标应用。
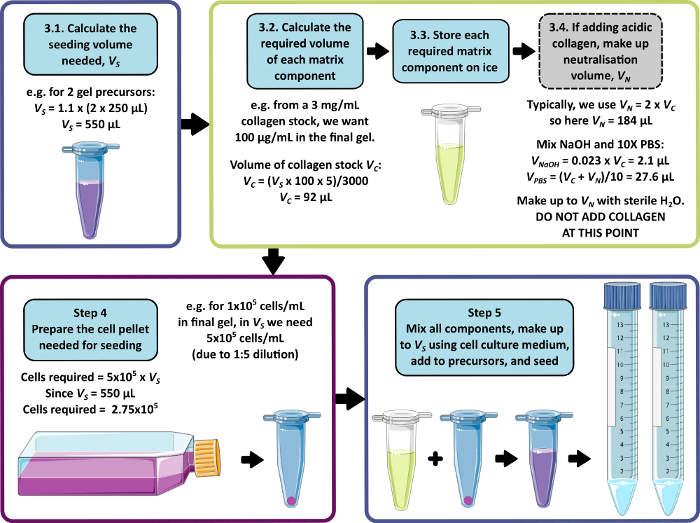
图 1:基质组成和晶种密度的计算示例。 此示例工作流程描述了以 1 x 10 5个细胞/ mL 的最终细胞密度接种两个添加 100 μg/mL 胶原蛋白的肽凝胶前体所遵循的程序。 请单击此处查看此图的较大版本。
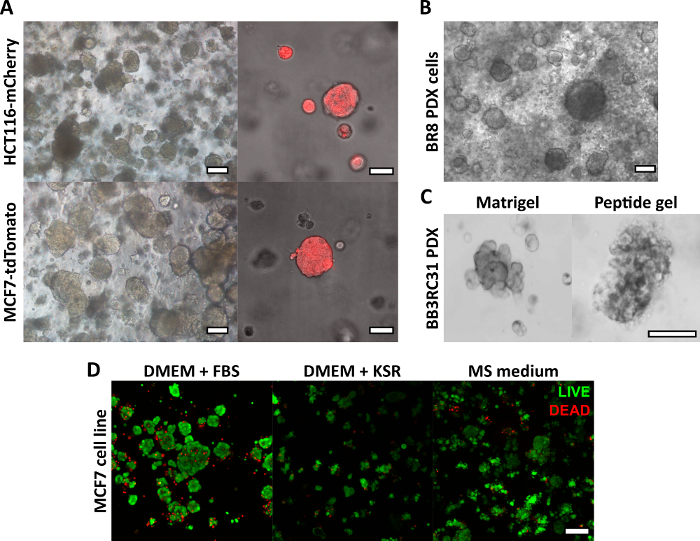
图 2:无基质肽凝胶为细胞系和患者来源的癌症模型提供了合适的 3D 培养平台。 (A) HCT116 结直肠癌和 MCF7 乳腺癌细胞系,分别组成性表达荧光标志物 mCherry 和 tdTomato,到第 9 天在 6 mg/mL 凝胶中形成细胞簇(左),并且可以使用荧光显微镜实时成像(右,比例尺 50 μm);(B) 来自三阴性乳腺癌患者 (BR8) 的患者来源的异种移植 (PDX) 细胞在第 7 天在 10 mg/mL 肽凝胶中形成细胞簇;(C) 来自雌激素受体阳性乳腺肿瘤 (BB3RC31) 的 PDX 细胞可以在无血清条件下生长18,在匹配的传代处用基底膜基质(例如 Matrigel)对照显示以进行比较;(D) 在第 7 天使用 LIVE/DEAD 细胞测定进行评估,在无基质和无血清条件下,MCF7 乳腺癌细胞在 6 mg/mL 肽凝胶中存活。KSR = 敲除血清替代物,MS 培养基 = 乳腺球培养基19。比例尺 100 μm,除非另有说明。 请单击此处查看此图的较大版本。
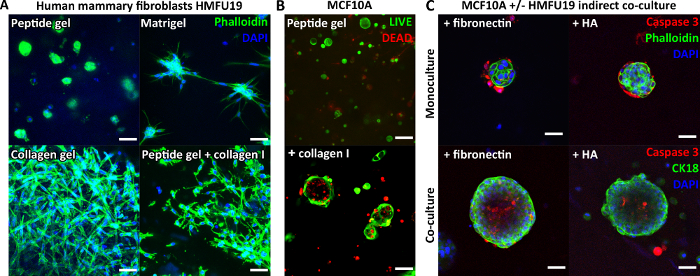
图 3:引入基质添加和共培养可能会增加肽凝胶的复杂性。 (A) 人乳腺成纤维细胞系 HMFU19 需要添加胶原蛋白以恢复 6 mg/mL 肽凝胶中的伸长形态,用纯基底膜基质(例如基质胶)和 1.5 mg/mL 大鼠尾部胶原蛋白 I 凝胶进行比较,比例尺 50 μm;(B) 添加 100 μg/mL 人胶原蛋白 I,比例尺 100 μm,MCF10A 正常乳腺细胞在 6 mg/mL 肽凝胶中第 7 天形成腺泡结构;(C) 在间接共培养中联合添加基质成分纤连蛋白/HA(透明质酸,分子量 804 kDa)和 HMFU19 可增加 10 mg/mL 肽凝胶中 MCF10A 腺泡的大小和组织,通过裂解的半胱天冬酶 3 染色评估,比例尺 50 μm。 请单击此处查看此图的较大版本。
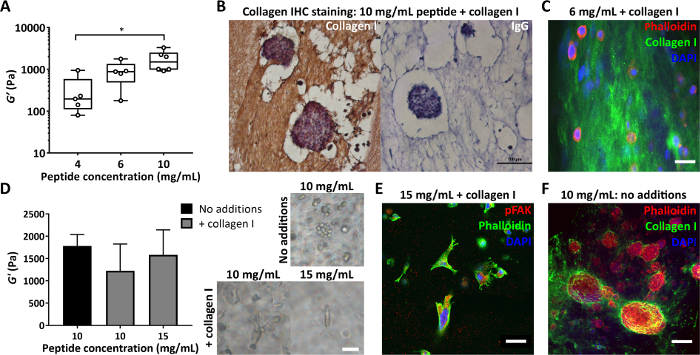
图 4:肽凝胶可以独立控制刚度和组成,并评估细胞沉积的基质。 (A) 体流变测量表明,通过控制肽浓度可实现典型的刚度范围(储能模量, G'),* 表示 p < 0.05;(B) 免疫组织化学显示 150 μg/mL 胶原蛋白 I 在封装的 MCF7 的 10 mg/mL 肽凝胶中染色(第 7 天,比例尺 100 μm);(C) 通过琼脂包埋和振动切片机(比例尺 25 μm)对 6 mg/mL 肽凝胶和 200 μg/mL 人胶原蛋白 I 中的分布进行免疫荧光;(D) 添加 200 μg/mL 胶原蛋白 I 可使 10 mg/mL 肽凝胶的储能模量 G' 适度降低(体振荡流变学),但肽浓度增加至 15 mg/mL 可抵消。MDA MB 231 三阴性乳腺癌细胞显示在每种条件下(第 7 天,比例尺 50 μm);(E) 含 200 μg/mL 人胶原蛋白 I 的 15 mg/mL 肽凝胶中的 MDA MB 231 通过 pFAK 染色显示伸长和与基质的相互作用(第 14 天,比例尺 50 μm);(F) MCF7 胶原蛋白 I 沉积在最初无基质的 10 mg/mL 肽凝胶中的原位染色(第 10 天,比例尺 100 μm)。 请单击此处查看此图的较大版本。

图 5:使用明场显微镜可以解决常见的肽凝胶故障排除问题。 除非另有说明,否则显示的细胞是第 7 天的 MCF10A 正常乳腺上皮细胞。(A) 正确混合的凝胶母离子应具有光学透明性,无不一致,而 (B) 混合/中和不足会导致肽凝胶中出现可见的不均匀性/条纹(白色箭头);(C) MCF10A 在添加 HMFU19 间接共培养物后在 6 mg/mL 肽凝胶中形成腺泡结构,但 (D) 在 15 mg/mL 时,肽浓度太高,无法形成腺泡;(E) 添加 100 μg/mL 胶原蛋白 I 后,以 5 x 10个 5 个细胞/mL 接种的 MCF10A 在 6 mg/mL 凝胶中形成腺泡结构,但 (F) 2 x 10个 5 个细胞/mL 的细胞密度太低,无法形成腺泡;(G) 胶原蛋白添加可在第 14 天产生大细胞簇,但 (H) 添加不当(在此过程中过早中和胶原蛋白)会阻止细胞簇生长。比例尺 100 μm。 请点击此处查看此图的较大版本。
讨论
我们发现此处描述的肽凝胶是一种简单、经济高效且灵活的解决方案,可支持多种细胞类型的 3D 培养。通过完全控制所用肽的浓度和所添加的蛋白质或聚糖,该方法可以根据其应用仔细定制肽凝胶。
与现有方法相比,肽凝胶的关键优势在于,可以使用不需要任何复杂化学程序的简单方法独立控制基质组成和机械性能。肽凝胶的机械性能主要由初始凝胶前体中的肽浓度决定。随后添加细胞和/或基质组分,即可创建完全用户定义的体外环境。尽管基质添加可能会改变凝胶的初始机械性能,但这很容易被肽浓度的独立变化所抵消5。与现有系统(例如胶原蛋白凝胶)相比,这提供了明显的优势,其中控制刚度的参数通常也会导致整合素结合基序的变化20,21。
我们已经证明了肽凝胶在癌细胞系和患者来源材料体外培养中的应用5。肽凝胶可获得的刚度范围(在 100 到 1000 Pa 的范围内)非常适合在乳房等软组织中复制正常和肿瘤基质环境。然而,我们认识到其他应用需要相当严格的环境,例如在 10-20 kPa 范围内用于骨再生。需要进一步修改此处介绍的协议,以将可实现的刚度扩展到此范围内,这在藻酸盐凝胶22 等替代方法中更为典型。同样,这里我们描述了一种通过在肽凝胶内物理包埋基质蛋白/聚糖来实现官能化的简单方法。对于此处描述的应用,这种方法效果很好,并且很容易适应希望使用 3D 体外疾病模型的非专业群体使用。与许多其他水凝胶11 一样,此处使用的肽可以扩展到包括细胞结合或其他生物基序,对于某些应用,这种方法可能更可取。
我们已经确定了几个需要仔细注意以确保成功的关键点。凝胶前体的形成是一个关键的中间步骤,使用户能够在掺入细胞之前检查所使用的条件是否正确。该前体可以储存数周(在 4°C 下),但必须在 80 °C 下孵育,然后在使用前在 37 °C 下孵育。合适的前驱体在 80 °C 时为完全液态,在 37 °C 时为自支撑。 这些检查对于确保凝胶正确发生至关重要。然后可以在生理条件下掺入细胞和/或基质。
已经使用 3D 基质的实验室将熟悉将细胞封装在肽凝胶中所需的小心处理。在包封步骤之前和期间必须注意限制细胞的搅动。我们发现,在此过程中,特定细胞类型对损伤的敏感性不同,用户必须仔细评估。此处描述的肽凝胶的浓度允许凝胶化在一定时间范围内进行,对于上述细胞,允许细胞在沉入铸型底部之前被封装,但速度足够慢,以至于它们不会被这个过程损坏。然而,值得注意的是,一些敏感细胞类型可能需要更快速的中和,以避免长时间暴露在升高的 pH 值下。在这种情况下,向肽凝胶周围的培养基中添加 10 mM HEPES 可能是有益的。
采用本协议中描述的方法时,仔细考虑肽源的质量非常重要。这里的肽不是用作功能性基序或涂层,而是水凝胶的整个不溶性部分。因此,肽结构中的任何污染物或变化都可能对最终水凝胶中支持细胞活力的完整性或能力产生重大影响。当转移到新批次的肽时,必须注意确保供应商具有良好的批次间一致性,并在形成凝胶前体时检查肽的行为。
总之,该协议描述了一个 3D 培养系统,其关键重点是机械和生物特性的独立控制。该方法的简单性和适应性使其适合任何细胞培养实验室采用,并适用于广泛的应用5。将来,该方案可能会扩展以允许肽序列的共价修饰。这可以与先进的显微镜方法相结合,以研究细胞施加在其周围基质上的拉伸力。然而,关键是能够区分人工掺入的基质和由封装细胞本身合成的基质。这种控制和监测基质随时间变化的能力将使人们对细胞-基质相互作用在癌症和其他疾病发展中的作用有前所未有的见解。
披露声明
作者没有什么可披露的。
致谢
我们要感谢国家研究动物替代、细化和减少中心的资助 NC/N0015831/1 至 JCA、GF 和 CLRM,NC/T001267/1 至 RBC、CLRM、JCA、KL-S 和 KS,NC/T001259/1 至 JCA、KL-S 和 CLRM 以及 NC/P002285/1 至 AMG、SJ 和 CLRM。还有来自工程和物理科学研究委员会的 EP/R035563/1 对 KL-S 和 CLRM 以及 EP/N006615/1 对 JLT 和 CLRM 的资助。 图 1 是使用 Servier Medical Art 改编的图形创建的。施维雅医学艺术 (Servier Medical Art) 根据知识共享署名 3.0 未本地化版本许可获得许可。
材料
| Name | Company | Catalog Number | Comments |
| Gel fabrication - Reagents | |||
| FEFEFKFK | Pepceuticals | n/a | Polypeptide; available from various suppliers. Pepceuticals is our recommended supplier due to the quality of the product. |
| PBS 10X | Gibco | 70011-036 | |
| Sodium hydroxide (1 M) | Sigma-Aldrich | S2770 | NaOH; dilute to 0.5 M prior to use |
| Water | Sigma-Aldrich | W3500 | |
| Gel fabrication - Equipment and Consumables | |||
| 15 mL falcon tubes | Greiner | 188261 | If using different brand ensure the material withstands temperatures of up to 90°C |
| 24 well plate | Corning Costar | 3524 | Alternative brands/suppliers can be used as long as there is a gap between the insert base and the plate surface |
| Centrifuge | Any | 200 x g for 3 minutes | |
| Class II Microbiological Safety Cabinet | Any | ||
| Fine balance | Any | Readability 0.1 mg | |
| Hanging insert for 24 well plate | Millipore | MCRP24H48 | Alternative brands/suppliers can be used as long as there is a gap between the insert base and the plate surface |
| Incubator | Any | 37°C, 5% CO2, humidified environment | |
| Oven | Any | set to 80°C | |
| P1000/200/20/10 pipette | Any | It is essential the pipettes used for the procedure are calibrated | |
| P1000/200/20/10 tips | Any | ||
| pH meter with microprobe | Any | ||
| Spatula | Any | ||
| Vortex | Any | ||
| Matrix addition | |||
| Collagen I (human) | Stem Cell Technologies | 07005 | |
| Collagen I (rat tail) | Gibco | A10483 | |
| Fibronectin | Stem Cell Technologies | 07159 | |
| Hyaluronic Acid | Iduron | HA804 | |
| Matrigel | Corning | 354234 | |
| Cell encapsulation/culture | |||
| B27 Supplement (no retinoic acid) | Gibco | 12587010 | Media additions for serum free cultures (Figure 2D) |
| Cholera toxin | Sigma-Aldrich | C-8052 | Media additions for MCF10A cells (Figure 3, 5) |
| DMEM | Gibco | 21969-035 | |
| DMEM/F12 | Sigma-Aldrich | D8062 | Media additions for MCF10A cells (Figure 3, 5) |
| DMEM/F12 Phenol Red Free | Gibco | 21041-025 | Media additions for serum free cultures (Figure 2D) |
| DPBS | Gibco | 14190-094 | |
| EGF | SourceBiosciences | ABC016 | Media additions for MCF10A cells (Figure 3, 5) |
| Fetal Bovine Serum | Gibco | 10500-064 | |
| Horse serum | Gibco | 26050-070 | Media additions for MCF10A cells (Figure 3, 5) |
| Human cancer/epithelial cell lines | e.g. MCF7/tdTomato MCF7/MCF10a/HCT116-mCherry | ||
| Human mammary fibroblasts | e.g. HMFU19 | ||
| Hydrocortisone | Sigma-Aldrich | H-0888 | Media additions for MCF10A cells (Figure 3, 5) |
| Insulin | Sigma-Aldrich | I9278 | Media additions for MCF10A cells (Figure 3, 5) |
| Knockout serum replacement | Gibco | 10828-028 | Media additions for serum free cultures (Figure 2D) |
| L-glutamine | Gibco | 25030-024 | |
| RPMI | Gibco | 21875-034 | |
| RPMI Phenol Red Free | Sigma-Aldrich | R7509 | |
| Imaging and other assays | |||
| 4% paraformaldehyde | Polysciences | 18814 | |
| Agar | SLS | CHE1070 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | 5482 | |
| Confocal and/or fluorescent microscope | Any | e.g. Leica TCS SPE confocal laser scanning microscope (Figures 2-4) | |
| DAPI solution | Invitrogen | D3571 | 300 uM working solution |
| DPX mounting medium | ThermoFisher Scientific | ||
| Glass cover slips | Any | No1 coverslips 0.13 - 0.17 mm thickness | |
| Glass-bottom dishes | MatTek | ||
| Goat Anti-Rabbit IgG H&L (HRP polymer) | Abcam | ab214880 | |
| Haematoxylin and Eosin | Any | ||
| Histology molds (disposable, plastic) | Any | ||
| Image analysis software | ImageJ | ||
| Live/Dead assay kit | Invitrogen | L3224 | |
| Microtome | Any | ||
| Phalloidin | Life Technologies | F432/R415 | |
| Pierce Peroxidase IHC Detection Kit | ThermoFisher Scientific | 36000 | |
| Primary Ab Caspase 3 | Abcam | ab34710 | Shown in Figure 3C |
| Primary Ab Collagen I | Cell Signalling Technology | 9661 | Shown in Figure 4B, C, F |
| Primary Ab pFAK Tyr 397 | ThermoFisher Scientific | 44-624G | Shown in Figure 4E |
| Prolong gold/diamond anti-fade mountant with DAPI | Molecular Probes | S36939 | |
| Rheometer Physica MCR 301 | Anton Paar | ||
| Scalpel | Any | ||
| Secondary antibody Goat anti Rabbit AF488 | nvitrogen | a11034 | |
| Secondary antibody Goat anti Rabbit AF546 | Invitrogen | a11010 | |
| SuperFrost slides | ThermoFisher Scientific | Coating e.g. APES can help to retain microtome sections on slides. | |
| Triton X 100 | Sigma-Aldrich | X100 | |
| Trypsin-EDTA (0.25%) | Gibco | 25300054 | |
| Vibratome | Leica |
参考文献
- Hynes, R. The extracellular matrix: not just pretty fibrils. Science. 326 (5957), 1216-1219 (2009).
- Tian, C., et al. Cancer-cell-derived matrisome proteins promote metastasis in pancreatic ductal adenocarcinoma. Cancer Research. 80 (7), 1461-1474 (2020).
- Hebert, J. D., et al. Proteomic profiling of the ECM of xenograft breast cancer metastases in different organs reveals distinct metastatic niches. Cancer Research. 80 (7), 1475-1485 (2020).
- Vennin, C., et al. CAF hierarchy driven by pancreatic cancer cell p53-status creates a pro-metastatic and chemoresistant environment via perlecan. Nature Communication. 10 (1), 3637(2019).
- Ashworth, J. C., et al. Peptide gels of fully-defined composition and mechanics for probing cell-cell and cell-matrix interactions in vitro. Matrix Biology. 85, 15-33 (2020).
- Toniatti, C., Jones, P., Graham, H., Pagliara, B., Draetta, G. Oncology drug discovery: Planning a turnaround. Cancer Discovery. 4 (4), 397-404 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5, 539-551 (2020).
- Onion, D., et al. 3-Dimensional patient-derived lung cancer assays reveal resistance to standards-of-care promoted by stromal cells but sensitivity to histone deacetylase inhibitors. Molecular Cancer Therapy. 15 (4), 753-763 (2016).
- Saunders, J. H., et al. Individual patient oesophageal cancer 3D models for tailored treatment. Oncotarget. 8 (15), 24224-24236 (2017).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Kühn, S., et al. Cell-instructive multiphasic gel-in-gel materials. Advanced Functional Materials. 30, 1908857(2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., Lutolf, M. P. Synthesis and characterization of well- defined hydrogel matrices and their application to intestinal stem cell and organoid culture. Nature Protocols. 12 (11), 2263-2274 (2017).
- Saiani, A., et al. Self assembly and gelation properties of α-helix versus β-sheet forming peptides. Soft Matter. 5 (1), 193-202 (2008).
- Wan, S., et al. Self-assembling peptide hydrogel for intervertebral disc tissue engineering. Acta Biomaterialia. 46, 29-40 (2016).
- Blache, U., Stevens, M. M., Gentleman, E. Harnessing the secreted extracellular matrix to engineer tissues. Nature Biomedical Engineering. 4 (4), 357-363 (2020).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Barcus, C. E., Keely, P. J., Eliceiri, K. W., Schule, L. A. Stiff collagen matrices increase tumorigenic prolactin signaling in breast cancer cells. Journal of Biological Chemistry. 288, 12722-12732 (2013).
- Bax, D. V., et al. Impact of UV- and carbodiimide-based crosslinking on the Integrin-binding properties of collagen-based materials. Acta Biomaterialia. 100, 280(2019).
- Huang, B. P., et al. Multi-peptide presentation and hydrogel mechanics jointly enhance therapeutic duo-potential of entrapped stromal cells. Biomaterials. 245, 119973(2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。