Method Article
Preparazione di un gel peptidico definito dall'utente per modelli di coltura 3D controllati di cancro e malattia
In questo articolo
Riepilogo
Presentiamo un metodo per creare un ambiente di coltura cellulare 3D, che può essere utilizzato per studiare l'importanza delle interazioni cellula/matrice nella progressione del cancro. Utilizzando un semplice octapeptide autoassemblante, la matrice che circonda le cellule incapsulate può essere controllata, con una regolazione indipendente dei segnali meccanici e biochimici.
Abstract
C'è una crescente consapevolezza che le cellule coltivate in 3D modellano meglio il comportamento in vivo rispetto a quelle coltivate in 2D. In questo protocollo, descriviamo un idrogel 3D semplice e sintonizzabile, adatto per la coltura di cellule e tessuti in un ambiente che corrisponde al loro ambiente nativo. Ciò è particolarmente importante per i ricercatori che studiano l'inizio, la crescita e il trattamento del cancro, dove l'interazione tra le cellule e la loro matrice extracellulare locale è una parte fondamentale del modello. Il passaggio alla coltura 3D può essere impegnativo ed è spesso associato a una mancanza di riproducibilità a causa dell'elevata variazione da lotto a lotto nelle matrici di coltura 3D di origine animale. Allo stesso modo, i problemi di manipolazione possono limitare l'utilità degli idrogel sintetici. In risposta a questa esigenza, abbiamo ottimizzato un semplice gel peptidico autoassemblante, per consentire la coltura di modelli di linee cellulari rilevanti di cancro e malattia, nonché di tessuti/cellule derivati da pazienti. Il gel stesso è privo di componenti della matrice, a parte quelli aggiunti durante l'incapsulamento o depositati nel gel dalle cellule incapsulate. Le proprietà meccaniche degli idrogel possono anche essere modificate indipendentemente dall'aggiunta di matrice. Pertanto, agisce come una "tabula rasa" che consente ai ricercatori di costruire un ambiente di coltura 3D che rifletta il tessuto bersaglio di interesse e di sezionare le influenze delle forze meccaniche e/o del controllo biochimico del comportamento cellulare in modo indipendente.
Introduzione
I molti ruoli svolti dall'ambiente extracellulare nello sviluppo e nella progressione del cancro stanno diventando sempre più chiari1. Recentemente, analisi dettagliate basate sulla proteomica si sono aggiunte a una già convincente base di letteratura, dimostrando che i componenti della matrice derivati da cellule stromali associate al cancro, o le cellule tumorali stesse, sono fattori chiave in eventi come la promozione della transizione mesenchimale epiteliale e la diffusione metastatica 2,3,4. Data questa riconosciuta importanza della matrice extracellulare (ECM), sta diventando cruciale passare a piattaforme di coltura cellulare che consentano il controllo dell'ambiente 3D presentato alle cellule. In risposta a questa esigenza, questo protocollo presenta un metodo per l'incapsulamento e la coltura cellulare in un idrogel 3D, con composizione ECM e proprietà meccaniche definite dall'utente5.
Attualmente, esiste una scarsa correlazione tra l'efficacia terapeutica del cancro in colture 2D in vitro, l'impatto di queste terapie negli attuali modelli in vivo (xenotrapianto derivato da paziente, PDX) e la loro eventuale attività negli studi clinici 6,7. Ciò ha portato a fallimenti significativi nella pipeline di scoperta di farmaci, con l'urgente necessità di modelli in vitro migliorati che consentano alle terapie testate di "fallire presto, fallire a buon mercato". Molti ricercatori utilizzano il prodotto derivato dal mastocitoma di topo, ad esempio Matrigel (o prodotti simili) per creare ambienti ricchi di matrici 3D per crescere e osservare il comportamento cellulare in vitro, comprese le cellule derivate da PDX e altre cellule vicine al paziente 8,9,10. Tuttavia, questo approccio "taglia unica" trascura il complesso ruolo svolto dalle proteine della matrice/glicani nell'inizio e nella progressione del cancro.
Il riconoscimento del ruolo della matrice extracellulare (ECM) nel controllo del comportamento cellulare ha anche incoraggiato l'uso della coltura 3D in o su idrogel composti da specifici componenti della matrice11. Sebbene ciò sia utile per studiare interazioni specifiche, questi sistemi soffrono dell'incapacità di separare le istruzioni meccaniche e biochimiche tra cellule e matrice. Possono anche essere difficili da gestire e possono fornire letture poco chiare del comportamento cellulare. I gel di collagene sono un esempio chiave di questo problema, poiché la contrazione del gel cellulo-mediata può ridurre drasticamente la capacità di visualizzare le cellule all'interno del gel5. Ci sono anche alcuni sistemi di gel multicomponente molto eleganti, che gli esperti hanno utilizzato con grande effetto 12,13,14. Questi possono incorporare linker sensibili agli enzimi e motivi bioattivi, ma sono significativamente più complessi nella loro formulazione e applicazione rispetto al sistema qui descritto.
Questo protocollo descrive un metodo per la creazione di modelli di coltura 3D completamente definiti, che consente di modellare in vitro i ruoli della MEC nello sviluppo e nella malattia. La base del modello 3D è un gel peptidico, che abbiamo precedentemente descritto come un'ottimizzazione di un semplice idrogel ottapeptidico autoassemblante 5,15,16. Abbandonando le complesse matrici di origine animale, questo sistema offre un vantaggio significativo in termini di migliore coerenza tra lotti e una migliore gestione. Nel suo stato semplice, il peptide non contiene motivi derivati dalla matrice e fornisce efficacemente una "tabula rasa" su cui l'utente può costruire funzionalità.
Dimostriamo come le proprietà meccaniche del gel peptidico possano essere regolate in modo indipendente, insieme all'incorporazione di proteine/glicani della matrice. Il sistema è altamente sintonizzabile, consentendo l'incapsulamento di una gamma di tipi di cellule in vari formati. È importante per la costruzione di un modello di cancro, anche le cellule stromali possono essere incorporate: in co-coltura diretta o separate per consentire un'analisi specifica delle interazioni indirette cellula tumorale-stroma. Soprattutto, il protocollo qui descritto non richiede conoscenze complesse di chimica e può essere riprodotto in qualsiasi laboratorio di coltura cellulare senza la necessità di conoscenze o attrezzature chimiche specializzate.
Abbiamo ottimizzato i metodi per lo studio del comportamento cellulare nei gel peptidici, tra cui l'imaging, l'analisi reologica, l'estrazione del materiale per la PCR5 e l'inclusione per la valutazione istologica. Un chiaro vantaggio del semplice sistema idrogel è la capacità di visualizzare e studiare la matrice depositata dalle cellule incapsulate. L'importanza delle matrici derivate da cellule e i benefici di una migliore comprensione di come le cellule riprogettano il loro microambiente locale sono stati evidenziati di recente17 e riflettono una crescente consapevolezza dell'importanza di intrappolare i componenti della matrice secreti dalle cellule, in modo simile a quanto avviene in vivo. Sfruttare la capacità di modellare tali processi può essere uno dei fattori fondamentali per una maggiore rilevanza per i pazienti dei modelli di malattia basati su idrogel.
Protocollo
1. Dissoluzione del peptide
- In una cappa per coltura tissutale, aggiungere 800 μL di acqua sterile in una provetta da 15 mL utilizzando una pipetta P1000.
- Utilizzando una bilancia fine, pesare la polvere di peptidi in una navicella di pesatura non statica. Utilizzare una massa (in mg) di 1,25 volte la concentrazione finale di gel peptidico desiderata (in mg/mL, Tabella 1).
NOTA: Il metodo qui descritto produrrà un volume di circa 1,25 mL di gel peptidico per provetta al punto di gelificazione finale. È possibile preparare più provette alla volta o, in alternativa, aumentare il volume per provetta quando l'utente ha esperienza con il metodo presentato.
| Concentrazione di peptidi (dopo la gelificazione finale) | Massa del peptide | Aggiunta iniziale di NaOH |
| 6 mg/mL | 7,5 mg rivestite con film | 30 μl |
| 10 mg/mL | 12,5 mg compresse rivestite di film | 60 μl |
| 15 mg/mL | 18,75 mg compresse rivestite con film | 100 μl |
Tabella 1: Massa peptidica e aggiunta iniziale di NaOH suggerita per le tipiche concentrazioni finali di gel. Gli intervalli di concentrazioni peptidiche elencati possono essere estesi in entrambe le direzioni, tuttavia, è più probabile che concentrazioni peptidiche più basse non possano formare gel stabili, mentre ad alte concentrazioni il gel risultante può essere troppo denso per consentire un sufficiente scambio di nutrienti e vitalità cellulare. La concentrazione appropriata richiederà l'ottimizzazione per diversi tipi di cellule e lotti di peptidi.
- Aggiungere il peptide pesato nella provetta da 15 mL. Muovi la barca di pesatura per assicurarti che non rimanga polvere.
NOTA: La polvere peptidica può essere molto statica, fare attenzione a ridurre al minimo la perdita di polvere. Non è necessario mantenere le condizioni di sterilità durante le fasi 1.2 e 1.3 (o per qualsiasi misurazione del pH) poiché la sterilizzazione avviene durante l'incubazione a 80 °C più avanti nel processo. - Agitare per 3 min, quindi centrifugare a 200 x g per 3 min.
- Incubare la soluzione peptidica in forno a 80 °C per un minimo di 2 ore. Se dopo l'incubazione è presente un peptide non disciolto, ripetere il passaggio 1.4.
NOTA: Poiché il riscaldamento uniforme è essenziale, un blocco termico non è adatto per questo passaggio. Tuttavia, abbiamo scoperto che i forni di ibridazione funzionano bene così come un bagno d'acqua, purché la soluzione peptidica sia completamente sommersa.
2. Formazione di precursori del gel
- Preparare una soluzione sterile di idrossido di sodio (NaOH) 0,5 M utilizzando acqua sterile.
NOTA: Si consiglia una soluzione di NaOH appena diluita per ottenere risultati più coerenti. - In una cappa per coltura tissutale, aggiungere 0,5 M di NaOH al centro del peptide disciolto e mescolare mescolando lentamente con la punta della pipetta (Tabella 1).
- Agitare la provetta per 10 s e centrifugare a 200 x g per 10 s per rimuovere le bolle.
- Se il precursore del gel è torbido, ripetere i passaggi 2.2 e 2.3, aggiungendo incrementi di 5 μL di NaOH.
NOTA: La misurazione del pH può aiutare a determinare se è stata aggiunta una quantità sufficiente di NaOH: il pH ottimale è compreso tra 9 e 10,5 ed è preferibile non superarlo poiché l'uso di acidi per abbassare il pH può causare disomogeneità del gel. Il volume preciso di NaOH richiesto può variare a seconda della fonte peptidica. - Una volta che il precursore del gel è otticamente limpido e autoportante (o scorre appena) all'inversione della provetta da 15 mL, aggiungere 100 μL di PBS sterile 10x in una cappa di coltura tissutale. Vortex per 10 s e centrifugare a 200 x g per 10 s.
NOTA: Se il precursore del gel è torbido, ripetere il passaggio 2.4 fino a quando non diventa limpido e semisolido. Se il precursore del gel è liquido (al di sopra del pH ~10,5), non formerà un gel stabile e deve essere scartato. - Incubare per una notte in forno a 80 °C.
- Controllare visivamente il precursore del gel per assicurarsi che sia completamente liquido a 80 °C.
- Se il precursore del gel non è completamente liquido a 80 °C, non è stato sufficientemente neutralizzato, aggiungere NaOH seguendo il passaggio 2.4.
- Se il precursore del gel è liquido ma sono presenti bolle d'aria o piccoli precipitati, agitare bruscamente il tubo per disperderli. Se le bolle d'aria o i precipitati persistono dopo aver azionato la provetta, agitare il precursore del gel e centrifugare a 200 x g per 10 s ciascuno.
- Dopo aver seguito una delle fasi 2.7.1 o 2.7.2, incubare i gel precursori per altre 2 ore a 80 °C prima di procedere alla gelificazione finale.
- Conservare i precursori del gel a 80 °C fino al momento del bisogno (massimo 48 ore).
NOTA: Il protocollo può essere messo in pausa qui, conservare i precursori del gel a 4 °C per un massimo di 4 settimane. Se si riparte da questo punto di pausa, incubare i precursori del gel a 80 °C per almeno 2 ore e ricominciare dal passaggio 2.7. Si consiglia vivamente di preparare i precursori del gel con largo anticipo rispetto alla loro necessità per la gelificazione finale, per assicurarsi che ci sia tempo sufficiente per le modifiche di cui sopra, se necessario.
3. Preparazione dei componenti della matrice per la semina
NOTA: Un esempio di calcolo per i passaggi da 3 a 5 è mostrato nella Figura 1. La fase 3 e la fase 4 possono essere omesse per produrre rispettivamente un gel senza matrice e/o senza cellule.
- Calcolare il volume totale combinato di cellule, matrice e terreno necessari per la semina, consentendo l'aggiunta di 250 μl a ciascun gel precursore da 1 mL. Moltiplicare questo volume per 1,1 per tenere conto dell'errore di pipettaggio. Questo è il volume di semina, VS.
- Per ciascun componente della matrice, calcolare il volume di soluzione madre da aggiungere al volume di semina utilizzando l'equazione 1:
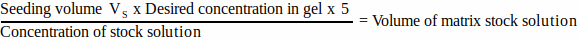 (1)
(1)
NOTA: VS corrisponde al volume totale di terreno di semina necessario per la semina di tutti i gel (passaggio 3.1). Assicurarsi che la somma di tutti i volumi dei componenti della matrice non superi VS. - Scongelare accuratamente tutti i componenti della matrice (fare riferimento alle istruzioni del produttore) e conservare in ghiaccio fino al momento del bisogno.
NOTA: Alcuni componenti della matrice saranno molto inclini alla gelificazione. Fare riferimento alle istruzioni del produttore per evitare che ciò accada. - Se è necessario aggiungere una soluzione madre di collagene acido che richiede la neutralizzazione (fare riferimento alle istruzioni del produttore), preparare la soluzione di neutralizzazione come segue:
- Calcolare il volume della soluzione madre di collagene, VC, richiesto utilizzando l'equazione 1.
- Determinare un volume adatto per la soluzione di neutralizzazione, VN. Questo dovrebbe essere scelto in modo tale che il volume combinato di tutte le aggiunte di matrice non superi il volume di semina, VS.
NOTA: Generalmente, un valore ragionevole per VN = 2 x Vc, ma questo può essere regolato in base al numero e al volume di altri componenti della matrice da aggiungere. - Calcolare il volume di 1 M NaOH richiesto per la neutralizzazione utilizzando l'equazione 2.
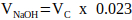 (2)
(2) - Calcolare il volume di 10x PBS richiesto nella soluzione di neutralizzazione utilizzando l'equazione 3.
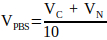 (3)
(3) - Combinare i volumi calcolati di 1 M NaOH e 10x PBS, quindi portare fino a VN con acqua sterile. Mescolare bene e conservare con ghiaccio fino al momento del bisogno.
NOTA: Non aggiungere il collagene acido a questo punto. La miscelazione prematura del collagene con la soluzione di neutralizzazione porterà all'inizio della fibrillogenesi del collagene, che può causare incoerenza nelle proprietà del gel peptidico finale.
4. Preparazione delle cellule per la semina
- Se non è già stato completato, calcolare il volume di semina, VS secondo il passaggio 3.1.
- Calcolare la densità cellulare richiesta in questa sospensione cellulare, prendendo la densità cellulare desiderata nel gel peptidico finale e moltiplicando per 5.
NOTA: La sospensione cellulare è 5 volte la concentrazione finale desiderata per tenere conto della diluizione dopo la miscelazione con il precursore del gel. Le densità cellulari dovrebbero essere ottimizzate per ogni nuova linea cellulare in esame. A seconda del tipo di cellula, possono essere appropriate densità comprese tra 1 x 104 e 1 x 106 cellule/mL nel gel peptidico finale. - Calcolare il numero totale di celle necessarie per la semina (moltiplicare la densità delle celle per il volume di semina VS calcolato al punto 4.1.).
- Utilizzando i metodi standard di coltura/passaggio per le cellule in uso, preparare un pellet di cellule contenente la quantità richiesta di cellule, come calcolato al punto 4.3.
5. Gelificazione finale/incapsulamento cellulare
- Al momento di iniziare la gelificazione finale, trasferire i precursori del gel dal forno a 80 °C in un bagno d'acqua a 37 °C.
NOTA: I precursori del gel devono essere autoportanti a 37 °C. Se sono liquidi, è improbabile che si verifichi una gelificazione completa e i precursori del gel devono essere scartati. - Preparare una piastra da 96 pozzetti o, in alternativa, una piastra da 24 pozzetti (o simile) con inserti per colture cellulari.
NOTA: Assicurarsi che ci sia uno spazio tra la base dell'inserto e la piastra a pozzetti quando si placcano i gel peptidici in inserti a 24 pozzetti. Ciò garantisce che il gel sia a contatto con i fluidi. - Se è necessario aggiungere la matrice, combinare tutti i componenti della matrice e le soluzioni di neutralizzazione (passaggio 3). Preparare fino a VS (passaggio 3.1) utilizzando il terreno di coltura cellulare e mescolare accuratamente. Se si desidera aggiungere cellule, risospendere il pellet di cellule preparato al punto 4 utilizzando il volume di semina VS.
NOTA: Se nella fase 3 non sono stati preparati componenti della matrice, utilizzare il terreno di coltura cellulare per il volume di semina. Questo è generalmente il terreno di coltura standard per il tipo di cellula in uso, anche se potrebbe essere necessario convalidarlo se viene utilizzata una miscela di tipi di cellule. - Utilizzando una pipetta P1000, aggiungere delicatamente 250 μl della miscela cellula/matrice sopra il precursore in gel.
NOTA: I componenti della matrice, in particolare l'estratto della membrana basale, possono iniziare a polimerizzare una volta aggiunti al precursore del gel. È quindi importante passare al passaggio successivo il più rapidamente possibile. - Miscelare delicatamente mediante l'azione combinata di pipettaggio e agitazione. Il gel si assottiglia a taglio, quindi diventerà più facile da miscelare con un pipettaggio/agitazione delicato. Una volta accuratamente miscelato, aggiungere 100 μl a ciascun pozzetto di una piastra a 96 pozzetti o 200 μl a ciascun inserto di coltura cellulare.
NOTA: Durante la miscelazione, il pipettaggio inverso con un P1000 impostato a 200 μl può essere utile per evitare l'introduzione di bolle d'aria. Il gel può essere inizialmente difficile da miscelare, ma continuando la miscelazione dovrebbe diventare più facile: questo indica che la miscelazione è efficiente. - Incubare per 10 minuti a 37 °C in CO2 al 5% e in atmosfera umidificata.
NOTA: Questo passaggio non è necessario se il gel peptidico non contiene aggiunte di matrice. - Aggiungere 200 μL di terreno a ciascun pozzetto della piastra a 96 pozzetti o 1 mL all'esterno dell'inserto di coltura cellulare con alcune gocce sulla parte superiore del gel. Incubare a 37 °C in CO2 al 5% e in atmosfera umidificata.
- Cambia i file multimediali due volte entro l'ora successiva e di nuovo dopo diverse ore (o il giorno successivo).
NOTA: Fai attenzione qui poiché i gel saranno instabili per diverse ore. - Cambiare i terreni ogni 2-3 giorni (o seguendo il protocollo di coltura standard per le cellule in uso).
6. Co-cultura indiretta
NOTA: Questo metodo è applicabile solo quando i gel peptidici vengono seminati in inserti per piastre a 24 pozzetti o formati simili in cui il gel può essere supportato sopra un monostrato cellulare. In questo caso, la co-coltura indiretta può essere introdotta preparando uno strato di cellule alimentatore 2D sul fondo della piastra a pozzetti.
- Preparare una piastra a 24 pozzetti per la semina. Questa dovrebbe essere una piastra separata dai gel peptidici, ma dovrebbe essere della stessa marca per garantire la compatibilità con gli inserti utilizzati (vedere il passaggio 5.2).
- Calcolare la densità cellulare necessaria per la semina della co-coltura indiretta, in base al tipo di cellula in esame.
NOTA: La densità di semina cellulare deve essere ottimizzata per ogni nuova linea cellulare in esame. Le celle devono essere piastrate in modo da dare circa il 30-50% di confluenza. Ad esempio, la linea cellulare di fibroblasti mammari umani HMFU19 è tipicamente placcata a una densità di 1-5 x 104 cellule/pozzetto. - Utilizzando i metodi standard di coltura/passaggio per le cellule in uso, preparare una sospensione cellulare adatta alla semina a 1 mL/pozzetto, utilizzando il terreno di crescita tipico per queste cellule.
- Seminare la sospensione cellulare nella piastra a pozzetti, 1 mL per pozzetto.
- Incubare a 37 °C in CO2 al 5% e in atmosfera umidificata per diverse ore o durante la notte. Quindi rimuovere il terreno dai pozzetti.
- Utilizzando una pinza sterile, trasferire gli inserti della piastra a 24 pozzetti contenenti i gel peptidici nei nuovi pozzetti contenenti le cellule pre-seminate in 2D. Aggiungere 1 mL di terreno goccia a goccia all'esterno dell'inserto e alcune gocce sulla superficie del gel.
NOTA: Tipicamente, il terreno utilizzato a questo punto è quello adatto per le cellule incapsulate nel gel, ma l'idoneità di questo mezzo per le cellule in 2D potrebbe richiedere una verifica o un'ottimizzazione per il particolare esperimento in esame. - Preparare regolarmente strati di alimentazione freschi per evitare l'eccessiva confluenza e trasferire i gel peptidici in questi nuovi pozzetti seguendo lo stesso metodo di cui sopra.
NOTA: Tipicamente, le cellule per la co-coltura indiretta vengono preparate contemporaneamente alla semina del gel peptidico. I gel peptidici possono quindi essere trasferiti in co-coltura al momento del cambio del terreno dopo alcune ore o incubazione notturna, vedere la fase 5.8.
7. Reologia oscillatoria di massa di gel peptidici
NOTA: Come standard, la caratterizzazione reologica viene effettuata 24 ore dopo la semina del gel, che dovrebbe avvenire in inserti di piastre a 24 pozzetti.
- Impostare e calibrare il reometro secondo le istruzioni del produttore. Utilizzare una geometria della piastra parallela con il diametro della piastra il più vicino possibile al diametro dell'inserto per coltura cellulare.
NOTA: Se lo si desidera, i test possono essere eseguiti a 37 °C, replicando l'ambiente durante la coltura. - Rimuovere il primo campione di gel peptidico da testare dall'inserto di coltura cellulare capovolgendo l'inserto e ritagliando la membrana di plastica con un bisturi.
NOTA: Assicurarsi che la piastra contenente i gel peptidici sia all'esterno dell'incubatore per colture cellulari il più breve tempo possibile prima del test. I terreni con un sistema tampone a base di bicarbonato si basano sulla presenza di CO2 per mantenere il pH. I gel che sono stati fuori dall'incubatore troppo a lungo andranno alla deriva del pH, il che può influire sulla valutazione reologica. Può essere utile mantenere i gel con 10 mM di HEPES aggiunti al terreno per prevenire questo effetto. - Trasferire con cura il gel sulla piastra del reometro. Quindi, utilizzando un bisturi, tagliare l'altezza del gel a circa 1 mm per ridurre al minimo la deformazione del gel quando viene caricato sotto la piastra del reometro.
NOTA: Fare attenzione a non toccare o danneggiare la piastra del reometro quando si utilizza il bisturi. - Impostare la distanza tra le piastre parallele su 1 mm. Eliminare il gel in eccesso che non è coperto dalle piastre del reometro.
- Eseguire le impostazioni di test desiderate sul reometro, secondo le istruzioni del produttore.
NOTA: Per ogni nuova condizione del campione, si consiglia di eseguire uno sweep di ampiezza dallo 0,1 al 100% di deformazione per garantire che tutti i test vengano eseguiti a un livello di deformazione all'interno della regione viscoelastica lineare del campione.
8. Colorazione viva/morta di cellule incapsulate
- Rimuovere il terreno dai pozzetti e lavare i gel peptidici due volte con 1x PBS, utilizzando la stessa tecnica utilizzata per un cambio del terreno (passaggio 5.7).
- Rimuovere i gel peptidici che sono stati coltivati in inserti di piastre a 24 pozzetti dopo il passaggio 7.2. Conservare i gel in 1x PBS nella piastra a pozzetti originale fino al momento della colorazione.
NOTA: Fai attenzione perché i gel possono essere fragili a questo punto, soprattutto dopo una coltura prolungata. - Preparare una soluzione di colorazione viva/morta, che consenta di ottenere 500 μl di colorante per inserto della piastra a 24 pozzetti o 50 μl per pozzetto di una piastra a 96 pozzetti. Una colorazione tipica è 4 μM di omodimero di etidio e 2 μM di calcicina AM in 1x PBS. Proteggere la soluzione risultante dalla luce.
NOTA: Le concentrazioni di reagenti vivi/morti possono richiedere un'ulteriore ottimizzazione a seconda del tipo di cellula utilizzata e del fornitore di reagenti. - Rimuovere con cura il PBS da ogni gel e sostituirlo con alcune gocce della soluzione colorante, assicurandosi che ogni gel sia ben coperto.
- Incubare i gel nella soluzione colorante al buio per 10-15 minuti, quindi visualizzare utilizzando un microscopio confocale/fluorescente.
NOTA: Per immagini di qualità superiore, può essere utile trasferire i gel su piatti con fondo di vetro dello spessore del vetrino coprioggetti.
9. Fissaggio di gel peptidici per l'imaging di endpoint
- Lavare i gel peptidici seguendo il passaggio 8.1.
- Aggiungere il 4% di paraformaldeide (PFA) in 1x PBS: 100 μL per ogni pozzetto di una piastra da 96 pozzetti e 1 mL per ogni gel in un inserto per piastra da 24 pozzetti (alcune gocce devono essere aggiunte sopra il gel all'interno dell'inserto).
ATTENZIONE: La paraformaldeide (PFA) è altamente tossica e viene facilmente assorbita attraverso la pelle. È estremamente distruttivo per la pelle, gli occhi, le mucose e le vie respiratorie superiori. Il PFA deve essere maneggiato in una cappa aspirante e gli utenti devono indossare indumenti protettivi e guanti. I fissativi chimici alternativi possono essere utilizzati allo stesso modo a seconda dell'applicazione finale. - Incubare i gel peptidici nel fissativo PFA per 1 ora a temperatura ambiente.
- Rimuovere il fissativo PFA e lavare due volte i gel peptidici con 1x PBS.
NOTA: Il protocollo può essere messo in pausa qui, conservare i gel peptidici fissati a 4 °C in 1x PBS per un massimo di 4 settimane, assicurandosi che la piastra sia ben sigillata con pellicola di paraffina.
10. Inclusione di gel peptidici per il sezionamento
NOTA: L'inclusione di gel peptidici in agar al 4% è un passaggio cruciale prima dell'inclusione in paraffina per l'immunoistochimica. In alternativa, i gel possono essere incorporati in agar al 2% e sezionati utilizzando un vibratomo (in genere sezioni da 500 μm danno buoni risultati). Questo è un passaggio facoltativo, che produce sezioni di gel idratato che possono essere utili per colorare la localizzazione della matrice extracellulare nel gel, utilizzando i metodi nella sezione 11.
- Preparare una soluzione fusa di agar al 2% o al 4% in 1x PBS (vedi nota sopra), facendo bollire in un forno a microonde. Lasciar raffreddare per qualche minuto prima dell'uso.
NOTA: L'agar fuso presenta un pericolo di calore: maneggiare con cura utilizzando protezioni per le mani e il viso. Una volta preparata, la soluzione di agar può essere conservata a 4 °C fino al momento del bisogno. - Rimuovere il gel peptidico dall'inserto per coltura cellulare seguendo il passaggio 7.2.
- Utilizzando una pipetta di plastica Pasteur, coprire la base di uno stampo da inclusione istologica con un sottile strato di soluzione di agar. Lasciare raffreddare a 20 °C per qualche secondo.
- Usando una spatola, posiziona il gel peptidico al centro dell'agar. Quindi coprire completamente il gel peptidico con l'agar.
NOTA: Il gel non deve penetrare nell'agar. In tal caso, rimuovere il gel e attendere ancora qualche secondo fino a quando l'agar non si sarà solidificato di più e riprovare. Cerca di non lasciare che avvenga troppa solidificazione o ci sarà una debole giunzione tra i due strati. - Lasciare raffreddare il gel incorporato per 1 ora a 4 °C prima di rimuoverlo dallo stampo istologico.
NOTA: Il protocollo può essere messo in pausa qui, conservare i gel incorporati a 4 °C in 1x PBS per un massimo di 4 settimane. - Se è necessario eseguire l'immunoistochimica, inserire i gel incorporati in un processore di tessuti e procedere utilizzando i metodi di laboratorio standard.
NOTA: In alternativa, i gel incorporati possono essere tagliati in sezioni idratate utilizzando un vibratomo. Le sezioni idratate devono essere conservate in piastre sigillate a 4 °C in 1x PBS per un massimo di 4 settimane.
11. Colorazione delle cellule in gel mediante immunocitochimica
- Rimuovere il 1x PBS che copre i gel peptidici/sezioni di gel. Rimuovere eventuali gel ancora negli inserti della piastra a 24 pozzetti seguendo il passaggio 7.2.
- Coprire i gel/le sezioni di gel in un tampone bloccante e incubare per 30 minuti a 20 °C.
NOTA: Un tipico tampone bloccante è costituito dallo 0,5% di albumina sierica bovina (BSA) in 1x PBS con 0,1% di Triton X-100. Triton X-100 è tossico e provoca gravi danni agli occhi, irritazioni cutanee ed è molto tossico per la vita acquatica. Gli utenti devono indossare indumenti protettivi, protezione per gli occhi e guanti. - Preparare gli anticorpi primari in tampone bloccante a concentrazioni di lavoro ottimizzate. Consentire 200 μl per gel per piastra a 24 pozzetti, 100 μl per sezione di gel e 50 μl per pozzetto per piastra a 96 pozzetti.
NOTA: In genere, le concentrazioni di anticorpi utilizzate per la colorazione 3D nei gel dovrebbero essere doppie rispetto alla concentrazione utilizzata nel 2D. - Rimuovere il tampone bloccante e aggiungere la soluzione anticorpale ai gel goccia a goccia.
- Sigillare la piastra con pellicola di paraffina e incubare per una notte a 4 °C.
- Rimuovere la soluzione di anticorpi e lavare due volte con tampone bloccante.
- Aggiungere l'anticorpo secondario seguendo le stesse procedure descritte nei passaggi 11.3 e 11.4.
- Incubare al buio per una notte a 4 °C o per 3 ore a 20 °C.
- Rimuovere la soluzione di anticorpi e lavare due volte con 1x PBS.
- Coprire i campioni in una soluzione DAPI 1:1.000 e incubare a 4 °C al buio per 1 ora.
- Trasferire il gel su un vetrino coprioggetto di vetro e creare un'immagine mediante microscopia fluorescente/confocale.
12. Estrazione dell'RNA
NOTA: I volumi utilizzati in questo metodo sono applicabili quando i gel peptidici vengono seminati in inserti di piastre a 24 pozzetti. È possibile utilizzare altri formati di gel e regolare i volumi di conseguenza.
- Rimuovere il terreno dai pozzetti e lavare i gel peptidici due volte con 1x PBS, utilizzando la stessa tecnica utilizzata per un cambio del terreno (passaggio 5.7).
- Rimuovere i gel peptidici che sono stati coltivati in inserti di piastre a 24 pozzetti dopo il passaggio 7.2. Mettere ogni gel in una provetta da centrifuga separata da 15 mL.
NOTA: Fai attenzione perché i gel possono essere fragili a questo punto, soprattutto dopo una coltura prolungata. - Utilizzando un P1000, aggiungere 500 μl di tripsina-EDTA (0,25%) a ciascuna provetta e pipettare su e giù per miscelare e interrompere il gel.
- Incubare i gel nella tripsina-EDTA a 37 °C per 3-5 minuti.
NOTA: I tempi di incubazione possono richiedere un'ottimizzazione a seconda del tipo di cellula utilizzata. - Aggiungere 5 mL di 1x PBS per diluire la tripsina-EDTA.
- Centrifugare a 200 x g per 5 minuti fino a pellettare le celle.
- Rimuovere il surnatante.
NOTA: Fare attenzione poiché potrebbe essersi formato uno strato di gel tra il pellet cellulare e il surnatante. - Risospendere il pellet cellulare nel tampone di lisi, secondo le istruzioni del produttore, e procedere seguendo i protocolli standard per l'estrazione dell'RNA.
Risultati
Il metodo di fabbricazione del gel peptidico qui descritto consente all'utente di definire e creare un ambiente di coltura 3D su misura. Mentre l'ambiente meccanico è determinato principalmente dalla concentrazione di peptidi, i componenti della matrice di interesse possono anche essere aggiunti a densità controllate, come mostrato dal calcolo di esempio nella Figura 1. Nella sua forma più semplice, tuttavia, il protocollo su gel peptidico fornisce un metodo per incapsulare le cellule in un ambiente 3D privo di matrice. La Figura 2 mostra come questo approccio possa essere combinato con un'ampia gamma di modelli tumorali, tra cui linee cellulari tumorali marcate in fluorescenza (Figura 2A) e materiale xenotrapianto derivato da pazienti (PDX) (Figura 2B, C). È importante sottolineare che le linee cellulari e il materiale PDX possono essere entrambi coltivati all'interno dei gel in condizioni prive di siero (Figura 2C, D), fornendo un sistema di coltura 3D con una composizione completamente definita.
Poiché il peptide stesso non contiene alcun motivo di legame cellulare, le cellule incapsulate mostrano tipicamente una morfologia arrotondata nei gel peptidici non modificati. La Figura 3A lo dimostra per i fibroblasti mammari umani in un gel peptidico da 6 mg/mL, rispetto alla loro classica morfologia allungata osservata nel Matrigel puro e in un gel di collagene puro. Tuttavia, è importante sottolineare che il protocollo su gel peptidico consente l'incorporazione di componenti della matrice di interesse. La Figura 3A mostra come l'aggiunta di 200 μg/mL di collagene I possa ripristinare la morfologia allungata dei fibroblasti nei gel peptidici.
Le aggiunte di matrice possono anche supportare la crescita e l'organizzazione di altri tipi di cellule, ad esempio MCF10A, come mostrato nella Figura 3B. In questo caso, l'aggiunta di 100 μg/mL di collagene I a un gel peptidico da 6 mg/mL consente la formazione di strutture acinose entro il giorno 7. Un'ulteriore complessità può essere introdotta anche dall'incorporazione di uno strato cellulare di supporto in co-coltura indiretta. La Figura 3C mostra come l'approccio combinato dell'incorporazione della matrice e della co-coltura indiretta con fibroblasti mammari umani possa migliorare la crescita e l'organizzazione di MCF10A.
Un altro parametro importante è la concentrazione di peptide utilizzato nella fabbricazione di gel peptidici. La Figura 4A mostra un esempio di come il controllo della concentrazione di peptidi, in questo caso tra 4 e 10 mg/mL, si traduca in una rigidità compresa tra 100 e 1000 di Pa. Questi gel possono essere fabbricati senza matrice o possono essere creati con aggiunte di matrice per consentire il controllo simultaneo sia della rigidità che della composizione. I gel peptidici con aggiunte di matrice possono essere sezionati e colorati per consentire la visualizzazione della distribuzione di queste aggiunte. Le Figure 4B e C mostrano due approcci per fare ciò: inclusione in agar al 4% seguita da trattamento tissutale standard e inclusione in paraffina per immunoistochimica (Figura 4B) o inclusione in agar al 2% seguita da sezionamento del vibratomo e colorazione fluorescente (Figura 4C).
Quando si modifica la composizione dei gel peptidici, è fondamentale assicurarsi che questi cambiamenti non influiscano sull'ambiente meccanico inizialmente presentato alle cellule. La Figura 4D mostra come le modifiche alla concentrazione del peptide possano essere utilizzate per compensare eventuali cambiamenti nella rigidità del gel peptidico all'incorporazione della matrice. Le misurazioni della reologia oscillatoria di massa della rigidità del gel (modulo di stoccaggio, G') possono quindi distinguere tra gli effetti della composizione del gel e della rigidità sulla morfologia cellulare. Come mostrato nelle immagini in campo chiaro, le cellule MDA MB 231 sviluppano una morfologia allungata con l'aggiunta di collagene a gel peptidici da 10 mg/mL o 15 mg/mL. La Figura 4E mostra che queste cellule allungate si colorano positivamente per pFAK, indicando un'interazione con la matrice circostante. L'ambiente inizialmente privo di matrice dei gel peptidici li rende anche una piattaforma ideale per lo studio della sintesi cellulare e della deposizione di componenti della matrice di interesse. La Figura 4F mostra la deposizione localizzata di collagene I da parte di cellule MCF7 incapsulate in gel peptidici da 10 mg/mL.
Uno dei principali vantaggi dei gel peptidici è la facilità con cui i metodi di laboratorio standard possono essere applicati alla loro analisi. Il materiale può essere estratto per la qRT-PCR per determinare i profili di espressione genica (come mostrato nella nostra recente pubblicazione5). L'imaging mediante microscopia a campo chiaro consente inoltre la visualizzazione in tempo reale della crescita cellulare. La Figura 5 mostra alcuni dei tipici problemi di risoluzione dei problemi che possono essere riscontrati nei gel peptidici non riusciti: miscelazione incompleta del precursore del gel (Figura 5A, B); errata ottimizzazione della concentrazione peptidica (Figura 5C,D) o della densità di semina (Figura 5E,F); e neutralizzazione errata del collagene acido prima dell'incorporazione nei gel peptidici (Figura 5G,H). La concentrazione peptidica e la densità di semina, in particolare, devono essere ottimizzate per ogni linea cellulare e fonte peptidica, per garantire che l'ambiente di coltura sia adeguatamente definito e rappresentativo dell'applicazione di interesse.
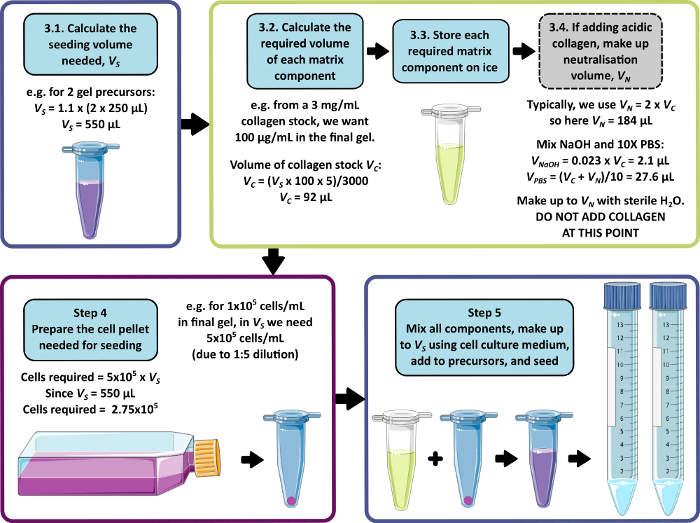
Figura 1: Un esempio di calcolo per la composizione della matrice e la densità di semina. Questo flusso di lavoro di esempio descrive la procedura che verrebbe seguita per seminare due precursori di gel peptidici con aggiunte di 100 μg/mL di collagene, a una densità cellulare finale di 1 x 105 cellule/mL. Clicca qui per visualizzare una versione più grande di questa figura.
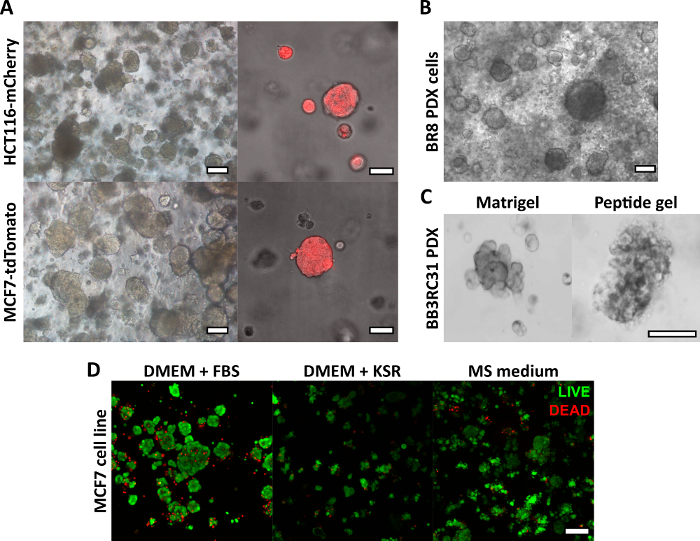
Figura 2: I gel peptidici privi di matrice forniscono una piattaforma di coltura 3D adatta per linee cellulari e modelli di cancro derivati da pazienti. (A) Le linee cellulari di carcinoma colorettale HCT116 e MCF7, che esprimono costitutivamente rispettivamente i marcatori fluorescenti mCherry e tdTomato, formano cluster cellulari in gel da 6 mg/mL entro il giorno 9 (a sinistra) e possono essere visualizzate dal vivo utilizzando la microscopia fluorescente (a destra, barra della scala 50 μm); (B) Le cellule di xenotrapianto derivate da pazienti provenienti da una paziente con carcinoma mammario triplo negativo (BR8) formano cluster cellulari entro il giorno 7 in gel peptidici da 10 mg/mL; (C) Le cellule PDX da tumori mammari positivi al recettore degli estrogeni (BB3RC31) possono essere coltivate in condizioni prive di siero18, mostrate con il controllo della matrice della membrana basale (ad es. Matrigel) al passaggio abbinato per il confronto; (D) Le cellule di carcinoma mammario MCF7 sono vitali in gel peptidici da 6 mg/mL in condizioni prive di matrice e senza siero, come valutato utilizzando un saggio di cellule VIVE/MORTE al giorno 7. KSR = sostituzione del siero knockout, terreno MS = terrenomammoferico 19. Barra di scala 100 μm se non diversamente specificato. Clicca qui per visualizzare una versione più grande di questa figura.
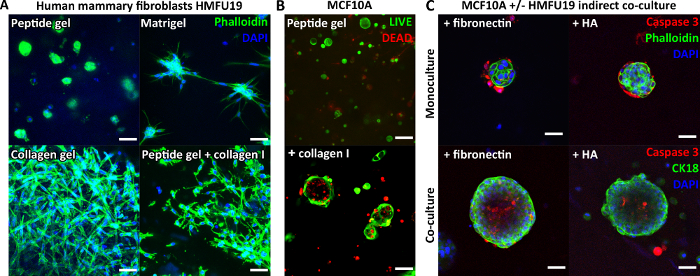
Figura 3: La complessità del gel peptidico può essere aumentata mediante l'introduzione di aggiunte di matrice e la co-coltura. (A) La linea cellulare di fibroblasti mammari umani HMFU19 richiede aggiunte di collagene per ripristinare una morfologia allungata in un gel peptidico da 6 mg/mL, mostrato con una matrice di membrana basale pura (ad es. Matrigel) e 1,5 mg/mL di gel di collagene a coda di ratto I per confronto, barra graduata 50 μm; (B) Le cellule mammarie normali MCF10A formano strutture acinose entro il giorno 7 in gel peptidici da 6 mg/mL con l'aggiunta di 100 μg/mL di collagene umano I, barra della scala 100 μm; (C) L'aggiunta combinata dei componenti della matrice fibronectina/HA (acido ialuronico, peso molecolare 804 kDa) e HMFU19 in co-coltura indiretta aumenta le dimensioni e l'organizzazione degli acini MCF10A in gel peptidici da 10 mg/mL, come valutato mediante colorazione con caspasi 3 scissata, barra della scala 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
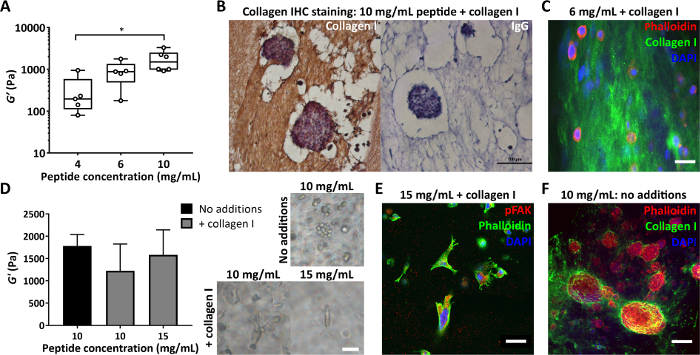
Figura 4: I gel peptidici consentono il controllo indipendente della rigidità e della composizione e la valutazione della matrice depositata nelle cellule. (A) Misure di reologia di massa che dimostrino un intervallo di rigidità tipico (modulo di stoccaggio, G') ottenibile mediante il controllo della concentrazione di peptidi, * indica p < 0,05; (B) Immunoistochimica che mostra la colorazione di 150 μg/mL di collagene I in un gel peptidico da 10 mg/mL con MCF7 incapsulato (giorno 7, barra della scala 100 μm); (C) Immunofluorescenza della distribuzione del collagene I in un gel peptidico da 6 mg/mL con 200 μg/mL di collagene I umano, mediante inclusione in agar e sezionamento del vibratomo, barra della scala 25 μm; (D) L'aggiunta di 200 μg/mL di collagene I dà una modesta diminuzione del modulo di conservazione, G', di 10 mg/mL di gel peptidici (reologia oscillatoria di massa), compensata dall'aumento della concentrazione di peptidi a 15 mg/mL. MDA MB 231 cellule di carcinoma mammario triplo negativo sono mostrate in ogni condizione (giorno 7, barra della scala 50 μm); (E) MDA MB 231 in gel peptidici da 15 mg/mL con 200 μg/mL di collagene umano I mostrano allungamento e interazione con la matrice tramite colorazione pFAK (giorno 14, barra della scala 50 μm); (F) Colorazione in situ della deposizione di collagene I MCF7 in un gel peptidico inizialmente privo di matrice da 10 mg/mL (giorno 10, barra della scala 100 μm). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: I problemi comuni relativi alla risoluzione dei problemi relativi al gel peptidico possono essere risolti utilizzando la microscopia a campo chiaro. Le cellule mostrate sono cellule epiteliali mammarie normali MCF10A, al giorno 7 se non diversamente specificato. (A) Un precursore del gel correttamente miscelato dovrebbe essere otticamente chiaro e privo di incongruenze, mentre (B) una miscelazione/neutralizzazione insufficiente può causare disomogeneità/striature visibili nel gel peptidico (frecce bianche); (C) MCF10A forma strutture acinose in gel peptidici da 6 mg/mL con l'aggiunta di co-coltura indiretta di HMFU19, tuttavia (D) a 15 mg/mL la concentrazione peptidica è troppo alta per consentire la formazione di acinari; (E) MCF10A seminato a 5 x 105 cellule/mL forma strutture acinose in gel da 6 mg/mL con l'aggiunta di 100 μg/mL di collagene I, tuttavia (F) a 2 x 105 cellule/mL la densità cellulare è troppo bassa per consentire la formazione di acinari; (G) Le aggiunte di collagene possono produrre grandi ammassi cellulari entro il giorno 14, tuttavia (H) un'aggiunta errata (neutralizzazione del collagene troppo presto nel processo) può prevenire la crescita dei grappoli. Barra graduata 100 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Discussione
Abbiamo scoperto che i gel peptidici qui descritti sono una soluzione semplice, economica e flessibile per supportare la coltura 3D di più tipi di cellule. Fornendo il pieno controllo sulla concentrazione di peptidi utilizzati e sulle aggiunte di proteine o glicani apportate, questo metodo consente di adattare attentamente i gel peptidici alla loro applicazione.
Il vantaggio cruciale dei gel peptidici rispetto ai metodi esistenti è che la composizione della matrice e le proprietà meccaniche possono essere controllate in modo indipendente, utilizzando un metodo semplice che non richiede procedure chimiche complesse. Le proprietà meccaniche del gel peptidico sono determinate principalmente dalla concentrazione di peptidi nel precursore iniziale del gel. La successiva aggiunta di cellule e/o componenti della matrice consente quindi la creazione di un ambiente in vitro completamente definito dall'utente. Sebbene le aggiunte di matrice possano alterare le proprietà meccaniche iniziali del gel, ciò può essere facilmente compensato dalla variazione indipendente della concentrazione di peptidi5. Ciò fornisce un vantaggio tangibile rispetto ai sistemi esistenti, ad esempio i gel di collagene, in cui i parametri che controllano la rigidità provocano comunemente anche un cambiamento nei motivi di legame delle integrine20,21.
Abbiamo dimostrato l'applicazione del gel peptidico per la coltura in vitro di linee cellulari tumorali e materiale derivato da pazienti5. L'intervallo di rigidità accessibile con il gel peptidico (nell'intervallo da 100 a 1000 di Pa) è ideale per replicare ambienti normali e di matrice tumorale nei tessuti molli come il seno. Tuttavia, riconosciamo che altre applicazioni richiedono ambienti notevolmente più rigidi, ad esempio nell'intervallo 10-20 kPa per la rigenerazione ossea. Sarebbe necessaria un'ulteriore modifica del protocollo qui presentato per estendere la rigidità ottenibile in questo intervallo, che è più tipico di approcci alternativi come i gel di alginato22. Allo stesso modo, qui abbiamo descritto un semplice metodo per la funzionalizzazione mediante intrappolamento fisico di proteine/glicani della matrice all'interno del gel peptidico. Per le applicazioni qui descritte, questo approccio funziona bene ed è facilmente adattabile per l'uso da parte di gruppi non specializzati che desiderano utilizzare modelli 3D in vitro della malattia. Come molti altri idrogel11, il peptide utilizzato qui può essere esteso per includere il legame cellulare o altri motivi biologici e per alcune applicazioni questo approccio può essere preferibile.
Abbiamo identificato alcuni punti chiave che richiedono un'attenzione particolare per garantire il successo. La formazione del precursore del gel è una fase intermedia critica che consente all'utente di verificare che le condizioni utilizzate siano corrette prima che le cellule vengano incorporate. Questo precursore può essere conservato per diverse settimane (a 4°C), ma deve essere incubato a 80 °C e successivamente a 37 °C prima dell'uso. Un precursore adatto sarà completamente liquido a 80 °C e autoportante a 37 °C. Questi controlli sono essenziali per garantire che la gelificazione avvenga correttamente. Le cellule e/o la matrice possono quindi essere incorporate in condizioni fisiologiche.
I laboratori che già utilizzano matrici 3D avranno familiarità con l'attenta manipolazione necessaria per incapsulare le cellule nei gel peptidici. Bisogna fare attenzione a limitare l'agitazione delle cellule prima e durante le fasi di incapsulamento. Abbiamo scoperto che specifici tipi di cellule sono differenzialmente suscettibili ai danni durante questo processo e questo deve essere attentamente valutato dall'utente. Le concentrazioni del gel peptidico qui descritte consentono di procedere alla gelificazione in un lasso di tempo che, per le cellule menzionate, consente di incapsulare le cellule prima che affondino bene sul fondo del getto, ma abbastanza lentamente da non essere danneggiate da questo processo. Tuttavia, è da notare che alcuni tipi di cellule sensibili possono richiedere una neutralizzazione più rapida per evitare l'esposizione prolungata a pH elevato. In questo caso, l'aggiunta di 10 mM di HEPES al terreno che circonda il gel peptidico può essere utile.
Quando si adotta il metodo descritto in questo protocollo, è molto importante considerare attentamente la qualità della fonte peptidica. Piuttosto che essere utilizzato come motivo funzionale o rivestimento, il peptide qui è l'intera parte non solubile dell'idrogel. Pertanto, è probabile che qualsiasi contaminante o variazione nella struttura del peptide abbia un impatto significativo sull'integrità o sulla capacità di supportare la vitalità cellulare nell'idrogel finale. Quando si passa a un nuovo lotto di peptide, è necessario prestare attenzione per garantire che vi sia una buona coerenza da lotto a lotto da parte del fornitore, oltre a controllare il comportamento del peptide durante la formazione del precursore del gel.
In sintesi, questo protocollo descrive un sistema di coltura 3D con un focus cruciale sul controllo indipendente delle proprietà meccaniche e biologiche. La semplicità e l'adattabilità del metodo lo rendono adatto all'adozione da parte di qualsiasi laboratorio di coltura cellulare e per un'ampia gamma di applicazioni5. In futuro, questo protocollo potrebbe essere esteso per consentire la modifica covalente della sequenza peptidica. Questo potrebbe essere combinato con metodi avanzati di microscopia per studiare le forze di trazione esercitate dalle cellule sulla matrice circostante. Di fondamentale importanza, tuttavia, è la capacità di distinguere tra matrice incorporata artificialmente e matrice sintetizzata dalle cellule incapsulate stesse. Questa capacità di controllare e monitorare i cambiamenti della matrice nel tempo consentirà intuizioni senza precedenti sui ruoli delle interazioni cellula-matrice nello sviluppo del cancro e di altre malattie.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il National Centre for the Replacement, Refinement and Reduction of Animals in Research NC/N0015831/1 a JCA, GF e CLRM, NC/T001267/1 a RBC, CLRM, JCA, KL-S e KS, NC/T001259/1 a JCA, KL-S e CLRM e NC/P002285/1 ad AMG, SJ e CLRM. Anche finanziamenti dal Consiglio di Ricerca per l'Ingegneria e le Scienze Fisiche, EP/R035563/1 a KL-S e CLRM e EP/N006615/1 a JLT e CLRM. La figura 1 è stata creata utilizzando grafici adattati da Servier Medical Art. Servier Medical Art di Servier è concesso in licenza con una licenza Creative Commons Attribuzione 3.0 Unported.
Materiali
| Name | Company | Catalog Number | Comments |
| Gel fabrication - Reagents | |||
| FEFEFKFK | Pepceuticals | n/a | Polypeptide; available from various suppliers. Pepceuticals is our recommended supplier due to the quality of the product. |
| PBS 10X | Gibco | 70011-036 | |
| Sodium hydroxide (1 M) | Sigma-Aldrich | S2770 | NaOH; dilute to 0.5 M prior to use |
| Water | Sigma-Aldrich | W3500 | |
| Gel fabrication - Equipment and Consumables | |||
| 15 mL falcon tubes | Greiner | 188261 | If using different brand ensure the material withstands temperatures of up to 90°C |
| 24 well plate | Corning Costar | 3524 | Alternative brands/suppliers can be used as long as there is a gap between the insert base and the plate surface |
| Centrifuge | Any | 200 x g for 3 minutes | |
| Class II Microbiological Safety Cabinet | Any | ||
| Fine balance | Any | Readability 0.1 mg | |
| Hanging insert for 24 well plate | Millipore | MCRP24H48 | Alternative brands/suppliers can be used as long as there is a gap between the insert base and the plate surface |
| Incubator | Any | 37°C, 5% CO2, humidified environment | |
| Oven | Any | set to 80°C | |
| P1000/200/20/10 pipette | Any | It is essential the pipettes used for the procedure are calibrated | |
| P1000/200/20/10 tips | Any | ||
| pH meter with microprobe | Any | ||
| Spatula | Any | ||
| Vortex | Any | ||
| Matrix addition | |||
| Collagen I (human) | Stem Cell Technologies | 07005 | |
| Collagen I (rat tail) | Gibco | A10483 | |
| Fibronectin | Stem Cell Technologies | 07159 | |
| Hyaluronic Acid | Iduron | HA804 | |
| Matrigel | Corning | 354234 | |
| Cell encapsulation/culture | |||
| B27 Supplement (no retinoic acid) | Gibco | 12587010 | Media additions for serum free cultures (Figure 2D) |
| Cholera toxin | Sigma-Aldrich | C-8052 | Media additions for MCF10A cells (Figure 3, 5) |
| DMEM | Gibco | 21969-035 | |
| DMEM/F12 | Sigma-Aldrich | D8062 | Media additions for MCF10A cells (Figure 3, 5) |
| DMEM/F12 Phenol Red Free | Gibco | 21041-025 | Media additions for serum free cultures (Figure 2D) |
| DPBS | Gibco | 14190-094 | |
| EGF | SourceBiosciences | ABC016 | Media additions for MCF10A cells (Figure 3, 5) |
| Fetal Bovine Serum | Gibco | 10500-064 | |
| Horse serum | Gibco | 26050-070 | Media additions for MCF10A cells (Figure 3, 5) |
| Human cancer/epithelial cell lines | e.g. MCF7/tdTomato MCF7/MCF10a/HCT116-mCherry | ||
| Human mammary fibroblasts | e.g. HMFU19 | ||
| Hydrocortisone | Sigma-Aldrich | H-0888 | Media additions for MCF10A cells (Figure 3, 5) |
| Insulin | Sigma-Aldrich | I9278 | Media additions for MCF10A cells (Figure 3, 5) |
| Knockout serum replacement | Gibco | 10828-028 | Media additions for serum free cultures (Figure 2D) |
| L-glutamine | Gibco | 25030-024 | |
| RPMI | Gibco | 21875-034 | |
| RPMI Phenol Red Free | Sigma-Aldrich | R7509 | |
| Imaging and other assays | |||
| 4% paraformaldehyde | Polysciences | 18814 | |
| Agar | SLS | CHE1070 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | 5482 | |
| Confocal and/or fluorescent microscope | Any | e.g. Leica TCS SPE confocal laser scanning microscope (Figures 2-4) | |
| DAPI solution | Invitrogen | D3571 | 300 uM working solution |
| DPX mounting medium | ThermoFisher Scientific | ||
| Glass cover slips | Any | No1 coverslips 0.13 - 0.17 mm thickness | |
| Glass-bottom dishes | MatTek | ||
| Goat Anti-Rabbit IgG H&L (HRP polymer) | Abcam | ab214880 | |
| Haematoxylin and Eosin | Any | ||
| Histology molds (disposable, plastic) | Any | ||
| Image analysis software | ImageJ | ||
| Live/Dead assay kit | Invitrogen | L3224 | |
| Microtome | Any | ||
| Phalloidin | Life Technologies | F432/R415 | |
| Pierce Peroxidase IHC Detection Kit | ThermoFisher Scientific | 36000 | |
| Primary Ab Caspase 3 | Abcam | ab34710 | Shown in Figure 3C |
| Primary Ab Collagen I | Cell Signalling Technology | 9661 | Shown in Figure 4B, C, F |
| Primary Ab pFAK Tyr 397 | ThermoFisher Scientific | 44-624G | Shown in Figure 4E |
| Prolong gold/diamond anti-fade mountant with DAPI | Molecular Probes | S36939 | |
| Rheometer Physica MCR 301 | Anton Paar | ||
| Scalpel | Any | ||
| Secondary antibody Goat anti Rabbit AF488 | nvitrogen | a11034 | |
| Secondary antibody Goat anti Rabbit AF546 | Invitrogen | a11010 | |
| SuperFrost slides | ThermoFisher Scientific | Coating e.g. APES can help to retain microtome sections on slides. | |
| Triton X 100 | Sigma-Aldrich | X100 | |
| Trypsin-EDTA (0.25%) | Gibco | 25300054 | |
| Vibratome | Leica |
Riferimenti
- Hynes, R. The extracellular matrix: not just pretty fibrils. Science. 326 (5957), 1216-1219 (2009).
- Tian, C., et al. Cancer-cell-derived matrisome proteins promote metastasis in pancreatic ductal adenocarcinoma. Cancer Research. 80 (7), 1461-1474 (2020).
- Hebert, J. D., et al. Proteomic profiling of the ECM of xenograft breast cancer metastases in different organs reveals distinct metastatic niches. Cancer Research. 80 (7), 1475-1485 (2020).
- Vennin, C., et al. CAF hierarchy driven by pancreatic cancer cell p53-status creates a pro-metastatic and chemoresistant environment via perlecan. Nature Communication. 10 (1), 3637(2019).
- Ashworth, J. C., et al. Peptide gels of fully-defined composition and mechanics for probing cell-cell and cell-matrix interactions in vitro. Matrix Biology. 85, 15-33 (2020).
- Toniatti, C., Jones, P., Graham, H., Pagliara, B., Draetta, G. Oncology drug discovery: Planning a turnaround. Cancer Discovery. 4 (4), 397-404 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5, 539-551 (2020).
- Onion, D., et al. 3-Dimensional patient-derived lung cancer assays reveal resistance to standards-of-care promoted by stromal cells but sensitivity to histone deacetylase inhibitors. Molecular Cancer Therapy. 15 (4), 753-763 (2016).
- Saunders, J. H., et al. Individual patient oesophageal cancer 3D models for tailored treatment. Oncotarget. 8 (15), 24224-24236 (2017).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Kühn, S., et al. Cell-instructive multiphasic gel-in-gel materials. Advanced Functional Materials. 30, 1908857(2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., Lutolf, M. P. Synthesis and characterization of well- defined hydrogel matrices and their application to intestinal stem cell and organoid culture. Nature Protocols. 12 (11), 2263-2274 (2017).
- Saiani, A., et al. Self assembly and gelation properties of α-helix versus β-sheet forming peptides. Soft Matter. 5 (1), 193-202 (2008).
- Wan, S., et al. Self-assembling peptide hydrogel for intervertebral disc tissue engineering. Acta Biomaterialia. 46, 29-40 (2016).
- Blache, U., Stevens, M. M., Gentleman, E. Harnessing the secreted extracellular matrix to engineer tissues. Nature Biomedical Engineering. 4 (4), 357-363 (2020).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Barcus, C. E., Keely, P. J., Eliceiri, K. W., Schule, L. A. Stiff collagen matrices increase tumorigenic prolactin signaling in breast cancer cells. Journal of Biological Chemistry. 288, 12722-12732 (2013).
- Bax, D. V., et al. Impact of UV- and carbodiimide-based crosslinking on the Integrin-binding properties of collagen-based materials. Acta Biomaterialia. 100, 280(2019).
- Huang, B. P., et al. Multi-peptide presentation and hydrogel mechanics jointly enhance therapeutic duo-potential of entrapped stromal cells. Biomaterials. 245, 119973(2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon