Method Article
Kanser ve Hastalığın Kontrollü 3D Kültür Modelleri için Kullanıcı Tanımlı Bir Peptit Jelinin Hazırlanması
Bu Makalede
Özet
Kanser ilerlemesinde hücre / matris etkileşimlerinin önemini araştırmak için kullanılabilecek bir 3D hücre kültürü ortamı oluşturmak için bir yöntem sunuyoruz. Kendi kendine birleşen basit bir oktapeptid kullanılarak, kapsüllenmiş hücreleri çevreleyen matris, mekanik ve biyokimyasal ipuçlarının bağımsız olarak düzenlenmesi ile kontrol edilebilir.
Özet
3D olarak yetiştirilen hücrelerin, in vivo davranışı 2D olarak yetiştirilenlere göre daha iyi modellediğine dair artan bir farkındalık var. Bu protokolde, hücreleri ve dokuları doğal ortamlarına uygun bir ortamda kültürlemek için uygun olan basit ve ayarlanabilir bir 3D hidrojel tarif ediyoruz. Bu, hücreler ve yerel hücre dışı matrisleri arasındaki etkileşimin modelin temel bir parçası olduğu kanserin başlangıcını, büyümesini ve tedavisini araştıran araştırmacılar için özellikle önemlidir. 3B kültüre geçiş zor olabilir ve genellikle hayvanlardan elde edilen 3B kültür matrislerindeki partiden partiye yüksek varyasyon nedeniyle tekrarlanabilirlik eksikliği ile ilişkilendirilir. Benzer şekilde, kullanım sorunları sentetik hidrojellerin kullanışlılığını sınırlayabilir. Bu ihtiyaca yanıt olarak, kanser ve hastalığın ilgili hücre hattı modellerinin yanı sıra hastadan türetilen doku / hücrelerin kültürünü sağlamak için kendi kendine birleşen basit bir peptit jeli optimize ettik. Jelin kendisi, kapsülleme sırasında eklenenler veya kapsüllenmiş hücreler tarafından jel içine bırakılanlar dışında, matris bileşenlerinden arındırılmıştır. Hidrojellerin mekanik özellikleri, matris ilavesinden bağımsız olarak da değiştirilebilir. Bu nedenle, araştırmacıların ilgilenilen hedef dokuyu yansıtan bir 3D kültür ortamı oluşturmalarına ve mekanik kuvvetlerin ve / veya hücre davranışının biyokimyasal kontrolünün etkilerini bağımsız olarak incelemelerine olanak tanıyan bir 'boş sayfa' görevi görür.
Giriş
Hücre dışı ortamın kanser gelişimi ve ilerlemesinde oynadığı birçok rol giderek daha açık hale gelmektedir1. Son zamanlarda, ayrıntılı proteomik temelli analizler, kanserle ilişkili stromal hücrelerden veya kanser hücrelerinin kendisinden türetilen matris bileşenlerinin, epitelyal mezenkimal geçişin ve metastatik yayılmanın teşvik edilmesi gibi olaylarda anahtar faktörler olduğunu gösteren, zaten ikna edici bir literatür tabanına eklenmiştir 2,3,4. Hücre dışı matrisin (ECM) bu bilinen önemi göz önüne alındığında, hücrelere sunulan 3B ortam üzerinde kontrole izin veren hücre kültürü platformlarına doğru ilerlemek çok önemli hale geliyor. Bu ihtiyaca yanıt olarak, bu protokol, kullanıcı tanımlı ECM bileşimi ve mekanik özelliklere sahip bir 3D hidrojelde hücre kapsülleme ve kültür için bir yöntem sunar5.
Şu anda, 2D in vitro kültürde kanser terapötik etkinliği, bu terapötiklerin mevcut in vivo (hasta kaynaklı ksenogreft, PDX) modellerdeki etkisi ve klinik çalışmalardaki nihai aktiviteleri arasında zayıf bir korelasyon vardır 6,7. Bu, ilaç keşif hattında önemli başarısızlıklara yol açmıştır ve test edilmiş terapötiklerin 'erken başarısız olmasına, ucuza başarısız olmasına' izin veren gelişmiş in vitro modellere acil ihtiyaç duyulmaktadır. Birçok araştırmacı, PDX'ten türetilmiş ve diğer hastaya yakın hücreler de dahil olmak üzere, hücre davranışını in vitro olarak büyütmek ve gözlemlemek için 3D matris açısından zengin ortamlar oluşturmak için fare mastositomasından türetilmiş ürünü, örneğin Matrigel'i (veya benzer ürünleri) kullanır 8,9,10. Bununla birlikte, bu 'herkese uyan tek beden' yaklaşımı, matris proteinlerinin / glikanların kanserin başlangıcında ve ilerlemesinde oynadığı karmaşık rolü ihmal eder.
Hücre davranışının kontrolünde hücre dışı matrisin (ECM) rolünün tanınması, spesifik matris bileşenlerinden oluşan hidrojellerin içinde veya üzerinde 3D kültürün kullanımını da teşvik etmiştir11. Bu, belirli etkileşimleri araştırmak için yararlı olsa da, bu sistemler, hücreler ve matris arasındaki mekanik ve biyokimyasal talimatları ayıramamaktan muzdariptir. Ayrıca ele alınması zor olabilir ve hücre davranışının belirsiz okumalarını verebilir. Kollajen jeller bu sorunun önemli bir örneğidir, çünkü hücre aracılı jel kasılması, jel5 içindeki hücreleri görselleştirme yeteneğini önemli ölçüde azaltabilir. Uzmanların büyük etki yaratmak için kullandıkları çok zarif, çok bileşenli jel sistemleri de vardır 12,13,14. Bunlar, enzime duyarlı bağlayıcıları ve biyo-aktif motifleri içerebilir, ancak formülasyonları ve uygulamaları açısından burada açıklanan sistemden önemli ölçüde daha karmaşıktır.
Bu protokol, ECM'nin gelişim ve hastalıktaki rollerinin in vitro olarak modellenmesine izin veren, tam olarak tanımlanmış 3D kültür modelleri oluşturmak için bir yöntemi tanımlar. 3D modelin temeli, daha önce basit bir kendi kendine birleşen oktapeptit hidrojel 5,15,16'nın optimizasyonu olarak tanımladığımız bir peptit jelidir. Karmaşık, hayvansal kaynaklı matrislerden uzaklaşan bu sistem, partiden partiye tutarlılık ve daha iyi kullanım gibi önemli bir avantaj sunar. Basit haliyle, peptit, matristen türetilmiş motifler içermez ve kullanıcının üzerine işlevsellik oluşturabileceği etkili bir 'boş sayfa' sağlar.
Peptit jelin mekanik özelliklerinin, matris proteinlerinin / glikanların dahil edilmesinin yanı sıra bağımsız olarak nasıl düzenlenebileceğini gösteriyoruz. Sistem son derece ayarlanabilir olup, çeşitli biçimlerde bir dizi hücre tipinin kapsüllenmesine izin verir. Bir kanser modeli oluşturmak için önemli olan, stromal hücreler de dahil edilebilir: ya doğrudan ko-kültürde ya da dolaylı kanser hücresi-stroma etkileşimlerinin spesifik analizine izin vermek için ayrılabilir. En önemlisi, burada açıklanan protokol karmaşık bir kimya bilgisi gerektirmez ve özel kimyasal bilgi veya ekipmana ihtiyaç duymadan herhangi bir hücre kültürü laboratuvarında çoğaltılabilir.
Görüntüleme, reolojik analiz, PCR5 için materyalin ekstraksiyonu ve histolojik değerlendirme için gömme dahil olmak üzere peptit jellerdeki hücre davranışının incelenmesi için optimize edilmiş yöntemlere sahibiz. Basit hidrojel sisteminin açık bir yararı, kapsüllenmiş hücreler tarafından biriktirilen matrisi görselleştirme ve inceleme yeteneğidir. Hücre kaynaklı matrislerin önemi ve hücrelerin yerel mikro çevrelerini nasıl yeniden yapılandırdıklarının daha iyi anlaşılmasının faydaları son zamanlarda vurgulanmıştır17 ve hücre tarafından salgılanan matris bileşenlerinin, in vivo olarak meydana gelene benzer bir şekilde yakalanmasının önemine dair artan bir farkındalığı yansıtmaktadır. Bu tür süreçleri modelleme yeteneğinden yararlanmak, hidrojel bazlı hastalık modellerinin hasta alaka düzeyinin iyileştirilmesinin temel itici güçlerinden biri olabilir.
Protokol
1. Peptitin çözünmesi
- Bir doku kültürü davlumbazında, bir P1000 pipeti kullanarak 15 mL'lik bir tüpe 800 μL steril su ekleyin.
- İnce bir terazi kullanarak, peptit tozunu statik olmayan bir tartım teknesine tartın. İstenen nihai peptit jel konsantrasyonunun 1.25 katı bir kütle (mg olarak) kullanın (mg / mL cinsinden, Tablo 1).
NOT: Burada açıklanan yöntem, son jelleşme noktasında tüp başına yaklaşık 1.25 mL peptit jeli hacmi üretecektir. Bir seferde birden fazla tüp hazırlanabilir veya alternatif olarak, kullanıcı sunulan yöntemle deneyimli olduğunda tüp başına hacim artırılabilir.
| Peptit konsantrasyonu (son jelleşmeden sonra) | Peptit kütlesi | İlk NaOH ilavesi |
| 6 mg / mL | 7.5 mg | 30 μL |
| 10 mg / mL | 12.5 mg | 60 μL |
| 15 mg / mL | 18,75 mg | 100 μL |
Tablo 1: Peptit kütlesi ve tipik nihai jel konsantrasyonları için önerilen ilk NaOH ilavesi. Listelenen peptit konsantrasyonlarının aralıkları her iki yönde de uzatılabilir, ancak daha düşük peptit konsantrasyonlarının stabil jeller oluşturmaması daha olasıdır, oysa yüksek konsantrasyonlarda elde edilen jel, yeterli besin değişimine ve hücre canlılığına izin veremeyecek kadar yoğun olabilir. Uygun konsantrasyon, farklı hücre tipleri ve peptit partileri için optimizasyon gerektirecektir.
- Tartılan peptidi 15 mL'lik tüpe ekleyin. Geride toz kalmadığından emin olmak için tartı teknesini hafifçe vurun.
NOT: Peptit tozu çok statik olabilir, toz kaybını en aza indirmeye özen gösterin. 1.2 ve 1.3 adımları sırasında (veya herhangi bir pH ölçümü için) steril koşulların korunması gerekli değildir, çünkü sterilizasyon işlemin ilerleyen aşamalarında 80 °C'de inkübasyon sırasında gerçekleşir. - 3 dakika vorteks yapın, ardından 3 dakika boyunca 200 x g'da santrifüjleyin.
- Peptit çözeltisini 80 ° C'ye ayarlanmış bir fırında en az 2 saat inkübe edin. İnkübasyondan sonra çözünmemiş peptit varsa, adım 1.4'ü tekrarlayın.
NOT: Eşit ısıtma gerekli olduğundan, bu adım için bir ısı bloğu uygun değildir. Bununla birlikte, hibridizasyon fırınlarının, peptit çözeltisi tamamen suya batırıldığı sürece bir su banyosu kadar iyi çalıştığını bulduk.
2. Jel öncülerinin oluşumu
- Steril su kullanarak steril bir 0,5 M sodyum hidroksit (NaOH) çözeltisi hazırlayın.
NOT: En tutarlı sonuçlar için taze seyreltilmiş NaOH çözeltisi önerilir. - Bir doku kültürü davlumbazında, çözünmüş peptidin merkezine 0.5 M NaOH ekleyin ve pipet ucu ile yavaşça karıştırarak karıştırın (Tablo 1).
- Tüpü 10 saniye vorteksleyin ve kabarcıkları çıkarmak için 10 saniye boyunca 200 x g'da santrifüjleyin.
- Jel öncüsü bulanıksa, 5 μL'lik artışlarla NaOH ekleyerek 2.2 ve 2.3 adımlarını tekrarlayın.
NOT: pH ölçümü, yeterli NaOH eklenip eklenmediğini belirlemeye yardımcı olabilir: optimum pH 9-10.5 arasındadır ve pH'ı geri getirmek için asitlerin kullanılması jel homojensizliğine neden olabileceğinden, bunun aşılmaması tercih edilir. Gerekli olan kesin NaOH hacmi, peptit kaynağına göre değişebilir. - Jel öncüsü, 15 mL'lik tüpün ters çevrilmesinde optik olarak berrak ve kendi kendini destekleyen (veya sadece akan) olduğunda, bir doku kültürü başlığına 100 μL steril 10x PBS ekleyin. 10 saniye boyunca girdap ve 10 saniye boyunca 200 x g'da santrifüjleyin.
NOT: Jel öncüsü bulanıksa, berrak ve yarı katı hale gelene kadar adım 2.4'ü tekrarlayın. Jel öncüsü sıvı ise (pH ~ 10.5'in üzerinde), stabil bir jel oluşturmaz ve atılmalıdır. - Gece boyunca 80 °C'lik bir fırında inkübe edin.
- 80 °C'de tamamen sıvı olduğundan emin olmak için jel öncüsünü görsel olarak kontrol edin.
- Jel öncüsü 80 ° C'de tamamen sıvı değilse, yeterince nötralize edilmemiştir, adım 2.4'ü izleyerek NaOH ekleyin.
- Jel öncüsü sıvıysa ancak hava kabarcıkları veya küçük çökeltiler varsa, bunları dağıtmak için tüpü keskin bir şekilde hafifçe vurun. Tüpü hafifçe vurduktan sonra hava kabarcıkları veya çökeltiler devam ederse, jel öncüsünü girdap haline getirin ve her biri 10 saniye boyunca 200 x g'da santrifüjleyin.
- 2.7.1 veya 2.7.2 adımlarından herhangi birini izledikten sonra, nihai jelleşmeye geçmeden önce öncü jelleri 80 ° C'de 2 saat daha inkübe edin.
- Jel öncüllerini ihtiyaç duyulana kadar 80 °C'de tutun (maksimum 48 saat).
NOT: Protokol burada duraklatılabilir, jel öncüllerini 4 haftaya kadar 4 °C'de saklayın. Bu duraklama noktasından yeniden başlatıyorsanız, jel öncülerini en az 2 saat boyunca 80 °C'de inkübe edin ve adım 2.7'den yeniden başlatın. Gerekirse yukarıdaki modifikasyonlar için yeterli zaman olduğundan emin olmak için, son jelleşme için ihtiyaç duyulmadan çok önce jel öncüllerinin hazırlanması şiddetle tavsiye edilir.
3. Tohumlama için matris bileşenlerinin hazırlanması
NOT: 3-5 arası adımlar için örnek bir hesaplama Şekil 1'de gösterilmiştir. Adım 3 ve adım 4, sırasıyla matrissiz ve / veya hücresiz bir jel üretmek için ihmal edilebilir.
- Her 1 mL öncü jele 250 μL eklenmesine izin vererek, tohumlama için gereken hücre, matris ve ortamın toplam birleşik hacmini hesaplayın. Pipetleme hatasını önlemek için bu hacmi 1,1 ile çarpın. Bu tohumlama hacmi, VS.
- Her bir matris bileşeni için, Denklem 1'i kullanarak tohumlama hacmine eklenecek stok çözeltisinin hacmini hesaplayın:
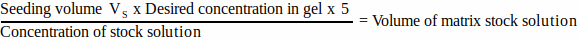 (1)
(1)
NOT: VS , tüm jellerin tohumlanması için gereken toplam tohumlama ortamı hacmine karşılık gelir (adım 3.1). Tüm matris bileşen hacimlerinin toplamının VS'yi aşmadığından emin olun. - Tüm matris bileşenlerini iyice çözün (üreticinin talimatlarına bakın) ve ihtiyaç duyulana kadar buz üzerinde saklayın.
NOT: Bazı matris bileşenleri jelleşmeye çok eğilimli olacaktır. Bunun olmasını önlemek için üreticinin talimatlarına bakın. - Nötralizasyon gerektiren asidik bir kollajen stok çözeltisi eklenecekse (üreticinin talimatlarına bakın), nötralizasyon çözeltisini aşağıdaki gibi hazırlayın:
- Denklem 1'i kullanarak gerekli olan kollajen stok çözeltisinin (VC) hacmini hesaplayın.
- Nötralizasyon çözeltisi için uygun bir hacim belirleyin, VN. Bu, tüm matris ilavelerinin birleşik hacmi, tohumlama hacmini, VS'yi aşmayacak şekilde seçilmelidir.
NOT: Genel olarak, VN = 2 x Vc için mantıklı bir değer, ancak bu, eklenecek diğer matris bileşenlerinin sayısına ve hacmine göre ayarlanabilir. - Denklem 2'yi kullanarak nötralizasyon için gereken 1 M NaOH hacmini hesaplayın.
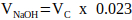 (2)
(2) - Denklem 3'ü kullanarak nötralizasyon çözeltisinde gerekli olan 10x PBS hacmini hesaplayın.
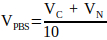 (3)
(3) - Hesaplanan 1 M NaOH ve 10x PBS hacimlerini birleştirin, ardından steril su ile VN'ye kadar tamamlayın. İyice karıştırın ve ihtiyaç duyulana kadar buz üzerinde saklayın.
NOT: Bu noktada asidik kollajen eklemeyin. Kollajenin nötralizasyon çözeltisi ile erken karıştırılması, nihai peptit jelinin özelliklerinde tutarsızlığa neden olabilecek kollajen fibrillogenezinin başlamasına yol açacaktır.
4. Tohumlama için hücrelerin hazırlanması
- Henüz tamamlanmadıysa, tohumlama hacmini, VS'yi adım 3.1'e göre hesaplayın.
- Bu hücre süspansiyonunda gerekli olan hücre yoğunluğunu, son peptit jelinde istenen hücre yoğunluğunu alıp 5 ile çarparak hesaplayın.
NOT: Hücre süspansiyonu, jel öncüsü ile karıştırıldığında seyreltmeyi hesaba katmak için istenen son konsantrasyonun 5 katıdır. Hücre yoğunlukları, incelenen her yeni hücre hattı için optimize edilmelidir. Hücre tipine bağlı olarak, son peptit jelinde 1 x 104 ile 1 x 106 hücre / mL arasındaki yoğunluklar uygun olabilir. - Tohumlama için gereken toplam hücre sayısını hesaplayın (hücre yoğunluğunu adım 4.1'de hesaplanan tohumlama hacmi VS ile çarpın).
- Kullanılan hücreler için standart kültür/geçiş yöntemlerini kullanarak, adım 4.3'te hesaplandığı gibi gerekli miktarda hücre içeren bir hücre peleti hazırlayın.
5. Son jelleşme / hücre kapsülleme
- Son jelleşmeye başlamaya hazır olduğunuzda, jel öncüllerini 80 °C fırından 37 °C'lik bir su banyosuna aktarın.
NOT: Jel öncüleri 37 °C'de kendi kendini desteklemelidir. Sıvı iseler, tam jelleşmenin meydana gelmesi olası değildir ve jel öncüleri atılmalıdır. - 96 oyuklu bir plaka veya alternatif olarak hücre kültürü ekleri ile 24 oyuklu bir plaka (veya benzeri) hazırlayın.
NOT: Peptit jelleri 24 oyuklu eklerde kaplarken, ekin tabanı ile kuyu plakası arasında bir boşluk olduğundan emin olun. Bu, jelin ortamla temas halinde olmasını sağlar. - Matris eklenecekse, tüm matris bileşenlerini ve nötralizasyon çözeltilerini birleştirin (adım 3). Hücre kültürü ortamını kullanarak VS'ye (adım 3.1) kadar oluşturun ve iyice karıştırın. Hücreler eklenecekse, tohumlama hacmi VS kullanılarak 4. adımda hazırlanan hücre peletini yeniden süspanse edin.
NOT: 3. adımda herhangi bir matris bileşeni hazırlanmamışsa, tohumlama hacmi için hücre kültürü ortamını kullanın. Bu genellikle kullanılan hücre tipi için standart kültür ortamıdır, ancak hücre tiplerinin bir karışımı kullanılıyorsa bunun doğrulanması gerekebilir. - Bir P1000 pipeti kullanarak, jel öncüsünün üzerine nazikçe 250 μL hücre / matris karışımı ekleyin.
NOT: Matris bileşenleri, özellikle bazal membran özütü, jel öncüsüne eklendikten sonra polimerleşmeye başlayabilir. Bu nedenle, mümkün olan en kısa sürede bir sonraki adıma geçmek önemlidir. - Pipetleme ve karıştırmanın birleşik etkisiyle nazikçe karıştırın. Jel kesme incelticidir, bu nedenle hafif pipetleme/karıştırma ile karıştırılması daha kolay hale gelecektir. İyice karıştırıldığında, 96 oyuklu bir plakanın her bir oyuğuna 100 μL veya her hücre kültürü ekine 200 μL ekleyin.
NOT: Karıştırma sırasında, hava kabarcıklarının oluşmasını önlemek için 200 μL'de bir P1000 seti kullanarak ters pipetleme yapmak faydalı olabilir. Jelin başlangıçta karıştırılması zor olabilir, ancak sürekli karıştırmada daha kolay hale gelmelidir - bu, karışımın verimli olduğunu gösterir. - % 5 CO2 ve nemlendirilmiş bir atmosferde 37 ° C'de 10 dakika inkübe edin.
NOT: Peptit jeli matris ilavesi içermiyorsa bu adım gerekli değildir. - 96 oyuklu plakanın her bir oyuğuna 200 μL ortam ekleyin veya jelin üstüne birkaç damla ile hücre kültürü ekinin dışına 1 mL ekleyin. 37 °C'de %5 CO2 ve nemlendirilmiş bir atmosferde inkübe edin.
- Medyayı sonraki bir saat içinde iki kez ve birkaç saat sonra (veya ertesi gün) tekrar değiştirin.
NOT: Jeller birkaç saat boyunca kararsız olacağından burada dikkatli olun. - Besiyerini her 2-3 günde bir değiştirin (veya kullanılan hücreler için standart kültür protokolünü izleyerek).
6. Dolaylı ortak kültür
NOT: Bu yöntem, yalnızca peptit jellerinin 24 oyuklu plaka eklerine veya jelin bir hücre tek tabakasının üzerinde desteklenebileceği benzer formatlara ekildiği durumlarda uygulanabilir. Bu durumda, kuyu plakasının dibinde bir 2D besleyici hücre tabakası hazırlanarak dolaylı ko-kültür tanıtılabilir.
- Tohumlama için 24 oyuklu bir plaka hazırlayın. Bu, peptit jelleri için ayrı bir plaka olmalıdır, ancak kullanılan eklerle uyumluluğu sağlamak için aynı markadan olmalıdır (bkz. adım 5.2).
- İncelenen hücre tipine göre dolaylı ko-kültürün tohumlanması için gereken hücre yoğunluğunu hesaplayın.
NOT: Hücre tohumlama yoğunluğu, incelenen her yeni hücre hattı için optimize edilmelidir. Hücreler yaklaşık% 30-50 birleşme sağlayacak şekilde kaplanmalıdır. Örnek olarak, insan meme fibroblast hücre hattı HMFU19 tipik olarak 1-5 x 104 hücre / kuyu yoğunluğunda kaplanır. - Kullanılan hücreler için standart kültür/geçiş yöntemlerini kullanarak, bu hücreler için tipik büyüme ortamını kullanarak 1 mL/kuyuda tohumlamaya uygun bir hücre süspansiyonu hazırlayın.
- Hücre süspansiyonunu, oyuk başına 1 mL olacak şekilde kuyu plakasına tohumlayın.
- 37 ° C'de% 5 CO2 ve nemlendirilmiş bir atmosferde birkaç saat veya gece boyunca inkübe edin. Ardından ortamı kuyulardan çıkarın.
- Steril forseps kullanarak, peptit jellerini içeren 24 oyuklu plaka eklerini, önceden tohumlanmış hücreleri 2D olarak içeren yeni oyuklara aktarın. Ek parçanın dışına damla damla 1 mL orta damla ve jelin yüzeyine birkaç damla ekleyin.
NOT: Tipik olarak, bu noktada kullanılan ortam, jel içinde kapsüllenmiş hücreler için uygun olandır, ancak bu ortamın 2D'deki hücreler için uygunluğu, söz konusu deney için doğrulama veya optimizasyona ihtiyaç duyabilir. - Aşırı birleşmeyi önlemek için düzenli olarak taze besleyici katmanları hazırlayın ve peptit jellerini yukarıdakiyle aynı yöntemi izleyerek bu yeni kuyucuklara aktarın.
NOT: Tipik olarak, dolaylı ko-kültür için hücreler, peptit jel tohumlaması ile aynı anda hazırlanır. Peptit jeller daha sonra birkaç saat veya gece boyunca inkübasyondan sonra ortam değişikliği noktasında ko-kültüre aktarılabilir, bkz. adım 5.8.
7. Peptit jellerin toplu salınımlı reolojisi
NOT: Standart olarak, reolojik karakterizasyon, 24 oyuklu plaka ekinde yapılması gereken jel tohumlamadan 24 saat sonra gerçekleştirilir.
- Reometreyi üreticinin talimatlarına göre kurun ve kalibre edin. Hücre kültürü ekinin çapına mümkün olduğunca yakın plaka çapına sahip paralel bir plaka geometrisi kullanın.
NOT: İstenirse testler 37 °C'de gerçekleştirilebilir ve kültür sırasında ortam kopyalanabilir. - Test edilecek ilk peptit jel numunesini, eki ters çevirerek ve plastik zarı bir neşter kullanarak keserek hücre kültürü ekinden çıkarın.
NOT: Testten önce peptit jellerini içeren plakanın mümkün olduğunca kısa bir süre hücre kültürü inkübatörünün dışında olduğundan emin olun. Bikarbonat tamponlama sistemine sahip ortam, pH'ı korumak için CO2'nin varlığına dayanır. İnkübatörün dışında çok uzun süre kalan jeller pH'da sürüklenir ve bu da reolojik değerlendirmeyi etkileyebilir. Bu etkiyi önlemek için ortama eklenen 10 mM HEPES ile jellerin bakımının yapılması faydalı olabilir. - Jeli dikkatlice reometre plakasına aktarın. Ardından, bir neşter kullanarak, reometre plakasının altına yüklendiğinde jel deformasyonunu en aza indirmek için jelin yüksekliğini yaklaşık 1 mm'ye kadar kesin.
NOT: Neşteri kullanırken reometre plakasına dokunmamaya veya zarar vermemeye dikkat edin. - Paralel plaka aralığını 1 mm'ye ayarlayın. Reometre plakaları tarafından örtülmeyen fazla jeli kesin.
- Üreticinin talimatlarına göre reometre üzerinde istenen test ayarlarını çalıştırın.
NOT: Her yeni numune koşulu için, tüm testlerin numunenin doğrusal viskoelastik bölgesi içindeki bir gerinim seviyesinde gerçekleştirildiğinden emin olmak için %0,1-100 gerinim arasında bir genlik taraması yapılması tavsiye edilir.
8. Kapsüllenmiş hücrelerin canlı / ölü boyanması
- Ortamı kuyucuklardan çıkarın ve peptit jelleri, bir ortam değişikliği ile aynı tekniği kullanarak 1x PBS ile iki kez yıkayın (adım 5.7).
- Adım 7.2'yi izleyerek 24 oyuklu plaka eklerinde kültürlenmiş peptit jellerini çıkarın. Jelleri lekelenmeye hazır olana kadar orijinal kuyu plakasında 1x PBS'de tutun.
NOT: Jeller bu noktada, özellikle uzun süreli kültürden sonra kırılgan olabileceğinden dikkatli olun. - 24 oyuklu plaka eki başına 500 μL lekeye veya 96 oyuklu plakanın oyuklu başına 50 μL'ye izin veren canlı / ölü bir boyama çözeltisi hazırlayın. Tipik bir leke, 1x PBS'de 4 μM etidyum homodimer ve 2 μM kalsein'dir. Elde edilen çözeltiyi ışıktan koruyun.
NOT: Canlı/ölü reaktiflerin konsantrasyonları, kullanılan hücre tipine ve reaktif tedarikçisine bağlı olarak daha fazla optimizasyon gerektirebilir. - PBS'yi her jelden dikkatlice çıkarın ve her jelin iyi bir şekilde kaplandığından emin olarak birkaç damla boyama solüsyonu ile değiştirin.
- Jöleleri karanlıkta boyama solüsyonunda 10-15 dakika inkübe edin, ardından konfokal / floresan mikroskobu kullanarak görselleştirin.
NOT: Daha yüksek kaliteli görüntüler için, jellerin lamel kalınlığındaki cam tabanlı tabaklara aktarılması faydalı olabilir.
9. Son nokta görüntüleme için peptit jellerinin sabitlenmesi
- Adım 8.1'i izleyerek peptit jellerini yıkayın.
- 1x PBS'de% 4 paraformaldehit (PFA) ekleyin: 96 oyuklu bir plakanın her bir oyuğu için 100 μL ve 24 oyuklu bir plaka ekindeki her jel için 1 mL (ekin içindeki jelin üzerine birkaç damla eklenmelidir).
DİKKAT: Paraformaldehit (PFA) oldukça toksiktir ve cilt tarafından kolayca emilir. Cilt, gözler, mukoza zarları ve üst solunum yolları için son derece tahrip edicidir. PFA bir davlumbaz içinde ele alınmalı ve kullanıcılar koruyucu giysi ve eldiven giymelidir. Son uygulamaya göre alternatif kimyasal fiksatifler de aynı şekilde kullanılabilir. - Peptit jellerini oda sıcaklığında 1 saat PFA fiksatifinde inkübe edin.
- PFA sabitleyicisini çıkarın ve peptit jellerini 1x PBS ile iki kez yıkayın.
NOT: Protokol burada duraklatılabilir, sabit peptit jelleri 4 ° C'de 1x PBS'de 4 haftaya kadar saklayın ve plakanın parafin film ile iyice kapatıldığından emin olun.
10. Kesitleme için peptit jellerinin gömülmesi
NOT: Peptit jellerinin %4 agar içine gömülmesi, immünohistokimya için parafin gömülmeden önce çok önemli bir adımdır. Alternatif olarak, jeller %2 agar içine gömülebilir ve bir vibratom kullanılarak bölümlere ayrılabilir (tipik olarak 500 μm'lik bölümler iyi sonuçlar verir). Bu, bölüm 11'deki yöntemleri kullanarak jeldeki hücre dışı matris lokalizasyonunu boyamak için faydalı olabilecek hidratlı jel bölümleri üreten isteğe bağlı bir adımdır.
- Bir mikrodalgada kaynatarak erimiş %2 veya %4'lük agar çözeltisini 1x PBS'de (yukarıdaki nota bakın) hazırlayın. Kullanmadan önce birkaç dakika soğumaya bırakın.
NOT: Erimiş agar ısı tehlikesi oluşturur – el ve yüz koruması kullanarak dikkatli tutun. Hazırlandıktan sonra, agar çözeltisi ihtiyaç duyulana kadar 4 ° C'de saklanabilir. - Adım 7.2'yi izleyerek hücre kültürü ekinden peptit jeli çıkarın.
- Plastik bir Pasteur pipeti kullanarak, histolojik bir gömme kalıbının tabanını ince bir agar çözeltisi tabakası ile kaplayın. 20 °C'de birkaç saniye soğumaya bırakın.
- Bir spatula kullanarak, peptit jeli agarın ortasına yerleştirin. Daha sonra peptit jeli agarda tamamen örtün.
NOT: Jel agarın içine batmamalıdır. Varsa, jeli çıkarın ve agar daha fazla katılaşana kadar birkaç saniye daha bekleyin ve tekrar deneyin. Çok fazla katılaşmanın gerçekleşmesine izin vermemeye çalışın, aksi takdirde iki katman arasında zayıf bir birleşme olacaktır. - Histolojik kalıptan çıkarmadan önce gömülü jelin 4 °C'de 1 saat soğumasını bekleyin.
NOT: Protokol burada duraklatılabilir, gömülü jelleri 4 °C'de 1x PBS'de 4 haftaya kadar saklayın. - İmmünohistokimya yapılacaksa, gömülü jelleri bir doku işlemcisine koyun ve standart laboratuvar yöntemlerini kullanarak devam edin.
NOT: Alternatif olarak, gömülü jeller bir vibratom kullanılarak hidratlı bölümler halinde kesilebilir. Hidratlı bölümler, 4 haftaya kadar 1x PBS'de 4 ° C'de kapalı plakalarda saklanmalıdır.
11. İmmünositokimya kullanarak jellerdeki hücrelerin boyanması
- Peptit jelleri/jel bölümlerini kaplayan 1x PBS'yi çıkarın. Adım 7.2'yi izleyerek hala 24 kuyulu plaka eklerinde bulunan jelleri çıkarın.
- Jelleri/jel bölümlerini bir bloke edici tamponla kapatın ve 20 ° C'de 30 dakika inkübe edin.
NOT: Tipik bir bloke edici tampon, %0.1 Triton X-100 ile 1x PBS'de %0.5 sığır serum albümininden (BSA) oluşur. Triton X-100 toksiktir ve ciddi göz hasarına, cilt tahrişine neden olur ve su yaşamı için çok toksiktir. Kullanıcılar koruyucu giysi, göz koruması ve eldiven giymelidir. - Optimize edilmiş çalışma konsantrasyonlarında bloke edici tamponda birincil antikorları hazırlayın. 24 oyuklu plaka jeli başına 200 μL, jel bölümü başına 100 μL ve 96 oyuklu plaka kuyucuğu başına 50 μL'ye izin verin.
NOT: Tipik olarak, jellerde 3D boyama için kullanılan antikor konsantrasyonları, 2D'de kullanılan konsantrasyonun iki katı olmalıdır. - Bloke edici tamponu çıkarın ve jellere damla damla antikor çözeltisi ekleyin.
- Plakayı parafin film ile kapatın ve gece boyunca 4 °C'de inkübe edin.
- Antikor çözeltisini çıkarın ve bloke edici tampon ile iki kez yıkayın.
- Adım 11.3 ve 11.4'te açıklanan prosedürlerin aynısını izleyerek ikincil antikor ekleyin.
- Gece boyunca karanlıkta 4 °C'de veya 20 °C'de 3 saat inkübe edin.
- Antikor solüsyonunu çıkarın ve 1x PBS ile iki kez yıkayın.
- Numuneleri 1: 1.000 DAPI çözeltisinde örtün ve karanlıkta 4 ° C'de 1 saat inkübe edin.
- Jeli bir cam lamele aktarın ve floresan / konfokal mikroskopi ile görüntüleyin.
12. RNA ekstraksiyonu
NOT: Bu yöntemde kullanılan hacimler, peptit jellerinin 24 oyuklu plaka eklerine ekildiği durumlarda geçerlidir. Diğer jel formatları kullanılabilir ve hacimler buna göre ayarlanabilir.
- Ortamı kuyucuklardan çıkarın ve peptit jelleri, bir ortam değişikliği ile aynı tekniği kullanarak 1x PBS ile iki kez yıkayın (adım 5.7).
- Adım 7.2'yi izleyerek 24 oyuklu plaka eklerinde kültürlenmiş peptit jellerini çıkarın. Her jeli ayrı bir 15 mL santrifüj tüpüne yerleştirin.
NOT: Jeller bu noktada, özellikle uzun süreli kültürden sonra kırılgan olabileceğinden dikkatli olun. - Bir P1000 kullanarak, her tüpe 500 μL Tripsin-EDTA (% 0.25) ekleyin ve karıştırmak ve jeli bozmak için yukarı ve aşağı pipetleyin.
- Jelleri Tripsin-EDTA içinde 37 ° C'de 3-5 dakika inkübe edin.
NOT: Kuluçka süreleri, kullanılan hücre tipine bağlı olarak optimizasyon gerektirebilir. - Tripsin-EDTA'yı seyreltmek için 5 mL 1x PBS ekleyin.
- Pelet hücrelerine 5 dakika boyunca 200 x g'da santrifüjleyin.
- Süpernatanı çıkarın.
NOT: Hücre peleti ile süpernatan arasında bir jel tabakası oluşmuş olabileceğinden dikkatli olun. - Hücre peletini lizis tamponunda yeniden süspanse edin, üreticinin talimatlarına göre, ve RNA ekstraksiyonu için standart protokolleri izleyerek devam edin.
Sonuçlar
Burada açıklanan peptit jel üretim yöntemi, kullanıcının ısmarlama bir 3D kültür ortamı tanımlamasına ve oluşturmasına olanak tanır. Mekanik ortam esas olarak peptit konsantrasyonu ile belirlenirken, Şekil 1'deki örnek hesaplamada gösterildiği gibi, ilgilenilen matris bileşenleri de kontrollü yoğunluklarda eklenebilir. Bununla birlikte, en basit haliyle, peptit jel protokolü, hücreleri matris içermeyen bir 3D ortamda kapsüllemek için bir yöntem sağlar. Şekil 2 , bu yaklaşımın, floresan etiketli kanser hücre hatları (Şekil 2A) ve hasta kaynaklı ksenogreft (PDX) materyali (Şekil 2B,C) dahil olmak üzere çok çeşitli kanser modelleriyle nasıl birleştirilebileceğini göstermektedir. Daha da önemlisi, hücre hatları ve PDX materyalinin her ikisi de serumsuz koşullarda jeller içinde kültürlenebilir (Şekil 2C, D), bu da tam olarak tanımlanmış bileşime sahip bir 3D kültür sistemi sağlar.
Peptitin kendisi herhangi bir hücre bağlama motifi içermediğinden, kapsüllenmiş hücreler tipik olarak modifiye edilmemiş peptit jellerinde yuvarlak bir morfoloji gösterir. Şekil 3A , saf Matrigel ve saf bir kollajen jelinde görülen klasik uzun morfolojileri ile karşılaştırıldığında, 6 mg / mL'lik bir peptit jelindeki insan meme fibroblastları için bunu göstermektedir. Bununla birlikte, daha da önemlisi, peptit jel protokolü, ilgilenilen matris bileşenlerinin dahil edilmesine izin verir. Şekil 3A , 200 μg/mL kollajen I ilavesinin peptit jellerindeki uzamış fibroblast morfolojisini nasıl geri kazandırabileceğini göstermektedir.
Matris ilaveleri, Şekil 3B'de gösterildiği gibi, örneğin MCF10A gibi diğer hücre tiplerinin büyümesini ve organizasyonunu da destekleyebilir. Bu durumda, 6 mg / mL'lik bir peptit jele 100 μg / mL kollajen I eklenmesi, asiner yapıların 7. güne kadar oluşmasına izin verir. Dolaylı ko-kültüre destekleyici bir hücre tabakasının dahil edilmesiyle daha fazla karmaşıklık da ortaya çıkabilir. Şekil 3C , matriks dahil etme ve insan meme fibroblastları ile dolaylı ko-kültürün birleşik yaklaşımının MCF10A büyümesini ve organizasyonunu nasıl artırabileceğini göstermektedir.
Bir diğer önemli parametre, peptit jel üretiminde kullanılan peptit konsantrasyonudur. Şekil 4A , peptit konsantrasyonunun, bu durumda 4 ila 10 mg / mL arasında kontrol edilmesinin, 100s ila 1000s Pa arasında değişen bir sertlik ile nasıl sonuçlandığına dair bir örnek göstermektedir. Bu jeller matrissiz olarak üretilebilir veya hem sertliğin hem de bileşimin aynı anda kontrol edilmesini sağlamak için matris ilaveleri ile oluşturulabilir. Matris ilaveleri olan peptit jelleri, bu ilavelerin dağılımının görselleştirilmesini sağlamak için bölümlere ayrılabilir ve boyanabilir. Şekil 4B, C, bunu yapmak için iki yaklaşım göstermektedir: %4 agarda gömme ve ardından standart doku işleme ve immünohistokimya için parafin gömme (Şekil 4B) veya %2 agarda gömme ve ardından vibratom kesiti ve floresan boyama (Şekil 4C).
Peptit jellerin bileşimini değiştirirken, bu değişikliklerin başlangıçta hücrelere sunulan mekanik ortamı etkilememesini sağlamak çok önemlidir. Şekil 4D , matris dahil edilmesinde peptit jel sertliğindeki herhangi bir değişikliği dengelemek için peptit konsantrasyonundaki değişikliklerin nasıl kullanılabileceğini göstermektedir. Jel sertliğinin toplu salınımlı reoloji ölçümleri (depolama modülü, G') daha sonra jel bileşiminin ve sertliğin hücre morfolojisi üzerindeki etkilerini ayırt edebilir. Parlak alan görüntülerinde gösterildiği gibi, MDA MB 231 hücreleri, 10 mg / mL veya 15 mg / mL peptit jellerine kollajen ilavesi üzerinde uzun bir morfoloji geliştirir. Şekil 4E , bu uzun hücrelerin pFAK için pozitif boyandığını ve bu da çevrelerindeki matris ile bir etkileşimi gösterdiğini göstermektedir. Peptit jellerin başlangıçta matris içermeyen ortamı, onları hücresel sentezi ve ilgilenilen matris bileşenlerinin biriktirilmesini incelemek için ideal bir platform haline getirir. Şekil 4F , 10 mg / mL peptit jelleri içinde kapsüllenmiş MCF7 hücreleri tarafından kollajen I'in lokalize birikimini göstermektedir.
Peptit jellerin en önemli avantajlarından biri, analizlerine standart laboratuvar yöntemlerinin uygulanabilme kolaylığıdır. Gen ekspresyon profillerini belirlemek için qRT-PCR için materyal ekstrakte edilebilir (son yayınımız5'te gösterildiği gibi). Parlak alan mikroskobu ile görüntüleme ayrıca hücre büyümesinin gerçek zamanlı olarak görselleştirilmesini sağlar. Şekil 5 , başarısız peptit jellerinde karşılaşılabilecek tipik sorun giderme sorunlarından bazılarını göstermektedir: jel öncüsünün eksik karıştırılması (Şekil 5A,B); peptit konsantrasyonunun (Şekil 5C,D) veya tohumlama yoğunluğunun (Şekil 5E,F) yanlış optimizasyonu; ve peptit jellerine dahil edilmeden önce asidik kollajenin yanlış nötralizasyonu (Şekil 5G, H). Özellikle peptit konsantrasyonu ve tohumlama yoğunluğu, kültür ortamının uygun şekilde tanımlanmasını ve ilgilenilen uygulamanın temsil edilmesini sağlamak için her hücre hattı ve peptit kaynağı için optimize edilmelidir.
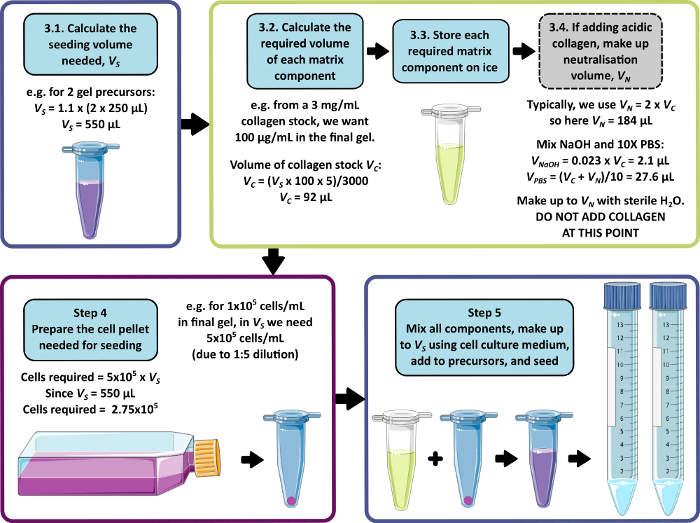
Şekil 1: Matris bileşimi ve tohumlama yoğunluğu için örnek bir hesaplama. Bu örnek iş akışı, 1 x 105 hücre/mL'lik bir nihai hücre yoğunluğunda 100 μg/mL kollajen ilaveleriyle iki peptit jel öncüsünü tohumlamak için izlenecek prosedürü açıklar. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
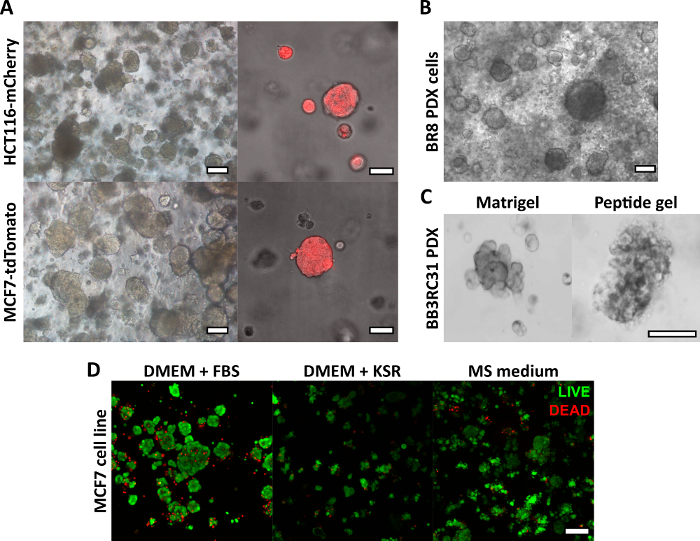
Şekil 2: Matris içermeyen peptit jelleri, hücre hattı ve hasta kaynaklı kanser modelleri için uygun bir 3D kültür platformu sağlar. (A) HCT116 kolorektal kanser ve MCF7 meme kanseri hücre hatları, sırasıyla floresan belirteçleri mCherry ve tdTomato'yu yapısal olarak eksprese eder, 9. güne kadar 6 mg / mL jellerde hücre kümeleri oluşturur (solda) ve floresan mikroskobu kullanılarak canlı olarak görüntülenebilir (sağda, ölçek çubuğu 50 μm); (B) Üçlü negatif meme kanseri hastasından (BR8) hasta kaynaklı ksenogreft (PDX) hücreleri, 10 mg / mL peptit jellerinde 7. güne kadar hücre kümeleri oluşturur; (C) Östrojen reseptörü pozitif meme tümörlerinden (BB3RC31) elde edilen PDX hücreleri, karşılaştırma için eşleşen geçişte bazal membran matrisi (örneğin Matrigel) kontrolü ile gösterilen serumsuz koşullarda18 büyütülebilir; (D) MCF7 meme kanseri hücreleri, 7. günde CANLI / ÖLÜ hücre testi kullanılarak değerlendirildiği gibi, matris içermeyen ve serumsuz koşullarda 6 mg / mL peptit jellerinde canlıdır. KSR = nakavt serum replasmanı, MS ortamı = mamosfer ortamı19. Belirtilmedikçe ölçek çubuğu 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
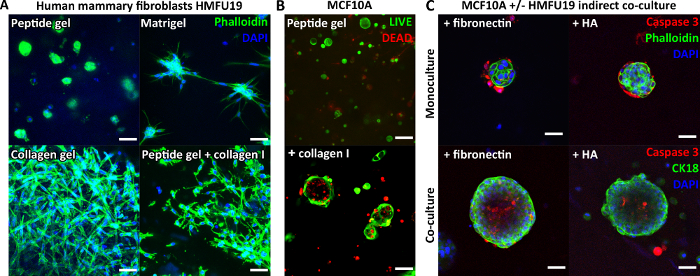
Şekil 3: Peptit jel karmaşıklığı, matris ilaveleri ve ko-kültürün eklenmesiyle arttırılabilir. (A) İnsan meme fibroblast hücre hattı HMFU19, saf bazal membran matrisi (örneğin Matrigel) ve karşılaştırma için 1.5 mg / mL sıçan kuyruğu kollajen I jeli ile gösterilen 6 mg / mL'lik bir peptit jelinde uzun bir morfolojiyi eski haline getirmek için kollajen ilaveleri gerektirir, ölçek çubuğu 50 μm; (B) MCF10A normal meme hücreleri, 100 μg / mL insan kollajen I, ölçek çubuğu 100 μm ilavesiyle 6 mg / mL peptit jellerinde 7. güne kadar asiner yapılar oluşturur; (C) Matris bileşenleri fibronektin / HA (hyaluronik asit, moleküler ağırlık 804 kDa) ve HMFU19'un dolaylı ko-kültürde kombine eklenmesi, bölünmüş kaspaz 3 boyama ile değerlendirildiği gibi 10 mg / mL peptit jellerinde MCF10A asinisinin boyutunu ve organizasyonunu arttırır, ölçek çubuğu 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
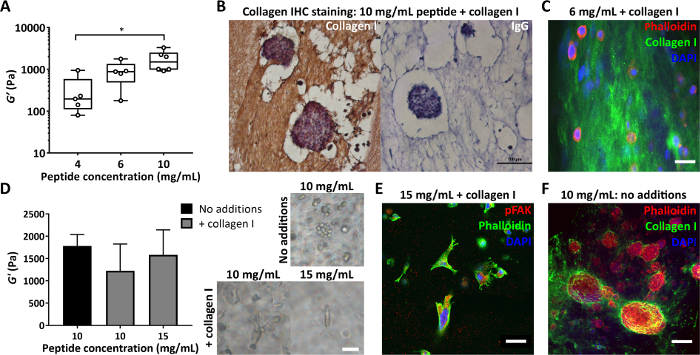
Şekil 4: Peptit jelleri, sertlik ve bileşimin bağımsız kontrolüne ve hücre tarafından biriktirilen matrisin değerlendirilmesine izin verir. (A) Peptit konsantrasyonunun kontrolü ile elde edilebilecek tipik bir sertlik aralığını (depolama modülü, G') gösteren toplu reoloji ölçümleri, * p < 0.05'i gösterir; (B) Kapsüllenmiş MCF7 ile 10 mg / mL peptit jelinde 150 μg / mL kollajen I'in boyanmasını gösteren immünohistokimya (7. gün, ölçek çubuğu 100 μm); (C) 200 μg / mL insan kollajen I ile 6 mg / mL peptit jeli içinde kollajen I dağılımının immünofloresansı, agar gömme ve vibratom kesiti, ölçek çubuğu 25 μm; (D) 200 μg / mL kollajen I ilavesi, peptit konsantrasyonunun 15 mg / mL'ye çıkarılmasıyla dengelenen 10 mg / mL peptit jellerinin (toplu salınım reolojisi) depolama modülünde, G' de mütevazı bir azalma sağlar. MDA MB 231 üçlü negatif meme kanseri hücreleri her durumda gösterilir (7. gün, ölçek çubuğu 50 μm); (E) 200 μg/mL insan kollajeni I içeren 15 mg / mL peptit jellerinde MDA MB 231, pFAK boyama yoluyla matris ile uzama ve etkileşim gösterir (14. gün, ölçek çubuğu 50 μm); (F) Başlangıçta matris içermeyen 10 mg / mL peptit jelinde (10. gün, ölçek çubuğu 100 μm) MCF7 kollajen I birikiminin yerinde boyanması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Yaygın peptit jel sorun giderme sorunları, parlak alan mikroskobu kullanılarak çözülebilir. Gösterilen hücreler, belirtilmedikçe 7. günde MCF10A normal meme epitel hücreleridir. (A) Doğru karıştırılmış bir jel öncüsü, hiçbir tutarsızlık olmaksızın optik olarak berrak olmalıdır, oysa (B) yetersiz karıştırma/nötralizasyon, peptit jelinde (beyaz oklar) görünür homojen olmayanlara/çizgilere neden olabilir; (C) MCF10A, HMFU19 dolaylı ko-kültürünün eklenmesiyle 6 mg / mL peptit jellerinde asiner yapılar oluşturur, ancak (D) 15 mg / mL'de peptit konsantrasyonu asiner oluşumuna izin vermeyecek kadar yüksektir; (E) 5 x 105 hücre / mL'de tohumlanan MCF10A, 100 μg / mL kollajen I ilavesiyle 6 mg / mL jellerde asiner yapılar oluşturur, ancak (F) 2 x 105 hücre / mL'de hücre yoğunluğu asiner oluşumuna izin vermeyecek kadar düşüktür; (G) Kollajen ilaveleri 14. güne kadar büyük hücre kümeleri üretebilir, ancak (H) yanlış ilavesi (sürecin çok erken kollajen nötralizasyonu) küme büyümesini önleyebilir. Ölçek çubuğu 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada açıklanan peptit jellerinin, çoklu hücre tiplerinin 3D kültürünü desteklemek için basit, uygun maliyetli ve esnek bir çözüm olduğunu bulduk. Bu yöntem, kullanılan peptit konsantrasyonu ve yapılan protein veya glikan ilaveleri üzerinde tam kontrol sağlayarak, peptit jellerinin uygulamalarına dikkatlice uyarlanmasını sağlar.
Peptit jellerin mevcut yöntemlere göre en önemli avantajı, matris bileşiminin ve mekanik özelliklerin, herhangi bir karmaşık kimyasal prosedür gerektirmeyen basit bir yöntem kullanılarak bağımsız olarak kontrol edilebilmesidir. Peptit jelin mekanik özellikleri, esas olarak ilk jel öncüsündeki peptit konsantrasyonu ile belirlenir. Hücrelerin ve/veya matris bileşenlerinin daha sonra eklenmesi, tamamen kullanıcı tanımlı bir in vitro ortamın oluşturulmasına izin verir. Matris ilaveleri jelin ilk mekanik özelliklerini değiştirebilse de, bu, peptit konsantrasyonunun5 bağımsız varyasyonu ile kolayca dengelenebilir. Bu, sertliği kontrol eden parametrelerin aynı zamanda yaygın olarak integrin bağlama motiflerinde bir değişikliğe neden olduğu kollajen jelleri gibi mevcut sistemlere göre somut bir avantaj sağlar20,21.
Kanser hücre dizilerinin ve hastadan türetilen materyalin in vitro kültürü için peptit jelin uygulanmasını gösterdik5. Peptit jel ile erişilebilen sertlik aralığı (100s ila 1000s Pa aralığında), meme gibi yumuşak dokularda normal ve tümör matris ortamlarını çoğaltmak için idealdir. Bununla birlikte, diğer uygulamaların, örneğin kemik rejenerasyonu için 10-20 kPa aralığında önemli ölçüde daha sert ortamlar gerektirdiğinin farkındayız. Burada sunulan protokolün daha fazla modifikasyonu, elde edilebilir sertliği bu aralığa genişletmek için gerekli olacaktır, bu da aljinat jelleri22 gibi alternatif yaklaşımlar için daha tipiktir. Benzer şekilde, burada matriks proteinlerinin/glikanlarının peptit jeli içinde fiziksel olarak hapsedilmesiyle işlevselleştirme için basit bir yöntem tanımladık. Burada açıklanan uygulamalar için, bu yaklaşım iyi çalışır ve hastalığın 3D in vitro modellerini kullanmak isteyen uzman olmayan gruplar tarafından kullanım için kolayca uyarlanır. Diğer birçok hidrojel11 gibi, burada kullanılan peptit, hücre bağlama veya diğer biyolojik motifleri içerecek şekilde genişletilebilir ve bazı uygulamalar için bu yaklaşım tercih edilebilir.
Başarıyı sağlamak için dikkat edilmesi gereken birkaç kilit nokta belirledik. Jel öncüsünün oluşumu, kullanıcının hücreler dahil edilmeden önce kullanılan koşulların doğru olup olmadığını kontrol etmesini sağlayan kritik bir ara adımdır. Bu öncü birkaç hafta (4 ° C'de) saklanabilir, ancak kullanımdan önce 80 ° C'de ve ardından 37 ° C'de inkübe edilmelidir. Uygun bir öncü, 80 °C'de tamamen sıvı olacak ve 37 °C'de kendi kendini destekleyecektir. Bu kontroller, jelleşmenin doğru bir şekilde gerçekleşmesini sağlamak için gereklidir. Hücreler ve/veya matris daha sonra fizyolojik koşullar altında birleştirilebilir.
Halihazırda 3D matrisleri kullanan laboratuvarlar, peptit jellerindeki hücreleri kapsüllemek için gereken dikkatli işleme aşina olacaktır. Kapsülleme adımlarından önce ve sırasında hücrelerin ajitasyonunu sınırlamak için özen gösterilmelidir. Belirli hücre tiplerinin bu işlem sırasında hasara karşı farklı şekilde duyarlı olduğunu bulduk ve bu, kullanıcı tarafından dikkatlice değerlendirilmelidir. Burada tarif edilen peptit jelin konsantrasyonları, jelleşmenin, bahsedilen hücreler için, hücrelerin döküm kuyusunun dibine batmadan önce, ancak bu işlemden zarar görmeyecek kadar yavaş kapsüllenmesine izin veren bir zaman diliminde ilerlemesine izin verir. Bununla birlikte, bazı hassas hücre tiplerinin, yüksek pH'a uzun süre maruz kalmaktan kaçınmak için daha hızlı nötralizasyon gerektirebileceği unutulmamalıdır. Bu durumda, peptit jeli çevreleyen ortama 10 mM HEPES eklenmesi faydalı olabilir.
Bu protokolde açıklanan yöntemi benimserken, peptit kaynağının kalitesini dikkatlice düşünmek çok önemlidir. İşlevsel bir motif veya kaplama olarak kullanılmak yerine, buradaki peptit, hidrojelin çözünmeyen kısmının tamamıdır. Bu nedenle, peptit yapısındaki herhangi bir kirletici veya varyasyonun, nihai hidrojeldeki hücre canlılığını destekleme bütünlüğü veya kapasitesi üzerinde önemli bir etkiye sahip olması muhtemeldir. Yeni bir peptit partisine geçerken, jel öncüsünü oluştururken peptitin davranışını kontrol etmenin yanı sıra, tedarikçiden partiden partiye iyi bir tutarlılık olduğundan emin olmak için özen gösterilmelidir.
Özetle, bu protokol, mekanik ve biyolojik özelliklerin bağımsız kontrolüne çok önemli bir şekilde odaklanan bir 3D kültür sistemini tanımlar. Yöntemin basitliği ve uyarlanabilirliği, onu herhangi bir hücre kültürü laboratuvarı tarafından benimsenmeye ve çok çeşitli uygulamalar için uygun hale getirir5. Gelecekte, bu protokol peptit dizisinin kovalent modifikasyonuna izin verecek şekilde genişletilebilir. Bu, hücrelerin çevrelerindeki matris üzerine uyguladıkları çekme kuvvetlerini araştırmak için gelişmiş mikroskopi yöntemleriyle birleştirilebilir. Bununla birlikte, kilit öneme sahip olan, yapay olarak dahil edilmiş matris ile kapsüllenmiş hücrelerin kendileri tarafından sentezlenen matris arasında ayrım yapma yeteneğidir. Zaman içindeki matris değişikliklerini kontrol etme ve izleme yeteneği, kanser ve diğer hastalıkların gelişiminde hücre matrisi etkileşimlerinin rolleri hakkında benzeri görülmemiş içgörüler sağlayacaktır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Araştırmada Hayvanların Değiştirilmesi, İyileştirilmesi ve Azaltılması Ulusal Merkezi'nden NC/N0015831/1'den JCA, GF ve CLRM'ye, NC/T001267/1'den RBC, CLRM, JCA, KL-S ve KS, NC/T001259/1'den JCA, KL-S ve CLRM'ye ve NC/P002285/1'den AMG, SJ ve CLRM'ye fon sağlamayı kabul etmek isteriz. Ayrıca Mühendislik ve Fizik Bilimleri Araştırma Konseyi'nden EP/R035563/1'den KL-S ve CLRM'ye ve EP/N006615/1'den JLT ve CLRM'ye fon sağlanmıştır. Şekil 1 , Servier Medical Art'tan uyarlanmış grafikler kullanılarak oluşturulmuştur. Servier Medical Art by Servier, Creative Commons Atıf 3.0 Taşınmamış Lisansı ile lisanslanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Gel fabrication - Reagents | |||
| FEFEFKFK | Pepceuticals | n/a | Polypeptide; available from various suppliers. Pepceuticals is our recommended supplier due to the quality of the product. |
| PBS 10X | Gibco | 70011-036 | |
| Sodium hydroxide (1 M) | Sigma-Aldrich | S2770 | NaOH; dilute to 0.5 M prior to use |
| Water | Sigma-Aldrich | W3500 | |
| Gel fabrication - Equipment and Consumables | |||
| 15 mL falcon tubes | Greiner | 188261 | If using different brand ensure the material withstands temperatures of up to 90°C |
| 24 well plate | Corning Costar | 3524 | Alternative brands/suppliers can be used as long as there is a gap between the insert base and the plate surface |
| Centrifuge | Any | 200 x g for 3 minutes | |
| Class II Microbiological Safety Cabinet | Any | ||
| Fine balance | Any | Readability 0.1 mg | |
| Hanging insert for 24 well plate | Millipore | MCRP24H48 | Alternative brands/suppliers can be used as long as there is a gap between the insert base and the plate surface |
| Incubator | Any | 37°C, 5% CO2, humidified environment | |
| Oven | Any | set to 80°C | |
| P1000/200/20/10 pipette | Any | It is essential the pipettes used for the procedure are calibrated | |
| P1000/200/20/10 tips | Any | ||
| pH meter with microprobe | Any | ||
| Spatula | Any | ||
| Vortex | Any | ||
| Matrix addition | |||
| Collagen I (human) | Stem Cell Technologies | 07005 | |
| Collagen I (rat tail) | Gibco | A10483 | |
| Fibronectin | Stem Cell Technologies | 07159 | |
| Hyaluronic Acid | Iduron | HA804 | |
| Matrigel | Corning | 354234 | |
| Cell encapsulation/culture | |||
| B27 Supplement (no retinoic acid) | Gibco | 12587010 | Media additions for serum free cultures (Figure 2D) |
| Cholera toxin | Sigma-Aldrich | C-8052 | Media additions for MCF10A cells (Figure 3, 5) |
| DMEM | Gibco | 21969-035 | |
| DMEM/F12 | Sigma-Aldrich | D8062 | Media additions for MCF10A cells (Figure 3, 5) |
| DMEM/F12 Phenol Red Free | Gibco | 21041-025 | Media additions for serum free cultures (Figure 2D) |
| DPBS | Gibco | 14190-094 | |
| EGF | SourceBiosciences | ABC016 | Media additions for MCF10A cells (Figure 3, 5) |
| Fetal Bovine Serum | Gibco | 10500-064 | |
| Horse serum | Gibco | 26050-070 | Media additions for MCF10A cells (Figure 3, 5) |
| Human cancer/epithelial cell lines | e.g. MCF7/tdTomato MCF7/MCF10a/HCT116-mCherry | ||
| Human mammary fibroblasts | e.g. HMFU19 | ||
| Hydrocortisone | Sigma-Aldrich | H-0888 | Media additions for MCF10A cells (Figure 3, 5) |
| Insulin | Sigma-Aldrich | I9278 | Media additions for MCF10A cells (Figure 3, 5) |
| Knockout serum replacement | Gibco | 10828-028 | Media additions for serum free cultures (Figure 2D) |
| L-glutamine | Gibco | 25030-024 | |
| RPMI | Gibco | 21875-034 | |
| RPMI Phenol Red Free | Sigma-Aldrich | R7509 | |
| Imaging and other assays | |||
| 4% paraformaldehyde | Polysciences | 18814 | |
| Agar | SLS | CHE1070 | |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | 5482 | |
| Confocal and/or fluorescent microscope | Any | e.g. Leica TCS SPE confocal laser scanning microscope (Figures 2-4) | |
| DAPI solution | Invitrogen | D3571 | 300 uM working solution |
| DPX mounting medium | ThermoFisher Scientific | ||
| Glass cover slips | Any | No1 coverslips 0.13 - 0.17 mm thickness | |
| Glass-bottom dishes | MatTek | ||
| Goat Anti-Rabbit IgG H&L (HRP polymer) | Abcam | ab214880 | |
| Haematoxylin and Eosin | Any | ||
| Histology molds (disposable, plastic) | Any | ||
| Image analysis software | ImageJ | ||
| Live/Dead assay kit | Invitrogen | L3224 | |
| Microtome | Any | ||
| Phalloidin | Life Technologies | F432/R415 | |
| Pierce Peroxidase IHC Detection Kit | ThermoFisher Scientific | 36000 | |
| Primary Ab Caspase 3 | Abcam | ab34710 | Shown in Figure 3C |
| Primary Ab Collagen I | Cell Signalling Technology | 9661 | Shown in Figure 4B, C, F |
| Primary Ab pFAK Tyr 397 | ThermoFisher Scientific | 44-624G | Shown in Figure 4E |
| Prolong gold/diamond anti-fade mountant with DAPI | Molecular Probes | S36939 | |
| Rheometer Physica MCR 301 | Anton Paar | ||
| Scalpel | Any | ||
| Secondary antibody Goat anti Rabbit AF488 | nvitrogen | a11034 | |
| Secondary antibody Goat anti Rabbit AF546 | Invitrogen | a11010 | |
| SuperFrost slides | ThermoFisher Scientific | Coating e.g. APES can help to retain microtome sections on slides. | |
| Triton X 100 | Sigma-Aldrich | X100 | |
| Trypsin-EDTA (0.25%) | Gibco | 25300054 | |
| Vibratome | Leica |
Referanslar
- Hynes, R. The extracellular matrix: not just pretty fibrils. Science. 326 (5957), 1216-1219 (2009).
- Tian, C., et al. Cancer-cell-derived matrisome proteins promote metastasis in pancreatic ductal adenocarcinoma. Cancer Research. 80 (7), 1461-1474 (2020).
- Hebert, J. D., et al. Proteomic profiling of the ECM of xenograft breast cancer metastases in different organs reveals distinct metastatic niches. Cancer Research. 80 (7), 1475-1485 (2020).
- Vennin, C., et al. CAF hierarchy driven by pancreatic cancer cell p53-status creates a pro-metastatic and chemoresistant environment via perlecan. Nature Communication. 10 (1), 3637(2019).
- Ashworth, J. C., et al. Peptide gels of fully-defined composition and mechanics for probing cell-cell and cell-matrix interactions in vitro. Matrix Biology. 85, 15-33 (2020).
- Toniatti, C., Jones, P., Graham, H., Pagliara, B., Draetta, G. Oncology drug discovery: Planning a turnaround. Cancer Discovery. 4 (4), 397-404 (2014).
- Mak, I. W., Evaniew, N., Ghert, M. Lost in translation: animal models and clinical trials in cancer treatment. American Journal of Translational Research. 6 (2), 114-118 (2014).
- Aisenbrey, E. A., Murphy, W. L. Synthetic alternatives to Matrigel. Nature Reviews Materials. 5, 539-551 (2020).
- Onion, D., et al. 3-Dimensional patient-derived lung cancer assays reveal resistance to standards-of-care promoted by stromal cells but sensitivity to histone deacetylase inhibitors. Molecular Cancer Therapy. 15 (4), 753-763 (2016).
- Saunders, J. H., et al. Individual patient oesophageal cancer 3D models for tailored treatment. Oncotarget. 8 (15), 24224-24236 (2017).
- Caliari, S. R., Burdick, J. A. A practical guide to hydrogels for cell culture. Nature Methods. 13 (5), 405-414 (2016).
- Kühn, S., et al. Cell-instructive multiphasic gel-in-gel materials. Advanced Functional Materials. 30, 1908857(2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Gjorevski, N., Lutolf, M. P. Synthesis and characterization of well- defined hydrogel matrices and their application to intestinal stem cell and organoid culture. Nature Protocols. 12 (11), 2263-2274 (2017).
- Saiani, A., et al. Self assembly and gelation properties of α-helix versus β-sheet forming peptides. Soft Matter. 5 (1), 193-202 (2008).
- Wan, S., et al. Self-assembling peptide hydrogel for intervertebral disc tissue engineering. Acta Biomaterialia. 46, 29-40 (2016).
- Blache, U., Stevens, M. M., Gentleman, E. Harnessing the secreted extracellular matrix to engineer tissues. Nature Biomedical Engineering. 4 (4), 357-363 (2020).
- Sachs, N., et al. A living biobank of breast cancer organoids captures disease heterogeneity. Cell. 172 (1-2), 373-386 (2018).
- Shaw, F. L., et al. A detailed mammosphere assay protocol for the quantification of breast stem cell activity. Journal of Mammary Gland Biology and Neoplasia. 17 (2), 111-117 (2012).
- Barcus, C. E., Keely, P. J., Eliceiri, K. W., Schule, L. A. Stiff collagen matrices increase tumorigenic prolactin signaling in breast cancer cells. Journal of Biological Chemistry. 288, 12722-12732 (2013).
- Bax, D. V., et al. Impact of UV- and carbodiimide-based crosslinking on the Integrin-binding properties of collagen-based materials. Acta Biomaterialia. 100, 280(2019).
- Huang, B. P., et al. Multi-peptide presentation and hydrogel mechanics jointly enhance therapeutic duo-potential of entrapped stromal cells. Biomaterials. 245, 119973(2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır