A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحديد السريع لتقارب الأجسام المضادة- المستضدات بواسطة القياس الضوئي الشامل
In This Article
Summary
نحن وصف نهج جزيء واحد لقياسات تقارب الأجسام المضادة المضادة باستخدام القياس الضوئي الشامل (MP). البروتوكول المستندة إلى MP سريع ودقيق، ويستخدم كمية صغيرة جدا من المواد، ولا يتطلب تعديل البروتين.
Abstract
إن قياسات خصوصية وتقارب تفاعلات الأجسام المضادة للأجسام المضادة ذات أهمية حاسمة للتطبيقات الطبية والبحثية. في هذا البروتوكول، نحن وصف تنفيذ تقنية جزيء واحد جديد، قياس ضوئي الشامل (MP)، لهذا الغرض. MP هو تقنية خالية من التسمية والشل الحركة التي تكشف عن الكتل الجزيئية وفئات الأجسام المضادة ومجمعات الأجسام المضادة على مستوى جزيء واحد. MP يحلل عينة الأجسام المضادة للمضادات في غضون دقائق، مما يسمح لتحديد دقيق من تقارب ملزمة وفي وقت واحد توفير المعلومات عن علم التشنج والدولة القلية من البروتينات. هذا هو تقنية بسيطة ومباشرة التي تتطلب سوى بيكومويل كميات من البروتين والمواد الاستهلاكية لا مكلفة. ويمكن استخدام نفس الإجراء لدراسة البروتين البروتين ملزمة للبروتينات مع كتلة الجزيئية أكبر من 50 كيلو Da. للتفاعلات البروتينية المتعددة التكافؤ، يمكن الحصول على تقارب مواقع الربط المتعددة في قياس واحد. ومع ذلك، فإن طريقة قياس الجزيء الواحد وعدم وجود العلامات تفرض بعض القيود التجريبية. هذه الطريقة تعطي أفضل النتائج عند تطبيقها على قياسات تقارب التفاعل دون ميكرومولار، مستضدات مع كتلة جزيئية من 20 كيلو أم أيه أو أكبر، و نقي نسبيا عينات البروتين. كما أننا نُصف الإجراء اللازم لتنفيذ خطوات التركيب والحساب المطلوبة باستخدام برنامج تحليل البيانات الأساسي.
Introduction
أصبحت الأجسام المضادة أدوات في كل مكان من البيولوجيا الجزيئية وتستخدم على نطاق واسع في كل من التطبيقات الطبية والبحثية. في الطب، فهي ذات أهمية حاسمة في التشخيص، ولكن تطبيقاتها العلاجية تتوسع أيضاً ويتم تطوير العلاجات الجديدة القائمة على الأجسام المضادة باستمرار1،2،3،4. وتشمل التطبيقات العلمية للأجسام المضادة العديد من التقنيات المختبرية التي لا غنى عنها مثل immunofluorescence5، المناعي6، تدفق cytometry7، ELISA ، والنشاف الغربية. بالنسبة لكل من هذه التطبيقات، فإن الحصول على قياسات دقيقة لخصائص الربط للجسم المضاد، بما في ذلك تقارب الربط وخصوصيته، أمر بالغ الأهمية.
منذ أول جهاز الرنين البلازمون سطح التجارية (SPR) تم إدخالها في عام 1990، أصبحت أجهزة الاستشعار الحيوي البصرية "المعيار الذهبي" لتوصيف الأجسام المضادة، ولكن التقنيات الأخرى، بما في ذلك ELISA، تستخدم أيضا بشكل روتيني لقياس تقارب الأجسام المضادة8،9. هذه الطرق عادة ما تتطلب شل أو وضع العلامات على الجزيئات المحللة، والتي يمكن أن تؤثر على التفاعل بين الفائدة. كما أنها بطيئة نسبياً، وتنطوي على خطوات مقارنة متعددة قبل أن يتسنى جمع النتائج لتحليل البيانات. A وضعت مؤخرا واحد جزيء طريقة، القياس الضوئي الشامل (MP)، يكتشف الجزيئات مباشرة في الحل عندما تهبط على سطح المجهر يغطي10،11. لا يتطلب الكشف البصري القائم على تشتت الضوء الذي يستخدمه النائب وضع العلامات على البروتين أو تعديله. يتم تسجيل جزيئات البروتين الفردية بواسطة المجهر التشتت التداخلي كما البقع الداكنة التي تظهر في الصورة (الشكل 1D) ، ويمكن الكشف عن عدة آلاف من الجزيئات خلال الحصول على البيانات لمدة دقيقة واحدة12. يتم تحديد كمية الإشارة التي يتم إنشاؤها بواسطة كل جسيم على حدة، ويتم حساب قيمة التباين (ظلام نسبي). وتتناسب قيم التباين التداخلي مع الكتل الجزيئية للبروتينات، مما يسمح بتحديد الأنواع المقيدة والحرّة في خليط الأجسام المضادة للمضادات. في الوقت نفسه، من خلال عد أحداث الهبوط الجزيئي، MP يقيس مباشرة مجموعات الأنواع. وهذا يعطي MP الأساليب المستندة إلى قدرة فريدة لتحديد بشكل مستقل تقارب مواقع الربط المتعددة.
ربط المستضد (Ag) يمكن وصف جزيئات إلى موقعين ملزمين من الأجسام المضادة سليمة (Ab) كما :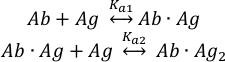
مع الثوابت اقتران التوازن Ka1 و Ka2 تعريف ك:
حيث ci و fi تمثل التركيز وجزء من المكون i، على التوالي. يمكن التعبير عن تركيز المستضد الكلي (cAg)على النحو:
منذ تركيزات مجموع الأجسام المضادة (جAb)tot و antigen (cAg) من المعروفأن هذه المعادلة يمكن استخدامها لتناسب مباشرة الكسور المكون التجريبية التي تم الحصول عليها من قياسات MP وحساب ثوابت اقتران التوازن Ka1 و Ka2 (انظر المعلومات التكميلية).
ويمكن أيضا أن تستخدم بيانات MP لتقدير التعاون بين موقعين للجسم المضاد ملزمة11. لاثنان جسم مضادّة ثوابت مع ثوابت متماثلة مجهريّة ملزمة, العاملات إحصائيّة يصف العملية من مجموعة سكان من ال أب· Ag وAb· Ag2 المجمعات تملي أن الثوابت التوازن العيان واضح Ka1 و Ka2 لن تكون متساوية عدديا، وKa1 = 4Ka2. ولذلك، تشير القيم التجريبية لـ Ka1 < 4Ka2 إلى التعاون الإيجابي بين موقعي ربط الأجسام المضادة. وبالمثل، Ka1 > 4Ka2 يشير إلى التعاونية السلبية.
قياسات MP لتقارب الربط المضاد للجسم سريع ويتطلب كمية صغيرة من المواد. توفر التوزيعات الكتلة النائب المستخدمة في عمليات حسابية ثابتة التوازن معلومات إضافية حول خصائص العينة وتمكن من تقييم نقاء العينة، oligomerization، وتجميع في تجربة واحدة. ويمكن استخدام نفس الطريقة لقياس نسبة عالية من البروتين البروتين ملزمة، وMP مفيد بشكل خاص لدراسات التفاعلات البروتينية متعددة التكافؤ. وعادة ما يكون المجمعات متعددة البروتينات كتل جزيئية كبيرة، الأمثل للكشف عن النائب، ويمكن استخدام بيانات جزيء واحد لقياس stoichiometry وحساب تقارب مواقع الربط متعددة في وقت واحد. عادةً ما يصعب الحصول على هذه المعلومات باستخدام أساليب مجمعة.
دون تعديلات، والبروتوكول الحالي هو مناسبة لقياسات تقارب عالية نسبيا، تفاعلات دون micromolar مع مستضدات من كتلة جزيئية من 20 كيلو أم لا أو أكبر. للحصول على أفضل النتائج، يجب أن تكون مخزونات البروتين من درجة النقاء العالية، ولكن لا توجد متطلبات محددة العازلة. باستخدام MP، يمكن تقييم ربط الأجسام المضادة المضادة في أقل من خمس دقائق. يمكن إجراء جمع البيانات والتحليل المطلوبة لإجراء حسابات Kd دقيقة في غضون 30 دقيقة.
Protocol
1. إعداد غرف التدفق
- تنظيف أغطية الزجاج
- باستخدام زجاجات الغسيل بالماء المقطر والإيثانول والأيزوبروبانول، شطف 24 مم × 50 مم يغطي بالترتيب التالي: الماء والإيثانول والماء والإيزوبروبانول والماء. جفف الأغطية مع تيار من النيتروجين النظيف. من المهم شطف الأغطية من أعلى إلى أسفل ، مع عقد الزاوية السفلية مع ملقط لينة الرؤوس. تجفيف الغطاء في نفس الاتجاه لتجنب نقل التلوث من ملقط (الشكل 2A).
- وبالمثل، شطف 24 مم × 24 ملم يغطي بالماء المقطر والإيثانول والماء المقطر. جفف الأغطية مع تيار من النيتروجين النظيف.
- حدد جانب العمل من غطاء الغطاء، وضع قطرة من الماء المقطر على سطح غطاء نظيف واتبع الخطوات 3.1-3.2 من البروتوكول. عادةً ما يكون هناك جانب واحد فقط من أغطية 24 مم × 50 مم لديه جودة بصرية مناسبة لقياسات MP.
ملاحظة: بعد التركيز، لا يجب أن تكون أي عيوب سطحية كبيرة قابلة للكشف، ويجب أن تكون قيمة "الإشارة" الموضحة في برنامج جمع البيانات أقل من 0.05٪(الشكل 1A-C). يتم توجيه الجوانب العاملة من جميع الأغطية في المربع في نفس الاتجاه. وينبغي استخدام نفس الإجراء لاختبار كفاءة تنظيف الأغطية.
- تجميع غرفة التدفق
- ضع غطاء الأغطية 24 مم × 24 مم على قطعة من رقائق الألومنيوم. ضع شرائط من الشريط على الوجهين على أعلى غطاء 24 مم × 24 مم كما هو موضح في الشكل 2B وقطع الشريط على طول حافة الزجاج. فصل الغطاء من رقائق الألومنيوم وإرفاقه إلى الجانب العامل من 24 مم × 50 مم الأغطية (الشكل 2C).
ملاحظة: يمكن أن يختلف حجم القناة، ولكن يوصى بعرض 3 مم إلى 5 مم. تتطلب القنوات الأوسع حجم عينات أكبر وقد يصعب تحميل القنوات الضيقة للغاية. عادة، يمكن بسهولة إنشاء قناتين متوازيتين على غطاء 24 مم × 24 مم. يمكن إيقاف البروتوكول مؤقتًا هنا.
- ضع غطاء الأغطية 24 مم × 24 مم على قطعة من رقائق الألومنيوم. ضع شرائط من الشريط على الوجهين على أعلى غطاء 24 مم × 24 مم كما هو موضح في الشكل 2B وقطع الشريط على طول حافة الزجاج. فصل الغطاء من رقائق الألومنيوم وإرفاقه إلى الجانب العامل من 24 مم × 50 مم الأغطية (الشكل 2C).
2. إعداد عينات مستضد الأجسام المضادة لقياسات تقارب
- تصفية ما لا يقل عن 2 مل من المخزن المؤقت PBS باستخدام مرشحات حقنة 0.22 ميكرومتر لإزالة جزيئات الغبار أو المجاميع. الطرد المركزي مخزون البروتين لمدة 10 دقائق في السرعة القصوى للطرد المنضدة (حوالي 16000 x ز).
ملاحظة: برنامج تلفزيوني هو المخزن المؤقت الموصى به لهذا البروتوكول ولكن MP لا متطلبات المخزن المؤقت معينة، والمخازن الحيوية الأخرى مقبولة أيضاً. ومع ذلك، تركيزات الغليسيرول عالية (> 10٪) ونقاط القوة الأيونية المنخفضة جداً (تركيز الملح < 10 mM) قد تؤثر على جودة الصورة والبيانات ولا ينصح بها. - تحديد التركيزات الفعلية للأجسام المضادة وأرصدة المستضد من خلال قياس امتصاصها للأشعة فوق البنفسجية 280 نانومتر.
- حساب تركيزات القياس لخليط الأجسام المضادة للمضادات. إذا كانت القيمة المقدرة لتقارب الربط المضاد للأجسام غير معروفة، فخطط لإعداد عينة ذات مستضد 30 ن م وتركيز الأجسام المضادة 20 ن م. عندما يكون التقارب التقريبي معروفًا، ينبغي تحسين نسبة الأجسام المضادة إلى المستضد وتركيزاتها وفقًا لقيم Kd المتوقعة. استخدم مجموع تركيز المستضد في الخليط الذي يساوي مجموع Kd المتوقعة وتركيز الأجسام المضادة الكلي في المعادلة أدناه. على افتراض Kd1 = Kd2 لباراتوبين من الجسم المضاد، سيؤدي ذلك إلى تركيزات مماثلة للأجسام المضادة الحرة ومجمعات الضد في العينة.
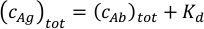
ضبط تركيز الأجسام المضادة للحفاظ على تركيز البروتين الكلي في العينة داخل نطاق 10 nM و 50 nM. يتم الحصول على أفضل النتائج باستخدام الخلائط مع تركيزات الأجسام المضادة بين 5 ن م و 25 ن م.
ملاحظة: يكتشف MP البروتينات ذات الكتلة الجزيئية التي تزيد عن 40 كيلو Da. وبالتالي، يمكن أن تتجاوز تركيزات العينات من المستضدات ذات الكتلة الجزيئية الأصغر من 40 كيلو Da الحد النموذجي 50 nM. ومع ذلك، عند تركيزات أعلى من حوالي 100 nM، حتى مستضدات الكتلة الجزيئية المنخفضة قد تؤثر على جودة ودقة الصورة من تحديد Kd. - إعداد 50 ميكرولتر من خليط مضاد الأجسام في تركيز القياس النهائي المحسوب في الخطوة 2.3.
ملاحظة: يلزم عينة واحدة فقط من خليط الأجسام المضادة المضادة لتحديد KD. ومع ذلك، يمكن أن يساعد إعداد عدة عينات بنسب مستضد مختلفة إلى الأجسام المضادة في تحسين تركيز العينات. وإذا تم جمع بيانات من عدة عينات، يمكن تحليلها عن طريق نوبة عالمية. - احتضان خليط الأجسام المضادة للضد (10 دقائق) تقريبًا في درجة حرارة الغرفة للسماح للتفاعل الملزم بالوصول إلى التوازن الكيميائي. تجنب أوقات الحضانة الطويلة بلا داع.
ملاحظة: قد يختلف وقت الحضانة وفقًا لحركية الربط. وللتأكد من أن التوازن الكيميائي قد تم التوصل إليه، يمكن تكرار قياسات العينات في أوقات الحضانة المختلفة. تشير قيم Kd الثابتة زمنياً إلى فترة حضانة طويلة بما فيه الكفاية. الحضانة المطولة قد تؤدي إلى امتصاص البروتين كبيرة على سطح labware البلاستيك، وبالتالي، إلى أخطاء كبيرة في تحديد تركيز البروتين. لهذا السبب، ينصح بشدة لـ low-التصاق labware لإعداد عينة MP13.
3. جمع بيانات القياس الضوئي الشامل
- تطبيق قطرة من زيت الغمر المجهر على الهدف أداة MP ووضع غرفة تدفق تجميعها على مرحلة المجهر. تأكد من أن النفط يمتد الفجوة بين غطاء والهدف.
- قم بتحميل غرفة التدفق وركز على مقياس الضوئي الشامل.
- إيداع 10 ميكرولتر من محلول عازلة نظيفة ومصفاة في نهاية واحدة من قناة غرفة التدفق المعدة في الخطوة 1. السائل سيدخل القناة عن طريق عمل الشعرية.
- ضبط المرحلة Z-الموقف لتركيز المجهر على سطح العمل من أغطية 24 × 50 ملم.
- في علامة التبويب التحكم في التركيز من برنامج تجميع البيانات، استخدم أزرار حركة المرحلة الخشنة لأعلى ولون لإجراء التعديلات الأولية.
- انقر فوق الزر الحدة لإظهار قراءة إشارة الحدة واستخدم أزرار الضبط لأعلى ولون لأعلى لزيادة قيمة الحدة إلى أقصى حد.
- انقر فوق الزرين ضبط التركيز البؤري والتركيز على التركيز لتنشيط وظيفة تتبع التركيز البؤري. يجب أن يكون للصورة التي تركز بشكل صحيح(الشكل 1A, C)قيمة "الإشارة" أقل من 0.05٪.
ملاحظة: إذا كانت قيمة "الإشارة" في موضع الحدة القصوى أعلى من 0.05٪، قد يشير ذلك إلى وجود شوائب على سطح الزجاج أو في المخزن المؤقت.
- باستخدام نفس القناة، تحميل 20 ميكرولتر من عينة مستضد الأجسام المضادة عن طريق إيداعها على جانب واحد من القناة ونشاف السائل من الطرف الآخر مع قطعة صغيرة من الورق النشاف (الشكل 2D).
ملاحظة: يبلغ حجم القناة التي يبلغ عرضها 3 إلى 5 مم حوالي 10 ميكرولتر. يُوصى بحجم العينة الإضافي لاستبدال المخزن المؤقت الموجود في القناة بالكامل وتجنب تخفيف العينة. - بعد تحميل العينة، انقر على الفور على زر تسجيل لبدء جمع البيانات، والحصول على فيديو 100 s(الشكل 1D).
- في نهاية مجموعة البيانات أدخل اسم الملف وانقر فوق موافق لحفظ ملف البيانات.
- تجاهل الأغطية ومسح الزيت من العدسة الهدف مع مسحات بصرية القطن الرطب مع ايزوبروبانول.
ملاحظة: يمكن أن يكون مؤقتاً البروتوكول هنا.
4. تحليل بيانات النائب
- معالجة ملف الفيديو الذي تم جمعه باستخدام برنامج معالجة بيانات MP لتحديد أحداث الهبوط.
- استخدم خيار القائمة ملف/فتح لتحميل الملف للتحليل وانقر فوق تحليل.
- انقر فوق الزر Load لتحميل وظيفة المعايرة وحفظ البيانات التي تم تحليلها باستخدام خيار القائمة File/Save النتائج باسم.
- تناسب توزيع الكتلة الجزيئية مع وظائف غاوسي للحصول على تركيزات نسبية من كل نوع في العينة. يمكن إجراء هذا التحليل باستخدام برنامج رسم بياني علمي شائع (انظر جدول المواد).
- استيراد ملف "eventsFitted.csv" إلى البرنامج ومؤامرة توزيع الكتلة الجزيئية (العمود M في الملف .csv) باستخدام الدالة رسم / الإحصاء / الرسم البياني.
- انقر نقراً مزدوجاً فوق الرسم البياني لفتح إطار "خصائص المؤامرة". قم بتعطيل binning التلقائي وحدد حجم سلة من 2.5 كيلو Da. انقر فوق الزر تطبيق والذهاب لإنشاء البيانات مراكز و عدد الحاويات.
- حدد أعمدة مراكز و أعداد الحاويات واستخدم وظيفة قائمة التحليل/القمم وتناسب الـ Baseline/Multi Peak Fit لاحتواء الرسم البياني مع دالات الغوسية. انقر نقراً مزدوجاً للإشارة إلى المواقف التقريبية للذروة على الرسم التوزيع ثم انقر فوق الزر فتح NLFit.
- تحقق من مربعات الاختيار الثابتة لمراكز الذروة "xc" وحدد قيمها على الكتل الجزيئية المتوقعة للأجسام المضادة الحرة ومجمعات الأجسام المضادة المضادة الوحيدة والمزدوجة. تحقق من خيار المشاركة لمعلمات العرض. انقر فوق الزر احتواء. وتمثل قيم ارتفاع الذروة المجهزة لمكونات جاوسي التركيز النسبي لكل نوع في العينة11.
ملاحظة: قد يتم ضبط حجم الحاوية لتحسين دقة مخطط التوزيع الشامل. يبلغ الحد الأقصى لدقة MP حوالي 1 كيلو أونيد، وقد تزيد أحجام الحاويات الصغيرة من ضجيج التوزيع، بينما لا تكشف عن أي معلومات إضافية. سوف أحجام بن كبيرة جداً حجب التفاصيل الدقيقة لتوزيعات الشامل.
- حساب جزء تركيز كل نوع باستخدام المعادلة التالية:
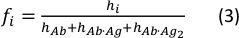
حيث تمثل قيم hi و fi ذروة الارتفاعات وكسور التركيز من الأجسام المضادة الحرة والأجسام المضادة أحادية مزدوجة في العينة، على التوالي.
5. حساب التوازن القيم الثابتة
- تناسب كسور التركيز من الأنواع التفاعل محسوبة في الخطوة 4.3 مع Eq. 1 و 2 باستخدام برنامج تحليلي مناسب. هنا نُظهر طريقة لحساب ثوابت التوازن باستخدام برنامج جدولالبيانات 14 (راجع المعلومات التكميلية).
- افتح ورقة العمل "حساب Kd.xlsx". في ورقة العمل هذه، يمكن تعديل قيم الخلايا في الصفوف من 1 إلى 10 المميزة باللون الأصفر لإجراء حسابات ثوابت التوازن.
- أدخل قيم Kd المقدرة في وحدات نانوموللار في الخلايا B1 و B2 في الجدول. سيتم تحسين قيم البداية هذه في إجراء التركيب. إذا كانت قيم Kd المقدرة غير معروفة، اترك القيم الافتراضية في الخلايا B1 و B2 دون تغيير.
- أدخل قيم (جAb)tot و (cAg)في وحدات نانوموللار في الخلايا D2 و E2. أدخل قيم الكسر المحسوبة في الخطوة 4.3 في الخلايا F2 و G2 و H2. وإذا قيست عينات متعددة بنسب تركيز مختلفة، يمكن إدخال قيم تركيز إضافية تم الحصول عليها لتلك العينات في الصفوف من 2 إلى 10.
- حدد دالة القائمة Data/Solver. أدخل "$B $15" في المربع "تعيين الهدف" و "$B $ 1: $B $ 2" في المربع "بواسطة تغيير الخلايا المتغيرة:". حدد زر الاختيار Min للخيار إلى: تحقق من خانة الاختيار جعل المتغيرات غير المقيدة غير سالبة وحدد GRG Nonlinear كأسلوب حل. انقر فوق الزر حل. سيتم عرض أفضل تناسب Kd1 و Kd2 القيم في الخلية B1 و B2 و المجموع النهائي من أخطاء مربعة في الخلية B15.
ملاحظة: إذا لم تكن الدالة Solver نشطة، حدد خيارات ضمن القائمة ملف في برنامج جدول البيانات. في الفئة الوظائف الإضافية حدد الوظيفة الإضافية Solver ضمن الوظائف الإضافية غير النشطة للتطبيق وانقر فوق زر الانتقال. حدد خانة الاختيار Solver الوظيفة الإضافية وانقر فوق موافق.

الشكل 1: صور قياس ضوئي شامل. (أ)صورة عرض أصلية تمثيلية لمخزن التصوير المؤقت الذي تم جمعه على غطاء نظيف و (B) على غطاء مع عيوب سطحية. (C) صورة نسبة تفاضلية من العازلة التصوير و (D) و AHT · HT الحل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: MP تدفق غرفة إعداد والتحميل. (أ) Coverslip عقد الموقف لإجراء التنظيف. (B) محاذاة 24 × 24 مم الأغطية (الطبقة الوسطى) والشريط على الوجهين (الطبقة العليا) على سطح رقائق الألومنيوم (الطبقة السفلية، لا تظهر). خطوط زرقاء متقطعة تظهر موقع خطوط قطع. (C) عرض علوي وجانبي لغرفة التدفق المجمعة مع قناتين للعينة، وصورة لغرفة التدفق المجمعة. (D)الإجراء الخاص بالتحميل في قناة تدفق مسبقًا. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
لقد سبق فحصنا التفاعل بين الإنسان α-ثرومبين (HT) والماوس أحادية النسيلة المضادة البشرية ثرومبين الأجسام المضادة (AHT) باستخدام MP يستند إلى المقايسة11. وبما أن الكتلة الجزيئية لـ HT (37 كيلو Da) أقل من حد الكشف عن 40 كيلو Da، فإن الحد الأقصى لتركيز العينة يمكن أن يتجاوز الحد الأقصى من ترك?...
Discussion
يوفر بروتوكول القياس الضوئي الشامل الموضح هنا طريقة سريعة ودقيقة لقياس تقاربات ربط الأجسام المضادة. يستخدم تحليل MP كمية صغيرة جدًا من المواد، ويمكن تقييم المعلومات الإضافية - بما في ذلك قياس الرزينة ، oligomerization ، والنقاء - من نفس البيانات (الشكل 5). دون تعديلات، وهذا الأسلوب ?...
Disclosures
ليس لدى أصحاب البلاغ ما يكشفون عنه.
Acknowledgements
نشكر كير نيومان على قراءته النقدية للمخطوطة. وقد دعم هذا العمل البرنامج داخل الأمعاء في المعهد الوطني للصحة.
Materials
| Name | Company | Catalog Number | Comments |
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24x24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24x50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
References
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer's Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer - A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved