需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过质量光度法快速测定抗体抗原亲和力
摘要
我们使用质量光度测量 (MP) 来描述抗原-抗体亲和力测量的单分子方法。基于MP的协议是快速,准确,使用非常少量的材料,不需要蛋白质修改。
摘要
测量抗原-抗体相互作用的特异性和亲和力对于医疗和研究应用至关重要。在此协议中,我们描述了一种新的单分子技术,质量光度测量(MP),为此目的的实现。MP 是一种无标签和固定技术,在单分子水平上检测和量化抗体和抗原复合物的分子质量以及数量。MP 在几分钟内分析抗原抗体样品,从而能够精确确定结合亲和力,同时提供有关蛋白质的组细胞和寡聚状态的信息。这是一种简单明了的技术,只需要少量的蛋白质,不需要昂贵的消耗品。同样的程序可用于研究分子质量大于50kDa的蛋白质的蛋白质-蛋白质结合。对于多价蛋白相互作用,可以在一次测量中获得多个结合位点的亲和力。然而,单分子测量模式和缺乏标签存在一些实验限制。该方法在测量亚微摩尔相互作用亲亲度、分子质量为20 kDa或更大的抗原以及相对纯净的蛋白质样品时,可获得最佳效果。我们还描述了使用基本数据分析软件执行所需拟合和计算步骤的过程。
引言
抗体已成为分子生物学的无处不在的工具,并广泛应用于医学和研究应用。在医学方面,它们在诊断中至关重要,但它们的治疗应用也在不断扩大,新的抗体疗法也在不断开发1、2、3、4。抗体的科学应用包括许多不可或缺的实验室技术,如免疫荧光5、免疫沉淀6、流细胞学7、ELISA和西印迹。对于每个应用,获得抗体结合特性的准确测量,包括结合亲和力和特异性,至关重要。
自1990年引进第一台商用表面表面质共振(SPR)仪器以来,光学生物传感器已成为抗体表征的"黄金标准",但包括ELISA在内的其他技术也经常用于测量抗体亲和力8、9。这些方法通常需要对分析的分子进行固定或标记,这可能会影响兴趣的相互作用。它们也相对缓慢,涉及多个检测步骤,然后才能收集结果进行数据分析。最近研制的单分子方法,质量光度测量(MP),当分子降落在显微镜表面时,直接检测溶液中的分子。MP 采用的基于光散射的光学检测不需要蛋白质标记或修改。干涉测量散射显微镜将单个蛋白质分子记录为图像中出现的黑点(图1D),在一分钟的数据采集12中可以检测到几千个分子。每个粒子生成的信号被量化,并计算其对比度值(相对黑暗)。干涉测比值与蛋白质的分子质量成正比,从而可以识别抗原-抗体混合物中的结合和自由物种。同时,通过计算分子着陆事件,MP直接测量物种种群。这为基于 MP 的方法提供了独立量化多个绑定站点的亲缘性的独特功能。
抗原(Ag) 分子与完整抗体 (Ab) 的两个结合位点结合可描述为: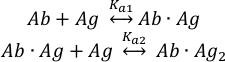
平衡关联常数 Ka1 和 Ka2 定义为:
其中ci和 f i分别表示成分 i 的浓度和分数。总抗原浓度 (cAg)托特可以表示为:
由于抗体(cAb)托特和抗原 (cAg) tot 的总浓度已知 ,此方程可用于直接拟合从 MP 测量中获得的实验组分分数,并计算平衡关联常数 Ka1 和 Ka2( 参见 补充信息)。
MP数据也可用于估计两个抗体结合位点11之间的合作性。对于具有相同微观结合常数的两种抗体副托普,描述 Ab + 种群过程的统计因子阿格和阿布|Ag2复合物规定,表观宏观平衡常数Ka1和Ka2在数值上不相等,而Ka1 = 4Ka2。因此,Ka1 < 4Ka2的实验值表示两个抗体结合位点之间的正合作率。同样,Ka1 > 4Ka2表示负合作性。
抗原-抗体结合亲和力的MP测量速度快,需要少量材料。用于平衡常量计算的MP质量分布提供了有关样品特性的附加信息,并可用于在单个实验中评估样品纯度、寡聚化和聚合。同样的方法可用于测量高亲和力蛋白-蛋白质结合,MP对于研究多价蛋白相互作用特别有用。多蛋白复合物通常具有较大的分子质量,是 MP 检测的最佳选择,单分子数据可用于同时测量组分测量和计算多个结合位点的亲缘性。使用基于批量的方法通常很难获取此信息。
如果不进行修改,目前的协议适用于测量相对高的亲和力,亚微摩尔相互作用的分子质量为20kDa或更大的抗原。为了获得最佳效果,蛋白质储存应具有高纯度,但没有特定的缓冲液要求。通过使用MP,抗原抗体结合可以在五分钟内评估。准确的Kd 计算所需的数据收集和分析可以在 30 分钟内完成。
研究方案
1. 准备流室
- 清洁玻璃盖玻片
- 使用用蒸馏水、乙醇和异丙醇洗瓶,按以下顺序冲洗 24 mm x 50 mm 盖玻片:水、乙醇、水、异丙醇、水。用干净的氮气流擦干盖玻片。重要的是要从上到下冲洗盖玻片,用软尖钳握住底角。以相同方向干燥盖玻片,以避免从钳子中转移污染物(图2A)。
- 同样,用蒸馏水、乙醇和蒸馏水冲洗 24 mm x 24 mm 盖玻片。用干净的氮气流擦干盖玻片。
- 确定盖玻片的工作侧,在清洁盖玻片表面放置一滴蒸馏水,然后按照协议的步骤 3.1~3.2 操作。通常只有 24 mm x 50 mm 盖玻片的一侧具有适合 MP 测量的光学质量。
注:对焦后,不应检测到明显的表面缺陷,数据收集软件中显示的"信号"值应小于0.05%(图1A-C)。包装盒中所有盖玻片的工作侧朝向同一方向。应使用相同的程序来测试盖玻片清洁的效率。
- 组装流室
- 将 24 mm x 24 mm 盖玻片放在一块铝箔上。将双面胶带条放在 24 mm x 24 mm 盖玻片的顶部,如图 2B 所示 ,然后沿玻璃边缘切割胶带。将盖玻片与铝箔分离,并将其连接到 24 mm x 50 mm 盖玻片的工作侧(图 2C)。
注:通道尺寸可能不同,但建议宽度为 3 mm~5 mm。更宽的通道需要更大的采样量,并且非常窄的通道可能难以加载。通常,可以在 24 mm x 24 mm 盖玻片上轻松创建两个平行通道。可以在这里暂停协议。
- 将 24 mm x 24 mm 盖玻片放在一块铝箔上。将双面胶带条放在 24 mm x 24 mm 盖玻片的顶部,如图 2B 所示 ,然后沿玻璃边缘切割胶带。将盖玻片与铝箔分离,并将其连接到 24 mm x 50 mm 盖玻片的工作侧(图 2C)。
2. 为亲和力测量准备抗体抗原样本
- 使用 0.22 μm 注射器过滤器过滤至少 2 mL 的 PBS 缓冲液,以去除灰尘颗粒或集料。以桌面离心机的最大速度(约 16,000 x g)将蛋白质库存离心 10 分钟。
注意:PBS 是此协议的推荐缓冲区,但 MP 没有特定的缓冲区要求,其他生物缓冲区也是可以接受的。然而,高甘油浓度(>10%)和非常低的离子强度(盐浓度 <10 mM)可能会影响图像和数据质量,不建议这样做。 - 通过测量抗体和抗原库存的 280 nm 紫外线吸收度,确定其实际浓度。
- 计算抗原-抗体混合物的测量浓度。如果抗体结合亲和力的估计值尚不清楚,则计划制备具有 30 nM 抗原和 20 nM 抗体浓度的样本。当已知近似亲和力时,抗体与抗原比及其浓度应根据预期的Kd值进行优化。在混合物中使用总抗原浓度,等于预期Kd和以下等式中总抗体浓度的总和。假设抗体的两个副托普的Kd1 = Kd2,这将导致样品中游于自由抗体和抗体抗原复合物的浓度。
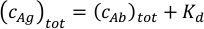
调整抗体浓度,使样品中的总蛋白质浓度在 10 nM 和 50 nM 范围内。使用抗体浓度在5 nM至25 nM之间的混合物获得最佳结果。
注:MP 检测分子质量大于 40 kDa 的蛋白质。因此,分子质量小于40 kDa的抗原样品浓度可以超过典型的50 nM限制。然而,在浓度高于约100 nM时,即使是低分子质量的抗原也可能影响Kd测定的图像质量和精度。 - 在步骤2.3中计算的最终测量浓度下制备50μL的抗体-抗原混合物。
注:K d 测定只需要一个抗原 抗体混合物的样本 。然而,制备几个具有不同抗原与抗体比的样品有助于优化样品浓度。如果收集了多个样本的数据,则可通过全局拟合进行分析。 - 在室温下孵育抗原抗体混合物约10分钟,使结合反应达到化学平衡。避免不必要的长时间孵育时间。
注:孵育时间可能因结合动力学而异。为了确认已达到化学平衡,可以在不同的孵化时间重复样品测量。时间不变的 Kd 值表示孵育时间足够长。长时间的孵育可能导致塑料实验室设备表面的蛋白质吸附显著,从而导致蛋白质浓度测定出现重大错误。因此,强烈建议在MP样品制备13中使用低粘附性实验室软件。
3. 收集大质量光度测量数据
- 在 MP 仪器目标上涂抹一滴显微镜浸入油,将组装的流室放在显微镜舞台上。确保机油跨越盖玻片和目标之间的间隙。
- 加载流室并聚焦质量光度计。
- 将步骤 1 中准备的流室通道一端的清洁过滤缓冲液 10 μL 沉积。液体通过毛细管作用进入通道。
- 调整舞台的 Z 位置,使显微镜聚焦在 24 x 50 mm 盖玻片的工作表面上。
- 在数据收集软件的"焦点控制"选项卡中,使用粗糙阶段移动向上和向下按钮进行初始调整。
- 单击锐度按钮以显示锐度信号读出,并使用精细的向上和向下调整按钮以最大化锐度值。
- 单击"设置焦点"和"锁定焦点"按钮以激活焦点跟踪功能。正确聚焦的图像(图1A,C)的"信号"值应低于0.05%。
注:如果最大锐度位置的"信号"值高于 0.05%,这可能表示玻璃表面或缓冲液中的杂质。
- 使用相同的通道,将抗体抗原样品沉积在通道的一侧,用一小片印迹纸从另一端印迹液体,对样品进行20μL的加载(图2D)。
注:3×5毫米宽通道的体积约为10μL。建议增加样品体积,以完全替换通道中的缓冲液,避免样品稀释。 - 加载示例后,立即单击 "记录" 按钮开始数据收集,获取 100 s 的视频(图 1D)。
- 在数据收集结束时输入文件名,然后单击" 确定" 以保存数据文件。
- 丢弃盖玻片,用棉光拭子用异丙醇擦拭客观透镜中的油。
注意:可以在这里暂停协议。
4. 分析MP数据
- 使用 MP 数据处理软件处理收集的视频文件,以识别着陆事件。
- 使用"文件/打开"菜单选项加载用于分析的文件,然后单击"分析"。
- 单击" 加载 "按钮以加载校准功能,并使用"文件/保存结果 作为菜单"选项保存分析 的数据。
- 将分子质量分布与高斯函数配合使用,以获得样品中每个物种的相对浓度。此分析可以使用常见的科学绘图软件执行(参见 材料表)。
- 使用"绘图/统计.csv图"函数将"事件安装.csv"文件导入软件,并绘制分子质量分布(.csv 文件中的列 M)。
- 双击直方图以打开"绘图 属性" 窗口。禁用自动装箱并选择 2.5 kDa 的箱装尺寸。单击" 应用 "和" 转到 "按钮以创建 "箱中心" 和"计数 " 数据。
- 选择 "Bin 中心和 计数" 列,并使用 "分析/峰值"和"基线/多峰拟 合"菜单功能将直方图与高斯函数配合使用。双击以指示分布图上的近似峰值位置,然后单击"打开 NLFit" 按钮。
- 检查 "xc" 峰值中心的固定复选框,并设置其值,以自由抗体和单和双抗原-抗体复合物的预期分子质量。检查宽度 参数 的"共享"选项。单击"适合 " 按钮。高斯分量的拟合峰值高度值表示样本11中每个物种的相对浓度。
注:可调整装箱大小以优化质量分布图的分辨率。MP 精度限制约为 1 kDa,较小的箱尺寸可能会放大分布的噪声,同时不显示任何其他信息。非常大的箱尺寸会掩盖质量分布的精细细节。
- 使用以下等式计算每个物种的浓度分数:
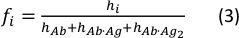
其中hi和fi值分别表示样品中自由抗体和单结合抗体的峰值高度和浓度分数。
5. 计算均衡常数值
- 使用合适的分析软件,将步骤4.3中计算的相互作用物种的浓度分数与Eq.1和2进行拟合。在这里,我们演示一种使用电子表格程序14计算平衡常数的方法( 参见 补充信息)。
- 打开"Kd 计算.xlsx"工作表。在此工作表中,可以修改以黄色突出显示的第 1 行到第 10 行中的单元格值,以执行均衡常量计算。
- 在表中输入 以纳米摩尔 单位为单位的估计 K d 值到单元格 B1 和 B2 中。这些起始值将在装配过程中进行优化。如果估计 的 Kd 值不知道,请保持单元格 B1 和 B2 中的默认值不变。
- 输入细胞D2和E2中( cAb)tot和 (cAg)tot的值。在单元格 F2、G2 和 H2 中输入步骤 4.3 中计算的分数值。如果测量了不同浓度比率的多个样品,则这些样品获得的额外浓度值可以输入第 2 行到第 10 行。
- 选择数据 /解算器 菜单功能。在"$B目标"框中输入"$B$15",在"通过更改可变单元格:"框中输入"$B$1:$B$2"。选择" 到 :"选项的 最小单选 按钮。选中" 使无约束变量非负" 复选框并选择 GRG 非线性作为 求解方法。单击"求 解" 按钮。最佳拟合 Kd1 和 Kd2 值将显示在单元格 B1 和 B2 中,以及单元格 B15 中平方误差的最终总和。
注:如果解算器函数未激活,请在电子表格程序中的"文件"菜单下选择"选项"。在外接程序类别中,选择"非活动应用程序外接程序"下的解算器外接程序,然后单击"转到"按钮。选中解算器外接程序复选框,然后单击"确定"。

图1:质量光度测量图像。(A) 在干净的盖玻片和 ( B ) 上收集的成像缓冲器的代表性本机视图图像,具有表面缺陷。(C) 成像缓冲液和 ( D )AHT+的差分比率图像HT 解决方案。 请单击此处查看此图的较大版本。

图2:MP流室准备和装载。(A) 清洁程序的盖玻片保持位置。(B) 铝箔表面的 24 x 24 mm 盖玻片(中间层)和双面胶带(顶层)的对齐方式(底部层,未显示)。蓝色虚线显示切割线的位置。(C) 具有两个采样通道的装配流室的顶部和侧面视图,以及装配流室的图片。(D) 将样品加载到以前充满缓冲的流通道的过程。 请单击此处查看此图的较大版本。
结果
我们之前已经使用基于MP的α 11研究了人类血栓(HT)和小鼠单克隆抗人类血栓抗体(AHT)的相互作用。由于HT(37 kDa)的分子质量低于40kDa检测限值,因此最大样品浓度可以超过50 nM MP 浓度限制,而不会对质量分布的分辨率产生负面影响。实验计划为定型系列,AHT抗体浓度为25 nM,HT浓度为7.5 nM、15 nM、30 nM、60 nM和120 nM。 图3 显示了抗原抗体混合物和抗体样?...
讨论
此处概述的基于质量光度测量的协议提供了一种快速、准确的测量抗原-抗体结合亲和力的方法。MP 分析使用非常少量的材料,并且可以从相同的数据评估其他信息(包括测定、寡聚化和纯度)(图5)。如果不作修改,此方法适用于在大约 5 nM 至 500 nM 范围内的分离常数的测量,以及分子质量约为 20 kDa 或更大的配体分子的测量。当至少一个结合伙伴的分子质量大于50kDa时,?...
披露声明
作者没有什么可透露的。
致谢
我们感谢基尔·诺伊曼对手稿的批判性阅读。这项工作得到了国家卫生和、国家卫生和、国家卫生和、国家、地膜内方案的支持。
材料
| Name | Company | Catalog Number | Comments |
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24x24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24x50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
参考文献
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer's Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer - A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。