A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
נחישות מהירה של זיקה נוגדנים אנטיגן על ידי פוטומטריה המונית
In This Article
Summary
אנו מתארים גישה של מולקולה אחת למדידות זיקה לאנטיגן-נוגדנים באמצעות פוטומטריה המונית (MP). הפרוטוקול מבוסס MP הוא מהיר, מדויק, משתמש בכמות קטנה מאוד של חומר, ואינו דורש שינוי חלבון.
Abstract
מדידות של הספציפיות והזיקה של אינטראקציות נוגדנים אנטיגן חשובים ביותר עבור יישומים רפואיים ומחקריים. בפרוטוקול זה, אנו מתארים את היישום של טכניקה חדשה של מולקולה אחת, פוטומטריה המונית (MP), למטרה זו. MP היא טכניקה נטולת תוויות ואי-תנועה המזהה ומכומתת מסות מולקולריות ואוכלוסיות של נוגדנים ותסביך נוגדנים ברמת מולקולה אחת. MP מנתח את דגימת האנטיגן-נוגדן בתוך דקות, ומאפשר קביעה מדויקת של הזיקה מחייבת בו זמנית מתן מידע על stoichiometry ואת המצב האוליגומרי של החלבונים. זוהי טכניקה פשוטה וישירה הדורשת רק כמויות picomole של חלבון ולא מתכלים יקרים. אותו הליך יכול לשמש לחקר חלבון חלבון מחייב חלבונים עם מסה מולקולרית גדולה מ 50 kDa. עבור אינטראקציות חלבון רב-לשוניות, ניתן להשיג את הזיקה של אתרי קשירה מרובים במדידה אחת. עם זאת, מצב המדידה של מולקולה אחת וחוסר התיוג כופה כמה מגבלות ניסיוניות. שיטה זו נותנת את התוצאות הטובות ביותר כאשר מוחל על מדידות של זיקה אינטראקציה תת מיקרומולרית, אנטיגנים עם מסה מולקולרית של 20 kDa או יותר, דגימות חלבון טהור יחסית. כמו כן, אנו מתארים את ההליך לביצוע שלבי ההתאמה והחישוב הנדרשים באמצעות תוכנה בסיסית לניתוח נתונים.
Introduction
נוגדנים הפכו לכלים בכל מקום של ביולוגיה מולקולרית והם משמשים בהרחבה הן ביישומים רפואיים והן ביישומים מחקריים. ברפואה, הם חשובים ביותר באבחון, אבל היישומים הטיפוליים שלהם מתרחבים גם טיפולים מבוססי נוגדנים חדשיםמפותחים כל הזמן 1,2,3,4. היישומים המדעיים של נוגדנים כוללים טכניקות מעבדה חיוניות רבות כגון immunofluorescence5, immunoprecipitation6, ציטומטריהזרימה 7, ELISA, ו סופג מערבי. עבור כל אחד מיישומים אלה, השגת מדידות מדויקות של תכונות מחייבות של הנוגדן, כולל זיקה מחייבת וספניות, היא בעלת חשיבות מכרעת.
מאז הוצג המכשיר המסחרי הראשון תהודה פלסמון (SPR) בשנת 1990, biosensors אופטי הפכו "תקן הזהב" של אפיון נוגדנים, אבל טכניקות אחרות, כולל ELISA, משמשים גם באופן שגרתי למדידת זיקהנוגדנים 8,9. שיטות אלה דורשות בדרך כלל קיבוע או תיוג של המולקולות המנותחות, אשר עלולות להשפיע על האינטראקציה של עניין. הם גם איטיים יחסית, מעורבים שלבי בדיקה מרובים לפני שניתן יהיה לאסוף את התוצאות לניתוח נתונים. שיטה שפותחה לאחרונה מולקולה אחת, פוטומטריה המונית (MP), מזהה מולקולות ישירות בת פתרון כאשר הם נוחתים על פני השטח של המיקרוסקופ מכסה אתהנקודה 10,11. הזיהוי האופטי מבוסס פיזור האור שחבר הפרלמנט משתמש בו אינו דורש תיוג או שינוי של חלבונים. מולקולות חלבון בודדות מתועדות על ידי מיקרוסקופ פיזור אינטרפרומטריכתמים כהיםהמופיעים בתמונה ( איור 1D ), וכמה אלפי מולקולות ניתן לזהות במהלך רכישת נתונים שלדקה אחת 12. האות שנוצר על-ידי כל חלקיק בודד מכומת, וערך החדות שלו (חשכה יחסית) מחושב. ערכי הניגוד האינטרפרומטרי פרופורציונליים להמונים המולקולריים של החלבונים, המאפשרים זיהוי של מינים קשורים וחופשיים בתערובת נוגדני האנטיגן. במקביל, על ידי ספירת אירועי נחיתה מולקולרית, חבר הפרלמנט מודד ישירות את אוכלוסיות המינים. הדבר מעניק לשיטות מבוססות MP יכולת ייחודית לכמת באופן עצמאי זיקה לאתרי איגוד מרובים.
קשירה של מולקולותאנטיגן( Ag ) לשני אתרי קשירה של הנוגדןשלם( Ab ) ניתן לתאר כ: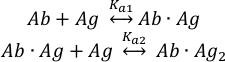
עם קבועי שיוך שיווי המשקל K a1ו- Ka2 המוגדרים כ:
כאשר ci ו- f אני מייצג ריכוז ושבר של הרכיב i, בהתאמה. ריכוז אנטיגן הכולל (cAg)טוט יכול לבוא לידי ביטוי כ:
מאז הריכוזים הכוללים שלהנוגדן( cAb)טוט ואנטיגן (cAg)טוט ידועים, משוואה זו יכולה לשמש כדי להתאים ישירות את שברי הרכיב הניסיוני המתקבלים ממדידות MP ולחשב את קבועי שיוך שיווי המשקל K A1 ו- Ka2 (ראה מידע משלים).
ניתן להשתמש גם בנתונים של MP כדי להעריך שיתוף פעולה בין שני אתרי איגוד הנוגדנים11. עבור שני משטחי נוגדנים עם קבועי קשירה מיקרוסקופיים זהים, הגורמים הסטטיסטיים המתארים את תהליך האוכלוסייה של Ab· אג ואב· קומפלקסים Ag2 מכתיבים כי קבועי שיווי המשקל המקרוסקופיים לכאורה Ka1 ו- Ka2 לא יהיו שווים מבחינה מספרית, ו- Ka1 = 4Ka2. לכן, הערכים הניסיוניים של Ka1 < 4Ka2 מצביעים על שיתוף פעולה חיובי בין שני אתרי איגוד הנוגדנים. באופן דומה, Ka1 > 4K a2מציין שיתוף פעולה שלילי.
מדידות MP של זיקה מחייב נוגדן אנטיגן הם מהירים ודורשים כמות קטנה של חומר. ההתפלגויות ההמוניות של MP המשמשות לחישובים קבועים של שיווי משקל מספקות מידע נוסף אודות מאפייני המדגם ומאפשרות הערכה של טוהר המדגם, אוליגומריזציה וצבירה בניסוי יחיד. ניתן להשתמש באותה שיטה כדי למדוד זיקה גבוהה חלבון חלבון מחייב, ו MP הוא שימושי במיוחד עבור מחקרים של אינטראקציות חלבון רב ואלנט. קומפלקסים מרובי חלבונים בדרך כלל יש מסות מולקולריות גדולות, אופטימלי לגילוי MP, ונתונים מולקולה אחת ניתן להשתמש כדי למדוד stoichiometry ולחשב זיקה של אתרי קשירה מרובים בו זמנית. בדרך כלל קשה להשיג מידע זה בשיטות המבוססות בצובר.
ללא שינויים, הפרוטוקול הנוכחי מתאים למדידות של זיקה גבוהה יחסית, אינטראקציות תת מיקרומולריות עם אנטיגנים של מסה מולקולרית של 20 kDa ומעלה. לקבלת תוצאות מיטביות, מלאי החלבון צריך להיות בעל טוהר גבוה, אך אין דרישות חיץ ספציפיות. באמצעות MP, ניתן להעריך את איגוד נוגדני האנטיגן בפחות מחמש דקות. איסוף הנתונים והניתוח הנדרשים לחישובי KD מדויקים יכולים להתבצע תוך 30 דקות.
Protocol
1. הכן את תאי הזרימה
- נקה את כיסויי הזכוכית
- באמצעות בקבוקי כביסה עם מים מזוקקים, אתנול, ו isopropanol, לשטוף את 24 מ"מ x 50 מ"מ מכסה בסדר הבא: מים, אתנול, מים, isopropanol, מים. יבש את הכיסויים עם זרם של חנקן נקי. חשוב לשטוף את הכיסויים מלמעלה למטה, מחזיקים את הפינה התחתונה עם מדפים רכים. יבש את הכיסויים באותו כיוון כדי למנוע העברת זיהום מהמדפים (איור 2A).
- באופן דומה, יש לשטוף את הכיסויים של 24 מ"מ x 24 מ"מ במים מזוקקים, אתנול ומים מזוקקים. יבש את הכיסויים עם זרם של חנקן נקי.
- זהה את צד העבודה של הכיסוי, מניח טיפת מים מזוקקים על פני השטח של הכיסוי הנקי ובצע את השלבים 3.1-3.2 של הפרוטוקול. בדרך כלל רק צד אחד של כיסוי 24 מ"מ x 50 מ"מ יש את האיכות האופטית המתאימה למדידות MP.
הערה: לאחר התמקדות, אין לזהות פגמים משמעותיים בפני השטח, וערך ה"אות" המוצג בתוכנת איסוף הנתונים צריך להיות פחות מ- 0.05% (איור 1A-C). הצדדים העובדים של כל הכיסויים בתיבה מכוונים לאותו כיוון. יש להשתמש באותו הליך כדי לבדוק את היעילות של ניקוי כיסוי.
- הרכבת תא הזרימה
- מקם את כיסוי 24 מ"מ x 24 מ"מ על פיסת רדיד אלומיניום. מניחים רצועות של סרט הדבקה דו-צדדי על גבי כיסויי 24 מ"מ x 24 מ"מ כפי שמוצג ב-Figure 2B וחותכים את הקלטת לאורך קצה הזכוכית. הפרד את הכיסויים מנייר האלומיניום והצמד אותו לצד העבודה של כיסוי 24 מ"מ x 50 מ"מ (איור 2C).
הערה: גודל הערוץ עשוי להשתנות, אך מומלץ להשתמש ברוחב של 3 מ"מ-5 מ"מ. ערוצים רחבים יותר דורשים נפחי דגימה גדולים יותר וערוצים צרים מאוד עשויים להיות קשים לטעינה. בדרך כלל, שני ערוצים מקבילים ניתן ליצור בקלות על 24 מ"מ x 24 מ"מ coverslip. ניתן להשהות את הפרוטוקול כאן.
- מקם את כיסוי 24 מ"מ x 24 מ"מ על פיסת רדיד אלומיניום. מניחים רצועות של סרט הדבקה דו-צדדי על גבי כיסויי 24 מ"מ x 24 מ"מ כפי שמוצג ב-Figure 2B וחותכים את הקלטת לאורך קצה הזכוכית. הפרד את הכיסויים מנייר האלומיניום והצמד אותו לצד העבודה של כיסוי 24 מ"מ x 50 מ"מ (איור 2C).
2. הכן את דגימות נוגדנים אנטיגן עבור מדידות זיקה
- סנן לפחות 2 מ"ל של מאגר PBS באמצעות מסנני מזרק μm 0.22 כדי להסיר חלקיקי אבק או אגרגטים. צנטריפוגה מלאי החלבון במשך 10 דקות במהירות המרבית של צנטריפוגה השולחן (כ 16,000 x גרם).
הערה: PBS הוא המאגר המומלץ עבור פרוטוקול זה, אך ל- MP אין דרישות מאגר מסוימות ומאגרים ביולוגיים אחרים מקובלים גם הם. עם זאת, ריכוזי גליצרול גבוהים (10%). וחוזקות יוניות נמוכות מאוד (ריכוז מלח <10 mM) עשויות להשפיע על איכות התמונה והנתונים ולא מומלץ. - לקבוע את הריכוזים בפועל של מניות הנוגדנים ואנטיגן על ידי מדידת ספיגת UV 280 ננוום שלהם.
- לחשב את ריכוזי המדידה של תערובת נוגדני האנטיגן. אם הערך המשוער של זיקה מחייבת נוגדנים אינו ידוע, תכנן להכין מדגם עם אנטיגן 30 ננונומגה וריכוז נוגדנים 20 ננומגה. כאשר הזיקה המשוערת ידועה, יש לייעל את יחס הנוגדן לאנטיגן ואת הריכוזים שלהם בהתאם לערכי KD הצפויים. השתמש בריכוז האנטיגן הכולל בתערובת השווה לסכום ה- KD הצפוי ולריכוז הנוגדנים הכולל במשוואה שלהלן. בהנחה KD1 = Kd2 עבור שני paratopes של הנוגדן, זה יגרום ריכוזים דומים של נוגדן חינם ואת קומפלקסים נוגדנים אנטיגן בדגימה.
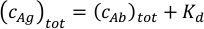
התאימו את ריכוז הנוגדנים כדי לשמור על ריכוז החלבון הכולל בדגימה בטווח של 10 ננוום ו-50 ננומט. התוצאות הטובות ביותר מתקבלות באמצעות תערובות עם ריכוזי נוגדנים בין 5 ננו"מ ל 25 ננומט.
הערה: MP מזהה חלבונים עם מסה מולקולרית הגדולה מ- 40 kDa. כתוצאה מכך, ריכוזי מדגם של אנטיגנים עם מסה מולקולרית קטנה מ 40 kDa יכול לחרוג מגבלת 50 ננומגום טיפוסי. עם זאת, בריכוזים גבוהים יותר מאשר כ 100 ננומגה, אפילו אנטיגנים מסה מולקולרית נמוכה עשויים להשפיע על איכות התמונה ואת הדיוק של קביעת KD. - הכן 50 μL של תערובת נוגדנים אנטיגן בריכוז המדידה הסופי שלה מחושב בשלב 2.3.
הערה: רק מדגם אחד של תערובת נוגדני האנטיגן נדרש לקביעת KD. עם זאת, הכנת מספר דגימות עם אנטיגן שונים ליחסי נוגדנים יכולה לעזור לייעל את ריכוז המדגם. אם נאספים נתונים ממספר דגימות, ניתן לנתח אותם באמצעות התאמה גלובלית. - הדגירה את תערובת נוגדני האנטיגן במשך כ -10 דקות בטמפרטורת החדר כדי לאפשר לתגובת הכריכה להגיע לשיווי משקל כימי. הימנע פעמים דגירה ארוכות שלא לצורך.
הערה: זמן הדגירה עשוי להשתנות בהתאם לקינטיקה המחייבת. כדי לאשר כי שיווי המשקל הכימי הושג, מדידות מדגם ניתן לחזור על עצמם בזמני דגירה שונים. ערכי Kd של זמן-invariantמצביעים על דגירה ארוכה מספיק. דגירה ממושכת עלולה להוביל לריחוף חלבונים משמעותי אל פני השטח של כלי המעבדה מפלסטיק, וכתוצאה מכך לשגיאות משמעותיות בקביעת ריכוז החלבון. מסיבה זו, labware הידבקות נמוכה מומלץ מאוד להכנת מדגם MP13.
3. לאסוף את נתוני פוטומטריה המונית
- החל טיפה של שמן טבילה מיקרוסקופ על המטרה מכשיר MP ולהחיל את תא הזרימה התאספו על שלב המיקרוסקופ. ודא שהשמן משתרע על פני הפער בין הכיסוי לבין המטרה.
- טען את תא הזרימה ומקד את הפומטר ההמוני.
- הפקד 10 μL של פתרון מאגר נקי ומסונן בקצה אחד של ערוץ תא הזרימה שהוכן בשלב 1. נוזל ייכנס לערוץ בפעולה נימית.
- התאם את מיקום ה- Z של השלב כדי למקד את המיקרוסקופ על משטח העבודה של כיסוי 24 x 50 מ"מ.
- בכרטיסיה בקרת מיקוד של תוכנת איסוף הנתונים, השתמש בלחצנים 'למעלה ולמטה' בתנועת השלבים גסים כדי לבצע את ההתאמות הראשוניות.
- לחצו על הלחצן Sharpness כדי להציג את קריאת האות החדות ולהשתמש בלחצני ההתאמה העדינים למעלה ולמטה כדי למקסם את הערך Sharpness.
- לחץ על הלחצנים הגדר מוקד ונעל מוקד כדי להפעיל את פונקציית המעקב אחר המוקד. תמונה ממוקדת כראוי (איור 1A,C) צריכה להיות בעל ערך "אות" מתחת ל- 0.05%.
הערה: אם הערך "אות" במיקום החדות המרבי הוא מעל 0.05%, הדבר עשוי להצביע על זיהומים על משטח הזכוכית או במאגר.
- באמצעות אותו ערוץ, לטעון 20 μL של מדגם נוגדן אנטיגן על ידי הפקדת אותו בצד אחד של התעלה ורוקן את הנוזל מה הקצה השני עם פיסת נייר סופג קטנה (איור 2D).
הערה: עוצמת הקול של ערוץ ברוחב 3-5 מ"מ היא כ- 10 μL. אמצעי האחסון הנוסף לדוגמה מומלץ להחליף לחלוטין את המאגר הנוכחי בערוץ ולהימנע מדללול דגימה. - לאחר טעינת הדגימה, לחץ מיד על לחצן הקלט כדי להתחיל באיסוף נתונים, ורכש סרטון של 100 שניות (איור 1D).
- בסוף איסוף הנתונים הזן את שם הקובץ ולחץ על אישור כדי לשמור את קובץ הנתונים.
- השליכו את הכיסויים ונגבו את השמן מהעדשה האובייקטיבית עם ספוגיות כותנה אופטיות רטובות עם isopropanol.
הערה: ניתן להשהות את הפרוטוקול כאן.
4. לנתח את נתוני MP
- עבד את קובץ הווידאו שנאסף באמצעות תוכנת עיבוד הנתונים MP כדי לזהות את אירועי הנחיתה.
- השתמש באפשרות התפריט קובץ/פתיחה כדי לטעון את הקובץ עבור הניתוח ולחץ על נתח.
- לחצו על הלחצן 'טען' כדי לטעון את פונקציית הכיול ולשמור את הנתונים שנותחו באמצעות אפשרות התפריט 'קובץ/שמור תוצאות בשם'.
- התאם את התפלגות המסה המולקולרית עם פונקציות גאוסיאניות כדי להשיג ריכוזים יחסיים של כל מין בדגימה. ניתוח זה יכול להתבצע באמצעות תוכנת גרפים מדעית נפוצה (ראה רשימת חומרים).
- יבא את הקובץ "eventsFitted.csv" לתוכנה והתוות את התפלגות המסה המולקולרית (עמודה M בקובץ .csv) באמצעות הפונקציה התוויה/סטטיסטיקה/היסטוגרמה.
- לחץ פעמיים על ההיסטוגרמה כדי לפתוח את החלון מאפייני התוויה. הפוך את האון-קישור האוטומטי ללא זמין ובחר גודל סל של 2.5 kDa. לחץ על הלחצנים החל ודרך כדי ליצור את הנתונים מרכזי סל וספירה.
- בחר את העמודות מרכזי סלים וספירות ולהשתמש בפונקציית התפריט ניתוח/פסגות ו- Baseline/Multiple Peak Fit כדי להתאים את ההיסטוגרמה לפונקציות גאוסיאניות. לחץ פעמיים כדי לציין את מיקומי השיא המשוערים בהתווית ההפצה ולאחר מכן לחץ על לחצן פתח NLFit.
- בדוק את תיבות הסימון הקבועות עבור מרכזי השיא "xc" והגדר את ערכיהם למסות המולקולריות הצפויות של הנוגדן החופשי ולתסבימי נוגדני האנטיגן הבודדים והכפילים. בדוק את האפשרות שיתוף עבור פרמטרי הרוחב. לחץ על לחצן התאם. ערכי שיא הגובה המותאמים של הרכיבים הגאוסיאניים מייצגים את הריכוז היחסי של כל מין בדגימה11.
הערה: ניתן להתאים את גודל התאם את גודל התאם כדי למטב את הרזולוציה של התוויית ההפצה ההמונית. מגבלת הדיוק של MP היא כ- 1 kDa, וגדלי סלים קטנים יותר עשויים להגביר את רעש ההפצה, מבלי לחשוף מידע נוסף. גדלי סלים גדולים מאוד יטשטשו את הפרטים הקטנים של הפצות המוניות.
- חשב את שבר הריכוז של כל מין באמצעות המשוואה הבאה:
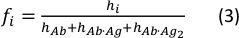
כאשר ערכי hi ו- fi מייצגים שיא גבהים ושברי ריכוז של הנוגדן החופשי והנוגדן החד-כרוך בדגימה, בהתאמה.
5. חשב ערכים קבועים של שיווי משקל
- התאם את שברי הריכוז של מיני האינטראקציה המחושבים בשלב 4.3 עם Eq. 1 ו- 2 באמצעות תוכנה אנליטית מתאימה. כאן אנו מדגימים שיטה לחישוב קבועי שיווי משקל באמצעות תוכנית גיליוןאלקטרוני 14 (ראה מידע משלים).
- פתח את גליון העבודה "חישוב Kd.xlsx" . בגליון עבודה זה, ניתן לשנות את ערכי התא בשורות 1 עד 10 המסומן בצהוב כדי לבצע את חישובי קבועי שיווי המשקל.
- הזן את ערכי Kd המשוערים ביחידות ננו-מולאר לתאים B1 ו- B2 בטבלה. ערכים התחלתיים אלה ימוטבו בהליך ההתאמה. אם ערכי K d המשוערים אינם ידועים, השאר את ערכי ברירת המחדל בתאים B1 ו- B2 ללא שינוי.
- הזן את הערכים של (cAb)tot ו- (cAg)tot ביחידות ננו-מולאר לתאים D2 ו- E2. הזן את ערכי השבר המחושבים בשלב 4.3 בתאים F2, G2 ו- H2. אם נמדדו דגימות מרובות ביחסי ריכוז שונים, ניתן להזין ערכי ריכוז נוספים המתקבלות עבור דגימות אלה בשורות 2 עד 10.
- בחר בפונקציית התפריט Data/Solver. הזן "$B$15" בתיבה "הגדר מטרה" ו- "$B$1:$B$2" בתיבה "על-ידי שינוי תאים משתנים:". בחר בלחצן האפשרויות Min עבור האפשרות אל: . סמן את תיבת הסימון הפוך משתנים ללא הגבלה ללא שלילי ובחר GRG לא ליניארי כשיטה לפתרון. לחץ על לחצן פתור. הערכים Kd1 ו- Kd2 המתאימים ביותר יוצגו בתאים B1 ו- B2 ואת הסכום הסופי של שגיאות בריבוע בתא B15.
הערה: אם הפונקציה Solver אינה פעילה, בחר אפשרויות תחת תפריט קובץ בתוכנית הגיליון האלקטרוני. בקטגוריה תוספות, בחר את התוספת Solver תחת תוספות יישומים לא פעילות ולחץ על לחצן עבור. סמן את תיבת הסימון תוספת Solver ולחץ על אישור.

איור 1: תמונות פוטומטריה המוניות. (א)תמונת תצוגה מקורית מייצגת של מאגר ההדמיה שנאסף על קוכיסוי נקי ו-( B ) על קו כיסוי עם פגמים במשטח. (C) תמונה דיפרנציאלית של מאגר ההדמיהו-( D ) AHT· פתרון HT. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הכנה וטעינה של תא זרימה MP. (א)עמדת החזקת כיסוי עבור הליך הניקוי. (B) יישור של כיסוי 24 x 24 מ"מ (השכבה האמצעית) ואת הסרט הדו צדדי (השכבה העליונה) על פני השטח של רדיד אלומיניום (השכבה התחתונה, לא מוצג). קווים מקווקווים כחולים מראים את המיקום של קווים חתוכים. (C)מבט מלמעלה ומחוץ לתא הזרימה שהורכב עם שני ערוצי דגימה, ותמונה של תא הזרימה שהורכב. (D) הליך עבור טעינה לדוגמה לערוץ זרימה שמולא בעבר במאגר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
בעבר בדקנו את האינטראקציה של α-טרומבין אנושי (HT) ונוגדן טרומבין אנטי-אנושי עכבר (AHT) באמצעות ה- MP מבוסס assay11. מאז המסה המולקולרית של HT (37 kDa) הוא מתחת לגבול זיהוי 40 kDa, ריכוז המדגם המרבי יכול לחרוג ממגבלת ריכוז 50 ננומטרי מגה פיקסל מבלי להשפיע לרעה על הרזולוציה של הפצות המוניות. הניסו...
Discussion
פרוטוקול Mass Photometry המתואר כאן מספק שיטה מהירה ומדויקת למדידת זיקה לקשירת נוגדנים אנטיגן. ניתוח MP משתמש בכמות קטנה מאוד של חומר, ומידע נוסף – כולל סטואיכימטריה, אוליגומריזציה וטוהר – ניתן להעריך מאותם נתונים (איור 5). ללא שינויים, שיטה זו חלה על המדידות של קבועי דיסוציאציה בט...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לקייר נוימן על הקריאה הביקורתית של כתב היד. עבודה זו נתמכה על ידי התוכנית האינטרא-מורלית של ה-NHLBI, NIH.
Materials
| Name | Company | Catalog Number | Comments |
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24x24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24x50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
References
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer's Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer - A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved