Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kitle Fotometrisi ile Antikor-Antijen Affinitesinin Hızlı Tayini
Bu Makalede
Özet
Biz kitle fotometri (MP) kullanarak antijen-antikor afinite ölçümleri için tek moleküllü bir yaklaşım açıklar. MP tabanlı protokol hızlı, doğru, malzeme çok az miktarda kullanır ve protein modifikasyonu gerektirmez.
Özet
Antijen-antikor etkileşimlerinin özgüllüğü ve yakınlığının ölçüleri tıbbi ve araştırma uygulamaları için kritik öneme bağlıdır. Bu protokolde, bu amaçla yeni bir tek molekültekniği olan kütle fotometrisinin (MP) uygulanmasını açıklıyoruz. MP, moleküler kütleleri ve antikor ve antikor komplekslerinin popülasyonlarını tek moleküllü düzeyde algılayan ve ölçen etiket ve hareketsiz bir tekniktir. MP birkaç dakika içinde antijen-antikor örneğini analiz eder, bağlayıcı afinite kesin belirlenmesi için izin ve aynı anda stokiyometri ve proteinlerin oligomerik durumu hakkında bilgi sağlayan. Bu protein ve hiçbir pahalı sarf malzemeleri sadece pikomol miktarları gerektiren basit ve basit bir tekniktir. Aynı prosedür, moleküler kütlesi 50 kDa'dan büyük olan proteinler için protein-protein bağlanmasını incelemek için de kullanılabilir. Çok valent protein etkileşimleri için, birden fazla bağlama sitelerinin yakınlıkları tek bir ölçümde elde edilebilir. Ancak, tek moleküllü ölçüm modu ve etiketleme eksikliği bazı deneysel sınırlamalar getirir. Bu yöntem, alt mikromolar etkileşim yakınlıklarının, moleküler kütleli 20 kDa veya daha büyük antijenlerin ve nispeten saf protein örneklerinin ölçümlerine uygulandığında en iyi sonuçları verir. Ayrıca, temel veri analizi yazılımını kullanarak gerekli montaj ve hesaplama adımlarını gerçekleştirme prosedürünü de açıklarız.
Giriş
Antikorlar moleküler biyolojinin her yerde bulunan araçları haline gelmiştir ve hem tıbbi hem de araştırma uygulamalarında yaygın olarak kullanılmaktadır. Tıpta, onlar kritik tanı önemlidir, ama onların terapötik uygulamaları da genişletiyor ve yeni antikor tabanlı tedaviler sürekligeliştirilmektedir 1,2,3,4. Antikorların bilimsel uygulamaları arasında immünoresans5,immünopredikasyon6,akış sitometrisi7, ELISA ve batı lekelenme gibi birçok vazgeçilmez laboratuvar tekniği bulunmaktadır. Bu uygulamaların her biri için, bağlanma yakınlığı ve özgüllüğü de dahil olmak üzere antikor bağlayıcı özelliklerinin doğru ölçümlerinin alınması çok önemlidir.
İlk ticari yüzey plazmon rezonans (SPR) cihazı 1990 yılında tanıtıldı bu yana, optik biyosensörler antikor karakterizasyonu "altın standart" haline gelmiştir, ancak Diğer teknikler, ELISA dahil olmak üzere, aynı zamanda rutin antikor yakınlıkları ölçmek için kullanılır8,9. Bu yöntemler genellikle immobilizasyon veya potansiyel ilgi etkileşimi etkileyebilir analiz moleküllerinin etiketleme gerektirir. Sonuçlar veri analizi için toplanmadan önce birden çok tahlil adımı içeren nispeten yavaşlardır. Yakın zamanda geliştirilen tek moleküllü bir yöntem olan kütle fotometrisi (MP), mikroskop kapağının yüzeyine indiklerinde molekülleri doğrudan çözeltide algılar10,11. MP'nin kullandığı ışık saçılımı tabanlı optik algılama protein etiketlemeveya modifikasyon gerektirmez. Bireysel protein molekülleri, görüntüde görünen koyu noktalar olarak interferometrik saçılma mikroskobu tarafından kaydedilir(Şekil 1D), ve birkaç bin molekül bir dakikalık veri toplama sırasında tespit edilebilir12. Her bir parçacık tarafından oluşturulan sinyal ölçülür ve kontrast değeri (göreli karanlık) hesaplanır. İnterferometrik kontrast değerleri proteinlerin moleküler kütleleri ile orantılıdır, bu da antijen-antikor karışımındaki bağlı ve serbest türlerin tanımlanmasına olanak sağlar. Aynı zamanda, moleküler iniş olayları sayarak, MP doğrudan tür popülasyonları ölçer. Bu, MP tabanlı yöntemlere birden çok bağlama alanının benzerliklerini bağımsız olarak ölçmek için benzersiz bir yetenek sağlar.
Antijen(Ag)moleküllerinin bozulmamış antikor(Ab)iki bağlayıcı siteye bağlanması şu şekilde tanımlanabilir: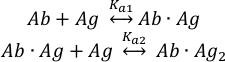
denge ilişkisi sabitleri K a1 ve Ka2 olarak tanımlanır:
ci ve fi bileşenininkonsantrasyonu ve fraksiyonu temsil nerede , sırasıyla. Toplam antijen konsantrasyonu (cAg)tot olarak ifade edilebilir:
Antikor(cAb)tot ve antijen(cAg)tot toplam konsantrasyonları bilindiğinden, bu denklem doğrudan MP ölçümleri elde edilen deneysel bileşen fraksiyonları sığdırmak ve denge ilişkilendirme sabitleri Ka1 ve Ka2 hesaplamak için kullanılabilir (Ek Bilgibakınız).
MP verileri ayrıca iki antikor bağlama siteleri11arasındaki işbirliği tahmin etmek için kullanılabilir. Aynı mikroskobik bağlama sabitlerine sahip iki antikor paratopiniçin Ab popülasyon sürecini açıklayan istatistiksel faktörler · Ag ve Ab· Ag2 kompleksleri görünür makroskopik denge sabitleri Ka1 ve Ka2 sayısal eşit olmaz ve Ka1 = 4Ka2dikte . Bu nedenle, Ka1 < 4Ka2'nin deneysel değerleri iki antikor bağlama alanı arasında pozitif cooperativity gösterir. Benzer şekilde, Ka1 > 4Ka2 negatif cooperativity gösterir.
Antijen-antikor bağlayıcı afinite MP ölçümleri hızlı ve malzeme küçük bir miktar gerektirir. Denge sabit hesaplamaları için kullanılan MP kütle dağılımları örnek özellikleri hakkında ek bilgi sağlar ve tek bir deneyde örnek saflığı, oliomerizasyon ve toplamanın değerlendirilmesini sağlar. Aynı yöntem yüksek afinite protein-protein bağlanmasını ölçmek için kullanılabilir ve MP özellikle çok valent protein etkileşimleri çalışmaları için yararlıdır. Çoklu protein kompleksleri genellikle büyük moleküler kitlelere sahiptir, MP tespiti için optimal, ve tek moleküllü veri stokiyometri ölçmek ve aynı anda birden fazla bağlama sitelerinin afinitelerini hesaplamak için kullanılabilir. Bu bilgileri genellikle toplu tabanlı yöntemler kullanarak elde etmek zordur.
Modifikasyonlar olmadan, mevcut protokol nispeten yüksek afinite, 20 kDa veya daha büyük bir moleküler kütle antijenleri ile alt mikromolar etkileşimleri ölçümleri için uygundur. Optimal sonuçlar için, protein stokları yüksek saflıkta olmalıdır, ancak belirli bir tampon gereksinimleri vardır. MP kullanılarak, antijen-antikor bağlama az beş dakika içinde değerlendirilebilir. Doğru Kd hesaplamaları için gerekli veri toplama ve analiz 30 dakika içinde gerçekleştirilebilir.
Protokol
1. Akış odalarını hazırlamak
- Cam kapakları temizleyin
- Distile su, etanol ve izopropanol ile yıkama şişeleri kullanarak, aşağıdaki sırayla 24 mm x 50 mm kapakları durulayın: su, etanol, su, izopropanol, su. Kapakları temiz bir nitrojen akışı ile kurulayın. Örtüleri yukarıdan aşağıya doğru durulamak ve alt köşeyi yumuşak uçlu çelişlerle tutmak önemlidir. Coverslip'i, kirlenmenin çerterlerden akmasını önlemek için aynı yönde kurutun(Şekil 2A).
- Benzer şekilde, 24 mm x 24 mm kapakları distile su, etanol ve distile su ile durulayın. Kapakları temiz bir nitrojen akışı ile kurulayın.
- Kapak kaymasının çalışma tarafını belirleyin, temiz kapak fişinin yüzeyine bir damla distile su yerleştirin ve protokolün 3.1-3.2. Genellikle 24 mm x 50 mm'lik kapak lı kapağın sadece bir tarafı MP ölçümleri için uygun optik kaliteye sahiptir.
NOT: Netlemeden sonra önemli yüzey kusurları tespit edilmemeli ve veri toplama yazılımında gösterilen "sinyal" değeri %0,05'ten az olmalıdır(Şekil 1A-C). Kutudaki tüm kapakların çalışma kenarları aynı yönde yönlendirilir. Aynı prosedür, kapaklı temizliğin verimliliğini test etmek için kullanılmalıdır.
- Akış odasını birleştirin
- 24 mm x 24 mm kapak lı kapağı alüminyum folyo parçasıüzerine yerleştirin. Şekil 2B'de gösterildiği gibi 24 mm x 24 mm kapak kapağının üzerine çift taraflı bant şeritler yerleştirin ve bandı camın kenarı boyunca kesin. Kapak kapağını alüminyum folyodan ayırın ve 24 mm x 50 mm kapak lının çalışma tarafına takın(Şekil 2C).
NOT: Kanal boyutu değişebilir, ancak 3 mm-5 mm genişliğinde olması önerilir. Daha geniş kanallar daha büyük örnek hacimleri gerektirir ve çok dar kanallarıyüklemek zor olabilir. Genellikle 24 mm x 24 mm kapak üzerinde iki paralel kanal kolayca oluşturulabilir. Protokol burada duraklatılmış olabilir.
- 24 mm x 24 mm kapak lı kapağı alüminyum folyo parçasıüzerine yerleştirin. Şekil 2B'de gösterildiği gibi 24 mm x 24 mm kapak kapağının üzerine çift taraflı bant şeritler yerleştirin ve bandı camın kenarı boyunca kesin. Kapak kapağını alüminyum folyodan ayırın ve 24 mm x 50 mm kapak lının çalışma tarafına takın(Şekil 2C).
2. Afinite ölçümleri için antikor-antijen örneklerini hazırlamak
- Toz partiküllerini veya agregalarını temizlemek için 0,22 μm şırınga filtreleri kullanarak PBS tamponunun en az 2 mL'sini filtreleyin. Protein stoğunu masa üstü santrifüjün maksimum hızında 10 dakika (yaklaşık 16.000 x g)santrifüj edin.
NOT: PBS bu protokol için önerilen arabellektir, ancak MP'nin belirli bir arabellek gereksinimleri yoktur ve diğer biyolojik arabellekler de kabul edilebilir. Ancak, yüksek gliserol konsantrasyonları (>10%) ve çok düşük iyonik mukavemetler (tuz konsantrasyonu <10 mM) görüntü ve veri kalitesini etkileyebilir ve tavsiye edilmez. - 280 nm UV absorbansını ölçerek antikor ve antijen stoklarının gerçek konsantrasyonlarını belirleyin.
- Antijen-antikor karışımının ölçüm konsantrasyonlarını hesaplayın. Antikor bağlayıcı afinite sinin tahmini değeri bilinmiyorsa, 30 nM antijen ve 20 nM antikor konsantrasyonu içeren bir numune hazırlamayı planlayın. Yaklaşık yakınlık bilindiğinde, antijen oranına ve konsantrasyonlarına kadar antikor beklenen K d değerlerine göre optimize edilmelidir. Karışımdaki toplam antijen konsantrasyonu, beklenen K d toplamına eşit ve aşağıdaki denklemdeki toplam antikor konsantrasyonu kullanın. Antikorikiparatopları için Kd1 = Kd2 varsayarsak, bu örnekte serbest antikor ve antikor-antijen kompleksleri karşılaştırılabilir konsantrasyonlarda neden olacaktır.
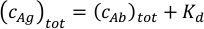
Örnekteki toplam protein konsantrasyonu 10 nM ve 50 nM aralığında tutmak için antikor konsantrasyonu ayarlayın. En iyi sonuçlar 5 nM ile 25 nM arasında antikor konsantrasyonu olan karışımlar kullanılarak elde edilir.
NOT: MP, moleküler kütlesi 40 kDa'dan büyük olan proteinleri algılar. Sonuç olarak, moleküler kütlesi 40 kDa'dan küçük olan antijenlerin numune konsantrasyonları tipik 50 nM sınırını aşabilir. Ancak, yaklaşık 100 nM'den yüksek konsantrasyonlarda, düşük moleküler kütleli antijenler bile Kd tayininin görüntü kalitesini ve doğruluğunu etkileyebilir. - Adım 2.3'te hesaplanan son ölçüm konsantrasyonunda antikor-antijen karışımının 50 μL'sini hazırlayın.
NOT: Kd tayini için sadece bir antijen-antikor karışımı örneği gereklidir. Ancak, antikor oranları farklı antijen ile çeşitli örnekler hazırlanması örnek konsantrasyonu optimize yardımcı olabilir. Birkaç örnekten veri toplanırsa, bunlar genel bir uyum yoluyla analiz edilebilir. - Antijen-antikor karışımını(lar) oda sıcaklığında yaklaşık 10 dakika kuluçkaya yatırarak bağlayıcı reaksiyonun kimyasal dengeye ulaşmasını bekleyin. Gereksiz yere uzun kuluçka süreleri kaçının.
NOT: Kuluçka süresi bağlayıcı kinetiklere bağlı olarak değişebilir. Kimyasal dengeye ulaşıldığını doğrulamak için, numune ölçümleri farklı kuluçka zamanlarında tekrarlanabilir. Zaman değişmez Kd değerleri yeterince uzun kuluçka gösterir. Uzun süreli kuluçka plastik labware yüzeyine önemli protein adsorpsiyonyol açabilir ve sonuç olarak, protein konsantrasyonu belirlenmesinde önemli hatalar. Bu nedenle, düşük yapışma labware kuvvetle MP örnek hazırlama için tavsiye edilir13.
3. Toplu Fotometri verilerini toplayın
- MP alet objektifine bir damla mikroskop daldırma yağı uygulayın ve monte edilmiş akış odasını mikroskop aşamasına yerleştirin. Yağın kapak ve amaç arasındaki boşluğu kapladığından emin olun.
- Akış odasını yükleyin ve kütle fotometresini odakla.
- 1. adımda hazırlanan akış odası kanalının bir ucunda temiz, filtrelenmiş tampon çözeltisinin 10 μL'sini yatırın. Sıvı kılcal eylem ile kanala girecek.
- 24 x 50 mm'lik kapak kaymasının çalışma yüzeyine mikroskobu odaklayacak şekilde sahnenin Z konumunu ayarlayın.
- Veri toplama yazılımının Odak Denetimi sekmesinde, ilk ayarlamaları yapmak için kaba sahne hareketi Yukarı ve Aşağı düğmelerini kullanın.
- Netlik sinyali okumasını göstermek için Netlik düğmesini tıklatın ve Netlik değerini en üst düzeye çıkarmak için ince Yukarı ve Aşağı ayarlama düğmelerini kullanın.
- Odak izleme işlevini etkinleştirmek için Odak'ı Ayarla ve Odak'ı Kilitle düğmelerini tıklatın. Düzgün odaklanmış bir görüntü(Şekil 1A,C)%0,05'in altında "sinyal" değerine sahip olmalıdır.
NOT: Maksimum netlik konumundaki "sinyal" değeri %0,05'in üzerindeyse, bu cam yüzeyinde veya tamponda yabancı maddelerini gösterebilir.
- Aynı kanalı kullanarak, antikor-antijen örneğinin 20 μL'sini kanalın bir tarafına tevdi ederek ve sıvıyı küçük bir leke leme kağıdı parçasıyla diğer ucundan blotlayarak yükleyin(Şekil 2D).
NOT: 3-5 mm genişliğindeki kanalın hacmi yaklaşık 10 μL'dir. Ek örnek hacmi tamamen kanalda bulunan arabellek yerine ve örnek seyreltme önlemek için önerilir. - Örneği yükledikten sonra, veri toplamaya başlamak için hemen Kaydet düğmesini tıklatarak 100'lü bir video(Şekil 1D)elde edin.
- Veri toplamanın sonunda dosya adını girin ve veri dosyasını kaydetmek için Tamam'ı tıklatın.
- Kapakları atın ve izopropanol ile ıslak pamuk optik bezleri ile objektif lens yağı silin.
NOT: Protokol burada duraklatılabilir.
4. MP verilerini analiz edin
- İniş olaylarını tanımlamak için MP veri işleme yazılımını kullanarak toplanan video dosyasını işleyin.
- Çözümleme için dosyayı yüklemek için Dosya/Aç menüsü seçeneğini kullanın ve Analiz et'itıklatın.
- Kalibrasyon işlevini yüklemek ve çözümlenen verileri Dosya/Sonuçları Menü Olarak Kaydet seçeneğini kullanarak kaydetmek için Yükle düğmesini tıklatın.
- Örnekteki her türün göreceli konsantrasyonlarını elde etmek için moleküler kütle dağılımını Gauss fonksiyonlarıyla bağdartır. Bu analiz ortak bir bilimsel grafik yazılımı kullanılarak gerçekleştirilebilir (bkz. Malzeme Tablosu).
- "eventsFitted.csv" dosyasını yazılıma aktarın ve Plot/Statistics/Histogram işlevini kullanarak moleküler kütle dağılımını (.csv dosyasındaki M sütunu) çizin.
- Çizim Özellikleri penceresini açmak için histogramA çift tıklayın. Otomatik binning'i devre dışı bırakıp 2,5 kDa'lık bir depo gözü seçin. Kutu Merkezleri ve Sayımlar verilerini oluşturmak için Uygula ve Git düğmelerini tıklatın.
- Kutu Merkezleri ve Sayımlar sütunlarını seçin ve histogramı Gaussian işlevlerine sığdırmak için Analiz/Tepeler ve Taban Çizgisi/Çoklu Tepe Sığdır menüsü işlevini kullanın. Dağıtım çizimindeki yaklaşık tepe konumlarını belirtmek için çift tıklatın ve ardından NLFit'i Aç düğmesini tıklatın.
- "xc" tepe merkezleri için Sabit onay kutularını kontrol edin ve değerlerini serbest antikor ve tek ve çift antijen-antikor komplekslerinin beklenen moleküler kütlelerine ayarlayın. Genişlik parametreleri için Paylaş seçeneğini işaretleyin. Sığdır düğmesini tıklatın. Gaussian bileşenlerinin donatılmış tepe yükseklik değerleri örnek11'dekiher türün göreli konsantrasyonunu temsil eder.
NOT: Kütle dağıtım çiziminin çözünürlüğünü en iyi duruma getirmek için depo gözü boyutu ayarlanabilir. MP hassas lık sınırı yaklaşık 1 kDa'dır ve daha küçük depo gözü boyutları, herhangi bir ek bilgi açıklamazken dağıtımın gürültüsünü yükseltebilir. Çok büyük depo gözü boyutları, kütle dağılımlarının ince ayrıntılarını gizletir.
- Aşağıdaki denklemi kullanarak her türün konsantrasyon fraksiyonu hesaplayın:
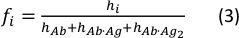
h i ve fi değerleri, serbest antikor ve numunedeki tek ve çift bağlı antikorların tepe yüksekliklerini ve konsantrasyon fraksiyonlarını temsil eder.
5. Denge sabit değerlerini hesaplama
- Uygun bir analitik yazılım kullanarak Eq. 1 ve 2 ile adım 4.3'te hesaplanan etkileşim türlerinin konsantrasyon fraksiyonlarını sığdırın. Burada bir elektronik tablo programı14 kullanarak denge sabitleri hesaplamak için bir yöntem göstermek (Ek Bilgilerbakınız).
- "Kd hesaplama.xlsx" çalışma sayfasını açın. Bu çalışma sayfasında, sarı renkle vurgulanan 1 ile 10 arasındaki satırlarda bulunan hücre değerleri denge sabitleri hesaplamalarını gerçekleştirmek için değiştirilebilir.
- Nanomolar birimlerdeki tahmini Kd değerlerini tablodaki B1 ve B2 hücrelerine girin. Bu başlangıç değerleri montaj prosedüründe optimize edilecektir. Tahmini K d değerleri bilinmiyorsa, B1 ve B2 hücrelerindeki varsayılan değerleri değişmeden bırakın.
- Nanomolar ünitelerde (cAb)tot ve (cAg)tot değerlerini D2 ve E2 hücrelerine girin. F2, G2 ve H2 hücrelerine adım 4.3'te hesaplanan kesir değerlerini girin. Farklı konsantrasyon oranlarında birden fazla numune ölçülürse, bu numuneler için elde edilen ek konsantrasyon değerleri 2-10 satır olarak girilebilir.
- Veri/Çözücü menü işlevini seçin. "Hedef Ayarla" kutusuna "15 $B$" ve "Değişken Hücreleri Değiştirerek:" kutusuna "$B$1:$B$2" girin. To: seçeneği için Min radyo düğmesini seçin. Sınırlandırılmamış Değişkenleri Negatif Olmayan onay kutusunu işaretleyin ve çözme yöntemi olarak GRG Doğrusal Olmayan'ı seçin. Çöz düğmesini tıklatın. En uygun Kd1 ve Kd2 değerleri B1 ve B2 hücresinde ve B15 hücresindeki kare hataların son toplamında gösterilir.
NOT: Çözücü işlevi etkin değilse, elektronik tablo programında Dosya menüsünün altındaki Seçenekler'i seçin. Eklentiler kategorisinde Etkin Olmayan Uygulama Eklentileri altında Çözücü Eklentisi'ni seçin ve Git düğmesini tıklatın. Çözücü Eklentisi onay kutusunu işaretleyin ve Tamam'ıtıklatın.

Şekil 1: Toplu fotometri görüntüleri. (A) Temiz bir kapak kayması üzerinde toplanan görüntüleme tamponunun temsili doğal görüntü görüntüsü ve (B) yüzey kusurları olan bir kapak kayması üzerinde. (C) Görüntüleme tamponunun diferansiyel oranmetrik görüntüsü ve (D) AHT· HT çözeltisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: MP akış odası hazırlama ve yükleme. (A) Temizleme işlemi için kapaklı tutma pozisyonu. (B) Alüminyum folyo yüzeyinde 24 x 24 mm coverslip (orta tabaka) ve çift taraflı bant (üst tabaka) hizalaması (alt tabaka gösterilmez). Mavi kesikçizgiler kesme satırlarının konumunu gösterir. (C) İki örnek kanallı birleştirilmiş akış odasının üst ve yan görünümü ve monte edilmiş akış odasının bir resmi. (D) Daha önce arabellek le doldurulmuş bir akış kanalına örnek yükleme prosedürü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Sonuçlar
Daha önce insan α trombin (HT) ve fare monoklonal anti-insan antimbin antikor (AHT) MP tabanlı test11kullanarak etkileşiminceledik. HT'nin moleküler kütlesi (37 kDa) 40 kDa algılama limitinin altında olduğundan, maksimum numune konsantrasyonu kütle dağılımlarının çözünürlüğünü olumsuz etkilemeden 50 nM MP konsantrasyon sınırlamasını aşabilir. Deney, SABIT 25 nM konsantrasyonda AHT antikorlu titrasyon serisi ve 7.5 nM, 15 nM, 30 nM, 60 nM ve 120 nM konsantrasyonlarda HT ...
Tartışmalar
Burada özetlenen Toplu Fotometri tabanlı protokol antijen-antikor bağlayıcı yakınlıkları ölçme hızlı ve doğru bir yöntem sağlar. MP analizi çok az miktarda malzeme kullanır ve stokiyometri, oliomerizasyon ve saflık da dahil olmak üzere ek bilgiler aynı verilerden değerlendirilebilir(Şekil 5). Modifikasyonlar olmadan, bu yöntem yaklaşık 5 nM ila 500 nM aralığındaki dissosilasyon sabitlerinin ölçümleri ve moleküler kütlesi yaklaşık 20 kDa veya daha büyük ol...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Keir Neuman'a el yazını eleştirel okuduğu için teşekkür ederiz. Bu çalışma NHLBI, NIH intramural programı tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24x24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24x50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
Referanslar
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer's Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer - A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır