Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Быстрое определение антител-антигена Аффинити по массовой фотометрии
В этой статье
Резюме
Мы описываем одномекулярный подход к измерениям сродства антиген-антител с использованием массовой фотометрии (MP). Протокол на основе MP быстр, точен, использует очень небольшое количество материала и не требует модификации белка.
Аннотация
Измерения специфичности и сродства взаимодействий антиген-антител критически важны для медицинского и исследовательского применения. В этом протоколе мы описываем внедрение новой одномекулярной техники, массовой фотометрии (MP), для этой цели. MP — это метод без этикеток и иммобилизации, который обнаруживает и количественно определяет молекулярные массы и популяции антител и антиген-антител на одном молекулярном уровне. Депутат анализирует образец антиген-антитела в течение нескольких минут, что позволяет точно определить связывающее сродство и одновременно предоставлять информацию о стоихиометрии и олигомерном состоянии белков. Это простой и простой метод, который требует только пикомол количества белка и не дорогие расходные расходные материалов. Та же процедура может быть использована для изучения белково-белкового связывания белков с молекулярной массой более 50 кДа. Для многовалентных белковых взаимодействий, сродства нескольких связывающих участков могут быть получены в одном измерении. Однако одномекулярный режим измерения и отсутствие маркировки накладывает некоторые экспериментальные ограничения. Этот метод дает наилучшие результаты при применении к измерениям субмимолярного взаимодействия сродства, антигенов с молекулярной массой 20 кДа или больше, и относительно чистых образцов белка. Мы также описываем процедуру выполнения необходимых этапов установки и расчета с использованием базового программного обеспечения для анализа данных.
Введение
Антитела стали повсеместными инструментами молекулярной биологии и широко используются как в медицинских, так и в научно-исследовательских приложениях. В медицине, они имеют решающее значение в диагностике, но их терапевтическое применение также расширяется и новые антитела на основетерапии постоянно разрабатываются 1,2,3,4. Научное применение антител включает в себя множество незаменимых лабораторных методов, таких как иммунофлуоресценция5,иммунопреципиентация 6,цитометрия потока 7,ELISA и западное blotting. Для каждого из этих применений, получение точных измерений связывающих свойств антитела, включая связывающее сродство и специфичность, имеет решающее значение.
С тех пор как в 1990 году был введен первый коммерческий прибор для производства поверхностных плазмоновых резонансов (SPR), оптические биосенсоры стали «золотым стандартом» характеристики антител, но другие методы, включая ELISA, также регулярно используются дляизмерения сродства антител 8,9. Эти методы обычно требуют иммобилизации или маркировки анализируемых молекул, что потенциально может повлиять на взаимодействие интересов. Они также относительно медленные, включающие несколько этапов анализа, прежде чем результаты могут быть собраны для анализа данных. Недавно разработанный одномекулярный метод, массовая фотометрия (MP), обнаруживает молекулы непосредственно в растворе, когда они приземляются на поверхность микроскопа coverslip10,11. Световое рассеяние на основе оптического обнаружения, которое использует MP, не требует маркировки или модификации белка. Индивидуальные молекулы белка регистрируются интерферометрическим рассеянным микроскопом как темные пятна, появляющиесяна изображении (рисунок 1D),и несколько тысяч молекул могут быть обнаружены в течение одной минуты полученияданных 12. Сигнал, генерируемый каждой отдельной частицей, измеряется количественно, и рассчитывается его контрастное значение (относительная темнота). Значения интерферометрического контраста пропорциональны молекулярным массам белков, что позволяет идентифицировать связанные и свободные виды в смеси антиген-антител. В то же время, подсчитывая молекулярные посадочные явления, депутат напрямую измеряет популяции видов. Это дает методам, основанным на MP, уникальную возможность независимой количественной оценки сродства нескольких связывающих сайтов.
Связывание молекул антигена(Ag) с двумя связывающими участками нетронутого антитела(Ab) может быть описано как: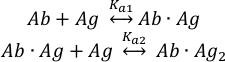
с константами равновесной ассоциации Ka1 и Ka2, определяемыми как:
где ci и fя представляю концентрацию и фракцию компонента i,соответственно. Общая концентрация антигена (cAg)tot может быть выражена как:
Так как общие концентрации антитела (cAb )totи антигена (cAg)tot известны, это уравнение может быть использовано непосредственно для непосредственного времени подходят экспериментальные компонентные фракции, полученные из измерений MP и вычислить константы равновесной ассоциации Ka1 и Ka2 (см. Дополнительную информацию).
Данные MP также могут быть использованы для оценки кооператорности между двумя сайтами связывания антител11. Для двух паратопов антител с идентичными микроскопическими связывающими константами, статистические факторы, описывающие процесс популяции Аб Аг и Аб Ag2 комплексы диктуют, что очевидное макроскопическое равновесие константы Ka1 и Ka2 не будет численно равным, и K a1 и 4Ka2. Таким образом, экспериментальные значения Ka1 lt; 4Ka2 указывают на положительную кооператорность между двумя сайтами связывания антител. Аналогичным образом, Ka1 и 4Ka2 указывает на отрицательную кооператорность.
Измерения MP антиген-антитела связывая сродства быстры и требуют малого количества материала. Массовые распределения MP, используемые для равновесных постоянных расчетов, предоставляют дополнительную информацию о свойствах выборки и позволяют оценить чистоту выборки, олигомеризацию и агрегацию в одном эксперименте. Тот же метод может быть использован для измерения высокой сродства белково-белковой привязки, и MP особенно полезен для исследований многовалентных белковых взаимодействий. Мульти-белковые комплексы обычно имеют большие молекулярные массы, оптимальные для обнаружения MP, и одномекулярные данные могут быть использованы для измерения стоихиометрии и расчета сродства нескольких связывающих участков одновременно. Эта информация, как правило, трудно получить с помощью навалочных методов.
Без изменений текущий протокол подходит для измерений относительно высокого сродства, субмимолярных взаимодействий с антигенами молекулярной массы 20 кДа и больше. Для достижения оптимальных результатов запасы белка должны быть высокой чистоты, но особых требований к буферу не существует. С помощью MP, связывание антиген-антител может быть оценено менее чем за пять минут. Сбор и анализ данных, необходимых для точных расчетов Kd, может быть выполнен в течение 30 минут.
протокол
1. Подготовь камеры потока
- Очистите стеклянные крышки
- Используя мыть бутылки с дистиллированной водой, этанолом и изопропанолом, промыть 24 мм х 50 мм крышки в следующем порядке: вода, этанол, вода, изопропанол, вода. Высушите крышки потоком чистого азота. Важно, чтобы промыть крышки сверху вниз, держа нижний угол с мягкой наконечником типсов. Высушите крышку в том же направлении, чтобы избежать передачи загрязнения от типсов(рисунок 2A).
- Аналогичным образом, промыть 24 мм х 24 мм охватывает с дистиллированной водой, этанолом и дистиллированной водой. Высушите крышки потоком чистого азота.
- Определите рабочую сторону крышки, поместите каплю дистиллированной воды на поверхность чистого крышки и следуйте шагам 3.1-3.2 протокола. Обычно только одна сторона 24 мм х 50 мм крышки имеет оптическое качество подходит для измерения MP.
ПРИМЕЧАНИЕ: После фокусировки не следует обнаруживать существенные поверхностные недостатки, а значение «сигнала», показанное в программном обеспечении для сбора данных, должно быть меньше 0,05%(рисунок 1A-C). Рабочие стороны всех обложек в коробке ориентированы в одном направлении. Та же процедура должна быть использована для проверки эффективности очистки крышки.
- Соберите камеру потока
- Распоить 24 мм х 24 мм крышки на кусок алюминиевой фольги. Поместите полоски односторонней ленты поверх 24 мм х 24 мм крышки, как показано на рисунке 2B и вырезать ленту вдоль края стекла. Отделить крышку от алюминиевой фольги и прикрепить его к рабочей стороне 24 мм х 50 мм крышки(рисунок 2C).
ПРИМЕЧАНИЕ: Размер канала может варьироваться, но рекомендуется ширина от 3 мм до 5 мм. Более широкие каналы требуют больших объемов выборки, и очень узкие каналы могут быть трудно загрузить. Как правило, два параллельных канала могут быть легко созданы на 24 мм х 24 мм крышки. Протокол можно приостановить здесь.
- Распоить 24 мм х 24 мм крышки на кусок алюминиевой фольги. Поместите полоски односторонней ленты поверх 24 мм х 24 мм крышки, как показано на рисунке 2B и вырезать ленту вдоль края стекла. Отделить крышку от алюминиевой фольги и прикрепить его к рабочей стороне 24 мм х 50 мм крышки(рисунок 2C).
2. Подготовка образцов антител-антигенов для измерений сродства
- Фильтруйте не менее 2 мл буфера PBS с помощью шприц-фильтров 0,22 мкм для удаления частиц пыли или агрегатов. Центрифуга белкового бульона в течение 10 минут с максимальной скоростью центрифуги столешницы (примерно 16 000 х г).
ПРИМЕЧАНИЕ: PBS является рекомендуемый буфер для этого протокола, но MP не имеет особых требований буфера, и другие биологические буферы также приемлемы. Тем не менее, высокие концентрации глицерола (10%) и очень низкие ионные сильные стороны (концентрация соли lt;10 mM) могут повлиять на качество изображения и данных и не рекомендуются. - Определите фактические концентрации запасов антител и антигенов, измерив их 280 нм УФ-абсорбанса.
- Рассчитайте измерительные концентрации смеси антиген-антител. Если оценочное значение сродства связывания антител не известно, планируйте подготовить образец с 30 nM антигеном и концентрацией антител 20 nM. Когда известно приблизительное сродство, соотношение антител к антигену и их концентрации должны быть оптимизированы в соответствии с ожидаемыми значениями Kd. Используйте общую концентрацию антигена в смеси, равную сумме ожидаемого Kd и общей концентрации антител в уравнении ниже. Предполагая, что Kd1 и Kd2 для двух паратопов антитела, это приведет к сопоставимым концентрациям свободных антител и антител-антигенных комплексов в образце.
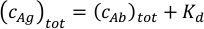
Отрегулируйте концентрацию антител, чтобы сохранить общую концентрацию белка в образце в диапазоне 10 нм и 50 нМ. Наилучшие результаты получены с использованием смесей с концентрацией антител между 5 нм и 25 нм.
ПРИМЕЧАНИЕ: MP обнаруживает белки с молекулярной массой более 40 кДа. Следовательно, выборочных концентраций антигенов с молекулярной массой менее 40 кДа может превышать типичный предел 50 нм. Однако при концентрациях выше примерно 100 нМ даже антигены низкой молекулярной массы могут влиять на качество изображения и точность определения Kd. - Подготовьте 50 МКЛ смеси антител-антигенов при окончательной концентрации измерения, рассчитанной в шаге 2.3.
ПРИМЕЧАНИЕ: Только один образец смеси антиген-антитела требуется для определения Kd. Тем не менее, подготовка нескольких образцов с различными соотношениями антигена к антителам может помочь оптимизировать концентрацию образца. Если данные из нескольких образцов собраны, они могут быть проанализированы с помощью глобальной подгонки. - Инкубировать антиген-антитела смеси (ы) в течение примерно 10 минут при комнатной температуре, чтобы обязательная реакция для достижения химического равновесия. Избегайте излишне долгого инкубации раз.
ПРИМЕЧАНИЕ: Время инкубации может варьироваться в зависимости от привязки кинетики. Чтобы подтвердить, что химическое равновесие было достигнуто, выборочных измерений может быть повторен в разное время инкубации. Значения Time-invariant Kd указывают на достаточно длительный инкубационный период. Длительная инкубация может привести к значительному adsorption белка на поверхность пластиковой лаборатории и, следовательно, к значительным ошибкам в определении концентрации белка. По этой причине, с низким содержанием адгезии labware настоятельно рекомендуется для подготовки образца MP13.
3. Сбор данных о массовой фотометрии
- Нанесите каплю микроскопового масла погружения на цель МП-инструмента и поместите собранную камеру потока на сцену микроскопа. Убедитесь, что масло охватывает разрыв между крышкой и цели.
- Загрузите камеру потока и сосредоточьте массовый фотометр.
- Депозит 10 йл чистого, отфильтрованного буферного решения на одном конце канала камеры потока, подготовленного в шаге 1. Ликвидная жидкость войдет в канал с помощью капиллярного действия.
- Отрегулируйте положение этапа, чтобы сфокусировать микроскоп на рабочей поверхности крышки 24 x 50 мм.
- Во вкладке Focus Control программного обеспечения для сбора данных используйте кнопки грубой стадии Вверх и вниз, чтобы внести первоначальные коррективы.
- Нажмите кнопку Sharpness, чтобы показать считывание сигнала резкости и использовать тонкие кнопки регулировки Up and Down, чтобы максимизировать значение Sharpness.
- Нажмите кнопки Set Focus и Lock Focus, чтобы активировать функцию отслеживания фокусировки. Правильно сфокусированное изображение(рисунок 1A.C)должно иметь значение "сигнал" ниже 0,05%.
ПРИМЕЧАНИЕ: Если значение "сигнал" в максимальной позиции резкости выше 0,05%, это может указывать на примеси на поверхности стекла или в буфере.
- Используя тот же канал, загрузите 20 МКЛ образца антитела-антигена, депонирование его на одной стороне канала и смахивания жидкости с другого конца с небольшим куском бумаги с блоттингом(рисунок 2D).
ПРИМЕЧАНИЕ: Объем канала шириной 3-5 мм составляет примерно 10 мкл. Дополнительный объем выборки рекомендуется полностью заменить буфер, присутствующий в канале, и избежать разбавления образца. - После загрузки образца, немедленно нажмите кнопку Запись, чтобы начать сбор данных, приобретая 100 с видео (Рисунок 1D).
- В конце сбора данных введите имя файла и нажмите OK, чтобы сохранить файл данных.
- Отбросьте крышки и протрите масло из объектива с помощью ватных оптических тампонов, влажных изопропанолом.
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь.
4. Анализ данных MP
- Обработайте собранный видеофейл с помощью программного обеспечения для обработки данных MP для идентификации событий посадки.
- Используйте опцию Файл /Открытое меню, чтобы загрузить файл для анализа и нажмите Анализ.
- Нажмите кнопку нагрузки, чтобы загрузить функцию калибровки и сохранить проанализированные данные с помощью опции Файл/Сохранить результаты как меню.
- Подгонка молекулярного распределения массы с гауссийских функций для получения относительных концентраций каждого вида в образце. Этот анализ может быть выполнен с помощью общего научного программного обеспечения для графики (см. таблицу материалов).
- Импорт файла "eventsFitted.csv" в программное обеспечение и участок молекулярного распределения массы (колонка M в файле .csv) с использованием функции Участок/Статистика/Гистограмма.
- Дважды нажмите на гистограмму, чтобы открыть окно Участка Свойства. Отключите автоматическое биннинг и выберите размер ячеек 2.5 kDa. Нажмите кнопки Применить и Перейти для создания bin центров и графов данных.
- Выберите столбцы Bin Centers and Counts и используйте функцию анализа/пиков и базовых/множественных пиков, чтобы соответствовать гистограмме с функциями Гауссиана. Двойной щелчок, чтобы указать приблизительные пиковые позиции на участке распределения, а затем нажмите кнопку Open NLFit.
- Проверьте фиксированные флажки для пиковых центров "xc" и установите их значения ожидаемым молекулярным массам свободных антител и единым и двойным антигенно-антителам. Проверьте параметр Share для параметров ширины. Нажмите кнопку Fit. Установленные пиковые значения высоты госсских компонентов представляют относительную концентрацию каждого вида в образце11.
ПРИМЕЧАНИЕ: Размер bin может быть скорректирован для оптимизации разрешения участка массового распространения. Предел точности MP составляет примерно 1 кДа, а меньшие размеры ячеек могут усиливать шум дистрибутива, не раскрывая при этом никакой дополнительной информации. Очень большие размеры бункеров заслонят мелкие детали массовых дистрибутивов.
- Рассчитайте концентрацию доли каждого вида, используя следующее уравнение:
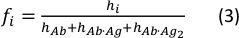
где значения hi и fi представляют пиковые высоты и концентрационые фракции свободных антител и одно- и двойные антитела в образце, соответственно.
5. Рассчитать равновесные постоянные значения
- Подходит для концентрации фракций видов взаимодействия, рассчитанных в шаге 4.3 с Eq. 1 и 2 с помощью подходящего аналитического программного обеспечения. Здесь мы демонстрируем метод расчета равновесных констант с помощью программы электронной таблицы14 (см. Дополнительную информацию).
- Откройте лист "Kd .xlsx" . В этом листе значения ячеев в строках от 1 до 10, выделенных желтым цветом, могут быть изменены для выполнения расчетов равновесных констант.
- Введите предполагаемые значения Kd в наномолярных единицах в ячейки B1 и B2 в таблице. Эти стартовые значения будут оптимизированы в процедуре установки. Если оценочные значения Kd неизвестны, оставьте значения по умолчанию в ячейках B1 и B2 без изменений.
- Введите значения (cAb)tot и (cAg)tot в наномолярных единицах в клетки D2 и E2. Введите значения фракций, рассчитанные в шаге 4.3 в ячейки F2, G2 и H2. При измерении нескольких образцов при различных соотношениях концентрации дополнительные значения концентрации, полученные для этих образцов, могут быть введены строками 2-10.
- Выберите функцию меню Data/Solver. Введите "$B $15" в поле "Set Objective" и "$B$1:$B$2" в поле "Изменение переменных ячеек:" Выберите радиочастотную кнопку Min для опции To:. Проверьте сделать неограниченные переменные не-отрицательный флажок и выберите GRG Nonlinear в качестве метода решения. Нажмите кнопку Solve. Наилучшие значения Kd1 и Kd2 будут показаны в ячейках B1 и B2, а окончательная сумма ошибок в ячейке B15 будет в квадрате.
ПРИМЕЧАНИЕ: Если функция Solver не активна, выберите Параметры в меню файла в программе электронной таблицы. В категории Дополнительные встрой выберите добавление Solver под неактивными дополнениями приложения и нажмите кнопку Go. Проверьте флажок Solver Add-in и нажмите OK.

Рисунок 1: Массовые фотометрические изображения. (A) Представитель родной вид изображения буфера изображения собраны на чистой крышкой и (B) на крышке с поверхностью несовершенства. (C)Дифференциальное соотношение параметрического изображения буфера изображенияи (D) AHT Решение HT. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: MP подготовки камеры потока и погрузки. (A)Позиция холдинга Coverslip для процедуры очистки. (B)Выравнивание крышки 24 x 24 мм (средний слой) и двусторонняя лента (верхний слой) на поверхности алюминиевой фольги (нижний слой, не показан). Синие пунктирной линии показывают расположение линий разреза. (C)Верхний и боковой вид собранной камеры потока с двумя образцами каналов и изображением собранной камеры потока. (D)Процедура загрузки образца в канал потока, ранее заполненный буфером. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Результаты
Ранее мы исследовали взаимодействие человека α-тромбина (HT) и мыши моноклональных антител к тромбину человека (AHT) с использованием MP на основеанализа 11. Поскольку молекулярная масса HT (37 kDa) ниже предела обнаружения 40 кДа, максимальная концентрация образца может превышать о...
Обсуждение
Протокол на основе массовой фотометрии, изложенный здесь, обеспечивает быстрый и точный метод измерения антиген-антител, связывающих сходства. Анализ MP использует очень небольшое количество материала, и дополнительная информация, включая стоихиометрию, олигомеризацию и чистоту, може...
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы благодарим Кейра Ноймана за его критическое прочтение рукописи. Эта работа была поддержана внутримунной программой NHLBI, NIH.
Материалы
| Name | Company | Catalog Number | Comments |
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24x24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24x50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
Ссылки
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer's Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer - A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены