Method Article
إعداد الكبار Drosophila melanogaster لتصوير الدماغ كله أثناء السلوك والمحفزات الاستجابات
In This Article
Summary
نحن نقدم طريقة مصممة خصيصا لتصوير الدماغ كله من Drosophila الكبار أثناء السلوك واستجابة للمحفزات. يتم وضع الرأس للسماح بالوصول البصري إلى الدماغ كله ، في حين أن الذبابة يمكن أن تحرك ساقيها والهوائيات ، وطرف خرطوم ، ويمكن للعيون تلقي المحفزات الحسية.
Abstract
نقدم طريقة تم تطويرها خصيصا لتصوير دماغ Drosophila بأكمله أثناء السلوك المستمر مثل المشي. يتم تحسين تثبيت الرأس وتشريحها لتقليل تأثيرها على السلوك. ويتحقق ذلك أولا باستخدام حامل يقلل من عوائق الحركة. يتم لصق الجزء الخلفي من رأس الذبابة على هذا الحامل بزاوية تسمح بالوصول البصري إلى الدماغ بأكمله مع الاحتفاظ بقدرة الذبابة على المشي والعريس والرائحة والذوق والرؤية. يتم تشريح الجزء الخلفي من الرأس لإزالة الأنسجة في المسار البصري والعضلات المسؤولة عن القطع الأثرية حركة الرأس. يمكن تصوير دماغ الذبابة لاحقا لتسجيل نشاط الدماغ ، على سبيل المثال باستخدام مؤشرات الكالسيوم أو الجهد ، أثناء سلوكيات محددة مثل المشي أو الاستمالة ، واستجابة لمحفزات مختلفة. بمجرد أن يتم إتقان التشريح الصعب ، الذي يتطلب ممارسة كبيرة ، تسمح هذه التقنية بتسجيل مجموعات بيانات غنية تتعلق بنشاط الدماغ بأكمله بالسلوك والاستجابات التحفيزية.
Introduction
وقد عمق تصوير نشاط الدماغ باستخدام تقنيات مختلفة فهم وظيفة الدماغ. في البشر ، وتقنيات تصوير الدماغ لها حدود هامة : في حين أن التصوير بالرنين المغناطيسي الوظيفي (fMRI) يقدم دقة spatio الزمنية أقل بكثير من قرار الخلايا العصبية واحد ، والتقنيات السريعة مثل تخطيط كهربية الدماغ (EEG) يسمح فقط الوصول غير المباشر والجزئي إلى الدماغ1. في نماذج حيوانية كبيرة بما فيه الكفاية مثل القوارض ، وتسجيل أجهزة استشعار النشاط الفلورسنت (على سبيل المثال ، GCaMP) باستخدام المجاهر محمولة على الرأس يسمح لمراقبة نشاط الدماغ في حين أن الحيوان يتحرك في بيئته2. ومع ذلك، فإن هذه التقنيات لا تتيح حاليا الوصول إلا إلى جزء صغير من الدماغ. يمكن تصوير الحيوانات الثابتة الرأس بشكل أكثر شمولا ، ولكن التغطية لا تزال جزئية (على سبيل المثال ، سطح القشرة3). فقط في الحيوانات الصغيرة ، مثل يرقات حمار وحشي ، C. elegans و Drosophila يمكن تصوير الدماغ بأكمله بدقة زمنية ومكانية على مستوى أو بالقرب من الخلايا العصبية الفردية4.
D. melanogaster واعدة بشكل خاص لأنه قد استخدمت منذ فترة طويلة ككائن حي نموذج وراثي5 وقد وضعت أدوات وراثية قوية6. تكملها الشبكة التشريحية الجديدة واسعة النطاق المستمدة من المجهر الإلكتروني 7 ، يمكن أن توفر الذبابة فرصا فريدةلدراسةديناميكيات الدماغ المعقدة المتولدة على شبكة واسعة النطاق8. على الرغم من أن الجلد ليس شفافا ، وبالتالي يجب إزالته لتصوير الدماغ ، إلا أن التصوير الوظيفي في الجسم الحي أصبح مكانا شائعا أكثر وأكثر منذ الدراسة الأولى في عام 20029 وتم نشر العديد من البروتوكولات بالفعل. ومع ذلك، وتشمل هذه الأساليب إما فصل رأس الذبابة عن الجسم10، وتقييد بشدة تحركات الذبابة و / أو الاستجابات للمحفزات11 ، 12،13،14،15، أو السماح فقط صغيرة جزء من الدماغ ليتم تصويرها9،16،25،26،27،17،18،19،20،21،22،23،24. لاستكمال هذه النهج القوية ومع ذلك، وضعنا مؤخرا إعداد لتصوير الدماغ كله أثناء السلوك والاستجابات لمختلف المحفزات28.
هنا ، نبني على هذه الدراسة لتقديم طريقة وضعت خصيصا لتصوير الدماغ كله في حين أن الذبابة تؤدي سلوكا شبه طبيعي (أي المشي والاستمالة) وتستجيب للمحفزات الحسية. ويتحقق ذلك باستخدام حامل مراقبة مصمم لإعطاء إمكانية الوصول إلى الدماغ كله من الجانب الخلفي الخلفي، مع ترك الهوائيات وخرطوم سليمة، والسماح للذبابة لتحريك ساقيها على المشي (على سبيل المثال، على كرة خففت الهواء). وقد تم صقل خطوات تشريح الجزء الخلفي من الرأس للسرعة، والاستنساخ، وتقليل تأثيرها على جدوى وحركة الذبابة.
Protocol
يتم تنفيذ كافة الخطوات تحت منظار مجسم.
1. إعداد حامل
- طباعة حامل 'FlyholderVJove.stl' (انظر المواد التكميلية)مع طابعة ثلاثية الأبعاد أو طباعتها باستخدام الخدمات عبر الإنترنت(الشكل 1A). كل من SLS (النايلون PA12) والانصهار multijet (PA12) هي مناسبة.
- إنشاء فتحة الرأس.
- ضع قطعة من الشريط اللاصق بشكل مستطيل على سطح مستو. قطع شريحة من حوالي 5 ملم × 1 سم. قطع فتحة الرقبة (~ 400 × 400 ميكرومتر) في منتصف الجانب الأطول من الشريط باستخدام شفرات متوازية ثابتة (شفرات مشرط اثنين عالقة معا) لضمان نفس العرض في كل حامل (الشكل 1B).
- وضع الشريط على الجانب تملق من ثقب في حامل على الجانب السفلي (انظر الشكل 1C والشكل 1D). يمكن أن تشوه الشريط عن طريق دفعه إلى أسفل مع ملقط ~ 500 ميكرومتر حول الحفرة. وهذا من شأنه أن يقلل إلى أدنى حد من عرقلة حركات الطيران في وقت لاحق.
- تغطية الشريط وحامل من أعلى مع طلاء الأظافر الأسود لمنع العازلة من التسرب. كما أن طلاء الأظافر الأسود سيحمي عيون الذبابة من ضوء الإثارة للمجهر. دع طلاء الأظافر يجف قبل ساعة على الأقل من استخدام الحامل.
- مرة واحدة طلاء الأظافر الجافة، إضافة ~ 1 ميكرولتر من الشحوم في فتحة الرأس باستخدام الأنسجة المدلفنة لضمان الغراء لن الرطب الجزء الخلفي من رأس الذبابة (الشكل 2A). تأكد من عدم وضع الشحوم خارج الفتحة التي من شأنها أن تمنع الغراء من الالتصاق.
- إنشاء فتحة الجسم (الشكل 2B).
- اختياريا، قم بإعداد الشريط الذي سيتم استخدامه لوضع جسم الذبابة (انظر أدناه) مقدما. استخدم التصميم الموضح في الشكل 2B (أعلى) لقطع قطعة من شريط عرضه ~2 سم في اثنين وقطع شرائح عرضها 1.5 مم. قطع 0.3 ملم الكتفين العميقة وفتحة الجسم. تأكد من أنه يناسب حامل.
ملاحظة: التباين بين أحجام الذباب (خاصة مع الجنس أو العمر أو النمط الجيني أو الأنواع) يمكن أن يجعل من الضروري ضبط تصميم الشريط. إذا كان الرأس يميل إلى أن يكون سوء تركزت، يمكن أن يكون من المفيد إضافة قطعة على شكل حرف V من الشريط مؤقتا على فتحة الرقبة(الشكل 3). أيضا تطبيق عدد قليل من microliters من الشحوم داخل فتحة الرقبة وعلى الشريط على شكل حرف V.
- اختياريا، قم بإعداد الشريط الذي سيتم استخدامه لوضع جسم الذبابة (انظر أدناه) مقدما. استخدم التصميم الموضح في الشكل 2B (أعلى) لقطع قطعة من شريط عرضه ~2 سم في اثنين وقطع شرائح عرضها 1.5 مم. قطع 0.3 ملم الكتفين العميقة وفتحة الجسم. تأكد من أنه يناسب حامل.
2. وضع ذبابة
ملاحظة: الذباب الأنثوي من يوم إلى أربعة أيام مثالي لأن رأس الأنثى أكبر وبالتالي أسهل في التشريح من رأس الذكر ، والذباب الأصغر سنا لديه لطيف أكثر ليونة. لتجارب المشي يمكن زيادة نشاط الذبابة عن طريق مطابقة التجارب مع أوقات النشاط الإيقاعي الأعلى (ZT0 أو ZT11) ، باستخدام المالحة التي تحتوي على الجلوكوز (مثل 103 mM NaCl ، 3 mM KCl ، 5 mM TES ، 8 mM trehalose 2 H2O ، 10 MM الجلوكوز, 26 mM NaHCO3, 1 mM NaH2PO4, 2.5 mM CaCl2· 2 H2O, 4 mM MgCl2·6 H2O), عن طريق تجويع ذبابة تصل إلى 24 ساعة مع بيئة المياه فقط, وتسخين البيئة إلى ~ 28 درجة مئوية خلال التجربة. قص الأجنحة على الأقل يوم واحد مقدما يساعد أيضا على تقليل محاولات الطيران وبالتالي زيادة وتيرة نوبات المشي7،29،30.
- ملء طبق بيتري أو غطاء مربع تلميح ماصة مع الجليد، ووضع الأنسجة المختبرية على رأس الجليد وتعيين حامل رأسا على عقب على ذلك.
- نقل ذبابة على الجليد لشل ذلك عن طريق امتصاصه من قارورته في أنبوب وتهب على الجليد (تأكد من عدم ذوبان الجليد الذي من شأنه أن يغرق الذبابة).
- عندما تتوقف الذبابة عن الحركة، استخدم ملقط مملة لشريحة في حامل مع الرقبة داخل الفتحة (يمكن عقد ذبابة على أساس الجناح) كما هو الحال في الشكل 4 (اليسار). يجب أن تكون العيون في مواقف متساوية فيما يتعلق بجوانب الفتحة(الشكل 4، الوسط). إذا لزم الأمر، إضافة 1 ميكرولتر الشحوم على الجزء العلوي من الرأس لمنع الغراء (انظر الخطوة التالية) من الوصول إلى الجزء الخلفي من الرأس وإزالة في وقت لاحق.
- قم بتغطية الجسم بمنديل وبعض الثلج للتأكد من أن الذبابة لا تتحرك خلال هذه الخطوة والخطوة التالية(الشكل 4، يمين). وثمة خيار آخر لمنع الساقين من الوصول إلى الرأس هو استخدام قطعة من الشريط أسفل الرأس مباشرة (انظر الشكل 6).
3. تأمين الرأس
- ضع الرأس بزاوية 20 درجة تقريبا من منظر خلفي بالكامل (حول المحور الجانبي، انظر الشكل 5A). هذا هو حل وسط بين خفض العمق إلى صورة وعلى الجانب الآخر الحفاظ على الساق الأمامية حرة في التحرك والتقليل من امتداد الرقبة.
- مع الأنسجة المدلفنة(الشكل 5B)،وضع الأشعة فوق البنفسجية الغراء حول الرأس مع تجنب تسخين المنطقة الحسية من الفائدة (الهوائيات، خرطوم و / أو عيون). لتجارب الذوق، سحب خرطوم بها وإضافة الغراء في قاعدتها لمنع الحركة. إذا لم يتم التخطيط لتجربة الذوق ، فمن الأفضل دفع خرطوم في الرأس وثابتة مع الغراء لتقليل الحركة(الشكل 6).
- علاج الغراء مع الأشعة فوق البنفسجية للضوء لمدة 5 ق. تنظيف بعناية المحيطة بالرأس مع الأنسجة المدلفنة لإزالة الغراء السائل المتبقية التي يمكن أن تلتصق الساقين و / أو المناطق الحسية التربة.
ملاحظة: الشريط يمكن أن تكون خشنة مع الصنفرة لزيادة الالتصاق الغراء إذا لزم الأمر. - استخدم شريطا رفيعا من الشريط أو نسيجا ملفوفا لنقل الساقين إلى الأمام (إذا لم تكونا موجودتين بالفعل) ، لذلك لن تتضررا من الخطوة التالية.
4. تحديد موقع الجسم
ملاحظة: يجب تنفيذ هذه الخطوة بسرعة; قبل أن تتعافى الذبابة من التخدير
- إزالة حاوية الثلج وتحويل حامل حولها. إزالة المياه حول ذبابة مع الأنسجة.
- ضع شريط فتحة الجسم (تم إنشاؤه في الخطوة 1) فوق الحفرة وادفع جسم الذبابة برفق إلى الأسفل(الشكل 7). كن حذرا لعدم تمديد الرقبة كثيرا.
5. إغلاق الحفرة
- تغطية أي ثقوب كبيرة المتبقية مع الشريط.
- إضافة ~ 1 ميكرولتر من الشحوم إلى الجزء الخلفي من الرأس وفي منطقة الرقبة للتأكد من عدم وجود الغراء سوف الرطب هناك.
- مع الأنسجة المدلفنة، والطلاء الأشعة فوق البنفسجية الغراء حول وعلى رأس الشريط وعلى الصدر (الجزء الظهري العلوي من mesonotum) لإصلاحه. علاج الغراء مع الأشعة فوق البنفسجية ل ~ 5 ق.
ملاحظة: من المهم تقليل استخدام الأشعة فوق البنفسجية لأنها يمكن أن تؤثر بقوة على صحة الذبابة. - تنظيف الشحوم بعناية والغراء غير المنقص مع الأنسجة المختبرية.
- وضع ~ 1 مل من المالحة على رأس. دفع فقاعات الهواء جانبا مع ملقط. ابحث عن التسربات عن طريق وضع غطاء فوق المالحة وتحويل حامل حولها للتحقق من وجود المالحة على الجانب الأمامي. إذا كان هناك أي تسرب، وإزالة المالحة وإصلاح ثقب (إما عن طريق إضافة المزيد من الغراء أو المزيد من الشحوم).
ملاحظة: يمكن أن يكون هذا وقتا مناسبا للتوقف مؤقتا إذا لزم الأمر. يمكن تقديم ذبابة قطعة صغيرة من الأنسجة أو الكرة الستايروفوم على المشي لمنع الخفقان وتهدئة ذبابة أسفل.
6. تشريح الرأس
ملاحظة: استخدام ملقط شحذ للخطوات التالية. ملقط غرامة جدا حاسمة كما ملقط مملة سيجعل من الصعب فتح لطيف الرأس ويمكن أن يؤدي إلى إصابات إضافية على رأس الذبابة أو الدماغ. التكبير القوي يمكن أن يساعد في هذه المرحلة. لهذا الهدف ، يمكن للمرء أن يستبدل العينين من المجهر مناظير مع 30x العين.
- جعل اثنين من التخفيضات في قاعدة مثلث مائل الظلام المركزي على كل جانب من جوانب الرقبة (انظر الصلبان في الشكل 8A).
- قطع حول المثلث المظلم وإزالة هذا الجزء من لطيف.
- ثقب في الدماغ من خلالها العضلات 16 والمريء الذهاب ينبغي الآن أن تكون مرئية والتحرك بشكل إيقاعي(فيديو 1 يقدم هذه الحركة الإيقاعية في ذبابة مع عضلات الفلورسنت). قرصة بعناية الجزء العلوي من هذه المنطقة لقطع العضلات 16 دون ثقب المريء. إذا توقفت الحركة الإيقاعية للدماغ ، فمن المرجح إزالة العضلات 16 ، ومع ذلك ، فإن الحركة تتوقف في بعض الأحيان وتعاود التشغيل في وقت لاحق. وبالتالي من المهم الانتباه إلى الحركات الإيقاعية وتنفيذ هذه الخطوة مرة أخرى إذا لزم الأمر.
- قطع قطعة المتبقية في قطع صغيرة وإزالتها بعناية. حاول أن لا تسحب على لطيف أكثر من اللازم. بدلا من ذلك استخدام ملقط مثل زوج من مقص، لقطع قطع من الأنسجة. يمكن للمرء أن يبدأ على حواف وسيطة ، حيث تمت إزالة المثلث المظلم من قبل والعمل في طريقه إلى الجانبين.
ملاحظة: يمكن استخدام قطعة من كتل لكشط بلطف من الهيئات الدهون إذا كان موجودا. - إزالة أكياس الهواء قطعة واحدة تلو الأخرى عن طريق الاستيلاء عليها مع ملقط وسحب ببطء وثبات.
النتائج
الإعداد المذكور أعلاه يسمح بمراقبة الدماغ كله تحت المجهر للتصوير ثلاثي الأبعاد على نطاق واسع مثل الفوتونات الكلاسيكية 2 أو المجهر confocal ، ولكن أيضا تقنيات أسرع مثل ورقة الضوء31 وغيرها من تقنيات المجهر الإضاءة المنظمة (استعرضت في32)، أو المجهر حقل الضوء28.
يسمح الوصول إلى الدماغ كله أثناء مراقبة السلوك والحفاظ على الأعضاء الحسية الوظيفية بالإجابة على العديد من الأسئلة.
أولا، ما هو نشاط الدماغ بشكل عام عندما تكون الذبابة في حالة راحة، وأثناء السلوك، وعندما تستجيب للمحفزات؟ على سبيل المثال، نقوم بتضمين البيانات التي تم الحصول عليها باستخدام مجهر حقل الضوء الذي يظهر تنشيط الدماغ أثناء الاستجابات للمحفزات والسلوك. على سبيل المثال ، في الفيديو 2، تم التعبير عن مسبار الكالسيوم في جميع الخلايا العصبية (nsyb-GAL4 و UAS-syt-GCaMP6s (يسار) أو UAS-GCaMP6M (يمين)) وتم تقديم نفخة من الرائحة. لاحظ كيف يسمح التحضير للحصول على لمحة عامة عن نشاط الدماغ أثناء الاستجابة للتحفيز. يمكن استخدام الأدوات الوراثية القوية في Drosophila لتقييد التعبير عن أجهزة الاستشعار هذه إلى أنواع فرعية معينة من الخلايا العصبية. في الفيديو 3, نحن تقييد التعبير عن جهاز استشعار الكالسيوم إلى الخلايا العصبية الدوبامين والسيروتونين (TH-GAL4, DDC-GAL4 وUAS-GCaMP6M). لاحظ النشاط المتزامن القوي فوق الدماغ المرتبط ارتباطا وثيقا بالمشي الذبابي ، المسموح به من خلال مراقبة الدماغ بأكمله أثناء السلوك. بالإضافة إلى نشاط الكالسيوم ، يمكن تصوير إشارات فيزيائية أو كيميائية أخرى (باستخدام أجهزة استشعار على سبيل المثال للجهد28،33، منتجات التمثيل الغذائي34،35 أو أجهزة نوم عصبية محددة36).
لفهم دور نشاط الدماغ بشكل أكثر تحديدا، يمكننا أن نسأل ما هي المناطق المشاركة في أي سلوك أو استجابة للمحفزات أو أنماط النشاط التلقائية. ويمكن بالفعل استخدام البيانات كشاشة غير متحيزة لاستخراج المناطق الوظيفية باستخدام تقنيات مثل تحليل المكونات الرئيسية وتحليل المكونات المستقلة. يظهر الشكل 9A مناطق وظيفية مختلفة بألوان مختلفة. شكل وتوطين المناطق الوظيفية تسمح لرسم خريطة لهم القوالب التشريحية لتحديد مناطق الدماغ وفي بعض الحالات نوع الخلايا العصبية. وعلاوة على ذلك، بمجرد الانحياز إلى القالب التشريحي، يمكن أن يكون متوسط قيم الفلورسينس في مناطق الدماغ التشريحية للتحليل الكمي (انظر الشكل 9B). على سبيل المثال، يظهر نموذج غاوسي هرمي مطبق على البيانات في الشكل 9B أن المناطق أكثر نشاطا أثناء المشي (بمتوسط ΔF/F يبلغ 0.029، 95٪ فاصل زمني موثوق =[0.017 0.041]) ولكن ليس أثناء العريس (متوسط ΔF/F = -0.0049 مع فاصل زمني موثوق بنسبة 95٪ = [-0.016 0.0059]).
إضافة إلى عمق الفهم ، يمكن استخدام التسجيلات المتزامنة لمختلف المناطق الوظيفية المسموح بها من قبل الإعداد لدراسة الخصائص الديناميكية للشبكة الوظيفية. وهذا أمر مهم لأن مناطق الدماغ في جميع الأدمغة التي تمت دراستها حتى الآن مترابطة بشكل متكرر للغاية وتظهر المزيد والمزيد من الدراسات أنه حتى المناطق الحسية تستجيب للدولة السلوكية للحيوان. ويمكن النظر في عدة جوانب مثل خصائص الرسم البياني الوظيفي (مثل الوحدات) والأنماط الزمنية التي يمكن أن تتناسب مع النظم الديناميكية (انظر8 للأمثلة).
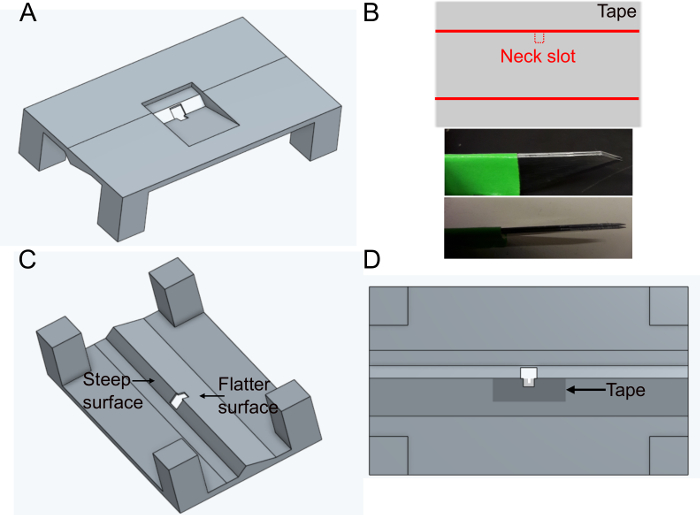
الشكل 1: إعداد الحامل (الخطوة 1). أ)تصميم حامل (عرض من الأعلى). ب)إعداد فتحة الرقبة. أعلى: تصميم الشريط، أسفل: شفرات موازية تستخدم لقطع فتحة الرقبة. ج)عرض حامل من الأسفل. D) عرض أسفل تشير إلى أين لإضافة شريط فتحة الرقبة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
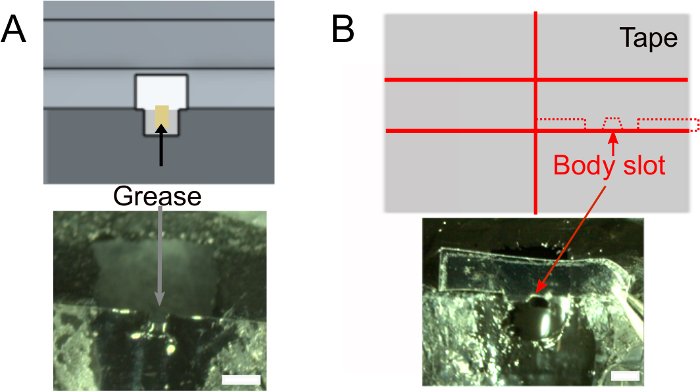
الشكل 2: الاستعدادات الإضافية (الخطوة 1). أ)إضافة الشحوم في فتحة الرقبة لمنع الغراء لتغطية الجزء الخلفي من الرأس ومنع تسرب المالحة. أشرطة مقياس، 1 مم ب) أعلى: شكل قطعة من الشريط التي سيتم استخدامها لدفع الجسم إلى أسفل. أسفل: تأكد من الشريط يناسب حامل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: وضع شريط على شكل حرف V للمساعدة في التوسيط. (أ) عرض أسفل. (ب) العرض العلوي. شريط المقياس، 2 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: ضع الذبابة (الخطوة 2). اليسار، واستخدام اثنين من ملقط مملة لوضع الجسم بحيث الرقبة في فتحة الرقبة. الوسط، محاذاة الرأس. تقع العيون على كلا الجانبين على حواف الفتحة. رأس الذبابة مستقيم. صحيح، دس الذبابة بمنديل مغطى بالثلج لمنعها من الحركة. شريط المقياس، 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: إصلاح الرأس (الخطوة 3). أ)زاوية مثالية من الرأس. ب)إضافة الغراء الأشعة فوق البنفسجية حول الرأس، وتجنب المناطق الحسية ذات الاهتمام. شريط المقياس، 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: يمكن الاحتفاظ طرف خرطوم والهوائيات خالية من الغراء (الخطوة 3). تشير الدائرة البيضاء إلى المنطقة التي تم فيها تطبيق الغراء بالأشعة فوق البنفسجية. يظهر السهم الأجزاء التي تترك خالية من الغراء للتجارب الشمية والعاصفة. لاحظ الشريط الاختياري الذي يمنع الساقين من لمس منطقة الغراء. شريط المقياس، 200 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: ضع الشريط الخلفي (الخطوة 4.2). يستخدم الشريط الذي تم إنشاؤه في الخطوة 1 (انظر الشكل 2، إلى اليسار) لوضع الجسم وتغطية الثقب الكبير في الحامل. شريط المقياس، 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: خطوات التشريح (الخطوة 6). أ-ب) قطع على كل جانب في قاعدة المثلث المظلم (الصلبان) وإزالة هذا الجزء من Cلطيف ). D) و E) إزالة العضلات 16. ثم إزالة بلطف بقية لطيف F), أكياس الهواء G), والعضلات. H) تشريح الرأس. شريط المقياس، 200 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
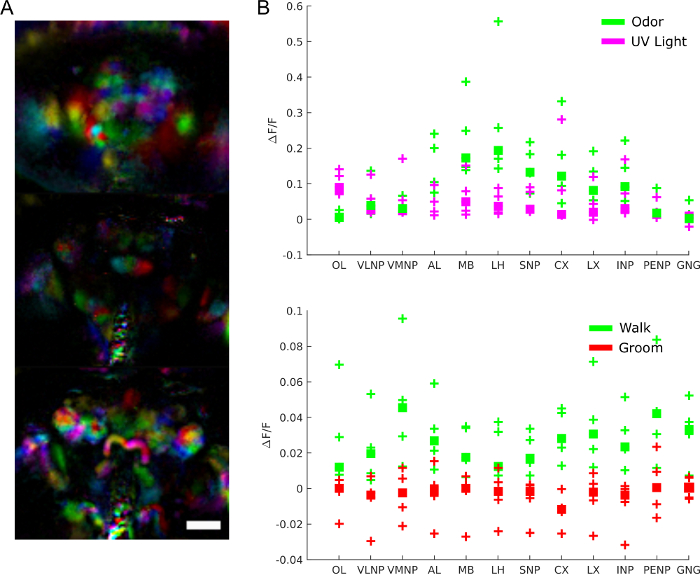
الشكل 9: النتائج التمثيلية. أ)المناطق الوظيفية (المستخرجة باستخدام PCA وICA كما هو الحال في28) لذبابة تعبر عن GCaMP6 عموم الخلايا العصبية صورت مع المجهر حقل الضوء (25x، NA = 0.95 مع مطابقة و / 12 صفيف عدسة صغيرة). شريط مقياس، 100 ميكرومتر ب) متوسط نشاط الكالسيوم في مناطق الدماغ الكبيرة خلال الاستجابات للمحفزات والسلوك (مستنسخة من28). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: حركات العضلات 16 (الخطوة 6.3). تم التعبير عن GFP في العضلات. لاحظ حركة الضخ التي تأتي من الحفرة فوق القصبة الهوائية مباشرة. الرجاء الضغط هنا لتحميل هذا الفيديو.
فيديو 2: نشاط الكالسيوم في عموم الخلايا العصبية أثناء الاستجابة لرائحة لاثنين من الاستعدادات المختلفة. الخل البلسمي كان منتفخا على الطاير. تم تصوير نشاط الكالسيوم عبر الخلايا العصبية (سائق nsyb-GAL4 ، UAS-syt-GCaMP6s إلى اليسار وUAS-GCaMP6M إلى اليمين) بمجهر حقل خفيف (25x ، NA = 0.95 مع مجموعة f/12 microlens مطابقة). ثم أعيد بناء الصور الميدانية الخفيفة كما هو موضح في المرجع28،37. الرجاء الضغط هنا لتحميل هذا الفيديو.
فيديو 3: نشاط الكالسيوم في مجموعة فرعية من نوع الخلايا العصبية أثناء السلوك. تم التعبير عن GCaMP6 في الخلايا العصبية الدوبامين والسيروتونينية (مع TH-GAL4 و DDC-GAL4). بالاقتران مع الأدوات الوراثية الذبابة، وإعداد يسمح لمراقبة زيادة قوية في النشاط في العديد من المناطق أثناء المشي. الرجاء الضغط هنا لتحميل هذا الفيديو.
المواد التكميلية. الرجاء الضغط هنا لتحميل هذا الملف.
Discussion
Drosophila هي واحدة من الحيوانات البالغة النادرة حيث يمكن تصوير الدماغ كله خلال السلوكيات المعقدة. هنا، نقدم طريقة لإعداد الذبابة وتعريض دماغها كله لتصوير نشاط الدماغ كله المستمر. وتجدر الإشارة إلى عدة نقاط هامة.
تشريح صغير مثل D. melanogaster يشكل تحديا. وبالتالي تتطلب هذه الطريقة الكثير من الممارسة والصبر لإتقانها. ومع ذلك ، بعد التدريب ، يستغرق الإجراء أقل من 30 دقيقة وينتج عنه نتائج قابلة للاستنساخ.
الطريقة التي قدمناها لديها قيود إضافية. أولا، إمالة رأس الذبابة من وضعها الطبيعي يؤدي إلى تمديد الرقبة التي يمكن أن تضر النسيج الضام والأعصاب أو العضلات. ثانيا، على الرغم من إمكانية الوصول بصريا إلى المنطقة الفرعية للبطين ( SEZ )، إلا أنها أقل من المريء شبه الشفاف ، مما يقلل من الكثافة والدقة في هذه المنطقة. وأخيرا ، على الرغم من أن حامل بعيد المنال في معظم الاتجاهات ، والذبابة لا يزال يدرك في بعض الأحيان وجودها ويدفع على ذلك في محاولة للهروب.
وعلى الرغم من هذه القيود، فإن البيانات الشاملة التي تم الحصول عليها من تصوير الدماغ بأكمله أثناء السلوك والاستجابات للمحفزات ستجعل من الممكن فك وظيفة الدماغ على مستوى الشبكة بأكملها عندما يتفاعل الحيوان مع البيئات الطبيعية المعقدة ويتنقل فيها.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نشكر هايدي ميلر-مومرسكامب على المساعدة التقنية وإيفث ميليسا غواتيبونزا أريفالو على تعليقاتها المفيدة على المخطوطة. تم تطوير الإصدارات الأولية من البروتوكول في مختبر رالف غرينسبان. تم دعم هذا العمل من قبل مؤسسة الأبحاث الألمانية (DFG) ، ولا سيما من خلال منحة FOR2705 (TP3) إلى IGK ، ومؤسسة سيمونز (Aimon - 414701) ومعهد كافلي للدماغ والعقل (رقم المنحة #2017-954) الذي تلقته SA.
Materials
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
References
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved