Method Article
Preparando melanogaster de Drosophila adulto para imagem cerebral inteira durante respostas comportamentais e estímulos
Neste Artigo
Resumo
Apresentamos um método especificamente adaptado para a imagem de todo o cérebro da Drosophila adulta durante o comportamento e em resposta a estímulos. A cabeça está posicionada para permitir acesso óptico a todo o cérebro, enquanto a mosca pode mover suas pernas e antenas, a ponta do proboscis, e os olhos podem receber estímulos sensoriais.
Resumo
Apresentamos um método desenvolvido especificamente para a imagem de todo o cérebro de Drosophila durante comportamentos contínuos, como a caminhada. A fixação e dissecção da cabeça são otimizadas para minimizar seu impacto no comportamento. Isso é conseguido pela primeira vez usando um suporte que minimiza os obstáculos de movimento. A parte de trás da cabeça da mosca é colada a este suporte em um ângulo que permite acesso óptico a todo o cérebro, mantendo a capacidade da mosca de andar, noivo, cheirar, saborear e ver. A parte de trás da cabeça é dissecada para remover tecidos no caminho óptico e músculos responsáveis pelos artefatos de movimento da cabeça. O cérebro de mosca pode ser posteriormente imageado para registrar a atividade cerebral, por exemplo, usando indicadores de cálcio ou tensão, durante comportamentos específicos, como caminhar ou aliciamento, e em resposta a diferentes estímulos. Uma vez que a dissecção desafiadora, que requer uma prática considerável, tenha sido dominada, essa técnica permite registrar conjuntos de dados ricos relacionando toda a atividade cerebral a respostas de comportamento e estímulo.
Introdução
A atividade cerebral por imagem usando várias técnicas aprofundou a compreensão da função cerebral. Em humanos, as técnicas de imagem cerebral têm limitações importantes: enquanto a ressonância magnética funcional (fMRI) oferece resolução espátula-temporal muito abaixo da resolução de neurônios únicos, técnicas rápidas como a eletroencefalografia (EEG) só permitem acesso indireto e parcial ao cérebro1. Em modelos animais suficientemente grandes, como roedores, o registro de sensores de atividade fluorescente (por exemplo, GCaMP) usando microscópios montados na cabeça permite observar a atividade cerebral enquanto o animal está se movendo em seu ambiente2. No entanto, essas técnicas atualmente dão acesso apenas a uma pequena parte do cérebro. Animais com fixação da cabeça podem ser imagens de forma mais abrangente, mas a cobertura ainda é parcial (por exemplo, a superfície do córtex3). É apenas em animais pequenos, como as larvas de zebrafish, C. elegans e Drosophila que todo o cérebro pode ser imageado com resolução temporal e espacial ao nível ou próximo de neurôniosúnicos 4.
D. melanogaster é particularmente promissor porque tem sido usado há muito tempo como um organismo modelo genético5 e poderosas ferramentas genéticas foramdesenvolvidas 6. Complementada pela nova rede anatômica em larga escala derivada da microscopia eletrônica7,a mosca poderia fornecer oportunidades únicas para estudar dinâmicas cerebrais complexas geradas em uma rede de grande escala8. Embora a cutícula não seja transparente e, portanto, deve ser removida para imagem do cérebro, a imagem funcional in vivo tornou-se cada vez mais comum desde o primeiro estudo em 20029 e vários protocolos já foram publicados. No entanto, esses métodos envolvem separar a cabeça de mosca do corpo10,restringindo severamente os movimentos e/ou respostas da mosca aos estímulos11,12,13,14,15, ou apenas permitindo um pequeno parte do cérebro a ser imageado9,16,25,26,27,17,18,19,20,21,22,23,24. Para complementar essas abordagens, no entanto, poderosas, desenvolvemos recentemente uma preparação para imagem de todo o cérebro durante o comportamento e respostas a vários estímulos28.
Aqui, baseamos neste estudo para apresentar um método especificamente desenvolvido para imagem de todo o cérebro enquanto a mosca executa comportamentos seminat naturalistas (ou seja, caminhada e preparação) e responde a estímulos sensoriais. Isso é conseguido usando um suporte de observação projetado para dar acesso a todo o cérebro a partir do lado dorsal-posterior, deixando as antenas e proboscis intactas, e permitindo que a mosca mova suas pernas para andar (por exemplo, em uma bola amortecida a ar). Os passos para dissecar a parte de trás da cabeça foram refinados para velocidade, reprodutibilidade e para minimizar seu efeito sobre a viabilidade e mobilidade da mosca.
Protocolo
Todas as etapas são executadas sob um estereótipo.
1. Preparando o titular
- Imprima o titular 'FlyholderVJove.stl' (ver Material Suplementar) com uma impressora 3D ou imprima-o usando serviços online(Figura 1A). Tanto SLS (Nylon PA12) quanto multijet fusion (PA12) são adequados.
- Crie o slot da cabeça.
- Coloque um pedaço de fita adesiva retangularmente sobre uma superfície plana. Corte uma fatia de aproximadamente 5 mm x 1 cm. Corte a ranhura do pescoço (~400 x 400 μm) no meio do lado mais longo da fita usando lâminas paralelas fixas (duas lâminas de bisturi grudes grudes) para garantir a mesma largura em cada suporte(Figura 1B).
- Coloque a fita sobre o lado liso do orifício no suporte na parte inferior (ver Figura 1C e Figura 1D). A fita pode ser deformada empurrando-a para baixo com fórceps ~500 μm ao redor do buraco; isso minimizará ainda mais o impedimento dos movimentos posteriores de moscas.
- Cubra a fita e o suporte de cima com esmalte preto para evitar que o tampão vaze. O esmalte preto também protegerá os olhos da mosca da luz de excitação do microscópio. Deixe o esmalte secar pelo menos uma hora antes de usar o suporte.
- Uma vez que o esmalte esteja seco, adicione ~1 μL de graxa na ranhura da cabeça usando um tecido enrolado para garantir que a cola não molhe a parte de trás da cabeça da mosca(Figura 2A). Certifique-se de não colocar graxa fora da ranhura que evitaria que a cola grude.
- Criar a ranhura do corpo(Figura 2B).
- Opcionalmente, prepare a fita que será usada para posicionar o corpo da mosca (veja abaixo) com antecedência. Use o design mostrado na Figura 2B (parte superior) para cortar um pedaço de fita de ~2 cm de largura em duas e cortar fatias de 1,5 mm de largura. Corte 0,3 mm de ombros profundos e ranhura corporal. Certifique-se de que ele se encaixa no suporte.
NOTA: A variabilidade entre tamanhos de mosca (em particular com sexo, idade, genótipo ou espécie) pode tornar necessário ajustar o desenho da fita. Se a cabeça tende a ser mal centrada, pode ser útil adicionar uma fita em forma de V temporariamente sobre a ranhura do pescoço(Figura 3). Aplique também alguns microliters de graxa dentro da ranhura do pescoço e na fita em forma de V.
- Opcionalmente, prepare a fita que será usada para posicionar o corpo da mosca (veja abaixo) com antecedência. Use o design mostrado na Figura 2B (parte superior) para cortar um pedaço de fita de ~2 cm de largura em duas e cortar fatias de 1,5 mm de largura. Corte 0,3 mm de ombros profundos e ranhura corporal. Certifique-se de que ele se encaixa no suporte.
2. Colocar a mosca
NOTA: Moscas fêmeas de um a quatro dias de idade são ideais porque a cabeça feminina é maior e, portanto, mais fácil de dissecar do que a cabeça masculina, e moscas mais jovens têm cutícula mais macia. Para experimentos de caminhada, a atividade da mosca pode ser aumentada combinando os experimentos com tempos de maior atividade circadiana (ZT0 ou ZT11), usando soro fisiológico contendo glicose (como 103 mM NaCl, 3 mM KCl, 5 mM TES, 8 mM trehalose 2 H2O, 10 mM de glicose, 26 mM NaHCO3, 1 mM NaH2PO4, 2,5 mM CaCl2·2 H2O, 4 mM MgCl2·6 H2O), passando fome a mosca até 24 h com um ambiente somente de água, e aquecendo o ambiente a ~28 °C durante o experimento. Cortar as asas com pelo menos um dia de antecedência também ajuda a diminuir as tentativas de voar e, assim, aumentar a frequência de ataques de caminhada7,29,30.
- Encha uma placa de Petri ou a tampa da caixa de ponta de pipeta com gelo, coloque um tecido de laboratório em cima do gelo e coloque o suporte de cabeça para baixo sobre ele.
- Transfira uma mosca no gelo para paralisá-la, sugando-a de seu frasco para um tubo e soprando-a para o gelo (certifique-se de que o gelo não seja derretido, o que afogaria a mosca).
- Quando a mosca parar de se mover, use fórceps maçante para deslizá-lo para dentro do suporte com o pescoço dentro da fenda (a mosca pode ser mantida na base da asa) como na Figura 4 (esquerda). Os olhos devem estar em posições iguais em relação aos lados da ranhura(Figura 4, meio). Se necessário, adicione 1 μL de graxa na parte superior da cabeça para evitar que a cola (veja o próximo passo) atinja a parte de trás da cabeça e remova mais tarde.
- Cubra o corpo com um tecido e um pouco de gelo para garantir que a mosca não se mova durante esta etapa e a próxima(Figura 4, à direita). Outra opção para evitar que as pernas cheguem à cabeça é usar um pedaço de fita logo abaixo da cabeça (ver Figura 6).
3. Fixar a cabeça
- Coloque a cabeça em um ângulo ~20° a partir de uma visão totalmente posterior (ao redor do eixo lateral, ver Figura 5A). Este é um compromisso entre diminuir a profundidade para a imagem e do outro lado manter a perna dianteira livre para se mover e minimizar o estiramento do pescoço.
- Com um tecido enrolado(Figura 5B),coloque cola UV ao redor da cabeça, evitando sujar a área sensorial de interesse (antenas, proboscis e/ou olhos). Para experimentos de sabor, puxe o proboscis para fora e adicione cola em sua base para evitar o movimento. Se nenhum experimento de sabor for planejado, o proboscis é melhor empurrado para a cabeça e fixado com cola para minimizar o movimento(Figura 6).
- Cure a cola com luz UV para 5 s. Limpe cuidadosamente o circundante da cabeça com um tecido enrolado para remover a cola líquida restante que pode grudar nas pernas e/ou áreas sensoriais do solo.
NOTA: A fita pode ser áspera com lixa para aumentar a adesão à cola, se necessário. - Use uma fina tira de fita ou um tecido enrolado para mover as pernas para a frente (se ainda não estiverem), para que não sejam danificadas pelo próximo passo.
4. Posicionamento do corpo
NOTA: Esta etapa precisa ser executada rapidamente; antes que a mosca se recupere da anestesia.
- Retire o recipiente de gelo e gire o suporte. Remova a água ao redor da mosca com um tecido.
- Coloque a fita do entalhe do corpo (criada no passo 1) sobre o orifício e empurre suavemente o corpo da mosca para baixo(Figura 7). Tenha cuidado para não esticar muito o pescoço.
5. Selar o buraco
- Cubra os buracos grandes restantes com fita adesiva.
- Adicione ~1 μL de graxa na parte de trás da cabeça e na área do pescoço para garantir que nenhuma cola molhe lá.
- Com um tecido enrolado, pinte cola UV ao redor e em cima da fita e no tórax (parte dorsal superior do mesonotum) para corrigi-lo. Cure a cola com luz UV por ~5 s.
NOTA: É importante minimizar o uso da luz UV, pois pode afetar fortemente a saúde da mosca. - Limpe cuidadosamente a graxa e a cola não cicatrizada com um tecido de laboratório.
- Coloque ~1 mL de soro fisiológico em cima da cabeça. Empurre as bolhas de ar de lado com fórceps. Procure vazamentos colocando uma mancha sobre o soro fisiológico e virando o suporte para verificar se há soro fisiológico na parte frontal. Se houver algum vazamento, remova o soro fisiológico e fixe o orifício (adicionando mais cola ou mais graxa).
NOTA: Este pode ser um bom momento para pausar, se necessário. A mosca pode ser oferecida um pequeno pedaço de tecido ou bola de isopor para andar para evitar flailing e acalmar a mosca para baixo.
6. Dissecando a cabeça
NOTA: Use fórceps aguçados para as seguintes etapas. Fórceps muito finos são críticos, pois fórceps maçante tornarão mais difícil abrir a cutícula da cabeça e podem levar a lesões adicionais na cabeça ou cérebro da mosca. A ampliação forte pode ajudar nesta fase. Para esse objetivo, pode-se substituir os oculares do microscópio binóculo por oculares de 30x.
- Faça dois cortes na base do triângulo cuticular escuro central em cada lado do pescoço (ver cruzes na Figura 8A).
- Corte ao redor do triângulo escuro e remova esta parte da cutícula.
- O buraco no cérebro através do qual o músculo 16 e o esôfago vão agora deve ser visível e mover-se ritmicamente (Vídeo 1 apresenta esse movimento rítmico em uma mosca com músculos fluorescentes). Belisque cuidadosamente a parte superior desta área para cortar o músculo 16 sem perfurar o esôfago. Se o movimento rítmico do cérebro parou, o músculo 16 provavelmente foi removido, no entanto, o movimento às vezes pausa e reinicia mais tarde. Por isso, é importante prestar atenção aos movimentos rítmicos e realizar esse passo novamente, se necessário.
- Corte a cutícula restante em pequenos pedaços e remova-as cuidadosamente. Tente não puxar muito a cutícula. Em vez disso, use os fórceps como uma tesoura, para cortar pedaços de tecido. Pode-se começar nas bordas medial, onde o triângulo escuro foi removido antes e trabalhar o caminho para os lados.
NOTA: Pedaços de cutícula podem ser usados para raspar suavemente corpos de gordura se presentes. - Remova os sacos de ar uma peça após a outra, agarrando-os com os fórceps e puxando lentamente e de forma constante.
Resultados
A preparação descrita acima permite a observação de todo o cérebro sob um microscópio para imagens 3D em larga escala, como fótons clássicos 2 ou microscopia confocal, mas também técnicas mais rápidas, como a folha de luz31 e outras técnicas estruturadas de microscopia de iluminação (revisada em32), ou microscopia de campo leve28.
O acesso a todo o cérebro observando o comportamento e mantendo órgãos sensoriais funcionais permite responder a várias perguntas.
Primeiro, qual é a atividade cerebral geral quando a mosca está em repouso, durante o comportamento, e quando ela responde a estímulos? Como exemplo, incluímos dados obtidos com um microscópio de campo leve mostrando a ativação cerebral durante respostas a estímulos e comportamentos. Por exemplo, no Vídeo 2,uma sonda de cálcio foi expressa em todos os neurônios (nsyb-GAL4 e UAS-syt-GCaMP6s (esquerda) ou UAS-GCaMP6M (direita)) e um sopro de odor foi apresentado. Observe como a preparação permite obter uma visão geral da atividade cerebral durante a resposta ao estímulo. As poderosas ferramentas genéticas em Drosophila podem ser usadas para restringir a expressão desses sensores a subtipos neuronais específicos. No Vídeo 3,restringimos a expressão de um sensor de cálcio a neurônios dopaminérgicos e serotoninérgicos (TH-GAL4, DDC-GAL4 e UAS-GCaMP6M). Observe a forte atividade síncronica sobre o cérebro fortemente correlacionada com a mosca andando, permitida observando todo o cérebro durante o comportamento. Além da atividade de cálcio, outros sinais físicos ou químicos podem ser imagens (utilizando, porexemplo,sensores para tensão28,33, produtos metabolismos34,35 ou neuromoduladores específicos36).
Para entender o papel da atividade cerebral de forma mais especifica, podemos perguntar quais regiões estão envolvidas em que comportamento, resposta a estímulos ou padrões espontâneos de atividade. Os dados podem de fato ser usados como uma tela imparcial para extrair regiões funcionais usando técnicas como análise de componentes principais e análise de componentes independentes. A Figura 9A mostra diferentes regiões funcionais em cores diferentes. A forma e localização das regiões funcionais permitem mapeá-las para modelos anatômicos para identificar regiões cerebrais e, em alguns casos, tipo de neurônio. Além disso, uma vez alinhados ao modelo anatômico, os valores de fluorescência podem ser mediados em regiões cerebrais anatômicas para análise quantitativa (ver Figura 9B). Por exemplo, um modelo gaussiano hierárquico aplicado aos dados na Figura 9B mostra que as regiões são mais ativas durante a caminhada (com uma mediana ΔF/F de 0,029, Intervalo 95% crível=[0,017 0,041]) mas não durante o noivo (mediana ΔF/F = -0,0049 com intervalo 95% crível=[-0,016 0,0059]).
Somando-se à profundidade de compreensão, as gravações simultâneas das diferentes regiões funcionais permitidas pela preparação podem ser utilizadas para estudar as propriedades dinâmicas da rede funcional. Isso é importante porque as regiões cerebrais em todos os cérebros estudados até agora são altamente recorrentemente interconectadas e cada vez mais estudos mostram que mesmo áreas sensoriais respondem ao estado comportamental do animal. Vários aspectos podem ser analisados, como propriedades de gráficos funcionais (por exemplo, módulos) e padrões espáteris-temporais que podem ser adequados com sistemas dinâmicos (ver8 por exemplo).
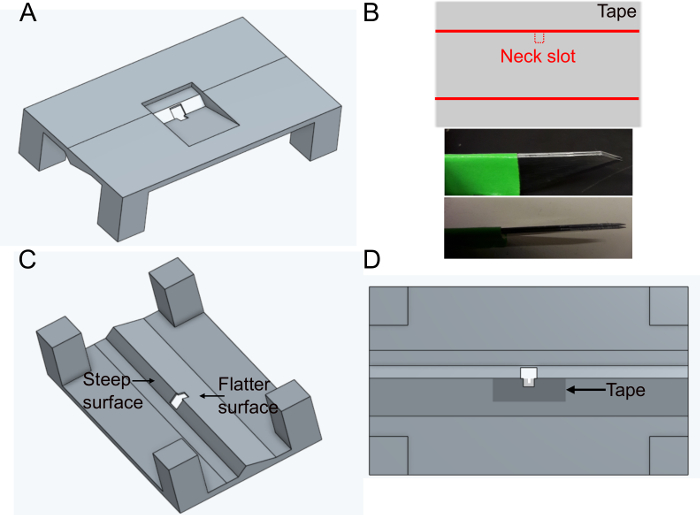
Figura 1: Preparando o titular (passo 1). A) Design do suporte (vista a partir da parte superior). B) Preparação do slot do pescoço. topo: design de fita, fundo: lâminas paralelas usadas para cortar a ranhura do pescoço. C) Vista do suporte de baixo. D) Vista inferior indicando onde adicionar a fita do entalhe do pescoço. Clique aqui para ver uma versão maior desta figura.
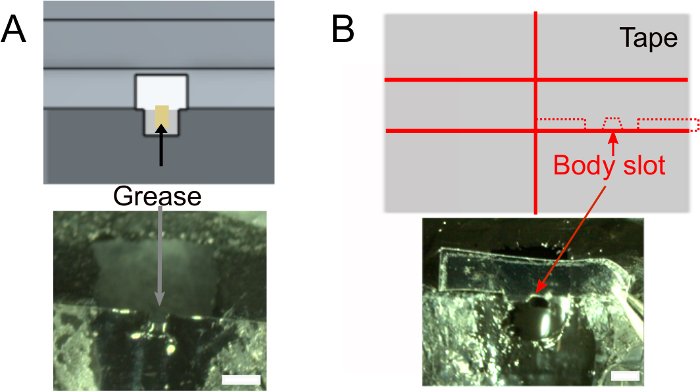
Figura 2: Preparativos adicionais (etapa 1). A) Adicione graxa na fenda do pescoço para evitar a cola para cobrir a parte de trás da cabeça e evitar vazamentos salinos. Barras de escala, 1 mm. B) Topo: forma da peça de fita que será usada para empurrar o corpo para baixo. Inferior: certifique-se de que a fita se encaixa no suporte. Clique aqui para ver uma versão maior desta figura.

Figura 3: Colocação de uma fita em forma de V para auxiliar o centro. (A) Vista inferior. (B) Vista superior. Barra de escala, 2 mm. Clique aqui para ver uma versão maior desta figura.

Figura 4: Coloque a mosca (passo 2). À esquerda, use dois fórceps maçante para colocar o corpo para que o pescoço esteja na fenda do pescoço. No meio, alinhe a cabeça. Os olhos estão em ambos os lados nas bordas da fenda. A cabeça da mosca está reta. Certo, coloque a mosca com um tecido coberto de gelo para evitar que ela se mova. Barra de escala, 1 mm. Clique aqui para ver uma versão maior desta figura.

Figura 5: Fixar a cabeça (passo 3). A) Ângulo ideal da cabeça. B) Adicione cola UV ao redor da cabeça, evitando áreas sensoriais de interesse. Barra de escala, 1 mm. Clique aqui para ver uma versão maior desta figura.

Figura 6: A ponta do proboscis e as antenas podem ser mantidas livres de cola (passo 3). O círculo branco indica a área onde a cola UV foi aplicada. A seta mostra quais partes são deixadas livres de cola para experimentos olfativos e gustativos. Observe a fita opcional que impede que as pernas toquem na área da cola. Barra de escala, 200 μm. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 7: Coloque a fita traseira (passo 4.2). A fita criada na etapa 1 (ver Figura 2, esquerda) é usada para colocar o corpo e cobrir o grande orifício no suporte. Barra de escala, 1 mm. Clique aqui para ver uma versão maior desta figura.

Figura 8: Etapas de dissecação (etapa 6). A-B) Corte em cada lado na base do triângulo escuro (cruzes) e remova esta parte da cutícula C). D) e E) removam o músculo 16. Em seguida, remova suavemente o resto da cutícula F, os sacos de ar G), e músculos. H) Cabeça dissecada. Barra de escala, 200 μm. Por favor, clique aqui para ver uma versão maior desta figura.
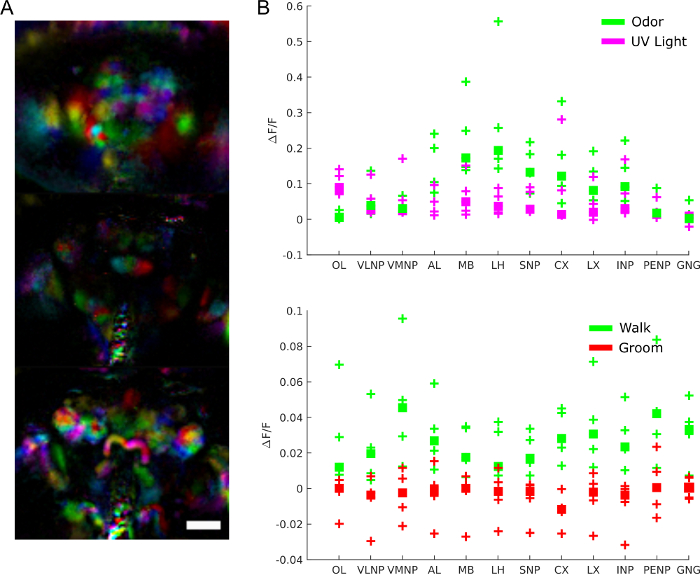
Figura 9: Resultados representativos. A) Regiões funcionais (extraídas usando PCA e ICA como em28) para uma mosca expressando GCaMP6 pan-neuronalmente imagens com um microscópio de campo leve (25x, NA=0,95 com uma matriz de lentes de microsetos f/12 correspondente). Barra de escala, 100 μm. B) Atividade média de cálcio em grandes regiões cerebrais durante respostas a estímulos e comportamento (reproduzido a partir de28). Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Movimentos musculares 16 (passo 6.3). A GFP foi expressa em músculos. Observe o movimento de bombeamento que vem do orifício logo acima da traqueia. Clique aqui para baixar este vídeo.
Vídeo 2: Atividade pan-neuronal de cálcio durante a resposta ao odor para duas preparações diferentes. Vinagre balsâmico foi soprado na mosca. A atividade pan-neuronal de cálcio (driver nsyb-GAL4, UAS-syt-GCaMP6s esquerda e UAS-GCaMP6M à direita) foi imagem com um microscópio de campo leve (25x, NA=0,95 com uma matriz de microlens f/12 correspondente). As imagens de campo de luz foram então reconstruídas como descrito no ref.28,37. Clique aqui para baixar este vídeo.
Vídeo 3: Atividade de cálcio em um subconjunto do tipo neurônio durante o comportamento. GCaMP6 foi expresso em neurônios dopaminérgicos e serotoninérgicos (com TH-GAL4 e DDC-GAL4). Em combinação com as ferramentas genéticas da mosca, a preparação permite observar um forte aumento da atividade em muitas regiões durante a caminhada. Clique aqui para baixar este vídeo.
Material Suplementar. Clique aqui para baixar este arquivo.
Discussão
Drosophila é um dos raros animais adultos onde todo o cérebro pode ser imagen durante comportamentos complexos. Aqui, apresentamos um método para preparar a mosca e expor todo o seu cérebro à imagem de toda a atividade cerebral. Vários pontos importantes devem ser observados.
Dissecar um pequeno animal como D. melanogaster é um desafio. O método, portanto, requer muita prática e paciência para dominá-lo. No entanto, após o treinamento, o procedimento leva menos de 30 minutos e produz resultados reprodutíveis.
O método que apresentamos tem limitações adicionais. Primeiro, inclinar a cabeça de mosca de sua posição natural leva ao alongamento do pescoço que pode ser prejudicial ao tecido conjuntivo, nervos ou músculo. Em segundo lugar, embora a zona subesofágica ventral (SEZ) seja opticamente acessível, está abaixo do esôfago semitranspar transparent, o que diminui a intensidade e a resolução nesta área. Finalmente, embora o titular esteja fora de alcance na maioria das direções, a mosca ainda às vezes percebe sua presença e empurra sobre ele para tentar escapar.
Apesar dessas limitações, os dados abrangentes obtidos de imagens cerebrais inteiras durante o comportamento e respostas a estímulos permitirão decifrar a função cerebral ao nível de toda a rede quando o animal interagir e navegar em ambientes complexos e naturalistas.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Heidi Miller-Mommerskamp por ajuda técnica e Iveth Melissa Guatibonza Arevalo por comentários úteis sobre o manuscrito. Versões iniciais do protocolo foram desenvolvidas no laboratório de Ralph Greenspan. Este trabalho foi apoiado pela Fundação Alemã de Pesquisa (DFG), em particular por meio de uma bolsa FOR2705 (TP3) ao IGK, e pela Fundação Simons (Aimon – 414701) e pelo Instituto Kavli para Cérebro e Mente (número de subvenção #2017-954) recebido pela SA.
Materiais
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
Referências
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados