Method Article
Préparation du drosophile adulte melanogaster pour l’imagerie cérébrale entière pendant les réponses au comportement et aux stimuli
Dans cet article
Résumé
Nous présentons une méthode spécifiquement adaptée à l’image de l’ensemble du cerveau de la drosophile adulte pendant le comportement et en réponse aux stimuli. La tête est positionnée pour permettre un accès optique à l’ensemble du cerveau, tandis que la mouche peut déplacer ses jambes et les antennes, le bout de la trompe, et les yeux peuvent recevoir des stimuli sensoriels.
Résumé
Nous présentons une méthode développée spécifiquement pour l’image de l’ensemble du cerveau drosophile lors de comportements continus tels que la marche. La fixation et la dissection de la tête sont optimisées pour minimiser leur impact sur le comportement. Ceci est d’abord réalisé en utilisant un support qui minimise les entraves de mouvement. L’arrière de la tête de la mouche est collé à ce support à un angle qui permet un accès optique à l’ensemble du cerveau tout en conservant la capacité de la mouche à marcher, toiletter, sentir, goûter et voir. L’arrière de la tête est disséqué pour enlever les tissus dans le chemin optique et les muscles responsables des artefacts de mouvement de la tête. Le cerveau volant peut ensuite être photographié pour enregistrer l’activité cérébrale, par exemple à l’aide d’indicateurs de calcium ou de tension, lors de comportements spécifiques tels que la marche ou le toilettage, et en réponse à différents stimuli. Une fois que la dissection difficile, qui nécessite une pratique considérable, a été maîtrisée, cette technique permet d’enregistrer de riches ensembles de données relatant l’activité cérébrale entière aux réactions de comportement et de stimulus.
Introduction
L’activité cérébrale d’imagerie utilisant diverses techniques ont approfondi la compréhension de la fonction cérébrale. Chez l’homme, les techniques d’imagerie cérébrale ont des limitations importantes : alors que l’imagerie par résonance magnétique fonctionnelle (IRMf) offre une résolution spatio-temporelle bien en deçà de la résolution d’un seul neurone, les techniques rapides telles que l’électroencéphalographie (EEG) ne permettent qu’un accès indirect et partielau cerveau 1. Dans des modèles animaux suffisamment grands comme les rongeurs, l’enregistrement de capteurs d’activité fluorescente (p. ex., GCaMP) à l’aide de microscopes montés sur la tête permet d’observer l’activité cérébrale pendant que l’animal se déplace dansson environnement 2. Néanmoins, ces techniques ne donnent actuellement accès qu’à une petite partie du cerveau. Les animaux fixés à la tête peuvent être photographiés de façon plus complète, mais la couverture est encore partielle (p. ex., la surface du cortex3). Ce n’est que chez les petits animaux, comme les larves de poisson zèbre, C. elegans et Drosophila, que tout le cerveau peut être photographié avec une résolution temporelle et spatiale au niveau ou à proximité de neuronesindividuels 4.
D. melanogaster est particulièrement prometteur parce qu’il a longtemps été utilisé comme un organisme modèlegénétique 5 et de puissants outils génétiques ont été développés6. Complétée par le nouveau réseau anatomique à grande échelle dérivé de la microscopieélectronique 7,la mouche pourrait offrir des possibilités uniques d’étudier la dynamique cérébrale complexe générée sur un réseau à grande échelle8. Bien que la cuticule ne soit pas transparente, et doit donc être enlevée pour imager le cerveau, l’imagerie fonctionnelle in vivo est devenue de plus en plus courante depuis la première étude en 20029 et plusieurs protocoles ont déjà été publiés. Toutefois, ces méthodes impliquent soit de séparer la tête de mouchedu corps 10,de restreindre sévèrement les mouvements de la mouche et/ou les réponses aux stimuli11,12,13,14,15, ou seulement de permettre une petite partie de le cerveau à être photographié9,16,25,26,27,17,18,19,20,21,22,23,24. Pour compléter ces approches néanmoins puissantes, nous avons récemment développé une préparation à l’image de l’ensemble du cerveau lors du comportement et des réponses à divers stimuli28.
Ici, nous nous construisons sur cette étude pour présenter une méthode spécifiquement développée pour imager l’ensemble du cerveau tandis que la mouche effectue un comportement semi-naturaliste (c’est-à-dire la marche et le toilettage) et répond aux stimuli sensoriels. Ceci est réalisé en utilisant un support d’observation conçu pour donner accès à l’ensemble du cerveau à partir du côté dorsale-postérieur, tout en laissant les antennes et la trompe intactes, et en permettant à la mouche de déplacer ses jambes pour marcher (par exemple, sur une boule coussinée par air). Les étapes de dissécation de l’arrière de la tête ont été affinées pour la vitesse, la reproductibilité et pour minimiser leur effet sur la viabilité et la mobilité de la mouche.
Protocole
Toutes les étapes sont effectuées sous un stéréomicroscope.
1. Préparation du titulaire
- Imprimez le support 'FlyholderVJove.stl' (voir Matériel supplémentaire)avec une imprimante 3D ou laissez-le imprimer à l’aide de services en ligne (Figure 1A). La fusion SLS (Nylon PA12) et multijet (PA12) convient.
- Créez la fente de tête.
- Placez un morceau de ruban adhésif rectangulairement sur une surface plane. Couper une tranche d’environ 5 mm x 1 cm. Couper la fente cervicale (~400 x 400 μm) au milieu du côté plus long du ruban à l’aide de lames parallèles fixes (deux lames de scalpel collées ensemble) pour assurer la même largeur dans chaque support (figure 1B).
- Placez la bande sur le côté plus plat du trou dans le support sur le côté inférieur (voir la figure 1C et la figure 1D). Le ruban peut être déformé en le poussant vers le bas avec des forceps ~500 μm autour du trou ; cela permettra de minimiser davantage les entraves aux mouvements ultérieurs de la mouche.
- Couvrez la bande et le support du haut avec du vernis à ongles noir pour empêcher le tampon de s’échapper. Le vernis à ongles noir protégera également les yeux de la mouche de la lumière d’excitation du microscope. Laisser sécher le vernis à ongles au moins une heure avant d’utiliser le support.
- Une fois que le vernis à ongles est sec, ajouter ~ 1 μL de graisse dans la fente de la tête à l’aide d’un tissu roulé pour s’assurer que la colle ne sera pas mouiller l’arrière de la tête de la mouche (Figure 2A). Assurez-vous de ne pas mettre de graisse à l’extérieur de la fente qui empêcherait la colle de coller.
- Créez la fente du corps (Figure 2B).
- En option, préparez la bande qui sera utilisée pour positionner le corps de la mouche (voir ci-dessous) à l’avance. Utilisez la conception indiquée dans la figure 2B (en haut) pour couper un morceau de ruban adhésif d’environ 2 cm de large en deux et couper des tranches de 1,5 mm de large. Découpez des épaules profondes de 0,3 mm et une fente corporelle. Assurez-vous qu’il s’adapte au support.
REMARQUE : La variabilité entre les tailles de mouches (en particulier avec le sexe, l’âge, le génotype ou les espèces) peut rendre nécessaire l’ajustement de la conception du ruban adhésif. Si la tête a tendance à être mal centrée, il peut être utile d’ajouter temporairement un morceau de ruban adhésif en forme de V au-dessus de la fente cervicale (figure 3). Appliquez également quelques microlitres de graisse à l’intérieur de la fente du cou et sur le ruban en forme de V.
- En option, préparez la bande qui sera utilisée pour positionner le corps de la mouche (voir ci-dessous) à l’avance. Utilisez la conception indiquée dans la figure 2B (en haut) pour couper un morceau de ruban adhésif d’environ 2 cm de large en deux et couper des tranches de 1,5 mm de large. Découpez des épaules profondes de 0,3 mm et une fente corporelle. Assurez-vous qu’il s’adapte au support.
2. Placer la mouche
REMARQUE : Les mouches femelles d’un à quatre jours sont idéales parce que la tête femelle est plus grosse et donc plus facile à disséquer que la tête masculine, et les mouches plus jeunes ont la cuticule plus douce. Pour les expériences de marche, l’activité de la mouche peut être augmentée en faisant correspondre les expériences avec des périodes d’activité circadienne plus élevée (ZT0 ou ZT11), en utilisant de la solution saline contenant du glucose (comme 103 mM NaCl, 3 mM KCl, 5 mM TES, 8 mM trehalose 2 H2O, 10 mM de glucose, 26 mM NaHCO3, 1 mM NaH2PO4, 2,5 mM CaCl2·2 H2O, 4 mM MgCl2·6 H2O), en affamant la mouche jusqu’à 24 h avec un environnement d’eau seulement, et en chauffant l’environnement à ~28 °C pendant l’expérience. Couper les ailes au moins un jour à l’avance contribue également à diminuer les tentatives de vol et ainsi augmenter la fréquence des combats demarche 7,29,30.
- Remplissez un couvercle de boîte à pointes de boîte de Pétri ou de pipette avec de la glace, placez un tissu de laboratoire sur la glace et placez le support à l’envers.
- Transférez une mouche sur la glace pour la paralyser en la suçant de son flacon dans un tube et en la soufflant sur la glace (assurez-vous que la glace n’est pas fondue, ce qui noierait la mouche).
- Lorsque la mouche cesse de bouger, utilisez des forceps ternes pour le glisser dans le support avec le cou à l’intérieur de la fente (la mouche peut être tenue à la base de l’aile) comme dans la figure 4 (àgauche). Les yeux doivent être à des positions égales par rapport aux côtés de la fente (figure 4, milieu). Si nécessaire, ajouter 1 μL de graisse sur le dessus de la tête pour empêcher la colle (voir l’étape suivante) d’atteindre l’arrière de la tête et retirer plus tard.
- Couvrez le corps d’un tissu et d’un peu de glace pour vous assurer que la mouche ne bouge pas pendant cette étape et la suivante (figure 4, à droite). Une autre option pour empêcher les jambes d’atteindre la tête est d’utiliser un morceau de ruban juste en dessous de la tête (voir la figure 6).
3. Sécurisation de la tête
- Placez la tête à un angle ~20° à partir d’une vue entièrement postérieure (autour de l’axe latéral, voir figure 5A). Il s’agit d’un compromis entre la diminution de la profondeur à l’image et de l’autre côté de maintenir la jambe avant libre de se déplacer et de minimiser l’étirement du cou.
- Avec un tissu enroulé (figure 5B), mettre de la colle UV autour de la tête tout en évitant de salir la zone sensorielle d’intérêt (antennes, trompes et / ou les yeux). Pour les expériences gustatives, retirez la trompe et ajoutez de la colle à sa base pour empêcher le mouvement. Si aucune expérience gustative n’est prévue, la trompe est mieux poussée dans la tête et fixée avec de la colle pour minimiser le mouvement (Figure 6).
- Guérir la colle avec de la lumière UV pendant 5 s. Nettoyez soigneusement l’environnement de la tête à l’aide d’un tissu enroulé pour enlever le reste de la colle liquide qui pourrait coller aux jambes et/ou aux zones sensorielles du sol.
REMARQUE : Le ruban peut être rugueux avec du papier de verre pour augmenter l’adhérence de la colle si nécessaire. - Utilisez une fine bande de ruban adhésif ou un tissu enroulé pour déplacer les jambes vers l’avant (si elles ne sont pas déjà), de sorte qu’ils ne seront pas endommagés par l’étape suivante.
4. Positionnement du corps
REMARQUE : Cette étape doit être effectuée rapidement; avant que la mouche ne se remette de l’anesthésie.
- Retirez le contenant de glace et retournez le support. Retirer l’eau autour de la mouche avec un mouchoir.
- Placez la bande de fente de corps (créée dans l’étape 1) au-dessus du trou et poussez doucement le corps de la mouche vers le bas (figure 7). Veillez à ne pas trop étirer le cou.
5. Sceller le trou
- Couvrir les grands trous restants de ruban adhésif.
- Ajouter ~1 μL de graisse à l’arrière de la tête et dans la région du cou pour s’assurer qu’aucune colle ne s’y mouillera.
- Avec un tissu enroulé, peindre la colle UV autour et sur le dessus du ruban adhésif et sur le thorax (partie dorsale supérieure du mésonotum) pour le fixer. Guérir la colle avec de la lumière UV pour ~5 s.
REMARQUE : Il est important de minimiser l’utilisation de la lumière UV car elle peut fortement affecter la santé de la mouche. - Nettoyez soigneusement la graisse et la colle non durcie à l’aide d’un tissu de laboratoire.
- Mettez ~1 mL de solution saline sur le dessus de la tête. Repoussez les bulles d’air avec des forceps. Recherchez les fuites en plaçant un coverslip sur la solution saline et en retournant le support pour vérifier la solution saline sur le côté avant. S’il y a des fuites, retirez la solution saline et fixez le trou (soit en ajoutant plus de colle ou plus de graisse).
REMARQUE : C’est peut-être le bon moment pour faire une pause si nécessaire. La mouche peut être offert un petit morceau de tissu ou de boule de polystyrène à marcher sur pour empêcher les flailing et calmer la mouche vers le bas.
6. Disséquer la tête
REMARQUE : Utilisez des forceps aiguisés pour les étapes suivantes. Les forceps très fins sont critiques car les forceps ternes ront le rendre plus difficile d’ouvrir la cuticule de tête et peuvent mener aux dommages additionnels sur la tête ou le cerveau de la mouche. Un grossissement fort peut aider à ce stade. À cet effet, on peut remplacer les oculaires du microscope binoculaire par des oculaires 30x.
- Faire deux coupes à la base du triangle cuticulaire central foncé de chaque côté du cou (voir croix dans la figure 8A).
- Couper autour du triangle sombre et enlever cette partie de la cuticule.
- Le trou dans le cerveau à travers lequel vont le muscle 16 et l’œsophage doit maintenant être visible et se déplacer rythmiquement(la vidéo 1 présente ce mouvement rythmique dans une mouche avec des muscles fluorescents). Pincez soigneusement le dessus de cette zone pour couper le muscle 16 sans percer l’œsophage. Si le mouvement rythmique du cerveau s’est arrêté, le muscle 16 a probablement été enlevé, cependant, le mouvement s’arrête parfois et redémarre plus tard. Il est donc important de prêter attention aux mouvements rythmiques et d’effectuer cette étape à nouveau si nécessaire.
- Couper le reste de la cuticule en petits morceaux et les enlever soigneusement. Essayez de ne pas trop tirer sur la cuticule. Utilisez plutôt les forceps comme une paire de ciseaux, pour couper des morceaux de tissu. On peut commencer sur les bords médiaux, où le triangle sombre a été enlevé avant et travailler son chemin vers les côtés.
REMARQUE : Des morceaux de cuticule peuvent être utilisés pour gratter doucement les gros corps s’ils sont présents. - Retirez les sacs d’air une pièce après l’autre en les saisissant avec les forceps et en tirant lentement et régulièrement.
Résultats
La préparation décrite ci-dessus permet l’observation de l’ensemble du cerveau au microscope pour l’imagerie 3D à grande échelle comme les photons classiques 2 ou la microscopie confocale, mais aussi des techniques plus rapides telles que lafeuille de lumière 31 et d’autres techniques structurées de microscopie d’éclairage(examinées en 32), ou la microscopiede champ lumineux 28.
L’accès à l’ensemble du cerveau tout en observant le comportement et en maintenant les organes sensoriels fonctionnels permet de répondre à plusieurs questions.
Tout d’abord, quelle est l’activité cérébrale globale lorsque la mouche est au repos, pendant le comportement, et quand elle répond aux stimuli? À titre d’exemple, nous incluons des données obtenues au microscope à champ lumineux montrant l’activation du cerveau lors des réponses aux stimuli et au comportement. Par exemple, dans la vidéo 2, une sonde de calcium a été exprimée dans tous les neurones (nsyb-GAL4 et UAS-syt-GCaMP6s (gauche) ou UAS-GCaMP6M (droite)) et une bouffée d’odeur a été présentée. Remarquez comment la préparation permet d’obtenir un aperçu de l’activité cérébrale pendant la réponse au stimulus. Les puissants outils génétiques de Drosophila peuvent être utilisés pour limiter l’expression de ces capteurs à des sous-types neuronaux spécifiques. Dans la vidéo 3, nous avons limité l’expression d’un capteur de calcium aux neurones dopaminergiques et sérotoninergiques (TH-GAL4, DDC-GAL4 et UAS-GCaMP6M). Remarquez la forte activité synchrone au-dessus du cerveau étroitement corrélée avec la marche à la mouche, permise en observant tout le cerveau pendant le comportement. En plus de l’activité calcique, d’autres signaux physiques ou chimiques peuvent être photographiés (en utilisant par exemple des capteurspour la tension 28,33, produitsdu métabolisme 34,35 ou neuromodulateursspécifiques 36).
Pour mieux comprendre le rôle de l’activité cérébrale, nous pouvons nous demander quelles régions sont impliquées dans quel comportement, réponse aux stimuli ou modèles spontanés d’activité. Les données peuvent en effet être utilisées comme un écran impartial pour extraire les régions fonctionnelles à l’aide de techniques telles que l’analyse des composants principaux et l’analyse indépendante des composants. La figure 9A montre différentes régions fonctionnelles dans différentes couleurs. La forme et la localisation des régions fonctionnelles permettent de les cartographier en modèles anatomiques pour identifier les régions du cerveau et, dans certains cas, le type de neurone. De plus, une fois alignées sur le modèle anatomique, les valeurs de fluorescence peuvent être moyennes dans les régions anatomiques du cerveau pour une analyse quantitative (voir la figure 9B). Par exemple, un modèle gaussien hiérarchique appliqué aux données de la figure 9B montre que les régions sont plus actives pendant la marche (avec une médiane ΔF/F de 0,029, Intervalle crédible de 95% =[0,017 0,041]) mais pas pendant le toilettage (médiane ΔF/F = -0,0049 avec intervalle crédible de 95%=[-0,016 0,0059]).
En ajoutant à la profondeur de compréhension, les enregistrements simultanés des différentes régions fonctionnelles autorisés par la préparation peuvent être utilisés pour étudier les propriétés dynamiques du réseau fonctionnel. Ceci est important parce que les régions du cerveau dans tous les cerveaux étudiés jusqu’à présent sont fortement interconnectées de façon récurrente et de plus en plus d’études montrent que même les zones sensorielles répondent à l’état comportemental de l’animal. Plusieurs aspects peuvent être pris en compte, tels que les propriétés fonctionnelles des graphiques (p. ex., les modules) et les modèles spatio-temporels qui peuvent être adaptés aux systèmes dynamiques(voir 8 par exemple).
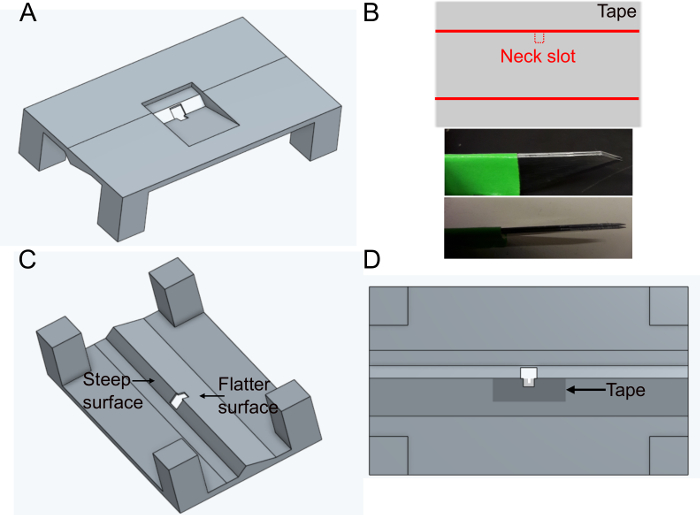
Figure 1 : Préparation du titulaire (étape 1). A) Conception du support (vue du haut). B) Préparation de fente de cou. haut : conception de bande, fond : lames parallèles utilisées pour couper la fente de cou. C) Vue du support d’en bas. D) Vue du bas indiquant où ajouter le ruban à sous du cou. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
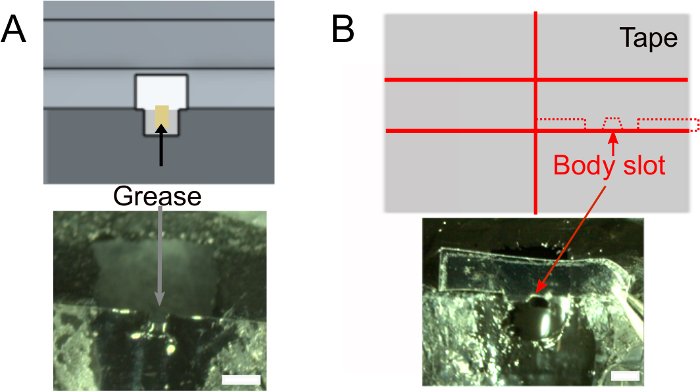
Figure 2 : Autres préparatifs (étape 1). R)Ajouter de la graisse dans la fente du cou pour empêcher la colle de couvrir l’arrière de la tête et pour éviter les fuites salines. Barres d’échelle, 1 mm. B) Haut : forme du morceau de ruban adhésif qui sera utilisé pour pousser le corps vers le bas. En bas : assurez-vous que la bande s’adapte au support. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3 : Placement d’un morceau de ruban en forme de V pour faciliter le centrage. (A) Vue du bas. (B) Vue supérieure. Barre d’échelle, 2 mm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Placez la mouche (étape 2). À gauche, utilisez deux forceps ternes pour placer le corps de sorte que le cou est dans la fente du cou. Au milieu, alignez la tête. Les yeux se trouvent des deux côtés sur les bords de la fente. La tête de la mouche est droite. À droite, rentrez la mouche avec un tissu recouvert de glace pour l’empêcher de bouger. Barre d’échelle, 1 mm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Fixer la tête (étape 3). A) Angle idéal de la tête. B) Ajouter de la colle UV autour de la tête, en évitant les zones sensorielles d’intérêt. Barre d’échelle, 1 mm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : La pointe de la trompe et les antennes peuvent être gardées exemptes de colle (étape 3). Le cercle blanc indique la zone où la colle UV a été appliquée. La flèche montre quelles parties sont laissées exemptes de colle pour des expériences olfactives et gustatives. Notez le ruban en option qui empêche les jambes de toucher la zone de colle. Barre d’échelle, 200 μm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 7 : Placez la bande arrière (étape 4.2). La bande créée à l’étape 1 (voir figure 2, à gauche) est utilisée pour placer le corps et couvrir le grand trou dans le support. Barre d’échelle, 1 mm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 8 : Étapes de dissection (étape 6). A-B) Couper de chaque côté à la base du triangle sombre (croix) et enlever cette partie de la cuticule C). D) et E) enlever le muscle 16. Puis retirez doucement le reste de la cuticule F),les sacs d’air G),et les muscles. H) Tête disséquée. Barre d’échelle, 200 μm. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
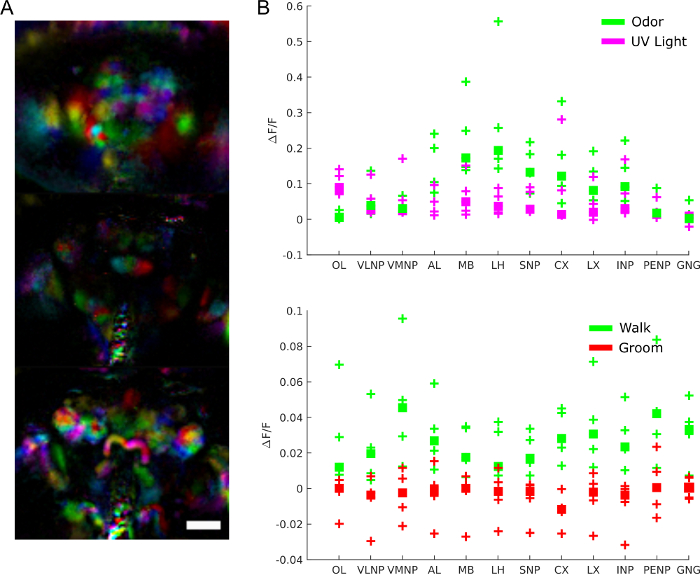
Figure 9 : Résultats représentatifs. A)Régions fonctionnelles (extraites à l’aide de PCA et ICAcomme dans 28) pour une mouche exprimant GCaMP6 pan-neuronally image avec un microscope à champ lumineux (25x, NA =0,95 avec un tableau correspondant f/12 micro lentille). Barre d’échelle, 100 μm. B) Activité moyenne de calcium dans les grandes régions du cerveau pendant les réponses aux stimuli et au comportement (reproduiteà partir de 28). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Vidéo 1: Muscle 16 mouvements (étape 6.3). GFP a été exprimé dans les muscles. Notez le mouvement de pompage qui vient du trou juste au-dessus de la trachée. S’il vous plaît cliquez ici pour télécharger cette vidéo.
Vidéo 2: Activité pan-neuronale de calcium pendant la réponse à l’odeur pour deux préparations différentes. Le vinaigre balsamique a été soufflé à la volée. L’activité pan-neuronale de calcium (conducteur de nsyb-GAL4, UAS-syt-GCaMP6s gauche et UAS-GCaMP6M droit) a été image avec un microscope de champ léger (25x, NA=0.95 avec un tableau assorti de f/12 microlens). Des images de champ de lumière ont ensuite été reconstruites telles que décrites dansl’arbitre 28,37. S’il vous plaît cliquez ici pour télécharger cette vidéo.
Vidéo 3 : Activité calcique dans un sous-ensemble de type neurone pendant le comportement. GCaMP6 a été exprimé dans les neurones dopaminergiques et sérotoninergiques (avec TH-GAL4 et DDC-GAL4). En combinaison avec les outils génétiques de mouche, la préparation permet d’observer une forte augmentation de l’activité dans de nombreuses régions pendant la marche. S’il vous plaît cliquez ici pour télécharger cette vidéo.
Matériel supplémentaire. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
La drosophile est l’un des rares animaux adultes où tout le cerveau peut être photographié lors de comportements complexes. Ici, nous présentons une méthode pour préparer la mouche et exposer tout son cerveau à l’image en cours toute l’activité cérébrale. Plusieurs points importants doivent être notés.
Disséquer un petit animal comme D. melanogaster est un défi. La méthode demande donc beaucoup de pratique et de patience pour la maîtriser. Cependant, après l’entraînement, la procédure prend moins de 30 minutes et produit des résultats reproductibles.
La méthode que nous avons présentée a des limites supplémentaires. Tout d’abord, incliner la tête de mouche de sa position naturelle conduit à étirer le cou qui pourrait être dommageable pour le tissu conjonctif, les nerfs ou les muscles. Deuxièmement, bien que la zone subesophagale ventrale (ZES) soit optiquement accessible, elle se trouve en dessous de l’œsophage semi-transparent, ce qui diminue l’intensité et la résolution dans ce domaine. Enfin, bien que le titulaire soit hors de portée dans la plupart des directions, la mouche réalise encore parfois sa présence et pousse sur elle pour essayer de s’échapper.
Malgré ces limitations, les données complètes obtenues à partir de l’imagerie cérébrale entière pendant le comportement et les réponses aux stimuli permettra de déchiffrer la fonction cérébrale au niveau de l’ensemble du réseau lorsque l’animal interagit avec des environnements complexes et naturalistes et y navigue.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Heidi Miller-Mommerskamp pour son aide technique et Iveth Melissa Guatibonza Arevalo pour les commentaires utiles sur le manuscrit. Les premières versions du protocole ont été développées dans le laboratoire de Ralph Greenspan. Ces travaux ont été soutenus par la Fondation allemande de recherche (DFG), notamment par le biais d’une subvention FOR2705 (TP3) à IGK, et par la fondation Simons (Aimon – 414701) et l’Institut Kavli pour le cerveau et l’esprit (numéro de subvention #2017-954) reçu par SA.
matériels
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
Références
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon