Method Article
Preparación de Drosophila melanogaster adulto para imágenes cerebrales completas durante las respuestas de comportamiento y estímulos
En este artículo
Resumen
Presentamos un método específicamente adaptado a la imagen de todo el cerebro de drosophila adulto durante el comportamiento y en respuesta a estímulos. La cabeza está posicionada para permitir el acceso óptico a todo el cerebro, mientras que la mosca puede mover sus piernas y las antenas, la punta del proboscis, y los ojos pueden recibir estímulos sensoriales.
Resumen
Presentamos un método desarrollado específicamente para imaginar todo el cerebro de Drosophila durante el comportamiento continuo como caminar. La fijación y disección de la cabeza están optimizadas para minimizar su impacto en el comportamiento. Esto se logra primero mediante el uso de un soporte que minimiza los obstáculos de movimiento. La parte posterior de la cabeza de la mosca está pegada a este soporte en un ángulo que permite el acceso óptico a todo el cerebro mientras conserva la capacidad de la mosca para caminar, acicalarse, oler, saborear y ver. La parte posterior de la cabeza se disecciona para eliminar los tejidos en la trayectoria óptica y los músculos responsables de los artefactos de movimiento de la cabeza. El cerebro de la mosca se puede tomar posteriormente imágenes para registrar la actividad cerebral, por ejemplo, utilizando indicadores de calcio o voltaje, durante comportamientos específicos como caminar o acicalarse, y en respuesta a diferentes estímulos. Una vez que la disección desafiante, que requiere una práctica considerable, ha sido dominada, esta técnica permite registrar conjuntos de datos enriquecidos que relacionan toda la actividad cerebral con el comportamiento y las respuestas de estímulo.
Introducción
La actividad cerebral por imágenes utilizando varias técnicas ha profundizado la comprensión de la función cerebral. En los seres humanos, las técnicas de diagnóstico por imágenes cerebrales tienen limitaciones importantes: mientras que la resonancia magnética funcional (fMRI) ofrece una resolución espacio-temporal muy por debajo de la resolución de una sola neurona, las técnicas rápidas como la electroencefalografía (EEG) sólo permiten el acceso indirecto y parcial al cerebro1. En modelos animales suficientemente grandes como roedores, la grabación de sensores de actividad fluorescente (por ejemplo, GCaMP) utilizando microscopios montados en la cabeza permite observar la actividad cerebral mientras el animal se mueve en su entorno2. Sin embargo, estas técnicas actualmente dan acceso sólo a una pequeña porción del cerebro. Los animales fijos en la cabeza se pueden imaginar de forma más completa, pero la cobertura sigue siendo parcial (por ejemplo, la superficie de la corteza3). Es sólo en animales pequeños, como las larvas de pez cebra, C. elegans y Drosophila que todo el cerebro se puede imaginar con resolución temporal y espacial a nivel de o cerca de neuronas individuales4.
D. melanogaster es particularmente prometedor porque durante mucho tiempo se ha utilizado como un organismo modelo genético5 y potentes herramientas genéticas se han desarrollado6. Complementada con la nueva red anatómica a gran escala derivada de la microscopía electrónica7,la mosca podría proporcionar oportunidades únicas para estudiar dinámicas cerebrales complejas generadas en una red a gran escala8. Aunque la cutícula no es transparente, y por lo tanto debe ser eliminada para tomar imágenes del cerebro, las imágenes funcionales in vivo se han vuelto cada vez más comunes desde el primer estudio en 20029 y ya se han publicado varios protocolos. Sin embargo, estos métodos implican separar el cabezal de mosca del cuerpo10,restringir severamente los movimientos de la mosca y/o las respuestas a los estímulos11,12,13,14,15,o sólo permitir una pequeña parte del cerebro a ser imagen9,16,25,26,27,17,18,19,20,21,22,23,24. Para complementar estos enfoques sin embargo poderosos, recientemente desarrollamos una preparación para imaginar todo el cerebro durante el comportamiento y las respuestas a varios estímulos28.
Aquí, nos basamos en este estudio para presentar un método desarrollado específicamente para imaginar todo el cerebro mientras la mosca realiza un comportamiento semi-naturalista (es decir, caminar y acicalarse) y responde a estímulos sensoriales. Esto se logra mediante el uso de un soporte de observación diseñado para dar acceso a todo el cerebro desde el lado dorsal-posterior, dejando las antenas y el proboscis intactos, y permitiendo que la mosca mueva sus piernas para caminar (por ejemplo, en una bola acolchada por aire). Los pasos para diseccionar la parte posterior de la cabeza se han refinado para la velocidad, reproducibilidad y minimizar su efecto sobre la viabilidad y movilidad de la mosca.
Protocolo
Todos los pasos se realizan bajo un estereomicroscopio.
1. Preparación del titular
- Imprima el soporte 'FlyholderVJove.stl' (ver Material complementario)con una impresora 3D o imprímalo mediante servicios en línea (Figura 1A). Tanto sls (nylon PA12) como fusión multirreactor (PA12) son adecuados.
- Cree la ranura para la cabeza.
- Coloque un trozo de cinta adhesiva rectangularmente sobre una superficie plana. Corte una rebanada de aproximadamente 5 mm x 1 cm. Corte la ranura del cuello (~400 x 400 μm) en el centro del lado más largo de la cinta utilizando cuchillas paralelas fijas (dos cuchillas de bisturí pegadas juntas) para asegurar la misma anchura en cada soporte (Figura 1B).
- Coloque la cinta sobre el lado más plano del agujero en el soporte en el lado inferior (consulte la Figura 1C y la Figura 1D). La cinta se puede deformar empujándola hacia abajo con fórceps ~500 μm alrededor del agujero; esto minimizará aún más obstaculizar los movimientos posteriores de la mosca.
- Cubra la cinta y el soporte de la parte superior con esmalte de uñas negro para evitar que el búfer se filtre. El esmalte de uñas negro también protegerá los ojos de la mosca de la luz de excitación del microscopio. Deje que el esmalte de uñas se seque al menos una hora antes de usar el soporte.
- Una vez que el esmalte de uñas esté seco, agregue ~1 μL de grasa en la ranura de la cabeza usando un tejido enrollado para asegurar que el pegamento no humedecerá la parte posterior de la cabeza de la mosca(Figura 2A). Asegúrese de no poner grasa fuera de la ranura que evitaría que el pegamento se pegue.
- Cree la ranura para el cuerpo (Figura 2B).
- Opcionalmente, prepare la cinta que se utilizará para colocar el cuerpo de la mosca (ver abajo) de antemano. Utilice el diseño que se muestra en la Figura 2B (superior) para cortar un trozo de cinta de ~2 cm de ancho en dos y cortar rodajas de 1,5 mm de ancho. Corte los hombros de 0,3 mm de profundidad y la ranura del cuerpo. Asegúrese de que se ajuste al soporte.
NOTA: La variabilidad entre los tamaños de mosca (en particular con sexo, edad, genotipo o especie) puede hacer necesario ajustar el diseño de la cinta. Si la cabeza tiende a estar mal centrada, puede ser útil añadir una pieza de cinta en forma de V temporalmente sobre la ranura del cuello (Figura 3). También aplique algunos microlitros de grasa dentro de la ranura del cuello y en la cinta en forma de V.
- Opcionalmente, prepare la cinta que se utilizará para colocar el cuerpo de la mosca (ver abajo) de antemano. Utilice el diseño que se muestra en la Figura 2B (superior) para cortar un trozo de cinta de ~2 cm de ancho en dos y cortar rodajas de 1,5 mm de ancho. Corte los hombros de 0,3 mm de profundidad y la ranura del cuerpo. Asegúrese de que se ajuste al soporte.
2. Colocación de la mosca
NOTA: Las moscas hembra de uno a cuatro días de edad son ideales porque la cabeza femenina es más grande y por lo tanto más fácil de diseccionar que la cabeza masculina, y las moscas más jóvenes tienen cutícula más suave. Para los experimentos a pie, la actividad de la mosca puede incrementarse haciendo coincidir los experimentos con tiempos de mayor actividad circadiana (ZT0 o ZT11), mediante el uso de solución salina que contiene glucosa (como 103 mM NaCl, 3 mM KCl, 5 mM TES, 8 mM trehalose 2 H2O, Glucosa de 10 mM, 26 mM NaHCO3,1 mM NaH2PO4,2,5 mM CaCl2·2 H2O, 4 mM MgCl2·6 H2O), al morir de hambre hasta 24 h con un ambiente solo de agua, y calentando el medio ambiente a ~28 °C durante el experimento. Cortar las alas con al menos un día de antelación también ayuda a disminuir los intentos de volar y así aumentar la frecuencia de los combates a pie7,29,30.
- Llene una placa de Petri o una tapa de la caja de la punta de la pipeta con hielo, coloque un tejido de laboratorio encima del hielo y coloque el soporte boca abajo sobre ella.
- Transfiera una mosca sobre hielo para paralizarla succionándola de su vial en un tubo y volándola sobre el hielo (asegúrese de que el hielo no se derrita, lo que ahogaría la mosca).
- Cuando la mosca deje de moverse, utilice fórceps apagados para deslizarla en el soporte con el cuello dentro de la ranura (la mosca se puede mantener en la base del ala) como en la Figura 4 (izquierda). Los ojos deben estar en posiciones iguales con respecto a los lados de la ranura(Figura 4,centro). Si es necesario, agregue 1 μL de grasa en la parte superior de la cabeza para evitar que el pegamento (ver siguiente paso) llegue a la parte posterior de la cabeza y retire más tarde.
- Cubra el cuerpo con un pañuelo y un poco de hielo para asegurarse de que la mosca no se mueva durante este paso y el siguiente(Figura 4,derecha). Otra opción para evitar que las piernas lleguen a la cabeza es usar un trozo de cinta justo debajo de la cabeza (ver Figura 6).
3. Asegurar la cabeza
- Coloque la cabeza en un ángulo ~20° desde una vista totalmente posterior (alrededor del eje lateral, consulte la Figura 5A). Este es un compromiso entre disminuir la profundidad a la imagen y en el otro lado mantener la pierna delantera libre para moverse y minimizar el estiramiento del cuello.
- Con un tejido enrollado(Figura 5B),coloque pegamento UV alrededor de la cabeza mientras evita ensuciar el área sensorial de interés (antenas, proboscis y/o ojos). Para experimentos de sabor, tire del proboscis y agregue pegamento en su base para evitar el movimiento. Si no se planifica ningún experimento de sabor, el proboscis se empuja mejor en la cabeza y se fija con pegamento para minimizar el movimiento(Figura 6).
- Cura el pegamento con luz UV durante 5 s. Limpie cuidadosamente los alrededores de la cabeza con un tejido enrollado para eliminar el pegamento líquido restante que podría pegarse a las piernas y/o a las áreas sensoriales del suelo.
NOTA: La cinta se puede desbaste con papel de lija para aumentar la adherencia del pegamento si es necesario. - Utilice una tira delgada de cinta adhesiva o un tejido enrollado para mover las piernas hacia la parte delantera (si aún no lo están), por lo que no se dañarán en el siguiente paso.
4. Posicionamiento del cuerpo
NOTA: Este paso debe realizarse rápidamente; antes de que la mosca se recupere de la anestesia.
- Retire el recipiente de hielo y dé la vuelta al soporte. Retire el agua alrededor de la mosca con un pañuelo.
- Coloque la cinta de ranura del cuerpo (creada en el paso 1) sobre el agujero y empuje suavemente el cuerpo de la mosca hacia abajo (Figura 7). Tenga cuidado de no estirar demasiado el cuello.
5. Sellado del agujero
- Cubra los orificios grandes restantes con cinta adhesiva.
- Añadir ~ 1 μL de grasa a la parte posterior de la cabeza y en el área del cuello para asegurarse de que ningún pegamento se moje allí.
- Con un tejido enrollado, pinta pegamento UV alrededor y encima de la cinta y en el tórax (parte dorsal superior del mesonótum) para arreglarlo. Cura el pegamento con luz UV para ~5 s.
NOTA: Es importante minimizar el uso de luz UV, ya que puede afectar fuertemente la salud de la mosca. - Limpie cuidadosamente la grasa y el pegamento sin seguridad con un tejido de laboratorio.
- Poner ~ 1 mL de solución salina en la parte superior de la cabeza. Empuje las burbujas de aire a un lado con fórceps. Busque fugas colocando un control de cubierta sobre la solución salina y girando el soporte para comprobar si hay solución salina en el lado frontal. Si hay fugas, retire la solución salina y fije el orificio (ya sea añadiendo más pegamento o más grasa).
NOTA: Este puede ser un buen momento para hacer una pausa si es necesario. A la mosca se le puede ofrecer un pequeño pedazo de tejido o bola de poliestireno para caminar para evitar flaquear y calmar la mosca hacia abajo.
6. Diseccionar la cabeza
NOTA: Utilice fórceps afilados para los pasos siguientes. Los fórceps muy finos son críticos, ya que los fórceps apagados harán más difícil abrir la cutícula de la cabeza y pueden conducir a lesiones adicionales en la cabeza o el cerebro de la mosca. Una fuerte ampliación puede ayudar en esta etapa. Para ello, se puede sustituir los oculares del microscopio binocular por 30x oculares.
- Haga dos cortes en la base del triángulo cuticular oscuro central a cada lado del cuello (ver cruces en la Figura 8A).
- Corte alrededor del triángulo oscuro y retire esta parte de la cutícula.
- El agujero en el cerebro a través del cual van los músculos 16 y el esófago ahora debe ser visible y moverse rítmicamente(Video 1 presenta este movimiento rítmico en una mosca con músculos fluorescentes). Pellizque cuidadosamente la parte superior de esta área para cortar el músculo 16 sin perforar el esófago. Sin embargo, si el movimiento rítmico del cerebro se detuvo, es probable que se extirparan los músculos 16, el movimiento a veces se detiene y se reinicia más tarde. Por lo tanto, es importante prestar atención a los movimientos rítmicos y realizar este paso de nuevo si es necesario.
- Corte la cutícula restante en trozos pequeños y retírelos cuidadosamente. Trata de no tirar demasiado de la cutícula. En su lugar, usa los fórceps como un par de tijeras, para cortar trozos de tejido. Uno puede comenzar en los bordes medios, donde el triángulo oscuro fue eliminado antes y trabajar su camino a los lados.
NOTA: Los trozos de cutícula se pueden utilizar para raspar suavemente los cuerpos de grasa si están presentes. - Retire los sacos de aire una pieza tras otra agarrándolos con los fórceps y tirando lenta y constantemente.
Resultados
La preparación descrita anteriormente permite la observación de todo el cerebro bajo un microscopio para imágenes 3D a gran escala como fotones clásicos o microscopía confocal, pero también técnicas más rápidas como la hoja de luz31 y otras técnicas de microscopía de iluminación estructurada (revisadas en32),o microscopía de campo ligero28.
El acceso a todo el cerebro mientras se observa el comportamiento y el mantenimiento de órganos sensoriales funcionales permite responder a varias preguntas.
En primer lugar, ¿cuál es la actividad cerebral general cuando la mosca está en reposo, durante el comportamiento y cuándo responde a los estímulos? Como ejemplo, incluimos datos obtenidos con un microscopio de campo de luz que muestra la activación cerebral durante las respuestas a estímulos y comportamiento. Por ejemplo, en video 2, se expresó una sonda de calcio en todas las neuronas (nsyb-GAL4 y UAS-syt-GCaMP6s (izquierda) o UAS-GCaMP6M (derecha)) y se presentó un soplo de olor. Observe cómo la preparación permite obtener una visión general de la actividad cerebral durante la respuesta al estímulo. Las potentes herramientas genéticas de Drosophila se pueden utilizar para restringir la expresión de estos sensores a subtipos neuronales específicos. En video 3,restringimos la expresión de un sensor de calcio a las neuronas dopaminérgicas y serotoninérgicas (TH-GAL4, DDC-GAL4 y UAS-GCaMP6M). Observe la fuerte actividad sincrónica sobre el cerebro estrechamente correlacionada con la mosca caminando, permitida por la observación de todo el cerebro durante el comportamiento. Además de la actividad del calcio, se pueden tomar imágenes de otras señales físicas o químicas (utilizando, porejemplo,sensores para voltaje28,33,productos del metabolismo34,35 o neuromoduladores específicos36).
Para entender el papel de la actividad cerebral más específicamente, podemos preguntar qué regiones están involucradas en qué comportamiento, respuesta a estímulos o patrones espontáneos de actividad. De hecho, los datos se pueden utilizar como una pantalla imparcial para extraer regiones funcionales utilizando técnicas como el análisis de componentes principales y el análisis independiente de componentes. La Figura 9A muestra diferentes regiones funcionales en diferentes colores. La forma y localización de las regiones funcionales permiten mapearlas a plantillas anatómicas para identificar regiones cerebrales y en algunos casos tipo de neuronas. Además, una vez alineados con la plantilla anatómica, los valores de fluorescencia se pueden promediar en regiones cerebrales anatómicas para análisis cuantitativo (ver Figura 9B). Por ejemplo, un modelo gaussiano jerárquico aplicado a los datos de la Figura 9B muestra que las regiones son más activas durante el paseo (con una mediana ΔF/F de 0,029, 95% intervalo creíble=[0.017 0.041]) pero no durante el novio (mediana ΔF/F = -0.0049 con un intervalo creíble del 95%=[-0.016 0.0059]).
Además de la profundidad de comprensión, las grabaciones simultáneas de las diferentes regiones funcionales permitidas por la preparación se pueden utilizar para estudiar las propiedades dinámicas de la red funcional. Esto es importante porque las regiones cerebrales en todos los cerebros estudiados hasta ahora están altamente interconectadas recurrentemente y cada vez más estudios muestran que incluso las áreas sensoriales responden al estado conductual del animal. Se pueden examinar varios aspectos, como las propiedades funcionales del gráfico (por ejemplo, los módulos) y los patrones espacio-temporales que pueden ajustarse a los sistemas dinámicos (véase8 para ver ejemplos).
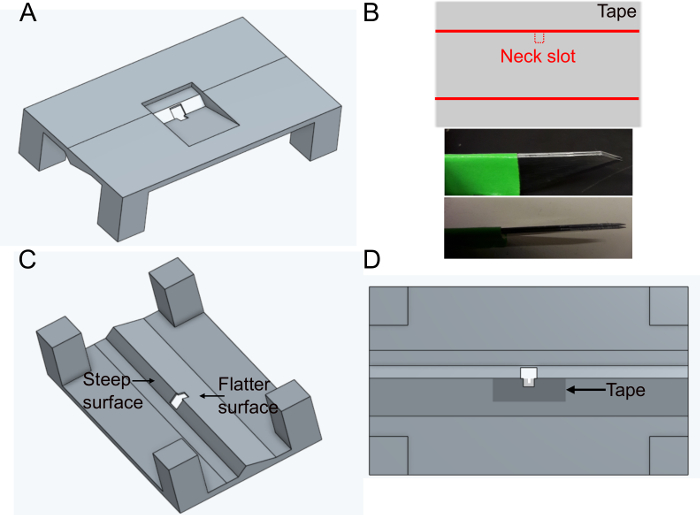
Figura 1: Preparación del soporte (paso 1). A) Diseño del soporte (vista desde la parte superior). B) Preparación de la ranura del cuello. superior: diseño de cinta, parte inferior: cuchillas paralelas utilizadas para cortar la ranura del cuello. C) Vista del soporte desde abajo. D) Vista inferior que indica dónde añadir la cinta de ranura del cuello. Haga clic aquí para ver una versión más grande de esta figura.
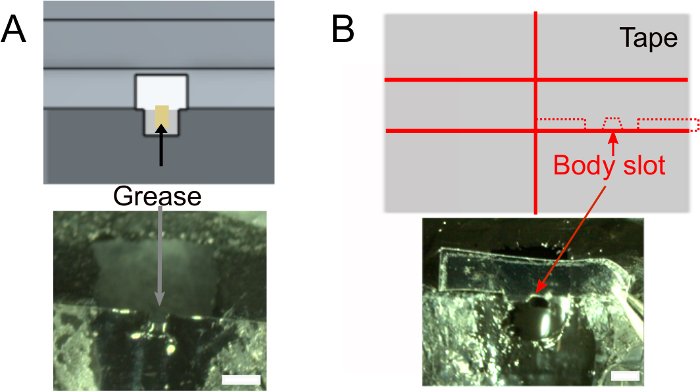
Figura 2: Otros preparativos (paso 1). A) Añadir grasa en la ranura del cuello para evitar el pegamento para cubrir la parte posterior de la cabeza y evitar fugas salinas. Barras de escala, 1 mm. B) Superior: forma de la pieza de cinta que se utilizará para empujar el cuerpo hacia abajo. Inferior: asegúrese de que la cinta se ajuste al soporte. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Colocación de un trozo de cinta en forma de V para ayudar a centrar. (A) Vista inferior. (B) Vista superior. Barra de escala, 2 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Coloque la mosca (paso 2). Izquierda, usa dos fórceps opacos para colocar el cuerpo para que el cuello esté en la ranura del cuello. En el medio, alinee la cabeza. Los ojos se encuentran a ambos lados en los bordes de la ranura. La cabeza de la mosca es recta. Bien, arropa la mosca con un tejido cubierto de hielo para evitar que se mueva. Barra de escala, 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Fijar la cabeza (paso 3). A) Ángulo ideal de la cabeza. B) Añadir pegamento UV alrededor de la cabeza, evitando áreas sensoriales de interés. Barra de escala, 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: La punta del proboscis y las antenas se pueden mantener libres de pegamento (paso 3). El círculo blanco indica el área donde se ha aplicado el pegamento UV. La flecha muestra qué partes se dejan libres de pegamento para experimentos olfativos y gustativos. Tenga en cuenta la cinta opcional que impide que las piernas toquen el área del pegamento. Barra de escala, 200 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Coloque la cinta posterior (paso 4.2). La cinta creada en el paso 1 (véase la Figura 2, izquierda) se utiliza para colocar el cuerpo y cubrir el agujero grande en el soporte. Barra de escala, 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Pasos de disección (paso 6). A-B) Corte a cada lado en la base del triángulo oscuro (cruces) y retire esta parte de la cutícula C). D) y E) extirpar el músculo 16. A continuación, retire suavemente el resto de la cutícula F),los sacos de aire G) y los músculos. H) Cabeza diseccionada. Barra de escala, 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
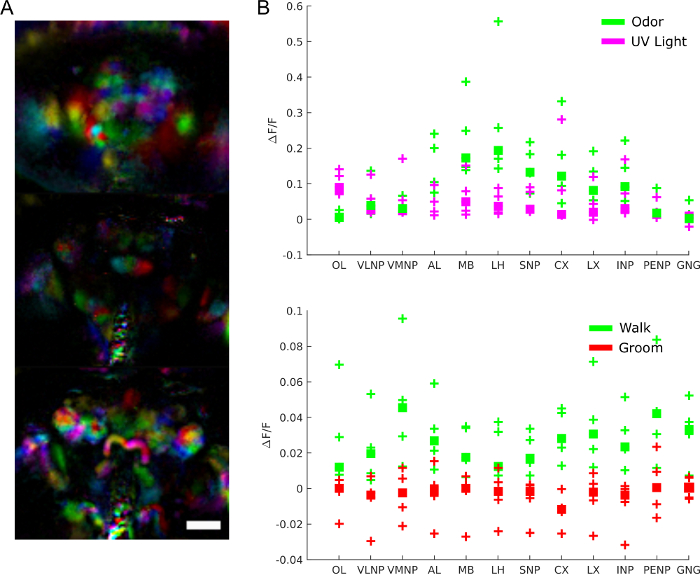
Figura 9: Resultados representativos. A) Regiones funcionales (extraídas usando PCA e ICA como en28)para una mosca que expresa GCaMP6 pan-neuronally con un microscopio de campo de luz (25x, NA =0.95 con una matriz de micro lentes f/12 a juego). Barra de escala, 100 μm. B) Actividad media de calcio en grandes regiones cerebrales durante las respuestas a estímulos y comportamiento (reproducido a partir de28). Haga clic aquí para ver una versión más grande de esta figura.
Vídeo 1: Músculo 16 movimientos (paso 6.3). GFP se expresó en los músculos. Observe el movimiento de bombeo que viene del agujero justo encima de la tráquea. Por favor, haga clic aquí para descargar este video.
Video 2: Actividad de calcio pan neuronal durante la respuesta al olor para dos preparaciones diferentes. El vinagre balsámico estaba hinchado sobre la marcha. La actividad del calcio pan neuronal (conductor nsyb-GAL4, UAS-syt-GCaMP6s izquierda y UAS-GCaMP6M a la derecha) fue imagenda con un microscopio de campo ligero (25x, NA=0.95 con una matriz de microlens f/12 a juego). Las imágenes de campo de luz fueron reconstruidas como se describe en la referencia28,37. Por favor, haga clic aquí para descargar este video.
Video 3: Actividad de calcio en un subconjunto de tipo neurona durante el comportamiento. GCaMP6 se expresó en neuronas dopaminérgicas y serotoninérgicas (con TH-GAL4 y DDC-GAL4). En combinación con las herramientas genéticas fly, la preparación permite observar un fuerte aumento de la actividad en muchas regiones durante el paseo. Por favor, haga clic aquí para descargar este video.
Material suplementario. Haga clic aquí para descargar este archivo.
Discusión
La drosophila es uno de los animales adultos raros donde todo el cerebro puede ser imagen durante comportamientos complejos. Aquí, presentamos un método para preparar la mosca y exponer todo su cerebro a la imagen de toda la actividad cerebral. Hay que tener en cuenta varios puntos importantes.
Diseccionar un animal pequeño como D. melanogaster es un reto. Por lo tanto, el método requiere mucha práctica y paciencia para dominarlo. Sin embargo, después del entrenamiento, el procedimiento tarda menos de 30 minutos y produce resultados reproducibles.
El método que presentamos tiene limitaciones adicionales. En primer lugar, inclinar la cabeza de la mosca desde su posición natural conduce a estirar el cuello que podría ser perjudicial para el tejido conectivo, los nervios o el músculo. En segundo lugar, aunque la zona subesofágica ventral (SEZ) es ópticamente accesible, está por debajo del esófago semitransparente, lo que disminuye la intensidad y resolución en esta área. Finalmente, aunque el soporte está fuera de su alcance en la mayoría de las direcciones, la mosca todavía a veces se da cuenta de su presencia y empuja sobre ella para tratar de escapar.
A pesar de estas limitaciones, los datos completos obtenidos de imágenes cerebrales enteras durante el comportamiento y las respuestas a los estímulos harán posible descifrar la función cerebral a nivel de toda la red cuando el animal interactúa y navega por entornos complejos y naturalistas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Heidi Miller-Mommerskamp por ayuda técnica y a Iveth Melissa Guatibonza Arévalo por sus comentarios útiles sobre el manuscrito. Las versiones iniciales del protocolo fueron desarrolladas en el laboratorio de Ralph Greenspan. Este trabajo fue apoyado por la Fundación Alemana de Investigación (DFG), en particular a través de una subvención FOR2705 (TP3) a IGK, y por la fundación Simons (Aimon – 414701) y el Instituto Kavli para el Cerebro y la Mente (número de subvención #2017-954) recibido por SA.
Materiales
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
Referencias
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados