Method Article
Подготовка взрослых Drosophila меланогастер для всего мозга изображений во время поведения и стимулов ответы
В этой статье
Резюме
Мы представляем метод, специально разработанный для изображения всего мозга взрослого Drosophila во время поведения и в ответ на раздражители. Голова расположена, чтобы обеспечить оптический доступ ко всему мозгу, в то время как муха может двигать ногами и антеннами, кончиком хоботка, и глаза могут получать сенсорные стимулы.
Аннотация
Мы представляем метод, разработанный специально для изображения всего мозга Дрозофилы во время текущего поведения, такого как ходьба. Фиксация головы и вскрытие оптимизированы, чтобы свести к минимуму их влияние на поведение. Это сначала достигается с помощью держателя, который сводит к минимуму препятствия движения. Задняя часть головы мухи приклеена к этому держателю под углом, который позволяет оптический доступ ко всему мозгу, сохраняя при этом способность мухи ходить, ухаживать, пахнуть, вкус и видеть. Задняя часть головы вскрывается для удаления тканей в оптическом пути и мышц, ответственных за движения головы артефактов. Мозг мухи впоследствии может быть изображен для записи активности мозга, например, с использованием кальция или индикаторов напряжения, во время конкретных видов поведения, таких как ходьба или уход, и в ответ на различные стимулы. После того, как сложные вскрытия, которая требует значительной практики, была освоено, этот метод позволяет записывать богатые наборы данных, связанные всей деятельности мозга поведения и стимулов ответов.
Введение
Воображение мозговой активности с использованием различных методов углубило понимание функции мозга. У людей методы визуализации мозга имеют важные ограничения: в то время как функциональная магнитно-резонансная томография (МРТ) предлагает пространственно-временное разрешение намного ниже разрешения одного нейрона, быстрые методы, такие как электроэнцефалография (ЭЭГ), позволяют только косвенный и частичный доступ кмозгу 1. В достаточно крупных животных моделях, таких как грызуны, запись датчиков флуоресцентной активности (например, GCaMP) с помощью головы установленных микроскопов позволяет наблюдать активность мозга в то время как животное движется всвоей среде 2. Тем не менее, эти методы в настоящее время дают доступ только к небольшой части мозга. Головные животные могут быть изображены более полно, но покрытие по-прежнему частично (например, поверхность коры3). Только у мелких животных, таких как личинки зебры, C. elegans и Drosophila, что весь мозг может быть изображен с временным и пространственным разрешением на уровне или близко к одномунейронов 4.
D. melanogaster является особенно перспективным, поскольку он уже давно используется в качестве генетическоймодели организма 5 и мощные генетические инструменты были разработаны6. Дополненная новой крупномасштабной анатомической сетью, полученной из электронноймикроскопии 7, муха можетпредоставить уникальные возможности для изучения сложной динамики мозга, генерируемой вкрупномасштабной сети 8. Хотя кутикула не является прозрачной, и, таким образом, должны быть удалены для изображения мозга, in vivo функциональной визуализации становится все более и более распространенным местом с момента первого исследования в 2002году 9 и несколько протоколов уже были опубликованы. Тем не менее, эти методы включают либо отделение головы мухиот тела 10, серьезно ограничивая движения мухи и / или ответы нараздражители 11,12,13,14,15, или только разрешение небольшой части мозга, чтобы бытьизображены 9,16,25,26,27,17,18,19,20,21,22,23,24. В дополнение к этим, тем не менее, мощные подходы, мы недавно разработали подготовку к изображению всего мозга во время поведения и ответы на различныестимулы 28.
Здесь мы опираемся на это исследование, чтобы представить метод, специально разработанный для изображения всего мозга в то время как муха выполняет полу-натуралистическое поведение (т.е. ходьба и уход) и реагирует на сенсорные стимулы. Это достигается с помощью держателя наблюдения, предназначенного для обеспечения доступа ко всему мозгу с спинно-задней стороны, оставляя антенны и хоботок нетронутыми, и позволяя мухе двигать ногами, чтобы ходить (например, на воздушном шаре). Шаги для вскрытия задней части головы были уточнены для скорости, воспроизводимости, и свести к минимуму их влияние на жизнеспособность и мобильность мухи.
протокол
Все шаги выполняются под стереомикроскопом.
1. Подготовка держателя
- Печать держателя 'FlyholderVJove.stl' (см. Дополнительный материал)с помощью 3D-принтера или его печать с помощью онлайн-сервисов(рисунок 1A). Подходят как SLS (Nylon PA12), так и мультиреактивный синтез (PA12).
- Создайте головной слот.
- Поместите кусок липкой ленты прямоугольно на плоскую поверхность. Вырезать ломтик примерно 5 мм х 1 см. Вырежьте шейный слот (400 х 400 мкм) в середине длинной стороны ленты с помощью фиксированных параллельных лезвий (два скальпеля лезвия застряли вместе), чтобы обеспечить ту же ширину в каждом держателе (Рисунок 1B).
- Поместите ленту на более льстить стороне отверстия в держателе на нижней стороне (см. Рисунок 1C и рисунок 1D). Лента может быть деформирована, нажав его вниз с типсами 500 мкм вокруг отверстия; это еще больше сведет к минимуму препятствование более поздним движениям мух.
- Обложка ленты и держатель сверху с черным лаком для ногтей, чтобы предотвратить утечку буфера. Черный лак для ногтей также защитит глаза мухи от возбуждения света микроскопа. Пусть лак для ногтей высохнуть по крайней мере за час до использования держателя.
- После того, как лак для ногтей высохнет, добавьте 1 мл жира в головной слот с помощью свернутой ткани, чтобы обеспечить клей не будет мокрой задней части головы мухи(рисунок 2A). Убедитесь в том, чтобы не положить жир за пределами слота, что бы предотвратить клей от прилипания.
- Создайте слот для тела(рисунок 2B).
- Дополнительно подготовьте ленту, которая будет использоваться для позиционирования тела мухи (см. ниже) заранее. Используйте дизайн, показанный на рисунке 2B (сверху), чтобы разрезать кусок ленты шириной 2 см на две части и разрезать 1,5 мм в ширину ломтиками. Вырежьте 0,3 мм глубокие плечи и слот для тела. Убедитесь, что он подходит владельцу.
ПРИМЕЧАНИЕ: Вариабельность между размерами мух (в частности, с полом, возрастом, генотипом или видом) может сделать необходимым корректировку конструкции ленты. Если голова, как правило, плохо в центре, это может быть полезно, чтобы добавить V-образный кусок ленты временно на шее слот (Рисунок 3). Также нанесите несколько микролитров смазки внутри шейного слота и на V-образную ленту.
- Дополнительно подготовьте ленту, которая будет использоваться для позиционирования тела мухи (см. ниже) заранее. Используйте дизайн, показанный на рисунке 2B (сверху), чтобы разрезать кусок ленты шириной 2 см на две части и разрезать 1,5 мм в ширину ломтиками. Вырежьте 0,3 мм глубокие плечи и слот для тела. Убедитесь, что он подходит владельцу.
2. Размещение мухи
ПРИМЕЧАНИЕ: От одного до четырех дней старые самки мух идеально подходят, потому что женская голова больше и, следовательно, легче вскрыть, чем мужская голова, и молодые мухи имеют более мягкие кутикулы. Для ходячих экспериментов активность мухи может быть увеличена путем сопоставления экспериментов со временем более высокой циркадной активности (ЗТ0 или ЗТ11), с помощью солевого раствора, содержащего глюкозу (например, 103 мММ NaCl, 3 мМ ККл, 5 мМТ TES, 8 мМ трегалоза 2 H2O, 10 мМ глюкозы, 26 мМНаХКО 3,1 мМНаГ 2PO4, 2,5 мМ CaCl2No2H 2 O, 4 мМ МгКл2No6 H2O), голодая летать до 24 ч с водой только окружающей среды, а также путем нагрева окружающей среды до 28 градусов по Цельсию во время эксперимента. Отсечение крыльев по крайней мере на один день вперед также помогает уменьшить попытки летать и тем самым увеличитьчастоту ходьбыбои 7,29,30.
- Заполните чашку Петри или крышку коробки наконечника пипетки со льдом, поместите лабораторную ткань поверх льда и установите держатель вверх дном на нем.
- Передача мухи на льду, чтобы парализовать его, сосать его из флакона в трубку и дует его на лед (убедитесь, что лед не расплавлен, который бы утопить муху).
- Когда муха перестает двигаться, используйте тупые типсы, чтобы сдвинуть его в держатель с шеей внутри слота (муха может быть проведена в основе крыла), как на рисунке 4 (слева). Глаза должны быть на равных позициях по отношению к сторонам слота(рисунок 4, средний). При необходимости добавьте смазку 1 МЛ на верхней части головы, чтобы предотвратить клей (см. следующий шаг) от достижения задней части головы и удалить позже.
- Обложка тела с тканью и немного льда, чтобы убедиться, что муха не двигается во время этого шага и следующий(рисунок 4, справа). Другой вариант, чтобы предотвратить ноги от достижения головы заключается в использовании кусок ленты чуть ниже головы (см. рисунок 6).
3. Обеспечение безопасности головы
- Поместите голову под углом 20 градусов с полностью заднего вида (вокруг боковой оси, см. Рисунок 5A). Это компромисс между уменьшением глубины изображения и с другой стороны поддержания передней ноги свободно двигаться и минимизации растяжения шеи.
- С свернутой ткани (Рисунок 5B), положить УФ-клей вокруг головы, избегая при этом загрязнения сенсорной области интереса (антенны, хоботок и / или глаза). Для вкусовых экспериментов вытяните хоботок и добавьте клей у его основания, чтобы предотвратить движение. Если вкус эксперимента не планируется, хоботок лучше всего толкнул в голову и фиксированной клеем, чтобы свести к минимуму движение(рисунок 6).
- Лечить клей с ультрафиолетовым светом в течение 5 с. Тщательно очистите окружающую голову свернутой тканью, чтобы удалить оставшийся жидкий клей, который может прилипать к ногам и/или почвенные сенсорные области.
ПРИМЕЧАНИЕ: Лента может быть грубой с наждачной бумагой, чтобы увеличить клей адгезии, если это необходимо. - Используйте тонкую полоску ленты или свернутой ткани, чтобы переместить ноги на фронт (если они еще не являются), так что они не будут повреждены следующим шагом.
4. Позиционирование тела
ПРИМЕЧАНИЕ: Этот шаг должен быть выполнен быстро; прежде чем муха оправиться от анестезии.
- Снимите контейнер со льдом и поверните держатель вокруг. Удалите воду вокруг мухи с помощью ткани.
- Поместите ленту слота тела (созданную в шаге 1) над отверстием и аккуратно нажмите тело мухи вниз(рисунок 7). Будьте осторожны, чтобы не растянуть шею слишком много.
5. Запечатывание отверстия
- Обложка любых оставшихся больших отверстий с лентой.
- Добавьте 1 мл жира в затылок и в области шеи, чтобы убедиться, что клей не будет мокрым там.
- С свернутой ткани, краска УФ-клей вокруг и на верхней части ленты и на грудной клетке (верхняя спинная часть мезонотума), чтобы исправить это. Лечить клей с ультрафиолетовым светом для 5 с.
ПРИМЕЧАНИЕ: Важно свести к минимуму использование УФ-излучения, поскольку это может сильно повлиять на здоровье мухи. - Тщательно очистите жир и неохватный клей лабораторной тканью.
- Положите 1 мл солевого раствора поверх головы. Нажмите пузырьки воздуха в сторону с типсами. Ищите утечки, поместив крышку над солевым раствором и поворачивая держатель вокруг, чтобы проверить на физраствор на передней стороне. Если есть какие-либо утечки, удалить солевой раствор и исправить отверстие (либо путем добавления более клея или больше жира).
ПРИМЕЧАНИЕ: Это может быть хорошее время, чтобы сделать паузу, если это необходимо. Муха может быть предложен небольшой кусочек ткани или пенополистирола мяч ходить, чтобы предотвратить flailing и успокоить муху вниз.
6. Рассекая голову
ПРИМЕЧАНИЕ: Используйте заточенные типсы для следующих шагов. Очень тонкие миппы имеют решающее значение, как скучно типсов сделает его более трудным, чтобы открыть голову кутикулы и может привести к дополнительным травмам на голове мухи или мозга. Сильное увеличение может помочь на данном этапе. С этой целью можно заменить глазки бинокулярного микроскопа 30x глаз.
- Сделайте два разреза у основания центрального темного катикулярного треугольника с каждой стороны шеи (см. кресты на рисунке 8A).
- Вырезать вокруг темного треугольника и удалить эту часть кутикулы.
- Отверстие в головном мозге, через которое проходят мышцы 16 и пищевод, теперь должно быть видимым и ритмично двигаться(Видео 1 представляет это ритмичное движение в мухе с флуоресцентными мышцами). Тщательно щепотку верхней части этой области, чтобы сократить мышцы 16 без прокола пищевода. Если ритмическое движение мозга остановилось, мышцы 16, скорее всего, были удалены, однако, движение иногда останавливается и перезапускается позже. Поэтому важно обратить внимание на ритмические движения и при необходимости снова выполнить этот шаг.
- Оставшуюся кутикулу нарезать мелкими кусочками и аккуратно удалить. Старайтесь не тянуть на кутикулу слишком много. Вместо этого используйте типсы, как ножницы, чтобы сократить куски ткани. Можно начать с медиальной кромки, где темный треугольник был удален до и работать свой путь в стороны.
ПРИМЕЧАНИЕ: Кусочки кутикулы могут быть использованы для мягкого соскабливание жировых тел, если присутствует. - Удалите воздушные мешки один кусок за другим, хватая их с типсами и потянув медленно и неуклонно.
Результаты
Препарат, описанный выше, позволяет наблюдения всего мозга под микроскопом для крупномасштабных 3D изображений, таких как классические 2 фотона или конфокальные микроскопии, но и быстрее методы, такие каксветовой лист 31 и другие структурированные методы микроскопииосвещения (рассмотрены в 32), или световое полемикроскопии 28.
Доступ ко всему мозгу при наблюдении за поведением и поддержании функциональных органов чувств позволяет ответить на несколько вопросов.
Во-первых, какова общая активность мозга, когда муха находится в покое, во время поведения, и когда она реагирует на раздражители? В качестве примера мы включаем данные, полученные с помощью светового полевого микроскопа, показывающего активацию мозга во время реакции на раздражители и поведение. Например, в видео 2,кальций зонд был выражен во всех нейронов (nsyb-GAL4 и UAS-syt-GCaMP6s (слева) или UAS-GCaMP6M (справа)) и клубы запаха был представлен. Обратите внимание, как препарат позволяет получить обзор активности мозга во время ответа на стимул. Мощные генетические инструменты в Drosophila могут быть использованы для ограничения экспрессии этих датчиков для конкретных подтипов нейронов. В видео 3, мы ограничили выражение датчика кальция дофаминергических и серотонинергических нейронов (TH-GAL4, DDC-GAL4 и UAS-GCaMP6M). Обратите внимание на сильную синхронную активность над мозгом, тесно связанную с ходьбой мухи, разрешенную наблюдением всего мозга во время поведения. В дополнение к активности кальция, другие физические или химические сигналы могут быть изображены (с помощью,например, датчики напряжения 28,33,метаболизм продукты 34,35 или конкретных нейромодуляторов36).
Чтобы понять роль мозговой активности более конкретно, мы можем спросить, какие регионы участвуют в каком поведении, реакции на раздражители или спонтанные модели активности. Данные действительно могут быть использованы в качестве беспристрастного экрана для извлечения функциональных регионов с использованием таких методов, как анализ основных компонентов и независимый анализ компонентов. На рисунке 9A показаны различные функциональные области в разных цветах. Форма и локализация функциональных областей позволяют сопоставить их с анатомическими шаблонами для определения областей мозга, а в некоторых случаях и типа нейронов. Кроме того, после присоединения к анатомическому шаблону значения флуоресценции могут быть усредняться в анатомических областях мозга для количественного анализа (см. рисунок 9B). Например, иерархическая гауссийская модель, применяемая к данным на рисунке 9B, показывает, что регионы более активны во время прогулки (при медиане 0,029, 95% достоверный интервал »0.017 0.041»), но не во время жениха (медиана F/F -0.0049 с 95% надежным интервалом »-0.016 0.0059»).
В дополнение к глубине понимания, одновременные записи различных функциональных областей, разрешенных препаратом, могут быть использованы для изучения динамических свойств функциональной сети. Это важно, потому что области мозга во всех изученных до сих пор мозга сильно взаимосвязаны, и все больше и больше исследований показывают, что даже сенсорные области реагируют на поведенческое состояние животного. Можно просмотреть несколько аспектов, таких как функциональные свойства графика (например, модули) и пространственно-временные узоры, которые могут быть вписана в динамические системы(см. 8 примеров).
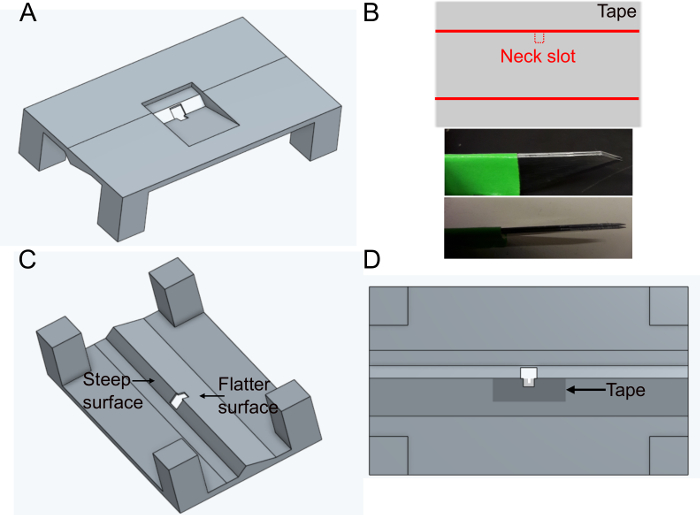
Рисунок 1: Подготовка держателя (шаг 1). A)Дизайн держателя (вид сверху). B) Подготовка слота шеи. вверху: конструкция ленты, дно: параллельные лезвия, используемые для разреза шеи слот. C)Вид держателя снизу. D) Нижняя точка зрения с указанием, где добавить ленту слот шеи. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
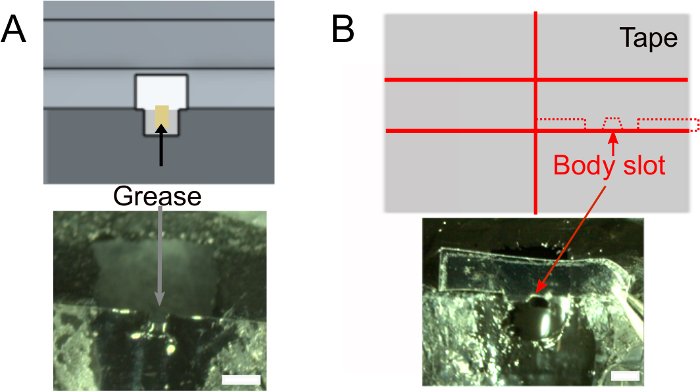
Рисунок 2: Дальнейшая подготовка (шаг 1). A) Добавить жир в шею слот для предотвращения клея для покрытия задней части головы и для предотвращения солевых утечек. Шкала баров, 1 мм. B) Сверху: форма кусок ленты, которая будет использоваться, чтобы подтолкнуть тело вниз. Внизу: убедитесь, что лента подходит держатель. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Размещение V-образный кусок ленты, чтобы помочь центрирования. (A)Нижний вид. (B)Вид сверху. Масштаб бар, 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Поместите муху (шаг 2). Слева используйте два тупых типса, чтобы поместить тело так, чтобы шея была в шейном слоте. Средний, выровнять голову. Глаза лежат с обеих сторон по краям слота. Голова мухи прямая. Правильно, уложи муху с тканью, покрытой льдом, чтобы она не двигалась. Шкала бар, 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Исправить голову (шаг 3). A)Идеальный угол головы. B) Добавить УФ-клей вокруг головы, избегая сенсорных областях, представляющих интерес. Шкала бар, 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: кончик хоботка и антенны могут быть свободны от клея (шаг 3). Белый круг указывает область применения УФ-клея. Стрелка показывает, какие части остаются свободными от клея для обонятельных и вкусных экспериментов. Обратите внимание на дополнительную ленту, которая предотвращает ноги от прикосновения клей области. Шкала бар, 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 7: Поместите заднюю ленту (шаг 4.2). Лента, созданная в шаге 1 (см. рисунок 2, слева) используется для места тела и покрытия большого отверстия в держателе. Шкала бар, 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 8: Шаги вскрытия (шаг 6). A-B) Вырезать с каждой стороны у основания темного треугольника (кресты) и удалить эту часть кутикулы C). D)и E) удалить мышцы 16. Затем аккуратно удалить остальную часть кутикулы F), воздушные мешки G), и мышцы. H)Рассеченная голова. Шкала бар, 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
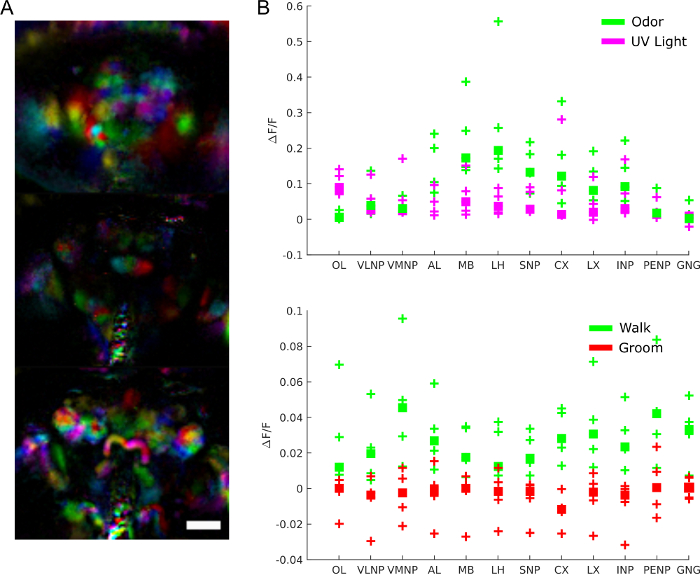
Рисунок 9: Результаты представительов. A)Функциональные регионы (извлеченные с помощью PCA и ICA,как в 28) для мухи, выражаюной GCaMP6 пан-нейронально изображены с помощью светового поля микроскопа (25x, NA'0.95 с соответствующим f/12 микрообъектив массив). Шкала бар, 100 мкм. B) Средняя активность кальция в крупных областях мозга во время реакции на раздражители и поведение (воспроизводитсяс 28). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Видео 1: Мышцы 16 движений (шаг 6.3). GFP был выражен в мышцах. Обратите внимание на насосное движение, которое исходит от отверстия чуть выше трахеи. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 2: Пан-нейрональной активности кальция во время реакции на запах для двух различных препаратов. Бальзамический уксус пыхтел на лету. Пан-нейронная активность кальция (водитель nsyb-GAL4, UAS-syt-GCaMP6s слева и UAS-GCaMP6M справа) была изображена с помощью светового полевого микроскопа (25x, NA-0.95 с соответствующим массивом микролинов f/12). Изображения светового поля были затем реконструированы, как описано врефери 28,37. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 3: Активность кальция в подмножестве типа нейронов во время поведения. GCaMP6 был выражен в дофаминергических и серотонинергических нейронов (с TH-GAL4 и DDC-GAL4). В сочетании с генетическими инструментами мухи, препарат позволяет наблюдать сильное увеличение активности во многих регионах во время прогулки. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительный материал. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Дрозофила является одним из редких взрослых животных, где весь мозг может быть изображен во время сложного поведения. Здесь мы представляем метод подготовки мухи и подвергать весь ее мозг изображению текущей всей деятельности мозга. Следует отметить несколько важных моментов.
Вскрытие небольшого животного, такого как D. melanogaster является сложной задачей. Таким образом, метод требует много практики и терпения, чтобы освоить его. Однако после тренировки процедура занимает менее 30 минут и дает воспроизводимые результаты.
Метод, который мы представили, имеет дополнительные ограничения. Во-первых, наклон головы мухи из ее естественного положения приводит к растяжению шеи, которые могут повредить соединительной ткани, нервов или мышц. Во-вторых, хотя вентраловая подэзофагеальная зона (СЕЗ) оптически доступна, она находится ниже полупрозрачного пищевода, что снижает интенсивность и разрешение в этой области. Наконец, хотя держатель находится вне досягаемости в большинстве направлений, муха все еще иногда осознает свое присутствие и толкает на него, чтобы попытаться бежать.
Несмотря на эти ограничения, всеобъемлющие данные, полученные от всего изображения мозга во время поведения и реакции на раздражители позволит расшифровать функции мозга на уровне всей сети, когда животное взаимодействует с и перемещается сложных, натуралистических средах.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы благодарим Хайди Миллер-Mommerskamp за техническую помощь и Ивет Мелисса Guatibonza Arevalo за полезные комментарии по рукописи. Первоначальные версии протокола были разработаны в лаборатории Ральфа Гринспена. Эта работа была поддержана Немецким исследовательским фондом (DFG), в частности, через грант FOR2705 (TP3) для IGK, и Фонд Симонс (Aimon - 414701) и Кавли Институт мозга и разума (грант номер #2017-954), полученный SA.
Материалы
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
Ссылки
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены