Method Article
Davranış ve Uyaran Yanıtları Sırasında Yetişkin Drosophila melanogaster'ı Tüm Beyin Görüntülemeye Hazırlama
Bu Makalede
Özet
Davranış sırasında ve uyaranlara yanıt olarak yetişkin Drosophila'nın tüm beynini imgelemek için özel olarak uyarlanmış bir yöntem sunuyoruz. Baş, tüm beyne optik erişime izin vermek için konumlandırılırken, sinek bacaklarını ve antenleri, hortumun ucunu hareket ettirebilir ve gözler duyusal uyaranları alabilir.
Özet
Yürüme gibi devam eden davranışlar sırasında drosophila beyninin tamamını imgelemek için özel olarak geliştirilmiş bir yöntem sunuyoruz. Kafa fiksasyonu ve diseksiyonu, davranış üzerindeki etkilerini en aza indirmek için optimize edilmiştir. Bu ilk olarak hareket engellerini en aza indiren bir tutucu kullanılarak elde edilir. Sineğin kafasının arkası, sineğin yürüme, damat, koku alma, tat alma ve görme yeteneğini korurken tüm beyne optik erişim sağlayan bir açıyla bu tutucuya yapıştırılmıştır. Başın arkası, optik yoldaki dokuları ve kafa hareketi eserlerinden sorumlu kasları çıkarmak için parçalara çıkarılır. Sinek beyni daha sonra, örneğin kalsiyum veya voltaj göstergeleri kullanılarak, yürüme veya tımar gibi belirli davranışlar sırasında ve farklı uyaranlara yanıt olarak beyin aktivitesini kaydetmek için görüntülenebilir. Önemli bir uygulama gerektiren zorlu diseksiyona hakim olduktan sonra, bu teknik tüm beyin aktivitesini davranış ve uyaran yanıtlarıyla ilgili zengin veri kümelerini kaydetmeye izin verir.
Giriş
Çeşitli teknikler kullanılarak beyin aktivitesinin görüntülenmesi beyin fonksiyonlarının anlaşılmasını derinleştirmişlerdir. İnsanlarda, beyin görüntüleme tekniklerinin önemli sınırlamaları vardır: fonksiyonel manyetik rezonans görüntüleme (fMRI) tek nöron çözünürlüğünün çok altında spatio-zamansal çözünürlük sunarken, elektroensefalografi (EEG) gibi hızlı teknikler sadece beyne dolaylı ve kısmi erişim sağlar1. Kemirgenler gibi yeterince büyük hayvan modellerinde, floresan aktivite sensörlerinin (örneğin, GCaMP) kafaya monte mikroskoplar kullanılarak kaydedilmeleri, hayvan kendi ortamında hareket ederken beyin aktivitesini gözlemlemeye izin vermektedir2. Bununla birlikte, bu teknikler şu anda beynin sadece küçük bir kısmına erişim sağlar. Kafa sabit hayvanları daha kapsamlı bir şekilde görüntülenebilir, ancak kapsama alanı hala kısmidir (örneğin, korteks yüzeyi3). Zebra balığı larvaları, C. elegans ve Drosophila gibi sadece küçük hayvanlarda, tüm beyin tek nöronlar düzeyinde veya yakınında zamansal ve mekansal çözünürlükle görüntülenebilir4.
D. melanogaster özellikle umut vericidir, çünkü uzun zamandır genetik model organizma olarak kullanılmaktadır5 ve güçlü genetik araçlar geliştirilmiştir6. Elektron mikroskopisi7'denelde edilen yeni büyük ölçekli anatomik ağ ile tamamlanan sinek, büyük ölçekli bir ağda üretilen karmaşık beyin dinamiklerini incelemek için benzersiz fırsatlar sağlayabilir8. Manikül şeffaf olmasa da ve böylece beyni görüntülemek için çıkarılması gerekse de, in vivo fonksiyonel görüntüleme 20029'daki ilk çalışmadan bu yana giderek daha yaygın bir yer haline geldi ve birkaç protokol zaten yayınlandı. Ancak, bu yöntemler, sinek kafasını vücuttan ayırmayıiçerir 10, sineğin hareketlerini ve /veya uyaranlara verilen yanıtları ciddi şekilde kısıtlar11,12,13,14,15, veya yalnızca bir görüntülenecek beynin küçük bir kısmı9,16,25,26,27,17,18,19,20,21,22,23,24. Bunlar yine de güçlü yaklaşımları tamamlamak için, son zamanlarda davranış ve çeşitli uyaranlara yanıtlar sırasında tüm beyni görüntülemek için bir hazırlık geliştirdik28.
Burada, sinek yarı natüralist davranış (yani yürüme ve tımar) gerçekleştirirken ve duyusal uyaranlara yanıt verirken tüm beyni imgelemek için özel olarak geliştirilmiş bir yöntem sunmak için bu çalışma üzerine inşa ediyoruz. Bu, antenleri ve hortumları sağlam bırakırken ve sineğin bacaklarını hareket ettirmesine izin verirken (örneğin, hava yastıklı bir topta) tüm beyne dorsal-posterior taraftan erişim sağlamak için tasarlanmış bir gözlem tutucu kullanılarak elde edilir. Başın arkasını parçalama adımları hız, tekrarlanabilirlik ve sineğin canlılığı ve hareketliliği üzerindeki etkilerini en aza indirmek için rafine edilmiştir.
Protokol
Tüm adımlar stereomikroskop altında gerçekleştirilir.
1. Tutucunun hazırlanması
- 'FlyholderVJove.stl' tutucusunu (bkz. Ek Malzeme)bir 3D yazıcı ile yazdırın veya çevrimiçi hizmetler (Şekil 1A) kullanarak yazdırın. Hem SLS (Naylon PA12) hem de multijet füzyon (PA12) uygundur.
- Kafa yuvasını oluşturun.
- Yapışkan bant parçasını düz bir yüzeye dikdörtgen olarak yerleştirin. Yaklaşık 5 mm x 1 cm'lik bir dilim kesin. Her tutucuda aynı genişliği sağlamak için sabit paralel bıçaklar (birbirine yapışmış iki neşter bıçağı) kullanarak bandın uzun tarafının ortasındaki boyun yuvasını (~400 x 400 μm) kesin(Şekil 1B).
- Bandı alt taraftaki tutucudaki deliğin düz tarafının üzerine yerleştirin (bkz. Şekil 1C ve Şekil 1D). Bant, deliğin etrafında yaklaşık 500 μm'lik emişlerle aşağı itilerek deforme edilebilir; bu, daha sonraki sinek hareketlerini daha da en aza indirecektir.
- Tamponun dışarı sızmasını önlemek için bandı ve tutucuyu üstten siyah oje ile örtün. Siyah oje ayrıca sineğin gözlerini mikroskobun heyecan verici ışığından koruyacaktır. Tutucuyu kullanmadan en az bir saat önce ojeyi kurumaya bırakın.
- Oje kuruduktan sonra, tutkalın sinek başının arkasını ıslatmayacağından emin olmak için yuvarlanmış bir doku kullanarak baş yuvasına ~ 1 μL gres ekleyin (Şekil 2A). Tutkalın yapışmasını önleyecek yağı yuvanın dışına koymamaya dikkat edin.
- Gövde yuvasını oluşturun (Şekil 2B).
- İsteğe bağlı olarak, sineğin gövdesini konumlandırmak için kullanılacak bandı önceden hazırlayın (aşağıya bakın). ~2 cm genişliğinde bir teyp parçasını ikiye kesmek ve 1,5 mm genişliğinde dilimler kesmek için Şekil 2B'de (üstte) gösterilen tasarımı kullanın. 0,3 mm derinliğinde omuzları ve gövde yuvasını kesin. Tutucuya uyduğundan emin olun.
NOT: Sinek boyutları arasındaki değişkenlik (özellikle cinsiyet, yaş, genotip veya türlerle) bant tasarımını ayarlamayı gerekli kılabilir. Kafa kötü merkezli olma eğilimindeyse, boyun yuvasının üzerine geçici olarak V şeklinde bir bant parçası eklemek yararlı olabilir (Şekil 3). Ayrıca boyun yuvasının içine ve V şeklindeki bant üzerine birkaç mikrolitre gres uygulayın.
- İsteğe bağlı olarak, sineğin gövdesini konumlandırmak için kullanılacak bandı önceden hazırlayın (aşağıya bakın). ~2 cm genişliğinde bir teyp parçasını ikiye kesmek ve 1,5 mm genişliğinde dilimler kesmek için Şekil 2B'de (üstte) gösterilen tasarımı kullanın. 0,3 mm derinliğinde omuzları ve gövde yuvasını kesin. Tutucuya uyduğundan emin olun.
2. Sineği yerleştirme
NOT: Bir ila dört günlük dişi sinekler idealdir, çünkü dişi kafa erkek kafasından daha büyük ve böylece kesilmesi daha kolaydır ve genç sinekler daha yumuşak kütiküllere sahiptir. Yürüyüş deneyleri için sinek aktivitesi, deneyleri daha yüksek sirkadiyen aktivite süreleriyle (ZT0 veya ZT11) eşleştirerek, glikoz içeren salin kullanılarak artırılabilir (103 mM NaCl, 3 mM KCl, 5 mM TES, 8 mM trehaloz 2 H2O, 10 mM glikoz, 26 mM NaHCO3, 1 mM NaH2PO4, 2,5 mM CaCl2·2 H2O, 4 mM MgCl2·6 H2O), sadece su ortamı ile 24 saate kadar sineği aç bırakarak ve deney sırasında ortamı ~28 °C'ye ısıtarak. Kanatları en az bir gün önceden kırpmak da uçma girişimlerini azaltmaya ve böylece yürüme sıklığını artırmaya yardımcı olur7,29,30.
- Petri kabını veya pipet ucu kutusu kapağını buzla doldurun, buzun üzerine bir laboratuvar dokusu yerleştirin ve tutucuyu üzerine baş aşağı yerleştirin.
- Şişesinden bir tüpe emerek ve buza üfleyerek felç etmek için buz üzerinde bir sinek aktarın (buzu eritmediğinden emin olun, bu da sineği boğar).
- Sinek hareket etmeyi bıraktığında, Şekil 4'te(solda) olduğu gibi, yuvanın içindeki boyunla tutucuya kaydırmak için donuk tokalar kullanın (sinek kanadın temelinde tutulabilir). Gözler yuvanın kenarlarına göre eşit konumlarda olmalıdır(Şekil 4, orta). Gerekirse, tutkalın başın arkasına ulaşmasını önlemek için başın üstüne 1 μL gres ekleyin (bir sonraki adıma bakın) ve daha sonra çıkarın.
- Bu adımda ve sonraki adımda sineğin hareket etmediğinden emin olmak için vücudu bir doku ve biraz buzla örtün (Şekil 4, sağ). Bacakların başa ulaşmasını önlemek için başka bir seçenek, başın hemen altında bir bant parçası kullanmaktır (bkz. Şekil 6).
3. Başın sabitlenerek
- Başı tamamen arka bir görünümden ~20° açıyla yerleştirin (yanal eksenin etrafında, bkz. Şekil 5A). Bu, görüntüye derinliği azaltmak ve diğer tarafta ön bacağı hareket ettirmek için serbest tutmak ve boynun esnemesini en aza indirmek arasında bir uzlaşmadır.
- Yuvarlanmış bir doku ile (Şekil 5B), duyusal ilgi alanını (anten, hortum ve / veya gözler) kirletmekten kaçınırken başın etrafına UV tutkal koyun. Tat deneyleri için hortumları çekin ve hareketi önlemek için tabanına tutkal ekleyin. Tat deneyi planlanmazsa, hortum en iyi şekilde kafaya itilir ve hareketi en aza indirmek için tutkalla sabitlenir (Şekil 6).
- Tutkalı 5 sn boyunca UV ışığı ile tedavi edin. Bacaklara ve/veya toprak duyusal alanlarına yapışabilecek kalan sıvı tutkalları çıkarmak için başın çevresini yuvarlanmış bir doku ile dikkatlice temizleyin.
NOT: Gerekirse tutkal yapışmasını artırmak için bant zımpara kağıdı ile pürüzlendirilebilir. - Bacakları öne taşımak için ince bir bant şeridi veya yuvarlanmış bir doku kullanın (henüz değilse), böylece bir sonraki adımda zarar görmezler.
4. Gövdenin konumlandırılması
NOT: Bu adımın hızlı bir şekilde gerçekleştirilmesi gerekir; sinek anesteziden iyileşmeden önce.
- Buz kabını çıkarın ve tutucuyu döndür. Sinek etrafındaki suyu bir mendille çıkarın.
- Gövde yuvası teybi (adım 1'de oluşturulmuştur) deliğin üzerine yerleştirin ve sineğin gövdesini hafifçe aşağı itin (Şekil 7). Boynu çok fazla germemeye dikkat edin.
5. Deliğin kapatılır
- Kalan büyük delikleri bantla kapatın.
- Orada hiçbir tutkalın ıslanmayacağından emin olmak için başın arkasına ve boyun bölgesine ~1 μL gres ekleyin.
- Yuvarlanmış bir doku ile, düzeltmek için bandın etrafına ve üstüne ve toraksa (mesonotumun üst dorsal kısmı) UV tutkal boyayın. Yapıştırıcıyı ~5 sn boyunca UV ışığı ile tedavi edin.
NOT: UV ışığının kullanımını en aza indirmek önemlidir, çünkü sinek sağlığını güçlü bir şekilde etkileyebilir. - Gresi ve kesilmemiş yapıştırıcıyı laboratuvar dokusuyla dikkatlice temizleyin.
- Başın üstüne ~1 mL salin koyun. Hava kabarcıklarını kanat çırparak bir kenara itin. Salinin üzerine bir kapak kılıfı yerleştirerek ve ön tarafta tuzlu su olup olmadığını kontrol etmek için tutucuyu döndürerek sızıntılara bakın. Herhangi bir sızıntı varsa, salini çıkarın ve deliği sabitlayın (daha fazla tutkal veya daha fazla gres ekleyerek).
NOT: Gerekirse duraklatmak için iyi bir zaman olabilir. Sinek, çırpınmasını önlemek ve sineği sakinleştirmek için yürümek için küçük bir doku parçası veya strafor topu sunulabilir.
6. Başın parçalanma
NOT: Aşağıdaki adımlar için keskinleştirilmiş forseps kullanın. Çok ince kümesler kritiktir, çünkü donuk kümesler baş manikülü açmayı zorlaştıracak ve sineğin kafasında veya beyninde ek yaralanmalara yol açabilir. Güçlü büyütme bu aşamada yardımcı olabilir. Bu amaçla, dürbün mikroskopunun okülerini 30x oküler ile değiştirebilirsiniz.
- Boynun her iki tarafındaki merkezi koyu kütiküler üçgenin tabanında iki kesik yapın (Şekil 8A'dakihaçlara bakın).
- Koyu üçgenin etrafını kesin ve manikranın bu kısmını çıkarın.
- Beyinde kas 16 ve yemek borusunun geçtiği delik artık görünür olmalı ve ritmik hareket etmelidir(Video 1, bu ritmik hareketi floresan kaslı bir sinekte sunar). Yemek borusunu delmeden kas 16'yı kesmek için bu bölgenin üst kısmını dikkatlice sıkıştırın. Beynin ritmik hareketi durduysa, kas 16 muhtemelen çıkarıldı, ancak hareket bazen duraklar ve daha sonra yeniden başlatılır. Bu nedenle ritmik hareketlere dikkat etmek ve gerekirse bu adımı tekrar gerçekleştirmek önemlidir.
- Kalan manikleyi küçük parçalar halinde kesin ve dikkatlice çıkarın. Manikleyi çok fazla çekmemeye çalış. Bunun yerine, doku parçalarını kesmek için bir makas gibi toparlayı kullanın. Karanlık üçgenin daha önce çıkarıldığı medial kenarlardan başlayabilir ve yanlara doğru çalışılabilir.
NOT: Manikül parçaları varsa yağ kütlelerinin hafifçe kazınmasını sağlamak için kullanılabilir. - Hava çuvallarını tek parça ardına, kanatçıklarla tutup yavaşça ve sabit bir şekilde çekerek çıkarın.
Sonuçlar
Yukarıda açıklanan preparat, klasik 2 foton veya konfokal mikroskopi gibi büyük ölçekli 3D görüntüleme için tüm beynin mikroskop altında gözlemlenmesine izin verir, aynı zamanda ışık tabakası31 ve diğer yapılandırılmış aydınlatma mikroskopi teknikleri(32'deincelenmiştir) veya ışık alanı mikroskopisi28gibi daha hızlı teknikler.
Davranışı gözlemlerken ve fonksiyonel duyu organlarını korurken tüm beyne erişim birkaç soruyu cevaplamayı sağlar.
İlk olarak, sinek dinlendiğinde, davranış sırasında ve uyaranlara yanıt verdiğinde genel beyin aktivitesi nedir? Örnek olarak, uyaranlara ve davranışlara verilen yanıtlar sırasında beyin aktivasyonunu gösteren bir ışık alanı mikroskobu ile elde edilen verileri dahil ediyoruz. Örneğin, Video 2'detüm nöronlarda (nsyb-GAL4 ve UAS-syt-GCaMP6s (solda) veya UAS-GCaMP6M'de (sağda) bir kalsiyum probu ifade edildi ve bir koku kabarcığı sunuldu. Hazırlığın, uyarana yanıt sırasında beyin aktivitesine genel bir bakış elde etmeye nasıl izin verdiğine dikkat edin. Drosophila'daki güçlü genetik araçlar, bu sensörlerin ekspresyonlarını belirli nöronal alt tiplerle sınırlamak için kullanılabilir. Video 3'te kalsiyum sensörünün ekspresyonunun dopaminerjik ve serotoninerjik nöronlarla (TH-GAL4, DDC-GAL4 ve UAS-GCaMP6M) ifadesini kısıtladık. Beyin üzerindeki güçlü senkron aktivitenin, davranış sırasında tüm beyni gözlemleyerek izin verilen sinek yürüyüşü ile sıkı bir şekilde ilişkili olduğuna dikkat edin. Kalsiyum aktivitesine ek olarak, diğer fiziksel veya kimyasal sinyaller görüntülenebilir (örneğin voltaj28,33,metabolizma ürünleri 34,35 veya spesifik nöromodülatörler36için sensörler kullanılarak).
Beyin aktivitesinin rolünü daha spesifik olarak anlamak için, hangi bölgelerin hangi davranışta yer aldığını, uyaranlara yanıt veya spontan aktivite kalıplarını sorabiliriz. Veriler, asıl bileşen analizi ve bağımsız bileşen analizi gibi teknikleri kullanarak işlevsel bölgeleri ayıklamak için tarafsız bir ekran olarak kullanılabilir. Şekil 9A farklı renklerde farklı işlevsel bölgeleri gösterir. Fonksiyonel bölgelerin şekli ve lokalizasyonu, beyin bölgelerini ve bazı durumlarda nöron tipini tanımlamak için anatomik şablonlarla eşlenmesine izin verir. Ayrıca, anatomik şablona hizalandıktan sonra, kantitatif analiz için anatomik beyin bölgelerinde floresan değerlerinin ortalaması alınabilir (bkz. Şekil 9B). Örneğin, Şekil 9B'deki verilere uygulanan hiyerarşik gauss modeli, bölgelerin yürüyüş sırasında daha aktif olduğunu gösterir (ΔF/F ortancası 0,029, %95 güvenilir aralık=[0.017 0.041]) ancak damat sırasında değil (ΔF/F ortanca = %95 güvenilir interval ile -0.0049=[-0.016 0.0059]).
Anlama derinliğine ek olarak, hazırlamanın izin verdiği farklı işlevsel bölgelerin eşzamanlı kayıtları, işlevsel ağın dinamik özelliklerini incelemek için kullanılabilir. Bu önemlidir, çünkü şimdiye kadar çalışılan tüm beyinlerdeki beyin bölgeleri oldukça tekrarlayıcı bir şekilde birbirine bağlıdır ve giderek daha fazla çalışma duyusal alanların bile hayvanın davranışsal durumuna yanıt verdiğini göstermektedir. İşlevsel grafik özellikleri (örneğin modüller) ve dinamik sistemlere sığabilecek mekansal-zamansal desenler gibi çeşitli yönlere bakılabilir (örnekleriçin bkz.
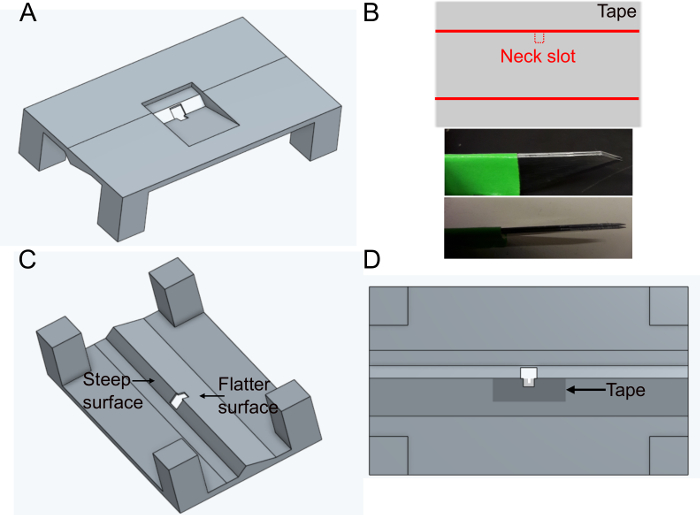
Şekil 1: Tutucunun hazırlanması (adım 1). A)Tutucu tasarımı (yukarıdan görünüm). B)Boyun yuvası hazırlığı. üst: bant tasarımı, alt: boyun yuvasını kesmek için kullanılan paralel bıçaklar. C) Tutucunun aşağıdan görünümü. D) Boyun yuvası bandının nereye ekleneceğini gösteren alt görünüm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
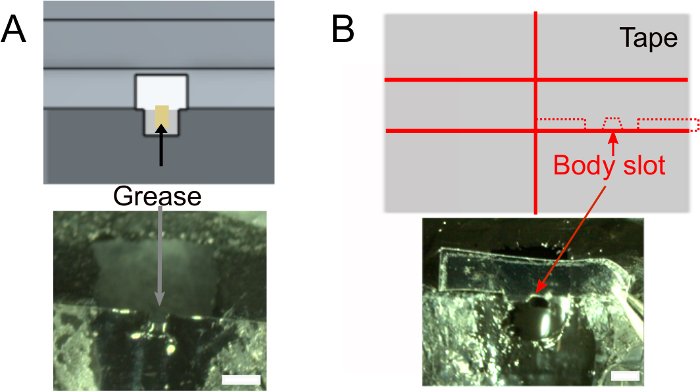
Şekil 2: Daha fazla hazırlık (adım 1). A)Başın arkasını kaplayacak yapıştırıcıyı önlemek ve tuzlu su sızıntılarını önlemek için boyun yuvasına gres ekleyin. Ölçek çubukları, 1 mm. B) Üst: gövdeyi aşağı itmek için kullanılacak bant parçasının şekli. Alt: bandın tutucuya uyduğundan emin olun. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Merkeze yardımcı olmak için v şeklinde bir bant parçasının yerleştirilmesi. (A) Alt görünüm. (B) Üst görünüm. Ölçek çubuğu, 2 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Sineği yerleştirin (adım 2). Sol, boynun boyun yuvasına olması için vücudu yerleştirmek için iki donuk tokmak kullanın. Orta, başını hizala. Gözler yuvanın kenarlarında her iki tarafta da uzanır. Sineğin kafası düz. Doğru, sineği hareket etmesini engellemek için buzla kaplı bir mendille sıkıştır. Ölçek çubuğu, 1 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: Başı sabitle (adım 3). A)Başın ideal açısı. B)Duyusal ilgi alanlarından kaçınarak başın etrafına UV tutkal ekleyin. Ölçek çubuğu, 1 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 6: Hortumun ucu ve antenleri tutkaldan uzak tutulabilir (adım 3). Beyaz daire, UV tutkalın uygulandığı alanı gösterir. Ok, koku alma ve gustatory deneyleri için tutkaldan hangi kısımların serbest bırakıldığını gösterir. Bacakların tutkal bölgesine dokunmasını önleyen isteğe bağlı banta dikkat edin. Ölçek çubuğu, 200 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 7: Arka teybi yerleştirin (adım 4.2). Adım 1'de oluşturulan bant (bkz. Şekil 2, sol) gövdeyi yerleştirmek ve tutucudaki büyük deliği kapatmak için kullanılır. Ölçek çubuğu, 1 mm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 8: Diseksiyon adımları (adım 6). A-B) Koyu üçgenin (haçlar) tabanında her iki tarafı kesin ve nikuzin C'ninbu kısmını çıkarın). D) ve E) kas 16 kaldırmak. Daha sonra tiksinti F'nin geri kalanını yavaşça çıkarın , hava Gçuvalları ) ve kasları. H) Parçalanmış kafa. Ölçek çubuğu, 200 μm. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
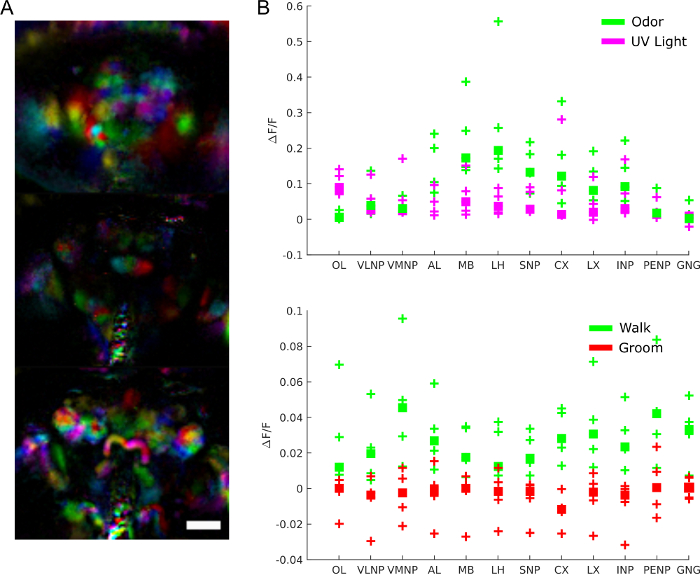
Şekil 9: Temsili sonuçlar. A)Fonksiyonel bölgeler(28'deolduğu gibi PCA ve ICA kullanılarak çıkarılır) bir ışık alanı mikroskobu ile görüntülenmiş GCaMP6 pan-nöronally'yi ifade eden bir sinek için (25x, NA=0.95 eşleşen bir f/12 mikro lens dizisi ile). Ölçek çubuğu, 100 μm. B) Uyaranlara ve davranışlara verilen yanıtlar sırasında büyük beyin bölgelerinde ortalama kalsiyum aktivitesi(28'denitibaren çoğaltılır). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Video 1: Kas 16 hareketleri (adım 6.3). GFP kaslarda ifade edildi. Nefes borusunun hemen üstündeki delikten gelen pompalama hareketine dikkat edin. Bu videoyu indirmek için lütfen tıklayınız.
Video 2: İki farklı preparat için kokuya yanıt sırasında pan-nöronal kalsiyum aktivitesi. Balzamik sirke sineğin üzerine şişirildi. Pan-nöronal kalsiyum aktivitesi (nsyb-GAL4 sürücüsü, UAS-syt-GCaMP6s sol ve UAS-GCaMP6M sağ) bir ışık alanı mikroskobu (25x, NA= 0.95 eşleşen bir f/12 mikrolens dizisi ile) ile görüntülendi. Işık alanı görüntüleri daha sonra28,37referansında açıklandığı gibi yeniden inşa edilmiştir. Bu videoyu indirmek için lütfen tıklayınız.
Video 3: Davranış sırasında nöron tipi bir alt kümede kalsiyum aktivitesi. GCaMP6 dopaminerjik ve serotoninerjik nöronlarda (TH-GAL4 ve DDC-GAL4 ile) ifade edildi. Sinek genetik araçları ile birlikte, preparat yürüyüş sırasında birçok bölgede aktivitede güçlü bir artış gözlemlemeye izin verir. Bu videoyu indirmek için lütfen tıklayınız.
Tamamlayıcı Malzeme. Bu dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Drosophila, karmaşık davranışlar sırasında tüm beynin görüntülenebildiği nadir yetişkin hayvanlardan biridir. Burada, sineği hazırlamak ve tüm beynini devam eden tüm beyin aktivitesini görüntüye maruz bırakmak için bir yöntem sunuyoruz. Birkaç önemli noktaya dikkat edilmelidir.
D. melanogaster gibi küçük bir hayvanı parçalamak zordur. Bu nedenle yöntem, ustalaşmak için çok fazla pratik ve sabır gerektirir. Ancak, eğitimden sonra, prosedür 30 dakikadan az sürer ve tekrarlanabilir sonuçlar üretir.
Sunduğumuz yöntemin ek sınırlamaları vardır. İlk olarak, sinek kafasını doğal konumundan eğmek boynun gerilmesine yol açar ve bu da bağ dokusuna, sinirlere veya kaslara zarar verebilir. İkincisi, ventral subözofageal bölgeye (SEZ) optik olarak erişilebilir olmasına rağmen, yarı saydam yemek borusunun altındadır ve bu da bu alandaki yoğunluğu ve çözünürlüğü azaltır. Son olarak, tutucu çoğu yönde ulaşılamaz olmasına rağmen, sinek hala bazen varlığını fark eder ve kaçmaya çalışmak için üzerine bastırır.
Bu sınırlamalara rağmen, davranış sırasında tüm beyin görüntülemesinden elde edilen kapsamlı veriler ve uyaranlara verilen yanıtlar, hayvan karmaşık, doğal ortamlarla etkileşime girdiğinde ve gezindiğinde beyin fonksiyonlarının tüm ağ düzeyinde deşifresini mümkün kılacaktır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Teknik yardım için Heidi Miller-Mommerskamp'a ve makale hakkında yararlı yorumlar için Iveth Melissa Guatibonza Arevalo'ya teşekkür ederiz. Protokolün ilk versiyonları Ralph Greenspan'ın laboratuvarında geliştirildi. Bu çalışma Alman araştırma vakfı (DFG), özellikle IGK'ya verilen bir HIBE (TP3) ve Simons vakfı (Aimon – 414701) ve Kavli Beyin ve Zihin Enstitüsü (#2017-954 hibe numarası) tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
Referanslar
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır