Method Article
行動と刺激反応の間に全脳イメージングのための成人ショ ウジョウバエメラノガスター を準備する
要約
行動中および刺激に反応して、成人 ショウジョウバエ の脳全体を画像化するために特別に調整された方法を提示する。頭部は脳全体への光学的アクセスを可能にする位置にあり、ハエは脚と触角、プロボシスの先端を動かすことができるので、目は感覚刺激を受けることができる。
要約
歩行などの継続的な行動の間に ショウジョウバエ の脳全体をイメージするために特別に開発された方法を提示する。頭部固定および解剖は、動作への影響を最小限に抑えるように最適化されています。これは、動きの障害を最小限に抑えるホルダーを使用することで、最初に達成されます。ハエの頭の後ろは、歩く、グルーミング、匂い、味わい、見るハエの能力を保持しながら、脳全体への光学アクセスを可能にする角度でこのホルダーに接着されています。頭部の後頭部は、光路の組織および頭部運動のアーティファクトを担う筋肉を除去するために解剖される。フライ脳は、その後、例えばカルシウムや電圧指標を使用して、歩行やグルーミングなどの特定の行動の間、および異なる刺激に応答して、脳活動を記録するために画像化することができます。かなりの練習を必要とする挑戦的な解剖が習得されると、この技術は、脳活動全体を行動および刺激応答に関連する豊富なデータセットを記録することを可能にする。
概要
様々な技術を用いた脳活動のイメージングは、脳機能の理解を深めています。脳イメージング技術は重要な制限を有する:機能的磁気共鳴画像法(fMRI)は単一ニューロン分解能をはるかに下回る時空間分解能を提供するが、脳波(EEG)のような高速技術は脳への間接的かつ部分的なアクセスのみを可能にする1。げっ歯類のような十分に大きな動物モデルでは、頭部取付け顕微鏡を用いた蛍光活動センサ(例えばGCaMP)の記録は、動物がその環境内で移動している間に脳活動を観察することを可能にする2。それにもかかわらず、これらの技術は現在、脳のごく一部へのアクセスのみを与える。頭部固定動物はより包括的に画像化することができるが、カバレッジはまだ部分的である(例えば、皮質表面3)。ゼブラフィッシュの幼虫 、C.エレガンス 、 ショウジョウバエ などの小動物でのみ、脳全体が単一ニューロン4のレベルまたはそれに近いレベルで時間的および空間的解像度で画像化することができる。
D.メラノガスターは、長い間遺伝モデル生物5として使用されてきたので特に有望であり、強力な遺伝ツールが6開発されている。電子顕微鏡7に由来する新しい大規模解剖学的ネットワークによって補完され、ハエは大規模ネットワーク8で生成された複雑な脳のダイナミクスを研究するユニークな機会を提供することができる。キューティクルは透明ではなく、脳を画像化するために除去する必要がありますが、生体内機能イメージングは2002年9年の最初の研究以来ますます一般的な場所となっており、いくつかのプロトコルがすでに公開されています。しかし、これらの方法は、ハエヘッドをボディ10から分離するか、ハエの動きや刺激11、12、13、14、15に対する応答を厳しく制限するか、または脳の小さな部分を9、16、25、26、20、21、22、22、21、22、24にしか与え、または20、21、22、24である。これらの強力なアプローチを補完するために、我々は最近、様々な刺激に対する行動と応答の間に脳全体をイメージするための準備を開発しました28.
ここでは、この研究に基づいて、ハエが半自然主義的な行動(すなわち歩行およびグルーミング)を行い、感覚刺激に反応する間、脳全体を画像化するために特別に開発された方法を提示する。これは、後部側から脳全体へのアクセスを与え、触角とプロボシスをそのまま残し、ハエが足を歩いて歩くことを可能にするように設計された観測ホルダーを使用することによって達成される(例えば、エアクッションボールで)。頭部の後部を解剖するためのステップは速度、再現性のために改良され、そしてハエの生存性および移動性への影響を最小にする。
プロトコル
すべてのステップは実体顕微鏡で行われる。
1. ホルダーの準備
- 3D プリンタでホルダー 'FlyholderVJove.stl' を印刷するか ( 補足資料を参照)、オンライン サービスを使用して印刷します (図 1A)。SLS(ナイロンPA12)とマルチジェット融合(PA12)の両方が適しています。
- ヘッドスロットを作成します。
- 粘着テープを平らな面に長方形に置きます。約5mm×1cmのスライスを切ります。固定の平行な刃(2つのメスの刃がくっついた2つのメスの刃)を使用して、テープの長い側の中央にネックスロット(約400 x 400 μm)を切り取り、すべてのホルダーに同じ幅を確保します(図1B)。
- テープを下部のホルダーの穴の平坦な側に置きます( 図1C および 図1Dを参照)。テープは、穴の周りに鉗子〜500 μmでそれを押し下げることによって変形することができる;これにより、後のフライの動きをさらに妨げるのを最小限に抑えることができます。
- テープとホルダーを上から黒いマニキュアで覆い、バッファーが漏れないようにします。黒いマニキュアはまた顕微鏡の励起ライトからハエの目を保護する。ホルダーを使用する前に、マニキュアを少なくとも1時間乾燥させてください。
- マニキュアが乾いたら、ロール組織を使用してヘッドスロットに約1μLのグリースを加え、接着剤がハエの頭部の背面を濡らさないようにします(図2A)。接着剤が付着するのを防ぐスロットの外にグリースを置かないようにしてください。
- ボディスロットを作成します(図2B)。
- 必要に応じて、フライの本体を配置するために使用するテープを事前に準備します(下記参照)。 図2B(上)に示すデザインを使用して、2cm幅のテープを2枚に切り、幅1.5mmのスライスをカットします。0.3mmの深い肩とボディスロットを切り取ります。ホルダーに合っていることを確認します。
注:フライサイズ(特に性別、年齢、遺伝子型または種)の間の変動は、テープの設計を調整する必要があります。ヘッドが中心が不整合になりがちな場合は、V字型のテープを一時的にネックスロットに追加すると便利です(図3)。また、ネックスロットとV字テープの中に数マイクロリットルのグリースを塗布します。
- 必要に応じて、フライの本体を配置するために使用するテープを事前に準備します(下記参照)。 図2B(上)に示すデザインを使用して、2cm幅のテープを2枚に切り、幅1.5mmのスライスをカットします。0.3mmの深い肩とボディスロットを切り取ります。ホルダーに合っていることを確認します。
2. フライを配置する
注:1〜4日の雌のハエは、女性の頭が男性の頭よりも大きく、解剖が容易で、若いハエはより柔らかいキューティクルを持っているので理想的です。歩行実験の場合、ハエの活性は、より高い概日活性(ZT0またはZT11)の時間と実験を一致させることによって増加することができ、グルコースを含む生理食類(例えば103mMNaCl、、 3 mM KCl、5 mM TES、8 mM トレハロース2 H2O、10 mMグルコース、26 mM NaHCO3、1mM NaH2PO 4、2.5 mM CaCl2·2 H22 O、4 mM MgCl2·6H2O)を水のみで24時間までフライを飢えさせることにより、28°C°C°Cの間に加熱した。少なくとも1日前に翼をクリッピングすることも飛行の試みを減らすのに役立ち、したがって、7、29、30を歩く頻度を増加させます。
- ペトリ皿またはピペットチップボックスの蓋に氷を入れ、実験室の組織を氷の上に置き、ホルダーを逆さまにします。
- 氷の上でハエを移して、バイアルからチューブに吸い込んで氷の上に吹き飛ばして麻痺させる(氷が溶かしてハエを溺れさせないことを確認してください)。
- フライが動かなくなったら、鈍い鉗子を使用して、スロットの内側にネックを持つホルダーにスライドさせます(ハエは翼の基礎で保持できます)。 図4(左)。。目はスロットの側面に対して等しい位置にする必要があります(図4、中央)。必要に応じて、頭の上部に1 μLのグリースを加えて、接着剤(次のステップを参照)が頭部の後ろに届かないようにし、後で取り外します。
- 体を組織と氷で覆い、このステップと次の段階でハエが動かないようにします(図4、右)。脚が頭部に到達するのを防ぐもう 1 つの方法は、ヘッドのすぐ下にあるテープを使用することです ( 図 6を参照)。
3. ヘッドの固定
- 完全後視から頭部を〜20°の角度に配置します(横軸の周り、 図5Aを参照)。これは、画像への深さを減らすと、前脚を自由に動かすことを維持し、首の伸びを最小限に抑える反対側の妥協点です。
- 巻き上げたティッシュ(図5B)を使って、関心のある感覚領域(触角、プロボシスおよび/または目)を汚さないようにしながら、頭の周りにUV接着剤を入れます。味の実験のために、プロボシスを引き出し、動きを防ぐためにそのベースに接着剤を追加します。味の実験が計画されていない場合、プロボシスは頭に押し込まれ、動きを最小限に抑えるために接着剤で固定するのが最善です(図6)。
- 5 sのUV-ライトで接着剤を治す。慎重に巻き上げた組織で頭の周囲をきれいにして、脚や土壌感覚領域に付着する可能性のある残りの液体接着剤を取り除きます。
注:テープは、必要に応じて接着剤の接着を増加させるためにサンドペーパーで粗くすることができます。 - テープの薄いストリップまたはロールアップされたティッシュを使用して脚を前に移動します(まだ動かしていない場合)、次のステップで損傷を受けないようにします。
4. ボディの配置
注: この手順は、高速で実行する必要があります。ハエが麻酔から回復する前に。
- 氷容器を取り外し、ホルダーを回します。ティッシュでハエの周りの水を取り除きます。
- ボディスロットテープ(ステップ1で作成)を穴の上に置き、フライのボディを軽く押し下げます(図7)。首を伸ばしすぎないように注意してください。
5. 穴の密閉
- テープで残りの大きな穴をカバーします。
- 約1μLのグリースを頭の後ろと首の部分に加えて、接着剤が濡れないようにします。
- 巻き上げティッシュで、それを修正するためにテープの周りと上と胸郭(メソノータムの上部の後ろ側部分)にUV接着剤をペイントします。〜5 sのUV-ライトで接着剤を硬化させる。
注: フライの健康に強く影響を与える可能性があるため、UV ライトの使用を最小限に抑えることが重要です。 - 実験室のティッシュと慎重にきれいなグリースおよび未硬化の接着剤。
- 頭の上に約1mLの生理液を入れます。鉗子で気泡を脇に押し出します。カバースリップを生理し、ホルダーを回して前面の生理的な検査を行い、漏れを探します。漏れがある場合は、生理し、穴を固定します(接着剤またはグリースを追加します)。
注: 必要に応じて、この時間を一時停止する良い時間です。ハエは、発泡を防ぎ、フライダウンを落ち着かせるために歩くために、ティッシュや発泡スチロールボールの小片を提供することができます。
6. 頭を解剖する
注: 次の手順でシャープな鉗子を使用します。鈍い鉗子は頭部のキューティクルを開くことをより困難にし、ハエの頭部または脳の付加的な傷害につながる可能性があるため、非常に細かい鉗子は重大である。この段階では、強い倍率が役立ちます。その目的のために、双眼顕微鏡の眼を30倍の眼に置き換えることができます。
- 首の両側にある中央の暗いカツキュリ三角形の底部に2つのカットを行います( 図8Aの十字架を参照)。
- 暗い三角形の周りにカットし、キューティクルのこの部分を削除します。
- 筋肉16と食道が行く脳の穴が今見えるようにしてリズミカルに動く必要があります(ビデオ1 は、蛍光筋肉を持つハエでこのリズミカルな動きを提示します)。食道を穿刺せずに筋肉16を切断するために慎重にこの領域の上部をつまみます。脳のリズミカルな動きが止まった場合、筋肉16は取り除かれる可能性が高く、しかし、動きは時々一時停止し、後で再開する。したがって、リズミカルな動きに注意を払い、必要に応じてこのステップをもう一度実行することが重要です。
- 残りのキューティクルを小さく切り、慎重に取り除きます。キューティクルを引っ張りすぎないようにしてください。代わりに、組織の破片をカットするために、はさみのペアのような鉗子を使用しています。内側の端から始めることができ、暗い三角形は以前に取り除かれ、側面に向かうことができます。
注:キューティクルの破片は、存在する場合は、脂肪体の穏やかに削るために使用することができます。 - フォースでそれらをつかみ、ゆっくりと着実に引っ張ることによって、エアサックを次々と取り除く。
結果
上記の調製は、古典的な2光子または共焦点顕微鏡のような大規模な3Dイメージングのための顕微鏡下での脳全体の観察を可能にするが、光シート31 および他の構造化された照明顕微鏡技術(32で検討)、または光場顕微鏡28のようなより速い技術も可能にする。
行動を観察し、機能的な感覚器官を維持しながら、脳全体へのアクセスは、いくつかの質問に答えることを可能にします。
まず、ハエが休息しているとき、行動中、および刺激に反応するとき、全体的な脳活動は何ですか?例として、刺激や行動に対する応答時の脳活性化を示す光場顕微鏡で得られたデータを挙げてください。例えば、ビデオ2では、すべてのニューロン(nsyb-GAL4およびUAS-syt-GCaMP6s(左)またはUAS-GCaMP6M(右))でカルシウムプローブが発現し、臭いのパフが提示された。準備が刺激に対する応答の間に脳活動の概要を得ることを可能にする方法に注意してください。ショウジョウバエの強力な遺伝的ツールは、特定の神経サブタイプにこれらのセンサーの発現を制限するために使用することができます。ビデオ3では、カルシウムセンサーの発現をドーパミン作動性およびセロトニン作動性ニューロン(TH-GAL4、DDC-GAL4およびUAS-GCaMP6M)に制限しました。脳上の強い同期活動は、行動中に脳全体を観察することによって許可されたハエの歩行と密接に相関していることに注意してください。カルシウム活性に加えて、他の物理的または化学的信号を画像化することができる(例えば電圧28、33、代謝産物34、35または特定の神経調節剤36のためのセンサーを使用)。
脳活動の役割をより具体的に理解するために、どのような領域がどのような行動、刺激反応、または自発的な活動パターンに関与しているのかを尋ねることができます。データは、主成分分析や独立成分分析などの手法を用いて機能領域を抽出する、公平な画面として実際に使用することができます。 図9Aは 、異なる色で異なる機能領域を示しています。機能的領域の形状と局在化により、脳領域を識別し、場合によってはニューロンの種類を識別するために解剖学的テンプレートにマッピングすることができます。さらに、解剖学的テンプレートに一致すると、定量的分析のために解剖学的脳領域で蛍光値を平均化することができる( 図9Bを参照)。たとえば、 図 9B のデータに適用される階層ガウス モデルは、歩行中の領域のアクティブ性が高い (ΔF/F 中央値が 0.029、95% 信頼できる間隔=[0.017 0.041]) が、グルーミング中にはアクティブでないことがわかります (ΔF/F 中央値 = -0.0049 95% 信頼できる区間=-0.016.009])。
理解深度に加えて、準備によって許可される異なる機能領域の同時記録は、機能ネットワークの動的特性を研究するために使用することができる。これまでに研究されたすべての脳の脳領域は非常に再び相互接続されており、ますます多くの研究は、感覚領域でさえ動物の行動状態に反応することを示しているので、これは重要です。機能的なグラフプロパティ(例えば、モジュール)や、動的系に適合する時空間パターンなど、いくつかの側面を見ることができます(例については8 を参照)。
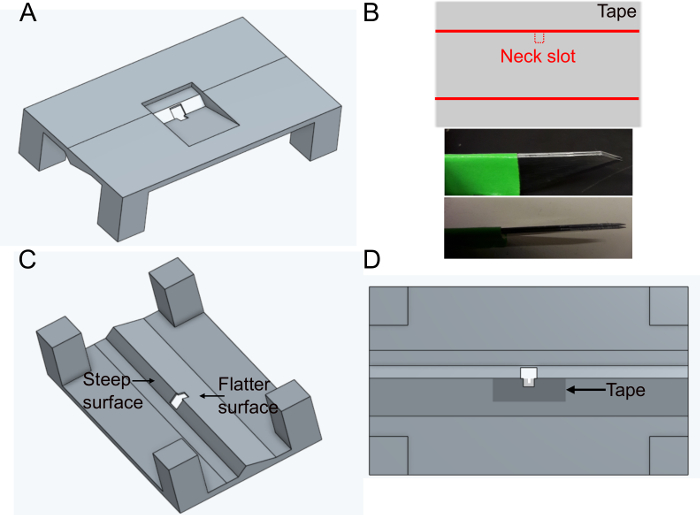
図1:ホルダーの準備(ステップ1)。A)ホルダーデザイン(上から見た眺め)。 B)ネックスロットの準備。上:テープの設計、底:ネックスロットを切断するために使用される平行な刃。 C)ホルダーの下からの眺め。D) ネックスロットテープを追加する場所を示すボトムビュー。 この図の大きなバージョンを表示するには、ここをクリックしてください。
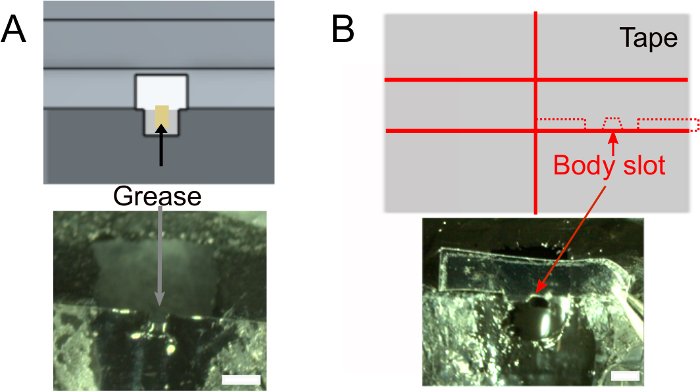
図2:さらなる準備(ステップ1)。A)ヘッドの背面を覆い、生理的な漏れを防ぐために、接着剤を防ぐために、ネックスロットにグリースを追加します。スケールバー、1 mm B)トップ:ボディを押し下げるために使用されるテープのピースの形状。下:テープがホルダーに合っていることを確認します。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:中央に配置するV字型テープの配置(A) ボトムビュー(B) トップビュースケールバー、2 mm. この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:フライを配置します(ステップ2)。左、首がネックスロットにあるように体を配置するために2つの鈍い鉗子を使用しています。真ん中、頭を合わせます。目はスロットの端の両側にあります。ハエの頭はまっすぐです。右、動かないように氷で覆われたティッシュでハエをタックします。スケールバー、1 mm. この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:ヘッドを固定します(ステップ3)。)頭の理想的な角度。 B)頭部の周囲にUV接着剤を追加し、関心のある感覚領域を避けます。スケールバー、1 mm. この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:プロボシスの先端とアンテナは、接着剤から自由に保つことができます(ステップ3)。白い円は、UV 接着剤が適用されている領域を示します。矢印は、嗅覚および実験のための接着剤から自由に残されている部分を示しています。脚が接着領域に触れないようにするオプションのテープに注意してください。スケールバー、200 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。

図 7: バック テープを配置します (手順 4.2)。ステップ 1 で作成したテープ ( 図 2、左を参照) を使用して、本体を配置し、ホルダーに大きな穴を開けます。スケールバー、1 mm. この図の大きなバージョンを表示するには、ここをクリックしてください。

図 8: 解剖手順 (手順 6)。A-B)暗い三角形(十字架)の底部の両側にカットし、キューティクル Cのこの部分を取り除きます。 D)及び E)は筋16を除去する。その後、キューティクル Fの残りの部分、空気袋 G)、筋肉をそっと取り除きます。 H)解剖された頭部。スケールバー、200 μm. この図の大きなバージョンを表示するには、ここをクリックしてください。
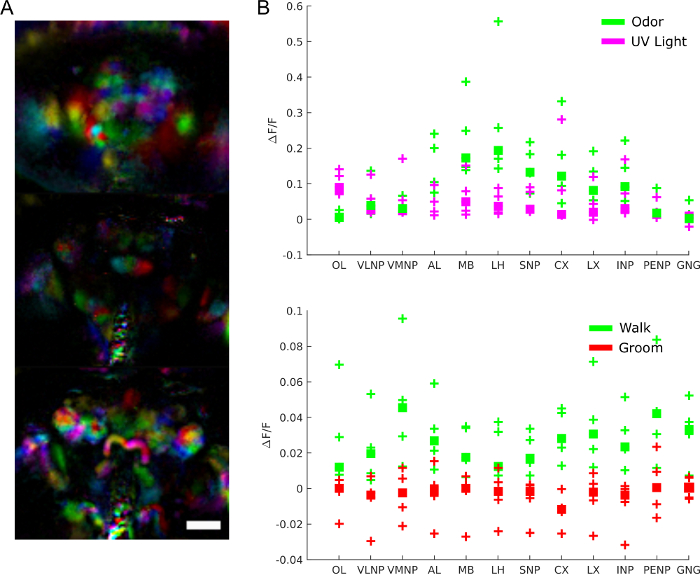
図9:代表的な結果。 A)光場顕微鏡で画像化されたGCaMP6パンニューロンを発現するハエ用の機能領域(PCAおよびICAを用いて抽出した28)(25x、NA=0.95、f/12マイクロレンズアレイに一致する)スケールバー, 100 μm. B) 刺激と行動に対する応答時の大脳領域におけるカルシウム活性の平均(28から再現)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ビデオ1:筋肉16の動き(ステップ6.3)。 GFPは筋肉で表現された。気管のすぐ上の穴から来るポンプの動きに注意してください。 こちらをクリックして、このビデオをダウンロードしてください。
ビデオ2:2つの異なる製剤のための臭気に応答中の汎神経細胞カルシウム活性。バルサミコ酢をその場にふくらませた。汎ニューロンカルシウム活性(nsyb-GAL4ドライバー、UAS-syt-GCaMP6s左およびUAS-GCaMP6M右)を光場顕微鏡(25x、NA=0.95、一致するf/12マイクロレンズアレイ)で画像化した。次に、光場画像は ref.28,37に記述されているように再構築されました。こちらをクリックして、このビデオをダウンロードしてください。
ビデオ3:行動中のニューロン型サブセットにおけるカルシウム活性。 GCaMP6はドーパミン作動性およびセロトニン作動性ニューロン(TH-GAL4およびDDC-GAL4)で発現した。ハエ遺伝ツールとの組み合わせで、準備は、歩行中に多くの領域での活動の強い増加を観察することができます。 こちらをクリックして、このビデオをダウンロードしてください。
ディスカッション
ショウジョウバエ は、複雑な行動の間に脳全体を画像化することができる珍しい成虫動物の一つです。ここでは、ハエを準備し、進行中の脳活動全体を画像化するために脳全体を露出する方法を提示する。いくつかの重要な点に注意する必要があります。
D.メラノガスターのような小さな動物を解剖することは困難です。この方法は、このようにそれを習得するために多くの練習と忍耐を必要とします。しかし、トレーニング後、手順は30分未満で、再現性の高い結果を生成します。
我々が提示した方法には、追加の制限があります。まず、その自然な位置からハエの頭を傾けると、結合組織、神経または筋肉に損傷を与える可能性のある首を伸ばすことができます。第2に、腹側食道領域(SEZ)は光学的にアクセス可能であるが、半透明食道より下にあり、この領域の強度と解像度が低下する。最後に、ホルダーはほとんどの方向に手の届かないところにありますが、ハエはまだ時々その存在を認識し、脱出しようとするそれを押します。
これらの制限にもかかわらず、行動中の脳イメージング全体から得られた包括的なデータと刺激への応答は、動物が複雑で自然主義的な環境と相互作用し、ナビゲートするときに、ネットワーク全体のレベルで脳機能を解読することを可能にします。
開示事項
著者らは開示するものは何もない。
謝辞
ハイジ・ミラー=モマーズカンプの技術的な助け、アイヴス・メリッサ・グアティボンザ・アレバロの原稿に対する有益なコメントに感謝します。プロトコルの初期バージョンはラルフグリーンスパンの研究室で開発されました。この研究は、ドイツ研究財団(DFG)、特にIGKへの助成金FOR2705(TP3)、およびサイモンズ財団(アイモン - 414701)とカブリ脳と心研究所(認可番号#2017-954)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
参考文献
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved