Method Article
Vorbereitung von Adult Drosophila melanogaster für die Bildgebung des gesamten Gehirns während des Verhaltens und der Stimuli-Reaktionen
In diesem Artikel
Zusammenfassung
Wir präsentieren eine Methode, die speziell auf das Bild des gesamten Gehirns von erwachsenen Drosophila während des Verhaltens und als Reaktion auf Reize zugeschnitten ist. Der Kopf ist positioniert, um den optischen Zugang zum gesamten Gehirn zu ermöglichen, während die Fliege ihre Beine und die Antennen, die Spitze des Proboscis bewegen kann, und die Augen sensorische Reize empfangen können.
Zusammenfassung
Wir präsentieren eine Methode, die speziell entwickelt wurde, um das gesamte Drosophila-Gehirn während des laufenden Verhaltens wie Gehen abzubilden. Kopffixierung und -sektion sind optimiert, um deren Auswirkungen auf das Verhalten zu minimieren. Dies wird zuerst durch die Verwendung eines Halters erreicht, der Bewegungshindernisse minimiert. Die Rückseite des Fliegenkopfes wird in einem Winkel an diesen Halter geklebt, der optischen Zugang zum gesamten Gehirn ermöglicht, während die Fähigkeit der Fliege zu gehen, zu pflegen, zu riechen, zu schmecken und zu sehen. Der Hinterkopf des Kopfes wird seziert, um Gewebe im optischen Pfad und Muskeln zu entfernen, die für Kopfbewegungsartefakte verantwortlich sind. Das Fliegenhirn kann anschließend abgebildet werden, um die Gehirnaktivität aufzuzeichnen, z. B. mithilfe von Kalzium- oder Spannungsindikatoren, bei bestimmten Verhaltensweisen wie Gehen oder Pflegen und als Reaktion auf unterschiedliche Reize. Sobald die anspruchsvolle Sezierung, die erhebliche Übung erfordert, gemeistert wurde, ermöglicht diese Technik, reiche Datensätze aufzuzeichnen, die die gesamte Gehirnaktivität mit Verhaltens- und Stimulusreaktionen in Beziehung setzen.
Einleitung
Bildgebende Gehirnaktivität mit verschiedenen Techniken haben das Verständnis der Gehirnfunktion vertieft. Beim Menschen haben Bildgebungstechniken des Gehirns wichtige Einschränkungen: Während die funktionelle Magnetresonanztomographie (fMRI) eine räumlich-zeitliche Auflösung weit unter der Auflösung einzelner Neuronen bietet, erlauben schnelle Techniken wie die Elektroenzephalographie (EEG) nur den indirekten und teilweisen Zugriff auf das Gehirn1. In ausreichend großen Tiermodellen wie Nagetieren ermöglicht die Aufzeichnung von fluoreszierenden Aktivitätssensoren (z.B. GCaMP) mit Kopfmikroskopen die Beobachtung der Hirnaktivität, während sich das Tier in seiner Umgebung bewegt2. Dennoch bieten diese Techniken derzeit nur Zugang zu einem kleinen Teil des Gehirns. Kopffixierte Tiere können umfassender abgebildet werden, aber die Abdeckung ist noch partiell (z. B. die Kortexoberfläche3). Nur bei Kleintieren, wie den Zebrafischlarven, C. elegans und Drosophila, kann das ganze Gehirn mit zeitlicher und räumlicher Auflösung auf der Ebene oder nahe an einzelnen Neuronen4abgebildet werden.
D. melanogaster ist besonders vielversprechend, weil es seit langem als genetischer Modellorganismus verwendet wird5 und leistungsfähige genetische Werkzeuge entwickelt wurden6. Ergänzt durch das neue groß angelegte anatomische Netzwerk, das aus der Elektronenmikroskopie7abgeleitet wurde, könnte die Fliege einzigartige Möglichkeiten bieten, komplexe Gehirndynamiken zu untersuchen, die in einem großen Netzwerk erzeugt werden8. Obwohl die Nagelhaut nicht transparent ist und daher entfernt werden muss, um das Gehirn abzubilden, ist die funktionelle In-vivo-Bildgebung seit der ersten Studie im Jahr 20029 immer häufiger an der Tagesordnung und mehrere Protokolle wurden bereits veröffentlicht. Diese Methoden beinhalten jedoch entweder die Trennung des Fliegenkopfes vom Körper10, die stark einschränkenden Bewegungen der Fliege und/oder die Reaktionen auf Reize11,12,13,14,15, oder nur erlauben, einen kleinen Teil des Gehirns abgebildet werden9,16,25,26,27,17,18,19,20,21,22,23,24. Um diese dennoch starken Ansätze zu ergänzen, haben wir vor kurzem eine Vorbereitung entwickelt, um das gesamte Gehirn während des Verhaltens und der Reaktionen auf verschiedene Reize abzubilden28.
Hier bauen wir auf dieser Studie auf, um eine Methode zu präsentieren, die speziell entwickelt wurde, um das gesamte Gehirn abzubilden, während die Fliege semi-naturalistisches Verhalten (d. h. Gehen und Pflege) ausführt und auf sensorische Reize reagiert. Dies wird erreicht, indem ein Beobachtungshalter verwendet wird, der entworfen wurde, um den Zugang zum gesamten Gehirn von der dorsal-posterioren Seite zu ermöglichen, während die Antennen und Proboscis intakt bleiben, und es der Fliege ermöglicht, ihre Beine zu gehen (z. B. auf einem luftgepolsterten Ball). Schritte zur Sezieren des Hinterkopfes wurden auf Geschwindigkeit, Reproduzierbarkeit und deren Auswirkungen auf die Lebensfähigkeit und Beweglichkeit der Fliege verfeinert.
Protokoll
Alle Schritte werden unter einem Stereomikroskop durchgeführt.
1. Vorbereitung des Halters
- Drucken Sie den Halter 'FlyholderVJove.stl' (siehe Ergänzendes Material) mit einem 3D-Drucker oder lassen Sie ihn mit Online-Diensten drucken (Abbildung 1A). Sowohl SLS (Nylon PA12) als auch Multijet Fusion (PA12) sind geeignet.
- Erstellen Sie den Kopfschlitz.
- Legen Sie ein Stück Klebeband rechteckig auf eine flache Oberfläche. Schneiden Sie eine Scheibe von ca. 5 mm x 1 cm. Schneiden Sie den Halsschlitz (ca. 400 x 400 m) in der Mitte der längeren Seite des Bandes mit festen parallelen Klingen (zwei Skalpellklingen zusammengeklebt), um die gleiche Breite in jedem Halter zu gewährleisten(Abbildung 1B).
- Legen Sie das Band über die flachere Seite des Lochs in der Halterung auf der Unterseite (siehe Abbildung 1C und Abbildung 1D). Das Band kann verformt werden, indem es mit Zangen von 500 m um das Loch nach unten gedrückt wird; Dadurch werden spätere Flugbewegungen weiter minimiert.
- Bedecken Sie das Band und den Halter von oben mit schwarzem Nagellack, um zu verhindern, dass der Puffer austritt. Der schwarze Nagellack schützt auch die Augen der Fliege vor dem Anregungslicht des Mikroskops. Lassen Sie den Nagellack mindestens eine Stunde vor der Verwendung des Halters trocknen.
- Sobald der Nagellack trocken ist, fügen Sie mit einem gewalzten Gewebe 1 L Fett in den Kopfschlitz ein, um sicherzustellen, dass der Kleber die Rückseite des Fliegenkopfes nicht benetzt (Abbildung 2A). Stellen Sie sicher, dass Sie kein Fett außerhalb des Schlitzes setzen, das das Kleben des Klebers verhindern würde.
- Erstellen Sie den Körpersteckplatz (Abbildung 2B).
- Optional bereiten Sie das Band vor, mit dem der Körper der Fliege positioniert wird (siehe unten). Verwenden Sie das in Abbildung 2B (oben) gezeigte Design, um ein Stück mit einem 2 cm breiten Klebeband in zwei Teile zu schneiden und 1,5 mm breite Scheiben zu schneiden. 0,3 mm tiefe Schultern und Körperschlitz ausschneiden. Stellen Sie sicher, dass es zum Halter passt.
HINWEIS: Die Variabilität zwischen Fliegengrößen (insbesondere bei Geschlecht, Alter, Genotyp oder Art) kann eine Anpassung des Banddesigns erforderlich machen. Wenn der Kopf dazu neigt, schlecht zentriert zu sein, kann es hilfreich sein, ein V-förmiges Stück Klebeband vorübergehend über den Halsschlitz hinzuzufügen (Abbildung 3). Tragen Sie auch ein paar Mikroliter Fett in den Nackenschlitz und auf das V-förmige Band auf.
- Optional bereiten Sie das Band vor, mit dem der Körper der Fliege positioniert wird (siehe unten). Verwenden Sie das in Abbildung 2B (oben) gezeigte Design, um ein Stück mit einem 2 cm breiten Klebeband in zwei Teile zu schneiden und 1,5 mm breite Scheiben zu schneiden. 0,3 mm tiefe Schultern und Körperschlitz ausschneiden. Stellen Sie sicher, dass es zum Halter passt.
2. Platzieren der Fliege
HINWEIS: Ein bis vier Tage alte weibliche Fliegen sind ideal, weil der weibliche Kopf größer und damit leichter zu sezieren ist als der männliche Kopf, und jüngere Fliegen haben weichere Nagelhaut. Bei Gehexperimenten kann die Aktivität der Fliege erhöht werden, indem die Experimente mit Zeiten höherer zirkadianer Aktivität (ZT0 oder ZT11) in Einklang stehen, indem salinehaltige Glukose (z. B. 103 mM NaCl, 3 mM KCl, 5 mM TES, 8 mM Trehalose 2 H2O, 10 mM Glukose, 26 mM NaHCO3, 1 mM NaH2PO4, 2,5 mM CaCl2,2 H2 O,4 mM MgCl2,6 H2O), durch Aushungern der Fliege bis zu 24 h mit einer reinen Wasserumgebung und durch Erhitzen der Umgebung auf 28 °C während des Experiments. Das Abschneiden der Flügel mindestens einen Tag im Voraus hilft auch, die Flugversuche zu verringern und damit die Häufigkeit von Gehkämpfen7,29,30zu erhöhen.
- Füllen Sie eine Petrischale oder Pipette-Spitze Kastendeckel mit Eis, legen Sie ein Laborgewebe auf das Eis und stellen Sie den Halter auf den Kopf darauf.
- Übertragen Sie eine Fliege auf Eis, um sie zu lähmen, indem Sie sie von ihrer Durchstechflasche in eine Röhre saugen und auf das Eis blasen (stellen Sie sicher, dass das Eis nicht geschmolzen ist, was die Fliege ertränken würde).
- Wenn sich die Fliege nicht mehr bewegt, schieben Sie sie mit stumpfer Zange in den Halter mit dem Hals innerhalb des Schlitzes (die Fliege kann an der Basis des Flügels gehalten werden), wie in Abbildung 4 (links). Die Augen sollten in Bezug auf die Seiten des Schlitzes an gleichen Positionen sein(Abbildung 4, Mitte). Fügen Sie bei Bedarf 1 L Fett auf die Oberseite des Kopfes, um zu verhindern, dass der Kleber (siehe nächster Schritt) die Rückseite des Kopfes erreicht und später entfernt.
- Bedecken Sie den Körper mit einem Gewebe und etwas Eis, um sicherzustellen, dass sich die Fliege während dieses und nächsten Schritts nicht bewegt (Abbildung 4, rechts). Eine weitere Möglichkeit, zu verhindern, dass die Beine den Kopf erreichen, ist die Verwendung eines Stücks Klebeband direkt unter dem Kopf (siehe Abbildung 6).
3. Sicherung des Kopfes
- Platzieren Sie den Kopf in einem Winkel von 20° aus einer vollständig hinteren Ansicht (um die Seitenachse, siehe Abbildung 5A). Dies ist ein Kompromiss zwischen der Verringerung der Tiefe auf das Bild und auf der anderen Seite, das vordere Bein frei zu bewegen und die Dehnung des Halses zu minimieren.
- Mit einem aufgerollten Gewebe (Abbildung 5B) legen Sie UV-Kleber um den Kopf, während sie eine Verschmutzung des sensorischen Interessenbereichs (Antennen, Proboscis und/oder Augen) vermeiden. Für Geschmacksexperimente ziehen Sie die Proboscis heraus und fügen Sie Kleber an seiner Basis hinzu, um Bewegung zu verhindern. Wenn kein Geschmacksexperiment geplant ist, wird der Proboscis am besten in den Kopf geschoben und mit Kleber fixiert, um die Bewegung zu minimieren (Abbildung 6).
- Den Kleber mit UV-Licht für 5 s aushärten. Reinigen Sie die Umgebung des Kopfes sorgfältig mit einem aufgerollten Gewebe, um restliche flüssige Kleber zu entfernen, die an den Beinen und/oder Bodensensorienbereichen kleben könnten.
HINWEIS: Das Band kann mit Schleifpapier rauhet werden, um die Klebehaftung bei Bedarf zu erhöhen. - Verwenden Sie einen dünnen Streifen Klebeband oder ein aufgerolltes Gewebe, um die Beine nach vorne zu bewegen (wenn sie nicht bereits vorhanden sind), damit sie durch den nächsten Schritt nicht beschädigt werden.
4. Positionierung des Körpers
ANMERKUNG: Dieser Schritt muss schnell ausgeführt werden; bevor sich die Fliege von der Anästhesie erholt.
- Entfernen Sie den Eisbehälter und drehen Sie den Halter um. Entfernen Sie das Wasser um die Fliege mit einem Gewebe.
- Legen Sie das Körperschlitzband (erstellt in Schritt 1) über das Loch und drücken Sie den Körper der Fliege sanft nach unten (Abbildung 7). Achten Sie darauf, den Hals nicht zu sehr zu strecken.
5. Versiegelung des Lochs
- Bedecken Sie alle verbleibenden großen Löcher mit Klebeband.
- Fügen Sie der Rückseite des Kopfes und im Nackenbereich 1 L Fett hinzu, um sicherzustellen, dass dort kein Kleber nass wird.
- Mit einem aufgerollten Gewebe, lackieren UV-Kleber um und auf dem Band und auf dem Thorax (oberer dorsaler Teil des Mesonotums), um es zu beheben. Den Kleber mit UV-Licht für 5 s aushärten.
HINWEIS: Es ist wichtig, den Einsatz von UV-Licht zu minimieren, da es die Gesundheit der Fliege stark beeinträchtigen kann. - Reinigen Sie Fett und ungehärteten Kleber sorgfältig mit einem Laborgewebe.
- Legen Sie 1 ml Kochsaline auf den Kopf. Luftblasen mit Zange zur Seite schieben. Achten Sie auf Leckagen, indem Sie einen Coverslip über die Saline legen und den Halter umdrehen, um auf der Vorderseite nach Saline zu suchen. Wenn es irgendwelche Lecks gibt, entfernen Sie die Saline und fixieren Sie das Loch (entweder durch Hinzufügen von mehr Kleber oder mehr Fett).
HINWEIS: Dies kann ein guter Zeitpunkt sein, um bei Bedarf zu pausieren. Die Fliege kann ein kleines Stück Gewebe oder Styroporkugel angeboten werden, um zu gehen, um zu verhindern, dass die Fliege nach unten entgleist und beruhigt wird.
6. Sezieren des Kopfes
HINWEIS: Verwenden Sie geschärfte Zangen für die folgenden Schritte. Sehr feine Zangen sind kritisch, da stumpfe Zangen das Öffnen der Kopfhaut erschweren und zu zusätzlichen Verletzungen am Kopf oder Gehirn der Fliege führen können. Starke Vergrößerung kann in diesem Stadium helfen. Zu diesem Ziel kann man das Okularmikroskop durch ein 30-faches Okular ersetzen.
- Machen Sie zwei Schnitte an der Basis des zentralen dunklen Schnittdreiecks auf jeder Seite des Halses (siehe Kreuze in Abbildung 8A).
- Schneiden Sie um das dunkle Dreieck und entfernen Sie diesen Teil der Nagelhaut.
- Das Loch im Gehirn, durch das Muskel 16 und die Speiseröhre gehen, sollte nun sichtbar sein und sich rhythmisch bewegen(Video 1 stellt diese rhythmische Bewegung in einer Fliege mit fluoreszierenden Muskeln dar). Kneifen Sie vorsichtig die Spitze dieses Bereichs, um Muskel 16 zu schneiden, ohne die Speiseröhre zu punktieren. Wenn die rhythmische Bewegung des Gehirns aufhörte, wurde Muskel 16 wahrscheinlich entfernt, jedoch wird die Bewegung manchmal angehalten und später neu gestartet. Es ist daher wichtig, auf rhythmische Bewegungen zu achten und diesen Schritt bei Bedarf wieder auszuführen.
- Die restliche Nagelhaut in kleine Stücke schneiden und vorsichtig entfernen. Versuchen Sie nicht, an der Nagelhaut zu viel zu ziehen. Verwenden Sie stattdessen die Zange wie eine Schere, um Gewebestücke zu schneiden. Man kann an den medialen Rändern beginnen, wo das dunkle Dreieck zuvor entfernt wurde und sich den Weg zu den Seiten bahnen.
HINWEIS: Schnittstücke können verwendet werden, um Fettkörper sanft zu kratzen, wenn vorhanden. - Entfernen Sie die Luftsäcke ein Stück nach dem anderen, indem Sie sie mit der Zange packen und langsam und stetig ziehen.
Ergebnisse
Die oben beschriebene Präparation ermöglicht die Beobachtung des gesamten Gehirns unter dem Mikroskop für großformatige 3D-Bildgebung wie klassische 2 Photonen oder konfokale Mikroskopie, aber auch schnellere Techniken wie Lichtblatt31 und andere strukturierte Beleuchtungsmikroskopietechniken (überprüft in32), oder Lichtfeldmikroskopie28.
Der Zugang zum gesamten Gehirn unter Beobachtung des Verhaltens und der Aufrechterhaltung funktioneller Sinnesorgane ermöglicht es, mehrere Fragen zu beantworten.
Erstens, was ist die allgemeine Gehirnaktivität, wenn die Fliege ruht, während des Verhaltens, und wenn sie auf Reize reagiert? Als Beispiel nehmen wir Daten ein, die mit einem Lichtfeldmikroskop erhalten wurden, das die Aktivierung des Gehirns während der Reaktion auf Reize und Verhalten zeigt. In Video 2wurde beispielsweise eine Kalziumsonde in allen Neuronen (nsyb-GAL4 und UAS-syt-GCaMP6s (links) oder UAS-GCaMP6M (rechts)) exprimiert und ein Geruchsaufschlag dargestellt. Beachten Sie, wie das Präparat einen Überblick über die Gehirnaktivität während der Reaktion auf den Reiz ermöglicht. Die leistungsstarken genetischen Werkzeuge in Drosophila können verwendet werden, um die Expression dieser Sensoren auf bestimmte neuronale Subtypen zu beschränken. In Video 3beschränkten wir die Expression eines Calciumsensors auf dopaminerge und serotoninerge Neuronen (TH-GAL4, DDC-GAL4 und UAS-GCaMP6M). Beachten Sie die starke synchrone Aktivität über das Gehirn eng mit der Fliege gehen korreliert, durch die Beobachtung des gesamten Gehirns während des Verhaltens erlaubt. Neben der Kalziumaktivität können auch andere physikalische oder chemische Signale abgebildet werden (z.B. mit Sensoren für Spannung28,33, Stoffwechselprodukte34,35 oder spezifische Neuromodulatoren36).
Um die Rolle der Gehirnaktivität genauer zu verstehen, können wir fragen, welche Regionen an welchem Verhalten, an welchen Reizen oder spontanen Aktivitätsmustern beteiligt sind. Die Daten können in der Tat als unvoreingenommener Bildschirm verwendet werden, um funktionale Bereiche mithilfe von Techniken wie Hauptkomponentenanalyse und unabhängiger Komponentenanalyse zu extrahieren. Abbildung 9A zeigt verschiedene Funktionsbereiche in verschiedenen Farben. Die Form und Lokalisierung der funktionellen Regionen ermöglichen es, sie anatomischen Vorlagen zuzuordnen, um Hirnregionen und in einigen Fällen Neuronentyp zu identifizieren. Darüber hinaus können Fluoreszenzwerte, sobald sie an der anatomischen Vorlage ausgerichtet sind, in anatomischen Hirnregionen für die quantitative Analyse gemittelt werden (siehe Abbildung 9B). Beispielsweise zeigt ein hierarchisches Gauß-Modell, das auf Daten in Abbildung 9B angewendet wird, dass Regionen während des Gehens aktiver sind (mit einem Median von 0,029, 95 % glaubwürdigem Intervall=[0,017 0,041]), jedoch nicht während des Bräutigams (F/F-Median = -0,0049 mit 95 % glaubwürdigem Intervall=[-0.016 0.0059]).
Zusätzlich zur Verständnistiefe können die gleichzeitigen Aufnahmen der verschiedenen Funktionsbereiche, die durch die Zubereitung ermöglicht werden, verwendet werden, um die dynamischen Eigenschaften des Funktionsnetzwerks zu untersuchen. Dies ist wichtig, weil Hirnregionen in allen bisher untersuchten Gehirnen stark immer wieder miteinander verbunden sind und immer mehr Studien zeigen, dass selbst Sinnesbereiche auf den Verhaltenszustand des Tieres reagieren. Es können mehrere Aspekte betrachtet werden, wie z. B. funktionale Grapheneigenschaften (z. B. Module) und räumlich-zeitliche Muster, die mit dynamischen Systemen passen können (Beispielesiehe 8).
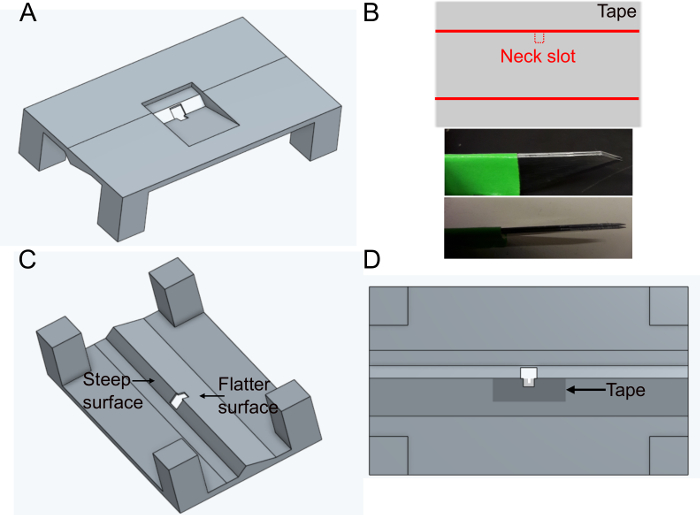
Abbildung 1: Vorbereiten des Halters (Schritt 1). A) Halter-Design (Ansicht von oben). B) HalsschlitzVorbereitung. oben: Banddesign, unten: parallele Klingen verwendet, um den Halsschlitz zu schneiden. C) Ansicht des Halters von unten. D) Untere Ansicht zeigt an, wo das Halsschlitzband hinzugefügt werden soll. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
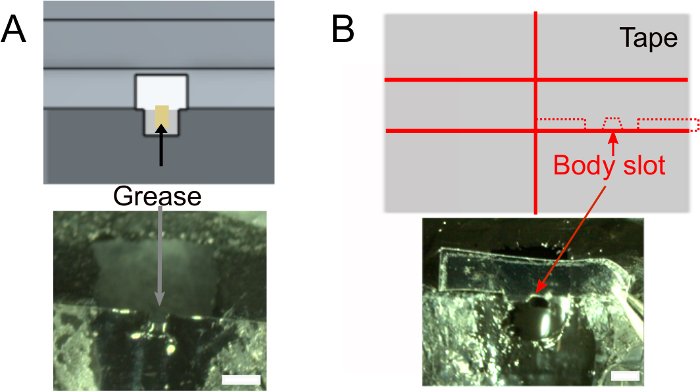
Abbildung 2: Weitere Vorbereitungen (Schritt 1). A) Fügen Sie Fett in den Halsschlitz, um Kleber zu verhindern, um die Rückseite des Kopfes zu bedecken und um Wasserlinienlecks zu verhindern. Schuppenstangen, 1 mm. B) Top: Form des Bandstücks, das verwendet wird, um den Körper nach unten zu drücken. Unten: Stellen Sie sicher, dass das Band in den Halter passt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Platzierung eines v-förmigen Bandstücks zur Unterstützung der Zentrierung. (A) Untere Ansicht. (B) Obere Ansicht. Maßstabsleiste, 2 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Platzieren Sie die Fliege (Schritt 2). Verwenden Sie zwei stumpfe Zangen, um den Körper so zu platzieren, dass sich der Hals im Nackenschlitz befindet. Mitte, richten Sie den Kopf aus. Die Augen liegen auf beiden Seiten an den Rändern des Schlitzes. Der Kopf der Fliege ist gerade. Rechts, stecken Sie die Fliege mit einem mit Eis bedeckten Gewebe, um sie davon abzuhalten, sich zu bewegen. Maßstabsleiste, 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Befestigen Sie den Kopf (Schritt 3). A) Idealer Winkel des Kopfes. B) Fügen Sie UV-Kleber um den Kopf, Vermeidung von sensorischen Bereichen von Interesse. Maßstabsleiste, 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Die Spitze des Proboscis und die Antennen können frei von Kleber gehalten werden (Schritt 3). Der weiße Kreis zeigt den Bereich an, in dem der UV-Kleber aufgebracht wurde. Der Pfeil zeigt, welche Teile für geruchs- und gustatorische Experimente frei von Leim übrig bleiben. Beachten Sie das optionale Klebeband, das verhindert, dass die Beine den Klebebereich berühren. Maßstabsleiste, 200 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Legen Sie das hintere Band (Schritt 4.2) auf. Das in Schritt 1 erstellte Band (siehe Abbildung 2, links) wird verwendet, um den Körper zu platzieren und das große Loch im Halter zu bedecken. Maßstabsleiste, 1 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Sezierschritte (Schritt 6). A-B) Schneiden Sie auf jeder Seite an der Basis des dunklen Dreiecks (Kreuze) und entfernen Sie diesen Teil der Nagelhaut C). D) und E) Muskel 16 entfernen. Dann entfernen Sie vorsichtig den Rest der Nagelhaut F), die Luftsäcke G), und Muskeln. H) Sezierter Kopf. Maßstabsleiste, 200 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
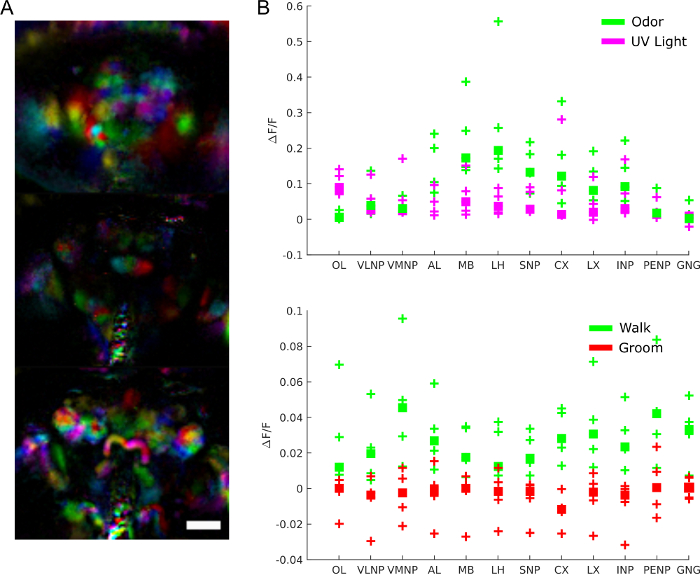
Abbildung 9: Repräsentative Ergebnisse. A) Funktionelle Regionen (extrahiert mit PCA und ICA wie in28) für eine Fliege, die GCaMP6 panneuronal mit einem Lichtfeldmikroskop (25x, NA=0,95 mit einem passenden f/12 Mikrolinsenarray) ausdrückt. Skala bar, 100 m. B) Durchschnittliche Kalziumaktivität in großen Hirnregionen während der Reaktionen auf Reize und Verhalten (reproduziert ab28). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Video 1: Muskel 16 Bewegungen (Schritt 6.3). GFP wurde in Muskeln ausgedrückt. Beachten Sie die Pumpbewegung, die aus dem Loch knapp über der Luftröhre kommt. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 2: Panneuronale Kalziumaktivität während der Geruchsreaktion auf zwei verschiedene Präparate. Balsamico-Essig wurde auf die Fliege gepufft. Panneuronale Calciumaktivität (nsyb-GAL4-Treiber, UAS-syt-GCaMP6s links und UAS-GCaMP6M rechts) wurde mit einem Lichtfeldmikroskop (25x, NA=0,95 mit einem passenden f/12-Mikrolinsenarray) abgebildet. Lichtfeldbilder wurden dann rekonstruiert, wie in Ref.28,37beschrieben. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Video 3: Calciumaktivität in einer Neuronen-Teilmenge während des Verhaltens. GCaMP6 wurde in dopaminergen und serotoninergen Neuronen (mit TH-GAL4 und DDC-GAL4) exprimiert. In Kombination mit den fliegengenetischen Werkzeugen ermöglicht das Präparat eine starke Zunahme der Aktivität in vielen Regionen während des Spaziergangs zu beobachten. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Material. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Drosophila ist eines der seltenen erwachsenen Tiere, bei denen das gesamte Gehirn während komplexer Verhaltensweisen abgebildet werden kann. Hier präsentieren wir eine Methode, um die Fliege vorzubereiten und ihr ganzes Gehirn der Bildfortlaufenden gesamten Gehirnaktivität auszusetzen. Mehrere wichtige Punkte sind zu beachten.
Ein kleines Tier wie D. melanogaster zu sezieren, ist eine Herausforderung. Die Methode erfordert also viel Übung und Geduld, um sie zu meistern. Nach dem Training dauert das Verfahren jedoch weniger als 30 Minuten und führt zu reproduzierbaren Ergebnissen.
Die von uns vorgestellte Methode hat zusätzliche Einschränkungen. Erstens führt das Kippen des Fliegenkopfes aus seiner natürlichen Position zur Dehnung des Halses, was dem Bindegewebe, den Nerven oder dem Muskel schaden könnte. Zweitens ist die ventrale subösophageale Zone (SEZ) zwar optisch zugänglich, liegt aber unterhalb der halbtransparenten Speiseröhre, was die Intensität und Auflösung in diesem Bereich verringert. Schließlich, obwohl der Halter in den meisten Richtungen außer Reichweite ist, erkennt die Fliege manchmal noch ihre Anwesenheit und drängt auf sie, um zu versuchen, zu entkommen.
Trotz dieser Einschränkungen werden die umfassenden Daten, die aus der gesamten Gehirnbildgebung während des Verhaltens und der Reaktionen auf Reize gewonnen werden, es ermöglichen, die Gehirnfunktion auf der Ebene des gesamten Netzwerks zu entschlüsseln, wenn das Tier mit komplexen, naturalistischen Umgebungen interagiert und sie durchquert.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Heidi Miller-Mommerskamp für die technische Hilfe und Iveth Melissa Guatibonza Arevalo für die hilfreichen Kommentare zum Manuskript. Erste Versionen des Protokolls wurden im Labor von Ralph Greenspan entwickelt. Diese Arbeit wurde von der Deutschen Forschungsstiftung (DFG) unterstützt, insbesondere durch ein Stipendium FOR2705 (TP3) an die IGK, sowie durch die Simons-Stiftung (Aimon – 414701) und das Kavli-Institut für Gehirn und Geist (Fördernummer #2017-954), das von SA erhalten wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
Referenzen
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten