Method Article
הכנת מלנוגאסטר דרוזופילה למבוגרים להדמיית מוח שלמה במהלך תגובות התנהגות וגירויים
In This Article
Summary
אנו מציגים שיטה המותאמת במיוחד כדי לדמות את המוח כולו של Drosophila הבוגר במהלך ההתנהגות בתגובה לגירויים. הראש ממוקם כדי לאפשר גישה אופטית לכל המוח, בעוד הזבוב יכול להזיז את רגליו ואת האנטנות, את קצה הפרובוסיס, והעיניים יכולות לקבל גירויים חושיים.
Abstract
אנו מציגים שיטה שפותחה במיוחד כדי לדמות את המוח Drosophila כולו במהלך התנהגות מתמשכת כגון הליכה. קיבוע ראש וניתוח ממוטבים כדי למזער את השפעתם על ההתנהגות. זה מושגת לראשונה באמצעות מחזיק הממזער מכשולי תנועה. החלק האחורי של ראשו של הזבוב מודבק למחזיק זה בזווית המאפשרת גישה אופטית לכל המוח תוך שמירה על יכולתו של הזבוב ללכת, לטפח, להריח, לטעום ולראות. החלק האחורי של הראש מנותח כדי להסיר רקמות בנתיב האופטי ושרירים האחראים על חפצי תנועת הראש. לאחר מכן ניתן לדמיין את המוח הזבוב כדי לתעד את פעילות המוח, למשל באמצעות מחווני סידן או מתח, במהלך התנהגויות ספציפיות כגון הליכה או טיפוח, ובתגובה לגירויים שונים. לאחר הניתוח המאתגר, אשר דורש תרגול ניכר, כבר שולט, טכניקה זו מאפשרת להקליט ערכות נתונים עשירים הקשורים פעילות מוחית שלמה להתנהגות ותגובות גירוי.
Introduction
הדמיית פעילות המוח בטכניקות שונות העמיקה את ההבנה של תפקוד המוח. בבני אדם, לטכניקות הדמיה מוחית יש מגבלות חשובות: בעוד שהדמיית תהודה מגנטית תפקודית (fMRI) מציעה רזולוציה מרחבית-זמנית הרבה מתחת לרזולוציית נוירון יחיד, טכניקות מהירות כגון אלקטרואנצפלוגרפיה (EEG) מאפשרות גישה עקיפה וחלקית למוח1בלבד . במודלים גדולים מספיק של בעלי חיים כגון מכרסמים, הקלטה של חיישני פעילות פלואורסצנטיים (למשל, GCaMP) באמצעות מיקרוסקופים המותקנים על הראש מאפשרת לבחון את פעילות המוח בזמן שהחיה נעה בסביבתה2. עם זאת, טכניקות אלה כיום לתת גישה רק לחלק קטן של המוח. ניתן לדמיין בעלי חיים קבועים בראש באופן מקיף יותר, אך הכיסוי עדיין חלקי (למשל, משטח קליפת המוח3). רק בבעלי חיים קטנים, כגון זחלי דג הזברה, C. elegans ו Drosophila כי המוח כולו יכול להיות בתמונה עם רזולוציה זמנית ומרחבית ברמה של או קרוב נוירונים בודדים4.
D. melanogaster הוא מבטיח במיוחד כי זה זמן רב שימש אורגניזם מודל גנטי5 וכלים גנטיים רבי עוצמה פותחו6. משלים את הרשת האנטומית בקנה מידה גדול החדש נגזר מיקרוסקופ אלקטרונים7, הזבוב יכול לספק הזדמנויות ייחודיות ללמוד דינמיקה מוחית מורכבת שנוצר ברשת בקנה מידה גדול8. למרות הקוטיקל אינו שקוף, ולכן יש להסיר כדי לדמיין את המוח, הדמיה תפקודית in vivo הפך יותר ויותר נפוץ מאז המחקר הראשון בשנת 20029 וכמה פרוטוקולים כבר פורסמו. עם זאת, שיטות אלה כוללות הפרדת ראש הזבוב מהגוף10, הגבלה חמורה של תנועות הזבוב ו /או תגובות לגירויים11,12,13,14,15, או רק להתיר חלק קטן של המוח להיות בתמונה 9,16,25,26,27,17,18,19,20,21,22,23,24. כדי להשלים את הגישות החזקות הללו, פיתחנו לאחרונה הכנה לדמות את המוח כולו במהלך ההתנהגות והתגובות לגירויים שונים28.
כאן, אנו בונים על מחקר זה כדי להציג שיטה שפותחה במיוחד כדי לדמות את המוח כולו בעוד הזבוב מבצע התנהגות חצי נטורליסטית (כלומר הליכה וטיפוח) ומגיב לגירויים חושיים. זה מושג על ידי שימוש במחזיק תצפית שנועד לתת גישה למוח כולו מהצד הגבי-אחורי, תוך השארת האנטנות והפרובוסיס ללא פגע, ומתן אפשרות לעוף להזיז את רגליו ללכת (למשל, על כדור מרופד באוויר). צעדים לנתח את החלק האחורי של הראש שוכללו למהירות, לשחזור, ולמזעור השפעתם על הכדאיות והניידות של הזבוב.
Protocol
כל השלבים מבוצעים תחת סטריאומיקרוסקופ.
1. הכנת המחזיק
- הדפס את המחזיק 'FlyholderVJove.stl' (ראה חומר משלים)במדפסת תלת-ממד או הדפסתו באמצעות שירותים מקוונים (איור 1A). הן SLS (ניילון PA12) והן היתוך multijet (PA12) מתאימים.
- צור את חריץ הראש.
- מניחים חתיכת סרט דביק מלבני על משטח שטוח. חותכים פרוסה של כ 5 מ"מ x 1 ס"מ. חותכים את חריץ הצוואר (~ 400 x 400 מיקרומטר) באמצע הצד הארוך יותר של הסרט באמצעות להבים מקבילים קבועים (שני להבי אזמל תקועים יחד) כדי להבטיח את אותו רוחב בכל מחזיק (איור 1B).
- הניחו את הקלטת מעל הצד המחמיא של החור במחזיק בצד התחתון (ראו איור 1C ואיור 1D). הקלטת יכולה להיות מעוותת על ידי דחיפתו למטה עם מלקחיים ~ 500 מיקרומטר סביב החור; זה יהיה עוד יותר למזער לעכב תנועות זבוב מאוחר יותר.
- מכסים את הקלטת ואת המחזיק מלמעלה עם לק שחור כדי למנוע את החיץ דולף החוצה. לק הציפורן השחור גם יגן על עיני הזבוב מאור העירור של המיקרוסקופ. תן לק להתייבש לפחות שעה לפני השימוש במחזיק.
- לאחר שהלק יבש, מוסיפים ~ 1 μL של שומן בחריץ הראש באמצעות רקמה מגולגלת כדי להבטיח שהדבק לא ירטיב את החלק האחורי של ראש הזבוב (איור 2A). הקפד לא לשים שומן מחוץ לחריץ שימנע את הדבק מלהידבק.
- צור את חריץ הגוף (איור 2B).
- באופן אופציונלי, הכינו את הקלטת שתשמש למיקום גוף הזבוב (ראו להלן) מראש. השתמש בעיצוב המוצג באיור 2B (למעלה) כדי לחתוך חתיכה של סרט ברוחב ~ 2 ס"מ לשניים ולחתוך פרוסות ברוחב 1.5 מ"מ. חותכים 0.3 מ"מ כתפיים עמוקות חריץ הגוף. ודא שזה מתאים למחזיק.
הערה: השונות בין גדלי זבובים (במיוחד עם מין, גיל, גנוטיפ או מינים) יכולה לעשות את זה הכרחי כדי להתאים את עיצוב הסרט. אם הראש נוטה להיות לא מרוכז, כדאי להוסיף פיסת סרט בצורת V באופן זמני מעל חריץ הצוואר(איור 3). יש למרוח גם כמה מיקרוליטרים של שומן בתוך חריץ הצוואר ועל סרט בצורת V.
- באופן אופציונלי, הכינו את הקלטת שתשמש למיקום גוף הזבוב (ראו להלן) מראש. השתמש בעיצוב המוצג באיור 2B (למעלה) כדי לחתוך חתיכה של סרט ברוחב ~ 2 ס"מ לשניים ולחתוך פרוסות ברוחב 1.5 מ"מ. חותכים 0.3 מ"מ כתפיים עמוקות חריץ הגוף. ודא שזה מתאים למחזיק.
2. הצבת הזבוב
הערה: זבובים נקביים בני יום עד ארבעה ימים הם אידיאליים מכיוון שהראש הנשי גדול יותר ולכן קל יותר לנתח מאשר הראש הגברי, ולזבובים צעירים יותר יש קוטיקל רך יותר. עבור ניסויי הליכה ניתן להגדיל את פעילות הזבוב על ידי התאמת הניסויים עם זמנים של פעילות ביולוגית גבוהה יותר (ZT0 או ZT11), באמצעות מלוחים המכילים גלוקוז (כגון 103 mM NaCl, 3 mM KCl, 5 mM TES, 8 mM trehalose 2 H2O, 10 מ"מ גלוקוז, 26 mM NaHCO3, 1 mM NaH2PO4, 2.5 mM CaCl2·2 H2O, 4 mM MgCl2·6 H2O), על ידי הרעבת לטוס עד 24 שעות עם סביבה מים בלבד, ועל ידי חימום הסביבה ~ 28 מעלות צלזיוס במהלך הניסוי. גזירת הכנפיים לפחות יום אחד מראש מסייעת גם להקטין את הניסיונות לעוף ובכך להגדיל את תדירות התקפיהליכה 7,29,30.
- ממלאים צלחת פטרי או מכסה תיבת קצה פיפטה עם קרח, מניחים רקמת מעבדה על גבי הקרח ומניחים את המחזיק במהופך על זה.
- להעביר זבוב על קרח כדי לשתק אותו על ידי מציצתו מבקבוקון שלה לתוך צינור נושבת אותו על הקרח (ודא הקרח לא נמס אשר יטביע את הזבוב).
- כאשר הזבוב מפסיק לנוע, השתמש במלקחיים עמומים כדי להחליק אותו לתוך המחזיק עם הצוואר בתוך החריץ (ניתן להחזיק את הזבוב בבסיס הכנף) כמו באיור 4 (משמאל). העיניים צריכות להיות בעמדות שוות ביחס לצדי החריץ(איור 4, אמצע). במידת הצורך, להוסיף 1 μL גריז על החלק העליון של הראש כדי למנוע את הדבק (ראה השלב הבא) מלהגיע לחלק האחורי של הראש ולהסיר מאוחר יותר.
- כסו את הגוף ברקמה וקצת קרח כדי לוודא שהטיסה לא זזה בשלב זה ובצעד הבא (איור 4, ימין). אפשרות נוספת למנוע מהרגליים להגיע לראש היא להשתמש בפיסת סרט הדבקה ממש מתחת לראש (ראו איור 6).
3. אבטחת הראש
- מקם את הראש בזווית של ~ 20° מתצוגה אחורית מלאה (מסביב לציר לרוחב, ראה איור 5A). זוהי פשרה בין הפחתת העומק לתמונה לבין הצד השני שמירה על הרגל הקדמית חופשי לנוע ולצמצם את מתיחת הצוואר.
- עם רקמה מגולגלת(איור 5B),הנח דבק UV סביב הראש תוך הימנעות מלכלך את אזור העניין החושי (אנטנות, פרובוסיס ו/או עיניים). לניסויי טעם, משוך את proboscis החוצה ולהוסיף דבק בבסיסו כדי למנוע תנועה. אם לא מתוכנן ניסוי טעם, מומלץ לדחוף את הפרובוסיס לראש ולקבע אותו בדבק כדי למזער את התנועה (איור 6).
- לרפא את הדבק עם אור UV עבור 5 s. בזהירות לנקות את הסביבה של הראש עם רקמה מגולגלת כדי להסיר דבק נוזלי שנותר שיכול להידבק לרגליים ו / או אזורים חושיים הקרקע.
הערה: הקלטת יכולה להיות מחוספסת עם נייר זכוכית כדי להגביר את הידבקות דבק במידת הצורך. - השתמש ברצועה דקה של סרט או רקמה מגולגלת כדי להזיז את הרגליים לחזית (אם הם עדיין לא), כך שהם לא ייפגעו בשלב הבא.
4. מיקום הגוף
הערה: שלב זה צריך להתבצע במהירות; לפני שהזבוב יחלים מהרדמה.
- הסר את מיכל הקרח וסובב את המחזיק. הסר את המים סביב הזבוב עם רקמה.
- הניחו את סרט חריץ הגוף (שנוצר בשלב 1) מעל החור ודחפו בעדינות את גופה של הזבוב כלפי מטה (איור 7). היזהר לא למתוח את הצוואר יותר מדי.
5. איטום החור
- לכסות את כל החורים הגדולים שנותרו עם קלטת.
- הוסף ~ 1 μL של שומן לחלק האחורי של הראש ובאזור הצוואר כדי לוודא שום דבק לא ירטיב שם.
- עם רקמה מגולגלת, צבעו דבק UV סביב ועל גבי הקלטת ועל בית החזה (החלק הגבי העליון של mesonotum) כדי לתקן את זה. לרפא את הדבק עם אור UV עבור ~ 5 s.
הערה: חשוב למזער את השימוש באור UV כפי שהוא יכול להשפיע מאוד על בריאותו של הזבוב. - מנקים בזהירות גריז ודבק לא מאובטח עם רקמת מעבדה.
- שים ~ 1 מ"ל של מלוחים על גבי הראש. לדחוף בועות אוויר הצידה עם מלקחיים. חפשו דליפות על ידי הנחת כיסוי מעל מלוחים והפיכת המחזיק מסביב כדי לבדוק אם יש תמיסת מלח בצד הקדמי. אם יש דליפות, להסיר את מלוחים ולתקן את החור (או על ידי הוספת דבק או יותר שומן).
הערה: זה יכול להיות זמן טוב להשהות במידת הצורך. הזבוב יכול להיות מוצע חתיכה קטנה של רקמה או כדור קלקר ללכת על מנת למנוע מתנופף ולהרגיע את לטוס למטה.
6. ניתוח הראש
הערה: השתמש במלקחיים מחודדים לשלבים הבאים. מלקחיים עדינים מאוד הם קריטיים כמו מלקחיים משעממים יקשה על פתיחת קוטיקל הראש ועלול להוביל לפציעות נוספות על הראש או המוח של הזבוב. הגדלה חזקה יכולה לעזור בשלב זה. למטרה זו, אפשר להחליף את העין של מיקרוסקופ המשקפת עם 30x עינית.
- בצעו שני חתכים בבסיס משולש החיתוך הכהה המרכזי בכל צד של הצוואר (ראו צלבים באיור 8A).
- חותכים סביב המשולש הכהה ומסירים את החלק הזה של הקוטיקל.
- החור במוח שדרכו השריר 16 והוושט ללכת עכשיו צריך להיות גלוי ולנוע בקצב (וידאו 1 מציג את התנועה הקצבית הזו בזבוב עם שרירי פלואורסצנט). בזהירות לצבוט את החלק העליון של אזור זה כדי לחתוך את השריר 16 מבלי לנקב את הוושט. אם התנועה הקצבית של המוח נעצרה, שריר 16 הוסר ככל הנראה, עם זאת, התנועה לפעמים עוצרת ומחדשת מאוחר יותר. לכן חשוב לשים לב לתנועות קצביות ולבצע צעד זה שוב במידת הצורך.
- חותכים את הקוטיקל הנותר לחתיכות קטנות ומסירים אותם בזהירות. נסה לא למשוך את הקוטיקל יותר מדי. במקום זאת להשתמש במלקחיים כמו זוג מספריים, כדי לחתוך חתיכות של רקמה. אפשר להתחיל בקצוות המדיאליים, שם המשולש הכהה הוסר בעבר ולעבוד בדרך לצדדים.
הערה: חתיכות של קוטיקל יכול לשמש בעדינות לגרד של גופי שומן אם קיים. - מוציאים את שקי האוויר חתיכה אחר חתיכה על ידי תפיסתם עם המלקחיים ומושכים לאט ובהתמדה.
תוצאות
ההכנה המתוארת לעיל מאפשרת התבוננות של המוח כולו תחת מיקרוסקופ להדמיה תלת-ממדית בקנה מידה גדול כגון 2 פוטונים קלאסיים או מיקרוסקופיה קונפוקלית, אך גם טכניקות מהירות יותר כגון יריעת אור31 וטכניקות מיקרוסקופיות תאורה מובנות אחרות (שנסקרו ב-32), או מיקרוסקופ שדה אור28.
הגישה למוח כולו תוך התבוננות בהתנהגות ושמירה על איברי חישה תפקודיים מאפשרת לענות על מספר שאלות.
ראשית, מהי הפעילות המוחית הכוללת כאשר הזבוב נמצא במנוחה, במהלך ההתנהגות, וכאשר הוא מגיב לגירויים? כדוגמה, אנו כוללים נתונים שהושגו עם מיקרוסקופ שדה אור המציג הפעלת המוח במהלך תגובות לגירויים והתנהגות. לדוגמה, בסרטון 2, בדיקת סידן באה לידי ביטוי בכל הנוירונים (nsyb-GAL4 ו- UAS-syt-GCaMP6s (משמאל) או UAS-GCaMP6M (מימין)) והוצגה נשיפה של ריח. שים לב כיצד ההכנה מאפשרת לקבל סקירה כללית של פעילות המוח במהלך התגובה לגירוי. ניתן להשתמש בכלים הגנטיים החזקים בדרוסופילה כדי להגביל את הביטוי של חיישנים אלה לתת-סוגים עצביים ספציפיים. בסרטון 3, הגבלנו את הביטוי של חיישן סידן לנוירונים דופאמין וסרוטונינרגי (TH-GAL4, DDC-GAL4 ו- UAS-GCaMP6M). שים לב לפעילות הסינכרונית החזקה על המוח בקורלציה הדוקה עם הליכה זבוב, מותר על ידי התבוננות במוח כולו במהלך ההתנהגות. בנוסף לפעילות סידן, אותות פיזיים או כימיים אחרים ניתן לדמיין (באמצעות למשל חיישנים עבור מתח28,33, מוצרי חילוף החומרים34,35 או נוירומודולטורים ספציפיים36).
כדי להבין את תפקידה של פעילות המוח באופן ספציפי יותר, אנו יכולים לשאול אילו אזורים מעורבים באיזו התנהגות, תגובה לגירויים או דפוסי פעילות ספונטניים. הנתונים אכן יכולים לשמש כמסך לא משוחד כדי לחלץ אזורים פונקציונליים באמצעות טכניקות כגון ניתוח רכיבים ראשיים וניתוח רכיבים עצמאיים. איור 9A מציג אזורים פונקציונליים שונים בצבעים שונים. הצורה והלוקליזציה של האזורים הפונקציונליים מאפשרים למפות אותם לתבניות אנטומיות כדי לזהות אזורי מוח ובמקרים מסוימים סוג נוירון. יתר על כן, לאחר יישור לתבנית האנטומית, ניתן לממוצע ערכי פלואורסצנטיות באזורי מוח אנטומיים לניתוח כמותי (ראו איור 9B). לדוגמה, מודל גאוסיאני הירארכי המוחל על נתונים באיור 9B מראה שאזורים פעילים יותר במהלך הליכה (עם חציון ΔF/F של 0.029, מרווח זמן אמין של 95%=[0.017 0.041]) אך לא במהלך החתן (חציון ΔF/F = -0.0049 עם מרווח זמן אמין של 95%=[-0.016 0.0059]).
בנוסף לעומק ההבנה, ההקלטות בו זמנית של האזורים הפונקציונליים השונים המותרים על ידי ההכנה יכולות לשמש כדי ללמוד את המאפיינים הדינמיים של הרשת הפונקציונלית. זה חשוב מכיוון שאזורי המוח בכל המוחות שנחקרו עד כה מחוברים זה לזה באופן חוזר, ויותר ויותר מחקרים מראים שאפילו אזורים חושיים מגיבים למצב ההתנהגותי של החיה. ניתן להסתכל על מספר היבטים כגון מאפייני גרף פונקציונליים (למשל, מודולים) ודפוסי ספטיו-טמפורלי שניתן להתאים למערכות דינמיות (ראה8 לדוגמה).
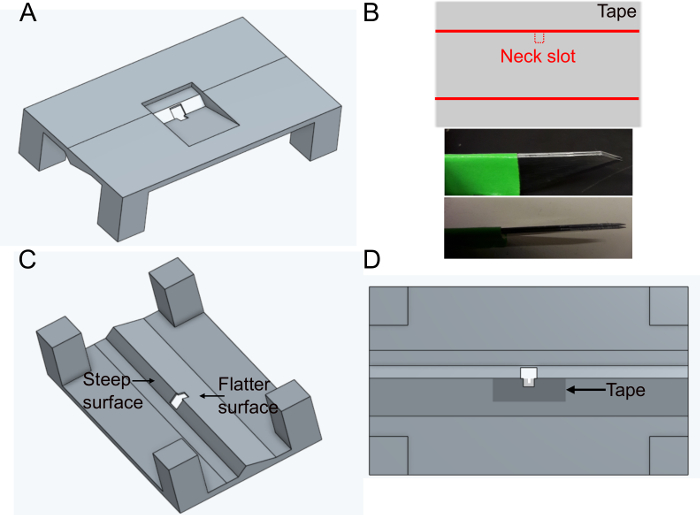
איור 1: הכנת המחזיק (שלב 1). A) עיצוב המחזיק (נוף מלמעלה). B) הכנת חריץ צוואר. למעלה: עיצוב סרט הדבקה, תחתון: להבים מקבילים המשמשים לחיתוך חריץ הצוואר. ג)מבט על המחזיק מלמטה. D) תצוגה תחתונה המציינת היכן להוסיף את סרט חריץ הצוואר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
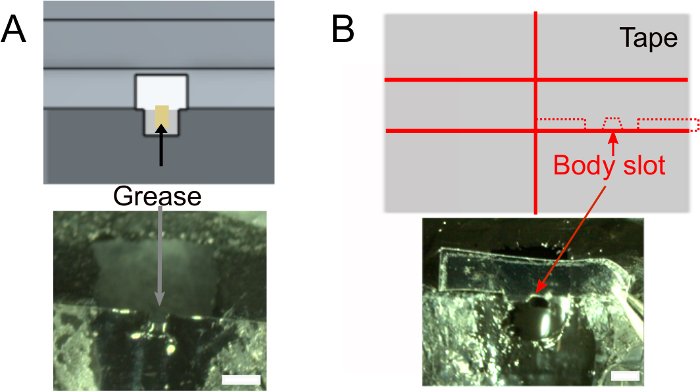
איור 2: הכנות נוספות (שלב 1). A) מוסיפים גריז לחריץ הצוואר כדי למנוע דבק כדי לכסות את החלק האחורי של הראש ולמנוע דליפות מלוחים. סרגלי קנה מידה, 1 מ"מ. B) למעלה: צורת פיסת הסרט שישמש לדחוף את הגוף כלפי מטה. למטה: ודא שהקלטת מתאימה למחזיק. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: מיקום של פיסת סרט בצורת V כדי לסייע במרכז. (A) תצוגה תחתונה. (B) תצוגה עליונה. סרגל קנה מידה, 2 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: מקם את הזבוב (שלב 2). שמאל, להשתמש בשתי מלקחיים משעממים למקם את הגוף, כך הצוואר הוא בחריץ הצוואר. באמצע, יישר את הראש. העיניים מונחות משני הצדדים בשולי החריץ. הראש של הזבוב ישר. נכון, לתחוב את הזבוב עם רקמה מכוסה בקרח כדי למנוע ממנו לזוז. סרגל קנה מידה, 1 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: תיקון הראש (שלב 3). A) זווית אידיאלית של הראש. B) הוסף דבק UV סביב הראש, הימנעות תחומי עניין חושיים. סרגל קנה מידה, 1 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: הקצה של הפרובוסיס והאנטנות ניתנים לניתור מדבק (שלב 3). העיגול הלבן מציין את האזור שבו הוחל דבק UV. החץ מראה אילו חלקים נותרים חופשיים מדבק לניסויים חוש הריח והמשב. שים לב לקלטת האופציונלית המונעת מהרגליים לגעת באזור ההדבקה. סרגל קנה מידה, 200 מיקרומטר.

איור 7: מקם את הקלטת האחורית (שלב 4.2). הקלטת שנוצרה בשלב 1 (ראה איור 2, משמאל) משמשת להצבת הגופה ולכיסוי החור הגדול במחזיק. סרגל קנה מידה, 1 מ"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 8: שלבי ניתוח (שלב 6). A-B) חותכים מכל צד בבסיס המשולש הכהה (צלבים) ומסירים חלק זה של הקוטיקל C). D) ו- E) להסיר שריר 16. לאחר מכן להסיר בעדינות את שאר הקוטיקל F), את שקי האוויר G), ואת השרירים. H) ראש מנותח. סרגל קנה מידה, 200 מיקרומטר.
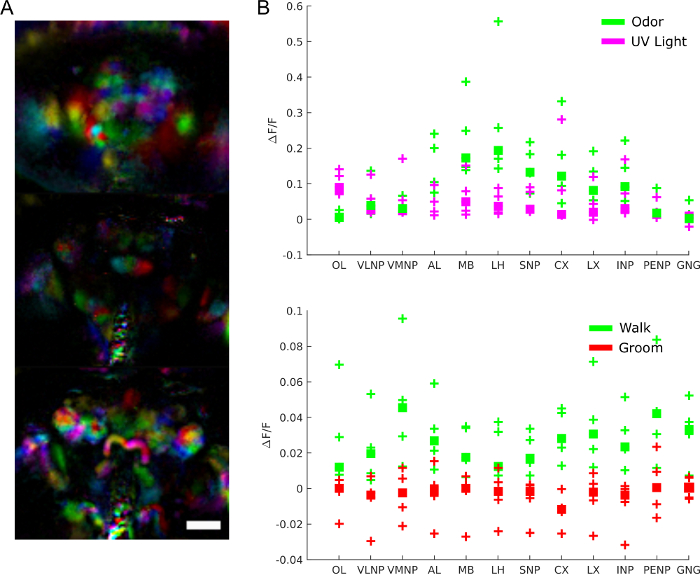
איור 9: תוצאות מייצגות. A) אזורים פונקציונליים (שחולצו באמצעות PCA ו- ICA כמוב- 28) עבור זבוב המבטא GCaMP6 פאן נוירון בתמונה עם מיקרוסקופ שדה אור (25x, NA = 0.95 עם מערך עדשות מיקרו f/12 תואם). סרגל סולם, 100 מיקרומטר. B) פעילות סידן ממוצעת באזורי מוח גדולים במהלך תגובות לגירויים והתנהגות (משוחזר מ28). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
וידאו 1: שריר 16 תנועות (שלב 6.3). GFP בא לידי ביטוי בשרירים. שימו לב לתנועת השאיבה שמגיעה מהחור ממש מעל קנה הנשימה. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 2: פעילות סידן פאן-עצבי במהלך התגובה לריח לשתי הכנות שונות. חומץ בלסמי היה נפוח על הזבוב. פעילות סידן פאן-עצבית (מנהל התקן nsyb-GAL4, UAS-syt-GCaMP6s שמאלה ו- UAS-GCaMP6M מימין) תדמיינה עם מיקרוסקופ שדה אור (25x, NA = 0.95 עם מערך f/12 microlens תואם). תמונות שדה אור שוחזרו כמתואר בשופט28,37. אנא לחץ כאן כדי להוריד וידאו זה.
וידאו 3: פעילות סידן בקבוצת משנה של סוג נוירון במהלך ההתנהגות. GCaMP6 בא לידי ביטוי נוירונים דופאמין סרוטונינרגי (עם TH-GAL4 ו DDC-GAL4). בשילוב עם הכלים הגנטיים לעוף, ההכנה מאפשרת לבחון עלייה חזקה בפעילות באזורים רבים במהלך ההליכה. אנא לחץ כאן כדי להוריד וידאו זה.
חומר משלים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
דרוזופילה היא אחת החיות הבוגרות הנדירות שבהן ניתן לדמיין את המוח כולו במהלך התנהגויות מורכבות. כאן, אנו מציגים שיטה להכנת הזבוב ולחשוף את כל מוחו כדי לדמות פעילות מוחית מתמשכת. יש לציין מספר נקודות חשובות.
ניתוח חיה קטנה כמו ד. מלנוגאסטר הוא מאתגר. השיטה ולכן דורשת הרבה תרגול וסבלנות לשלוט בה. עם זאת, לאחר האימון, ההליך לוקח פחות מ 30 דקות ומייצר תוצאות לשחזור.
לשיטה שהצגנו יש מגבלות נוספות. ראשית, הטיית ראש הזבוב ממצבו הטבעי מובילה למתוח את הצוואר אשר יכול להזיק רקמת חיבור, עצבים או שריר. שנית, למרות שהאזור התת-קרקעי הגחוני (SEZ) נגיש אופטית, הוא נמצא מתחת לוושט השקוף למחצה, אשר מקטין את העוצמה והרזולוציה באזור זה. לבסוף, למרות המחזיק הוא מחוץ להישג יד ברוב הכיוונים, הזבוב עדיין לפעמים מבין את נוכחותו ודוחף אותו כדי לנסות לברוח.
למרות מגבלות אלה, הנתונים המקיפים המתקבלים מהדמיה מוחית שלמה במהלך ההתנהגות והתגובות לגירויים יאפשרו לפענח את תפקוד המוח ברמת הרשת כולה כאשר החיה מקיימת אינטראקציה עם סביבות מורכבות ונטורליסטיות ומנווטת בהן.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים להיידי מילר-מומרסיקאמפ על העזרה הטכנית ולאיבת מליסה גוטיבונזה רבלו על הערות מועילות על כתב היד. גרסאות ראשוניות של הפרוטוקול פותחו במעבדה של ראלף גרינספן. עבודה זו נתמכה על ידי קרן המחקר הגרמנית (DFG), במיוחד באמצעות מענק עבור 2705 (TP3) ל- IGK, ועל ידי קרן סימונס (Aimon – 414701) ומכון קוולי למוח ולנפש (מספר מענק #2017-954) שהתקבל על ידי SA.
Materials
| Name | Company | Catalog Number | Comments |
| #5 forceps | FST by DUMONT | 11252-30 | straight tip 0.05 x 0.02 mm, Dumoxel, 11 cm long |
| #55 forceps | FST by DUMONT | 11255-20 | straight tip 0.05 x 0.02 mm, Inox, 11 cm long |
| 30x oculars | yegren | WF30-9-30-H | WF30X/9 High Eye-point Eyepiece Wide Field View Ocular Optical Lens for Stereo Microscope or Biological Microscope 30X, 30mm without Reticle |
| AHOME/UV flashlight | Shenzhen Yijiawan Technology Co., Ltd | B07V2W9543 (ASIN) | 365 nm |
| Fotoplast Gel/UV Glue | Dreve Otoplastik GmbH | 44791 | GHS07, GHS08 |
| Gloss Finish Transparent Tape | 3M Scotch | ||
| KIMTECH Science/Precision wipes | Kimberly-Clark Professional | 7552 | 11 x 21 cm |
| KL 1500 LCD/Microscope light | Schott | ||
| Leica MS5 Microscope | Leica | WF30X/9 | |
| Nail Lacqueur | Opi Products Inc., N. Hollywood | 6306585338 | black |
| Saline: Hepes NaH2PO4 NaHCO3 MgCl2 CaCl2 NaCl KCl sucrose threalose | Sigma Aldrich | ||
| Scalpel | Werner Dorsch GmbH | 78 621; B07SXCXWFS (ASIN) | soft handle |
| Vacuum grease | Dow corning | 0020080 /100 gr | Moly Kote 111 Compound Grease Grease Valve Stamp 100 g |
References
- Papanicolaou, A. C. . The Oxford Handbook of Functional Brain Imaging in Neuropsychology and Cognitive Neurosciences. , (2017).
- Zong, W., et al. Fast high-resolution miniature two-photon microscopy for brain imaging in freely behaving mice. Nature Methods. 14, 713-719 (2017).
- Musall, S., Kaufman, M. T., Juavinett, A. L., Gluf, S., Churchland, A. K. Single-trial neural dynamics are dominated by richly varied movements. Nature Neuroscience. 22, 1677-1686 (2019).
- Ahrens, M. B., Engert, F. Large-scale imaging in small brains. Current Opinion in Neurobiology. 32, 78-86 (2015).
- Sokolowski, M. B. Drosophila: Genetics meets behaviour. Nature Reviews Genetics. 2, 879-890 (2001).
- Venken, K. J. T., Bellen, H. J. Emerging technologies for gene manipulation in Drosophila melanogaster. Nature Reviews Genetics. 6, 167-178 (2005).
- Zheng, Z., et al. A Complete Electron Microscopy Volume of the Brain of Adult Drosophila melanogaster. Cell. 174, 730-743 (2018).
- Aimon, S., Grunwald Kadow, I. C. Studying complex brain dynamics using Drosophila. Journal of Neurogenetics. 34, 171-177 (2020).
- Fiala, A., et al. Genetically Expressed Cameleon in Drosophila melanogaster Is Used to Visualize Olfactory Information in Projection Neurons. Current Biology. 12, 1877-1884 (2002).
- Wang, J. W., Wong, A. M., Flores, J., Vosshall, L. B., Axel, R. Two-Photon Calcium Imaging Reveals an Odor-Evoked Map of Activity in the Fly Brain. Cell. 112, 271-282 (2003).
- Mann, K., Gallen, C. L., Clandinin, T. R. Whole-Brain Calcium Imaging Reveals an Intrinsic Functional Network in Drosophila. Current Biology. 27, 2389-2396 (2017).
- Liang, X., Holy, T. E., Taghert, P. H. Synchronous Drosophila circadian pacemakers display nonsynchronous Ca2+ rhythms in vivo. Science. 351, 976-981 (2016).
- Harris, D. T., Kallman, B. R., Mullaney, B. C., Scott, K. Representations of Taste Modality in the Drosophila Brain. Neuron. 86, 1449-1460 (2015).
- Yoshihara, M. Simultaneous recording of calcium signals from identified neurons and feeding behavior of Drosophila melanogaster. Journal of Visualized Experiments. , e1 (2012).
- Strutz, A., Völler, T., Riemensperger, T., Fiala, A., Sachse, S. Calcium imaging of neural activity in the olfactory system of Drosophila. Neuromethods. 72, 43-70 (2012).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nature Methods. 7, 535-540 (2010).
- Fisher, Y. E., Lu, J., D'Alessandro, I., Wilson, R. I. Sensorimotor experience remaps visual input to a heading-direction network. Nature. 576, 121-125 (2019).
- Green, J., Vijayan, V., Mussells Pires, P., Adachi, A., Maimon, G. A neural heading estimate is compared with an internal goal to guide oriented navigation. Nature Neuroscience. 22, 1460-1468 (2019).
- Shiozaki, H. M., Ohta, K., Kazama, H. A Multi-regional Network Encoding Heading and Steering Maneuvers in Drosophila. Neuron. 106, 126-141 (2020).
- Huang, C., et al. Long-term optical brain imaging in live adult fruit flies. Nature Communications. 9, 872 (2018).
- Kohatsu, S., Koganezawa, M., Yamamoto, D. Female contact activates male-specific interneurons that trigger stereotypic courtship behavior in Drosophila. Neuron. 69, 498-508 (2011).
- Grover, D., Katsuki, T., Greenspan, R. J. Flyception: imaging brain activity in freely walking fruit flies. Nature Methods. 13, 569-572 (2016).
- Cohn, R., Morantte, I., Ruta, V. Coordinated and Compartmentalized Neuromodulation Shapes Sensory Processing in Drosophila. Cell. 163, 1742-1755 (2015).
- Fiala, A., Spall, T. In Vivo Calcium Imaging of Brain Activity in Drosophila by Transgenic Cameleon Expression. Science Signaling. 2003, (2003).
- Silbering, A. F., Bell, R., Galizia, C. G., Benton, R. Calcium imaging of odor-evoked responses in the Drosophila antennal lobe. Journal of Visualized Experiments. , (2012).
- Bilz, F., Geurten, B. R. H., Hancock, C. E., Widmann, A., Fiala, A. Visualization of a Distributed Synaptic Memory Code in the Drosophila Brain. Neuron. 106, 963-976 (2020).
- Berry, J. A., Cervantes-Sandoval, I., Chakraborty, M., Davis, R. L. Sleep Facilitates Memory by Blocking Dopamine Neuron-Mediated Forgetting. Cell. 161, 1656-1667 (2015).
- Aimon, S., et al. Fast near-whole-brain imaging in adult Drosophila during responses to stimuli and behavior. PLOS Biology. 17, 2006732 (2019).
- Azevedo, A. W., et al. A size principle for recruitment of Drosophila leg motor neurons. Elife. 9, (2020).
- Haberkern, H., et al. Visually Guided Behavior and Optogenetically Induced Learning in Head-Fixed Flies Exploring a Virtual Landscape. Current Biology. 29, 1647-1659 (2019).
- Li, W., et al. SCAPE Microscopy for High Speed , 3D Whole-Brain Imaging in Drosophila Melanogaster. Biomed. Opt. Congr. 2016, 4-6 (2016).
- Wu, Y., Shroff, H. Faster, sharper, and deeper: structured illumination microscopy for biological imaging. Nature Methods. 15, 1011-1019 (2018).
- Bando, Y., Grimm, C., Cornejo, V. H., Yuste, R. Genetic voltage indicators. BMC Biology. 17, 71 (2019).
- Plaçais, P. -. Y., et al. Upregulated energy metabolism in the Drosophila mushroom body is the trigger for long-term memory. Nature Communications. 8, 15510 (2017).
- Gándara, L., Durrieu, L., Behrensen, C., Wappner, P. A genetic toolkit for the analysis of metabolic changes in Drosophila provides new insights into metabolic responses to stress and malignant transformation. Scientific Reports. 9, 19945 (2019).
- Andreoni, A., Davis, C. M. O., Tian, L. Measuring brain chemistry using genetically encoded fluorescent sensors. Current Opinion in Biomedical Engineering. 12, 59-67 (2019).
- Broxton, M., et al. Wave optics theory and 3-D deconvolution for the light field microscope. Optics Express. 21, 25418-25439 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved