A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
قياس إمكانات العمل البصري أحادي الخلية في خلايا القلب المشتقة من الخلايا الجذعية المتعددة القدرات
In This Article
Summary
هنا نحن نصف اكتساب البصرية وتوصيف إمكانات العمل من الخلايا الجذعية المستحثة متعددة القدرات المستمدة من خلايا القلب باستخدام نظام قياس ضوئي وحدات عالية السرعة.
Abstract
تقنيات الميكروليكترودي التقليدية داخل الخلايا لقياس الفيزيولوجيا الكهربية القلبية هي معقدة للغاية ، وكثيفة العمالة ، وعادة ما تنفذ في الإنتاجية المنخفضة. التوسع السريع والمستمر لتكنولوجيا الخلايا الجذعية المستحثة متعددة القدرات (iPSC) يقدم معيارا جديدا في أبحاث القلب والأوعية الدموية والطرق البديلة ضرورية الآن لزيادة إنتاجية البيانات الكهربية على مستوى خلية واحدة. VF2.1Cl هو صبغة حساسة الجهد المستمدة مؤخرا الذي يوفر قناة واحدة سريعة، استجابة عالية الحجم للتقلبات في إمكانات الغشاء. وهي تمتلك حركية متفوقة على تلك الموجودة في مؤشرات الجهد الأخرى، ويجعل البيانات الوظيفية المتاحة تعادل تلك التقنيات microelectrode التقليدية. هنا، ونحن نظهر مبسطة، وتوصيف العمل غير الغازية المحتملة في iPSC الإنسان يسير بخطى خارجية المستمدة cardiomyocytes باستخدام نظام قياس ضوئي وحدات وبأسعار معقولة للغاية.
Introduction
النمذجة الكهربية لخلايا القلب وبناء منصات فعالة لفحص أدوية القلب أمر ضروري لتطوير استراتيجيات علاجية لمجموعة متنوعة من اضطرابات عدم انتظام ضربات القلب. وقد أدى التوسع السريع في تكنولوجيا الخلايا الجذعية المستحثة متعددة القدرات (iPSC) إلى نجاحات واعدة في نمذجة الأمراض البشرية والتحقيق الدوائي باستخدام خلايا القلب المشتقة من المريض المعزول (iPSC-CM). "معيار الذهب" تقنيات توصيف الكهربية لهذه الخلايا من خلال التصحيح المشبك (المشبك الحالي) يمكن تحديد إمكانات العمل (AP) مورفولوجيا ومدة، ومع ذلك، هذه الطريقة معقدة بشكل لا يصدق وبطيئة، وليس مناسبا تماما لاكتساب البيانات الإنتاجية العالية1. يتم الإبلاغ بانتظام iPSC-CMs أن لديها زيادة الغشاء الانبساطي المحتملة وزيادة تسرب التيار بالمقارنة مع الكبار cardiomyocytes الأصلي2. ويقترح أن أصغر حجم الخلية وتقليل سعة الغشاء لوحظ في iPSC-CMs قد تنتج بعض الخطأ المنهجي عند استخدام تقنية المشبك الحالي, ربما يفسر هذه الانحرافات3. من أجل تحقيق أقصى قدر من الفائدة من منصة iPSC-CM، طريقة إضافية قيمة لزيادة الإنتاجية وضمان دقة البيانات عند توصيف التغيرات الجهد transmembrane على مستوى خلية واحدة في iPSC-CMs.
الأصباغ الحساسة الجهد (VSD) منذ فترة طويلة طريقة مقترحة لتوفير أسرع، وتحليل غير الغازية وما يعادلها من الحركية AP القلب مقارنة بتلك التقنيات التقليدية4. وقد أظهرت دراسة حديثة مدى ملاءمة قياس ضوئي حساس للجهد النسبي لقياس قياس ضوئي دقيق للقلب AP5. وعلاوة على ذلك، فإن القدرة على توسيع نطاق نهج القياس الضوئي البصري بسهولة تضفي هذه التقنية على شاشات السمية القلبية على نطاق واسع الحاسمة في تطوير الأدوية العلاجية (مثل CiPA). وقد أظهرت تطوير بروتوكولات السمية القلب موحدة في دراسة متعددة المواقع أعمى باستخدام صفيف microelectrode وتقنيات استشعار الجهد البصرية القيمة الرئيسية لهذا النهج6.
العديد من الأصباغ القوية متاحة تجاريا ، ويظهر التطوير الاصطناعي المستمر للمسابير الجديدة إمكانات مثيرة لتبسيط فعاليتها عبر مجموعة متنوعة من البنى القلبية والعصبية. سوف VSD المثالي زيادة الحركية والحساسية, في حين عرض انخفاض الحمل بالسعة, photobleaching والسمية الخلوية. وVF2.1Cl توليفها مؤخرا (FluoVolt) يعبر عن العديد من هذه الخصائص المفيدة ويرجع ذلك إلى حد كبير إلى بنيتها الجزيئية المستندة إلى الأسلاك الرواية, المشتركة من قبل أعضاء آخرين من عائلة الجهدفلور الجديد (VF)7. على النقيض من VSDs الكهربائية الشائعة التي تحقيقات بسيطة جزيئيا وكهربائيا اقتران غشاء البلازما، وتتألف هذه الصبغة من إدراج سلبي، الغشاء تمتد الأسلاك الاصطناعية التي أزواج المانحة الغنية بالإلكترونات مع الفلورسين المعدلة (FITC). وترد تفاصيل ميكانيكية في الشكل 1. هذه الصبغة يدل على حساسية ممتازة لتقلبات الجهد الغشاء، وعرض تغيير 27٪ في كثافة الانبعاثات لكل 100 mV بدلا من ~ 10٪ ينظر في تحقيقات مشتركة أخرى بسرعات مماثلة7. وبالإضافة إلى ذلك، لا تتفاعل أنظمة PeT المستندة إلى الأسلاك بشكل مباشر مع المجال الكهربائي الخلوي الذي ينتج الحد الأدنى من التداخل الكهربائي والتغيرات الضئيلة في الحمل الخلوي بالسعة.
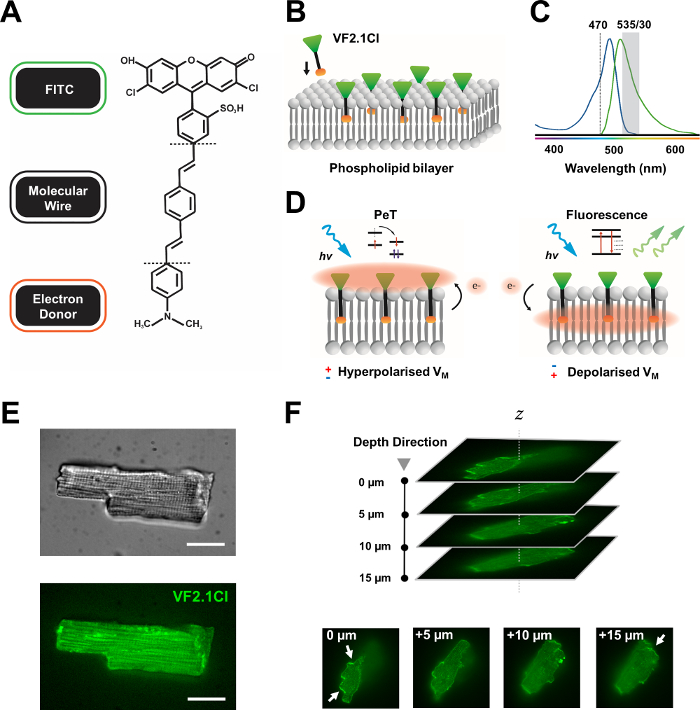
الشكل 1: المعلمات الكيميائية والطيفية والميكانية لصبغة VF2.1Cl. (أ) التركيب الكيميائي للVF2.1Cl. وتشمل الميزات الجزيئية أن نلاحظ مجموعات الألكيل متعددة داخل السلك الفينيل الفينيلين الجزيئية التي تسهل الإدراج في غشاء البلازما. تضمن مجموعة حمض الكبريتون المشحونة سلبيا والمقترانة بالمسبار FITC تثبيت الفلوروفور على السطح خارج الخلية والإيدز بالقرب من الإدراج المتعامد بالنسبة للمجال الكهربائي للسلالة ثنائية الدهون. (ب)تخطيطي مبسط للتضمين العمودي VF2.1Cl في غشاء البلازما لخلية مستهدفة. (ج) امتصاص وانبعاثات أطياف صبغة VF2.1Cl. الأطياف مطابقة لتلك التي من المعايير FITC وGFP تحقيقات. (د)تصوير طريقة ميكانيكية للعمل من VF2.1Cl. في ظروف الراحة (hyperpolarized) ، تدفع الفولتية السلبية داخل الخلايا الإلكترونات الحرة نحو الفلوروفور الوردي. تضمن وفرة الإلكترون تفضيل نقل الإلكترون الناجم عن الصور (PeT) كمسار للخروج من الحالة المتحمسة بعد الإثارة البصرية ، مما يطفئ الفلورسينس بشكل فعال. في المقابل ، تؤثر إمكانات الغشاء غير القطبي على حركة الإلكترون الهابطة التي تفضل الفلورسينس عند الإثارة البصرية. ترتبط الاستجابة الفلورية الناتجة خطيا بجهد الغشاء ويمكن استخدامها بدقة لجمع معلومات زمنية مفصلة عن الحركية الكهربية الخلوية. (ه) ممثل brightfield (العليا) وفلورسينس في 470 نانومتر (أقل) صور من خلايا القلب الليبورين محملة VF2.1Cl. (F) Z كومة من عضلة القلب محملة واحدة. تشير الأسهم إلى مناطق ترجمة واضحة ل VF2.1Cl إلى الغشاء الخلوي. تم الحصول على الصور مع نظام كونفوجال القرص الغزل تتكون من X-lightv3 الغزل رئيس القرص confocal مع نمط الثقب 50 ميكرومتر; LDI-7 مضيئة; Prime95B الكاميرا و PlanApo لامبدا 100x الهدف. شريط المقياس: 20 ميكرومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
يضمن مسبار FITC المترافق مع VF2.1Cl أنه يمكن استخدامه بفعالية بموجب تكوينات مرشحات GFP القياسية ، ولا يتطلب سوى نظام اكتساب قناة واحدة ، وكلاهما من السمات الشائعة لمنصات التصوير الفلورية. تحليل كثيفة الإنسان iPSC-CM monolayers مع هذه الصبغة وقد أفيد مؤخرا8،9،10،11. بروتوكولنا يختلف عن هذه الدراسات بسبب تحقيقنا من واحد، معزولة iPSC-CMs، غير مرتبك من التأثيرات الكهربائية والباراكرين من monolayers متزامنة كثيفة، واستخدامنا لنظام قياس ضوئي بأسعار معقولة وقابلة للتخصيص بدلا من ترتيبات التصوير confocal المعقدة أو واسعة المجال.
هنا، ونحن نصف بروتوكولنا للحصول السريع وتحليل APs البصرية قوية من خلايا القلب المشتقة من iPSC الإنسان معزولة وخلايا القلب الأصلية (انظر الملف التكميلي). نحن نستخدم VF2.1Cl إلى جانب حالة قابلة للتخصيص من منصة الفن لقياس قياس ضوئي خلية واحدة. وقد وافقت لجنة الأخلاقيات التابعة للمركز الطبي الجامعي غوتنغن (رقم 10/9/15) على هذه البروتوكولات التجريبية.
Protocol
1. الاستعدادات الخلوية
ملاحظة: تم اشتقاق iPSCs البشرية المستخدمة في هذا البروتوكول من المتبرعين الأصحاء وتم تمييزها في الطبقات الأحادية باستخدام تعديل جزيء صغير محدد بالكامل للإشارات WNT وتقنيات تنقية اللاكتات كما هو موضح سابقا12و13و14. تم الحفاظ على iPSC-CMs كل يومين إلى ثلاثة أيام مع وسيط ثقافي موضح أدناه.
- إعداد وسيط ثقافة من المتوسط القاعدي (RPMI 1640) و 2٪ ملحق (B27). يخزن عند درجة حرارة 4 درجات مئوية. يستخدم في درجة حرارة الغرفة (RT).
- إعداد وسيط الطلاء من المتوسط القاعدي (RPMI 1640), 2٪ تكملة (B27) و 1:2000 مثبط روك. يخزن عند درجة حرارة 4 درجات مئوية. استخدامها في RT.
- معطف معقم 10 ملم الزجاج المستدير # 0 coverslips مع 150 ميكرولتر من 1:60 عامل مصفوفة غشاء الطابق السفلي الحرة واحتضان في 4 درجة مئوية لمدة 4 ساعة.
ملاحظة: تحسين حجم غطاء الغطاء ضروري لضمان تغطية الزجاج بأكمله مع الحفاظ على التوتر السطحي الكافي لمنع الانسكاب. يوصى باستخدام 150 ميكرولتر للأغطية المستديرة مقاس 10 مم. يمكن أن يكون حجم الدفعة ونوع الغطاء وحجم الغطاء ونوع لوحة الثقافة مناسبة لاحتياجات المجربين. - بدء الفصام iPSC-CM مع كاشف فص الخلايا المستندة إلى EDTA. تأكد من أن الطبقة الأحادية منفصلة تماما عن طريق التنظيف بلطف مع ماصة 1000 ميكرولتر.
- نقل تعليق الخلوية في أنبوب 15 مل وإضافة حجم مزدوج الطلاء المتوسطة. جهاز طرد مركزي لمدة 10 دقائق عند 100 × ز.
- Resuspend بيليه مع حجم المطلوب (حجم إعادة الإنفاق) من وسط الطلاء. عد الخلايا يدويا أو إلكترونيا.
- حدد الكثافة المثلى لكل غطاء (15000) والتي ستسمح للتحليل الخلوي المعزول في وقت لاحق.
- حساب حجم التعليق الخلوي "النشط" (A) اللازم للوحة جميع الأغطية في هذه الكثافة المطلوبة. تطبيق الصيغة التالية والانسحاب في أنبوب منفصل:

- حساب حجم المتوسطة الطلاء اضافية (ب) اللازمة لاستيعاب كل غطاء في حجم المطلوب. تطبيق الصيغة التالية وإضافة حجم الناتجة إلى أنبوب تعليق نشط:
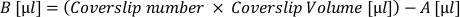
- إزالة المصفوفة من coverlips وتطبيق 'حجم coverlip' تعليق الخلية (A + B) على كل coverslip. إعادة الإنفاق بانتظام في الأنبوب لضمان التوزيع الخلوي حتى.
- حضانة عند 37 درجة مئوية لمدة ساعة واحدة. ملء بلطف البئر مع وسط الطلاء.
- بعد 24 ساعة، تبادل وسائل الإعلام مع المتوسطة الثقافة العادية والحفاظ على كل 2-3 أيام.
2. الإعداد التجريبي
- تجهيز المجهر epifluorescence مقلوب مع التكبير 40x ، عدسة الفتحة العددية العالية (N.A: > 0.75) لإجراء التجارب.
- زوجين سريع التحول الصمام الأبيض الدافئ إلى منفذ الإضاءة المنقولة من المجهر. أدخل مرشح أحمر بسيط 660 نانومتر في مسار الضوء المرسل.
ملاحظة: يمكن تنشيط هذا الضوء في جميع أنحاء تجارب القياس الضوئي لمراقبة العينة دون تلويث إشارة الفلورسنت الخضراء. - جبل سريع التبديل 470 نانومتر رئيس الصمام لتسجيل قياس الصور. أدخل فلتر إثارة 470/40 في منفذ المجهر الضوئي لتنظيف الضوء المتولد عن الصمام.
ملاحظة: للحصول على كمية إشارة الأمثل ينصح نظام الإضاءة مع التحكم في ردود الفعل عالية السرعة من الإخراج البصري. - أدخل مكعب مجهر يحتوي على مقسم شعاع تمرير طويل طوله 495 نانومتر في وحدة المرآة الدوارة داخل المجهر.
- تناسب ذراع الكشف التي تحتوي على الحجاب الحاجز حقل قابل للتعديل إلى منفذ المجهر C-جبل للسماح المنطقة من اختيار الفائدة.
- بشكل منفصل زوجين كاشف فوتوموليبليير (PMT) وكاميرا USB إلى المجهر. وهذا سيشكل أساس نظام الكشف عن الانبعاثات.
- أدخل مكعب فلتر يحتوي على مقسم شعاع تمرير طويل 565 نانومتر وفلتر انبعاث 535/50 في منفذ PMT. وهذا يقسم ضوء الانبعاثات بين الكاشفين.
ملاحظة: يمكن للكاميرا المتصلة بالمنفذ المرسل لنظام الكشف عن الانبعاثات أن تكشف الضوء المرسل تحت حقل ساطع في جميع التجارب. - الزوجين PMT إلى إمدادات الطاقة ومكبر للصوت PMT. قم بتوصيل مخرجات مكبر الصوت PMT إلى دبوس إدخال تماثلي لنظام الحصول على البيانات.
- تصفية البيانات التماثلية من PMT عند 1 كيلوهرتز أو أعلى.
- رقمنة البيانات بتردد لا يقل عن ضعف تردد أعلى تردد موجود في الإشارة التماثلية (2 كيلوهرتز أو أعلى) للوفاء بمعايير Nyquist ومنع الأسماء المستعارة.
3. تحميل الخلوية مع VF2.1Cl
ملاحظة: يجب تنفيذ جميع الخطوات التي تنطوي على هذه الصبغة في ظروف الإضاءة المنخفضة.
- إعداد حل حمام تايرود من (في mM): 140 NaCl, 10 HEPES, 10 الجلوكوز, 4 KCl, 1 MgCl2, 2 CaCl2, درجة الحموضة = 7.35 ودافئة إلى 37 درجة مئوية.
- إعداد aliquot من محلول التحميل في أنبوب الطرد المركزي الدقيق عن طريق خلط 5 ميكرولتر من 1000x VF2.1Cl و 50 ميكرولتر من محلول بولوكسيمر التشحيم 20٪.
- تطبيق 5 ميكرولتر من محلول التحميل إلى 5 مل من محلول التيرود الدافئ (مجموع تركيز صبغ 0.1x) في طبق بيتري 20 ملم.
ملاحظة: تركيز الصبغة النهائية هو 0.1x. هذا هو 1/10th التي اقترحها الشركة المصنعة. وهذا يحافظ على الموارد، ويضمن السمية الخلوية لا تذكر، والأهم من ذلك، لا يزال يحتفظ إشارات بصرية واضحة من الخلايا المحملة مع إشارة عالية إلى نسب الضوضاء. - أضف غطاء iPSC-CM واحد إلى الطبق واحتضنه عند 37 درجة مئوية لمدة 20 دقيقة.
- تجميع غرفة تصوير الخلايا الحية ساخنة. جبل على مرحلة المجهر وملء مع 500 ميكرولتر من محلول تايرود الطازجة.
- اغسل الغطاء بمحلول تايرود الطازج عند 37 درجة مئوية.
- تطبيق بعناية على iPSC-CM coverslip إلى غرفة حمام قبل تسخينها باستخدام ملقط نقطة غرامة.
ملاحظة: تأكد من تسخين الغرفة ومحتوياتها دائما في درجات حرارة فسيولوجية. إذا رغبت في ذلك، تبدأ مع التخبط المستمر من محلول تايرود الدافئة.
4. التحفيز الميداني الكهربائي
ملاحظة: التشغيل الخارجي ل iPSC-CM اختياري ولكنه مفيد لتوحيد الديناميكيات الخلوية والمعلمات التجريبية. فهو يزيد من سهولة التحليل ويسمح بالتحقيق في الآثار المعتمدة على التردد.
- إرفاق إدراج التحفيز مع اثنين من الأقطاب البلاتين متباعدة 5 ملم بعيدا في غرفة التسجيل.
- توصيل محفز خارجي لإدراج التحفيز. تعيين إلى نبضات حقل ثنائي القطب 5 مللي ثانية في 0.5 هرتز.
- تحديد الجهد التحفيز الأمثل عن طريق زيادة التحفيز من 1 V صعودا. يتم تعريف التحفيز عتبة كأقل الجهد الذي تبدأ الخلايا في الانكماش. تطبيق الفولتية تقريبا 25٪ فوق هذه العتبة. يتراوح المعدل الطبيعي بين 1 V و 30 V.
- إصلاح تردد التحفيز مع المحفز الخارجي أو تشغيله مع برنامج الاستحواذ.
5. اقتناء إمكانية العمل البصري
ملاحظة: يستخدم هذا البروتوكول برنامج تجاري للاستحواذ والتحليل.
- تصور myocytes في عرض brightfield باستخدام مسار الضوء المرسلة وكاميرا USB.
- حدد خلية معزولة ومحاصيل بإحكام مسارها البصري مع الحجاب الحاجز الحقل ضمان الضوء فقط من الخلية من الفائدة يتم رصدها.
- قم بتنشيط مكبر الصوت PMT وقم بتعيين إمداد PMT إلى 750 V.
- تشغيل بروتوكول التحفيز (انظر الخطوة 4) جنبا إلى جنب مع برنامج الاستحواذ وتفعيل ضوء الإثارة 470 نانومتر في وقت واحد. ويمكن القيام بهذا الأخير عن طريق لوحة عن بعد أو الآلي في كثافة ثابتة (إشارة TTL).
- ضبط الكسب والإزاحة من مكبر للصوت PMT للتأكد من أن الإشارة لا تشبع ويتم تحسينها لنطاق الكشف عن نظام التسجيل.
- سجل 10 عمليات الاجتياح ضمان اكتشاف إمكانات عمل مستقرة.
- مواصلة تسجيل وعلى الفور نقل مرحلة المجهر للحصول على لفترة وجيزة إشارة خلفية من منطقة خالية من الخلايا. أطفئ ضوء الإثارة
ملاحظة: سيتم استخدام قيمة الخلفية هذه (Foffset) لحساب أي مضان الخلفية. - إذا رغبت في ذلك، تتغلغل محليا الأدوية المرجعية مثل 1 ميكرومتر نيفيديبين لتحديد الاستجابات الخلوية للتلاعب الدوائي.
- بطريقة متسلسلة، كرر الخطوات 5.2-5.7، في كل مرة اختيار خلية جديدة. مبادلة خارج coverlips إذا رغبت في ضمان ارتفاع دوران التجريبية في جلسة واحدة.
ملاحظة: يتم وصف بروتوكولات التحميل والحصول على الصور في الشكل 2.
6. تحليل البيانات
- افتح تسجيلا محفوظا باستخدام برنامج التحليل ومتوسط 10 عمليات تمشيط تحتوي على إمكانات عمل محفزة من خلية واحدة.
- خذ متوسط إشارة خط الأساس التي تمثلإزاحة F وطرح هذا من التتبع المتوسط.
- حساب ∆F/F0 مع الصيغة التالية (حيث يتم قياس F مضان وF0 هو الانبساطي مضان):
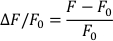
- تحديد خط الأساس النزرة (الانبساطي) ومنطقة الاهتمام (AP) وقياس المعلمات المحتملة للعمل القلبي المطلوب. وهذا يشمل ولكن لا يقتصر على وقت الاضمحلال ل50٪ (APD50)و 90٪ (APD90) إعادةالاستقطاب.
- تصدير البيانات من هذه الخلية المفردة إلى برنامج جدول بيانات.
- كرر الخطوات 6.1 - 6.5 لجميع التسجيلات. تقييم النتائج من خلال اختبارات غير مدفوعة الأجر مناسبة أو تحليل التباين.
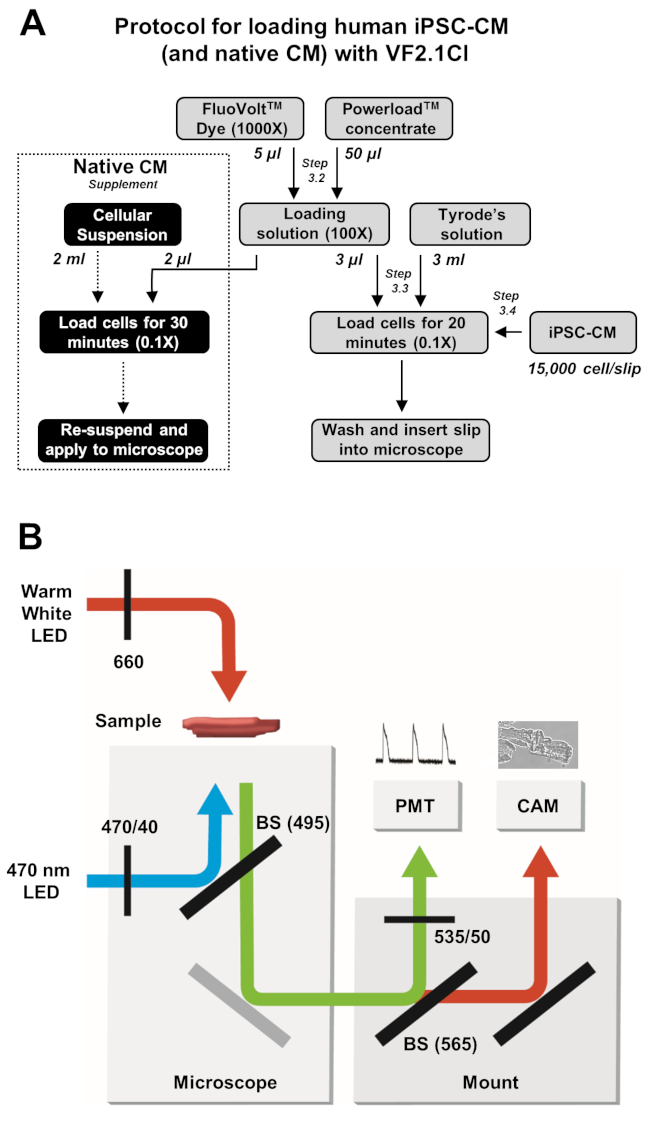
الشكل 2: بروتوكولات التحميل والحصول على الصور. (أ)مخطط تدفق كامل VF2.1Cl بروتوكول التحميل ل iPSC-CMs وخلايا القلب الأصلية. (ب)تخطيطي مبسط لمقسم الحزم (BS) وتكوينات التصفية المستخدمة في هذا البروتوكول لإثارة وكشف انبعاثات VF2.1Cl استجابة للتغيرات في الجهد عبر الميمبران. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
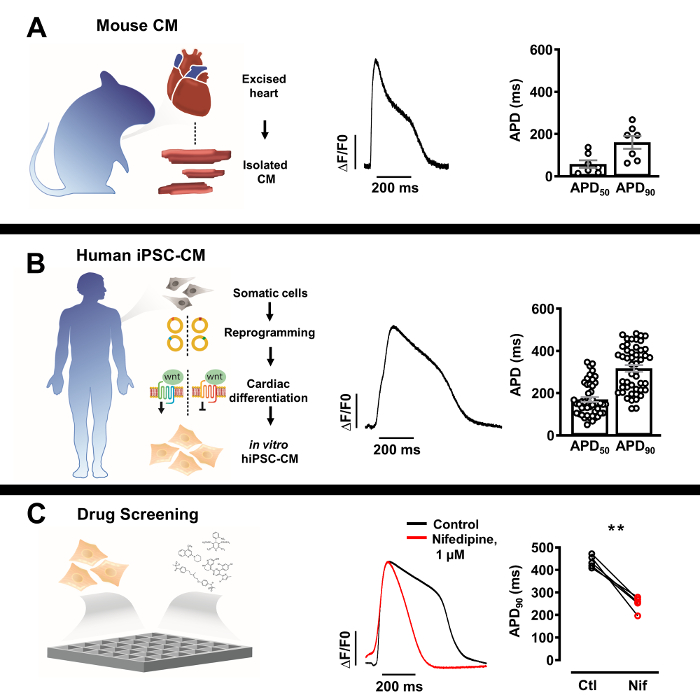
الشكل 3: ملامح إمكانات العمل البصري (AP) لخلايا القلب الأصلية المعزولة والخلايا الجذعية المتعددة القدرات المستحثة البشرية المستمدة من خلايا القلب (iPSC-CM). (أ) ممثل AP البصرية من عضلة القلب مورين واحد (وسط) مع متو?...
Discussion
هنا نصف بروتوكول أساسي للحصول بسهولة على ملامح AP مفصلة من iPSC-CMs معزولة مناسبة للنمذجة الكهربية وفحص الأدوية القلبية. نحن نكشف عن برامج العمل المنتظمة والقوية من iPSC-CMs ذات البذور القليلة مما يشير إلى وظائف المؤشر والإخلاص المنهجي.
نظرا للطيف الواسع من المنهجيات التجارية لإعا...
Disclosures
Cairn البحوث المحدودة دعمت هذا المنشور من خلال تغطية تكاليف إنتاج ملف الفيديو.
Acknowledgements
ويود المؤلفان أن يعترفا بسهم كيرن للأبحاث المحدودة لمساهمتهما المالية الرقيقة التي غطت تكاليف إنتاج هذا المنشور. وبالإضافة إلى ذلك، نشكر السيدة إينس مولر والسيدة ستيفاني كيستل على دعمهما التقني الممتاز.
ويدعم أبحاث المؤلفين من قبل المركز الألماني لأبحاث القلب والأوعية الدموية (DZHK)، ودويتشه فورشونجسجيمينشافت (DFG، مؤسسة البحوث الألمانية، VO 1568/3-1، IRTG1816 RP12، SFB1002 TPA13 وبموجب استراتيجية التميز الألمانية - EXC 2067/1 - 390729940) و Else-Kröner-Fresenius Stiftung (EKFS 2016_A20).
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
References
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochemistry. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved