Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Medición del potencial de acción óptica unicelular en cardiomiocitos derivados de células madre pluripotentes inducidas por humanos
En este artículo
Resumen
Aquí describimos la adquisición óptica y la caracterización de potenciales de acción de cardiomiocitos derivados de células madre pluripotentes inducidas utilizando un sistema de fotometría modular de alta velocidad.
Resumen
Las técnicas convencionales de microelectrodos intracelulares para cuantificar la electrofisiología de cardiomiocitos son extremadamente complejas, requieren mucha mano de obra y, por lo general, se llevan a cabo con bajo rendimiento. La expansión rápida y continua de la tecnología de células madre pluripotentes inducidas (iPSC) presenta un nuevo estándar en la investigación cardiovascular y ahora se necesita métodos alternativos para aumentar el rendimiento de los datos electrofisiológicos a nivel de una sola célula. VF2.1Cl es un tinte sensible al voltaje recientemente derivado que proporciona una respuesta rápida de un solo canal y de alta magnitud a las fluctuaciones en el potencial de membrana. Posee una cinética superior a las de otros indicadores de tensión existentes y pone a disposición datos funcionales equivalentes a los de las técnicas tradicionales de microelectrodos. Aquí, demostramos una caracterización simplificada y no invasiva del potencial de acción en cardiomiocitos humanos derivados de iPSC de ritmo externo utilizando un sistema de fotometría modular y altamente asequible.
Introducción
El modelado electrofisiológico de cardiomiocitos y la construcción de plataformas eficientes para el cribado de fármacos cardíacos es esencial para el desarrollo de estrategias terapéuticas para una variedad de trastornos arrítmicos. La rápida expansión de la tecnología de células madre pluripotentes inducidas (iPSC) ha producido avances prometedores en el modelado de enfermedades humanas y la investigación farmacológica utilizando cardiomiocitos aislados derivados de pacientes (iPSC-CM). Las técnicas "estándar de oro" para la caracterización electrofisiológica de estas células a través de patch-clamp (current-clamp) pueden cuantificar la morfología y la duración del potencial de acción (AP), sin embargo, este método es increíblemente complejo y lento, y no es adecuado para la adquisición de datos de alto rendimiento1. Se informa regularmente que los iPSC-CMs tienen un mayor potencial de membrana diastólica y una mayor corriente de fuga en comparación con los cardiomiocitos nativos adultos2. Se sugiere que el tamaño celular más pequeño y la capacitancia de membrana reducida observada en iPSC-CMs pueden producir algún error sistemático al usar la técnica de pinza de corriente, tal vez explicando estas desviaciones3. Con el fin de maximizar la utilidad de una plataforma iPSC-CM, un método adicional es valioso para aumentar el rendimiento y garantizar la precisión de los datos al caracterizar los cambios de voltaje transmembrana a nivel de una sola celda en iPSC-CM.
Los colorantes sensibles al voltaje (VSD) han sido durante mucho tiempo un método propuesto para proporcionar un análisis más rápido, no invasivo y equivalente de la cinética cardíaca de AP comparativa con las de las técnicas tradicionales4. Un estudio reciente ha demostrado la idoneidad de la fotometría de sonda sensible al voltaje ratiométrico para cuantificar con precisión el APcardíaco 5. Además, la capacidad de ampliar fácilmente los enfoques de fotometría óptica presta esta técnica a pruebas de cardiotoxicidad a gran escala críticas en el desarrollo de fármacos terapéuticos (por ejemplo, CiPA). El desarrollo de protocolos estandarizados de cardiotoxicidad en un estudio cegado de múltiples sitios utilizando matriz de microelectrodos y técnicas ópticas de detección de voltaje ha demostrado el valor clave de este enfoque6.
Muchos colorantes potenciométricos están disponibles comercialmente, y el desarrollo sintético en curso de nuevas sondas muestra un potencial emocionante para racionalizar su efectividad en una variedad de construcciones cardíacas y neuronales. El VSD ideal tendrá una cinética y sensibilidad aumentadas, al tiempo que mostrará una menor carga capacitiva, fotobleaching y citotoxicidad. El recientemente sintetizado VF2.1Cl (FluoVolt) expresa muchas de estas propiedades beneficiosas en gran parte debido a su novedosa estructura molecular basada en cables, compartida por otros miembros de la nueva familia VoltageFluor (VF)7. A diferencia de los VSD electrocrómicos comunes en los que sondas simples se conjugan molecular y eléctricamente con la membrana plasmática, este tinte consiste en un alambre sintético insertado pasivamente que abarca la membrana que empareja un donante rico en electrones con un fluorescéforo de fluoresceína modificado (FITC). Los detalles mecanicistas se proporcionan en la Figura 1. Este tinte demuestra una excelente sensibilidad a las fluctuaciones de voltaje de la membrana, mostrando un cambio del 27% en la intensidad de emisión por 100 mV en comparación con ~ 10% visto en otras sondas comunes a velocidades comparables7. Además, los sistemas PeT basados en cables no interactúan directamente con el campo eléctrico celular, lo que produce una interferencia eléctrica mínima y cambios insignificantes en la carga capacitiva celular.
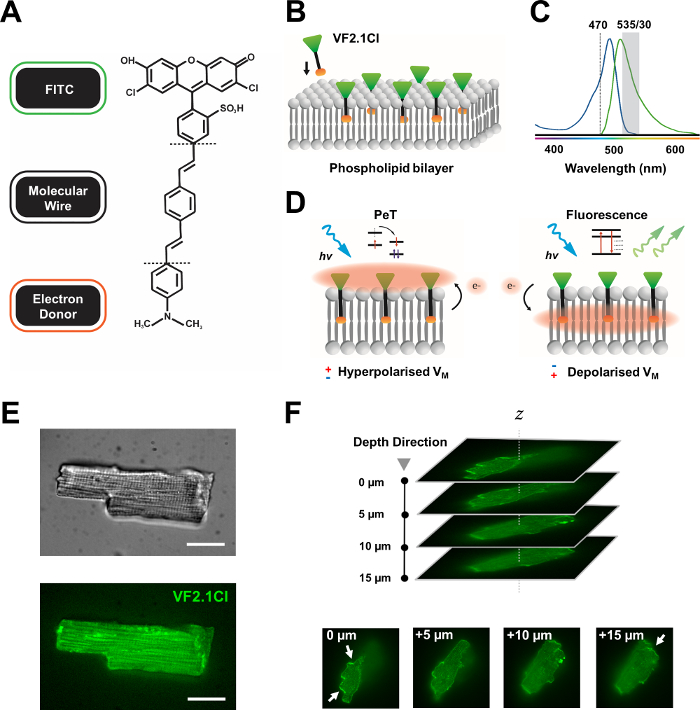
Figura 1: Parámetros químicos, espectrales y mecanicistas del colorante VF2.1Cl. (A) Estructura química de VF2.1Cl. Las características moleculares a tener en cuenta incluyen múltiples grupos alquilo dentro del alambre molecular de fenileno vinileno que facilitan la inserción en la membrana plasmática. Un grupo de ácido sulfónico cargado negativamente conjugado a la sonda FITC asegura la estabilización del fluoróforo en la superficie extracelular y ayuda a la inserción casi perpendicular en relación con el campo eléctrico de la bicapa lipídica. (B) Un esquema simplificado de la incrustación perpendicular vf2.1Cl en la membrana plasmática de una célula diana. (C) Espectros de absorción y emisión del colorante VF2.1Cl. Spectra es idéntico al de las sondas ESTÁNDAR FITC y GFP. (D) Representación del modo de acción mecanicista de VF2.1Cl. En condiciones de reposo (hiperpolarizadas), los voltajes intracelulares negativos impulsan los electrones libres hacia el fluoróforo rostral. La abundancia de electrones asegura que la transferencia de electrones fotoinducida (PeT) se favorezca como una vía para salir del estado excitado después de la excitación óptica, apagando efectivamente la fluorescencia. Por el contrario, un potencial de membrana despolarizada influye en el movimiento de electrones hacia abajo favoreciendo la fluorescencia sobre la excitación óptica. La respuesta fluorescente resultante está linealmente relacionada con el voltaje de la membrana y se puede utilizar con precisión para recopilar información temporal detallada sobre la cinética electrofisiológica celular. (E) Imágenes representativas de campo brillante (superior) y fluorescencia a 470 nm (inferior) de cardiomiocitos de leporina cargados con VF2.1Cl. (F) Z stack de un solo cardiomiocito cargado. Las flechas indican áreas de clara localización de VF2.1Cl a la membrana celular. Las imágenes se adquirieron con un sistema confocal de disco giratorio que consiste en una cabeza confocal de disco giratorio X-lightv3 con un patrón estenopeico de 50 μm; Iluminador LDI-7; Cámara Prime95B y un objetivo PlanApo Lambda 100x. Barra de escala: 20 μm. Haga clic aquí para ver una versión más grande de esta figura.
La sonda FITC conjugada a VF2.1Cl garantiza que se pueda utilizar de manera efectiva en configuraciones de filtro estándar y GFP, y solo requiere un sistema de adquisición de un solo canal, que son características comunes de las plataformas de imágenes fluorescentes. El análisis de monocapas iPSC-CM humanas densas con este tinte se ha reportado recientemente8,9,10,11. Nuestro protocolo difiere de estos estudios debido a nuestra investigación de iPSC-CMs únicos y aislados, imperturbables por las influencias eléctricas y paracrinas de las monocapas sincitiales densas, y nuestro uso de un sistema de fotometría asequible y personalizable en lugar de complejos arreglos de imágenes confocales o de campo amplio.
Aquí, describimos nuestro protocolo para la rápida adquisición y análisis de AP ópticos robustos a partir de cardiomiocitos humanos aislados derivados de iPSC y cardiomiocitos nativos (ver Archivo Complementario). Utilizamos VF2.1Cl junto con una plataforma personalizable de última generación para mediciones de fotometría de una sola célula. Estos protocolos experimentales han sido aprobados por el comité de ética del Centro Médico Universitario de Gotinga (Nº 10/9/15).
Protocolo
1. Preparaciones celulares
NOTA: Las iPSC humanas utilizadas en este protocolo se derivaron de donantes sanos y se diferenciaron en monocapas utilizando la modulación de moléculas pequeñas completamente definida de la señalización WNT y las técnicas de purificación de lactato como se describió anteriormente12,13,14. Los iPSC-CMs se mantuvieron cada 2-3 días con un medio de cultivo que se describe a continuación.
- Preparar un medio de cultivo de medio basal (RPMI 1640) y suplemento al 2% (B27). Conservar a 4 °C. Uso a temperatura ambiente (RT).
- Preparar un medio de recubrimiento de medio basal (RPMI 1640), suplemento al 2% (B27) e inhibidor de ROCK 1:2000. Conservar a 4 °C. Uso en RT.
- Cubra las cubiertas de vidrio redondo de 10 mm esterilizadas de 10 mm #0 con 150 μL de matriz de membrana basal libre de factor 1:60 e incube a 4 °C durante 4 h.
NOTA: La optimización del volumen de la cubierta es necesaria para garantizar que todo el vidrio esté cubierto mientras se mantiene una tensión superficial adecuada para evitar derrames. Se recomienda 150 μL para fundas redondas de 10 mm. El tamaño del lote, el tipo de cubierta, el volumen de la cubierta y el tipo de placa de cultivo pueden adaptarse a las necesidades de los experimentadores. - Comience la disociación de iPSC-CM con un reactivo de disociación celular basado en EDTA. Asegúrese de que la monocapa esté completamente separada enjuagando suavemente con una pipeta de 1.000 μL.
- Transfiera la suspensión celular a un tubo de 15 ml y agregue un medio de revestimiento de doble volumen. Centrífuga durante 10 min a 100 x g.
- Resuspend el pellet con un volumen deseado (volumen de resuspensión) de medio de recubrimiento. Contar las celdas de forma manual o electrónica.
- Seleccione la densidad óptima por deslizamiento (15,000) que permitirá el análisis celular aislado más adelante.
- Calcule el volumen de suspensión celular "activa" (A) necesaria para cubrir todos los cubrecubres a esta densidad deseada. Aplique la siguiente fórmula y retírela en un tubo separado:

- Calcule el volumen de medio de chapado adicional (B) necesario para acomodar cada cubierta al volumen deseado. Aplique la siguiente fórmula y agregue el volumen resultante al tubo de suspensión activa:
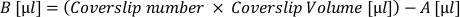
- Retire la matriz de los coverslips y aplique el 'volumen de coverslip' de la suspensión celular (A + B) a cada coverslip. Resuspenda regularmente en el tubo para asegurar una distribución celular uniforme.
- Incubar a 37 °C durante 1 h. Llene suavemente el pozo con un medio de chapado.
- Después de 24 h, intercambie medios con medio de cultivo normal y manténgalo cada 2-3 días.
2. Configuración experimental
- Equipe un microscopio de epifluorescencia invertida con un aumento de 40x, lente de alta apertura numérica (N.A: > 0.75) para realizar experimentos.
- Acopla un LED blanco cálido de conmutación rápida al puerto de iluminación transmitido del microscopio. Inserte un filtro rojo simple de 660 nm en la ruta de luz transmitida.
NOTA: Esta luz se puede activar a través de experimentos de fotometría para observar la muestra sin contaminar la señal fluorescente verde. - Monte un cabezal LED de conmutación rápida de 470 nm para la grabación de fotometría. Inserte un filtro de excitación 470/40 en el puerto epifluorescente del microscopio para limpiar la luz generada por el LED.
NOTA: Para una cuantificación óptima de la señal, se recomienda un sistema de iluminación con control de retroalimentación de alta velocidad de salida óptica. - Inserte un cubo de microscopio que contenga un divisor de haz de paso largo de 495 nm en el carrusel de la unidad de espejo dentro del microscopio.
- Ajuste un brazo de detección que contenga un diafragma de campo ajustable al puerto de montaje C del microscopio para permitir la selección de la región de interés.
- Acopla por separado un detector fotomultiplicador (PMT) y una cámara USB al microscopio. Esto constituirá la base del sistema de detección de emisiones.
- Inserte un cubo de filtro que contenga un divisor de haz de paso largo de 565 nm y un filtro de emisión 535/50 en el puerto PMT. Esto divide la luz de emisión entre los dos detectores.
NOTA: Una cámara conectada al puerto transmitido del sistema de detección de emisiones puede detectar la luz transmitida bajo campo brillante a lo largo de todos los experimentos. - Acopla el PMT a una fuente de alimentación y un amplificador PMT. Conecte la salida del amplificador PMT a un pin de entrada analógico de un sistema de adquisición de datos.
- Filtre los datos analógicos del PMT a 1 kHz o superior.
- Digitalice los datos a una frecuencia que sea al menos el doble que la frecuencia más alta presente en la señal analógica (2 kHz o superior) para cumplir con los criterios de Nyquist y evitar el aliasing.
3. Carga celular con VF2.1Cl
NOTA: Todos los pasos que involucran este tinte deben llevarse a cabo en condiciones de poca luz.
- Preparar una solución de baño de Tyrode de (en mM): 140 NaCl, 10 HEPES, 10 Glucosa, 4 KCl, 1 MgCl2,2 CaCl2,pH = 7.35 y caliente a 37 °C.
- Preparar una alícuota de solución de carga en un tubo de microcentrífuga mezclando 5 μL de 1.000x VF2.1Cl y 50 μL de solución de poloxámero solubilizante al 20%.
- Aplique 5 μL de la solución de carga a 5 ml de solución de Tyrode calentada (concentración total de colorante 0,1x) en una placa de Petri de 20 mm.
NOTA: La concentración final de colorante es de 0.1x. Esto es 1/10de lo sugerido por el fabricante. Esto conserva los recursos, asegura una citotoxicidad insignificante y, lo que es más importante, aún conserva señales ópticas claras de las células cargadas con altas proporciones de señal a ruido. - Añadir un solo resbalón de la cubierta iPSC-CM al plato e incubar a 37 °C durante 20 min.
- Ensamble una cámara de imágenes de células vivas calentada. Monte en la etapa del microscopio y llene con 500 μL de solución fresca de Tyrode.
- Lave el cubrecubres con la solución fresca de Tyrode a 37 °C.
- Aplique con cuidado la funda iPSC-CM en la cámara de baño precalenqueada con bórceps de punta fina.
NOTA: Asegúrese de que la cámara y su contenido se calienten siempre a temperaturas fisiológicas. Si lo desea, comience con la perfusión continua de la solución de Tyrode calentada.
4. Estimulación del campo eléctrico
NOTA: La activación externa de iPSC-CM es opcional pero útil para la estandarización de la dinámica celular y los parámetros experimentales. Aumenta la facilidad de análisis y permite la investigación de efectos dependientes de la frecuencia.
- Coloque un inserto de estimulación con dos electrodos de platino espaciados 5 mm de distancia en la cámara de grabación.
- Conecte un estimulador externo al inserto de estimulación. Establecido en pulsos de campo bipolar de 5 ms a 0,5 Hz.
- Determine el voltaje de estimulación óptimo aumentando el estímulo de 1 V hacia arriba. El estímulo umbral se define como el voltaje más bajo al que las células comienzan a contraerse. Aplique voltajes aproximadamente un 25% por encima de este umbral. El rango normal está entre 1 V y 30 V.
- Fije la frecuencia de estimulación con el estimulador externo o activé la activa con un software de adquisición.
5. Adquisición de potencial de acción óptica
NOTA: Este protocolo utiliza un software comercial para la adquisición y el análisis.
- Visualice los miocitos en la vista de campo brillante utilizando la ruta de luz transmitida y la cámara USB.
- Seleccione una celda aislada y recorte herméticamente su trayectoria óptica con el diafragma de campo, asegurando que solo se monitoree la luz de la celda de interés.
- Active el amplificador PMT y configure la fuente PMT a 750 V.
- Ejecute el protocolo de estimulación (consulte el paso 4) junto con el software de adquisición y active simultáneamente la luz de excitación de 470 nm. Esto último se puede hacer a través de un panel remoto o automatizado a una intensidad fija (señal TTL).
- Ajuste la ganancia y el desplazamiento del amplificador PMT para asegurarse de que la señal no se sature y esté optimizada para el rango de detección del sistema de grabación.
- Registre 10 barridos asegurando que se detecten potenciales de acción estables.
- Continúe grabando e inmediatamente mueva la etapa del microscopio para adquirir brevemente la señal de fondo de una región desprovista de células. Apaga la luz de excitación.
NOTA: Este valor de fondo(desplazamiento F) se utilizará para tener en cuenta cualquier fluorescencia de fondo. - Si lo desea, perfunda localmente fármacos de referencia como 1 μM de nifedipino para identificar las respuestas celulares a la manipulación farmacológica.
- De forma secuencial, repita los pasos 5.2–5.7, cada vez que seleccione una nueva celda. Intercambie los cubrecos si lo desea para garantizar una alta rotación experimental en una sola sesión.
NOTA: Los protocolos de carga y adquisición de imágenes se describen en la Figura 2.
6. Análisis de datos
- Abra una grabación guardada con el software de análisis y promedie 10 barridos que contengan potenciales de acción estimulados de una sola célula.
- Tome una media de la señal de referencia que represente eldesplazamiento F y reste esto de la traza promediada.
- Calcule ∆F/F0 con la siguiente fórmula (donde F se mide la fluorescencia y F0 es la fluorescencia diastólica):
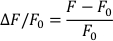
- Identificar el rastro basal (diastólico) y el área de interés (PA) y medir los parámetros potenciales de acción cardíaca deseados. Esto incluye, entre otros, el tiempo de descomposición para la repolarización del50%(APD 50) y del 90% (APD90).
- Exporte los datos de esta celda única a un software de hoja de cálculo.
- Repita los pasos 6.1 – 6.5 para todas las grabaciones. Evalúe los resultados con pruebas apropiadas no emparejadas o análisis de varianza.
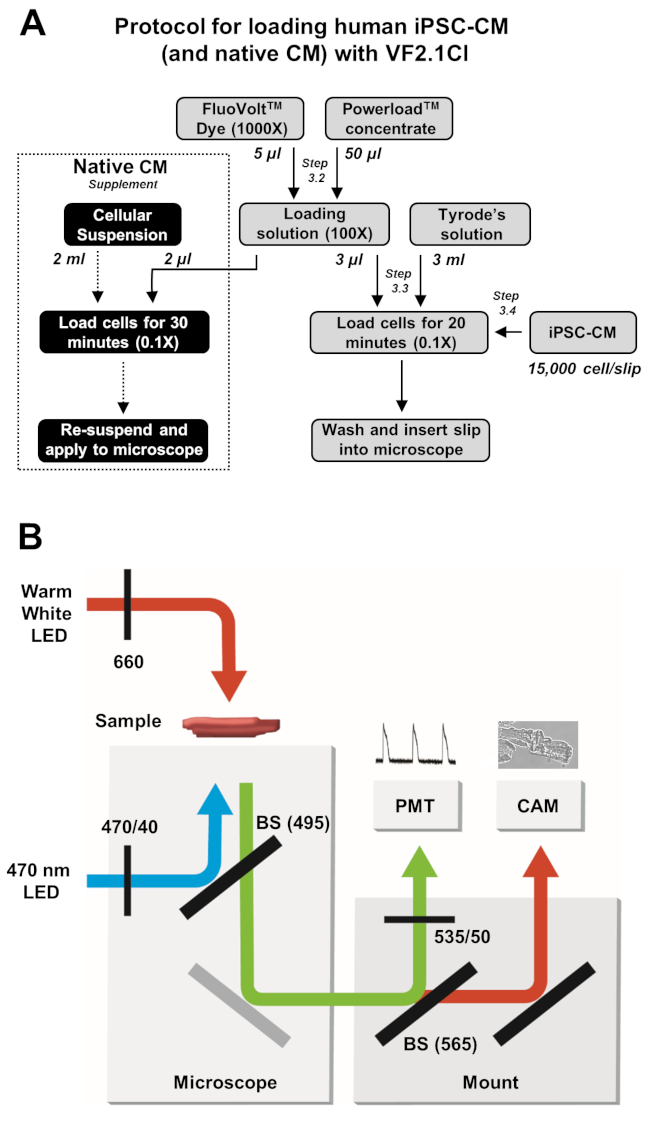
Figura 2: Protocolos de carga y adquisición de imágenes. (A) Diagrama de flujo del protocolo de carga VF2.1Cl completo para iPSC-CMs y cardiomiocitos nativos. (B) Un esquema simplificado de las configuraciones de divisor de haz (BS) y filtro utilizadas en este protocolo para la excitación y detección de la emisión de VF2.1Cl en respuesta a cambios en el voltaje transmembrana. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
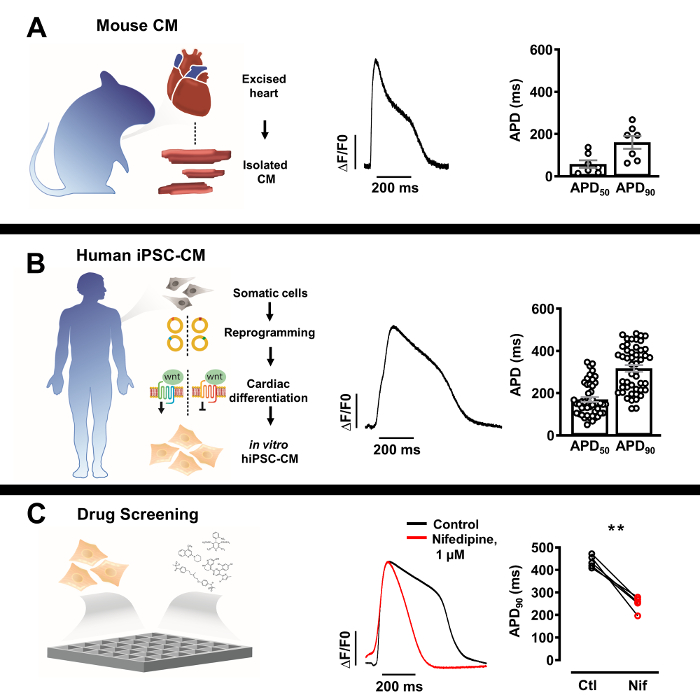
Figura 3: Perfiles de potencial de acción óptica (AP) de cardiomiocitos nativos aislados y cardiomiocitos derivados de células madre pluripotentes inducidas por humanos (iPSC-CM). (A) AP óptico representativo de un solo cardiomiocito murino (centro) con media ± SEM de APD50 y APD90 (n = 7, derecha). (B) AP óptico representativo...
Discusión
Aquí describimos un protocolo básico para adquirir fácilmente perfiles AP detallados a partir de iPSC-CMs aislados adecuados para el modelado electrofisiológico y la detección de fármacos cardíacos. Detectamos AP regulares y robustos de nuestros iPSC-CMs escasamente sembrados, lo que sugiere tanto la funcionalidad del indicador como la fidelidad metodológica.
Debido al amplio espectro de metodologías comerciales para la reprogramación de iPSC y la falta de estandarización para los p...
Divulgaciones
Cairn Research Ltd apoyó esta publicación cubriendo los costos de producción del archivo de video.
Agradecimientos
Los autores desean agradecer a Cairn Research Ltd. por su amable contribución financiera que cubrió los costos de producción de esta publicación. Además, agradecemos a la Sra. Ines Mueller y a la Sra. Stefanie Kestel por su excelente apoyo técnico.
La investigación de los autores está respaldada por el Centro Alemán de Investigación Cardiovascular (DZHK), la Deutsche Forschungsgemeinschaft (DFG, Fundación Alemana de Investigación, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 y bajo la Estrategia de Excelencia de Alemania - EXC 2067/1- 390729940) y la Else-Kröner-Fresenius Stiftung (EKFS 2016_A20).
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
Referencias
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochemistry. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados